Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Cuadernos de herpetología
versão On-line ISSN 1852-5768
Cuad. herpetol. vol.29 no.1 San Salvador de Jujuy maio 2015
PUNTOS DE VISTA
La morfología de los Anuros: pasado, presente y futuro de nuestras investigaciones
Silvia Inés Quinzio, Javier Goldberg, Julio César Cruz, Mariana Chuliver Pereyra, Marissa Fabrezi
Instituto de Bio y Geociencias (IBIGEO). Centro Científico Tecnológico CONICET- UNSa, 9 de Julio 14, Rosario de Lerma, A4405, Salta, Argentina.
Recibido: 22/08/14
Revisado: 23/09/14
Aceptado: 24/10/14
ABSTRACT
We review some theoretical and methodological issues about how we study the anuran morphology and recognize: 1) scarcely studied subjects with wide generalizations for the whole order; 2) concepts that were losing their meaning and are currently used in a confusing and/or ambiguous ways; 3) topics that were extensively studied from different perspectives (physiology, embryology, ecology) in model organisms providing contradictory or untested assumptions, and 4) studies addressing anatomical systems related to important functions based only on the fully formed apparatus and/or system. We analyzed four examples of our own studies: the organization of the lateral line system, the concepts of size/age/maturity, the relationships among thyroid glands, hormones and metamorphosis, and the interpretations about the evolution of the anuran locomotion, and highlight the need to review some ideas and test them with an updated, methodological and conceptual, approach. Furthermore, we emphasize the validity of studying phenotypic variation to strengthen the hypotheses about animal evolution.
Key words: Ontogeny; Phenotypic Variation; Concepts; Integration; Evo-Devo.
RESUMEN
Presentamos una revisión de ciertos aspectos teóricos y/o metodológicos que hacen a la manera en que investigamos la morfología de los anuros y a partir del conjunto de información publicada, reconocemos: 1) tópicos escasamente estudiados pero de los que se desprenden generalizaciones para todos los representantes del orden; 2) conceptos que fueron perdiendo significado y son utilizados de manera confusa o ambigua; 3) temas muy estudiados desde diferentes perspectivas (fisiología, embriología, ecología) en organismos modelo de los que surgen supuestos que se contradicen o no están suficientemente validados, y 4) investigaciones que abordaron sistemas anatómicos involucrados en funciones muy importantes pero sólo considerando la formas finales del aparato y/o sistema. Analizamos cuatro ejemplos que hemos estudiado: la organización del sistema de la línea lateral; los conceptos de tamaño/edad/madurez; la interrelación entre glándulas tiroides, hormonas y metamorfosis; las interpretaciones sobre la evolución de la locomoción en anuros y destacamos la necesidad de revisar algunas ideas, poniéndolas a prueba con un enfoque actualizado tanto en lo metodológico como conceptual. Subrayamos además, la vigencia del estudio de la variación fenotípica para fortalecer las hipótesis sobre la evolución animal.
Palabras clave: Ontogenia; Variación Fenotípica; Conceptos; Integración; Evo-Devo.
INTRODUCCION
La mayoría de los anuros presentan un ciclo de vida bifásico en el que se distinguen una fase larval y una adulta, distintas entre sí y unidas en la ontogenia por cambios a nivel celular y sistémico que en su conjunto constituyen la metamorfosis (Handrigan y Wassersug, 2007). Este fenómeno postembrionario implica la transición de una larva acuática de vida libre a un adulto tetrápodo e involucra numerosos cambios a nivel morfológico y fisiológico que pueden dividirse en tres tipos: 1) la regresión de estructuras y funciones que son importantes solo en la larva; 2) la trasformación de estructuras larvales a formas útiles en el adulto; 3) el desarrollo de novo de estructuras y funciones esenciales para el adulto y que están ausentes en la larva (Dodd y Dodd, 1976). El estudio de estas tres variantes en la ontogenia de un mismo ciclo de vida hace de los estudios en embriología y desarrollo de anuros una fuente de información muy rica para entender procesos celulares de diferenciación y crecimiento. En los últimos años hemos realizado investigaciones sobre la morfología de anfibios anuros, considerando trayectorias ontogenéticas de caracteres, complejos de caracteres, sistemas anatómicos y su integración en unidades morfo-funcionales (por mencionar algunos: Fabrezi y Quinzio, 2008; Goldberg y Fabrezi, 2008; Fabrezi y Lobo, 2009; Fabrezi et al., 2009, 2010, 2012; Fabrezi, 2011; Quinzio, 2011). Estos trabajos nos permitieron caracterizar aspectos particulares de su ontogenia (esqueleto, tegumento, línea lateral, sistema digestivo, gónadas) y determinar la diversidad de los ciclos de vida.
La información obtenida nos permitió ahondar en la variación fenotípica de los anuros pero al analizar, discutir y proponer nuevos enfoques para nuestros trabajos sobre los distintos tópicos explorados surgió la inquietud de plantear nuestro punto de vista sobre el estado actual del conocimiento de la morfología de los anuros y sobre ciertos problemas conceptuales que se presentaron al abordar distintos temas, entre los que reconocemos: 1) hay temas poco estudiados, generalmente conocidos para muy pocas especies y casi ignorados en la literatura reciente, con información escasa, antigua y con una ontología heterogénea. Por ejemplo el sistema de la línea lateral en anuros; 2) conceptos centrales en la Morfología y en otras disciplinas (Ecología, Sistemática, Fisiología, Embriología) muy usados pero de manera confusa y/o ambigua, donde parecen haberse perdido los límites de las definiciones y también su significado. Por ejemplo diferenciación/desarrollo y crecimiento que definen forma y tamaño respectivamente; 3) temas muy estudiados desde diferentes perspectivas, a los que les falta integración y coherencia aunque de ellos se desprenden generalizaciones para el conjunto de especies del orden. Por ejemplo, la ontogenia de la glándula tiroides, su fisiología y sus consecuencias morfológicas; y finalmente 4) temas en los que abunda información sobre la variación intraordinal pero que no cuentan con información de la variación en la ontogenia. Por ejemplo la locomoción postmetamórfica.
A continuación, trataremos de presentar un pantallazo del estado actual del conocimiento en estos diferentes tópicos, cómo los abordamos y cómo proyectamos nuestros trabajos a futuro.
El estudio del sistema de la línea lateral en larvas de anuros
El sistema de la línea lateral en vertebrados no amniotas es sensible a las variaciones en los movimientos de agua, y permite detectar presas y coespecíficos (Dijkgraaf, 1962; Coombs et al., 1989). Los órganos sensoriales involucrados pueden ser de tipo electroreceptor, denominados órganos ampulariales, o de tipo mecanoreceptor, denominados neuromastos (Northcutt y Bleckmann, 1993). Entre los Lissamphibia el sistema exhibe variación tanto en su morfología como en su ontogenia (Northcutt, 1997). En salamandras están presentes electro y mecanoreceptores mientras que en algunas cecilias los mecanoreceptores se han perdido; en los anuros está constituido sólo por órganos mecanoreceptores (Fritzsch et al., 1984; Fritzsch y Wake, 1986). El sistema es una característica común del desarrollo larval y está ausente en la mayoría de las especies de desarrollo directo (Fritzsch, 1989); su destino en estadios postmetamórficos también varía: mientras que la mayoría de los urodelos retienen el sistema completo toda su vida, en cecilias desaparecen los receptores y fibras nerviosas aunque las neuronas en los núcleos centrales son conservadas (Fritzsch y Wake, 1986; Will y Fritzsch, 1988; Dünker et al., 2000). En los anuros se ha generalizado la pérdida completa durante la metamorfosis (Fritzsch et al., 1987; Fritzsch, 1989; Whanschaffe et al., 1987), pero el sistema está presente en adultos de Pipidae (Will et al., 1985) y en los neobatracios Occidozyga laevis, O. lima y Lepidobatrachus laevis (Fritzsch et al., 1987). El sistema de la línea lateral ha sido poco explorado en anfibios y la mayoría de los estudios se refieren a organismos modelo como Ambystoma mexicanum y Xenopus laevis.
Las características que exhibe el sistema en los tres órdenes de anfibios reflejan transformaciones en la ontogenia con trayectorias propias para cada linaje (Northcutt, 1997). En los anfibios, el sistema de la línea lateral es funcional en el agua, y por eso en los anuros se asocia al plan corporal larval (Northcutt, 1989). Aunque el estudio de este sistema puede proporcionar información valiosa de la variación de todos sus componentes en relación a las diferentes morfologías y ecologías larvales, la información disponible está limitada a alguno de sus componentes y a unos pocos taxa en relación a la diversidad específica del grupo (Fig.1) (Wright, 1951; Shelton, 1970; Lannoo, 1987; Schlosser y Roth, 1995; Schlosser y Northcutt, 2000; Hall et al., 2002). Así, nos propusimos el estudio de los diferentes componentes del sistema de la línea lateral y su variación en larvas de anuros, analizando especies diferentes a las descritas previamente con el objeto de profundizar en el conocimiento de este sistema y ahondar en su variación (Quinzio et al., 2006; Fabrezi y Quinzio, 2008; Fabrezi et al., 2009, 2010; Quinzio, 2011; Quinzio y Fabrezi, 2014). Como punto de partida, se eligieron 10 especies de anuros representativas de tres de los cuatro tipos larvales descritos por Orton (1953) (Tipo I: Pipidae; Tipo II: Microhylidae; Tipo IV: Ceratophryidae, Hylidae, Telmatobiidae). Estos estudios consideraron aspectos del sistema como la morfología y organización de los mecanoreceptores dentro de las líneas laterales, el número disposición e inervación de las líneas laterales, la organización de los nervios de la línea lateral y la ontogenia del sistema.

Figura 1. Los estudios en el sistema de la línea lateral en anfibios anuros abordaron tanto aspectos embriológicos (A) como anatómicos (B) del mismo. Si bien los estudios anatómicos analizaron cada uno de los componentes del sistema (mecanoreceptores, nervios, proyecciones centrales), pocos estudios los consideraron de manera integrada, lo que se refleja en los diferentes criterios utilizados para su análisis. Además, la mayoría de estos estudios se restringieron a muy pocos taxa, y la información existente, aunque heterogénea en cuanto a su componente ontológico, fue generalizada para todos los anuros.
1) Sobre la base de las características histológicas de los neuromastos, se describió variación en el tamaño de los órganos y en la relación espacial de éstos con la epidermis (Quinzio, 2011). Además, a diferencia de lo descrito en Xenopus laevis, en Lepidobatrachus laevis (con sistema presente durante toda la ontogenia) los neuromastos alcanzan su morfología adulta (tamaño y relación con las diferentes capas del tegumento) en estadios larvales (Fig. 2A, D).
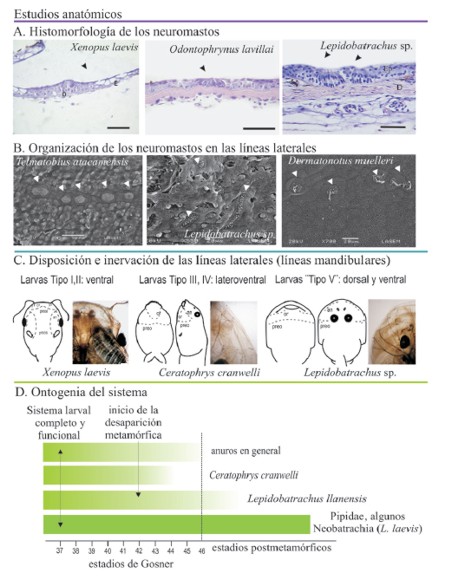
Figura 2. Estudios anatómicos recientes compararon las características (A-D) del sistema de la línea lateral entre los cuatro tipos larvales de anuros obteniendo información que permitió ahondar en su variación morfológica. Estos estudios permitieron establecer que aún cuando algunos componentes del sistema parecen haberse mantenido sin cambios significativos en la historia de los anuros (número e inervación de las líneas laterales), otros como la morfología de los neuromastos (A, B), la disposición de las líneas laterales (C) o la ontogenia del sistema (D) presentan particularidades específicas las que pueden ser interpretadas en relación a la evolución de las distintas ontogenias.
2) En la organización de los neuromastos dentro de las líneas laterales, reconocimos las tres condiciones descritas en la literatura (neuromastos simples, en "stitches" longitudinales, en "stitches" transversales) a las que se sumó una condición en la que los neuromastos se disponen de manera irregular, independientemente de la dirección de su eje mayor en vista superficial (Quinzio, 2011; Quinzio y Fabrezi, 2014) (Fig. 2B).
3) El análisis del número, disposición e inervación de las líneas laterales nos permitió identificar las líneas orbitales y del tronco, constantes en cuanto a su número, disposición e inervación (Quinzio, 2011). Por el contrario, las líneas relacionadas a las estructuras orales de las larvas exhiben marcada variación, ya que la posición del disco oral condiciona la disposición ventral, dorsal o lateroventral de las líneas mandibulares que puede interpretarse como una característica de los tipos larvales (Quinzio y Fabrezi, 2014) (Fig. 2C). Cabe destacar que ciertas dificultades surgieron al plantear el estudio de este aspecto del sistema ya que en la bibliografía se utilizaron diferentes criterios para la identificación y denominación de las líneas laterales, la ausencia de criterios comunes se presentó como un problema concreto al momento de analizar la información. Por ejemplo, algunos estudios sólo consideraron la disposición topográfica de las líneas laterales (Lannoo, 1987; Chou y Lin, 1997; Hall et al., 2002) mientras que otros además consideraron su inervación (Schlosser y Roth, 1995); con respecto a la terminología, se usó una general para otros vertebrados (por ejemplo salamandras, Schlosser y Roth, 1995) y en otros casos una nomenclatura específica para los anuros (Lannoo, 1987).
4) Respecto a la ontogenia del sistema, encontramos variación a nivel interespecífico e intraespecífico en la secuencia temporal y espacial de desaparición de las líneas de neuromastos, diferente a la generalización que establecía la regresión simultánea de todas las líneas laterales durante el clímax metamórfico (Wahnschaffe et al., 1987). Además, la completa desaparición de las líneas laterales puede suceder durante el climax metamórfico, como ocurre en Ceratophrys cranwelli o después de la completa desaparición de la cola como en Lepidobatrachus llanensis (Quinzio, 2011) (Fig. 2D).
Las características descritas para el sistema de la línea lateral y su variación entre los cuatro tipos larvales aportaron información valiosa que fue codificada e interpretada en análisis filogenéticos (Fabrezi y Quinzio, 2008; Quinzio, 2011). Esto permitió proponer un quinto tipo larval para anuros representado por la larva de Lepidobatrachus (Quinzio y Fabrezi, 2014), y reconocer que en Lepidobatrachus el sistema exhibe un desarrollo distinto al de otros anuros con adultos acuáticos, donde algunas características finales, como la morfología de los mecanoreceptores, se alcanzan en estadios previos a la metamorfosis sin sufrir transformaciones en la forma adulta (Quinzio, 2011).
El sistema de la línea lateral está presente en estadios larvales de todos los anuros con ciclo de vida bifásico y como tal, representa un sistema anatómico de interés desde el punto de vista morfológico, ontogenético y evolutivo. Este sistema se encuentra asociado estructuralmente al tegumento, y como parte del sistema nervioso está integrado funcionalmente con otros durante la etapa larval. Su degeneración metamórfica, cuando ocurre, implica diferentes eventos de degeneración celular en combinación con transformaciones estructurales en la piel y en el sistema nervioso que conducen a su organización en el plan corporal adulto.
En este contexto, el estudio de este sistema que fue en general ignorado por su aparente escasa variación en la historia evolutiva de los anuros, aporta información tanto de la variación, organización y ontogenia de sus componentes como en la relación e integración de los mismos con otros sistemas anatómicos, información que resulta imprescindible para interpretar su evolución en los distintos ciclos de vida. El desarrollo de estas investigaciones requirió esclarecer algunos aspectos metodológicos en cuanto a los criterios a utilizar para identificar una determinada estructura y terminológicos en cuanto a la unificación de términos para su denominación. Son necesarios análisis exhaustivos y detallados de la disposición e inervación de las líneas laterales y una nomenclatura que contenga la suficiente información morfológica que permita establecer equivalencias entre las líneas más allá de las diferentes morfologías larvales. Así, la información obtenida permite llevar a cabo análisis comparados con información clara, precisa y comparable.
Desarrollo, crecimiento y madurez sexual
Una idea incorporada en todos los estudios de sistemática basados en morfología es la del semaforonte (Hennig, 1966), que alude a la forma de un organismo en un momento determinado (como una fotografía) de su ontogenia. Resulta habitual utilizar términos como postmetamórficos, metamorfoseados, juveniles, subadultos y/o adultos para referirse a los estadios posteriores a la metamorfosis en los anuros, pero sin una definición clara de los límites entre cada una de estas "edades" sino más bien utilizando el tamaño del cuerpo para distinguir entre una y otra. ¿Es correcto inferir que un organismo es adulto porque alcanzó cierto tamaño? Gould (1977) señala que encontraremos ambigüedades si no estandarizamos un criterio y distinguimos entre tamaño, edad y estadio del desarrollo. Se debe tener en cuenta que en una serie ontogenética postembrionaria o postmetamórfica, la forma adulta madura sexualmente puede ser alcanzada antes de que algunos procesos de crecimiento se hayan detenido (Fabrezi, 2012), es decir que el tamaño a la madurez sexual y el tamaño máximo que una especie puede alcanzar no son coincidentes. Además la mayoría de las especies exhiben dimorfismo sexual en tamaño y las tasas de crecimiento por lo tanto varían entre sexos (Ryser, 1988; Leclair y Laurin, 1996). El tamaño responde a crecimiento, que se define como el aumento continuo de las dimensiones espaciales de un organismo, mientras que el desarrollo involucra un aumento en complejidad y organización producto de la diferenciación celular, organogénesis, etc., es decir afecta la forma (Needham, 1964; Gould, 1977). El crecimiento es un aspecto del desarrollo pero puede haber desarrollo sin crecimiento (Richtsmeier, 2003). En numerosos casos el tamaño ha sido utilizado como una aproximación de la edad, aunque algunos autores consideran ésto problemático (McKinney y McNamara, 1991; Godfrey y Sutherland, 1995; Klingenberg y Spence, 1993; Reilly et al., 1997; Fabrezi, 2012). En este sentido, una serie de tamaño no debería ser considerada sinónimo de serie ontogenética; las observaciones y conclusiones que de la primera se desprenderían no estarían relacionadas al grado de desarrollo sino a las diferencias individuales de tamaño entre varios organismos de una misma especie.
Organizar una serie ontogenética requiere de criterios claros para determinar el progreso relativo del desarrollo en cada individuo. Para ello, es necesario obtener una medida relevante del tiempo con la cual se pueda describir el inicio, la finalización o la tasa de los eventos del desarrollo (Reilly et al., 1997). La edad es el mejor parámetro para estimar el tiempo en una serie, y puede ser obtenida con datos de campo, de laboratorio o inferida mediante técnicas específicas como la esqueletocronología. Así, estudiar la ontogenia completa de un organismo implica describir series de desarrollo donde el tamaño puede ser uno de los tantos parámetros del desarrollo o un parámetro (crecimiento) independiente (forma versus tamaño). Por lo tanto también es importante definir un criterio para seleccionar aquellos eventos del ciclo de vida que usemos como referencia (e.g., fertilización, eclosión, metamorfosis, madurez sexual, etc.) y que no confundan desarrollo (forma) con crecimiento (tamaño).
En el ciclo de vida de los anuros, las diferentes etapas han sido definidas mediante un criterio temporal de la siguiente manera (www.amphibanat.org): a) estadio embrionario, entre la fertilización del huevo y la eclosión; b) larva, estadio inmaduro de un organismo, que se desarrolla entre el embrión y el estado juvenil, en el cual el organismo pasa además por la metamorfosis; c) juvenil, organismo sexualmente inmaduro que ha completado la metamorfosis y; d) adulto, organismo totalmente formado y maduro sexualmente. Todas las definiciones llevan implícito dos temas: desarrollo y madurez. Numerosos autores desde el siglo XIX (Leuckart, 1821; Dumeril, 1866; Kollman, 1886; Boas, 1896) notaron que el desarrollo gonadal está desacoplado del desarrollo somático y la metamorfosis, por lo que ambas trayectorias deben ser caracterizadas independientemente, dando origen al concepto de neotenia (revisado en Gould, 1977; Fink, 1982; Raff y Wray, 1989; Reilly et al., 1997). En anuros, a diferencia de los urodelos, la neotenia no ha sido descripta. Sin embargo, algunos individuos del hílido Sphaenorhynchus bromelicola ocasionalmente pueden alcanzar la madurez sexual (ovocitos en vitelogénesis, espermatozoides y sacos vocales) aún cuando retienen las colas (Bokermann, 1974).
Algunas de las expresiones normalmente utilizadas que combinan etapas del desarrollo con características sexuales para describir diferentes especímenes, y que dependen directamente del criterio aplicado, son: "juveniles con cola que poseen gónadas maduras", "larvas con gónadas maduras pero sin caracteres sexuales secundarios", "especímenes con cola que poseen ovarios o testículos maduros y caracteres sexuales secundarios", "adultos capaces de reproducirse". Estas expresiones confusas ponen en evidencia la necesidad de que se defina y aclare ¿qué se considera juvenil, qué se considera adulto, qué se considera maduro?
A lo largo de la historia, los conceptos juvenil (o juventud) y adulto han sido considerados de diferente manera, lo que ha generado problemas en cuanto a la ambigüedad de su significado. De Beer (1940) realizó una breve discusión sobre el término juvenil y concluyó que para su análisis sobre "heterocronía y la filogenia", juvenil describe a los estadios tempranos del desarrollo y que las estructuras que aparecen en ese estadio son las estructuras juveniles. Gould (1977) refiere que el estadio de desarrollo de la adultez es el de la llegada a la madurez sexual por lo que se infiere que juvenil representa a todos aquellos estadios donde la madurez sexual aún no fue alcanzada. Horner et al. (2000) en un estudio en huesos del dinosaurio Maiasaura peeblesorum, diferenciaron entre juveniles tempranos, juveniles tardíos, subadultos y adultos basándose en el tamaño relativo de los huesos y en diferentes características histológicas de los huesos en cada estadio, mientras que Maisano (2002) indicó que para algunos Squamata la fusión de ciertos elementos del esqueleto coincide con la adquisición de la madurez sexual. En estudios de historia natural y ecología es común encontrar que las observaciones, mediciones, etc. se hacen clasificando a los especímenes como juveniles, subadultos y adultos y estableciendo para tales distinciones un límite arbitrario sin otra base que el tamaño de los mismos (McCaffery y Maxell, 2010; Zumbado-Ulate et al., 2011; Streicher et al., 2012). El empleo ambiguo de estos términos puede llevar a interpretaciones erróneas si el criterio utilizado para definir cuándo un espécimen es considerado juvenil o cuándo adulto no está del todo claro o es demasiado subjetivo como para su repetición en nuevos estudios.
La noción que se tiene sobre el término maduración implica un proceso en el que se está por alcanzar un desarrollo pleno, que se llega a la forma más completa. La maduración supone cambios cualitativos en la organización anatómica y fisiológica de una estructura biológica hacia su nivel más complejo, hacia su forma final, madura. Alcanzar el estadio adulto implica no sólo la maduración sexual, esto es el desarrollo de todo el sistema reproductor y la capacitación de las células germinales, sino también el desarrollo de caracteres sexuales secundarios (e.g. saco vocal en machos), todos los comportamientos asociados con éstos y la adquisición (en la mayoría de las especies) del dimorfismo sexual (Fig. 3A).
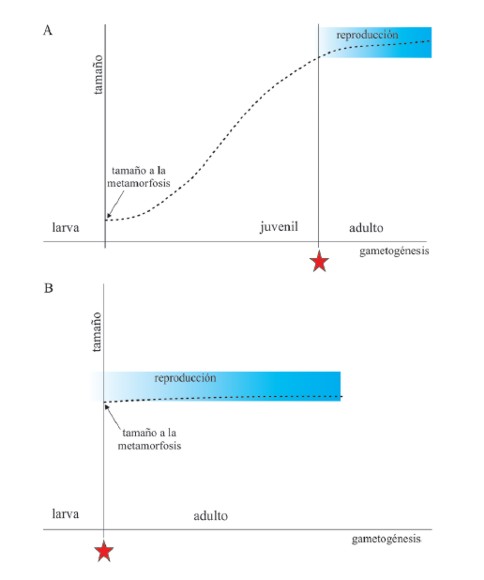
Figura 3. A. En los anuros, la generalidad establece que el crecimiento postmetamórfico de un individuo exhibe una curva característica hasta la edad de maduración sexual (estrella roja) en la que se alcanza una meseta o una tasa desacelerada de crecimiento (Ryser, 1988). La adultez, que implica la capacidad reproductiva, recién es posible cuando las gónadas están maduras, se han diferenciado espermatozoides u ovocitos vitelogénicos y los caracteres sexuales secundarios ya están definidos. B. En el caso particular de Pseudis paradoxa, al finalizar la metamorfosis, el tamaño es prácticamente el mismo que el de los individuos con capacidad reproductiva y algunos procesos de desarrollo (por ejemplo la diferenciación del aparato timpánico, la osificación de las epífisis) también han alcanzado las características de los adultos; esto implica que existe una superposición de estados metamórficos y juveniles o bien que los estados juveniles se han omitido (Fabrezi y Goldberg, 2009; Fabrezi et al., 2009; Fabrezi et al., 2010).
En general, una vez terminada la metamorfosis, con la regresión total de la cola, los especímenes entran a la etapa de juveniles en donde el crecimiento exhibe una curva característica (Fig. 3A) que alcanzará una meseta cuando se adquiere la madurez sexual (Needham, 1964). Esta última implica tanto desarrollo (de caracteres sexuales secundarios y gónadas y gametas maduras) como crecimiento (tamaño adulto y dimorfismo sexual cuando lo hubiera). Un ejemplo interesante a partir de nuestros estudios corresponde al caso de Pseudis paradoxa. En esta especie (Fig. 3B), al final de la metamorfosis la longitud del cuerpo (cabeza + tronco) es casi la máxima, todo el esqueleto está completamente formado y osificado (es decir que su desarrollo postmetamórfico es casi nulo), hay un avanzado grado de diferenciación de las gónadas y células germinales y el sistema timpánico alcanzó su completa diferenciación (Fabrezi y Goldberg, 2009; Fabrezi et al., 2009, 2010). En este caso, ¿Se puede hablar de juveniles de Pseudis paradoxa?, ¿Todos los especímenes postmetamórficos de P. paradoxa son adultos? Nuestros estudios, con datos sobre la diferenciación y el desarrollo gonadal, estructuras digestivas, cambios tegumentarios, del esqueleto, etc. llevaron a plantear que la metamorfosis prolongada comprende los estadios juveniles y la madurez sexual podría ocurrir tan pronto como se complete la metamorfosis. Así, algunos rasgos que en la mayoría de los anuros caracterizan el estadio juvenil, en P. paradoxa están presentes antes de que se pierda la cola por completo.
Algunos trabajos recientes enfocaron el problema de la falta de uniformidad en la terminología y la estandarización de los datos en los análisis morfológicos y plantearon la necesidad de glosarios u ontologías para resolver estos problemas (Maglia et al., 2007; Vogt, 2009; Deans et al., 2012). En este sentido, reconocer los eventos de la ontogenia comunes a todos los animales y cuáles son los grandes períodos comprendidos entre estos eventos, ayudaría a enriquecer, más que a reducir, la descripción morfológica de la variación fenotípica que brinda la ontogenia. Está claro que la falta de estandarización de la terminología utilizada o la ausencia de criterios específicos que indiquen a qué se refiere un concepto y en qué contexto se lo aplica puede llevar a la superposición de términos y al despojo de contenido conceptual de los mismos.
La glándula tiroides durante el desarrollo de anuros
Durante el desarrollo de cualquier organismo se produce una gran cantidad de acciones mediadas por hormonas. En los anuros, la metamorfosis está desencadenada por una serie de mecanismos fisiológicos producto de la respuesta del organismo a las interacciones de factores internos y externos, tales como la densidad conespecífica, la disponibilidad y calidad del alimento, la desecación y la exposición a predadores (Wilbur y Collins, 1973; Werner, 1986; Newman, 1992; Goater, 1994; Kupferberg, 1997; Denver, 1998; Relyea, 2007). El conjunto de cambios moleculares, bioquímicos y morfológicos durante la metamorfosis es dirigido por la hormona tiroidea (HT), producida por la glándula tiroides (Denver, 2013).
A principios de siglo pasado, los estudios experimentales pioneros de Gudernatsch (1912) y Allen (1918) en Rana ya habían demostrado que esta hormona es claramente esencial en la metamorfosis de los anuros. La hormona tiroidea inicia los programas de expresión de genes en diversos tejidos que conducen a la proliferación, muerte, diferenciación o migración celular durante esta etapa (Brown y Cai, 2007). La metamorfosis está mediada directamente por la glándula tiroides e indirectamente por la pars distalis de la glándula pituitaria, vía la hormona estimulante de la tiroides (TSH), que a su vez es controlada por el hipotálamo a través de neurohormonas (Fig. 4). El hipotálamo interviene en primera instancia en la interacción entre el ambiente y el medio interno con la consecuente producción de las hormonas vinculadas a la metamorfosis (Denver, 2013).
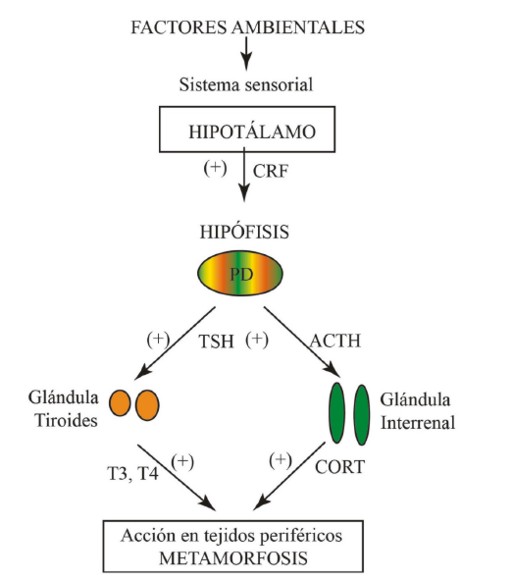
Figura 4. Los factores ambientales actúan sobre el eje hipotálamo-hipófisis-tiroides. Durante la metamorfosis el estímulo recibido por el hipotálamo es transferido a la hipófisis vía el factor liberador de corticotropina (CRF). Este factor estimula la secreción de la hormona adrenocortiotrófica (ACTH), que produce la liberación de corticosteroides (principalmente corticosterona -CORT- en las glándulas interrenales) y la hormona estimulante de la tiroides (TSH) que ocasiona la secreción de tiroxina (T4) y triiodotironina (T3) en las glándulas tiroides. Tanto las hormonas tiroideas (HT) como los corticosteroides (CSs) actúan de forma conjunta en los tejidos periféricos que responden durante la metamorfosis, los CSs aceleran los cambios inducidos por HT durante este periodo. Modificado de Denver (2013).
Es evidente como la serie de transformaciones morfológicas durante la metamorfosis debe ser encarada dentro de un contexto amplio, teniendo en cuenta que resulta de las interacciones recíprocas entre el medio interno y el ambiente. El estudio de la variación fenotípica durante el desarrollo de la glándula tiroides y su fisiología en anuros ha sido abordado por diversas investigaciones y aunque parecería estar casi completamente conocido, la integración de estos estudios todavía resulta necesaria. Respecto a este tópico, en estudios de Biología Evolutiva de los anuros reconocemos tres líneas de investigaciones principales:
1) La histomorfología de las glándulas tiroides y su relación con los cambios morfológicos durante el desarrollo larval siguiendo la caracterización de Etkin (1936).
2) Las consecuencias morfológicas de la alteración fisiológica de la hormona tiroidea ya sea por la ausencia de glándula tiroides (Rot-Nikcevic y Wassersug, 2004), la inhibición experimental de la síntesis de hormona tioridea (Dodd y Dodd, 1976) o la administración de hormona tiroidea exógena (Hanken y Summers, 1988; Hanken et al., 1989).
3) El rol de factores ambientales tales como la temperatura, desecación, competencia, disponibilidad de alimentos y dieta en la velocidad de desarrollo y crecimiento larval influenciando el sistema endócrino o viceversa (Pfennig, 1992; Buchholz y Hayes, 2005).
En la primera línea de investigación, Etkin (1936) definió y distinguió los períodos del desarrollo larval para los anuros sobre la base de características morfo-histológicas de las glándulas tiroides. Así reconoció los siguientes períodos: 1) premetamorfosis, que comprende la diferenciación y organización de las células secretoras en folículos tiroideos y organización de los mismos en lóbulos; 2) prometamorfosis, que se reconoce por un incremento en el volumen de las glándulas, tanto por el aumento en el número de folículos como en el tamaño del lumen; las células foliculares se vuelven más altas y hay una acumulación de secreción coloidal eosinófila en la luz de los folículos; y 3) clímax metamórfico, que se identifica por una disminución en la altura de las células foliculares y en el tamaño de la luz de los folículos con una progresiva ausencia de coloide. Esta caracterización fue realizada sobre la base del análisis del desarrollo de la glándula tiroides en Lithobates pipiens (Etkin, 1936) y posteriormente fue sustentado en L. palustris, L. catesbeianus y Pseudacris triseriata (Etkin, 1936) y en descripciones de otras especies no relacionadas, como Rana temporaria (Fox, 1966), Bufotes viridis, Hyla savignyi y Pelophylax ridibundus (Michael y Adhami, 1974), Xenopus laevis (Dodd y Dodd, 1976; Grim et al., 2009) y Rhinella arenarum (Miranda y Pisanó, 1996). Todas estas descripciones fueron realizadas con especímenes criados en laboratorio donde los parámetros que se mencionan en la metodología se refieren a condiciones de iluminación/temperatura pero no se especifican otros (por ejemplo, cantidad de especímenes por tanque de cría, dieta, etc.).
Con respecto al segundo punto, la ausencia o el mal funcionamiento de la glándula impiden que la metamorfosis ocurra (Rot-Nikcevic y Wassersug, 2003; 2004), como se ha observado en renacuajos de Xenopus laevis criados en laboratorio carentes de glándulas tiroides en los que se observó un crecimiento exagerado (renacuajos gigantes) pero con incapacidad de metamorfosear. En estos gigantes, el único sistema que puede continuar con su diferenciación y crecimiento independiente es el gonadal (Rot-Nikcevic y Wassersug, 2003; 2004). Mucho antes, Allen (1918) describió una situación similar en el desarrollo de renacuajos de Lithobates pipiens a los que extirpó la glándula tiroides. En ambos casos el crecimiento exagerado de los renacuajos y la interrupción del desarrollo estarían indicando la importancia de la hormona durante la metamorfosis. Estas consecuencias también fueron observadas mediante el uso de disruptores endócrinos que inhiben la síntesis de hormona tiroidea (Miranda et al., 1996; Degitz et al., 2005; Mitsui et al., 2006; Opitz et al., 2006; Smirnov y Vassilieva, 2014; entre otros). Sin embargo, algunas evidencias parecerían sugerir que la ausencia de glándulas tiroideas no necesariamente es un impedimento para que ocurran algunos cambios relacionados con la hormona tiroidea. Kerney et al. (2009) describieron en los renacuajos gigantes de Xenopus el desarrollo esqueletal y encontraron un avanzado grado en la osificación condral a nivel de cráneo, columna y extremidades con respecto a los renacuajos normales en el mismo estadio; el progreso de estas osificaciones estaría bajo control de la hormona tiroidea (Hanken y Summers, 1988; Hanken et al., 1989). Rot-Nikcevic y Wassersug (2004) sugirieron la posibilidad de existencia de folículos tiroideos ectópicos dado que durante el desarrollo de los ovarios la vitelogénesis implica síntesis de vitelo en el hígado mediado por la hormona tiroidea (Hayes, 1997). Recientemente, Smirnov y Vassilieva (2014) compararon los datos Kerney et al. (2009) en especímenes de Xenopus expuestos a la acción de disruptores endócrinos y encontraron que los renacuajos gigantes presentan un desarrollo más avanzado tanto en las características morfológicas externas como en las del esqueleto y sugirieron que es posible que existan fuentes adicionales de hormona tiroidea aparte de las glándulas.
La tercera línea de investigación, corresponde a estudios más ecológicos y fisiológicos en anuros de ambientes áridos donde el énfasis es puesto en las variables ambientales que afectan desarrollo y crecimiento. En algunas especies de escafiopódidos que habitan los desiertos de América del Norte coexisten tanto morfos omnívoros como carnívoros en la misma población y se propuso que el desarrollo acelerado de los morfos carnívoros está influenciado por la acción de señales endócrinas dadas por las hormona tiroidea como respuestas a variaciones en la dieta y competencia (Pfennig, 1992; Ledón-Rettig et al., 2009, 2010). Kupferberg (1997) discutió varias líneas de evidencias indicando que el incremento de proteína en la dieta (por carnivoría y canibalismo aparentemente) aumenta la tasa de crecimiento y de desarrollo por influencia en la función tiroidea. Los renacuajos pueden adquirir hormona tiroidea o precursores (iodo y tirosina) a través de la predación de camarones o renacuajos incluyendo co-específicos (Pfennig 1992, Ledón-Rettig y Pfennig, 2011). Por otra parte, Buchholz y Hayes (2005), Hollar et al., (2011) y Gomez-Mestre et al. (2013) analizaron algunas variables endócrinas en el desarrollo de estas ranas y encontraron cierta correlación con el tiempo de desarrollo larval, que indicaría que en aquellos taxa con desarrollo más rápido los tejidos tendrían mayor sensibilidad a la hormona tiroidea aún con similares niveles de hormona circulando; esta deriva en la fisiología de la hormona tiroidea sería una respuesta a la rápida desecación de los charcos.
Al analizar toda esta información, encontramos que se han estudiado las características de las glándulas tiroides en especímenes criados en laboratorio sin entrar en detalle sobre las condiciones del cautiverio. Así, la dieta que podría ser fundamental para entender la fisiología de la hormona tiroidea y las características de las glándulas durante el ciclo de vida y sus consecuencias no fueron usualmente consideradas. Por otra parte, en las numerosas investigaciones sobre plasticidad fenotípica del desarrollo de los escafiopódidos, la línea que enfatiza en la dieta y canibalismo y la línea que hace énfasis en la desecación se plantean por separado, y la ausencia de integración genera cierta dificultad a la hora de interpretar las relaciones recíprocas entre las influencias del ambiente, el medio interno y su expresión fenotípica durante el desarrollo. Esto nos invita a preguntarnos ¿Cómo son las glándulas tiroides de los escafiopódidos durante los estadios prometamórficos y de clímax?
Al considerar los enfoques en el estudio de la cuestión endócrina involucrada en el desarrollo larval nos preguntamos que pasaría si se investigara la morfología de especies que comparten los mismos sitios de cría pero que presentan patrones de desarrollo y crecimiento diferentes (Fig. 5):
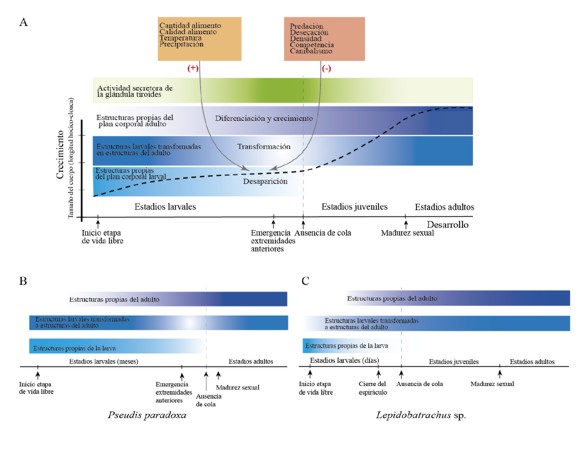
Figura 5. A. Gráfico que representa los cambios de forma y tamaño durante el ciclo de vida de un anuro. La actividad secretora de la glándula tiroidea (inferida por características histomorfológicas de la glándula y niveles de hormonas tiroideas [T3 y T4] en plasma) alcanza un pico durante la metamorfosis y es la responsable de los cambios morfológicos en el desarrollo (desaparición, transformación y diferenciación de estructuras). Existen factores ambientales que son censados por el hipotálamo y pueden influir positiva o negativamente sobre la tasa crecimiento y desarrollo larval. B y C. El mismo gráfico para los ciclos de vida de Pseudis paradoxa y Lepidobatrachus sp. En estos taxa, similares factores ambientales actúan de manera muy diferente sobre el ciclo de vida (Fabrezi, 2011). En B, favorecen un desarrollo larval prolongado y en C, todo lo contrario. Nos preguntamos ¿cómo son las interacciones entre factores ambientales, la hormona tiroidea (inferida a partir de la histomorfología de las glándulas), desarrollo y crecimiento?
1) ¿Cómo son las características histomorfológicas de las glándulas tiroides en especies que tienen un desarrollo larval prolongado y que exhiben un tamaño exagerado al metamorfosear? En la Figura 5B se esquematiza el desarrollo de Pseudis paradoxa, una especie en la que el renacuajo alcanza un gran tamaño con tasas de crecimiento desaceleradas (algo similar a los renacuajos gigantes que carecen de tiroides). En esta especie se esperaría que las glándulas presenten características similares a las de las glándulas premetamórficas de Rana (Etkin, 1936) durante gran parte del desarrollo larval con un pico de actividad entre prometamorfosis/clímax metamórfico. Sin embargo, la histomorfología revela que las características epiteliales de las glándulas tiroides en esta especie son similares a las descritas en Rana reconociéndose una fase de pre, prometamorfosis y clímax (J. Cruz, obs. pers.).
2) ¿Cómo son las características histomorfológicas de las glándulas tiroides en especies que tienen un desarrollo y crecimiento larval muy rápido? En la Figura 5C se esquematiza el desarrollo de Lepidobatrachus spp., que presentan tasas de crecimiento y desarrollo aceleradas, con un renacuajo que tiene una morfología similar a un anuro durante el clímax metamórfico. En estos se esperaría que las características histomorfológicas de las glándulas tiroides revelen una actividad secretora intensa durante el corto desarrollo larval. Sin embargo, en el desarrollo de Lepidobatrachus spp. las glándulas tiroides nunca muestran una marcada actividad por lo que las características singulares de su desarrollo podrían estar relacionadas con la presencia de HT materna, aportes extra de HT a partir de folículos tiroideos heterotópicos, o de HT exógena proveniente de una dieta carnívora con predominio de crustáceos (T2) y otros renacuajos (T4) (Fabrezi y Cruz, 2014).
Estas preguntas nos muestran una vez más que el estudio de la morfología y su relación con las interacciones endógenas y exógenas que ocurren durante la ontogenia todavía se encuentra en una fase exploratoria donde hay mucho por descubrir. Son necesarios estudios que integren diferentes aspectos relacionados a la morfología y fisiología de la glándula tiroides, por ejemplo, y las condiciones en las que los diferentes anuros se desarrollan para tener una mejor comprensión de mecanismos causales que definen la diversidad fenotípica.
La locomoción de los anuros adultos
Los anuros adultos presentan varias características anatómicas en el esqueleto axial, cintura pélvica y miembros posteriores que resultan en una combinación única entre los tetrápodos y que se asocian a su locomoción: ausencia de vértebras caudales y presencia de urostilo, articulación del ilion con la superficie ventral de las diapófisis sacras, fusión de tibia y fíbula, alargamiento de los elementos tarsales proximales y gran desarrollo de la musculatura del miembro posterior (Lutz y Rome, 1994; Jenkins y Shubin, 1998; Handrigan y Wassersug, 2007; Přykil et al., 2009; Púgener y Maglia, 2009; Manzano et al., 2013).
A lo largo de los años, se desarrollaron numerosas investigaciones sobre la morfología del aparato locomotor en anuros y se estableció que algunas características (morfología del ilion, articulación ilio-sacra y presencia de urostilo) fueron determinantes para la evolución del salto en el grupo (Emerson, 1979, 1982; Rage y Roček, 1989; Jenkins y Shubins, 1998; Reilly y Jorgensen, 2011). El análisis del registro fósil muestra que los taxa propuestos como grupos hermanos de Anura exhiben características anatómicas presentes en los anuros actuales: Triadobatrachus massinoti y Czatkobatrachus polonicus del Triásico Inferior de Madagascar y Polonia respectivamente, presentaban ilion y tarsales proximales alargados, menor número de vértebras en el tronco respecto de los tetrápodos basales y pocas vértebras caudales (Rage y Roček, 1989; Evans y Borsuk−Białynicka, 2009). Los anuros fósiles del Jurásico, como Prosalirus bitis (Shubin y Jenkins, 1995), Vieraella herbsti (Estes y Reig, 1973; Báez y Baso, 1996) y Notobatrachus degiustoi (Estes y Reig, 1973; Báez y Basso, 1996; Báez y Nicoli, 2008) suman características como la fusión de elementos del zeugopodio, un mayor acortamiento del tronco y la presencia de urostilo. A partir del estudio de estas especies fósiles, numerosos autores intentaron determinar cuál fue el primer tipo locomotor, haciendo énfasis en las estructuras esqueléticas antes mencionadas que representan cambios o novedades con respecto a otros tetrápodos filogenéticamente relacionados (Rage y Roček, 1989; Shubin y Jenkins, 1995; Jenkins y Shubin, 1998; Sigurdsen et al., 2012). Sin embargo, resulta muy difícil argumentar acerca del origen del salto sobre las bases del registro fósil ya que se debe tener en cuenta la preservación incompleta del material (estructuras cartilaginosas -apófisis, crestas y/o epífisis- que no se fosilizaron), el hiato temporal entre los escasos registros del Mesozoico y los linajes actualmente representados, y la ausencia de datos ontogenéticos que permitan el estudio del proceso de constitución del sistema locomotor, dado que los fósiles corresponderían a formas adultas (Rage y Roček, 1989).
Más allá de aquellos trabajos que incluyeron taxa fósiles, varios investigadores estudiaron las estructuras del postcráneo adulto y su musculatura basándose en formas actuales, y utilizando análisis electromiográficos discutieron la relevancia de las mencionadas novedades morfológicas para el desarrollo del salto en el grupo (Emerson, 1979; 1982; Jenkins y Shubin, 1998; Púgener y Maglia, 2009; Emerson y de Jongh, 1980; Lutz y Rome, 1994; Přikryl et al., 2009). Otros estudios plantearon cuál fue el primer tipo locomotor (por ejemplo la natación, el salto o el caminar) (Emerson, 1982; Reilly y Jorgensen, 2011; Jorgensen y Reilly, 2013; Přikryl et al., 2009), mientras que a partir de los trabajos de Gans y Parsons (1966) y Wassersug y Sperry (1977) existe un amplio consenso con respecto a que el salto en anuros evolucionó como un mecanismo de escape. Llama la atención que todo este cuerpo de información, a la hora de hablar de la locomoción en los anuros, enfatiza sólo en la pelvis, el esqueleto axial (sacro y urostilo) y su musculatura, pero no se tiene en cuenta que el aparato locomotor funciona como un sistema que integra a lo largo de la ontogenia estructuras esquelético-musculares con su inervación, en extremidades, cinturas y esqueleto axial (Fig. 6). A partir de todo esto surge la pregunta: ¿cuál fue la razón por la que tradicionalmente se enfatizó que las novedades anatómicas de la columna y la cintura pélvica fueron determinantes para la locomoción?
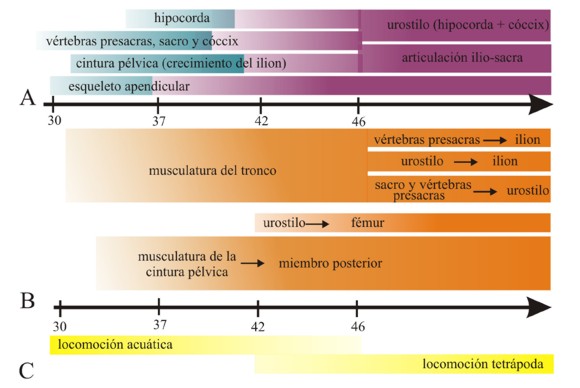
Figura 6. A. Secuencia del desarrollo del esqueleto postcraneal en la mayoría de los anuros según la tabla de Gosner (1960). Los moldes cartilaginosos (en azul) comienzan a osificar (en violeta) en distintos estadios. En el estadio 42 (cuando emergen los miembros anteriores) la cintura pélvica y el complejo sacro-urostílico aún no se encuentran completamente desarrollados y mantienen una posición larval. La articulación ilio-sacra y la formación del urostilo son los últimos eventos del desarrollo en definir el esqueleto postcraneal adulto. B. Secuencia del desarrollo de los músculos pélvicos en anuros de acuerdo con la tabla de Gosner; la flecha indica inserción del músculo. La musculatura del tronco retiene la morfología larval después de la metamorfosis. Los músculos con origen en el esqueleto axial que se insertarán en la pelvis o el urostilo comienzan a diferenciarse después que la musculatura de la cola se pierde por completo, mientras que los músculos del muslo con origen en la cintura pélvica (isquion e ilion) que se insertan en el miembro posterior se diferencian inmediatamente una vez que el fémur cartilaginoso y la cintura pélvica están presentes. Simultáneamente con la pérdida de la cola, el urostilo y la articulación ilio-sacra adquieren su forma final. C. Locomoción durante el desarrollo de los anuros: el estadio 46 de Gosner indica el fin de la metamorfosis, con la pérdida total de la cola. El esqueleto de los miembros y su musculatura están completamente diferenciados en el estadio 42, cuando las osificaciones en los huesos largos están en progreso. En este estadio, los miembros anteriores emergen y los movimientos ondulatorios de la cola se complementan con los movimientos de flexión-extensión del miembro. Es decir, la locomoción de los renacuajos y los adultos son funcionales simultáneamente durante el corto período que comienza con la emergencia de los miembros anteriores y finaliza con la completa ausencia de cola (estadios 42-46 de Gosner). Modificado de Fabrezi et al. (2014).
Una primera respuesta podría estar relacionada con el hecho de que los estudios más trascendentales no han considerado la ontogenia del aparato locomotor. Son escasos los trabajos que han descrito las trayectorias de desarrollo de algunas partes del sistema en los anuros; por ejemplo, Ročková y Roček (2005) analizaron la formación del urostilo y la cintura pélvica, Púgener y Maglia (2009) describieron el desarrollo de la articulación ilio-sacra y Manzano et al. (2013) la ontogenia y diferenciación de tejidos en la pelvis y la extremidad posterior. Recientemente, Fabrezi et al. (2014) plantearon la necesidad de establecer un esquema de cómo se integran las trayectorias ontogenéticas de los distintos componentes del sistema locomotor durante el desarrollo larval y post-larval, destacando que el registro fósil, al igual que la ontogenia, sugiere que la locomoción en los anuros adultos se originó por los cambios en los apéndices pares, las cinturas y su subsecuente integración con el esqueleto axial (Fabrezi et al., 2014).
Si bien la ausencia de datos ontogenéticos puede haber primado al considerar que los cambios estructurales asociados a la locomoción ocurrieron próximo-distalmente, resulta más difícil de explicar el hecho de que se haya subestimado el rol que cumple la morfología de las extremidades, en especial la de las extremidades posteriores. Como fue detallado anteriormente, una particularidad de las extremidades posteriores en los anuros es el alargamiento de los tarsales proximales, elementos típicamente nodulares en otros anfibios y amniotas, que en anuros se asemejan a los huesos del zeugopodio (tibia y fíbula) (Blanco et al., 1998). Cabe destacar que la presencia de elementos tarsales moderadamente alargados se evidencia tempranamente en anfibios Temnospondyli como Doleserpeton del Pérmico Inferior. Otro dato relevante que refuerza la importancia del alargamiento de los elementos tarsales es que ello ocurre también en primates prosimios como gálagos y tarsios, ambos grupos con capacidades saltatoriales (Handrigan y Wassersug, 2007). Esto indica que al enfatizar en las especializaciones del esqueleto axial y la cintura pélvica se dejó de lado una línea de evidencia que puede poner a prueba las hipótesis tradicionalmente aceptadas, ya que los miembros posteriores son funcionales antes de la formación de las articulaciones sacro-ilíaca, sacro-urostílica, e incluso previamente a la diferenciación de los músculos del tronco (Fig. 6). Es decir, los anuros adultos logran una locomoción tetrápoda antes de que el complejo formado por la pelvis, el sacro y el urostilo, con los miembros posteriores actúen como una unidad (Fabrezi et al., 2014).
Se plantea así la necesidad de estudiar la ontogenia del aparato locomotor de manera completa y ordenada, para definir cuándo y cómo desaparecen las estructuras responsables de la locomoción larval y aparecen las de la locomoción tetrápoda. A partir de un esquema de trabajo que contemple el desarrollo ontogenético de todo el sistema, será necesario revisar el concepto de locomoción en los anuros y separarlo de otras capacidades específicas de la locomoción (como cavar, planear, agarrar o trepar) y de interpretar los mecanismos causales asociados a la locomoción en general (nuevo hábitat) y a especializaciones (arborealidad y prensilidad). También, sobre la base de un re-análisis del registro fósil se podría replantear en qué medida la ontogenia reconstruye la filogenia del aparato locomotor.
Consideraciones finales
A fines del siglo pasado los avances en el desarrollo de nuevas metodologías, técnicas y herramientas de trabajo en las Ciencias Biológicas permitieron analizar niveles de organización más elementales, principalmente a nivel celular y molecular, hecho que relegó los estudios de los organismos a un segundo plano, sugiriendo que los mismos parecían haber agotado sus posibilidades de aportar información relevante, significativa e interesante (Wake, 2012).
La Morfología ha sido fuente de cuantiosa información para interpretar el origen de los organismos y los linajes y aspectos de su diversificación, filogenia y evolución (Wake, 1992). Los estudios en Morfología no se limitan a la descripción de órganos, sistemas de órganos y organismos, sino que su enriquecimiento como disciplina científica en el tiempo proporcionó las bases en torno a las cuales se desarrollaron conceptos centrales de la Biología del Desarrollo (heterocronía, heterotopía) y la Biología Evolutiva (homología, novedad morfológica, atavismo) que permitieron interpretar no solo la evolución de la forma sino también de aquellos procesos involucrados en ésta que hoy se reconocen en la Evo-Devo. Desde hace más de una década el surgimiento de la Evo-Devo, como un nuevo programa de investigación que intenta proporcionar una visión más comprensiva de los fenotipos analizando las relaciones entre el desarrollo y la evolución, puso en evidencia la necesidad de recuperar los estudios de Morfología tanto en sus enfoques tradicionales como utilizando nuevas herramientas (Jablonka y Lamb 2005; Müller, 2007). La Evo-Devo, con sus enfoques multidisciplinarios le ha devuelto a los estudios de Morfología la importancia que siempre han tenido para describir e interpretar la evolución de los organismos. Paralelamente, el desarrollo de nuevas técnicas digitales de procesamiento de imágenes ha permitido profundizar en estudios de Morfología para casos en los que las técnicas habituales no se podrían aplicar por diversas razones (técnicas invasivas, destrucción de los registros, etc.).
Este pantallazo sobre las problemáticas que surgen al estudiar la Morfología de un grupo pone de manifiesto que aún hay mucho por hacer; que es necesario estudiar la bibliografía, reanalizarla bajo una mirada conceptual y teórica actualizada y recuperar la riqueza del estudio de la variación en un contexto comparado en donde las inferencias evolutivas también puedan surgir del estudio de organismos no-modelos (Fabrezi et al., 2014). Resaltamos en este punto la necesidad de incrementar la rigurosidad al momento de realizar nuestras tareas tanto desde el punto de vista teórico (definiciones claras y precisas, definir el marco conceptual en el que vamos a trabajar) como práctico, por ejemplo hay que ser más explícitos en la elaboración y descripción de los materiales y técnicas usadas.
AGRADECIMIENTOS
Los autores agradecen a la Dra. Virginia Abdala, al Dr. Helio Da Silva y al Editor Asociado por sus enriquecedores comentarios y sugerencias. Todas las investigaciones que venimos desarrollando tienen financiamiento de CONICET a través del PIP 239 y del FONCyT a través de los PICT Bicentenario 616 y PICT 638.
LITERATURA CITADA
1. Allen, B.M. 1918. The results of thyroid removal in the larvae of Rana pipiens. Journal Experimental Zoology 26: 499-519. [ Links ]
2. Baez, A.M. & Basso, N. 1996. The earliest known frogs of the Jurassic of South America: Review and cladistic appraisal of their relationship. Münchner Geowissenschaftliche Abhandlungen, Reihe A (GeologiePalaontologie) 30: 131-158. [ Links ]
3. Baez, A.M. & Nicoli, L. 2008. A new species of Notobatrachus (Amphibia, Salientia) from the Middle Jurassic of Northwestern Patagonia. Journal of Paleontology 82: 372-376. [ Links ]
4. Blanco M.J.; Misof, B.Y. & Wagner, G.P. 1998. Heterochronic differences of Hoxa-11 expression in Xenopus fore- and hind limb development: Evidence for lower limb identity of the anuran ankle bones. Development Genes and Evolution 208: 175-187. [ Links ]
5. Boas, J.E.V. 1896. Ueber Neotenie: 1-20. En: Carl Gegenbaur (ed.), Festschrift turn siebzigsten Geburtstage, vol. 2. Leipzig, W. Engelman. [ Links ]
6. Bokermann, W.C.A. 1974. Observaçoes sobre desenvolvimento precoce em Sphaenorhynchus bromelicola Bok 1966 (Anura. Hylidae). Revista Brasileira de Biología 34: 35-41. [ Links ]
7. Brown, D.D. & Cai, L. 2007. Amphibian metamorphosis. Developmental Biology 306: 20-33. [ Links ]
8. Buchholz, D.R. & Hayes, T. 2005. Variation in thyroid hormone action and tissue content underlies species differences in the timing of metamorphosis in desert frogs. Evolution and Development 5: 458-467. [ Links ]
9. Chou, W. & Lin, J. 1997. Tadpoles of Taiwan. Special Publication Number 7. National Museum of Natural Science, Taiwan. [ Links ]
10. Coombs, S.; Görner, P. & Münz, H. 1989. The mechanosensory lateral line. Neurobiology and Evolution. Springer, New York. [ Links ]
11. Deans, A.R.; Yoder, M.J. & Balhoff, J.P. 2012. Time to change how we describe biodiversity. Trends in Ecology and Evolution 27: 78-84. [ Links ]
12. de Beer, G.R. 1940. Embryos and Ancestors. Oxford University Press. [ Links ]
13. Degitz, S.J.; Holcombe, G.W.; Flynn, K.M.; Kosian, P.A.; Korte, J.J. & Tietge, J.E. 2005. Progress towards development of an amphibian-based thyroid screening assay using Xenopus laevis. Organismal and thyroidal responses to the model compounds 6-propylthiouracil, methimazole, and thyroxine. Toxicological Sciences 87: 353-364. [ Links ]
14. Denver, R.J. 1998. Hormonal correlates of environmentally induced metamorphosis in the Western spadefoot toad, Scaphiopus hammondii. General and Comparative Endocrinology 110: 326-336. [ Links ]
15. Denver, R.J. 2013. Neuroendocrinology of amphibian metamorphosis. Current topics in developmental biology: 195-227. En: Yun-Bo, Shi. (ed.), Animal Metamorphosis. Academic Press, San Diego, USA. [ Links ]
16. Dijkgraaf, S. 1962. The functioning and significance of the lateral-line organs. Biological Reviews 38: 51-105. [ Links ]
17. Dodd, M.H.I. & Dodd, J.M. 1976. The biology of metamorphosis: 467-599. En: Lofts, B., (ed.), Physiology of Amphibia. Academic Press, New York. [ Links ]
18. Dumeril, A. 1866. Observations sur la reproduction, dans la Ménagerie des Reptiles du Muséum d'histoire naturelle, des Axolotls, batraciens urodèles à branchies extérieures, du Mexique, sur leur développement et sur leur métamorphoses. Nouvelles archives du Muséum d' Histoire Naturelle 2: 265-292. [ Links ]
19. Dünker, N.M.; Wake, H. & Olson, W.M. 2000. Embryonic and larval development in the caecilian Ichthyophis kohtaoensis (Amphibia, Gymnophiona): A staging table. Journal of Morphology 243: 3-34. [ Links ]
20. Emerson, S. 1979. The ilio-sacral articulation in frogs: form and function. Biological Journal of the Linnean Society 11: 153-168. [ Links ]
21. Emerson, S. 1982. Frog postcranial morphology: identification of a functional complex. Copeia 1982: 603-613. [ Links ]
22. Emerson, S. & de Jongh, H.J. 1980. Muscle activity at the ilio-sacral articulation of frogs. Journal of Morphology 166: 129-144. [ Links ]
23. Evans, S.E. & Borsuk-Bialynicka, M. 1998. A stem-group frog from the early Triassic of Poland. Acta Palaeontologica Polonica 43: 573-580. [ Links ]
24. Estes, R. & Reig, O.A. 1973. The early fossil record of frogs: A review of the evidence: 11-63. En: Vial, J.L. (ed.), Evolutionary Biology of the Anurans: Contemporary Research on Major Problems. University of Missouri Press. Columbia. [ Links ]
25. Etkin, W. 1936. The phenomena of the anuran metamorphosis. III. The development of the thyroid gland. Journal of Morphology 59: 68-89. [ Links ]
26. Fabrezi, M. 2011. Heterochrony in growth and development in anurans from the Chaco of South America. Evolutionary Biology 38: 390-411. [ Links ]
27. Fabrezi, M. 2012. Heterocronía y variación morfológica en anuros. Cuadernos de Herpetología 26: 29-47. [ Links ]
28. Fabrezi, M. & Quinzio, S.I. 2008. Morphological evolution in Ceratophryinae frogs (Anura, Neobatrachia): The effects of heterochronic changes during larval development and metamorphosis. Zoological Journal of the Linnean Society 154: 752-780. [ Links ]
29. Fabrezi, M. & Goldberg, J. 2009. Heterochrony during skeletal development of Pseudis platensis (Anura, Hylidae) and the early offset of skeleton development and growth. Journal of Morphology 270: 205-220. [ Links ]
30. Fabrezi, M. & Lobo, F. 2009. Hyoid skeleton, its related muscles and morphological novelties in the frog Lepidobatrachus (Anura, Ceratophryidae). The Anatomical Record 292: 1700-1712. [ Links ]
31. Fabrezi, M. & Cruz, J.C. 2014. Ontogeny of the thyroid glands during larval development of South American horned frogs (Anura, Ceratoprhyidae). Evolutionary Biology doi: 10.1007/s11692-014-9292-5. [ Links ]
32. Fabrezi, M.; Quinzio, S. & Goldberg, J. 2009.The giant tadpole and the delayed metamorphosis of Pseudis platensis Gallardo, 1961 (Anura, Hylidae). Journal of Herpetology 43: 228-243. [ Links ]
33. Fabrezi, M.; Quinzio, S.I. & Goldberg, J. 2010. The ontogeny of Pseudis platensis (Anura, Hylidae): Heterochrony and the effects of larval development in the postmetamorphic life. Journal of Morphology 271: 496-510. [ Links ]
34. Fabrezi, M.; Quinzio, S.; Goldberg, J. & De Sá, R. 2012. The Development of Dermatonotus muelleri (Anura: Microhylidae: Gastrophryninae). Journal of Herpetology 3: 363-380. [ Links ]
35. Fabrezi, M.; Manzano, A.S.; Abdala, V. & Lobo, F. 2014. Anuran locomotion: ontogeny and morphological variation of a distinctive set of muscles. Evolutionary Biology 41: 308-326. [ Links ]
36. Fink, W.L. 1982. The conceptual relationship between ontogeny and phylogeny. Paleobiology 8: 254-264. [ Links ]
37. Fox, H. 1966. Thyroid growth and its relationship to metamorphosis in Rana temporaria. Journal of Embryology and Experimental Morphology 16: 487-496. [ Links ]
38. Fritzsch, B. 1989. Diversity and Regression in the Amphibian Lateral Line and Electrosensory System: 99-114. En: Coombs, S.; Görner, P. & Münz, H. (eds.), The Mechanosensory Lateral Line. Springer, New York. [ Links ]
39. Fritzsch, B. & Wake, M. 1986.The distribution of ampullary organs in Gymnophiona. Journal of Herpetology 20: 90-93. [ Links ]
40. Fritzsch, B.; Nikundiwe, A.M. & Will, U. 1984. Projection patterns of lateral-line afferents in anurans: a comparative HRP study. Journal of Comparative Neurology 229: 451-469. [ Links ]
41. Fritzsch, B.; Drewes, R. & Ruibal, R. 1987. The retention of the lateral-line nucleous in adult anurans. Copeia 1987: 127-155. [ Links ]
42. Gans, C. & Parsons, T.S. 1966. On the origin of the jumping mechanism in frogs. Evolution 20: 92-99. [ Links ]
43. Goater, C.P. 1994. Growth and Survival of postmetamorphic toads—interactions among larval history, density, and parasitism. Ecology 75: 2264-2274.
44. Godfrey, L.R. & Sutherland, M.R. 1995. Flawed inference: why size based tests of heterochronic processes do not work. Journal of Theoretical Biology 172: 43-61. [ Links ]
45. Goldberg, F.J. & Fabrezi, M. 2008. Development and variation of the anuran webbed feet (Amphibia, Anura). Zoological Journal of the Linnean Society 152: 39-58. [ Links ]
46. Gomez-Mestre, I.; Kulkarni, S. & Buchholz, D.R. 2013. Mechanism and consequences of developmental acceleration in tadpoles responding to pond drying. Plos ONE 8: e84266. doi: 10.1371/journal.pone.0084266. [ Links ]
47. Gould, S.J. 1977. Ontogeny and phylogeny. The Belknap Press of Harvard University Press, Cambridge. [ Links ]
48. Grim, C.; Wolfe, M.; Braundbeck, T.; Iguchi, T.; Ohta, Y.; Tooi, O.; Touart, L.; Wolf, C. & Tietge, J. 2009. Thyroid histopathology assessments for the amphibian metamorphosis assay to detect thyroid-active substances. Toxicology and Pathology 37: 415-424. [ Links ]
49. Gudernatsch, J.F. 1912. Feeding experiments on tadpoles. I. The influence of specific organs given as food on growth and differentiation. A contribution to the knowledge of organs with internal secretion. Wilhelm Roux Arch Entwicklungsmech Organ 35: 457-483. [ Links ]
50. Hall, J.A.; Larsen, J.H. & Fitzner, R.E. 2002. Morphology of the prometamorphic larva of the spadefoot, Scaphiopus intermontanus, (Anura: Pelobatidae), with emphasis on the lateral line system and mouthparts. Journal of Morphology 252: 114-130. [ Links ]
51. Handrigan, G.R. & Wassersug, R.J. 2007. The anuran Bauplan: a review of the adaptive, developmental, and genetic underpinnings of frog and tadpole morphology. Biological Reviews 82: 1-25. [ Links ]
52. Hanken, J. & Summers, C.H. 1988. Skull development during anuran metamorphosis: III. Role of thyroid hormone in chondrogenesis. Journal of Experimental Zoology 246: 156-170. [ Links ]
53. Hanken, J.; Summers, C.H. & Hall, B.K. 1989. Morphological integration in the cranium during anuran metamorphosis. Experientia 45: 872-875. [ Links ]
54. Hayes, T.B. 1997. Hormonal mechanisms as potential constraints on evolution: examples from the Anura. American Zoologist 37: 482-490. [ Links ]
55. Hennig, W. 1966. Phylogenetic systematics. University of Illinois Press, Urbana. [ Links ]
56. Hollar, A.R.; Choi, J.; Grimm, A.T. & Buchholz, D.R. 2011. Higher thyroid hormone receptor expression correlates with short larval periods in spadefoot toads and increases metamorphic rate. General & Comparative Endocrinology 173: 190-198. [ Links ]
57. Horner, J.R.; De Ricqlès, A. & Padian, K. 2000. Long bone histology of the hadrosaurid dinosaur Maiasaura peeblesorum: growth dynamics and physiology based on an ontogenetic series of skeletal elements. Journal of Vertebrate Paleontology 20: 115-129. [ Links ]
58. Jablonka, E. & Lamb, M.J. 2005. Evolution in four dimensions: genetic, epigenetic, behavioral, and symbolic variation in the history of life. The MIT Press, Cambridge. [ Links ]
59. Jenkins, F.A. & Shubin, N.H. 1998. Prosalirus bitis and the anuran caudopelvic mechanism. Journal of Vertebrate Paleontology 18: 495-510. [ Links ]
60. Jorgensen, M.E. & Reilly, S.M. 2013. Phylogenetic patterns of skeletal morphometrics and pelvic traits in relation to locomotor mode in frogs. Journal of Evolutionary Biology 26: 929-943. [ Links ]
61. Kerney, R.; Wassersug, R. & Hall, B.K. 2009. Skeletal advance and arrest in giant non-metamorphosing african clawed frog tadpoles (Xenopus laevis: Daudin). Journal of Anatomy 20: 1-12. [ Links ]
62. Klingenberg, C.P. & Spence, J.R. 1993.Heterochrony and allometry: lessons from the water strider genus Limnoporus. Evolution 47: 1834-1853. [ Links ]
63. Kollman, J. 1885. Das ueberwintern von europäischen frosch- und tritonlarven und die umwandlung des mexikanischen axolotl. Verhandlungen der Naturforschendeden Gesellschaft in Basel 7: 387-398. [ Links ]
64. Kupferberg, S. 1997. The role of larval diet in anuran metamorphosis. American Zoologist 37: 146-159. [ Links ]
65. Lannoo, M.J. 1987. Neuromast topography in anuran amphibian. Journal of Morphology 191: 115-129. [ Links ]
66. Leclair, R. & Laurin, G. 1996. Growth and body size in populations of mink frogs Rana septentrionalis from two latitudes. Ecography 19: 296-304. [ Links ]
67. Ledón-Rettig, C.C. & Pfennig, D.W. 2011. Emerging model systems in eco-evo-devo: the environmentally responsive spadefoot toad. Evolution and Development 4: 391-400. [ Links ]
68. Ledón-Rettig, C.C.; Pfennig, D.W. & Crespi, E.J. 2009. Stress hormones and the fitness consequences associated with the transition to a novel diet in larval amphibians. Journal of Experimental Biology 212: 3743-3750. [ Links ]
69. Ledón-Rettig, C.C.; Pfennig, D.W. & Crespi, E.J. 2010. Diet and amphibians: implications for the evolution of novel feeding strategies. Evolution and Development 10: 316-325. [ Links ]
70. Leuckart, S. 1821. Einiges über die fischartigen Amphibien. Isis 8: 249-265. [ Links ]
71. Lutz, G.J. & Rome, L.C. 1994. Built for jumping the design of the frog muscular system. Science 263: 370-372. [ Links ]
72. Maglia, A.M.; Leopold, J.L.; Pugener, L.A. & Gauch, S. 2007. An anatomical ontology for amphibians. Pacific Symposium on Biocomputing 12: 367-378. [ Links ]
73. Maisano, J.A. 2002. Terminal fusions of skeletal elements as indicators of maturity in squamates. Journal of Vertebrae Paleontology 22: 268-275. [ Links ]
74. Manzano, A.; Abdala, V.; Ponssa, M.L. & Soliz, M. 2013. Ontogeny and tissue differentiation of the pelvic girdle and hind limbs of anurans. Acta Zoologica 94: 420-436. [ Links ]
75. McCaffery, R.M. & Maxell, B.A. 2010.Decreased winter severity increases viability of a montane frog population. Proceedings of the National Academy of Science USA 107: 8644-8649. [ Links ]
76. McKinney, M.L. & MacNamara, K. 1991. Heterochrony: the evolution of ontogeny. Plenum Publishing Corporation. New York. [ Links ]
77. Michael, M.I. & Al Adhami, M.A. 1974. The development of the thyroid glands in anuran amphibians of Iraq. Journal of Zoology 174: 315-323. [ Links ]
78. Miranda, L.A. & Pisanó, A. 1996. Estudio morfométrico sobre el desarrollo y evolución de las glándulas tiroides durante la metamorfosis de Bufo arenarum. Cuadernos de Herpetología 10: 47-57. [ Links ]
79. Miranda, L.A.; Pisanó, A. & Casco, V. 1996. Ultrastructural study on the thyroid gland of Bufo arenarum larvae kept in potassium perchlorate solution. Biocell 20: 147-153. [ Links ]
80. Mitsui, N.; Fujii, T.; Miyahara, M.; Oka, T.; Kashiwagi, A.; Kashiwagi, K.; Hanada, H.; Urushitani, H.; Santo, N.; Tooi, O. & Iguchi, T. 2006. Development of metamorphosis assay using Silurana tropicalis for the detection of thyroid system-disrupting chemicals. Ecotoxicology and Environmental Safety 64: 281-287. [ Links ]
81. Müller, G.B. 2007. Six memos for Evo-Devo: 499-524. En: M. D. Laubichler & Maienschein, J. (eds). From Embryology to Evo-Devo.A History of Developmental Evolution. The MIT Press, Cambridge. [ Links ]
82. Needham, A.E. 1964. The growth process in animals. Pitman Press, Londres. [ Links ]
83. Newman, R. 1992. Adaptive plasticity in amphibian metamorphosis. Bioscience 42: 671-678. [ Links ]
84. Northcutt, R. G. 1989. The phylogenetic distribution and innervation of craniate mechanoreceptive lateral lines: 17-78. En: Coombs, S.; Görner, P. & Münz, H. (eds.). The Mechanosensory Lateral Line. Springer, New York [ Links ]
85. Northcutt, R.G. 1997. Evolution of gnathostome lateral line ontogenies. Brain, Behaviour and Evolution 50: 25-37. [ Links ]
86. Opitz, R.; Hartmann, S.; Blank, T.; Braunbeck, T.; Lutz, I. & Kloas, W. 2006. Evaluation of histological and molecular endpoints for enhanced detection of thyroid system disruption in Xenopus laevis tadpoles. Toxicological Sciences 90: 337-348. [ Links ]
87. Orton, G.I. 1953. The systematics of vertebrate larvae. Systematic Zoology 2: 63-75. [ Links ]
88. Pfennig, D.W. 1992. Proximal and functional causes of pholyphenism in an anuran tadpole. Functional Ecology 6: 167-174. [ Links ]
89. Přikryl, T.; Aerts, P.; Havelková, P.; Herrel A. & Roček, Z. 2009. Pelvic and thigh musculature in frogs (Anura) and origin of anuran jumping locomotion. Journal of Anatomy 1: 100-139. [ Links ]
90. Púgener, L.A. & Maglia, A.M. 2009. Developmental evolution of the anuran sacro-urostylic complex. South American Journal of Herpetology 4: 193-209. [ Links ]
91. Quinzio, S. 2011. Evolución morfológica y desarrollo en anuros: El sistema de la líınea lateral y los escudos dorsales en Ceratophryinae (Anura, Ceratphryidae). Tesis Doctoral. Argentina: UNT. [ Links ]
92. Quinzio, S. & Fabrezi, M. 2014. The Lateral Line System in Anuran Tadpoles: Neuromast Morphology, Arrangement, and Innervation. The Anatomical Record 8: 1508-1522. [ Links ]
93. Quinzio, S.; Fabrezi, M. & Faivovich, J. 2006. Redescription of the tadpole of Chacophrys pierottii (Vellard, 1948) (Anura, Ceratophryidae). South American Journal of Herpetology 1: 202-209. [ Links ]
94. Raff, R.A. & Wray, G.A. 1989. Heterochrony: developmental mechanisms and evolutionary results. Journal of Evolutionary Biology 2: 409-434. [ Links ]
95. Rage, J.C. & Rocek, Z. 1989. Redescription of Triadobatrachus massinoti. Palaeontographica Abt. A 206: 1-16. [ Links ]
96. Reilly, S.M. & Jorgensen, M.E. 2011. The evolution of jumping in frogs: morphological evidence for the basal anuran locomotor condition and the radiation of locomotor systems in crown group anurans. Journal of Morphology 272: 149-168. [ Links ]
97. Reilly, S.M., Wiley, E.O. & Meinhardt, D.J. 1997. An integrative approach to heterochrony: The distinction between interspecific and intraspecific phenomena. Biological Journal of the Linnean Society 60: 119-143. [ Links ]
98. Relyea, R.A. 2007. Getting out alive: how predators affect the decision to metamorphose. Oecologia 152: 389-400. [ Links ]
99. Richtsmeier, J.T. 2003. Growth: 161-169. En: Hall, B.K. & Olson, W.M. (eds.), Key words & concepts in Evolutionary Developmental Biology. Harvard University Press, Cambridge. [ Links ]
100. Rockova, H. & Rocek, Z. 2005. Development of the pelvis and posterior part of the vertebral column in the Anura. Journal of Anatomy 206: 17-35. [ Links ]
101. Rot-Nikcevic, I. & Wassersug, R.J. 2003. Tissue sensitivity to thyroid hormone in athyroid Xenopus laevis larvae. Development, Growth & Differentiation 45: 321-325. [ Links ]
102. Rot-Nikcevic, I. & Wassersug, R.J. 2004. Arrested development in Xenopus laevis tadpoles: How size constrains metamorphosis. The Journal of Experimental Biology 207: 2133-2145. [ Links ]
103. Ryser, J. 1988. Determination of growth and maturation in the common frog, Rana temporaria, by skeletochronology. Journal of Zoology 216: 673-685. Schlosser, G. & Roth, G. 1995. Distribution of cranial and rostral spinal nerves in tadpoles of the frog Discoglossus pictus (Dicoglossidae). Journal of Morphology 226: 189-212. [ Links ]
104. Schlosser, G. & Northcutt, R.G. 2000. Development of neurogenic placodes in Xenopus laevis. Journal of Comparative Neurology 418: 121-146. [ Links ]
105. Shelton, P.M.J. 1970. The lateral line system at metamorphosis in Xenopus laevis (Daudin). Journal of Embryology and Experimental Morphology 24: 511-524. [ Links ]
106. Shubin, N.H. & Jenkins, F.A. 1995. An Early Jurassic jumping frog. Letters to Nature 377: 49-52. [ Links ]
107. Sigurdsen, T.; Green, D.M. & Bishop, P.J. 2012. Did Triadobatrachus Jump? Morphology and evolution of the anuran forelimb in relation to locomotion in early salientians. Fieldiana Life and Earth Sciences 5: 77-89. [ Links ]
108. Smirnov, S.V. & Vassilieva, A.B. 2014. Thyroid hormones in the skeletogenesis and accessory sources of endogenous hormones in Xenopus laevis (Amphibia; Anura) ontogeny: Experimental evidence. General Biology 455: 610-613. [ Links ]
109. Streicher, J.W.; Sheehy III, C.M.; Flores-Villela, O. & Campbell, J.A. 2012. Morphological variation in a polychromatic population of Chiricahua leopard frogs (Lithobates chiricahuensis) from Durango, Mexico. Journal of Herpetology 46: 387-392. [ Links ]
110. Vogt, L. 2009. The future role of bio-ontologies for developing a general data standard in biology: chance and challenge for zoo-morphology. Zoomorphology 128: 201-217. [ Links ]
111. Wake, M.H. 1992. Morphology, the study of form and function, in modern evolutionary biology: 289-346. En: Futuyma, D. & Antonovics, J. (eds.). Surveys in Evolutionary Biology, Oxford University Press, New York. [ Links ]
112. Wahnschaffe, U.; Bartsch, U. & Fritzsch, B. 1987. Metamorphic changes within the lateral-line system of Anura. Anatomy and Embryology 175: 431-442. [ Links ]
113. Wake, M.H. 2012. Morphology and herpetology: how and why they interact. Journal of Herpetology 3: 279-296. [ Links ]
114. Wassersug, R.J. & Sperry, D.G. 1977. The relationships of locomotion to differential predation on Pseudacris triseriata. Ecology 58: 830-839. [ Links ]
115. Werner, E.E. 1986. Amphibian metamorphosis: growth rate, predation risk, and the optimal size at transformation. The American Naturalist 128: 319-341. [ Links ]
116. Wilbur, H.M. & Collins, J.P. 1973. Ecological aspects of amphibian metamorphosis. Science 182: 1305-1314. [ Links ]
117. Will, U. & Fritzsch, B. 1988. The eighth nerve of amphibians: peripheral and central distribution: 159-183. En: The evolution of the amphibian auditory system, Fritzsch, B.; Ryan, M.J.; Wilczynski, W.; Hetherington, T.E. & Walkowiak, W. (eds.), Wiley, New York. [ Links ]
118. Will, U.; Lukede G. & Görner, P. 1985. The area octavo-lateralis in Xenopus laevis. Cell Tissue Research 239: 147-161. [ Links ]
119. Wright, M.R. 1951. The lateral line system of sense organs. Quarterly Review of Biology 26: 264-280. [ Links ]
120. Zumbado-Ulate, H.; Bolaños, F.; Willink, B. & Soley-Guardia, F. 2011. Population status and natural history notes on the critically endangered stream dwelling frog Craugastor ranoides (Craugastoridae) in a Costa Rican tropical dry forest. Herpetological Conservation and Biology 6: 455-464. [ Links ]














