Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Cuadernos de herpetología
versión On-line ISSN 1852-5768
Cuad. herpetol. vol.29 no.2 San Salvador de Jujuy set. 2015
TRABAJO
Anfibios de las Sierras Pampeanas Centrales de Argentina: diversidad y distribución altitudinal
Julián N. Lescano1; Javier Nori1,2; Ernesto Verga3; Facundo Robino2; Andrea Bonino2; Daniela Miloch2; Natalia Ríos2; Gerardo C. Leynaud1,2
1 Instituto de Diversidad y Ecología Animal (CONICET-Universidad Nacional de Córdoba). Rondeau 798, Córdoba (5000), Argentina.
2 Centro de Zoología Aplicada (FCEFyN; Universidad Nacional de Córdoba), Córdoba, Argentina. Rondeau 798, Córdoba (5000), Argentina.
3 Instituto Multidisciplinario de Biología Vegetal (CONICET- Universidad Nacional de Córdoba), Av. Velez Sarfield 1611, Córdoba (5000), Argentina.
Recibido: 06/08/14
Revisado: 08/09/14
Aceptado: 22/12/14
RESUMEN
Las Sierras Pampeanas Centrales (SPC) ocupan parte del territorio de las provincias de Córdoba y San Luis (Argentina) y constituyen un área de singular importancia biogeográfica. En este trabajo se presenta una síntesis sobre el conocimiento de la diversidad y distribución altitudinal de la fauna de anuros de las Sierras de Córdoba y San Luis. El listado de especies de anfibios de las SPC se compiló utilizando diversas fuentes de información (datos de campo, colecciones biológicas y registros bibliográficos). Utilizando esta información se caracterizó el rango de distribución altitudinal de cada especie y se analizaron las asociaciones entre la riqueza y composición de anfibios y el gradiente de altura de las SPC. Se registró un total de 24 especies de anfibios pertenecientes a cinco familias. Dicha fauna se distribuye de forma heterogénea en el gradiente de altura de las SPC observándose una disminución lineal de la riqueza en función de la altura y ensambles asociados a sectores altitudinales definidos. Los resultados obtenidos representan información básica y necesaria para evaluar el impacto de diversas actividades humanas en este particular y frágil sistema de montaña.
Palabras clave: Anuros, Ambientes de Montaña, Ecología, Córdoba, San Luis.
ABSTRACT
Amphibians from Sierras Pampeanas Centrales of Argentina: diversity and altitudinal distribution. Sierras Pampeanas Centrales (SPC) mountains are located in Córdoba and San Luis provinces (Argentina) and represent an area of unique biogeographic importance. In this paper we provide a synthesis about the knowledge of diversity and altitudinal distribution of anurans that inhabit SPC mountains. We compiled a species list through different information sources (field data, biological collections and bibliography). Using this information we characterize altitudinal distribution range of each species and analyze associations between species richness and composition and altitude gradient. We recorded 24 amphibians species belonging to five families. These species are heterogeneously distributed over the altitude gradient of SPC. We detect a linear negative relationship between altitude and species richness and defined assemblages associated with different altitude sectors. The results obtained in the paper represent basic information that will be useful to evaluate anthropogenic impact on this particular and fragile mountain system.
Key words: Anurans, Mountain systems, Ecology, Córdoba, San Luis.
INTRODUCCION
El conocimiento sobre la distribución temporal y espacial de la biota es un objetivo que resulta común tanto a la ecología como a la biogeografía (Gaston, 2000). Históricamente, diversos autores dedicados a estas disciplinas han destacado la particular importancia de los gradientes de altura para detectar y comprender los factores que limitan la distribución de las especies y condicionan los patrones de distribución espacial de la diversidad (Grinnell, 1924; Whittaker, 1960; Lomolino, 2001; Sundqvist et al., 2013). Sumado a esto, debido a la heterogeneidad climática que presentan los sistemas montañosos en escasos kilómetros lineales, los gradientes altitudinales ofrecen la posibilidad de abordar diversos aspectos relacionados con los efectos del cambio climático global (Haslet, 1997; Lenoir et al., 2008; Benito et al., 2011; Engler et al., 2011).
En Argentina, las Sierras Pampeanas representan uno de los sistemas montañosos extra-andinos más importantes respecto a su extensión y grado de aislamiento. Dentro de esta gran formación, las Sierras Pampeanas Centrales (también conocidas como Sierras Pampeanas de Córdoba y San Luis o Sierras Pampeanas Orientales) se destacan por presentar numerosas plantas (Cabido et al., 1998), hongos (Robledo et al., 2003, 2006, Robledo y Renison 2010) y animales endémicos (Cei, 1972, 1980; Di Tada et al., 1984; Nores, 1985; Polop,1989; Nores, 1995; Valleti et al., 2009).
La fauna de anfibios de las Sierras Pampeanas Centrales (SPC en adelante) ha sido tratada por diversos autores en trabajos taxonómicos (ej.: Cei, 1972; Di Tada et al., 1984; Martino y Sinsch, 2002; Céspedez, 2008; Valetti et al., 2009), biogeográficos (ej.: Bridarolli y Di Tada, 1994; Valetti et al., 2013) y de ecología e historia natural (ej.: Di Tada et al., 1996; Sinsch et al., 2001; Gavier et al., 2003; Jofré et al., 2005; Jofré et al., 2007; Pereyra et al., 2011; Verga et al., 2012; Baraquet et al., 2013; Lescano et al., 2013). El primer listado de anfibios de las SPC fue publicado por Martori y Aun (1994). En este trabajo los autores mencionan a 19 especies para las Sierras de la provincia de Córdoba. Posteriormente Avila et al. (1999) presentaron un listado de la herpetofauna de los pastizales de altura de las Sierras de Comechingones donde mencionan la presencia de cinco especies de anfibios. Si bien estos dos últimos trabajos representan valiosos aportes al conocimiento de la fauna de anfibios que habita las SPC, los antecedentes que involucran a los anuros de dicho sistema montañoso se han incrementado de forma significativa durante los últimos años (ej.: Sinsch et al., 2001; Martino y Sinsch, 2002; Gavier et al., 2003; Jofré et al., 2005; Rosset et al., 2006; Jofré et al., 2007; Céspedez, 2008; Ferraro y Casagranda, 2009; Kolenc et al., 2009; Valetti et al., 2009; Verga et al 2012; Baraquet et al., 2013; Lescano et al., 2013; Valetti et al., 2013).
En el presente trabajo se pone a disposición una síntesis sobre el conocimiento de la diversidad y distribución de la fauna de anuros de las Sierras de Córdoba y San Luis. Los objetivos particulares del trabajo son los siguientes: a) presentar un listado actualizado de las especies de anfibios que habitan las SPC de Argentina; b) caracterizar la distribución altitudinal de cada una de las especies presentes; c) analizar la variación en la riqueza de anfibios en función del gradiente de altura de las SPC y d) detectar asociaciones entre la composición de los ensambles de anfibios y dicho gradiente.
MATERIALES AND METODOS
Área de estudio
Las Sierras Pampeanas constituyen una unidad morfotectónica que aflora desde los 25° 30' hasta los 33° de latitud sur, en el centro y noroeste de Argentina. Tienen una extensión de aproximadamente 900 km en sentido N-S y unos 400 km en sentido E-O. Este extenso afloramiento de basamento preandino debe su elevación actual al funcionamiento de grandes fallas inversas que se activaron durante el Terciario (Baldo et al., 1999; Rapela et al., 2001). Las SPC (i.e. la porción centro-oriental de las Sierras Pampeanas) comprenden a la Sierra de San Luis, las Sierras de Córdoba (Sierra Grande-Comechingones, Sierra Chica, Sierra de Pocho-Guasapampa) y la Sierra Norte. Tienen una extensión aproximada de 400 km en sentido N-S y más de 100 km en sentido E-O en su sección más extensa (Rapela et al., 2001) (Fig. 1).
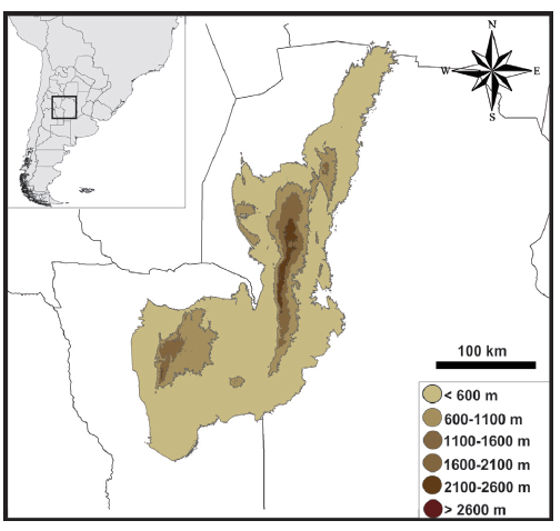
Figura 1. Ubicación geográfica de las Sierras Pampeanas Centrales en las provincias de Córdoba y San Luis, Argentina.
El piedemonte de las SPC comienza a los 600 m s.n.m. aproximadamente y éstas alcanzan su altura máxima en el Cerro Champaqui a 2780 m s.n.m. A lo largo de este gradiente altitudinal de casi 2200 metros existen cambios tanto en la composición como en la estructura florística, pudiendo diferenciarse tres pisos altitudinales. Entre los 600 y los 1350 m s.n.m. se desarrolla el Bosque Serrano, el cual se corresponde con una sub-unidad fitogeográfica del Chaco dominada por bosques de Lithraea molleoides y Schinopsis haenkeana (Luti et al., 1979; Prado, 1993). Entre los 1350 y los 1700 m s.n.m se encuentra un arbustal tradicionalmente denominado como Romerillar (o matorral serrano). Según Luti et al. (1979) dicha unidad fitogeográfica está definida por la dominancia del arbusto Heterothalamus alienus, sin embargo un estudio reciente sugiere que dicho piso altitudinal no presenta una identidad florística propia (Giorgis, 2011). A partir de los 1700 m s.n.m se encuentran los Pastizales y Bosquecillos de Altura (Luti et al., 1979; Bridarolli y Di Tada, 1996). El paisaje en esta franja de altura se compone de valles y barrancos con diferentes grados de disección y pendiente, afloramientos rocosos y acantilados escarpados. Según la condición topográfica y el disturbio pasado y presente, la vegetación en este piso altitudinal consiste en un mosaico de bosques de Polylepis australis, céspedes de vegetación baja con dominancia de Lachemilla pinnata, y pastizales y pajonales dominados por Poa stuckertii, Deyeuxia hieronymi y Festuca tucumanica (Cingolani et al., 2004, 2008, 2014).
El clima de las SPC es heterogéneo y dependiente de la altura. En localidades ubicadas en sectores bajos del bosque serrano las precipitaciones anuales promedio oscilan alrededor de los 670 mm y la temperatura media anual es de 18.9 °C mientras que en los pastizales de altura ubicados entre los 1900 y los 2200 m s.n.m. la temperatura media anual es de 9.6 °C y no hay meses libres de heladas. La precipitación media anual en estos sectores es de 870 mm concentrada entre los meses de octubre y abril. Las nevadas son frecuentes entre el otoño y la primavera temprana (datos obtenidos en estaciones meteorológicas del INA, CIRSA Villa Carlos Paz).
Listado de anfibios y caracterización de su distribución altitudinal
El listado de especies se compiló utilizando diversas fuentes de información. En primer lugar se utilizaron datos de campo registrados en 98 sitios de muestreo pertenecientes a localidades serranas ubicadas en la provincia de Córdoba entre los 600 y los 2350 m s.n.m. Dichos datos fueron tomados por los autores del trabajo durante los últimos siete años mediante una combinación de dos técnicas estandarizadas para el muestreo de anfibios: relevamientos por encuentros visuales y muestreos auditivos en sitios de reproducción (Crump y Scott, 1994; Scott y Woodward, 1994; Dorcas et al., 2010). Cada uno de los sitios muestreados fue relevado por dos personas en al menos dos oportunidades durante la estación de lluvias (noviembre a marzo). Sumado a estos datos, se utilizaron los registros de la base de datos de la ex colección de anfibios de la Cátedra de Ecología de la Universidad Nacional de Río Cuarto (actualmente depositada en la colección de Herpetología de la Fundación Miguel Lillo) (FML), la base de datos de la colección de anfibios del Centro de Zoología Aplicada (CZAa) (Universidad Nacional de Córdoba) y registros puntuales de la Colección del Laboratorio de Genética Evolutiva del Instituto de Biología Subtropical (CONICET-UNaM) (LGE). Los registros personales y de las bases de datos de las colecciones citadas se complementaron con registros bibliográficos publicados (Cei, 1972; Di Tada et al., 1976, 1984; Giambelluca, 1991; Martori y Aun, 1995; Di Tada et al., 1996; Avila et al., 1999; Di Tada, 1999; Sinsch et al., 2001; Martino y Sinsch, 2002; Jofré et al., 2005; Rosset et al., 2006; Jofré et al., 2007; Céspedez, 2008; Ferraro y Casagranda, 2009; Kolenc et al., 2009; Valetti et al., 2009; Verga et al., 2012; Baraquet et al., 2013; Lescano et al., 2013; Valetti et al., 2013).
A partir de estas fuentes de información se georeferenciaron las localidades citadas para cada especie y se caracterizó el rango de distribución altitudinal de cada una de ellas. Se consideraron como localidades pertenecientes a las SPC aquellas ubicadas por encima de los 600 m s.n.m. en los sistemas serranos de Sierras Chicas, Sierra del Norte, Sierra Grande-Comechingones, Sierra de Pocho- Guasapampa y Sierra de San Luis.
Análisis de datos
Para analizar las variaciones en la riqueza y composición de especies en función de la altura se dividió el gradiente (2200 metros de desnivel) en clases de altura de 100 metros (con excepción de la clase de altura superior que va de los 2700 a los 2780 m s.n.m.). Si bien el número de clases de altura que se obtienen al dividir el gradiente de esta manera es de 22, no hay registros de especies para localidades ubicadas entre los 2400 y los 2600 m s.n.m. Por esta razón el total de clases de altura utilizadas para los análisis fue de 20.
Utilizando las distintas fuentes de información (datos personales, bibliográficos y de colecciones) se compiló un inventario de especies presentes para cada una de las distintas clases de altura. Posteriormente se analizaron los cambios en la riqueza en función de la altura mediante un análisis de correlación de Pearson (con un nivel de significancia de p< 0.05). Para detectar asociaciones entre las especies y las distintas clases de altura se utilizó un análisis no paramétrico de ordenamiento multivariado (non-metric multidimensional scaling analisys, NMDS) (Kruskal, 1964; Faith et al., 1987). Este método produce una ordenación de las muestras en un espacio de pocas dimensiones a partir de la separación de las muestras en el espacio multidimensional generado por la ocurrencia de las especies en las clases de altura utilizadas (Urban et al., 2002). El método NMDS no posee supuestos sobre la naturaleza de la respuesta de las especies a gradientes subyacentes y el algoritmo ha demostrado ser robusto ante la falta de linealidad en los datos (Minchin, 1987; Quinn y Keough, 2002). Finalmente se calculó el recambio de especies en el gradiente de altura mediante la obtención del índice de complementariedad (Colwell y Coddington, 1994) entre las clases de altura adyacentes.
El número de registros (datos individuales) en el sistema de estudio disminuye en función de la altura (Correlación de Pearson; r=-0.8; p<0.001). Este patrón responde al hecho de que la superficie disponible para muestrear también disminuye a lo largo de las clases de altura definidas para el trabajo (Correlación de Pearson; r=-0.84; p<0.0001). Al corregir el número de registros individuales en relación a la superficie ocupada por cada clase de altura se aprecia que no existe una correlación significativa entre el número de registros por unidad de superficie y la altura (Correlación de Pearson; r=0.43; p=0.056). Esto último deja en evidencia que el set de datos no se encontró afectado por posibles diferencias en la accesibilidad a las distintas clases de altura. Sumado a esto, para dejar constancia de la representatividad de los datos y los inventarios obtenidos en cada una de las clases de altura, se calcularon los valores del estimador de riqueza de especies Chao2 (Magurran, 2004; Walther y Moore, 2005) con el programa EstimateS. Dicho estimador se calculó para cada clase de altura con excepción de las dos clases superiores (2600-2700 y 2700-2780) en las cuales solo se cuenta con datos de una única localidad (Cerro Los Linderos y Cerro Champaquí respectivamente). La escasez de localidades en estas alturas responde al hecho de que los sectores con alturas superiores a los 2600 m s.n.m. son muy escasos y sólo coinciden con los cerros puntuales mencionados más arriba.
RESULTADOS
Se registró un total de 24 especies de anfibios pertenecientes a cinco familias. De estas especies, 16 tienen distribución amplia a nivel nacional, cuatro pueden considerarse endémicas del sistema de las SPC y cuatro como microendémicas (endémicas de los sectores superiores del gradiente de altura). En la tabla 1 y en la figura 2 se presentan las especies registradas en las SPC junto con su distribución y estado de conservación.
Tabla 1. Listado de familias y especies de anfibios presentes en las Sierras Pampeanas Centrales y su distribución regional.

1 Distribución regional. Amplia: especies cuya distribución supera los relieves serranos de las provincias de Córdoba y San Luis. Endémica: especies cuya ocurrencia está limitada a los relieves serranos de Córdoba y San Luis. Micro-endémicas: especies cuya distribución está restringida a las cumbres y porciones superiores del gradiente de altura de las Sierras de Córdoba y San Luis. * Se consideraron como ejemplares correspondientes al taxón M. estebani a aquellos pertenecientes a las localidades mencionadas en Céspedez (2008) así como a los ejemplares asignables a la especie de acuerdo a la descripción original (Céspedez op. cit.), sin embargo es necesario considerar los aspectos mencionados en la discusión del trabajo respecto a la distribución y el status taxonómico de dicha especie. ** De acuerdo con el relevamiento de Valetti et al. (2013) las poblaciones del complejo P. kriegi-cordobae ubicadas al sur de los 31°50’ latitud sur se corresponden con P. cordobae. Por lo tanto en el presente trabajo se consideraron como P. kriegi a aquellas poblaciones de este complejo de poliploides ubicadas al norte de dicha latitud. Se resalta la necesidad de contar con un mapeo cariotípico completo latitudinal y altitudinal de dicho complejo. Ϯ Se considera a Odontophrynus cordobae como especie endémica ya que la mayor parte de las localidades conocidas para la especie coinciden con ambientes serranos, aunque existen algunas localidades extra-serranas mencionadas (ver Rosset et al., 2006).
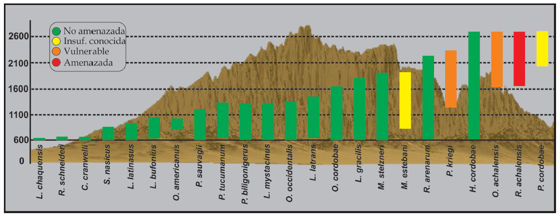
Figura 2. Imagen esquemática de un sector de las Sierras Pampeanas Centrales en el cual se muestra el rango altitudinal ocupado por las distintas especies de anfibios que las habitan. Los colores de las barras representan el estado de conservación de las especies de acuerdo con Vaira et al. (2012). No se incluye en la figura a Hypsiboas pulchellus dado que solo hay un registro para una única localidad (El Volcán, San Luis).
El 50 % de las especies presentes en las SPC sólo ocupa la porción inferior del gradiente (no superan los 1500 m s.n.m) (Fig. 2), seis especies presentan una distribución altitudinal amplia ocupando tanto los sectores inferiores como los pisos superiores de las sierras. Las especies con mayor amplitud altitudinal son Hypsiboas cordobae y Rhinella arenarum (Fig. 2). Cuatro especies se encuentran restringidas a los sectores más altos de las sierras y por lo tanto se consideran microendemismos (Rhinella achalensis; Pleurodema kriegi; P. cordobae y Odontophrynus achalensis). Estas especies se distribuyen a partir de los 1600 m s.n.m, con excepción de Pleurodema kriegi que si bien está principalmente distribuida en sectores altos, su límite inferior de distribución altitudinal se encuentra en localidades ubicadas por debajo de los 1300 m s.n.m (ej.: 1292 m s.n.m en Charcato y 1226 m s.n.m en la localidad de Cerro Blanco, ambas en el departamento Punilla). En el Apéndice 1 se presentan los valores de los límites inferior y superior de distribución altitudinal de las especies que habitan las SPC.
La riqueza de especies disminuyó linealmente en función de la altura tal como puede observarse en la figura 3 y se encontró una fuerte correlación negativa entre estas dos variables (R= -0.95; p<0.0001). La riqueza resultó máxima entre los 600 y los 700 m s.n.m (17 especies) y alcanzó valores mínimos por encima de los 2300 m s.n.m (cuatro especies). En la tabla 2 se presentan los valores de completitud de los inventarios de especies para cada clase de altura.

Figura 3. Variaciones en la riqueza de especies de anfibios a lo largo del gradiente de altura de las Sierras Pampeanas Centrales.
Tabla 2. Riqueza observada (S obs), riqueza estimada (S est) y completitud del inventario en cada una de las clases de altura de las Sierras Pampeanas Centrales.

El análisis NMDS muestra la existencia de asociaciones entre las distintas clases de altura y las especies de anfibios que habitan las SPC (Fig. 4). En dicho análisis se destaca un grupo de especies ínti mamente asociado a las clases de altura superiores a los 1600 m s.n.m. El mayor valor de complementariedad (recambio de especies) registrado entre clases de altura adyacentes se da entre la clase correspondiente a los 1500-1600 m s.n.m y la clase superior inmediata (1600-1700 m s.n.m) (ver tabla 3).
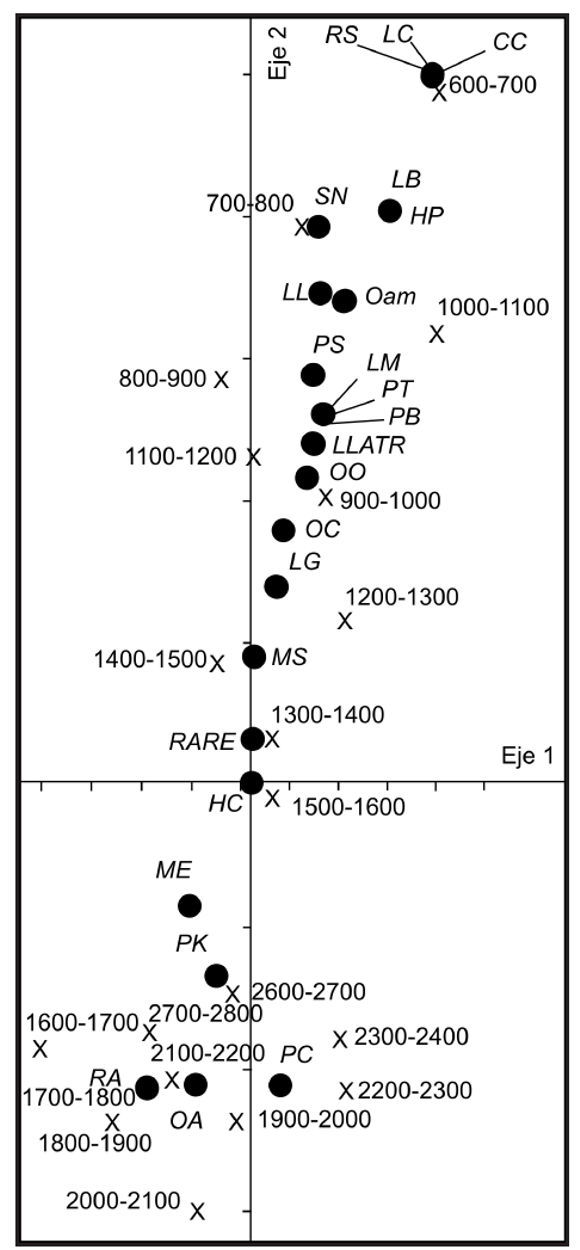
Figura 4. Gráfico bi-plot resultante del análisis multivariado NMDS donde se aprecian las asociaciones entre la ocurrencia de las especies y las clases de altura en las que se dividió a las sierras pampeanas de Córdoba y San Luis. Abreviaturas: PC: Pleurodema cordobae; OA: Odontophrynus achalensis; Oam: Odontophrynus americanus; RA: Rhinella achalensis; PK: Pleurodema kriegi; ME: Melanophryniscus estebani; HC: Hypsiboas cordobae; HP: Hypsiboas pulchellus; MS: Melanophryniscus stelzneri; LG: Leptodactylus gracilis; OC: Odontophrynus cordobae; OO: Odontophrynus occidentalis; PB: Physalaemus biligonigerus; PT: Pleurodema tucumanum; LLATR: Leptodactylus latrans; LM: Leptodactylus mystacinus; PS: Phyllomedusa sauvagii; LL: Leptodactylus latinasus; SN: Scinax nasicus; LB: Leptodactylus bufonius; LC: Leptodactlyus chaquensis; RS: Rhinella schneideri; CC: Ceratophrys cranwelli. Las × representan la posición de las clases de altura y los círculos la posición de las especies en el espacio multivariado.
Tabla 3. Valores del índice de complementariedad de Colwell y Coddington, (1994) entre clases de altura adyacentes. En negrita se resalta el mayor valor de complementariedad obtenido.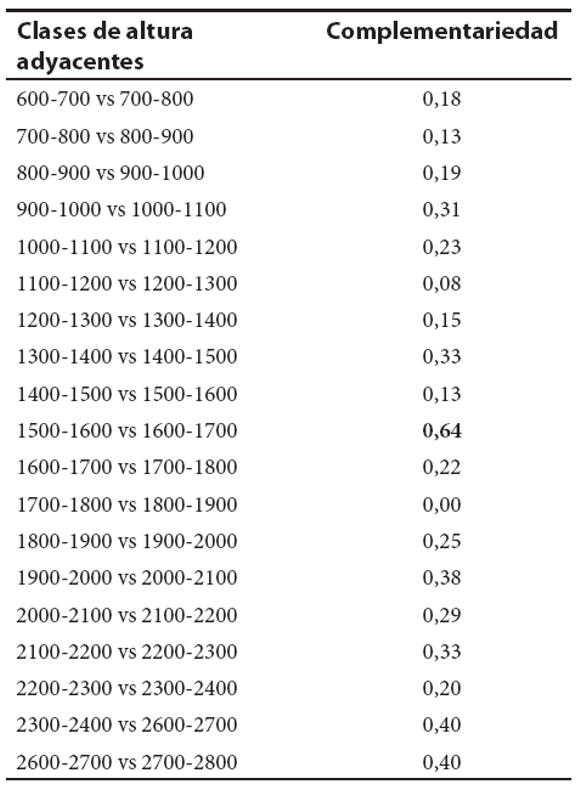
DISCUSION
Los resultados obtenidos indican que las Sierras Pampeanas Centrales presentan una fauna de anfibios diversa y distribuida de forma heterogénea a lo largo del gradiente de altura. Las 24 especies presentes en la región representan más del 70% del total de especies citadas para la provincia de Córdoba y superan en número al total de especies citadas para la provincia de San Luis (Vaira et al., 2012).
Martori y Aun, (1995) en su listado de la herpetofauna de las sierras de Córdoba mencionan 19 especies de anfibios. Las diferencias respecto al número y composición de especies con el presente listado se deben a dos aspectos distintos. En primer lugar, el trabajo de Martori y Aun, (1995) no incluye a las especies que fueron descriptas en la década pasada (Martino y Sinsch, 2002; Céspedez, 2008; Valetti et al., 2009). En segundo lugar, el inventario de Martori y Aun, (op. cit.) incluye registros de especies en localidades extra-serranas (por ejemplo: Río Cuarto; La Posta, La Carlota entre otras), y que por lo tanto no formarían parte de la fauna de anfibios de las SPC (por ejemplo: Rhinella fernandezae).
De acuerdo con el análisis de ordenamiento realizado resultan evidentes grandes sectores altitudinales definidos por la distribución de la fauna de anfibios (Fig. 4). Las clases de altura más bajas (600 a 1200 m s.n.m) presentan una composición de especies particular ya que en ella co-existen algunas especies endémicas de las SPC (Melanophryniscus stelzneri; Hypsiboas cordobae; Odontophrynus cordobae) junto con especies de distribución amplia en el país (Rhinella arenarum; Leptodactylus mystacinus; L. gracilis; L. latrans; Physalaemus biligonigerus entre otras) y especies de distribución Chaqueña (Leptodactylus chaquensis; Phyllomedusa sauvagii; Rhinella schneideri; Leptodactylus bufonius) (ver figuras 2 y 4). Las especies chaqueñas alcanzan sus límites superiores de distribución altitudinal entre los 700 y los 1200 m s.n.m. determinando que los cambios en la composición entre estas clases de altura adyacentes se den por la pérdida de especies (recambio por ausencia). Las clases de altura intermedias están asociadas con especies de distribución altitudinal amplia, en ausencia casi total de formas netamente chaqueñas o de especies micro-endémicas de la porción superior del gradiente (i.e. no presentan una identidad definida por especies exclusivas de estas alturas). Las clases de altura superiores a los 1600 m s.n.m. presentan una fuerte asociación con las especies microendémicas (Figs. 2 y 4). El marcado cambio en la composición de especies observado a partir de estas clases de altura está asociado con la desaparición casi completa de especies de distribución amplia y por otro lado con la aparición de los microendemismos de altura (recambio por ausencia y por sustitución de especies), lo cual se vio reflejado en los valores del índice de complementariedad (Tabla 3).
Este patrón de zonación y los cambios en la composición de especies de anfibios observados en el presente trabajo son congruentes con los resultados obtenidos en otros ambientes de montaña donde también quedan definidas una zona de piedemonte dominada por especies de ambientes cálidos, seguida de una zona transicional y una última zona de altura definida por un grupo de especies asociadas a las cumbres (Zancolli et al., 2014). Por otro lado, resulta interesante remarcar que la regionalización altitudinal de las SPC en función de la fauna de anfibios coincide en buena medida con el esquema fitogeográfico propuesto por Luti et al. (1979), ya que los sectores más bajos están definidos por su afinidad con ambientes Chaqueños, y se rescata una zona de altura definida por especies exclusivas de los pastizales que se encuentran por arriba de los 1600 a 1700 m s.n.m. Sin embargo los sectores intermedios del gradiente (i.e. los sectores ocupados por el Romerillar en el esquema fitogeográfico mencionado) no presentan una identidad propia definida por especies de anfibios exclusivas (Fig. 2), lo cual es coincidente con propuestas fitogeográficas regionales más recientes (Giorgis, 2011).
El recambio de especies a lo largo del gradiente altitudinal de las SPC favorece a la diversidad regional del sistema. Sin embargo, dicho gradiente también condiciona fuertemente a la diversidad alfa (la riqueza de cada clase de altura) y determina una disminución gradual del número de especies a medida que se aumenta en altura (Fig. 3). Los sectores serranos con mayor diversidad son aquellos ubicados por debajo de los 1000 m s.n.m. (donde ocurre la mixtura entre especies serranas, chaqueñas y de distribución amplia). Si bien ciertos autores han encontrado un patrón similar de disminución lineal de la riqueza de anfibios en función de la altura (Fauth et al., 1989; Zancolli et al., 2014) otras comunidades de anfibios muestran una respuesta unimodal donde la riqueza de especies alcanza valores máximos en alturas intermedias (Fu et al., 2006). De acuerdo con Fu et al. (2006) los patrones de riqueza específica de anfibios en gradientes de altura responden a una mixtura de factores climáticos y efectos de área. Los resultados y los análisis realizados para el presente trabajo no permiten especular sobre las razones de la forma de la respuesta de la riqueza de anfibios en las SPC, sin embargo estos aspectos resultan de gran interés para estudios posteriores.
Tal como puede observarse en las figuras 2 y 4, las especies micro-endémicas de las SPC están restringidas a las porciones superiores del gradiente. Sin embargo, es necesario destacar que algunas de estas especies encuentran su límite inferior de distribución altitudinal en sectores relativamente bajos. La especie micro-endémica con el limite altitudinal inferior más bajo es Pleurodema kriegi. Los hallazgos de esta especie en localidades ubicadas entre los 1200 y los 1300 m s.n.m. contrastan con las menciones de diversos autores que consideran a P. kriegi como especie endémica o íntimamente asociada a la Pampa de Achala (Barrio, 1977; Bridarolli y Di Tada, 1994; Di Tada, 1999; Ferraro y Casagranda, 2009; Valetti et al., 2009). La distribución registrada en el presente trabajo sugiere (en coincidencia con Kolenc et al., 2009) que el límite altitudinal inferior de P. kriegi supera ampliamente los límites de la Pampa de Achala (una altiplanicie de altura ubicada entre los 1800 y los 2200 m s.n.m. dentro de las SPC).
Respecto a las especies endémicas que ocupan la porción inferior del gradiente es interesante remarcar que, a diferencia de lo sugerido por Céspedez (2008), las dos especies del género Melanophryniscus que habitan las SPC presentan una distribución altitudinal similar. Céspedez (2008) menciona que M. estebani estaría restringida a sectores serranos superiores a los 1700 m s.n.m., y que M. stelzneri ocuparía los sectores inferiores. Los resultados obtenidos en el presente trabajo indican que M. estebani y M. stelzneri son especies simpátricas en su distribución altitudinal. Respecto a estas especies resulta importante aclarar que ambas son sintópicas y es frecuente encontrar ejemplares difícilmente asignables a una u otra especie en función de los caracteres distintivos mencionados por Céspedez (2008) (JNL obs. pers.). Considerando estas observaciones resultaría interesante realizar un análisis exhaustivo del status taxonómico y de la distribución de este complejo de especies.
De acuerdo con Vaira et al. (2012) cuatro de las especies que habitan las SPC se encuentran bajo alguna categoría de amenaza. Es interesante destacar que todas las especies vulnerables o amenazadas son micro-endemismos asociados a los Pastizales y Bosquecillos de altura remarcando la importancia de estas formaciones vegetales para la conservación de los anfibios del las SPC. En general las especies asociadas a estas porciones superiores del gradiente presentan poblaciones abundantes y de frecuente hallazgo, con excepción de la especie amenazada Rhinella achalensis la cual es rara y poco abundante (Lescano, 2012; Verga et al., 2012; Lescano et al., 2013). Esto último contrasta fuertemente con menciones y trabajos anteriores sobre R. achalensis (Sinsch et al., 2001; Giambelluca, 1991; Di Tada et al., 1996; Avila et al., 1999; Jofré, 2004) y sugiere que quizá algunas poblaciones de dicha especie sufrieron declinaciones poblacionales en años recientes.
Lavilla (2001) menciona como amenaza (real o potencial) para los anfibios endémicos de este sistema a la ganadería. Verga et al. (2012) analizaron el impacto de este factor sobre los ensambles de anfibios de los pastizales de altura de las SPC al comparar un área excluida de ganado durante 14 años con un área con ganadería extensiva. Los resultados obtenidos sugieren que la ganadería extensiva no tiene un impacto negativo sobre estos ensambles, sin embargo los autores mencionan la necesidad de evaluar el impacto de un manejo ganadero más intensivo. Por otro lado, los anfibios endémicos del área también enfrentan otras amenazas tales como la introducción de peces depredadores (Onchorhynchus mykyss y Salvelinus fontinalis) (obs. pers.) y la quitridiomicosis (Ghirardi et al., 2009; Lescano et al., 2013; Gutierrez et al., 2012). Considerando estos factores de amenaza y teniendo en cuenta la relevancia del cambio climático para las especies que habitan sistemas de montaña, consideramos que el presente trabajo aporta información de base que podrá resultar útil para monitorear y evaluar eventuales cambios en la distribución, composición y riqueza de los ensambles de anfibios de las Sierras Pampeanas.
Agradecimientos
A Silvana Longo y Emiliano Galli por su significativa colaboración en las actividades de campo. Al Dr. Ricardo Martori por facilitar la base de datos de la ex colección de anfibios de la Cátedra de Ecología (UNRC) (actualmente depositada en la Fundación Miguel Lillo). A Diego Baldo por brindarnos información sobre la colección del Laboratorio de Genética Evolutiva del Instituto de Biología Subtropical. A las autoridades de la Secretaría de Ambiente de la Provincia de Córdoba y a la Administración de Parques Nacionales por los permisos correspondientes para las actividades de campo. JN y EV agradecen al Doctorado en Ciencias Biológicas de la Universidad Nacional de Córdoba. El presente trabajo contó con el apoyo de Rufford Small Grants Foundation. JNL, JN & GCL agradecen el apoyo económico de MINCyT (PID 2010, proyecto #000113/2011) y FONCYT (PICT-2013-1607).
Apendice 1. Tabla a. Límite inferior de distribución altitudinal de los anfibios de las Sierras Pampeanas Centrales.
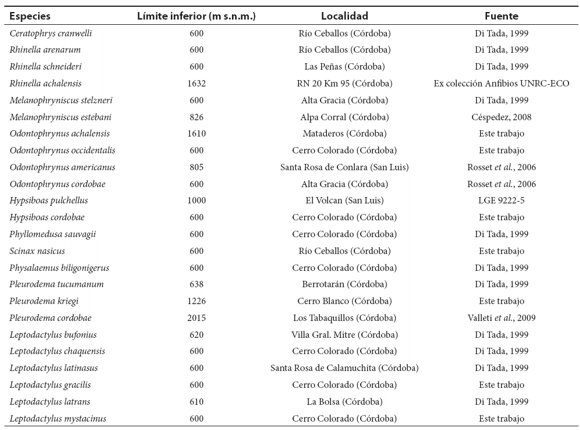
Apendice 1. Tabla b. Límite superior de distribución altitudinal de los anfibios de las Sierras Pampeanas Centrales.

.gif)
LITERATURA CITADA
1. Avila, L.J.; Morando, M. & Priotto, J.W. 1999. Amphibia and Reptilia of the high grasslands of the Sierra de Comenchingones, Córdoba, Argentina. Bulletin of the Maryland Herpetological Society 35: 97-113. [ Links ]
2. Baldo, E.G.; Saavedra, J.; Rapela, C.W.; Pankhurst, R.J.; Casquet, C. & Galindo, C. 1999. Síntesis geocronológica de la evolución paleozoica inferior del borde sur occidental de Gondwana en las Sierras Pampeanas, Argentina. Acta Geológica Hispánica 32: 17-28. [ Links ]
3. Baraquet, M.; Salas, N.E. & Martino, A.L. 2013. Advertisement Calls and Interspecific Variation in Hypsiboas cordobae and Hypsiboas pulchellus (Anura , Hylidae) from Central Argentina. Acta Zoologica Bulgarica 65: 479-486. [ Links ]
4. Barrio, A. 1977. Aportes para la elucidación del “status” taxonómico de Pleurodema bibroni Tschudi y Pleurodema kriegi (Müller) (Amphibia, Anura, Leptodactylidae). Physis 37: 311-331.
5. Benito, B.; Lorite, J. & Peñas, J. 2011. Simulating potencial effects of climatic warming on altitudinal patterns of key species in Mediterranean-alpine ecosystems. Climatic Change 108: 471-483. [ Links ]
6. Bridarolli, M.E. & Di Tada, I.E. 1994. Biogeografía de los Anfibios de la región central de Argentina. Cuadernos de Herpetología 8: 63-82. [ Links ]
7. Bridarolli, M.E. & Di Tada, I.E. 1996. Algunos aspectos de la geografía física de la provincia de Córdoba. En: Di Tada I.E. & Bucher E.H. (eds.), Biodiversidad de la provincia de Córdoba. Universidad Nacional de Río Cuarto, Córdoba, Argentina. [ Links ]
8. Cabido, M. & Acosta, A. 1985. Estudio fitosociológico en bosques de Polylepis australis BITT (‘Tabaquillo’) en las Sierras de Córdoba. Argentina. Documents Phytosociologiques 9: 385-400.
9. Cabido, M.; Funes, G.; Pucheta, E.; Vendramini, F. & Díaz, S. 1998. A chorological analysis of the mountains from Central Argentina. Is all what we call Sierra Chaco really Chaco? Contribution to the study of the flora and vegetation of the Chaco. XII. Candollea 53: 321-331. [ Links ]
10. Capitanelli, R.G. 1979. Clima. 45-138. En: Vázquez, J.B.; Miatello, R.A. & Roqué, M.A. (eds.), Geografía Física de la provincia de Córdoba. Buenos Aires, Editorial Bold. [ Links ]
11. Cei, J.M. 1972. Segregación corológica y procesos de especiación por aislamiento en anfibios de la Pampa de Achala, Córdoba. Acta Zoologica Lilloana 29: 233-246. [ Links ]
12. Cei, J.M. 1980. Amphibians of Argentina. Monitore Zoologico Italiano, Monograph 2: 1-609. [ Links ]
13. Céspedez, J.A. 2008. Una nueva especie de Melanophryniscus Gallardo, 1961 de Argentina (Amphibia: Anura: Bufonidae). FACENA 24: 35-48. [ Links ]
14. Cingolani, A.M.; Noy-Meir, I.; Renison, D.D. & Cabido, M. 2008. La ganadería extensiva, ¿es compatible con la conservación de la biodiversidad y de los suelos? Ecología Austral 18: 253-271. [ Links ]
15. Cingolani, A.M.; Renison, D.; Zak, M.R. & Cabido, M.R. 2004. Mapping vegetation in a heterogeneous mountain rangeland using landsat data: an alternative method to define and classify land-cover units. Remote Sensing Environment 92: 84-97. [ Links ]
16. Cingolani, A.M.; Vaieretti, M.V.; Giorgis, M.A.; Poca, M.; Tecco, P.A. & Gurvich, D.E. 2014. Can livestock grazing maintain landscape diversity and stability in an ecosystem that evolved with wild herbivores? Perspect. Plant Ecology Evolution and Systematics doi:10.1016/j.ppees.2014.04.002. [ Links ]
17. Colwell, R.K. & Coddington, J.A. 1994. Estimating terrestrial biodiversity through extrapolation. Philosophical Transactions of the Royal Society of London Series B 345: 101-118. [ Links ]
18. Crump, M.L. & Scott Jr., N.J. 1994. Visual encounter surveys. 84-92. En: Heyer, W.R.; Donnelly, M.A.; McDiarmid, R.W.; Hayek, L.C. & Foster, M.S. (eds.), Measuring and Monitoring Biological Diversity: Standard Methods for Amphibians, Smithsonian Institution Press, Washington. [ Links ]
19. Di Tada, I.E. 1999. Patrones de distribución de los anfibios anuros de la provincia de Córdoba. Tesis Doctoral. Universidad Nacional de Córdoba, Argentina. [ Links ]
20. Di Tada, I.E.; Barla, M.J.; Martori, R.A. & Cei, J.M. 1984. Odontophrynus achalensis una nueva especie de anfibio de la Pampa de Achala (Córdoba, Argentina). Historia Natural 4: 149-155. [ Links ]
21. Di Tada, I.E.; Zavattieri, M.V.; Bridarolli, M.E.; Salas, N.E. & Martino, A.L. 1996. Anfibios anuros de la provincia de Córdoba. 191-241. En: Di Tada, I.E. & Bucher, E.H. (eds.), Biodiversidad de la Provincia de Córdoba. Universidad Nacional de Río Cuarto, Río Cuarto, Argentina. [ Links ]
22. Di Tada, I.E.; Salusso, M. & Martori, R. 1976. Lista de los batracios de Córdoba con notas sobre su historia natural. Boletín de la Academia Nacional de Ciencias de Córdoba 51: 325-362. [ Links ]
23. Di Tada, I.E.; Zavattieri, M.V. & Martino, A.L. 1996. Análisis estructural del canto nupcial de Hyla pulchella cordobae (Amphibia: Hylidae) en la provincia de Córdoba (Argentina). Revista Española de Herpetología 10: 7-11. [ Links ]
24. Dorcas, M.E.; Price, S.J.; Walls, S.C. & Barichivich, W.J. 2010. Auditory monitoring of anuran populations: 281-298. En: Dodd, C.K. (ed.), Amphibian ecology and conservation, a handbook of techniques. Oxford University Press, Oxford. [ Links ]
25. Engler, R.; Randin, C.F.; Thuiller, W.; Dullinger, S.; Zimmermann, N.E.; Araújo, M.B. & Guisan, A. 2011. 21st century climate change threatens mountain flora unequally across Europe. Global Change Biology 17: 2330-2341. [ Links ]
26. Faith, D.P.; Minchin, P.R. & Belbin, L. 1987. Compositional dissimilarity as a robust measure of ecological distance. Vegetatio 69: 57-68. [ Links ]
27. Fauth, J.E.; Crother, B.I. & Slowinski, J.B. 1989. Elevational patterns of species richness, evenness, and abundance of the Costa Rican leaf-litter herpetofauna. Biotropica 21: 178–185.
28. Ferraro, D. & Casagranda, M.D. 2009. Geographic distribution of the genus Pleurodema in Argentina (Anura: Leiuperidae). Zootaxa 55: 33-55. [ Links ]
29. Fu, C.; Hua, X.; Li, J.; Chang, Z.; Pu, Z. & Chen, J. 2006. Elevational patterns of frog species richness and endemic richness in the Hengduan Mountains, China : geometric constraints, area and climate effects. Ecography 6: 919–927.
30. Gaston, K.J. 2000. Global patterns in biodiversity. Nature 405: 220-227. [ Links ]
31. Gavier, G.; Kufner, M.B.; Giraudo, L.; Sironi, M.; Altrichter, M. & Tamburini, D. 2003. Comunidades herpetológicas de la reserva La Quebrada, Río Ceballos, Córdoba (Argentina). Cuadernos de Herpetología 17: 51-64. [ Links ]
32. Ghirardi, R.; Lescano, J.N.; Longo, M.S.; Robledo, G.; Steciow, M. & Perotti, M.G. 2010. Batrachochytrium dendrobatidis in Argentina: first record in Leptodactylus gracilis and another record in Leptodactylus ocellatus. Herpetological Review 40: 175-176. [ Links ]
33. Giambelluca, L.A. 1991. Nueva cita de Bufo achalensis Cei, 1972. Boletín de la Asociación Herpetológica Argentina 7: 21-22. [ Links ]
34. Giorgis, M.A. 2011. Caracterización florística y estructural del Bosque Chaqueño Serrano (Córdoba) en relación a gradientes ambientales y de uso. Tesis Doctoral. Universidad Nacional de Córdoba, Córdoba, Argentina. [ Links ]
35. Grinnell, J. 1924. Geography and evolution. Ecology 5: 225-229. [ Links ]
36. Gutierrez, R.F.; Arellano, M.L.; Moreno, L.E. & Natale, G.S. 2010. Batrachochytrium dendrobatidis in Argentina: first record of infection in Hypsiboas cordobae and Odontophrynu soccidentalis tadpoles, in San Luis province. Herpetological Review 41: 323-324. [ Links ]
37. Haslett, J.R. 1997. Mountain ecology: Organism responses to environmental change, an introduction. Global Ecology and Biogeography 6: 3-6. [ Links ]
38. Jofré, M.G. 2004. Autoecología del Sapo Achaleño Cei, 1972. Tesis Doctoral. Universidad Nacional de Río Cuarto, Córdoba, Argentina. [ Links ]
39. Jofré, G.; Reading, C. & Di Tada, I. 2007. Habitat selection in the Pampa de Achala toad, Bufo achalensis. Amphibia-Reptilia 28: 129-138. [ Links ]
40. Jofré, G.M.; Reading, C.J. & Di Tada, I.E. 2005. Breeding behaviour and reproduction in the Pampa de Achala toad, Bufo achalensis. Amphibia-Reptilia 26: 451-458. [ Links ]
41. Kolenc, F.; Borteiro, C.; Baldo, D.; Ferraro, D.P. & Prigioni, C. 2009. The tadpoles and advertisement calls of Pleurodema bibroni Tschudi and Pleurodema kriegi (Müller), with notes on their geographic distribution and conservation status. Zootaxa 1969: 1-35. [ Links ]
42. Kruskal, J. 1964. Multidimensional scaling by optimizing goodness of fit to nonmetric hypothesis. Psychometrika 29: 1-27. [ Links ]
43. Lavilla, E.O. 2001. Amenazas, declinaciones poblacionales y extinciones en anfibios Argentinos. Cuadernos de Herpetología 15: 59-82. [ Links ]
44. Lenoir, J.; Gégout, J.C.; Marquet, P.A.; de Ruffray, P. & Brisse, H. 2008. A significant upward shift in plant species optimum elevation during the 20th century. Science 320: 1768-1770. [ Links ]
45. Lescano, J.N. 2012. Rhinella achalensis (Cei, 1972). Sapo de Achala. En: Categorización del Estado de Conservación de la Herpetofauna de la República Argentina. Ficha de los Taxones. Anfibios. Cuadernos de Herpetología 26 (S1): 53. [ Links ]
46. Lescano, J.N.; Longo, S. & Robledo, G. 2013. Chytridiomycosis in endemic amphibians of the mountain tops of the Córdoba and San Luis ranges, Argentina. Diseases of Aquatic Organisms 102: 249-54. [ Links ]
47. Lomolino, M.V. 2001 Elevation gradients of species-density : historical and prospective views. Global Ecology and Biogeography 10: 3-13. [ Links ]
48. Luti, R.; Bertrán De Solís, M.A.; Galera, M.F.; Muller de Ferreira, M.; Bersal, M.; Nores, M.; Herrera, M.A. & Barrera, J.C. 1979. Vegetación. 297-368. En: Vasquez, J.B.; Miatello, R.A. & Roqué, M.E. (eds), Geografía física de la provincia de Córdoba. Buenos Aires, Argentina, Editorial Bold. [ Links ]
49. Magurran, A. 2004. Measuring biological diversity. Blackwell Science Ltd., Oxford. [ Links ]
50. Martino, A.L. & Sinsch, U. 2002. Speciation by polyploidy in Odontophrynus americanus. Journal of Zoology 257: 67-81. [ Links ]
51. Martori, R.A. & Aun, L. 1995. Relevamiento de la herpetofauna de las Sierras Pampeanas del este en la provincia de Córdoba (Argentina) (registro de taxa y comentarios taxonómicos). Acta Zoologica Lilloana 43: 88-95. [ Links ]
52. Minchin, P.R. 1987. An evaluation of the relative robustness of techniques for ecological ordination. Vegetatio 69: 89-107. [ Links ]
53. Nores, M. & Yzurieta, D. 1983. Especiación en las Sierras Pampeanas de Córdoba y San Luis (Argentina), con descripción de siete nuevas subespecies de aves. El Hornero Nro. especial: 88-102. [ Links ]
54. Nores, M. 1995. Insular biogeography of birds on mountain- tops in north western Argentina. Journal of Biogeography 22: 61-70. [ Links ]
55. Pereyra, L.; Lescano, J.N. & Leynaud, G. 2011. Breeding-site selection by red-belly toads, Melanophryniscus stelzneri (Anura: Bufonidae), in Sierras of Córdoba, Argentina. Amphibia-Reptilia 32: 105-112. [ Links ]
56. Polop, J.J. 1989. Distribution and ecological observations of wild rodents in Pampa de Achala, Córdoba, Argentina. Studies on Neotropical Fauna and Environment 24: 53-59. [ Links ]
57. Prado, D.E. 1993. What is the Gran Chaco vegetation in South America? I. A review. Contribution to the study of flora and vegetation of the Chaco. V. Candollea 48: 145-172. [ Links ]
58. Rapela, C.W.; Casquet, C.; Baldo, E.G.; Dahlquist, J.; Pankhurst, R.J.; Galindo, C. & Saa. 2001. Las Orogénesis del Paleozoico Inferior en el margen proto-andino de América del Sur, Sierras Pampeanas, Argentina. Journal of Iberian Geology 27: 23-41.
59. Robledo, G.; Urcelay, C.; Domínguez, L. & Rajchenberg, M. 2006. Taxonomy, ecology and biogeography of Polypores (Basidiomycetes) from Argentinian Polylepis woodlands. Canadian Journal of Botany 84: 1561-1572. [ Links ]
60. Robledo, G.; Urcelay, C. & Rajchenberg, M. 2003. New species causing decay on living Polylepis australis in Córdoba, central Argentina. Mycologia 95: 347-353. [ Links ]
61. Robledo. G. & Renison, D. 2010. Wood-decaying polypores in the mountains of Central Argentina in relation to Polylepis forest structure and altitude. Fungal Ecology 3: 178-184.
62. Rosset, S.D.; Baldo, D.; Lanzone, C. & Basso, N.G. 2006. Review of the geographic distribution of diploid and tetraploid populations of the Odontophrynus americanus species complex (Anura : Leptodactylidae). Journal of Herpetology 40: 465-477. [ Links ]
63. Scott, N.J. & Woodward, B.D. 1994. Relevamiento de lugares de reproducción: 80-86. En: Heyer, W.R.; Donnelly, M.A.; McDiarmid, R.W.; Hayek, L.C. & Foster, M.S. (eds.). Medición y monitoreo de la diversidad biológica: Métodos estandarizados para anfibios. Smithsonian Institution Press & Editorial Universitaria de la Patagonia, Washington. [ Links ]
64. Sinsch, U.; Di Tada, I.E. & Martino, A.L. 2001. Longevity, demography and sex-specific growth of the Pampa de Achala toad, Bufo achalensis CEI, 1972. Studies on Neotropical Fauna and Environment 36: 95-104. [ Links ]
65. Sundqvist, M.K.; Sanders, N.J. & Wardle, D.A. 2013. Community and ecosystem responses to elevational gradients: processes, mechanisms, and insights for global change. Annual Review of Ecology, Evolution, and Systematics 44: 261-280. [ Links ]
66. Urban, D.; Goslee, S.; Pierce, K. & Lookingbill, T. 2002. Extending commmunity ecology to landscapes. Ecoscience 9: 200-230. [ Links ]
67. Vaira, M.; Akmentins, M.; Attademo, A.; Baldo, D.; Barrasso, D.; Barrionuevo, S.; Basso, N.; Blotto, B.; Cairo, S.; Cajade, R.; Céspedez, J.; Corbalán, V.; Chilote, P.; Duré, M.; Falcione, C.; Ferraro, D.; Gutierrez, F.; Ingaramo. M.R.; Junges, C.; Lajmanovich, R.; Lescano, J.N.; Marangoni, F.; Martinazzo, L.; Marti, R.; Moreno, L.; Natale, G.S.; Pérez Iglesias, J.; Peltzer, P.; Quiroga, L.; Rosset, S.; Sanabria, E.; Sanchez, L.; Schaefer, E.; Úbeda, C. & Zaracho, V. 2012. Categorización del estado de conservación de los Anfibios de la República Argentina. Cuadernos de Herpetología 26: 131-159.
68. Valetti, J.A.; Otero, M.A.; Grenat, P.R.; Salas, N.E. & Martino, A.L. 2013. Currently known geographical distribution of Pleurodema cordobae Valetti , Salas & Martino 2009 (Anura: Leptodactylidae: Leiuperinae) in Sierra Grande of Córdoba. Herpetology Notes 6: 559-561. [ Links ]
69. Valetti, J.A.; Salas, N.E. & Martino, A.L. 2009. A new polyploid species of Pleurodema (Anura : Leiuperidae) from Sierra de Comechingones, Córdoba, Argentina and redescription of Pleurodema kriegi (Müller, 1926). Zootaxa 2073: 1-21. [ Links ]
70. Verga, E.G.; Leynaud, G.C.; Lescano, J.N. & Bellis, L.M. 2012. Is livestock grazing compatible with amphibian diversity in the High Mountains of Córdoba, Argentina? European Journal of Wildlife Research 58: 823-832. [ Links ]
71. Walther, B.A. & Moore, J.L. 2005. The concepts of bias, precision and accuracy, and their use in testing the performance of species richness estimators, with a literature review of estimator performance. Ecography 28: 815-829. [ Links ]
72. Whittaker, R.H. 1960. Vegetation of the Siskiyou Mountains, Oregon and California. Ecological Monographs 30: 279-338. [ Links ]
73. Zancolli, G.; Steffan-Dewenter, I. & Rödel, M-O. 2014. Amphibian diversity on the roof of Africa: unveiling the effects of habitat degradation, altitude and biogeography. Diversity and Distributions 20: 297-308. [ Links ]














