Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Cuadernos de herpetología
versión On-line ISSN 1852-5768
Cuad. herpetol. vol.31 no.1 San Salvador de Jujuy mayo 2017
TRABAJO
Alometría y heterocronías durante el desarrollo temprano de cinco especies de Hypsiboas (Anura: Hylidae)
Grisel Navarro Acosta1, Florencia Vera Candioti2
1 Centro de Investigaciones y Transferencia de Jujuy (CIT-JUJUY), CONICET-UNJu. Av. Bolivia N° 1711, San Salvador de Jujuy, Jujuy, Argentina.
2 Unidad Ejecutora Lillo (CONICET-FML). Miguel Lillo 251, San Miguel de Tucumán, Tucumán, Argentina.
Recibido: 14/04/16
Revisado: 30/11/16
Aceptado: 22/12/16
ABSTRACT
Interesting structural and temporal variations have been reported in embryonic stages of different anuran groups. However, knowledge of the contribution of allometry and temporal patterns to the morphological change during ontogeny remains limited. We studied the early development of five species of Hypsiboas (Anura: Hylidae), in order to explore heterochronic changes during the sequence of events in the development of some embryonic and larval characters, and interspecific shape-size relationships. Ontogenetic series were analyzed using multivariate methods and sequence heterochrony approach. The results show variations in morphology and in the developmental sequence of the considered characters, in some cases in relation with the oviposition mode of the studied species. The relationship between shape, size, and the events that define developmental stages varies interspecifically and reveals a decoupling between some characters which result in embryos with different morphologies. This paper provides information and new questions towards a better understanding of the evolution of anuran development and variation in patterns and processes across different lineages.
Key words: Geometric morphometrics; Ontogeny; Sequence heterochrony; Shape; Size.
RESUMEN
Interesantes variaciones estructurales y temporales han sido reportadas en estadios embrionarios de diversos grupos de anuros. Sin embargo, el conocimiento de la contribución de patrones alométricos y temporales al cambio morfológico en el transcurso de la ontogenia continua siendo limitado. En este trabajo estudiamos el desarrollo temprano de cinco especies del género Hypsiboas (Anura: Hylidae) con el objeto de indagar en los cambios heterocrónicos durante la secuencia de eventos del desarrollo de ciertos caracteres embrionarios y larvales, y en las relaciones interespecíficas de forma-tamaño. Las series ontogenéticas se analizaron mediante métodos multivariados y la aproximación de heterocronías de secuencia. Los resultados muestran variaciones morfológicas y en la secuencia de desarrollo en los caracteres considerados, en algunos casos en aparente relación con el modo de oviposición de las especies estudiadas. La relación entre forma, tamaño, y eventos que definen estadios de desarrollo es variable interespecíficamente, y revela un desacople entre algunos caracteres que redunda en embriones con morfologías diferentes. Este trabajo genera numerosos nuevos interrogantes, cuya investigación es requisito para comprender la evolución del desarrollo en anuros y los cambios en patrones y procesos a través de diferentes linajes.
Palabras clave: Morfometría geométrica; Ontogenia; Heterocronías de secuencia; Forma; Tamaño.
INTRODUCCIÓN
Diversos estudios comparativos de las últimas décadas están revelando interesantes variaciones estructurales y temporales en los estadios embrionarios de los distintos grupos de anuros (e.g., Richardson et al., 1997; Chipman et al., 1999, 2000; Mitgutsch et al., 2008, 2009). Entre otras aproximaciones, la variación morfológica puede ser interpretada en su relación con el incremento de tamaño durante la ontogenia. Es así que el campo de la alometría (con sus diferentes niveles estático, ontogenético y evo lutivo; Cock, 1966; Gould, 1966) se aboca al estudio del efecto de la variación del tamaño corporal en el desarrollo de caracteres particulares, y con esto en el cambio de forma durante la ontogenia. La relación entre la forma y el tamaño difiere entre especies cercanamente emparentadas, y la importancia de analizar la similitud de los patrones alométricos radica en que éstos reflejan el cambio evolutivo en los patrones de crecimiento (Klingenberg, 2010).
Entre los anfibios, la contribución de la alometría ontogenética al cambio morfológico ha sido estudiada principalmente en urodelos (e.g., Alberch y Alberch, 1981; Hanken, 1984; Ivanovic et al., 2007). Los anuros por su parte son particularmente adecuados para estudios de alometría ya que son accesibles, fáciles de criar y atraviesan un aumento dramático de tamaño en un período de tiempo relativamente corto. Se han publicado investigaciones que refieren a patrones alométricos en estadios larvales y postmetamórficos (e.g., Larson, 2002, 2004, 2005, Di Cerbo y Biancardi, 2010; Garriga y Llorente, 2012; Lima y Pederassi, 2012) pero hasta donde conocemos, el rol de los cambios alométricos en las etapas de desarrollo embrionario no ha sido analizado aún. Complementariamente, los estudios comparativos pueden incluir transformaciones en los tiempos y secuencia en que ocurren los eventos del desarrollo (Smith, 2001, 2002, 2003). Estos cambios heterocrónicos son una fuente bien establecida de cambio evolutivo (Klingenberg, 1998), y en el caso de estructuras larvales y transitorias (i.e., que desaparecen en estadios larvales o durante la metamorfosis, y por lo tanto no tendrían participación en la definición del plan corporal adulto), la variación insospechada y amplia que se reporta conlleva un interés intrínseco por los mecanismos tempranos que la causan y su alto potencial evolutivo.
Nuestro objeto de estudio fueron ranas neotropicales del género Hypsiboas Wagler, 1830 (Hylidae: Cophomantini; Faivovich et al., 2005). El género contiene 93 especies (Frost, 2016) distribuidas en siete grupos. Entre estos, los grupos de H. pulchellus e H. faber son clados hermanos y los más derivados en la filogenia, por lo que comparten algunos caracteres a la vez que difieren en otros interesantes de indagar (revisado en Kolenc et al., 2008). Los estudios sobre ontogenia temprana en estos taxones son escasos y dispersos. Por ello en este trabajo, nos propusimos analizar la variación interespecífica en las series ontogenéticas considerando: 1) la relación entre la forma y el tamaño durante el desarrollo embrionario, a fin de interpretar y comparar patrones de cambio alométrico; y 2) cambios en la secuencia de desarrollo de caracteres embrionarios y larvales. Este trabajo complementa datos ya presentados (Navarro Acosta et al., 2017) concernientes a variaciones morfológicas en las estructuras larvales y embrionarias en estas mismas especies.
MATERIALES Y METODOS
Especímenes y confección de las series ontogenéticas
Trabajamos con embriones de cinco especies de anuros del género Hypsiboas: H. faber (del grupo homónimo), e H. curupi, H. pulchellus, H. riojanus y una especie innominada (del grupo de H. pulchellus) (Faivovich et al., 2005; Frost, 2016). Se colectaron oviposiciones de cada una de estas especies, a partir de ejemplares adultos en amplexo colectados en el campo (Tabla 1). Las puestas se trasladaron al laboratorio y allí se mantuvieron con fotoperíodo y temperatura ambientales en recipientes con agua declorinada. Una porción de los huevos se fijó inmediatamente en formol 4%, y luego a intervalos regulares cada 6-8 horas durante una semana aproximadamente. Con el material fijado se confeccionaron las series ontogenéticas, seleccionando embriones en etapas de desarrollo sucesivas cada vez que se notaba un cambio morfológico relevante. Consideramos principalmente los estadios de Gosner (1960; en adelante St.) entre el 18 y 25, período en que se desarrollan las estructuras embrionarias transitorias y larvales de interés. La series de desarrollo y las variaciones estructurales entre especies están descriptas en detalle en Navarro Acosta et al. (2017).
Tabla 1. Material utilizado: series ontogenéticas de 5 especies de Hypsiboas (St. 18-25). LGE: Laboratorio de Genética Evolutiva, Universidad Nacional de Misiones.

Análisis de las series ontogenéticas
Trayectorias alométricas. La relación entre forma y tamaño durante la ontogenia se estudió mediante regresiones multivariadas sobre un conjunto de embriones en estadios 18-25 (N = 179; Tabla 1). Para representar la forma de los especímenes aplicamos métodos estándar de morfometría geométrica, tomando fotografías en vista lateral y digitalizando un grupo de landmarks (puntos biológica y/o geométricamente homólogos; tpsDig2; Rohlf, 2005). Los landmarks considerados se ilustran en la Figura 1: (1) punto más anterior del cuerpo; (2) punto más anterior de la córnea; (3) punto más posterior de la córnea; (4) máxima altura del cuerpo; (5) origen de la aleta dorsal; (6) máxima curvatura de la aleta dorsal; (7) extremo de la aleta caudal; (8) punto más anterior de la unión tubo proctodeal-aleta ventral; (9) máxima curvatura ventral del cuerpo; (10) punto de máxima curvatura de la glándula adhesiva; (11) punto más dorsal de la unión cuerpo-musculatura caudal; (12) extremo de la musculatura caudal; (13) punto más ventral de la unión cuerpo-musculatura caudal; (14) punto más anterior de la línea media o eje de los miótomos caudales; (15) región branquial. Estos puntos fueron seleccionados de tal manera que representen el cambio de forma en el lapso considerado y puedan ser identificados en todos los especímenes, por lo que no incluyen estructuras que cambian drásticamente en este período (e.g., el disco oral). La región branquial también sufre cambios fundamentales desde la diferenciación de las branquias hasta la formación del espiráculo; para muestrear la región incluimos un landmark "fuzzy" (Valeri et al., 1998) que marcamos como un punto central en el área que ocupan el esbozo de los arcos branquiales, las branquias externas y el espiráculo.

Figura 1. Configuración de landmarks definida para el análisis de morfometría geométrica sobre embriones y larvas en vista lateral (dibujos no a escala). Los landmarks se definen en el texto.
Una vez digitalizadas, las configuraciones fueron trasladadas, rotadas y escaladas a través del método de superimposición de Procrustes Generalizado (Generalized Procrustes Analysis, GPA) con el programa MorphoJ (Klingenberg et al., 2011). Esto elimina las diferencias en tamaño, posición y rotación de los objetos y produce una configuración consenso contra la cual se interpretan los patrones de variación morfológica en el conjunto de datos. Con la matriz de coordenadas alineadas se efectuó un análisis de componentes principales (PCA), obteniendo un gráfico de especímenes en un espacio definido por ejes de variación, y grillas de deformación que ilustran el cambio de forma en el morfoespacio calculado.
Seguidamente, efectuamos una regresión multivariada de la forma (matriz de coordenadas alineadas) contra el tamaño para cada especie por separado. El tamaño se representó a través del tamaño centroide (CS, transformado a logCS), una variable que resulta del cálculo de la raíz cuadrada de la sumatoria de las distancias cuadradas de cada uno de los landmarks de la configuración hasta el centro (centroide) de la forma (Rohlf y Bookstein, 1990). La hipótesis nula de la regresión afirma que la forma se desarrolla de manera isométrica, por lo que una regresión significativa indica que la forma cambia con el aumento de tamaño siguiendo un modelo predecible. La cantidad de variación explicada por el modelo de regresión se cuantificó como el porcentaje de variación de forma total (Klingenberg y McIntyre, 1998). La significancia estadística de las regresiones se probó mediante permutaciones, contra la hipótesis nula de independencia (Drake y Klingenberg, 2008). Los análisis de regresión se llevaron a cabo también en MorphoJ (Klingenberg et al., 2011).
Heterocronías de secuencia. Las variaciones en la secuencia de eventos morfogenéticos en el desarrollo se analizaron mediante la aproximación de heterocronías de secuencia, que se reconoce cuando la posición de un evento en la secuencia de desarrollo cambia con respecto a otros eventos (Smith, 2001, 2002). Para el establecimiento de los eventos a analizar definimos estados relevantes en el desarrollo de cada una de las estructuras embrionarias y larvales bajo estudio, como sigue: Glándulas adhesivas: (1) surco en V, (2) glándulas como dos estructuras separadas, (3) glándulas no visibles; Glándula de eclosión: (1) glándula en máximo desarrollo, (2) glándula no visible; Branquias externas: (1) esbozos branquiales, (2) ramificación de filamentos branquiales, (3) branquias en máximo desarrollo, (4) branquia derecha cubierta, (5) branquia izquierda cubierta; Opérculo: (1) pliegue opercular en la base de las branquias, (2) opérculo fusionado medialmente, (3) espiráculo formado; Ciliación corporal: (1) ciliación máxima, (2) ciliación en regresión; Pliegues labiales= LTRF (fórmula labial): (1) 1/1, (2) 2/2, (3) 2/3, (4) 2/4, (5) 3/5; Dientes labiales: (1) primeros dientes labiales, (2) dientes labiales en hilera P3; Margen papilar: (1) papilas en labio superior y comisuras, (2) margen papilar completo, (3) papilas submarginales con dientes.
Para comparar las variaciones entre secuencias se asigna un número de orden para cada evento, y se grafican las trayectorias en comparación a una considerada de referencia. En este caso, consideramos la trayectoria de desarrollo en Rhinella arenarum, a fin de destacar las características de Hypsiboas en contraste con una especie de otra familia (Bufonidae). El número de orden para eventos sincrónicos (sea porque ocurren sincrónicamente o porque la resolución del muestreo así lo resume) se calcula como el promedio entre los números de orden correspondientes.
RESULTADOS
Trayectorias alométricas
El PCA de datos morfogeométricos para las cinco especies de Hypsiboas se ilustra en el espacio definido por los dos primeros componentes (PC1 y PC2; Fig. 2A). El primer eje captura casi un 72% de la variación de forma total de los embriones; la variación de forma en el PC2 es despreciable en comparación (7%). El PC1 describe la variación ontogenética desde los embriones más tempranos analizados, en el extremo negativo, hasta las formas casi larvales localizadas hacia el extremo positivo. Las grillas de deformación interpolan los cambios de forma a partir de la configuración consenso y a lo largo del eje. Los scores en el extremo positivo se asocian con una reducción en la altura del cuerpo por pérdida de masa vitelina, acompañada de acortamiento del cuerpo y concomitante alargamiento proporcional de la cola. Cambios más localizados indican la reducción de las glándulas adhesivas y un desplazamiento caudal de la región branquial. La distribución de los especímenes de H. pulchellus se restringe al extremo de la distribución, expresando un cambio de forma total menos marcado entre los embriones más tempranos y más tardíos analizados.
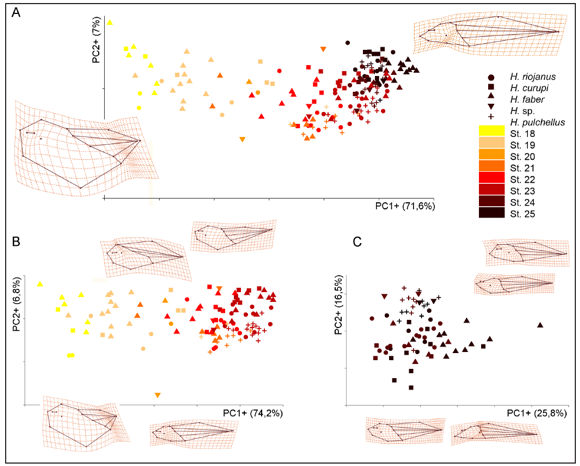
Figura 2. Análisis de componentes principales para las 5 especies de Hypsiboas analizadas. Gráfica del ordenamiento correspondiente a los 2 primeros componentes (PC1 y PC2) para todos los especímenes (A. St. 18 al 25) y dividiendo la matriz (B. St. 18-23; C. St. 24-25). Las grillas de deformación muestran el cambio de forma en los extremos de cada eje respecto de la forma consenso.
Entre los estadios 18 y 23 (Fig. 2B) el primer eje ordena los especímenes en un sentido ontogenético; el segundo eje, con un pequeño porcentaje de variación explicada, permite distinguir además una leve tendencia de las especies a discriminarse por el nacimiento de la aleta dorsal y la forma general del cuerpo (con Hypsiboas pulchellus en general con la aleta más anterior, e H. faber en general más posterior). Por el contrario, el análisis de los estadios 24 y 25 (Fig. 2C) muestra que la variación de forma no está relacionada fundamentalmente con la ontogenia (i.e., las larvas con o sin espiráculo formado de todas las especies tienen formas similares) sino con características de las especies; los embriones de H. faber que aparecen segregados son en general más deprimidos y tienen colas proporcionalmente más largas que los de las demás especies.
Los análisis de regresión forma-tamaño resultan en modelos de cambio de forma alométricos significativos en cuatro de las especies analizadas (p < 0.01 en todos los casos); los embriones de Hypsiboas sp. no se estudiaron en este contexto, dado su N muy bajo. Los porcentajes de variación del cambio de forma explicado por el incremento de tamaño para las otras cuatro especies son: H. faber: 69,47%; H. curupi: 64,53%; H. riojanus: 43,68%; H. pulchellus: 44,94%. La Figura 3 muestra las trayectorias alométricas de las cinco especies, destacando la variación interespecífica (Fig. 3A) e identificando además los estadios de desarrollo (Fig. 3B); las grillas de deformación de cada especie muestran el cambio de forma en una unidad de aumento de tamaño elegida a partir de un ejemplar promedio. En primer lugar se observa que las trayectorias son bastante similares, en general alineadas y superpuestas. La forma cambia linealmente con el tamaño hasta el estadio 23 aproximadamente, y luego de eso el tamaño sigue aumentando casi sin variación de forma. La trayectoria de H. faber diverge ligeramente de las de H. riojanus e H. curupi hacia el final, con los embriones de H. faber exhibiendo una forma más avanzada que los de las otras especies a tamaños comparables. Al individualizar los estadios de Gosner se aprecia que los especímenes de esta especie en general suceden a los de las otras en estadios equivalentes; esto indica que los eventos que definen estadios ocurren más tardíamente (i.e., con una forma más avanzada y un tamaño mayor) en esta especie que en las demás.

Figura 3. Análisis de regresión forma-tamaño; el tamaño (variable independiente) está representado por el tamaño centroide transformado a logaritmo (Log CS) y la forma (Regression score, variable dependiente) se obtiene a partir de la matriz de coordenadas de Procrustes; la variable Regression score se computa proyectando los datos del espacio de forma en un eje con la dirección del vector de regresión (Drake y Klingenberg, 2008). A. Gráfica de trayectorias alométricas para las 5 especies y B. discriminando también los estadios de desarrollo. Las grillas de deformación muestran el cambio de forma en un aumento = 0.3 unidades de logCS a partir de un ejemplar promedio. Las flechas señalan individuos de H. faber en St. 23 y de H. pulchellus en St. 25, ejemplificando la variación morfológica en un tamaño comparable.
Por otra parte, la trayectoria de Hypsiboas pulchellus es visiblemente más corta. Esto resulta de que no pudimos incluir embriones tan tempranos como en las otras especies, pero además, de que los cambios de forma ocurren rápidamente por unidad de tamaño y los eventos que definen estadios ocurren más tempranamente (i.e., en forma y tamaño) en comparación con las demás especies. Finalmente, el estadio 25 se alcanza con diferentes formas y tamaños entre las especies: en H. pulchellus se trata de embriones pequeños y de forma menos avanzada (más similares a un St. 23 de otras especies) y en H. faber especímenes de mayor tamaño y forma más "larval".
Heterocronías de secuencia
La Figura 4 muestra las secuencias de eventos de desarrollo en las cinco especies bajo estudio, y la Figura 5 resume los cambios de secuencia en el desarrollo del disco oral en particular. Los primeros eventos ocurren de manera bastante similar en Hypsiboas y Rhinella, y las mayores diferencias se registran luego de que la fórmula labial larval está definida. Los eventos más variables son el momento en que se dividen las glándulas adhesivas (más temprano en H. curupi y H. sp., y más tardío en H. riojanus -ver Fig. 4E) y la regresión de la glándula de eclosión (tardía en H. pulchellus). Las trayectorias de las especies del grupo de Hypsiboas pulchellus difieren de la de H. faber (Fig. 4A), principalmente en aspectos de desarrollo del disco oral (e.g., la fórmula labial 1/1 y la papilación completa se alcanzan más tarde). Dentro del grupo de H. pulchellus, H. pulchellus (Fig. 4D) ostenta una trayectoria en parte diferente, producto de una combinación de eventos que ocurren más tempranamente (e.g., la adquisición de la ciliación máxima) y otros relegados (e.g., regresión de la glándula de eclosión, separación de las glándulas adhesivas). Finalmente, H. curupi e H. sp. (Fig. 4B y C respectivamente) se distinguen del resto por la separación temprana de las glándulas adhesivas y la regresión tardía de la ciliación corporal. Las trayectorias de formación del disco oral son similares entre las especies (Fig. 5), con la excepción de H. pulchellus donde el margen papilar comienza a formarse antes. Entre las demás especies, la principal fuente de variación es la adición de hileras posteriores a la fórmula labial 2/3.

Figura 4. Heterocronías de secuencia. Para poder mantener las trayectorias de las especies comparables, para este gráfico se resumieron los eventos de tal forma que todos estén representados en todas las especies (eliminando características exclusivas, e.g., la adquisición de fórmulas labiales mayores a 2/3). El eje X indica los eventos de desarrollo ordenados tal como ocurren en la trayectoria de referencia (Rhinella arenarum); el eje Y marca el número de orden en que ocurre cada evento en la secuencia completa (1 = primer evento; 20 = último evento). B, branquias externas; C, ciliación; E, espiráculo; GA, glándulas adhesivas; GE, glándula de eclosión; LT, dientes labiales; LTRF, fórmula labial; O, opérculo; P, patas posteriores; PM, papilas marginales. Nótese las diferencias en las secuencias de H. faber y las especies del grupo de H. pulchellus, y de H. pulchellus respecto de las especies de su grupo. Las flechas destacan la separación temprana de las glándulas adhesivas y la regresión tardía de la ciliación corporal en H. curupi e H. sp., y la regresión tardía de la glándula de eclosión en H. pulchellus. Las micrografías de microscopio electrónico de barrido muestran embriones de las 5 especies analizadas con branquias externas en máximo desarrollo. A. Hypsiboas faber. B. H. curupi. C. H. sp. D. H. pulchellus. E. H. riojanus. Escala = 500 μm. Nótese las diferencias en tamaño relativo de las branquias, la separación tardía de las glándulas adhesivas en H. riojanus, y la ciliación rala en H. pulchellus.

Figura 5. Heterocronías de secuencia en el disco oral. Los eventos se colorean diferente para destacar los cambios en la secuencia. Los eventos precedidos por igual número indican simultaneidad; los signos de interrogación denotan que el evento no fue observado en el material. LTRF, fórmula labial; P3, tercera hilera labial posterior. Nótese la diferenciación temprana del margen papilar en H. pulchellus y la adición de hileras posteriores en H. faber e H. curupi-H. sp.
DISCUSIÓN
Entre los numerosos factores que contribuyen a la variación morfológica en anuros, los cambios alométricos asociados al incremento ontogenético del tamaño corporal pueden tener un impacto profundo en las formas anatómicas (Huxley, 1932; Gould, 1966; Emerson y Bramble, 1993; Klingenberg, 1996; Larson, 2004). Hasta el momento, los trabajos sobre alometría ontogenética en anuros se basan generalmente en caracteres esqueléticos y en estadios pre y postmetamórficos (e.g., Birch, 1999; Larson, 2004, 2005; Smith et al., 2006). Un estudio en la morfología externa de larvas de tres especies sugiere que las diferencias morfológicas se originan muy tempranamente, de forma tal que los embriones recién eclosionados ya pueden ser discriminados morfométricamente (Strauss y Altig, 1992). Sin embargo, el rol de la alometría en la determinación de cambios morfológicos en las etapas de desarrollo embrionario ha sido pobremente explorado. En nuestro caso, respecto de la relación forma-tamaño, las cinco especies coinciden en que el cambio de forma de los embriones ocurre rápidamente hasta que las branquias externas adquieren su máximo desarrollo (St. 23), y luego de ello se produce un aumento de tamaño y aparición de eventos particulares pero sin un cambio de forma general concomitante. El cambio de forma hasta el St. 23 involucra principalmente la dimensión ontogenética, i.e., la transición de forma del cuerpo en general desde un embrión a una larva; la variación que se registra a partir del St. 24 se relaciona aparentemente con rasgos particulares de las larvas de las especies.
Los cambios alométricos requieren la disociación de parámetros de desarrollo de diferentes partes del cuerpo (Alberch y Alberch, 1981). Por esto, la alometría está íntimamente asociada al fenómeno de heterocronía, que (en su acepción amplia) concierne cambios evolutivos en los momentos de aparición, tasas y secuencias de desarrollo de caracteres en la ontogenia, incorporando entonces el tiempo como un componente esencial (Reilly et al., 1997; Klingenberg, 1998). Durante la ontogenia temprana está cobrando importancia el análisis de las variaciones temporales en general, y las heterocronías de secuencia en particular, en los procesos del desarrollo. Eventos tan tempranos como el desarrollo de la cresta neural, diferenciación del tubo neural, formación de somitas y elongación del cuerpo registran variaciones interespecíficas (Chipman et al., 1999, 2000; Chipman, 2002; Mitgutsch et al., 2009). En algunos grupos, esta variación se sugiere como partícipe en la evolución de la diversidad de planes corporales larvales y modos de desarrollo (e.g., especies de Hemiphractidae; Wassersug y Duellman, 1984).
Las secuencias de eventos de desarrollo difieren entre las especies de Hypsiboas estudiadas (Figs. 4 y 5). En la mayoría, las branquias externas comienzan a ramificarse siempre antes de la aparición del pliegue opercular en su base, a diferencia de lo que ocurre en H. pulchellus, donde además la ramificación y desarrollo de las branquias es breve y escaso (ver Fig. 4D y Navarro Acosta et al., 2017). El máximo desarrollo branquial se alcanza casi simultáneamente al inicio de la diferenciación del disco oral, excepto H. faber que exhibe su máximo desarrollo con un disco ya iniciado. La regresión de las branquias coincide en general con la disminución de la ciliación corporal, excepto en H. curupi y H. sp. en quienes ésta ocurre tardíamente, luego de formado el espiráculo.
Entre las estructuras glandulares, la glándula de eclosión exhibe un desarrollo máximo simultáneo en las cinco especies antes de que comiencen a ramificarse las branquias, y se hace no visible antes del máximo desarrollo branquial, excepto en Hypsiboas pulchellus donde permanece evidente hasta luego de la regresión de la branquia derecha. De igual manera, las glándulas adhesivas aparecen simultáneamente en todas las trayectorias como una única estructura central con surco en V, pero éste puede desaparecer y las glándulas separarse tempranamente (e.g. H. curupi e H. sp.) o puede permanecer y continuar siendo la glándula una estructura indivisa hasta luego de la formación del disco, como sucede en H. riojanus.
Finalmente, en el caso del disco oral, el inicio de la diferenciación de los pliegues sucede a la fusión medial del opérculo, salvo en Hypsiboas faber, en quien ocurre anteriormente. La LTRF básica 2/3 se adquiere casi instantáneamente en todas las especies; en H. riojanus e H. faber la LTRF 2/3 se alcanza simultáneamente o antes de la regresión de la branquia derecha, mientras que en H. curupi, H. sp. e H. pulchellus lo hace después. Una vez formados los pliegues de esta fórmula básica comienza a desarrollarse el margen papilar, exceptuando H. pulchellus donde ya se advierten papilas en labio superior y comisuras cuando el disco exhibe una LTRF 1/1. El desarrollo completo del margen papilar puede concluir casi inmediatamente (H. faber, H. curupi e H. sp.) o puede extenderse hasta después de formado el espiráculo (H. riojanus e H. pulchellus). Los primeros dientes labiales emergen una vez adquirida la fórmula 2/3, antes o después de formado el margen papilar completo y el espiráculo; los dientes de la hilera P3 son los últimos en aparecer en esta LTRF 2/3 básica en todos los casos, y mientras esto determina la formación del disco larval definitivo en H. riojanus e H. pulchellus, en H. faber, H. curupi e H. sp. continúa con la formación de hileras distales. Los discos definitivos se adquieren luego de la aparición de los miembros posteriores en H. curupi e H. sp. (Navarro Acosta et al., 2017).
Para los hílidos en general, y el género Hypsiboas en particular, estudios que interpreten la relación entre los cambios alométricos y temporales del desarrollo embrionario de manera integrada son virtualmente inexistentes. La comparación interespecífica de las trayectorias ontogenéticas de las cinco especies analizadas revela la existencia de diversas combinaciones entre las variables de forma, tamaño y eventos que definen estadios de desarrollo. Hasta el estadio de branquias en máximo desarrollo, H. riojanus, H. curupi e H. faber comparten una trayectoria general en que a aumentos semejantes de tamaño corresponde un cambio de forma esperable y similar. Luego de esa instancia, los renacuajos de H. faber divergen ligeramente y se distinguen en que, a tamaños comparables, la forma es más avanzada (en términos de la variación morfológica que resumen los ejes de los análisis morfogeométricos, i.e., tienen cuerpo más deprimido y cola proporcionalmente más larga) que en las dos especies restantes. Los cambios de estadio de desarrollo sin embargo se encuentran retrasados, y la trayectoria completa de la especie puede apreciarse que ocurre en general a forma y tamaño más avanzados. Esto revela diferencias interespecíficas en el acople de diferentes caracteres ontogenéticos (caracteres que definen estadios vs. caracteres con los que describimos la forma general del cuerpo), que al manifestar variadas tasas de desarrollo producen combinaciones de morfologías diferentes. En este caso por ejemplo, la apariencia más avanzada de los embriones de H. faber respecto de H. riojanus e H. curupi del mismo tamaño, se contrarresta con su asignación a estadios menos avanzados. Y la situación se vuelve más compleja al analizar caracteres que no definen estadios ni han sido contemplados para representar la forma general, como es el caso del disco oral. En el caso de H. faber, los eventos del desarrollo del disco acompañan el cambio en la forma del cuerpo, y esta estructura comienza a diferenciarse en estadios anteriores que en las demás especies y su fórmula básica se completa rápidamente mientras las branquias son aún externas.
Hypsiboas pulchellus por otra parte muestra una trayectoria con marcadas diferencias. Varios de los eventos que definen estadios (e.g., opérculo en base de branquias, formación de espiráculo) y otros como la regresión de la ciliación corporal y la diferenciación del margen papilar del disco oral ocurren en forma y tamaño menores que en las demás especies. Otros caracteres en cambio manifiestan un desarrollo visiblemente más retrasado, como la glándula de eclosión visible hasta luego de la regresión de la branquia derecha, y la formación del disco oral definitivo que sucede al cierre del opérculo. Al contrario de lo que sucede en H. faber, esta combinación de características redunda en que los ejemplares de H. pulchellus invariablemente parecen más "embrionarios" que los demás.
Desde una perspectiva ecomorfológica, tanto la forma general del cuerpo como las estructuras embrionarias y larvales que aparecen durante el desarrollo temprano exhiben una incumbencia intrínseca para examinar las interacciones entre los embriones y su ambiente de desarrollo (Gilbert, 2001). Al respecto, examinando la variación morfológica y ontogenética en estas especies, señalamos una posible relación con los sitios de oviposición y ambientes en que se desarrollan los embriones y larvas (Navarro Acosta et al., 2017). Por ejemplo en H. curupi, el mayor tamaño relativo de las glándulas adhesivas puede relacionarse al desarrollo de los embriones y larvas en pequeños arroyos. Complementariamente, en este trabajo observamos que el desarrollo comparativamente más extendido de estas glándulas en términos de estadios, co-ocurrente con la formación también extendida de las estructuras orales, pueden responder a la necesidad de contar con estructuras de adhesión más desarrolladas y persistentes que eviten la deriva en el flujo de agua. Análogamente en H. faber detectamos un retraso en la regresión de las branquias y de la ciliación corporal (a diferencia de H. pulchellus en donde ambos eventos ocurren comparativamente más temprano), variaciones temporales que acompañan a las morfológicas reportadas por Navarro Acosta et al. (2017) del mayor tamaño branquial y mayor densidad de ciliación para la especie. En este caso se sugiere también cómo los cambios en los tiempos de desarrollo y permanencia de las estructuras involucradas en la función respiratoria de los embriones acompañan a los requerimientos de su desarrollo en nidos de barro con agua poco oxigenada. Sin embargo, restan registros y observaciones adicionales, fundamentalmente comportamentales de los embriones in situ, para discutir procesos heterocrónicos involucrados en las morfologías asociadas a aspectos ecológicos diferentes.
Como comentario final, es importante mencionar dos limitaciones de los datos considerados y por lo tanto las interpretaciones efectuadas. Por un lado, el tamaño muestral, aún en los casos en que contamos con más número de embriones relevados, no tiene en cuenta la variación intraespecífica, incluyendo además de la variación interindividual en una puesta, la variación entre puestas y entre poblaciones. Y en relación a esto, el efecto que la variación ambiental tiene sobre el desarrollo temprano puede también estar subestimado. Numerosos factores abióticos y bióticos (e.g., temperatura, luz, oxigenación, densidad) pueden modificar drásticamente variados aspectos estructurales y temporales del desarrollo (e.g., Love, 2010). En algunos de los caracteres estudiados, por ejemplo el disco oral, se conoce que diferentes condiciones de competencia o predación pueden inducir diferentes morfologías (e.g., Reylea y Auld, 2005). Si bien es deseable homogeneizar algunos de estos factores, en otros puede ser preferible respetar las condiciones naturales en que ocurre el desarrollo en lugar de estandarizar las condiciones de cría (por ejemplo con luz y temperatura fijados en laboratorio). En cualquier caso, los resultados y conclusiones a las que se arribe son contingentes respecto de las condiciones previas, y por lo tanto la extrapolación a otras situaciones debe ser efectuada con cautela. Dicho esto, este trabajo constituye una primera aproximación al conocimiento de los patrones de desarrollo, alometría y heterocronía en especies de Hypsiboas, y genera numerosos interrogantes acerca de los mecanismos tempranos que posibilitan la diversidad ontogenética, y sus implicancias ecológicas y evolutivas.
Agradecimientos
A D. Baldo, F. Kolenc y C. Borteiro por proporcionarnos las series de desarrollo. Al Instituto de Herpetología de la Fundación Miguel Lillo por permitir la realización de este proyecto. El mismo fue financiado por: PICT 2011-1524 (ANPCyT), PIP 0875 (CONICET), PIUNT-G519 (UNT) y beca estudiantil para investigación CIUNT-2013. Dos revisores anónimos mejoraron en gran medida una versión anterior del manuscrito.
LITERATURA CITADA
1. Alberch, P. & Alberch, J. 1981. Heterochronic mechanisms of morphological diversification and evolutionary change in the neotropical salamander, Bolitoglossa occidentalis (Amphibia: Plethodontidae). Journal of Morphology 167: 249-264. [ Links ]
2. Birch, J.M. 1999. Skull allometry in the Marine Toad, Bufo marinus. Journal of Morphology 241: 115-126. [ Links ]
3. Chipman, A.D. 2002. Variation, plasticity and modularity in anuran development. Zoology 105: 97-104. [ Links ]
4. Chipman, A.D.; Haas, A. & Khaner, O. 1999. Variation in anuran embryogenesis: yolk rich embryos of Hyperolius puncticulatus. Evolution and Development 1: 49-61. [ Links ]
5. Chipman, A.D.; Haas, A.; Tchernov, E. & Khaner, O. 2000. Variation in anuran embryogenesis: differences in sequence and timing of early developmental events. Journal of Experimental Zoology 288: 352-365. [ Links ]
6. Cock, A.G. 1966. Genetical aspects of metrical growth and form in animals. Quarterly Review of Biology 41: 131-190. [ Links ]
7. Di Cerbo, A.R. & Biancardi, C.M. 2010. Morphometric study on tadpoles of Bombina variegata (Linnaeus, 1758) (Anura; Bombinatoridae). Acta Herpetologica 5: 223-231. [ Links ]
8. Drake, A.G. & Klingenberg, C.P. 2008. The pace of morphological change: historical transformation of skull shape in St Bernard dogs. Proceedings of the Royal Society B: Biological Sciences 275: 71-76. [ Links ]
9. Emerson, S.B. & Bramble, D.M. 1993. Scaling, Allometry and Skull Design: 384-421. En: Hanken, J. & Hall, B.K. (eds.), The skull: functional and evolutionary mechanisms, Vol 3. University of Chicago Press, Chicago. [ Links ]
10. Faivovich, J.; Haddad, C.F.B.; Garcia, C.A.; Frost, D.R.; Campbell, J.A. & Wheeler, W.C. 2005. Systematic review of the frog family Hylidae, with special reference to Hylinae: Phylogenetic analysis and taxonomic revision. Bulletin of the American Museum of Natural History 294: 1-240. [ Links ]
11. Frost, D.R. 2016. Amphibian Species of the World: an Online Reference. Version 6.0. Disponible en: http://research.amnh.org/herpetology/amphibia/index.html. Ultimo acceso: 2 de septiembre de 2016. [ Links ]
12. Garriga, N. & Llorente, G.A. 2012. Chondrocranial ontogeny of Pelodytes punctatus (Anura: Pelodytidae). Response tu competition: geometric morphometric and allometric change analysis. Acta Zoologica 93: 453-464. [ Links ]
13. Gilbert, S.F. 2001. Ecological developmental biology: developmental biology meets the real world. Developmental Biology 233: 1-12. [ Links ]
14. Gosner, K.L. 1960. A simplified table for staging anuran embryos and larvae with notes on identification. Herpetologica 16: 183-190. [ Links ]
15. Gould, S.J. 1966. Allometry and size in ontogeny and phylogeny. Biological Reviews 41: 587-640. [ Links ]
16. Hanken, J. 1984. Miniaturization and its effects on cranial morphology in plethodontid salamanders, genus Thorius (Amphibia: Plethodontidae). I. Osteological variation. Biological Journal of the Linnean Society 23: 55-75. [ Links ]
17. Huxley, J. 1932. Problems of Relative Growth. Dial, New York. [ Links ]
18. Ivanovic, A.; Vukov, T.D.; Dukic, G.; Tomaevic, N. & Kalezic, M.L. 2007. Ontogeny of skull size and shape changes within a framework of biphasic lifestyle: a case study in six Triturus species (Amphibia, Salamandridae). Zoomorphology 126: 173-183. [ Links ]
19. Klingenberg, C.P. 1996. Multivariate Allometry: 23-49. En: Marcus, L.F.; Corti, M.; Loy, A.; Naylor, G. & Slice, D.E. (eds.), Advances in morphometrics. Proceedings of the 1993 NATO Advanced Studies Institute on Morphometrics in Il Ciocco, Italy. Plenum, New York. [ Links ]
20. Klingenberg, C.P. 1998. Heterochrony and allometry: the analysis of evolutionary change in ontogeny. Biological Reviews 73: 79-123. [ Links ]
21. Klingenberg, C.P. 2010. Evolution and development of shape: integrating quantitative approaches. Nature Reviews Genetics 11: 623-635. [ Links ]
22. Klingenberg, C.P. & McIntyre, G.S. 1998. Geometric morphometrics of developmental instability: analyzing patterns of fluctuating asymmetry with Procrustes methods. Evolution 52: 1363-1375. [ Links ]
23. Klingenberg, C.P.; Duttke, S.; Whelan, S. & Kim, M. 2011. Developmental plasticity, morphological variation and evolvability: a multilevel analysis of morphometric integration in the shape of compound leaves. Journal of Evolutionary Biology 25: 115-129. [ Links ]
24. Kolenc, F.; Borteiro, C.; Alcalde, L.; Baldo, D.; Cardozo, D. & Faivovich, J. 2008. Comparative larval morphology of eight species of Hypsiboas Wagler (Amphibia, Anura, Hylidae) from Argentina and Uruguay, with a review of the larvae of this genus. Zootaxa 1927: 1-66. [ Links ]
25. Larson, P.M. 2002. Chondrocranial development in larval Rana sylvatica (Anura: Ranidae): Morphometric analysis of cranial allometry and ontogenetic shape change. Journal of Morphology 252: 131-144. [ Links ]
26. Larson, P.M. 2004. Chondrocranial morphology and ontogenetic allometry in larval Bufo americanus (Anura, Bufonidae). Zoomorphology 123: 95-106. [ Links ]
27. Larson, P.M. 2005. Ontogeny, phylogeny, and morphology in anuran larvae: morphometric analysis of cranial development and evolution in Rana tadpoles (Anura: Ranidae). Journal of Morphology 264: 34-52. [ Links ]
28. Lima, M.S.C.S. & Pederassi, J. 2012. Morphometrics and ratio of body proportionality of tadpoles of Rhinella icterica (Anura, Bufonidae) at different developmental stages. Brazilian Journal of Biology 72: 623-629. [ Links ]
29. Love, A.C. 2010. Idealization in evolutionary developmental investigation: a tension between phenotypic plasticity and normal stages. Philosophical Transactions of the Royal Society B 365: 679-690. [ Links ]
30. Mitgutsch, C.; Piekarski, N.; Olsson, L. & Haas, A. 2008. Heterochronic shifts during early cranial neural crest migration in two ranid frogs. Acta Zoologica 89: 69-78. [ Links ]
31. Mitgutsch, C.; Olsson, L. & Haas, A. 2009. Early embryogenesis in discoglossoid frogs: a study of heterochrony at different taxonomic levels. Journal of Zoological Systematics and Evolutionary Research 47: 248-257. [ Links ]
32. Navarro Acosta, G.; Baldo, D.; Kolenc, K.; Borteiro, C. & Vera Candioti, M.F. 2017. Embryonic morphology in five species of Hypsiboas (Anura: Hylidae). The Herpetological Journal 26: 121-132. [ Links ]
33. Reilly, S.M.; Wiley, E.O. & Meinhardt, D.J. 1997. An integrative approach to heterochrony: the distinction between interspecific and intraspecific phenomena. Biological Journal of the Linnean Society 60: 119-143. [ Links ]
34. Relyea, R.A. & Auld, J.R. 2005. Predator- and competitor-induced plasticity: how changes in foraging morphology affect phenotypic trade-offs. Ecology 86: 1723-1729. [ Links ]
35. Richardson, M.K.; Hanken, J.; Gooneratne, M.L.; Pieau, C.; Raynaud, A.; Selwood, L. & Wright G.M. 1997. There is no highly conserved embryonic stage in the vertebrates: implications for current theories of evolution and development. Anatomy and Embryology 196: 91-106. [ Links ]
36. Rohlf, F.J. 2005. tpsDig2, Version 2.04, Copyright © 2005. Ecology and Evolution, Suny at Stony Brook. Disponible en: http: // life.bio.sunysb.edu / morph / soft-tps.html [ Links ]
37. Rohlf, F. J. & Bookstein, F.L. 1990. Proceedings of the Michigan Morphometrics Workshop. Special Publication No. 2, University of Michigan Museum of Zoology: Ann Arbor. [ Links ]
38. Smith, J.M.; Bares, W.J. P.; Downie, J.R. & Ruxton, G.D. 2006. Adhesion and allometry from metamorphosis to maturation in hylid tree frogs: a sticky problem. Journal of Zoology 270: 372-383. [ Links ]
39. Smith, K.K. 2001. Heterochrony revisited: the evolution of developmental sequences. Biological Journal of the Linnean Society 73: 169-186. [ Links ]
40. Smith, K.K. 2002. Sequence heterochrony and the evolution of development. Journal of Morphology 252: 82-97. [ Links ]
41. Smith, K.K. 2003. Time's arrow: heterochrony and the evolution of development. Integrative Journal of Developmental Biology 47: 613-621. [ Links ]
42. Strauss, R.E. & Altig, R. 1992. Ontogenetic body form changes in three ecological morphotypes of anuran tadpoles. Growth, Development and Aging 56: 3-16. [ Links ]
43. Valeri, C.J.; Cole, T.M.III; Lele, S. & Richtsmeier, J.T. 1998. Capturing data from three-dimensional surfaces using fuzzy landmarks. American Journal of Physical Anthropology 107: 113-124. [ Links ]
44. Wassersug, R.J. & Duellman, W.E. 1984. Oral structures and their development in egg-brooding hylid frog embryos and larvae: evolutionary and ecological implications. Journal of Morphology 182: 1-37. [ Links ]














