Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Cuadernos de herpetología
On-line version ISSN 1852-5768
Cuad. herpetol. vol.31 no.2 San Salvador de Jujuy June 2017
TRABAJO
El estado de alimentación de renacuajos de Pleurodema thaul (Anura: Leptodactylidae) modula la adquisición de un aprendizaje relacionado a riesgo de depredación
The feeding state of Pleurodema thaul (Anura: Leptodactylidae) tadpoles modulates the acquisition of a learning related to predation risk
Mariana Pueta1,2, Nayan Andaluz Arcos1, M. Gabriela Perotti1
1 Laboratorio de Fotobiología, Instituto de Investigaciones en Biodiversidad y Medioambiente (CONICET-CRUB, Universidad Nacional del Comahue), Quintral 1250, Río Negro (8400), Argentina.
2 Departamento de Biología General (CRUB, Universidad Nacional del Comahue), Quintral 1250, Río Negro (8400), Argentina.
Recibido: 28/10/17
Revisado: 07/02/17
Aceptado: 28/06/17
ABSTRACT
Feeding state of animals modulates the antipredator response and could affect the acquisition of new information related to predation risk. Tadpoles commonly decrease locomotor activity as an antipredator response. We performed laboratory assays to study whether an associative learning process to recognize predation risk can be modulated by the feeding state of Pleurodema thaul tadpoles. A group of tadpoles were fed ad libitum and a second group was deprived of food for 36 h prior to the learning acquisition phase. In the acquisition phase a half of tadpoles from each feeding treatment was conditioned by exposition to amphipod injury cues paired with conspecific injury ones (Paired group). The remaining tadpoles received the same cues as those presented to the Paired group but separated 4 h in time (Control group). At the end of the acquisition phase all tadpoles were fed ad libitum and two days later we evaluated changes in tadpoles' activity when they were exposed to amphipod cues. Our results showed that tadpoles in the Paired group that were fed ad libitum prior to acquisition phase decreased their activity when exposed to cues from injured amphipods, but starved tadpoles did not decrease their activity. Starved tadpoles apparently do not generate any association between conspecific and amphipod cues as fed tadpoles do. Our results provide important information regarding how the feeding state of tadpoles may interfere with the acquisition of learning and affect, for example, early detection of predation risk.
Key words: Anuran tadpoles; Associative learning; Fed state; Amphipods.
RESUMEN
El estado de alimentación de los animales modula la respuesta antidepredador y podría interferir en la adquisición de información relacionada al riesgo de depredación. En renacuajos, la disminución de la actividad locomotora es una respuesta antidepredador muy frecuente. Mediante una serie de ensayos de laboratorio estudiamos si un aprendizaje asociativo de reconocimiento de riesgo de depredación es modulado por el estado de alimentación de renacuajos de Pleurodema thaul durante la fase de adquisición de dicho aprendizaje. Un grupo de renacuajos de Pleurodema thaul fue alimentado ad libitum y otro grupo fue privado de comida 36 h previo a la fase de adquisición del aprendizaje. En la fase de adquisición la mitad de los renacuajos de cada tratamiento de alimentación recibió señal química de anfípodos dañados junto con señal química de conespecíficos dañados (grupo Apareado); la otra mitad recibió ambas señales pero con 4 h de diferencia entre la adición de cada una (grupo Control). Al finalizar la fase de adquisición todos los renacuajos fueron alimentados ad libitum y 48 h después se evaluó el cambio en la actividad de los renacuajos frente a la señal de anfípodo dañado. Los resultados mostraron que durante la evaluación los renacuajos del grupo Apareado que fueron bien alimentados previo a la adquisición disminuyeron su actividad frente a la clave de anfípodo dañado, mientras que los renacuajos que fueron hambreados no mostraron disminución en la actividad. Los renacuajos hambreados no parecen generar una asociación entre la señal de daño de conespecíficos y la de anfípodos, que sí adquieren aquellos renacuajos bien alimentados. Nuestros resultados brindan información importante acerca de cómo el estado de alimentación de renacuajos podría interferir en la adquisición de aprendizajes y afectar, por ejemplo, la detección temprana del riesgo de depredación.
Palabras clave: Renacuajos; Aprendizaje asociativo; Alimentación; Anfípodos.
INTRODUCCION
La detección temprana del riesgo de depredación modula la eficiencia con que las presas evitan la depredación (Wisenden, 2003). Cuando una presa detecta a un potencial depredador genera respuestas comportamentales a corto plazo que minimizan el riesgo de ser depredada. En ambientes acuáticos, las señales químicas son los principales estímulos que posibilitan a las presas evaluar el riesgo de depredación (Kieseker et al., 1996; Kats y Dill, 1998; Wisenden, 2000; Saidapur et al., 2009; Mogali et al., 2012). Las presas pueden percibir el riesgo de depredación a través de la liberación de señales químicas de congéneres dañados (señal de alarma) (Chivers y Smith, 1998; Gonzalo et al., 2007; Ferrari et al., 2008; Pueta et al., 2016) y de la liberación de feromonas (kairomonas) o de metabolitos provenientes de la dieta de los depredadores (Laurila et al., 1997; Chivers y Mirza, 2001; Schoeppner y Relyea, 2005; Mogali et al., 2012).
El aprendizaje es un mecanismo fundamental para ajustar el comportamiento a los cambios ambientales, pero el procesamiento y almacenamiento de la información es energéticamente costoso (Johnston, 1982; Bernays, 1998; Dukas, 1999; Laughlin, 2001; Maille y Schradin, 2016). Se ha sugerido que los mecanismos de atención y la habilidad de aprender y memorizar exhiben soluciones de compromiso o balances con otros rasgos asociados al "fitness" (Johnston, 1982; Dukas, 1999, 2002; Dukas y Bernays, 2000; Mery y Kawecki, 2003, 2005). En este sentido, el estado de alimentación de los animales determina un estado motivacional y fisiológico que podría modular la respuesta antidepredador o interferir en la adquisición de información (Kandel et al., 1997; Coleman et al., 2005; Leblond et al., 2011; Maille y Schradin, 2016). En términos generales, se predice que la intensidad o magnitud de la respuesta antidepredador disminuye con la disminución de reservas energéticas (Houston et al., 1993; Coleman et al., 2005). En renacuajos, las respuestas antidepredador mas frecuentes son la disminución de la actividad locomotora y el incremento en el uso de refugios (Skelly, 1994; Mirza et al., 2006; Fraker, 2008; Carlson et al., 2015). Al respecto, en un trabajo previo (Pueta et al., 2016) observamos en renacuajos de Pleurodema thaul que la respuesta antidepredador (cambio en actividad locomotora general) frente a señales de alarma de conespecíficos es modulada por el estado de alimentación de los renacuajos y por la disponibilidad de comida.
En los anuros, se ha demostrado la capacidad de los renacuajos de aprender a reconocer el olor de depredadores nativos o introducidos, observando una gran complejidad de las respuestas aprendidas (Ferrari et al., 2006; Gonzalo et al., 2010; Polo-Cavia y Gómez-Mestre, 2014). En un trabajo reciente (Pueta y Perotti, 2016) demostramos que el mecanismo de aprendizaje por el cual los renacuajos podrían adquirir nueva información sobre depredación sería del tipo asociativo donde, de acuerdo al procedimiento de condicionamiento clásico, una señal que naturalmente no representa riesgo de depredación (estímulo condicional, EC) adquiere dicha representación de riesgo cuando es previamente asociada con una señal que innatamente representa riesgo de depredación (estímulo incondicional, EI).
Pleurodema thaul (Anura: Leptodactylidae) es una de las especies de anfibios más comunes del noroeste de la Patagonia. Se reproduce principalmente en primavera en charcas temporarias libres de peces y coexiste con insectos depredadores que cambian en su abundancia tanto espacial como temporalmente (Jara, 2010; Jara y Perotti, 2010; Jara et al., 2013). Estos humedales temporales también presentan variación inter e intra-anual de los recursos alimentarios para los renacuajos (Díaz Villanueva, 2006; García, 2010).
El objetivo del presente trabajo fue analizar si un aprendizaje asociativo de reconocimiento de riesgo de depredación es modulado por el estado de alimentación de los renacuajos durante la fase de adquisición de dicho aprendizaje. El proceso de aprendizaje asociativo que evaluamos en el presente trabajo fue observado previamente en P. thaul (Pueta y Perotti, 2016) e implica que los renacuajos aprenden a reconocer riesgo de depredación en la señal de daño de Hyalella patagonica (Crustácea: Anfipoda) cuando ésta fue previamente asociada con la señal de alarma de renacuajos conespecíficos dañados. La oportunidad de generar este aprendizaje en la naturaleza resulta factible ya que en los humedales temporarios de la Patagonia los renacuajos de P. thaul se asocian generalmente con anfípodos en la zona bentónica, y estudios experimentales han demostrado que renacuajos y anfípodos comparten a sus principales depredadores (Jara, 2014). Para nuestro conocimiento, este es el primer estudio sobre el efecto del estado de alimentación sobre la capacidad de aprendizaje en renacuajos.
MATERIALES Y METODOS
Animales y preparación de señales químicas
Para realizar el experimento colectamos fragmentos de cuatro masas de huevos de Pleurodema thaul (Gosner 11-13; Gosner, 1960) de un humedal temporario situado en 25 km al SO de San Carlos de Bariloche, provincia de Río Negro, Argentina (Mallín Llao Llao, 41° 2' S, 71° 33' O, 821 m.s.n.m); los huevos fueron mantenidos en piletas al aire libre (sin depredadores) hasta el inicio del experimento. El desarrollo de P. thaul desde huevo en estadio de gástrula hasta la metamorfosis suele llevar dos meses en condiciones naturales, y en condiciones semi-naturales (condiciones más estables) esos tiempos son similares o un poco más largos (obs. pers.). En el mismo humedal se colectaron dos fragmentos adicionales de masas de huevos de P. thaul para la preparación de la señal de alarma y adultos de Hyalella patagonica (Amphipoda) para preparar señales químicas de heterospecíficos dañados.
Las señales de daño fueron preparadas por macerado de animales (Wisenden et al., 1999; Ferrari et al., 2006). Las señales de renacuajos (EI) y anfípodos (EC) se prepararon de la misma manera que en trabajos previos (Pueta y Perotti, 2016; Pueta et al., 2016). Brevemente, los renacuajos fueron anestesiados por exposición a baja temperatura (-8 °C) e inmediatamente se sacrificaron por decapitación con rápido corte de la cabeza. El tejido resultante fue macerado utilizando mortero y después se suspendió en agua destilada (concentración final: 0.07 g/ml). La solución se filtró a través de tela de filtro (Nitex 45 μm) para eliminar las partículas. La señal de anfípodo dañado se preparó de manera similar a la señal de renacuajo, pero macerando H. patagonica para lograr una concentración de 0.13 g/ml. En todos los casos, la solución resultante del filtrado se dividió en alícuotas de 1 ml y se congeló a -20 °C hasta su uso. La manipulación de los animales se realizó de acuerdo a las sugerencias de Guías internacionales en comportamiento y herpetología (ASIH, 2004; ASAB, 2012)
Protocolo experimental
Para evaluar si el estado de alimentación modula la adquisición de un aprendizaje asociativo en renacuajos de P. thaul, un grupo de renacuajos de fue alimentado ad libitum y otro grupo fue privado de comida 36 h previo a la fase de adquisición del aprendizaje. Luego, todos los renacuajos fueron alimentados ad libitum y a las 48 hs de la fase de adquisición se evaluó la actividad general de los renacuajos frente a la señal de H. patagonica. El experimento constó de un diseño factorial 2 x 2 definido como: Tratamiento de Alimentación previo a la fase de adquisición del aprendizaje (Hambreados o Alimentados) y Tratamiento de Adquisición (Apareado o Control) (Fig. 1). A tal fin, el primer día de experimentación (D1) por la mañana 40 renacuajos (muestra determinada en estadio Gosner 28-30) fueron trasladados a un cuarto de experimentación, con un fotoperíodo controlado (12:12 L:D) y luz artificial proporcionada por dos lámparas fluorescentes (Philips luz del día, TLT 40W / 54RS) a una temperatura ambiente media de 17 °C ± 0.5 °C. Cada renacuajo (unidad experimental) se colocó en un vaso de plástico (10 cm de diámetro) con 250 ml de agua limpia y fueron alimentados con una mezcla de cultivo de algas (Scenedesmus sp., Chlamydomonas sp.) y comida para peces de agua dulce (VitaFish®). A las 16:00 h del día 1 (D1) cada vaso se limpió cuidadosamente con un limpiador de fondo y se añadió agua limpia para completar 250 ml, en ese momento se asignaron aleatoriamente 20 renacuajos a cada Tratamiento de Alimentación. Los 20 renacuajos en el tratamiento Alimentados recibieron alimento junto con el cambio de agua del D1, mientras que los 20 renacuajos en el tratamiento Hambreados no recibieron alimento. Durante el D2 el grupo Alimentados recibió comida a la mañana y a la tarde y el grupo hambreados fue sólo manipulado imitando la adición de comida. En la mañana del D3 se asignaron aleatoriamente 10 renacuajos de cada grupo de alimentación a uno de los Tratamientos de Adquisición. El Tratamiento de Adquisición consistió en dos ensayos en un mismo día (D3) donde el grupo Apareado fue expuesto al EC y luego de 10 s al EI y el grupo Control fue expuesto a ambos estímulos pero separados por 4 h uno del otro. Los dos ensayos (adición de señales) en el grupo Apareado fueron a las 10 h y 14 h; en el grupo Control las adiciones de la mañana fueron a las 9 h y 12 h y las de la tarde a las 13 h y 16 h. El orden de adición de señales a cada individuo en el grupo Control fue invertido a la mañana y a la tarde para evitar contigüidad temporal y espacial de un EC y un EI. Para adicionar las señales se utilizó una pipeta semiautomática (1 ml). Al final de la tarde, se cambió el agua de cada vaso y los renacuajos en todos los tratamientos fueron alimentados ad libitum desde la tarde del D3 hasta la evaluación con el EC (D5).

Figura 1. Protocolo experimental. D: día; EC: estímulo condicional; EI: estímulo incondicional; RTP: indica los días en que se midió el largo rostro-tubo proctodeal. Se resaltan en negrita los tratamientos que componen el diseño factorial 2 x 2. Durante la evaluación los animales fueron filmados 4 min pre- y 4 min pos- adición del EC.
En la evaluación (D5), cada renacuajo fue filmado 4 min pre- y 4 min pos- adición del EC (anfípodo dañado), para registrar luego el tiempo de actividad total (cualquier movimiento) en cada período. La evaluación de los comportamientos durante ambos períodos (pre y pos-estímulo) es un método utilizado con frecuencia en los estudios de comportamiento donde los renacuajos están expuestos a señales químicas que indican riesgo de depredación (por ejemplo: Mathis et al., 2008; Ferrari y Chivers, 2011; Pueta y Perotti, 2016; Pueta et al., 2016). Una respuesta antidepredador típica de larvas de anfibios, incluyendo los renacuajos de P. thaul (Pueta y Perotti, 2016; Pueta et al., 2016), es la disminución de la actividad general cuando detectan señales que indican riesgo de depredación.
Al término de la evaluación los animales fueron fijados (formol 10%) para luego chequear el estadio de desarrollo.
Toma y análisis de datos
Las filmaciones de los renacuajos durante la evaluación el D5 fueron observadas y se tomó el tiempo de actividad (segundos) durante el periodo pre- y pos- estímulo. La confiabilidad inter-observador de acuerdo al coeficiente de correlación de Pearson fue 0.9945, p<0.0001. Luego obtuvimos la variable respuesta de cambio en la duración de la actividad [actividad pos-estímulo - actividad pre-estímulo]. A partir de los residuos de la variable respuesta (cambio en la duración de la actividad) se verificaron los supuestos de distribución normal y de homocedasticidad (Kolmogorov-Smirnov y Test de Levene, respectivamente). Previo al análisis de la variable de cambio en la actividad, analizamos la posibilidad de diferencias en la actividad durante el período pre-estímulo (basal) ya que diferencias en la actividad basal podrían enmascarar el efecto del Tratamiento de Adquisición sobre la variable de cambio en la actividad. La variable de duración de la actividad basal no cumplió con los supuestos de homocedasticidad y normalidad, por lo que fue analizada con estadística no paramétrica. El análisis de la varianza no paramétrico de Kruskal-Wallis examinando el efecto de ambos tratamientos combinados sobre la actividad basal fue significativo [H3, n=39=11.10, p<0.011]. Luego, mediante análisis de Wilcoxon (Mann Whitney U) examinamos el efecto de cada tratamiento sobre la actividad basal. Debido a que hubo un efecto del Tratamiento de Alimentación sobre la actividad basal (ver resultados) la comparación entre los grupos definidos por el Tratamiento de Adquisición (Apareado y Control) se realizó con ANOVAs secuenciales definidos por el Tratamiento de Alimentación.
Para estimar el largo rostro-tubo proctodeal (RTP) al momento de la adquisición del aprendizaje (D3) y para evitar manipular a los animales, el D2 por la tarde cada renacuajo fue filmado durante unos minutos con un papel milimetrado debajo del vaso (semitransparente). El D5 el papel milimetrado fue colocado al inicio de la evaluación, y dichas filmaciones sirvieron para estimar el largo RTP al momento de la evaluación. Los residuos de la variable de largo RTP en la adquisición y en la evaluación no se ajustaron a la distribución normal por lo cual se analizó mediante análisis no paramétricos (Wilcoxon y Kruskal-Wallis).
El número de individuos analizados por grupo final fue 10 (N=10) excepto en el grupo Alimentado-No apareado donde uno de los renacuajos no se movió en la evaluación y no fue incluido en los análisis. Este tamaño muestral fue considerado suficiente para detectar diferencias en el comportamiento analizado (actividad) en función del estado de alimentación o del aprendizaje en P. thaul (Pueta y Perotti, 2016; Pueta et al., 2016). El valor crítico de significancia en todos los análisis fue p < 0.05. Todos los análisis se realizaron con el software InfoStat 2013 (Di Rienzo et al., 2013).
RESULTADOS
El análisis de la actividad basal (pre-estímulo) de los renacuajos mostró un efecto significativo al Tratamiento de Alimentación [Wilcoxon W 1, n=39 =271, p<0.0022], donde los renacuajos hambreados presentaron una actividad mayor que los renacuajos bien alimentados (Fig. 2). Los ANOVAs secuenciales sobre la variable de cambio en la actividad definidos por el Tratamiento de Alimentación mostraron que: los renacuajos bien alimentados del grupo Apareado disminuyeron significativamente su actividad frente al EC comparado con el grupo Control [F1, 17=6.21; p=0.0234] (Fig. 3A); y que la actividad de los renacuajos hambreados no difirió significativamente entre los grupos Apareado y Control [F1, 18=0.28; p=0.6048] (Fig. 3B). El análisis del largo RTP en la adquisición mostró que los renacuajos hambreados fueron más pequeños que los bien alimentados [W 1, n=39=474.50, p<0.0040]. Dicha diferencia no se observa en el día de la evaluación ni en el análisis combinando ambos tratamientos [H 3, n=39=2.46, p=0.36] ni examinando cada tratamiento por separado [Tratamiento de Alimentación: W 1, n=39=433.50, p=0.08; Tratamiento de Adquisición: W 1, n=39=365, p=0.62]. En la Tabla 1 se muestran los valores del largo RTP en la adquisición y en la evaluación en función del Tratamiento de Alimentación.
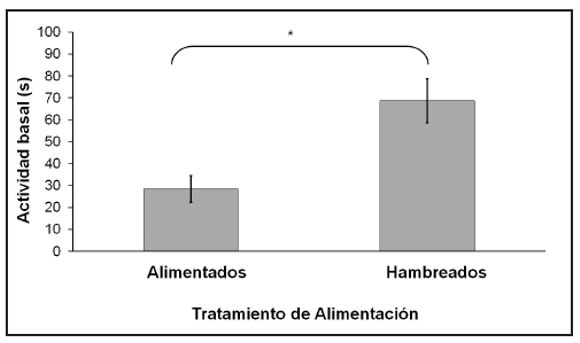
Figura 2. Actividad (en segundos) de los renacuajos durante el periodo pre-estímulo (basal) de la evaluación (D5) en función del Tratamiento de Alimentación. * indica una diferencia significativa. (Hambreados, N=20; Alimentados, N=19).
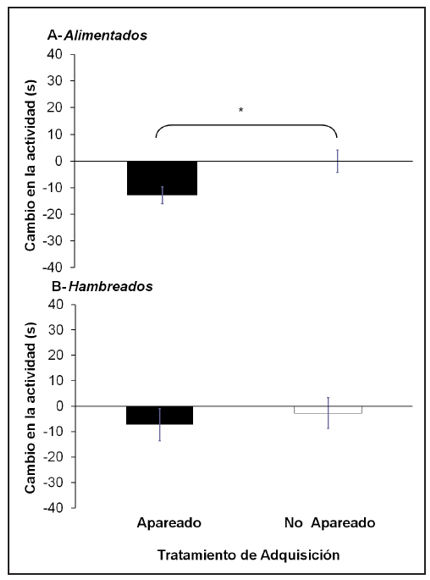
Figura 3. Cambio en la actividad (pos - pre, en segundos) durante la evaluación frente al EC (D5) en función del Tratamiento de Adquisición de los renacuajos que estuvieron bien alimentados (A) o hambreados (B) en la fase de adquisición (D3).* indica diferencia significativa. (N=10 excepto en el grupo Alimentados-No apareado donde N=9).
Tabla1. Largo rostro-tubo proctodeal ± error estandar (mm) de los renacuajos de Pleurodema thaul durante la fase de adquisición (día 3, dos ensayos cada cuatro horas) y la fase de evaluación (día 5, una evaluación de ocho minutos totales) del aprendizaje. Los valores en negrita difieren significativamente entre sí.

El estadio de desarrollo de los renacuajos al final de la evaluación (D5) fue similar a los determinados previo al inicio del experimento (D1), estadios Gosner 28-30.
DISCUSION
Los resultados obtenidos indican que el estado de alimentación modula la capacidad de los renacuajos para aprender en un contexto de riesgo de depredación. Los renacuajos hambreados no parecen generar una asociación entre la señal de daño de conespecíficos y la de anfípodos, esto se observa en la similitud entre las respuestas de los renacuajos hambreados del grupo apareado y control durante la evaluación. Los renacuajos bien alimentados sí adquirieron la asociación entre las señales adicionadas ya que mos traron disminución de la actividad frente a la señal de daño de anfípodo cuando ésta fue previamente asociada con la señal de alarma de conespecíficos y no así cuando recibieron ambos estímulos pero de manera no asociada (control).
El tratamiento de alimentación influyó en el tamaño de los renacuajos al momento de la adquisición, pero la alimentación ad libitum entre la fase de adquisición y de evaluación fue suficiente para que los renacuajos hambreados compensen su tamaño (Capellán y Nicieza, 2007) y no se diferencien de los bien alimentados al momento de la evaluación. Sin embargo, la actividad basal de los renacuajos hambreados sí se diferenció en la fase de evaluación, siendo mayor que la de los renacuajos bien alimentados. Esta mayor actividad basal de aquellos renacuajos hambreados en la adquisición podría relacionarse con un estado fisiológico y/o motivacional generado por el tratamiento de alimentación y que persiste más allá de haber compensado su tamaño (Andrew, 1974; Horat y Semlischt, 1994; Coleman et al., 2005).
En un procedimiento de condicionamiento asociativo el EI tiene gran significancia biológica y el EC adquiere importancia debido a la relación que establece con el estímulo incondicional (Domjan, 2005). Entonces, la falta de asociación entre el EC y el EI de los renacuajos hambreados podría deberse a que durante la fase de adquisición los renacuajos hambreados desarrollan una solución de compromiso entre invertir energía en buscar alimento o responder al riesgo impuesto por EI y en consecuencia limitar su capacidad de aprender (Dukas y Bernays, 2000; Mery y Kawecki, 2003, 2005; Maille y Schradin, 2016). Aunque no adicionamos comida durante la fase de adquisición, las señales adicionadas o las propias heces pueden ser consumidas por los renacuajos (Chivers y Ferrari, 2014; Carlson et al., 2015; Pueta et al., 2016; Pueta, obs. pers.); entonces, el EI no ejercería su efecto biológico relevante el día de la adquisición (riesgo de depredación) y la asociación con el EC no sucedería cuando los renacuajos están hambreados. Además, las características del EC también modulan el procedimiento de aprendizaje y en nuestro experimento, cuando los renacuajos están hambreados, el EC adquiriría una relevancia ecológica de potencial alimento y no de estímulo neutro presente cuando se experimenta riesgo de depredación (Domjan, 2005). En está misma línea, nosotros previamente hemos demostrado que una de las características del EC, tal como la intensidad (concentración de señal de anfípodo), puede modular el aprendizaje en el contexto de riesgo de depredación en renacuajos de P. thaul (Pueta y Perotti, 2016).
En nuestro experimento evaluamos el aprendizaje de los renacuajos a las 48 h de la fase de adquisición y, aunque los resultados de los renacuajos hambreados no muestran diferencia significativa entre el grupo apareado y control, la tendencia de la variable respuesta es una disminución de la actividad en el grupo apareado (Fig. 3B). Por lo tanto, no podemos descartar que la asociación se haya adquirido pero que la retención de la misma sea a más corto plazo debido al estado energético al momento de la adquisición (Hirano y Saito, 2013). Algunos trabajos en peces (Brown y Smith, 1996; Brown et al., 2011) encontraron que la falta total o parcial de alimento no influyó en la capacidad de los peces de aprender, pero si influyó en el tiempo de retención del aprendizaje (memoria), donde los animales mejor alimentados retienen la información adquirida por más tiempo (Brown et al., 2011). Los autores adjudican los cambios encontrados en los tiempos de retención a diferencias en la tasa de crecimiento de los peces al momento de adquirir el aprendizaje (Brown et al., 2011).
El desempeño cognitivo demanda energía, y son varios los cambios fisiológicos que se han descripto como consecuencia de la restricción de alimento y que son potencialmente moduladores de la adquisición o retención de aprendizajes (e.g.: niveles de glucosa en sangre, catabolismo de proteínas) (McCue, 2010; Maille y Schradin, 2016). El aprendizaje es un mecanismo fundamental que permite a los animales ajustar su comportamiento a los cambios en el ambiente (Dunlap y Stephens, 2009; Sutter y Kawecki, 2009). La magnitud de los eventos que generan cambios en la disponibilidad de alimento puede variar ampliamente (Díaz Villanueva, 2006; García, 2010; McCue, 2010), y resulta muy importante conocer que estos eventos podrían interferir en la adquisición de aprendizajes en los renacuajos y afectar, por ejemplo, la detección temprana del riesgo de depredación.
Agradecimientos
A la autoridades de la Secretaria de Medioambiente de la Municipalidad de San Carlos de Bariloche por otorgar el permiso para estudio y colecta en el Parque Municipal Llao Llao (N° 41-AP-2014). A J. C. Tallone por su ayuda en la edición. El presente trabajo contó con el apoyo de la Agencia Nacional de Promoción Científica y Tecnológica (PICT-BID 13-2384 to MP), Consejo Nacional de Investigaciones Científicas y Técnicas (PIP-11220110100782 to MGP) and Universidad Nacional del Comahue (UNCo B 194), Argentina.
LITERATURA CITADA
1. Andrew, R.J. 1974. Arousal and the causation of behaviour. Behaviour 51: 135-165. [ Links ]
2. ASAB 2012. Guidelines for the treatment of animals in behavioral research and teaching. Animal Behaviour 83:301-309. [ Links ]
3. ASIH 2004. Guidelines for Use of Live Amphibians and Reptiles in Field and Laboratory Research. Disponible en: www.asih.org/publications. Último acceso: 26 de octubre de 2016. [ Links ]
4. Bernays, E.A. 1998. The value of being a resource specialist: behavioral support for a neural hypothesis. The American Naturalist 151: 451-464. [ Links ]
5. Brown, G.E. & Smith, R.J.F. 1996. Foraging trade-offs in fathead minnows (Pimephales promelas, Osteichthyes, Cyprinidae): Acquired predator recognition in the absence of an alarm response. Ethology 102: 776-785. [ Links ]
6. Brown, G.E.; Ferrari, M.C.O.; Malka, P.H.; Oligny, M-A.; Romano, M. & Chivers, D.P. 2011. Growth rate and retention of learned predator cues in juvenile rainbow trout: faster growing fish forget sooner. Behavioral Ecology and Sociobiology 65: 1267-1276. [ Links ]
7. Capellán, E. & Nicieza, A.G. 2007. Non-equivalence of growth arrest induced by predation risk or food limitation: context-dependent compensatory growth in anuran tadpoles. Journal of Animal Ecology 76: 1026-1035. [ Links ]
8. Carlson, B.E.; Newman, J.C. & Langkilde, T. 2015. Food or fear: hunger modifies responses to injured conspecifics in tadpoles. Hydrobiologia 743: 299-308. [ Links ]
9. Chivers, D.P. & Ferrari, M.C.O. 2014. Social learning of predators by tadpoles: does food restriction alter the efficacy of tutors as information sources? Animal Behaviour 89: 93-97. [ Links ]
10. Chivers, D.P. & Mirza, R.S. 2001. Importance of predator diet cues in responses of larval wood frogs to fish and invertebrate predators. Journal of Chemical Ecology 27: 45-50. [ Links ]
11. Chivers, D.P. & Smith, R.J.F. 1998. Chemical alarm signalling in aquatic predator-prey systems: a review and prospectus. Ecoscience 5: 338-352. [ Links ]
12. Coleman, S.L.; Brown, V.R.; Levine D.S. & Mellgren R.L. 2005. A neural network model of foraging decisions made under predation risk. Cognitive, Affective, & Behavioral Neuroscience 5: 434-451. [ Links ]
13. Di Rienzo, J.A.; Casanoves, F.; Balzarini, M.G.; Gonzalez, L.; Tablada M. & Robledo, C.W. InfoStat versión 2013. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. [ Links ]
14. Díaz Villanueva, V. 2006. Diatom distribution in a temporary pond from the Patagonian Andes (Fantasma Pond) during drought. Nova Hedwigia 83: 459-472. [ Links ]
15. Domjan, M. 2005. Pavlovian conditioning: a functional perspective. Annual Review of Psychology 56: 179-206. [ Links ]
16. Dukas, R. 1999. Costs of memory: ideas and predictions. Journal of Theoretical Biology 197: 41-50. [ Links ]
17. Dukas, R. 2002. Behavioural and ecological consequences of limited attention. Philosophical transactions of the Royal Society of London B: Biological Sciences 357: 1539-1548. [ Links ]
18. Dukas, R. & Bernays, E.A. 2000. Learning improves growth rate in grasshoppers. Proceedings of the National Academy of Sciences 97: 2637-2640. [ Links ]
19. Dunlap, A.S. & Stephens, D.W. 2009. Components of change in the evolution of learning and unlearned preference. Proceedings of the Royal Society 276: 3201-3208. [ Links ]
20. Ferrari, M.C.O. & Chivers, D.P. 2009. Temporal variability, threat sensitivity and conflicting information about the nature of risk: understanding the dynamics of tadpole antipredator behaviour. Animal Behaviour 78: 11-16. [ Links ]
21. Ferrari, M.C.O. & Chivers, D.P. 2011. Learning about non-predators and safe places: the forgotten elements of risk assessment. Animal Cognition 14: 309-316. [ Links ]
22. Ferrari, M.C.O.; Kapitania-Kwok, T. & Chivers, D.P. 2006. The role of learning in the development of threat-sensitive predator avoidance: the use of predator cue concentration by fathead minnows. Behavioral Ecology and Sociobiology 60: 522-527. [ Links ]
23. Ferrari, M.C.O.; Messier, F. & Chivers, D.P. 2008. Degradation of chemical alarm cues under natural conditions: risk assessment by larval woodfrogs. Chemoecology 17: 263-266. [ Links ]
24. Fraker, M.E. 2008. The effect of hunger on the strength and duration of the antipredator behavioral response of green frog (Rana clamitans) tadpoles. Behavioral Ecology and Sociobiology 62: 1201-1205. [ Links ]
25. García, R.D. 2010. Historia de Vida de la Población del Copépodo Depredador Parabroteas sarsi (Calanoida, Centropagidae) en la Laguna Fantasma. Tesis de Grado, Universidad Nacional del Comahue, Argentina. [ Links ]
26. Gonzalo, A.; Lopez, P. & Martin, J. 2007. Iberian green frog tadpoles may learn to recognize novel predators from chemical alarm cues of conspecifics. Animal Behaviour 74: 447-453. [ Links ]
27. Gonzalo, A.; Lopez, P. & Martin, J. 2010. Risk level of chemical cues determines retention of recognition of new predators in Iberian green frog tadpoles. Behavioral Ecology and Sociobiology 64: 1117-1123. [ Links ]
28. Gosner, K.L. 1960. A simplified table for staging anuran embryos and larvae with notes on identification. Herpetologica 16: 183-190. [ Links ]
29. Hirano, Y. & Saito, M. 2013. Hunger and memory: CRTC coordinates long-term memory with the physiological state, hunger. Communicative & Integrative Biology 6: 25152. [ Links ]
30. Horat, P. & Semlitsch, R.D. 1994. Effects of predation risk and hunger on the behaviour of two species of tadpoles. Behavioral Ecology and Sociobiology 34: 393-401. [ Links ]
31. Houston, A.I.; McNamara, J.M. & Hutchinson, J.M.C. 1993. General results concerning the trade-off between gaining energy and avoiding predation. Philosophical Transactions of the Royal Society of London series B: Biological Sciences 341: 375-397. [ Links ]
32. Jara, F.G. 2010. Plasticidad Fenotípica en Anuros Patagónicos de los Géneros Pleurodema y Rhinella: Respuestas al Hidroperíodo y a los Depredadores. Tesis Doctoral. Univ. Nac. del Comahue. [ Links ]
33. Jara, F.G. 2014. Trophic ontogenetic shifts of the dragonfly Rhionaeschna variegata: the role of larvae as predators and prey in Andean wetland communities. Annales de Limnologie - International Journal of Limnology 50: 173-184. [ Links ]
34. Jara, F.G. & Perotti, M.G. 2010. Risk of predation and behavioural response in three anuran species: influence of tadpole size and predator type. Hydrobiologia 644: 313-324. [ Links ]
35. Jara, F.G.; Úbeda, C.A. & Perotti, M.G. 2013. Predatory insects in lentic freshwater habitats from Northwest Patagonia: richness and phenology. Journal of Natural History 47: 2749-2768. [ Links ]
36. Johnston, T. D. 1982. Selective costs and benefits in the evolution of learning. Advances in the Study of Behavior 12: 65-106. [ Links ]
37. Kandel, E.R.; Jessell, T.M. & Schartz, J.M. 1997. Neurociencia y Conducta. Prentice-Hall. Madrid . [ Links ]
38. Kats, L.B. & Dill, L.M. 1998. The scent of death: Chemosensory assessment of predation risk by prey animals. Ecoscience 5: 361-394. [ Links ]
39. Kiesecker, J.M.; Chivers, D.P. & Blaustein, A.R. 1996. The use of chemical cues in predator recognition by western toad tadpoles. Animal Behaviour 52: 1237-1245. [ Links ]
40. Laughlin, S.B. 2001. Energy as a constraint on the coding and processing of sensory information. Current Opinion in Neurobiology 11: 475-480. [ Links ]
41. Laurila, A.; Kujasalo, J. & Ranta, E. 1997. Different anti- predator behaviour in two anuran tadpoles: effects of predator diet. Behavioral Ecology and Sociobiology 40: 329-336. [ Links ]
42. Leblond, M.; Fan, D.; Brynildsen, J.K. & Yin, H.H. 2011. Motivational state and reward content determine choice behavior under risk in mice. PLoS ONE 6:e25342. [ Links ]
43. Maille, A. & Schradin, C. 2016. Ecophysiology of cognition: How do environmentally induced changes in physiology affect cognitive performance? Biological Reviews doi:10.1111/brv.12270 [ Links ]
44. Mathis, A.; Ferrari, M.C.O.; Windel, N.; Messier, F. & Chivers, D.P. 2008. Learning by embryos and the ghost of predation future. Proceedings of the Royal Society of London B: Biological Sciences 275: 2603-2607. [ Links ]
45. McCue, M.D. 2010. Starvation physiology: Reviewing the different strategies animals use to survive a common challenge. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology 156: 1-18. [ Links ]
46. Mery, F. & Kawecki, T.J. 2003. A fitness cost of learning ability in Drosophila melanogaster. Proceedings of the Royal Society of London B: Biological Sciences 270: 2465-2469. [ Links ]
47. Mery, F. & Kawecki, T.J. 2005. A cost of long-term memory in Drosophila. Science 308: 1148. [ Links ]
48. Mirza, R.S.; Ferrari, M.C.O.; Kiesecker, J.M. & Chivers, D.P. 2006. Responses of American toad tadpoles to predation cues: behavioural response thresholds, threat-sensitivity and acquired predation recognition. Behaviour 143: 887-889. [ Links ]
49. Mogali, S.M.; Saidapur, S.K. & Shanbhag, B.A. 2012. Tadpoles of the bronze frog (Rana temporalis) assess predation risk before evoking antipredator defense behavior. Journal of Ethology 30: 379-386. [ Links ]
50. Polo-Cavia, N. & Gomez-Mestre, I. 2014. Learned recognition of introduced predators determines survival of tadpole prey. Functional Ecology 28: 432-439. [ Links ]
51. Pueta, M. & Perotti, M.G. 2016. Anuran tadpoles learn to recognize injury cues from members of the same prey guild. Animal Cognition 19: 745-751. [ Links ]
52. Pueta, M, Cruz, F.B. & Perotti, M.G. 2016. Feeding regime and food availability determine behavioural decisions under predation risk in Pleurodema thaul (Anura: Leiuperidae) tadpoles. The Herpetological Journal 26: 61-64. [ Links ]
53. Saidapur, S. K.; Veeranagoudar, D.K; Hiragond, N.C. & Shanbhag, B.A. 2009. Mechanism of predator-prey detection and behavioral responses in some anuran tadpoles. Chemoecology 19: 21-28. [ Links ]
53. Schoeppner, N.M. & Relyea, R.A. 2005. Damage, digestion, and defense: the roles of alarm cues and kairomones for inducing prey defenses. Ecology Letters 8: 505-512. [ Links ]
54. Skelly, D.K. 1994. Activity level and susceptibility of anuran larvae to predation. Animal Behaviour 47: 465-468. [ Links ]
55. Sutter, M. & Kawecki, T.J. 2009. Influence of learning on range expansion and adaptation to novel habitats. Journal of Evolutionary Biology 22: 2201-2214. [ Links ]
56. Wisenden, B.D. 2000. Olfactory assessment of predation risk in the aquatic environment. Philosophical transactions of the Royal Society of London B 355: 1205-1208. [ Links ]
57. Wisenden, B.D. 2003. Chemically-mediated strategies to counter predation: 236-251. En: Collin, S.P. & Marshall N.J. (eds.), Sensory Processing in the Aquatic Environment. Springer- Verlag. New York. [ Links ]
58. Wisenden, B.D.; Cline, A. & Sparkes, T.C. 1999. Survival benefit to antipredator behavior in the amphipod Gammarus minus (Crustacea:Amphipoda) in response to injury-released chemical cues from conspecifics and heterospecifics. Ethology 105: 407-414. [ Links ]














