Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Cuadernos de herpetología
versão On-line ISSN 1852-5768
Cuad. herpetol. vol.31 no.2 San Salvador de Jujuy jun. 2017
PUNTOS DE VISTA
Forma, tamaño y tiempo en la ontogenia de Anfibios y Reptiles
Forms, size and time in ontogeny of Amphibians and Reptiles
Marissa Fabrezi1, Silvia Inés Quinzio1, Julio César Cruz1, Mariana Chuliver Pereyra1, Adriana Manzano2, Virginia Abdala3,4, María Laura Ponssa5, Yanina Prieto2, Javier Goldberg1
1 Instituto de Bio y Geociencias del NOA (CONICET). CCT-Salta. 9 de julio 14. Rosario de Lerma-4405, Salta, República Argentina.
2 Centro de Investigaciones Científicas y Transferencia de Tecnología a la Producción. Diamante-3205, Entre Ríos. República Argentina.
3 Instituto de Biodiversidad Neotropical (CONICET-UNT). CCT-Tucumán. Horco Molle sin número. Yerba Buena 4105. República Argentina.
4 Cátedra de Biología General, Facultad de Ciencias Naturales e IML, Miguel Lillo 205. San Miguel de Tucumán- 4000, Tucumán, República Argentina.
5 Unidad Ejecutora Lillo (CONICET-FML). CCT- Tucumán. Miguel Lillo 251. San Miguel de Tucumán-4000, Tucumán, República Argentina.
Recibido: 29/09/16
Revisado: 05/05/17
Aceptado: 17/06/17
ABSTRACT
In the life of an organism (ontogeny), phenotypic changes happen throughout the time. This contribution is a review of: a) terms and definitions used in studies of the ontogeny, b) the importance to distinguish between shape variation (development) and size variation (growth); and c) the need to consider the real time (age) in which the ontogeny takes place. Based on available information about the ontogeny among tetrapods with emphasis in anurans and nonavian sauropsids, it is outlined the need to increase the information about the ontogeny for comparative studies. We denote the relevancy to get tables of development to identify ontogenetic variation, the study of three fundamental components of ontogenies (it forms - size-time), and the processes that the age organizes (development and growth) to contribute the paradigm of the Evolution of the Development.
Key words: Development; Growth; Age; Life cycle; Tetrapods.
RESUMEN
En la vida de un organismo (ontogenia) suceden cambios fenotípicos a lo largo del tiempo. Esta contribución es una revisión de: a) términos y definiciones usados en estudios de la ontogenia, b) la importancia de distinguir entre la variación de la forma (desarrollo) y del tamaño (crecimiento); y c) la necesidad de considerar el tiempo real (edad) en el que se organiza la ontogenia. Sobre la base de información disponible de la ontogenia en tetrápodos con énfasis en anuros y saurópsidos no avianos, se destaca la necesidad de incrementar la información sobre la ontogenia para estudios comparados. Enfatizamos en la relevancia y pertinencia de contar con tablas de desarrollo donde se describa la variación en trayectorias ontogenéticas y el estudio de los tres componentes fundamentales de las ontogenias (forma-tamaño-tiempo) y los procesos que la edad organiza (desarrollo y crecimiento) para avanzar en el paradigma de la Evolución del Desarrollo.
Palabras clave: Desarrollo; Crecimiento; Edad; Ciclo de vida; Tetrápodos.
INTRODUCCIÓN
El estudio de la forma animal implica asumir una serie de premisas: 1) la forma animal resulta de la integración de diversos componentes (células organizadas, órganos y tejidos) que tienen roles individuales; 2) la forma animal tiene una naturaleza dinámica con cambios a lo largo del tiempo (diferenciación); 3) la forma animal tiene condicionamientos que responden a leyes físicas que definen su tamaño en el tiempo (crecimiento); 4) la forma animal tiene la capacidad de realizar una función que resulta de la integración de las partes que la componen en una secuencia temporal definida, es decir que la combinación dinámica de la forma y el tamaño ajusta funciones en el tiempo que tienen consecuencias evolutivas (Alberch et al., 1979).
Durante la embriogenia, se producen tres procesos que afectan a la forma inicial: crecimiento, morfogénesis y diferenciación (Maienschein, 2007). El crecimiento es un proceso que involucra multiplicación celular y posibilita la morfogénesis y la diferenciación (Fig. 1). Las células involucradas en el crecimiento interactúan entre ellas y migran, en un proceso que se denomina morfogénesis, para luego diferenciarse en el momento en que llegan a destino. Sin embargo, y a pesar de que mucho se ha investigado sobre los cambios de forma y tamaño que ocurren durante la embriogenia, es necesario enfatizar que la comprensión de la evolución de la forma animal requiere una visión integrada de su variación en toda la ontogenia.

La ontogenia implica cambios de forma y tamaño que ocurren en la vida de un organismo (edades) desde la fertilización (de Beer, 1940). Corresponde a una trayectoria unidireccional que tiene un comienzo y un final y puede ser analizada como la suma de las trayectorias de los diversos componentes (células organizadas, tejidos y órganos) de la forma. La forma/tamaño de cada componente tiene una secuencia temporal y espacial ordenada, cuyas variaciones interespecíficas son detectadas mediante el análisis comparado (Arthur, 2004). Estas variaciones pueden generarse por 1) alteraciones en los tiempos absolutos de desarrollo (heterocronía), 2) cambios en la secuencia espaciotemporal (repatterning) o espacial (heterotopía), 3) variación en la cantidad de desarrollo o heterometría, y 4) aparición de novedades morfológicas (heterotipia).
Durante mucho tiempo la Anatomía Comparada ha trabajado la forma y el tamaño como atributos estáticos que definen un taxón mientras que la Embriología ha restringido la variación de la forma y el tamaño animal a los cambios iniciales en el desarrollo de taxones modelo. Este hecho ha subestimado la importancia de la variación de la ontogenia en la evolución de los distintos linajes animales. Esta situación comenzó a cambiar al surgir un nuevo paradigma en las Ciencias Biológicas, conocido como Evo-Devo (Evolución del Desarrollo), que intenta comprender de manera integral la evolución de los fenotipos (Müller, 2007).
En este contexto, coincidimos en la necesidad de recuperar el valor del estudio de la forma animal sin perder de vista que es el resultado de las combinaciones entre procesos de desarrollo y crecimiento en el tiempo y su expresión funcional tanto intrínseca como extrínseca. Para ello realizamos una revisión de términos ampliamente usados en estudios comparados cuyos significados, a pesar de resultar familiares, han sido usados de manera ambigua o poco precisa. Discutimos ejemplos de nuestras investigaciones y enfatizamos sobre la necesidad de reconocer y delimitar puntos de referencia (eventos) y segmentos (etapas o períodos) en las trayectorias que nos permitan uniformizar criterios para realizar comparaciones entre ontogenias. Nuestro objetivo es despertar el interés por el estudio de la forma animal no como una instantánea o fotografía sino como una secuencia de fenotipos en el tiempo cuya consecuencia es el proceso de evolución animal.
Conceptos claves en el estudio de la ontogenia
Eventos claves en una trayectoria ontogenética: la ontogenia transcurre en un tiempo finito comprendido entre un momento inicial y un momento final. Entre ellos, existen etapas o períodos delimitados por eventos muy claros y definidos. Estos (eventos y etapas) se utilizan en la comparación de la ontogenia de la mayoría de los grupos animales. Bajo esta concepción, los eventos más importantes de una trayectoria son la fertilización, eclosión, madurez sexual y muerte y las etapas que delimitan son la embrionaria, juventud y adultez (Fig. 2A). En el caso del ciclo de vida complejo o bifásico, la etapa larval sucede a la embrionaria y existen diferentes interpretaciones sobre el evento que correspondería a la eclosión (Fig. 2B).

La fertilización ocurre cuando dos células sexuales y haploides (gametas) se fusionan (singamia) para crear una nueva célula diploide llamada huevo o zigoto. La fertilización tiene dos consecuencias: la combinación de genomas derivados de dos progenitores que se transmiten a la descendencia y el comienzo de las interacciones que permiten que el desarrollo proceda (Gilbert, 1997). Hall (1992) sostiene que la fertilización es la primera y la más importante interacción epigenética de la ontogenia, ya que dos células completamente diferentes (óvulo y espermatozoide) interactúan y se fusionan bajo circunstancias naturales. Estas interacciones se dan en la siguiente secuencia: 1) reconocimiento y vinculación entre el espermatozoide y la matriz extracelular que rodea al óvulo; 2) penetración a través de la cubierta y reacción acrosómica; y 3) vinculación y subsecuente fusión entre el espermatozoide y la membrana plasmática del ovocito (Meslin et al., 2012). Una vez que estas interacciones se han producido puede ocurrir la fusión del material genético. La fertilización es un punto de referencia para dar comienzo a la ontogenia.
La eclosión es un evento físico-químico por medio del cual el individuo abandona el huevo e inicia su vida libre. Los términos nacimiento y eclosión pueden ser usados indistintamente. En los grupos vivíparos, particularmente mamíferos, el nacimiento de nuevos individuos está controlado en gran medida por las contracciones del útero de la madre. En anamniotas y amniotas ovíparos, el evento de eclosión o nacimiento tiene que ver con el esfuerzo del embrión para despojarse de las membranas que lo rodean sin participación alguna de la madre (Gilbert, 1997). En los saurópsidos, monotremas y anuros con desarrollo directo, existe una estructura tegumentaria y dehiscente llamada diente del huevo con la que el embrión rompe la cáscara para eclosionar.
Es importante destacar que el concepto de vida libre se refiere a la adquisición de capacidades individuales para el movimiento y la alimentación en un ambiente no limitado y distinto al medio materno (i.e. envolturas de huevo, útero, oviducto). Sin embargo, existen algunas excepciones a esta definición tan precisa. En los marsupiales, por ejemplo un neonato no es un individuo de vida libre ya que no tiene capacidades para la termorregulación y locomoción que son suplidos en el marsupio materno. La eclosión o nacimiento no implica el inmediato funcionamiento del mecanismo de alimentación y/o locomoción. Los reptiles recién eclosionados se alimentan de restos vitelinos por ejemplo (Fig. 1E).
En formas con ciclo de vida complejo, la eclosión origina una serie de formas de vida libre que en anuros conocemos como renacuajos (Fig. 2B).
La madurez sexual es un punto en el que convergen aspectos morfológicos, fisiológicos y del comportamiento que determinan la adquisición de capacidad reproductiva. Entre los aspectos morfológicos, nos referimos a la finalización de la gonadogénesis y diferenciación de conductos asociados a las gónadas, la aparición de caracteres sexuales como la genitalia externa, coloración, ornamentaciones y anexos tegumentarios y en determinados casos, un tamaño mínimo distinto para hembras y machos. Los aspectos fisiológicos y bajo control de hormonas sexuales se refieren a que se completa el primer ciclo de gametogénesis. Finalmente, entre los aspectos comportamentales también hay un control endócrino que actúa en la selección de pareja, cortejo, vocalización, etc.
Del conjunto de eventos de una trayectoria ontogenética, la madurez sexual es el más difuso y difícil de definir en ausencia de reproducción.
La muerte es el evento terminal de la ontogenia que consiste en la extinción de los procesos homeostáticos de un organismo.
Etapas claves en las trayectorias: son conjuntos o secuencias de (fenotipos) o estadios de desarrollo y se reconocen como embriogenia, juventud y adultez. De acuerdo a Richardson (1999) los estadios del desarrollo son "agrupamientos temporales de estados de caracteres morfológicos" lo cual resume e integra los componentes temporales y espaciales del desarrollo (Fig. 3).

Figura 3. Cortes transversales de la falange subterminal del dedo IV de la pata en especimenes adultos de Ceratophrys cranwelli. A, especimen macho (LHC 81 mm) con 11 ±1 LAGs. B, especimen macho (LHC 84,6 mm) con 14 ±1 LAGs. Tinción de Hematoxilina - Eosina.
La embriogenia inicia la trayectoria ontogenética de un individuo entre la fertilización y la eclosión. Para un linaje dado, la embriogenia puede mostrar variación significativa en cuanto a su duración. Para que comience el desarrollo embrionario existen dos condicionamientos fundamentales: a) la formación de un nuevo genoma y b) la expresión de esa información asociada a la estructura espacial y a la interacción de los componentes del zigoto que ya mencionamos y que se denominan interacciones epigenéticas (modificaciones del fenotipo no genéticas). Todos los estadios del desarrollo embrionario ocurren separados del ambiente externo por las envolturas embrionarias y/o membranas del huevo y dependen de nutrientes maternos (Arthur, 2004). Los embriones iniciales corresponden a los estadios de clivaje, de blástula y de gástrula (con predominio de procesos morfogenéticos), mientras que los embriones tardíos son aquellos en los que predomina el crecimiento y la diferenciación, por ello en estos se incrementa la diversidad de formas (Figs. 1 y 2). La embriogenia es un período en el que reglas o restricciones del desarrollo (developmental constraints) mantienen cierta estabilidad fenotípica (Schwenk y Wagner, 2003) pero a medida que se incrementa la complejidad, se expande la variación estructural y así, un proceso de morfogénesis en el que predominan las mismas reglas, puede conducir a la diferenciación de una aleta, un brazo o un ala (Shubin y Alberch, 1986).
La embriogenia ofrece un abanico de posibilidades de variación temporal y espacial en un linaje. En algunos organismos, se puede enlentecer la actividad metabólica hasta el punto de simular un detenimiento del desarrollo, proceso llamado diapausa embrionaria, como ocurre en grupos de vertebrados amniotas como tortugas, camaleones (Andrews y Donoghue, 2004), canguros, osos hormigueros, mulitas, pandas y murciélagos (Sandell, 1990; Knott et al., 2013). El tiempo en que el embrión pasa en un estadio de diapausa es variable y depende de las condiciones ambientales; sin embargo esta variación temporal no tiene consecuencias para el embrión al momento de eclosionar. En las tortugas de agua dulce Phrynops hilarii, con dos puestas por año, una en otoño (comienzo la temporada de bajas temperaturas y de altos niveles hidrométricos o inundaciones) y otra en primavera-verano (altas temperaturas y bajos niveles hidrométricos), inmediatamente iniciado el desarrollo comienza la diapausa. Dependiendo de la temporada, la diapausa será de larga (más o menos 8 meses) o corta duración (más o menos 3 meses). Lo curioso e interesante es que los embriones de ambas puestas sincronizan el nacimiento en temporada con temperatura y humedad favorables para la supervivencia de los recién eclosionados (Booth, 2002; Prieto, 2015).
A medida que avanza la embriogenia las características diagnósticas del linaje al que pertenece el embrión se van diferenciando (por ejemplo las extremidades, el caparazón, algunas estructuras tegumentarias como las cubiertas de las mandíbulas, plumas, pelos y escamas; Fig. 2A). En los animales con desarrollo directo, la embriogenia avanza hasta la completa diferenciación de los órganos y sistemas, de manera tal que en el momento de iniciar la vida libre el individuo cuenta con la mayoría de las capacidades para cumplir con sus funciones vitales.
En anfibios con ciclos de vida complejos, los estadios larvales comprenden trayectorias ontogenéticas de individuos que llevan una vida autónoma ya que son capaces de alimentarse y/o de trasladarse por sí mismos, con morfología, fisiología y ecología diferente del adulto. La etapa larval comprende desde la eclosión hasta el final de la metamorfosis (Fig. 2B). La diversidad morfológica y ecológica de las larvas incluye formas sin capacidad de alimentarse (especies en las que el período larval se cumple a expensas del vitelo materno o larvas endótrofas) y/o trasladarse (ranas marsupiales, dendrobátidos) hasta aquellas especies en las que los procesos de desarrollo son tan rápidos e intensos que las larvas son más parecidas morfológica y ecológicamente a los adultos (Fabrezi y Quinzio, 2008; Fabrezi, 2011; Fabrezi et al., 2016).
Resulta importante destacar que el término larva no implica un grado de homología entre diferentes grupos animales sino más bien refiere a los estadios posteriores al embrión, que necesariamente deben pasar por un proceso de metamorfosis (Minelli, 2003). La metamorfosis es un conjunto de cambios ontogenéticos abruptos e irreversibles entre un estado postembrionario de vida libre multicelular (larva) a un estado pre-reproductivo (juvenil), que implica la transformación del plan corporal (Heyland et al., 2005) (Fig. 2B). La metamorfosis involucra procesos de desarrollo que implican pérdida de estructuras larvales, formación de nuevas estructuras que serán funcionales en el adulto y remodelación de otras (Dodd y Dodd, 1976).
En la literatura, la larva ha sido considerada: a) como el producto de procesos morfogenéticos que gradualmente transforman al embrión en una forma más compleja (Darwin, 1859); b) como estadios adicionales en los ciclos de vida con diferenciación postembrionaria que se elimina en la transición metamórfica (Wassersug, 1975; McEdward y Janies, 1993); y c) como estadios juveniles no reproductivos (de Beer, 1940).
En la Figura 2 se muestra un esquema que representa nuestra interpretación de los ciclos de vida complejos, siguiendo la opción b) antes mencionada. En esta interpretación la trayectoria adicional que incluye los estadios larvales y la metamorfosis se considera resultado de repatterning [cambios espacio-temporales sin consecuencias en la forma final (Zelditch, 2003)]. En la etapa larval, coexisten tres conjuntos de sistemas de cambio ontogenético: a) sistemas de órganos y elementos anatómicos que se remodelan durante la metamorfosis (por ejemplo arcos viscerales, sistema digestivo, piel) y que presentan una secuencia temporal y espacial diferente en las formas con desarrollo directo; b) sistemas de órganos y elementos anatómicos que son exclusivos de los estadios larvales (branquias internas, cola, estructuras orales queratinizadas) que podrían ser asumidas como novedades morfológicas y que desaparecen durante la metamorfosis; y c)sistemas de órganos y elementos anatómicos que serán funcionales a partir de la metamorfosis (por ejemplo, las extremidades, las gónadas) y son los que nos permite establecer ciertas equivalencias entre estadios larvales y embriones de taxones con desarrollo directo. El resultado al finalizar la metamorfosis es la formación de un plan corporal similar al del adulto y comparable con un recién nacido de las especies con desarrollo directo (Fig. 2).
La juventud comprende fenotipos de vida libre desde la eclosión, o fin de la metamorfosis, hasta la madurez sexual. Las trayectorias ontogenéticas más importantes de la juventud implican principalmente crecimiento somático y procesos de desarrollo relativos a la maduración sexual (Figs. 2-4). En general, los juveniles han alcanzado el plan corporal adulto y la mayoría de los sistemas son funcionales, especialmente la alimentación y locomoción (McEdward y Janies, 1993). El comienzo de la juventud implica una paulatina puesta en marcha de las funciones y capacidades de la vida libre. Por ejemplo, en las tortugas de agua dulce, los "juveniles tempranos" no se alimentan los primeros 15 días post-eclosión ya que se nutren de los restos de vitelo (Packard et al., 1988; Prieto, 2015) (Fig. 1E).

De Beer (1940) distingue las estructuras juveniles, como todo aquello que aparece o se desarrolla previo al estadio adulto, considerando esto último como la adquisición de la forma y tamaño final. Este criterio ha sido seguido por numerosos autores que definen diferentes estadios juveniles sobre la base del grado de osificación, la microhistología ósea, cantidad de vascularización de los huesos y/o ausencia de fusión de epífisis y diáfisis (Banbury y Maglia, 2006; Horner et al., 2000; Maisano, 2002), patrones de coloración (Pérez i de Lanuza et al., 2012) o simplemente en un tamaño sustancialmente menor al que se ha señalado como máximo en una especie (Ponssa et al., 2010; Streicher et al., 2012; Lange et al., 2012; Esperón Rodriguez y Gallo Reynoso, 2013; Vera y Ponssa, 2014; Vera et al., 2015). La definición de juvenil, por lo tanto, se basa tácitamente más en la ausencia de algo en relación al adulto (madurez sexual, tamaño máximo, etc.) que en una caracterización morfológica particular.
Otro problema que surge al analizar la etapa de juventud representa su extensión. Si se considera la juventud en su concepción de "sin cambios morfológicos" podría pensarse al tamaño (el cual cambia) como un indicador indirecto de la edad lo cual conlleva ignorar que: 1) el tamaño no aumenta necesariamente con el tiempo y 2) el crecimiento de los individuos depende de múltiples factores ambientales e intrínsecos, por lo cual no siempre hay una correspondencia directa entre tamaño y edad. En este sentido, una serie de tamaño no debería ser considerada sinónimo de serie ontogenética; las observaciones y conclusiones que posibilita la primera pueden estar sesgadas por diferencias de tamaño entre individuos de una misma especie. En algunas especies de anuros (e.g. Pseudis sp., Telmatobius atacamensis y Chacophrys pierottii) el tamaño al finalizar la metamorfosis es ligeramente menor que el tamaño de los adultos y por ello no resulta fácil distinguir a simple vista si un espécimen sin saco vocal (carácter sexual secundario del macho) es un individuo recién metamorfoseado o una hembra adulta (Fabrezi y Quinzio, 2008; Fabrezi et al., 2009; 2010). Algo parecido podría ocurrir en las especies miniatura.
Existen diferentes técnicas para determinar la edad cuya aplicación depende del tipo de organismo y de las etapas del desarrollo que se analizan. Se pueden obtener datos de la edad al criar especímenes en cautiverio o laboratorio, aunque extrapolar los resultados de condiciones no naturales simplifica o reduce las variables extrínsecas que influyen en la ontogenia (Packard, 1999). En animales en condiciones naturales, la captura, marcado y recaptura de individuos permite obtener información de la edad y el tamaño de los individuos y facilita la obtención de datos demográficos, pero requiere de poblaciones estables (Schmidt et al., 2002; Campbell et al., 2009; Lettink, 2012).
La esqueletocronología (Hemelaar, 1985; Leclair y Castanet, 1987) ha sido amplia y exitosamente utilizada para estimar la edad en distintos grupos de vertebrados (Tucker, 1997; Valdecantos et al., 2007; Matsuki y Matsui, 2009). Consiste en diferenciar períodos de crecimiento activo y de crecimiento lento en el tejido óseo en especies de vertebrados de áreas con estacionalidad (Fig. 3) y al combinar parámetros como el tamaño y la edad, y otro tipo de información morfológica (e.g. sexo) se pueden estimar tasas de crecimiento (Castanet, 1978). Además tiene la ventaja de poder ser aplicada en especímenes de colección (Fabrezi y Quinzio, 2008; Casale et al., 2011; Snover et al., 2013). Esta técnica ha sido usada en el análisis de trayectorias ontogenéticas y ha permitido estimar tasas de crecimiento en varios grupos de tetrápodos (Zug et al., 2002; Goshe et al., 2010; Mouden et al., 1999; Roitberg y Smirinia, 2006; Tinsley y Tocque, 1995; Jakob et al., 2002; Erişmiş et al., 2009). Sin embargo, se podría cuestionar que el depósito de los anillos puede alterar su periodicidad por condiciones ambientales (Duarte Varela y Cabrera, 2000) y/o la posible resorción de anillos (Chen et al., 2011; Mao et al., 2012; Gutiérrez et al., 2013).
Los caracteres y/o atributos relacionados con el desarrollo sexual, también podrían ser indicadores de etapas juveniles. En algunas especies, las formas no reproductivas presentan un patrón de coloración particular que nos permite asignarlos a categorías juveniles (Pérez i de Lanuza et al., 2012). Sin embargo, en ausencia de caracteres de la morfología externa, los juveniles son reconocidos por las características de sus órganos sexuales internos y/o por el estado de sus gónadas.
La etapa juvenil ha tenido un lugar menor en la diagnosis de los fenotipos a pesar de la cantidad de ejemplos que revelan la importancia de conocer las trayectorias ontogenéticas de órganos y sistemas en esta etapa. Por ejemplo, en las serpientes de la familia Viperidae que presentan gran variabilidad tanto en la morfología de la cabeza como en los tipos de presas que consumen, hay un alto grado de especialización morfológica en el cráneo en relación con la edad. En los juveniles, la forma y tamaño de estructuras cefálicas tales como el largo del hueso cuadrado, largo de las mandíbulas y ancho general de la cabeza difieren entre las serpientes especialistas -que comen solo mamíferos durante toda su vida- y las generalistas -que comen otro tipo de presas como anfibios, reptiles y recién en estadios adultos- mamíferos (Cundall y Greene, 2000; López et al., 2013).
La caracterización de juveniles sobre la base de forma, tamaño y edad hace posible detectar desviaciones importantes de las ontogenias (Figs. 4 y 5). Por lo menos una de las especies de ranas del género Pseudis se caracterizan porque el crecimiento, el desarrollo somático y la gonadogénesis alcanzan sus etapas finales al finalizar la metamorfosis (Fabrezi y Goldberg, 2009; Fabrezi et al., 2009; 2010) (Fig. 5). Esta combinación de trayectorias ontogenéticas que implican diferencias con otras es vista en ontogenias muy particulares (de Beer, 1930; Gould, 1977; Reilly et al., 1997) y pone de manifiesto la capacidad de variación y evolución de las distintas etapas de la ontogenia.
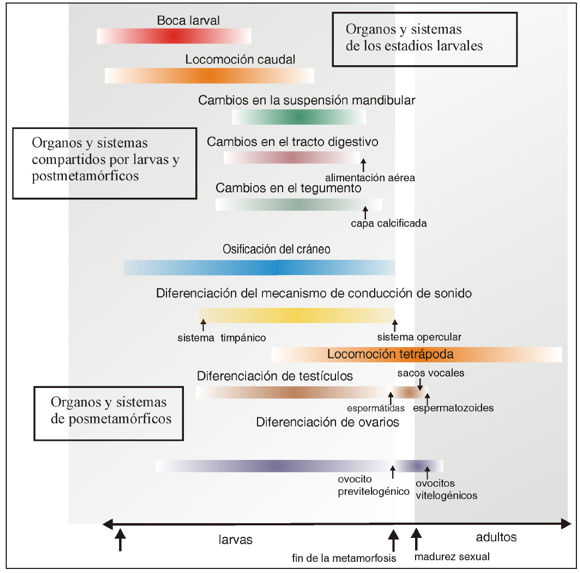
Figura 5. Representación esquemática de las trayectorias ontogenéticas que ocurren después de la eclosión e inicio de la vida libre en Pseudis platensis (datos tomados de Fabrezi et al., 2010). Como en la mayoría de los anuros, la metamorfosis es un proceso que determina la desaparición de sistemas y órganos larvales o la transformación de otros. En esta especie, el desarrollo de órganos y sistemas que no son afectados o influenciados por la metamorfosis parecen alcanzar su forma postmetamórfica al finalizar la metamorfosis.
La adultez corresponde a los estadios de un organismo cuyo tejido reproductivo se vuelve funcional, es decir presenta madurez gonadal, acompañado de dimorfismo sexual, si es que existe (www.xenbase.org; http://rgd.mcw.edu). Convencionalmente se considera que la adultez implica que el desarrollo se ha completado. De Beer (1940) describió a la forma adulta como el resultado final de la ontogenia, mientras que Gould (1977) consideró que es la llegada a la madurez sexual. En general, existe una concepción de ver al adulto como una forma final rígida, inmodificable con un diseño complejo y altamente específico para su modo de vida.
Alcanzar el estadio adulto implica no sólo desarrollo, en el que se incluye la maduración y capacitación de las células germinales y la diferenciación de caracteres sexuales secundarios, sino también crecimiento. Sin embargo el desarrollo nunca se completa enteramente, ya que la forma de un organismo no se fija definitivamente y la diferenciación celular no cesa durante su vida (Kellicot, 1913). Resulta interesante destacar que la forma adulta, madura sexualmente, puede ser alcanzada antes de que algunos procesos de crecimiento se hayan detenido, es decir que el tamaño a la madurez sexual y el tamaño máximo que una especie puede alcanzar no son necesariamente coincidentes. Por otra parte y dentro de los límites de una especie, la edad de adultez de machos y hembras puede ser diferente y eso implica una variación en tamaño-forma en función del tiempo que corresponde al dimorfismo sexual.
En una ontogenia, la adultez comprende a todos los estadios capaces de reproducirse, involucra envejecimiento y senescencia y su punto final es la muerte. El envejecimiento es el proceso biológico que involucra una serie de cambios estructurales y funcionales que aparecen con el paso del tiempo ("desgaste") y no son consecuencia de enfermedades ni accidentes, mientras que la senescencia es el proceso degenerativo complejo que termina naturalmente con la vida funcional de un órgano u organismo. Senectud y envejecimiento parecerían superponerse y definir una etapa de la adultez asociada a la disminución de la efectividad y eficiencia de ciertas funciones como por ejemplo la reproducción, locomoción, etc. Esta etapa ha sido escasamente considerada en el contexto de la Biología Comparada, posiblemente porque se asume que un animal en condiciones naturales rara vez la alcanza (Kirkwood y Rose, 1991; Monaghan et al., 2008; entre otros). Exceptuando a los mamíferos y en especial a los humanos, son limitados los casos en los que se estudian los posibles efectos de la vejez y la senectud sobre los fenotipos. Kara (1994) describe en anfibios el aumento de las uniones de las fibras paralelas de colágenos (cross-linking), la acumulación de pigmentos en la piel y la disminución del metabolismo como algunos efectos de la senescencia y el envejecimiento. Smirnov (1994) describe la aparición de huesos supernumerarios y asimetrías de huesos en especímenes de Xenopus laevis criados en laboratorio durante varios años. También se ha descrito la senescencia en el músculo esquelético en mamíferos tanto de pequeño como gran tamaño (Hindle et al., 2009a; 2009b; Hämäläinen et al., 2015) y algunas evidencias de senescencia fisiológica en parámetros hematológicos (hematocrito, albumina, creatinina) de especímenes salvajes del ciervo Capreolus capreolus (Jégo et al., 2014).
Los estudios de esqueletocronología y los datos directos de edad permitirían ordenar las secuencias de adultos para establecer trayectorias ontogenéticas de los cambios de forma-tamaño (incluyendo los relacionados con la vejez y la senectud). En algunas especies de Ceratophrys (Anura, Ceratophryidae), la presencia de placas óseas dorsales puede considerarse un signo de adultez o quizás de senescencia. En C. cranwelli, los escudos dorsales están ausentes en especímenes con menos de 70 mm de longitud hocico cloaca; mientras que en especímenes de mayor talla, el número de escudos (7-11) incrementa con la edad (11-14 anillos de crecimiento, Fig. 3) y el tamaño (74-84 mm), lo que sugiere que la presencia de estas estructuras depende de un tamaño y/o edad mínimos (Fabrezi y Quinzio, 2008; Quinzio y Fabrezi, 2012).
Este breve repaso de las distintas etapas de la ontogenia y de las particularidades de los ciclos de vida, demuestra que los cambios en la forma y el tamaño tienen trayectorias independientes. Paralelamente, destaca que la variación temporal nos permite distinguir cuál es la posición de una determinada forma/tamaño en la trayectoria ontogenética. Así, una trayectoria ontogenética acompañada de los tiempos en que transcurre resulta necesaria para interpretar como varían las tasas y velocidades en procesos de desarrollo y crecimiento.
Tablas de desarrollo
El estudio de los cambios durante la ontogenia requiere de aproximaciones que permitan ordenar temporalmente la variación fenotípica. En distintos grupos se han propuesto tablas de desarrollo con una subdivisión en estadios discretos y ordenados, cada uno de los cuales es una imagen separada arbitrariamente del eje temporal de la etapa, en la vida de un organismo que se analice (de Beer, 1940). El orden temporal (secuencia), nos permite comparar individuos en etapas de la ontogenia que definimos como equivalentes. Cada estadio es designado por un número, letra o cualquier convención que permita organizar la secuencia unidireccional que representa un intervalo específico en la ontogenia.
En general, una tabla de desarrollo facilita la identificación de estadios sobre la base de caracteres exomorfológicos claramente definidos (pliegues neurales, esbozo de la extremidad, etc.) (Hoopwood, 2007). Si bien el uso de caracteres de la morfología externa facilita la comparación de organismos enteros, se pueden organizar tablas de desarrollo también de sistemas y órganos internos. Una de las tablas de uso más extendido en los estudios herpetológicos es la tabla de desarrollo de Xenopus (Nieuwkoop y Faber, 1994), que caracteriza en simultáneo, la morfología larval y su correlato con la anatomía interna de cada estadio.
Otra característica de las tablas de desarrollo es que representan una secuencia graficada de morfologías. En una tabla, el carácter o los caracteres diagnósticos de un estadio deben ser ilustrados con la mayor claridad. Si el carácter que define el estadio es evaginación del dedo IV, este carácter debe ser mostrado mediante una ilustración (dibujo y/o fotografía) que facilite su reconocimiento.
Los caracteres que se usarán para diagnosticar los estadios deben ser indiscutibles, por ejemplo: presencia de una papila en el borde del labio; 3 hileras de dientes, largo del esbozo igual a dos veces el ancho, etc. Cada estadio debe ser descrito de manera concisa, telegráfica y sin usar verbos, independientemente de la condición precedente y subsecuente, por ejemplo: ángulo de la boca entre la narina y el ojo; esbozo de la pata en forma de paleta.
Cuando la serie ontogenética se obtiene a partir de la cría en condiciones de laboratorio o cautiverio, la información sobre los tiempos en que ocurren los estadios o las etapas y algunas condiciones de cría (temperatura, iluminación, volumen de agua, acidez, cantidad de alimento) constituyen datos adicionales muy importantes que se deben agregar como observaciones en la tabla. Sin embargo, las series ontogenéticas obtenidas en el campo, tienen un atributo fundamental que es que nos proveen del tiempo entre estadios que nos aproxima a la condición natural y real para una especie, aun cuando no podamos cuantificar variables que en laboratorio pueden ser controladas.
Para los distintos grandes grupos de vertebrados, se han elaborado tablas de desarrollo en especies modelo, en especies de criadero y/o domésticas y en especies silvestres (Tablas 1 y 2) y en algunos casos incluyen la variación en rasgos de la morfología interna. Mientras más específica sea la tabla, más detallada será la caracterización de los estadios (Dünker et al., 2000). Por ejemplo en anuros, dos tablas de desarrollo embrionario y larval son ampliamente usadas: la tabla de Nieuwkoop y Faber ( 1994) para el pípido Xenopus laevis que describe 66 estadios desde la fertilización hasta la ausencia completa de cola y la tabla de Gosner (1960) que resume en 46 estadios el desarrollo embrionario y larval de Incillus valliceps. Esta última es más simple y sus estadios resultan más fáciles de identificar en la mayoría de los anuros que tienen larvas tipo IV (diferentes a las larvas tipo I de los Pipoidea); sin embargo la tabla de desarrollo de Xenopus laevis es más informativa ya que hace referencia al desarrollo de órganos y sistemas de la anatomía interna.
Tabla 1. Información disponible en formato de tablas de desarrollo para los anfibios. El volumen de información publicada no representa ni el 1,5% de la diversidad de anfibios actuales y con familias en las que se desconocen la mayoría de los aspectos de sus ontogenias. EE: estadios embrionarios; EL: estadios larvales; EM: estadios metamórficos. DCN; desarrollo en condiciones naturales; DCL: Desarrollo en condiciones de laboratorio; DI: desarrollo interno; ME: morfología externa; E: esqueleto; Hi: histología.
.png)
.png)
.png)
Tabla 2. Información disponible en formato de tablas de desarrollo para los saurópsidos no avianos. Los datos condensados en esta tabla representan menos del 1% de la diversidad del grupo y los trabajos seminales hasta la década del '60 fueron compilados en Gans & Billet (1985). En el caso de las serpientes, el vacío de información es manifiesto para algunos grupos basales (tiflópidos y leptotiflópidos) y los muy diversos colúbridos.EE: estadios embrionarios; EL: estadios larvales; EM: estadios metamorficos. DCN; desarrollo en condiciones naturales; DCL: Desarrollo en condiciones de laboratorio; ME: morfología externa; E: esqueleto; HI: histología.
.png)
.png)
Las Tablas 1 y 2 presentan una versión sintética de la información disponible sobre el desarrollo en dos grupos de tetrápodos. En ellas se ponen en evidencia el énfasis que existió en el estudio del desarrollo inicial con una caracterización de estadios tempranos que implican sobre todo morfogénesis. Esto tiene que ver con la dificultad de organizar series ontogenéticas y también por la presunción de la ausencia de cambio morfológico cuando el organismo ha alcanzado un plan corporal que no cambiará.
En anfibios (Tabla 1), en los que el desarrollo externo facilita el estudio del desarrollo embrionario y larval y es factible obtener datos sobre los tiempos y variables ambientales en las que se produce el desarrollo, se puede acceder a tablas de desarrollo para menos de 120 especies que representan una insignificante fracción del total de las especies existentes. Sobre la variación de la ontogenia posteclosión/postmetamorfosis todavía no existe información que nos permita describir patrones relativos a tasas de crecimiento y tasas de desarrollo de juveniles y/o procesos de envejecimiento y senectud. En este contexto, un caso interesante de la evolución del desarrollo ha sido descrito en Xenopus laevis de criaderos en los que la aparición espontánea de renacuajos sin tiroides que crecen por largos períodos de tiempo sin metamorfosear nos plantean la posibilidad de la existencia de larvas (como una extensión del desarrollo postembrionario) que sufren envejecimiento y senectud (Rot-Nikcevic y Wassersug, 2003; 2004; Kerney et al., 2009).
En los saurópsidos, con excepción de la abundante literatura para las aves, el desarrollo inicial es poco conocido (Tabla 2). En general la mayoría de las tablas de desarrollo embrionario comienzan en el momento de la oviposición y poco se sabe de los tiempos del desarrollo embrionario inicial entre la fertilización y la oviposición. La incorporación de esta información al estudio de las ontogenias y la construcción de tablas de desarrollo serían bienvenidas para comprender la biodiversidad de linajes tan disímiles.
Los mamíferos son el grupo mejor estudiado en todas las etapas de la ontogenia y algunos linajes, como aquellos que pueden ser criados en cautiverio y que tienen una elevada fertilidad y rápido desarrollo (e.g. conejos, ratas, comadrejas), son usados como modelo por las ciencias experimentales. Desde el punto de vista de la Evo-Devo, los estudios de la ontogenia llevados a cabo en los murciélagos han puesto en evidencia cómo la edad, el tamaño y ciertos caracteres fenotípicos se han combinado en este grupo con resultados que incrementaron su diversificación y longevidad (Barja, 2002; Brunet-Rossinni, 2004; Brunet-Rossinni y Austad, 2004; Cretekos et al., 2005). Las investigaciones realizadas en los murciélagos han proporcionado una perspectiva novedosa sobre el papel de la edad en la evolución animal (Brunet-Rossinni y Austad, 2004).
Consideraciones finales
Desde nuestro punto de vista, los tres componentes fundamentales de las ontogenias (forma-tamaño-tiempo) y los procesos que la edad organiza (desarrollo y crecimiento) son el gran aporte de la Morfología al estudio de la evolución de los fenotipos que propone la Evo-Devo (Evolución del Desarrollo).
Aquí, hemos destacado la riqueza de información que el estudio de toda la ontogenia puede proporcionar para comprender la variación de la forma animal y también enfatizamos en la necesidad de organizar e incrementar la información sobre secuencias y tablas de desarrollo ya que hasta el momento sólo se conoce una pequeña fracción de la diversidad existente, sólo en el caso de los tetrápodos.La información, sintetizada en formato de tabla de desarrollo, que puede describir una trayectoria ontogenética como la juventud en un taxón dado, constituye una herramienta que en la formación del biólogo no tiene la dimensión que debería tener. Más aun cuando el término biodiversidad se hace cada vez más frecuente, es necesario asumir que a) una especie es algo más que la diagnosis de un estado de la ontogenia, b) que la ontogenia es variación del tamaño y la forma en el tiempo, y c) que la variación en el tiempo, es evolución.
Agradecimientos
Los autores agradecen a Fernando Lobo, Agustín Scanferla, Florencia Vera Candioti, Miriam Vera, Jessica Fratani y Gabriela Fontanarrosa por sus aportes a la discusión planteada en el marco del taller financiado por el PICT 616 (a MF) y que dio origen al primer manuscrito de este trabajo. A los editores de Cuadernos de Herpetología, Diego Baldo y David Buckley por haber contribuido a una revisión detallada que mejoró la versión final. El financiamiento de esta investigación corresponde a fondos de la Agencia Nacional de Promoción Científica y Tecnológica: PICT 616 y 510.
LITERATURA CITADA
1. Agarwal, S.K. & Niazi, I.A. 1977. A normal table of developmental stages of the Indian bull frog, Rana tigrina Daud (Ranidae, Anura, Amphibia). Proceedings of the National Academy of Sciences, India - Section B: Biological Sciences 47: 79-92. [ Links ]
2. Alcala, A.C. 1962. Breeding behavior and early development of frogs of Negros, Philippine Islands. Copeia 1962: 679-726. [ Links ]
3. Alberch, P.; Gould, S.J.; Oster, G.F. & Wake, D.B. 1979. Size and shape in ontogeny and phylogeny. Paleobiology 5: 296-317. [ Links ]
4. Amiet, J.L. 1970. Morphologie et développement de la larve de Leptodactylodon ventrimarmoratus (Boulenger) (Amphibien: Anoure). Annales de la Faculte des Sciences du Cameroun 4: 53-71. [ Links ]
5. Amin, N.M.; Womble, M.; Ledon-Rettig, C.; Hull, M.; Dickinson, A. & Nascone-Yoder, N. 2015. Budgett's frog (Lepidobatrachus laevis): A new amphibian embryo for developmental biology. Developmental Biology 405: 291-303. [ Links ]
6. Anderson, P. 1943. The normal development of Triturus pyrrhogaster. Anatomical Record 86: 59-63. [ Links ]
7. Andrade Cahueñas, C. 2015. Desarrollo y somitogénesis de Engystomops guayaco (Anura:Leptodactylidae) desde el huevo fecundado hasta la eclosión del renacuajo. Tesina de grado Pontificia Universidad Católica del Ecuador, Facultad de Ciencias Exactas y Naturales, Escuela de Ciencias Biológicas. [ Links ]
8. Andrews, R.M. & Donoghue, S. 2004. Effects of temperature and moisture on embryonic diapause of the veiled chameleon (Chamaeleo calyptratus). Journal of Experimental Zoology 30: 629-635. [ Links ]
9. Andrews, R.M. & Greene, V.W. 2011. Character variation in embryonic development of the lizard Uta stansburiana. Journal of Herpetology 45: 451-454. [ Links ]
10. Anstis, M. 2008. Direct development in the Australian myobatrachid frog Metacrinia nichollsi from Western Australia. Records of the Western Australian Museum 24: 133-150. [ Links ]
11. Anstis, M.; Roberts, J.D. & Altig, R. 2007. Direct development in two myobatrachid frogs, Arenophryne rotunda Tyler and Myobatrachus gouldii Gray, from Western Australia. Records-Western Australian Museum 23: 259-271. [ Links ]
12. Anstis, M.; Parker, F.; Hawkes, T.; Morris, I. & Richards, S.J. 2011. Direct development in some Australopapuan microhylid frogs of the genera Austrochaperina, Cophixalus and Oreophryne (Anura: Microhylidae) from northern Australia and Papua New Guinea. Zootaxa 3052: 1-50. [ Links ]
13. Araújo, O.G.; Haddad, C.F.; Silva, H.R. & Pugener, L.A. 2016. A simplified table for staging embryos of the pipid frog Pipa arrabali. Anais da Academia Brasileira de Ciências 88: 1875-1887. [ Links ]
14. Arthur, W. 2004. Biased embryos and evolution. Cambridge University Press, Cambridge. [ Links ]
15. Ba-Omar, T.; Ambu-Saidib, I.; Al-Bahrya, S. & Al-Khayata, A. 2004. Embryonic and larval staging of the Arabian Toad, Bufo arabicus (Amphibia: Bufonidae). Zoology in the Middle East 32: 47-56. [ Links ]
16. Bahir, M.M.; Meegaskumbura, M.; Manamendra-Arachchi, K.; Schneider, C.J. & Pethiyagoda, R. 2005. Reproduction and terrestrial direct development in Sri Lankan shrub frogs (Ranidae: Rhacophorinae: Philautus). The Raffles Bulletin of Zoology 12: 339-350. [ Links ]
17. Banbury, B. & Maglia, A.M. 2006. Skeletal Development of the Mexican Spadefoot, Spea multiplicata (Anura: Pelobatidae). Journal of Morphology 67: 803-821. [ Links ]
18. Barja, G. 2002. Rate of generation of oxidative stress- related damage and animal longevity. Free Radical Biology and Medicine 33: 1167-1172. [ Links ]
19. Beggs, K.; Young, J.; Georges, A. & West, P. 2000. Ageing the eggs and embryos of the pig-nosed turtle, Carettochelys insculpta (Chelonia: Caretto helydidae), from northern Australia. Canadian Journal of Zoology 78: 373-392. [ Links ]
20. Bernardes, M.; Rauhaus, A.; Michel, C.; Pham, C.T.; Nguyen, T.Q.; Le, M.C.; Pasmans, F.; Bonkowski, M. & Ziegler, T. 2017. Larval development and breeding ecology of Ziegler's Crocodile Newt, Tylototriton ziegleri Nishikawa, Matsui and and Nguyen, 2013 (Caudata: Salamandridae), compared to other Tylototriton representatives. Amphibian & Reptile Conservation 11: 72-87. [ Links ]
21. Billett, F.S.; Collins, P.; Goulding, D.A. & Sutherland, J. 1992. The development of Caretta caretta, at 25-34°C, in artificial nests. Journal of Morphology 213: 251-263. [ Links ]
22. Billy, A.J. 1988. Observations on the embryology of the unisexual lizard Cnemidophorus uniparens (Teiidae). Journal of Zoology 215: 55-81. [ Links ]
23. Blanc, F. 1974. Table de dévelopment de Chamaeleo lateralis Gray, 1831. Annales D'Embryologie et de Morphogenese 7: 99-115. [ Links ]
24. Boback, S.M.; Dichter, E.K. & Mistry, H.L. 2012. A developmental staging series for the African house snake, Boaedon (Lamprophis) fuliginosus. Zoology 115: 38-46. [ Links ]
25. Booth, D. 2002. Incubation of rigid-shelled turtle eggs: do hydric conditions matter? Journal of Comparative Physiology B 172: 627-633. [ Links ]
26. Boughner, J.C.; Buchtova, M.; Fu, K.; Diewert, V.; Hallgrimsson, B. & Richman, J.M. 2007. Embryonic development of Python sebae. I. Staging criteria and macroscopic skeletal morphogenesis of the head and limbs. Zoology 110: 212-230. [ Links ]
27. Briegleb, W. 1962. Zur biologie und ökologie des grottenolms (Proteus anguinus Laur.1768). Zeitschrift für Morphologie und Ökologie der Tiere 51: 271-334. [ Links ]
28. Brown, H.A. 1975. Temperature and development of the tailed frog, Ascaphus truei. Comparative Biochemistry and Physiology 50: 397-505. [ Links ]
29. Brunet-Rossinni, A.K. 2004. Reduced free-radical production and extreme longevity in the little brown bat (Myotis lucifigus) versus two non-flying mammals. Mechanisms of Ageing and Development 125: 11-20. [ Links ]
30. Brunet-Rossinni, A.K. & Austad S.N. 2004. Ageing studies on bats: a review. Biogerontology 5: 211-222. [ Links ]
31. Brusca G.J.; Brusca R.C. & Gilbert S.F. 1997. Characteristics of Metazoan Development: 3-19. En: Gilbert, S.F. & Raunio, A.M. (eds.), Embryology. Constructing the organism. Sinauer Associates Inc Publ., Sunderland. [ Links ]
32. Busse, K. 1971. Desarrollo de Batrachyla leptopus Bell con observaciones sobre su ecología y comportamiento (Amphibia, Leptodactylidae). Investigaciones Zoológicas Chilenas 15: 5-64. [ Links ]
33. Cambar, R. & Martin, S. 1959. Table chronologique du déveleopment embryonnaire et larvaire du crapaud accoucher (Alytes obstetricans Laur.). Actes de la Société Linnéenne de Bordeaux 98: 3-33. [ Links ]
34. Campbell, T.S.; Irvin, P.; Campbell, K.R; Hoffmann, K.; Dykes, M.E.; Harding, A.J. & Johnson, S.A. 2009. Evaluation of a new technique for marking anurans. Applied Herpetology 6: 247-256. [ Links ]
35. Casale, P.; Conte, N.; Freggi, D.; Cioni, C. & Argano, R. 2011. Age and growth determination by skeletochronology in loggerhead sea turtles (Caretta caretta) from the Mediterranean Sea. Scientia Marina 75: 197-203. [ Links ]
36. Castanet, J. 1978. Les marques de croissance osseuce comme indicateurs de l´age chez le lezards. Acta Zoologica 59: 35-48. [ Links ]
37. Chakravarty, P.; Bordoloi, S.; Grosjean, S.; Ohler, A. & Borkotoki, A. 2011. Tadpole morphology and table of developmental stages of Polypedates teraiensis (Dubois, 1987). Alytes 27: 85-115. [ Links ]
38. Chen, B.Y.; Liao, W.B & Mi, Z.P. 2011. Body size and age of the China wood frog (Rana chensinensis) in northeastern China. North-Western Journal of Zoology 7: 236-242. [ Links ]
39. Chipman, A.D.; Haas, A. & Khaner, O. 1999. Variations in anuran embryogenesis: yolk-rich embryos of Hyperolius puncticulatus (Hyperoliidae). Evolution & Development 1: 49-61. [ Links ]
40. Collazo, A. & Keller, R. 2010. Early development of Ensatina eschscholtzii: an amphibian with a large, yolky egg. EvoDevo 2010: 1-6. [ Links ]
41, Collazo, A. & Marks, S.B. 1994. Development of Gyrinophilus porphyriticus: identification of the ancestral developmental pattern in the salamander family Plethodontidae. Journal of Experimental Zoology 268: 239-258. [ Links ]
42. Cordero, A.G. & Hanzen, F.J. 2014. An enhanced developmental staging table for the painted turtle, Chrysemys picta (Testudines: Emydidae). Journal of Morphology 275: 442-55. [ Links ]
43. Crastz, F. 1982. Embryonic stages of the marine turtle Lepidochelys olivacea (Eschscholtz). Revista de Biología Tropical 30: 113-120. [ Links ]
44. Crespo, E.G. 1979. Contribuição para o conhecimento da biologia dos Alytes ibericos, Alytes obstetricans boscai, Lataste 1879 e Alytes cisternasii Bosca 1879 (Amphibia, Salientia): a problemática da especiação de Alytes cisternasii. Tesis, Universidade de Lisboa, Portugal. [ Links ]
45. Cretekos, C.J.; Weatherbee, S.D.; Chen, C-H.;Badwaik, N.K.; Niswander, L.; Behringer, R.R.& Rasweiler, J.J. 2005. Embryonic staging system for the short-tailed fruit bat, Carollia perspicillata, a model organism for the mammalian order Chiroptera, based upon timed pregnancies in captive-bred animals. Developmental Dynamics 233: 721-738. [ Links ]
46. Cundall, D. & Greene, H.W. 2000. Feeding in snakes: 293-333. En: Schwenk K. (ed.), Feeding: Form, Function and Evolution in Tetrapod Vertebrates. San Diego Academic Press, California. [ Links ]
47. Dabagyan, N.V. & Sleptsova, L.A. 1991. The Common Frog Rana temporaria: 283-305. En: Dettlaff, T.A. & Vassetzky, S.G. (eds.). Animal Species for Developmental Studies. Springer US, New York. [ Links ]
48. Darwin, C. 1859. On the Origin of Species by means of Natural Selection. John Murray, London. [ Links ]
49. Das, I.; Hedeir, H.; Pui, Y.M.; Hertwig, S.T. & Haas, A. 2016. Larval external morphology and development in Feihyla kajau (Dring, 1983) (Amphibia: Anura: Rhacophoridae). Raffles Bulletin of Zoology 64: 319-328. [ Links ]
50. De Bavay, J.M. 1993. The developmental stages of the sphagnum frog, Kyarranus sphagnicolous Moore (Anura, Myobatrachidae). Australian Journal of Zoology 41: 151-201. [ Links ]
51. de Beer, G.R. 1930. Embryology and evolution. The Clarendon Press, Oxford. [ Links ]
52. de Beer, G.R. 1940. Embryos and ancestors. The Clarendon Press, Oxford. [ Links ]
53. de Lima, A.V.P.; Reis, A.H.; Amado, N.G.; Cassiano-Lima, D.; Borges-Nojosa, D.M.; Oriá, R.B. & Abreu, J.G. 2016. Developmental aspects of the direct-developing frog Adelophryne maranguapensis. Genesis 54: 257-271. [ Links ]
54. Del Conte, E. & Sirlin, J.L. 1952. Pattern series of the first embryonary stages in Bufoarenarum. Anatomical Record 112: 125-135. [ Links ]
55. Del Pino, E.M. & Escobar, E. 1981. Embryonic stages of Gastrotheca riobambae (Fowler) during maternal incubation and comparison of development with that of other egg-brooding hylid frogs. Journal of Morphology 167: 277-295. [ Links ]
56. Del Pino, E.M.; Avila, M.E.; Perez, O.D.; Benitez, M.S.; Alarcon, I.; Noboa, V. & Moya, I.M. 2004. Development of the dendrobatid frog Colostethus machalilla. International Journal of Developmental Biology 48: 663-670. [ Links ]
57. Dendy, A. 1899. Outlines of the development of the tuatara, Sphenodon (Hatteria) punctatus. Quarterly Journal of Microscopical Science 42: 1-87. [ Links ]
58. Dent, J.N. 1942. The embryonic development of Plethodon cinereus as correlated with the differentiation and functioning of the thyroid gland. Journal of Morphology 71: 577-601. [ Links ]
59. Dent, J.N. 1956. Observations on the life history and development of Leptodactylus albilabris.Copeia 1956: 207-210. [ Links ]
60. Deraniyagala, P.E.P. 1939. The Tetrapod Reptiles of Ceylon - Vol. 1, Testudinates & Crocodilians. Colombo Museum of Natural History, Ceylon. [ Links ]
61. Díaz Jr., R.E. & Trainor, P.A. 2015. Hand/foot splitting and the 're-evolution' of mesopodial skeletal elements during the evolutrion and radiation of chameleons. BMC EvolutionaryBiology 15: 184. [ Links ]
62. Dhouailly, D. & Saxod, R. 1974. Les stades dedévelppment de Lacerta muralis Laurent. Entre la ponte et l´èclosion. Bulletin de la Société Zoologique de France 99: 489-494. [ Links ]
63. Dodd, M.H.I. & Dodd, J.M. 1976. The biology of metamorphosis: 467-599. En: Lofts, B. (ed.), Physiology of the Amphibia. Academic Press Inc., New York. [ Links ]
64. Domantay, J.S. 1968. Notes on the development and breeding habits of Chelonla mydas. Acta Manilana Serie A 4: 87-109. [ Links ]
65. Duarte Varela, C. & Cabrera, M. 2000. Testing skeletochronology in Black Tegu lizards (Tupinambis merianae) of known ages. Herpetological Review 31: 224-226. [ Links ]
66. Dufaure, J.P. & Hubert, J. 1961. Table de développement du lézard vivipare Lacerta (Zootoca) vivipara Jacquin. Archives d'Anatomie Microscopique et de Morphologie Experimentale 50: 309-328. [ Links ]
67. Dünker, N.M.; Wake, H. & Olson, W.M. 2000. Embryonic and larval development in the caecilian Ichthyophis kohtaoensis (Amphibia, Gymnophiona): A staging table. Journal of Morphology 243: 3-34. [ Links ]
68. Elinson, R. P. & del Pino, M.E. 1985. Cleavage and gastrulation in the egg-brooding, marsupial frog, Gastrotheca riobambae. Journal of Embryology and Experimental Morphology 90: 223-232. [ Links ]
69. Erişmiş, U.C.; Arıkan, H.; Konuk, M. & Guarino, F.M. 2009. Age structure and growth of the Caucasian parsley frog, Pelodytes caucasicus (Boulenger 1896) from Turkey. Russian Journal of Herpetology 16: 19-26. [ Links ]
70. Esperón Rodríguez, M. & Gallo Reynoso, J.P. 2013. Juvenile and subadult feeding preferences of the Guadalupe fur seal (Arctocephalus townsendi) at San Benito Archipelago, Mexico. Aquatic Mammals 39: 125-131. [ Links ]
71. Eycleshymer, A.C. & Wilson, J.M. 1910. Normal plates of the development of Necturus maculosus: 1-50. En: Keibel, F. (Ed.). Normentafeln zur Entwicklungsgeschichte der Wirbeltiere II, Gustav Fischer Verlag, Vienna. [ Links ]
72. Fabrezi, M. 2011. Heterochrony in growth and development in anurans from the Chaco of South America. Evolutionary Biology 38: 390-411. [ Links ]
73- Fabrezi, M. & Goldberg, J. 2009. Heterochrony during skeletal development of Pseudis platensis (Anura. Hylidae) and the early offset of skeleton development and growth. Journal of Morphology 270: 205-220. [ Links ]
74. Fabrezi, M. & Quinzio, S.I. 2008. Morphological evolution in Ceratophyinae frogs (Anura, Neobatrachia): the effects of heterochronic changes during larval development and metamorphosis. Zoological Journal of the Linnean Society 154: 752-780. [ Links ]
75. Fabrezi, M.; Quinzio, S.I. & Goldberg, J. 2009. The giant tadpole and delayed metamorphosis of Pseudis platensis Gallardo, 1961 (Anura, Hylidae). Journal of Herpetology 43: 228-243. [ Links ]
76. Fabrezi, M.; Quinzio, S.I. & Goldberg, J. 2010. The ontogeny of Pseudis platensis (Anura, Hylidae): Heterochrony and the effects of larval development in the postmetamorphic life. Journal of Morphology 271: 496-510. [ Links ]
77. Fabrezi, M.; Quinzio, S.I.; Goldberg, J. & De Sá, R.O. 2012. The Development of Dermatonotus muelleri (Anura: Microhylidae: Gastrophryninae). Journal of Herpetology 46: 363-380. [ Links ]
78. Fabrezi, M.; Quinzio S.I.; Goldberg, J.; Cruz, J.C.; Chuliver Pereyra, M.; Wassersug, R.J. 2016. Developmental changes and novelties in ceratophryid frogs. EvoDevo 2016: 5. DOI: 10.1186/s13227-016-0043-9 [ Links ]
79. Ferguson, M.J. 1985. The reproductive biology and embryology of crocodilians: 329-491, Vol 14. En: Gans, C.; Billett, F. & Maderson, P.F.A. (eds.). Biology of the Reptilia. John Wiley and Sons, New York. [ Links ]
80. Formas, J.R. & Pugín, E. 1971. Reproducción y desarrollo de Batrachyla antartandica (Barrio) (Anura, Leptodactylidae). Boletín del Museo de Historia Natural (Chile) 32: 201-213. [ Links ]
81. Gans, C. & Billett, F. 1985. Biology of the Reptilia. Development B. John Wiley & Sons, New York, Chichester, Brisbane, Toronto and Singapore. [ Links ]
82. Gawor, A.; Rauhaus, A.; Karbe, D.; Van Der Straeten, K.; Lötters, S. & Ziegler, T. 2012. Is there a chance for conservation breeding? Ex situ management, reproduction, and early life stages of the harlequin toad Atelopus flavescens Duméril & Bibron, 1841 (Amphibia: Anura: Bufonidae). Amphibian & Reptile Conservation 5: 29-44. [ Links ]
83. Gilbert, S.F. 1997. Developmental Biology.Sinauer Associates Inc Publ., Sunderland, Massachusetts. [ Links ]
84. Glücksohn, S. 1931. Äussere entwicklung der extremitäten und stadieneinteilung der larvenperiode von Triton taeniatus Leyd. und Triton cristatus Laur. Archiv Entwicklungsmechanik 125: 341-405. [ Links ]
85. Goldberg, J.; Vera Candioti, F. & Akmentins, M.S. 2012. Direct-developing frogs: ontogeny of Oreobates barituensis (Anura: Terrarana) and the development of a novel trait. Amphibia-Reptilia 33: 239-250. [ Links ]
86. Gollmann, B. & Gollamann, G. 1991. Embryonic development of the myobatrachine frogs Geocrinia laevis, Geocrinia victoriana, and their natural hybrids. Amphibia-Reptilia 12: 103-110. [ Links ]
87. Gómez, M.L.; Zaracho, V.H. & Sandoval, M.T. 2016. Desarrollo embrionario-larval y metamorfosis de Physalaemus albonotatus (Anura: Leptodactylidae). Revista Veterinaria 27: 21-27. [ Links ]
88. Goshe, L.R.; Avens, L.; Scharf, F.S. & Southwood A.L. 2010. Estimation of age at maturation and growth of Atlantic green turtles (Chelonia mydas) using skeletochronology. Marine Biology 157: 1725-1740. [ Links ]
89. Gosner, K.L. 1960. A simplified table for staging anuran embryos and larvae with notes on identification. Herpetologica 16: 183-190. [ Links ]
90. Gosner, K.L. & Black, I.H. 1954. Larval Development in Bufo woodhousei fowleri and Scaphiopus holbrooki holbrooki. Copeia 1954: 251-255. [ Links ]
91.Gosner, K.L. & Rossman, D.A. 1960. Eggs and larval development of the treefrogs Hyla crucifer and Hyla ocularis. Herpetologica 16: 225-232. [ Links ]
92. Gould, S.J. 1977. Ontogeny and phylogeny. The Belknap Press of Harvard University Press, Cambridge. [ Links ]
93. Grant, M.P. 1930. Diagnostic stages of urodele metamorphosis with reference to Amblystoma punctatum and Triturus viridescens. Anatomical Record 45: 1-25. [ Links ]
94. Grant, M.P. 1931. Diagnostic stages of metamorphosis in Amblystoma jeffersonianum and Amblystoma opacum. Anatomical Record 51: 1-15. [ Links ]
95. Greenbaum, E. & Carr, J. 2002. Staging criteria for embryos of the spiny softshell turtle, Apalone spinifera (Testudines: Trionychidae). Journal of Morphology 254: 272- 291. [ Links ]
96. Greenbaum, E. 2002. A standardized series of embryonic stages for the emydid turtle Trachemys scripta. Canadian Journal of Zoology 80: 1350-1370. [ Links ]
97. Gregorovicova, M.; Zahradnicek, O.; Tucker, A.S.; Velensky, P. & Horacek, I. 2012. Embryonic development of the monitor lizard, Varanus indicus. Amphibia-Reptilia 33: 451-468. [ Links ]
98. Grenat, P.; Zavala Gallo, L.; Salas, N. & Martino, A. 2011. External changes in embryonic and larval development of Odontophrynus cordobae Martino et Sinsch, 2002 (Anura: Cycloramphidae). Biologia 66: 1148-1158. [ Links ]
99. Gutiérrez, J.A.; Piantoni, C. & Ibargüengoytía, N.R. 2013. Altitudinal effects on life history parameters in populations of Liolaemus pictus argentinus (Sauria: Liolaemidae). Acta Herpetologica 8: 9-17. [ Links ]
100. Guyot, G.; Pieau, C. & Renous, S. 1994. Développement embryonnaire d'une tortue terrestre, la tortue d'Hermann, Testudo hermanni (Gmelin, 1789). Annales des Sciences naturelles Zoologie 15: 115-137. [ Links ]
101. Hall, B.K. 1992. Evolutionary Developmental Biology. Chapman and Hall, Londres. [ Links ]
102. Hall, J.A.; Larsen Jr., J.H. & Fitzner, R.E. 1997. Postembryonic ontogeny of the Spadefoot Toad, Scaphiopus intermontanus (Anura: Pelobatidae): external morphology. Herpetological Monographs 11:124-178. [ Links ]
103. Hämäläinen, A.; Dammhahn, M.; Aujard, F. & Kraus, C. 2015. Losing grip: Senescent decline in physical strength in a small-bodied primate in captivity and in the wild. Experimental Gerontology 61: 54-61. [ Links ]
104. Harrison, R.G. 1969. Harrison stages and description of the normal developmental of the spotted salamander, Ambystoma punctatum (Linn.): 44-66. En: Harrison, R.G. (ed.), Organization and development of the Embryo. Yale Univ. Press, New Haven. [ Links ]
105. Hemelaar, A. 1985. An improved method to estimate the number of year rings resorbed in phalanges of Bufo bufo (L) and its application to population from different latitudes and altitudes. Amphibia-Reptilia 6: 323-343. [ Links ]
106. Hervas, F.; Torres, K.P.; Montenegro-Larrea, P. & del Pino, E.M. 2015. Development and gastrulation in Hyloxalus vertebralis and Dendrobates auratus (Anura: Dendrobatidae). Amphibian & Reptile Conservation 8: 121-135. [ Links ]
107. Heyland, A.; Hodin, J. & Reitzel, A.M. 2005. Hormone signaling in evolution and development: a non‐model system approachs. BioEssays 27: 64-75. [ Links ]
108. Hindle, A.G.; Horning, M.; Mellish, J.A.E. & Lawler, J.M. 2009a. Diving into old age: muscular senescence in a large-bodied, long-lived mammal, the Weddell seal (Leptonychotes weddellii). Journal of Experimental Biology 212: 790-796. [ Links ]
109. Hindle, A.G.; Lawler, J.M.; Campbell, K.L. & Horning, M. 2009b. Muscle senescence in short-lived wild mammals, the soricine shrews Blarina brevicauda and Sorex palustris. Journal of Experimental Zoology Part A: Ecological Genetics and Physiology 311: 358-367. [ Links ]
110. Hoopwood, N. 2007. A history of normal plates, tables and stages in vertebrate embryology. The International Journal of Developmental Biology 51: 1-26. [ Links ]
111. Horner, H.A. & Macgregor, H.C. 1985. Normal development in newts (Triturus) and its arrest as a consequence of an unusual chromosomal situation. Journal of Herpetology 19: 261-270. [ Links ]
112. Horner, J.R.; De Ricqlès, A. & Padian, K. 2000. Long bone histology of the hadrosaurid dinosaur Maiasaura peeblesorum: growth dynamics and physiology based on an ontogenetic series of skeletal elements. Journal of Vertebrate Paleontology 20: 115-129. [ Links ]
113. Hua, T.M.; Wang, C.L. & Chen, B.H. 2004. Stages of embryonic development for Alligator sinensis. Zoological Research 25: 263-271. [ Links ]
114. Hubert, J. & Dufaure, J.P. 1968. Table de développement de la vipère aspic: Vipera aspic. Bulletin de la Société Zoologique de France 93: 135-148. [ Links ]
115. Hubert, J.; Dufaure, J.P. & Collins, J.P. 1966. Matériaux pour une table de dévelopment de Vipera apis L.I. Le période d´organegènese. Bulletin de la Société Zoologique de France 91: 779-781. [ Links ]
116. Hurle, J.M.; Garcia-Martinez, V.; Garan, Y.; Climent, V. & Blasco, M. 1987. Morphogenesis of the prehensile autopodium in the common chameleon (Chamaeleo chamaeleo). Journal of Morphology 194: 187-194. [ Links ]
117. Iungman, J.; Piña, C.I. & Siroski, P. 2008. Embryological development of Caiman latirostris (Crocodylia: Alligatoridae). Genesis 46: 401-417. [ Links ]
118. Iwasawa, H. & Kawasaki, N. 1979. Normal stages of development of the Japanese green frog Rhacophorus arboreus (Okada and Kawano). Japanese Journal of Herpetology 8: 22-35. [ Links ]
119. Iwasawa, H. & Kera, Y. 1980. Normal stages of development of the Japanese lungless salamander, Onychodactylus japonicus (Houttuyn). Japanese Journal of Herpetology 8: 73-89. [ Links ]
120- Iwasawa, H. & Morita, Y. 1980. Normal stages of development in the frog, Rana brevipoda porosa (in Japanese, English summary). Zoological Magazine 89: 65-75. [ Links ]
121. Iwasawa, H. & Futagami, J. 1992. Normal stages of development of a tree frog, Hyla japonica Günther. Japanese Journal of Herpetology 14: 129-142. [ Links ]
122. Iwasawa, H. & Yamashita, K. 1991. Normal stages of development of a Hynobiid salamander, Hynobius nigrescens Stejneger. Japanese Journal of Herpetology 14: 39-62. [ Links ]
123. Izeckson, E. & Jim, J. 1971. Observações sõbre o desenvolvimiento e os hábitos de Myersella sunnigra (Miranda-Ribeiro) (Amphibia, Anura, Microhylidae). Arquivos do Museu Nacional 54: 69-73. [ Links ]
124. Izquierdo, L. & Pereda, J. 1964. Influencia de la temperatura ambiental sobre el desarrollo de Pleurodema bibroni. Archivos de Biología Médica y Experimental 1: 141-151. [ Links ]
125. Jackson, K. 2002. Post-ovipositional development of the monocled cobra, Naja kaouthia (Serpentes: Elapidae). Zoology 105: 203-214. [ Links ]
126. Jakob, C.; Seitz, A.; Crivelli, A.J. & Miaud, C. 2002. Growth cycle of the marbled newt (Triturus marmoratus) in the Mediterranean region assessed by skeletochronology. Amphibia-Reptilia 23: 407-418. [ Links ]
127. Jégo, M.; Lemaître, J.F.; Bourgoin, G.; Capron, G.; Warnant, C.; Klein, F.; Gilot-Fromont, E. & Gaillard, J.M. 2014. Haematological parameters do senesce in the wild: evidence from different populations of a long-lived mammal. Journal of Evolutionary Biology 27: 2745-2752. [ Links ]
128. Jorquera, B. & Izquierdo, L. (1964). Stages of normal development of Calyptocephalella gayi (the Chilean frog). Biologica (Santiago, Chile) 36: 43-53. [ Links ]
129. Jorquera, B.; Pugín, E. & Goicoechea, O. 1972. Tabla de desarrollo normal de Rhinoderma darwini. Archivos de Medicina Veterinaria 4: 1-15. [ Links ]
130. Jorquera, B. & Pugín, E. 1975. Organogénesis de la rana chilena (Caliptocephalella caudibervera) (Amphibia, Leptodactylidae). Museo Nacional de Historia Natural, Chile. Publicación Ocasional 20: 3-29. [ Links ]
131. Jorquera, B. & Molinari, E. 1979. Estados de desarrollo normal de Batrachyla taeniata (Girard). Medio Ambiente 4: 89-102. [ Links ]
132. Kara, T.C. 1994. Ageing in amphibians. Gerontology 40: 161-173. [ Links ]
133. Kellicot, W.E. 1913. Outlines of chordate development. Henry Holt and Company, New York. [ Links ]
134. Kerney, R. 2011. Embryonic staging table for a direct-developing salamander, Plethodon cinereus (Plethodontidae). Anatomical Record 294: 1796-1808. [ Links ]
135. Kerney, R.; Wassersug, R. & Hall, B.K. 2009. Skeletal advance and arrest in giant non-metamorphosing African clawed frog tadpoles (Xenopus laevis: Daudin). Journal of Anatomy 20: 1-12. [ Links ]
136. Khan, M.S. 1965. A normal table of Bufo melanosticus Schneider. Biología 11: 1-39. [ Links ]
137. Khannoon, E.R. 2015. Developmental stages of the climbing gecko Tarentola annularis with special reference to the claws, pad lamellae, and subdigital setae. Journal of Experimental Zoology (Mol.Dev.Evol.) 324B: 450-464. [ Links ]
138. Khannoon, E.R. & Evans, S.E. 2014. The embryonic development of the Egyptian cobra Naja h. haje (Squamata: Serpentes: Elapidae). Acta Zoologica 95: 472-483. [ Links ]
139. Khannoon, E.R. & Zahradnicek, O. 2017. Postovipositional development of the sand snake Psammophis sibilans (Serpentes: Lamprophiidae) in comparison with other snake species. Acta Zoologica 98: 144-153. [ Links ]
140. Kirkwood, T.R.L. & Rose, M.R. 1991. Evolution of senescence: late survival sacrificed for reproduction. Philosophical Transactions of the Royal Society of London B 332: 15-24. [ Links ]
141. Kishimoto, K. & Hayashi, F. 2017. The complete embryonic and larval stages of the oophagous Frog Kurixalus eiffingeri (Rhacophoridae). Current Herpetology 36: 37-45. [ Links ]
142. Knott, K.K.; Roberts, B.M.; Maly, M.A.; Vance, C.K.; DeBeachaump, J.; Majors, J.; Riger, P.; DeCaluwe, H. & Kouba, A.J. 2013. Fecal estrogen, progestagen and glucocorticoid metabolites during the estrous cycle and pregnancy in the giant anteater (Myrmecophaga tridactyla): evidence for delayed implantation. Reproductive Biology and Endocrinology 11: doi: 10.1186/1477-7827-11-83. [ Links ]
143. Kuriyama, T. & Hasegawa, M. 2017. Embryonic developmental process governing the conspicuousness of body stripes and blue tail coloration in the lizard Plestiodon latiscutatus. Evolution & Development 19: 29-39. [ Links ]
144. Lamotte, M. 1963. Contribution à l'étude des batraciens de l'Ouest africain. XIV. Le développement larvaire de Hymenochirus (Pseudohymenochirus) merlini. Le Bulletin de l'Institut fondamental d' Afrique noire 25: 944-953. [ Links ]
145. Lamotte, M. 1964. Contribution à l'étude des batraciens de l'Ouest africain. XIV. Le développement larvaire de Phrynomantus microps. Le Bulletin de l'Institut fondamental d' Afrique noire 26: 228-237. [ Links ]
146. Lamotte, M. & Dzieduszycka, S.D.1958. Contribution à l'étude des batraciens de l'Ouest africain. VII. Le développement larvaire de Phynobatracus francisci. Le Bulletin de l'Institut fondamental d' Afrique noire 20: 1071-1086. [ Links ]
147. Lamotte, M.; Lauwarier, G. & Perret, J-L. 1957. Contribution à l'étude des batraciens de l'Ouest africain. V. Le développement larvaire de Rana (Hylarana) albolabris. Le Bulletin de l'Institut fondamental d' Afrique noire 19: 1312-1327. [ Links ]
148. Lamotte, M. & Perret, J-L. 1963a.Contribution à l'étude des batraciens de l'Ouest africain. XV. Le développement direct de l'espèce Arhrolpetis peocilonotus. Le Bulletin de l'Institut fondamental d' Afrique noire 25: 277-284. [ Links ]
149. Lamotte, M. & Perret, J-L. 1963b. Contribution à l'étude des batraciens de l'Ouest africain. XIV. Le développement larvaire de Chiromantis rufescens. Le Bulletin de l'Institut fondamental d' Afrique noire 25: 265-276. [ Links ]
150. Lamotte, M. & Xavier, F. 1972. Les amphibiens anoures a developpement direct d'Afrique. Observations sur la biologie de Nectophrynoides tornieri (Roux). Bulletin de la Société Zoologique de France 97: 413-428. [ Links ]
151. Lange, R.; Gruber, B.; Henle, K.; Sarre, S.D. & Hoehna, M. 2012. Mating system and intrapatch mobility delay inbreeding in fragmented populations of a gecko. Behavioral Ecology 24: 1260-1270. [ Links ]
152. Leclair, R. & Castanet, J. 1987. A skeletochronological assessment of age and growth in the frog Rana pipiens Schreber (Amphibia, Anura) from Southwestern Quebec. Copeia 1987: 361-369. [ Links ]
153. Lemus, D. 1967. Contribución al estudio de la embriología de reptiles Chilenos. II. Tabla de desarrollo de la lagartija vivipara Liolaemus gravenhorti (Reptilia-Squamata-Iguanidae). Biológica 40: 39-61. [ Links ]
154. Lemus, D.; Illanes, J.; Fuenzalida, M.; De La Vega, Y.P. & Garcia, M. 1981. Comparative analysis of the development of the lizard Liolaemus tenuis tenuis. II. A series of normal postlaying stages in embryonic development.Journal of Morphology 169: 337-349. [ Links ]
155. León-Ochoa, J. & Donoso-Barros, R. 1969. Desarrollo embrionario y metamorfosis de Pleurodema brachyops (Cope) (Salientia, Leptodactylidae). Boletín de la Sociedad de Biología de Concepción 42: 355-379. [ Links ]
156. Lettink, M. 2012. Herpetofauna: population estimates (using capture-mark-recapture data) v1.0. Inventory and monitoring toolbox: herpetofauna. Department of Conservation Te Papa Atawhai. [ Links ]
157. Limbaugh, B.A. & Volpe, E.P. 1957. Early development of the Gulf Coast toad, Bufo valliceps Wiegmann. American Museum Novitates 1842: 1-32. [ Links ]
158. López, M.S.; Manzano, A.S. & Prieto, Y.A. 2013. Ontogenetic variation in head morphology and diet in two snakes (Viperidae) from northeastern Argentina. Journal of Herpetology 47: 406-412. [ Links ]
159. Lukanov, S. & Tzankov, N. 2016. Life history, age and normal development of the Balkan-Anatolian crested newt (Triturus ivanbureschi Arntzen and Wielstra, 2013) from Sofia district. North-Western Journal of Zoology 12: 22-32. [ Links ]
160. Lynn, W.G. & Lutz, B. 1946a. The development of Eleutherodactylus guentheri STDNR. 1864. Boletim do Museu Nacional 71: 26-46. [ Links ]
161. Lynn, W.G. & Lutz, B. 1946b. The development of Eleutherodactylus nasutus Lutz (Salientia). Boletim do Museu Nacional 79: 1-30. [ Links ]
162. Magnusson, W.E. & Taylor, A.J. 1980.A description of developmental stages in Crocodylus porosus, for use in aging eggs in the field. Australian Wildlife Research 7: 479-485. [ Links ]
163. Mahmoud, I.Y.; Hess, G.L. & Klicka, J. 1973. Normal embryonic stages of the western painted turtle, Chrysemys picta bellii. Journal of Morphology 141: 269-280. [ Links ]
164. Maienschein, J. 2007. To Evo-Devo through cells, embryos, and morphogenesis: 109-121. En: Laubichler, M.D. & Maienschein, J. (eds), From Embryology to Evo-Devo. A History of Developmental Evolution. The MIT Press, Cambridge. [ Links ]
165. Maisano, J.A. 2002. Terminal fusions of skeletal elements as indicators of maturity in squamates. Journal of Vertebrate Paleontology 22: 268-275. [ Links ]
166. Mao, M.; Huang, Y.; Mi, Z.P.; Liu, Y.H. & Zhou, Q. 2012. Skeletochronological study of age, longevity and growth in a population of Rana nigromaculata (Amphibia: Anura) in Sichuan, China. Asian Herpetological Research 3: 258-264. [ Links ]
167. Marks, S.B. & Collazo, A. 1998. Direct development in Desmognathus aeneus (Caudata: Plethodontidae): a staging table. Copeia 1998: 637-648. [ Links ]
168. Matsuki, T. & Matsui, M. 2009. The validity of skeletochronology in estimating ages of Japanese clouded salamander, Hynobius nebulosus (Amphibia, Caudata). Current Herpetology 28: 41-48. [ Links ]
169. McEdward, L.R. & Janies, D.A. 1993. Life cycle evolution in asteroids: What is a larva? Biological Bulletin 184: 255-268. [ Links ]
170. Meslin, C.; Mugnier, S.; Callebaut, I.; Laurin, M.; Pascal, G.; Poupon, A.; Goudet, G. & Monget, P. 2012. Evolution of genes involved in gamete interaction: evidence for positive selection, duplications and losses in vertebrates. PLoS ONE 7 doi: 10.1371/journal.pone.0044548. [ Links ]
171. Michael, P. 1981. A normal table of early development in Bombina orientalis (Boulenger), in relation to rearing temperature. Development, Growth & Differentiation 23: 149-155. [ Links ]
172. Milaire, J. 1957. Contribution a la connaissance morphologique et cytologique des bourgeions de membres chez quelques reptiles. Archives de Biologie 68: 429-512. [ Links ]
173. Miller, J.D. 1985. Embryology of marine turtles: 269-328. En: Gans, C.; Billett, F. & Maderson, P.F.A. (eds.), Biology of the Reptilia. John Wiley and Sons, New York. [ Links ]
174. Minelli, A. 2003. The development of animal form. Cambridge University Press, Cambridge-New York. [ Links ]
175. Mitchell, N. & Swain, R. 1996. Terrestrial development in the Tasmanian frog, Bryobatrachus nimbus (Anura: Myobatrachinae): larval development and a field staging table. Papers and proceedings of the Royal Society of Tasmania 130: 75-80. [ Links ]
176. Moffat, L.A. 1985. Embryonic development and aspects of reproductive biology in the tuatara, Sphenodon puntatus: Vol. 14, 493-522. En: Gans, C.; Billett, F. & Maderson, P.F.A. (Eds.), Biology of the Reptilia. John Wiley and Sons, New York. [ Links ]
177. Monaghan, P.; Charmantier, A.; Nussey, D. & Ricklefs, R. 2008. The evolutionary ecology of senescence. Functional Ecology 22: 371-378. [ Links ]
178. Montero, R.; Gans C. & Lions, M.L. 1999. Embryonic development of the skeleton of Amphisbaena darwini heterozonata (Squamata: Amphisbaenidae). Journal of Morphology 239: 1-25. [ Links ]
179. Morrisett, F.W. 1986. Normal development of Pachymedusa dacnicolor. Ph.D Thesis, The University of Arizona, USA. [ Links ]
180. Mouden, E.E.; Bons, J.; Pieau, C.; Renous, S.; Znari, M. & Boumezzough, A. 2000. Table de développement embryonnaire d'un lézard agamidé, Agama impalearis Boettger, 1874. Annales des Sciences Naturelles. Serie Zoologie et Biologie Animale 21: 93-115. [ Links ]
181. Mouden, E.H.; Znari, M. & Brown, R.P. 1999. Skeletochronology and mark recapture assessments of growth in the North African agamid lizard (Agama impalearis). Journal of Zoology 249: 455-461. [ Links ]
182. Müller, G.B. 2007. Six memos for Evo-Devo: 499-524. En: Laubichler, M.D. & Maienschein, J. (eds.), From embryology to Evo-Devo. A history of developmental evolution. The MIT Press. Cambridge. [ Links ]
183. Muthukkarruppan, V.R.; Kanakambika, P.; Manickavel, V. & Veeraraghavan, K. 1970. Analysis of the development of the lizard, Calotes versicolor, I. a series of normal stages in the embryonic development. Journal of Morphology 130: 479-490. [ Links ]
184. Narayan, E.J.; Hero, J.-M.; Christi, K.S. & Morley, C.G. 2011. Early developmental biology of Platymantis vitiana including supportive evidence of structural specialization unique to the Ceratobatrachidae. Journal of Zoology 284: 68-75. [ Links ]
185. Narzari, J. & Bordoloi, S. 2013. Study of normal development and external morphology of tadpoles of Microhyla ornata and Uperodon globulosus of the family microhylidae (amphibia: anura) from North East India. International Journal of Advanced Biological Research 3: 61-73. [ Links ]
186. Neaves, L.; Wapstra, E.; Birch, D.; Girling, J.E. & Joss, J.M.P. 2006. Embryonic gonadal and sexual organ development in a small viviparous skink, Niveoscincus ocellatus. Journal of Experimental Zoology 305A: 74-82. [ Links ]
187. Nieuwkoop, P.D. & Faber, J. 1994. Normal table of Xenopus laevis (Daudin). Garland Publishing, New York. [ Links ]
188. Noro, M.; Uejima, A.; Abe, G.; Manabe, M. & Tamura, K. 2009. Normal developmental stages of the Madagascar Ground Gecko Paroedura pictus with special reference to limb morphogenesis. Developmental Dynamics 238: 100-109. [ Links ]
189. Nye, H.L.; Cameron, J.A.; Chernoff, E.A. & Stocum, D.L. 2003. Extending the table of stages of normal development of the axolotl: limb development. Developmental Dynamics 226: 555-560. [ Links ]
190. Okada, Y.; Yabe, T. & Oda, S-I. 2011. Embryonic development of the Japanese Pond Turtle, Mauremys japonica (Testudines: Geoe-mydidae). Current Herpetology 30: 89-102. [ Links ]
191. Orton, G.L. 1949. Larval development of Nectophrynoides tornieri (Roux), with comments on direct development in frogs. Annals of Carnegie Museum 31: 257-277. [ Links ]
192. Packard, G.C. 1999. Water relations of chelonian eggs and embryos: Is wetter better? American Zoologist 39: 289-303. [ Links ]
193. Packard, G.C.; Packard, M.J.; Miller, K. & Boardman, T.J. 1988. Effects of temperature and moisture during incubation on carcass composition of hatchling snapping turtles (Chelydra serpentina). Journal of Comparative Physiology B 158: 117-125. [ Links ]
194. Packer, W.C. 1966. Embryonic and larval development of Heleioporus eyrie (Amphibia: Leptodactylidae). Copeia 1966: 92-97. [ Links ]
195. Pasteels, J. 1956. Une table analytique du développement des reptiles. I. Stades de gastrulation chez chéloniens et lacertiliens. Annales de la Societé Royale Zoologique de Belgie 87: 217-241. [ Links ]
196. Penyapol, A. 1958. A preliminary study of the sea turtles in the Gulf of Thailand. The Natural History Bulletin of the Siam Society 17: 23-36. [ Links ]
197. Pérez, O.D.; Lai, N.B.; Buckley, D.; Del Pino, M.E. &. Wake, M.H. 2009. The morphology of prehatching embryos of Caecilia orientalis (Amphibia: Gymnophiona: Caeciliidae). Journal of Morphology 270: 1492-1502. [ Links ]
198. Pérez i de Lanuza, G.; Font, E. & Carazoa, P. 2012. Color-assortative mating in a color-polymorphic lacertid lizard. Behavioral Ecology 24: 273-279. [ Links ]
199. Peter, K. 1904. Normentafeln zur entwicklungsgeschichte der zauneidechse (Lacerta agilis): 1-65. En: Keibel F. (ed.), Normentafeln zur Entwicklungsgeschichte der Wirbeltiere, Gustav Fischer Verlag, Jena. [ Links ]
200. Peterka, M.; Sire, J.Y.; Hovorakova, M.; Prochazka, J.; Fougeirol, L.; Peterkova, R. & Viriot, L. 2010. Prenatal development of Crocodylus niloticus niloticus Laurenti, 1768. Journal of Experimental Zoology B 314: 353-368. [ Links ]
201. Polachowski, K.M. & Werneburg, I. 2013. Late embryos and bony skull development in Bothropoides jararaca (Serpentes, Viperidae). Zoology 116: 36-63. [ Links ]
202. Pollister, A.W. & Moore, J.A. 1937. Tables for the normal development of Rana sylvatica. Anatomical Record 68: 489-496. [ Links ]
203. Ponssa, M.L.; Goldberg, J.; Abdala, V. 2010. Sesamoids in Anurans: New Data, Old Issues. The Anatomical Record 293: 1646-1668. [ Links ]
204. Prieto, Y.A. 2015. Desarrollo embrionario de Phrynops hilarii (Testudinae: Chelidae): factores ambientales y orgánicos que influyen en el proceso de diapausa. Tesis Doctoral, Universidad Nacional de Córdoba, Argentina. [ Links ]
205. Py-Daniel, T.; Kennedy Soares De-Lima, A.; Campos Lima, F.; Pic-Taylor, A.; Rodrigues Pires Junior, O. & Sebben, A. 2017. A Staging Table of Post-Ovipositional Development for the South American Collared Lizard Tropidurus torquatus (Squamata: Tropiduridae). Anatomical Record 300: 277-290. [ Links ]
206. Quintero Gavilán, A.F. 2010. Descripción del desarrollo embrionario en condiciones de cautiverio de la tortuga hicotea Trachemys callirostris callirostris (Testudinata: Emydidae) en el parque recreativo y zoológico Piscilago (Girardot, Colombia). Ph.D. Dissertation. Pontificia Universidad Javeriana, Bogotá, Colombia. [ Links ]
207. Quinzio, S. & Fabrezi, M. 2012. Ontogenetic and structural variation of mineralizations and ossifications in the integument within ceratophryid frogs (Anura, Ceratophryidae). Anatomical Record 295: 2089-2103. [ Links ]
208. Ramaswami, L.S. & Lakshman, A.B. 1959. The skipper-frog as a suitable embryological animal and an account of the action of mammalian hormones on spawning of same. Proceedings of the National Institute of Sciences of India 25: 68-79. [ Links ]
209. Romero-Carvajal, A.; Sáenz-Ponce, N.; Venegas-Ferrín, M.; Almeida-Reinoso, D.; Lee, C.; Bond, J.; Ryan, M.J.; Wallingford, J.B. & del Pino, E.M. 2009. Embryogenesis and laboratory maintenance of the foam-nesting túngara frogs, genus Engystomops (=Physalaemus). Developmental Dynamics 238: 1444-1454. [ Links ]
210. Reilly, S.M.; Wiley, E.O. & Meinhardt, D.J. 1997. An integrative approach to heterochrony: The distinction between interspecific and intraspecific phenomena. Biological Journal of the Linnean Society 60: 119-143. [ Links ]
211. Richardson, M.K. 1999. Vertebrate evolution: the developmental origins of adult variation. BioEssays 21: 604-613. [ Links ]
212. Rieppel, O. 1994. Studies on skeleton formation in reptiles. Patterns of ossification in the skeleton of Lacerta agilis exigua Eichwald (Reptilia, Squamata). Journal of Herpetology 28: 145-153. [ Links ]
213. Roitberg, E.S. & Smirina, E.M. 2006. Adult body length and sexual size dimorphism in Lacerta agilis boemica (Reptilia, Lacertidae): between-year and interlocality variation: 175-187. En: Corti, C.; Lo Cascio, P. & Biaggini, M. (eds.), Mainland and insular Lacertid lizards: A Mediterranean perspective. Firenze University Press, Italy. [ Links ]
214. Roscito, J.G. & Rodrigues, M.T. 2012. Skeletal development in the fossorial gymnophthalmids Calyptommatus sinebrachiatus and Nothobachia ablephara. Zoology 115: 289-301. [ Links ]
215. Rot-Nikcevic, I. & Wassersug, R.J. 2003. Tissue sensitivity to thyroid hormone in athyroid Xenopus laevis larvae. Development Growth & Differentiation 45: 321-325. [ Links ]
216. Rot-Nikcevic, I. & Wassersug, R.J. 2004. Arrested development in Xenopus laevis tadpoles: How size constrains metamorphosis. The Journal of Experimental Biology 207: 2133-2145. [ Links ]
217. Saha, B.K. & Gupta, B.B.P. 2011. The development and metamorphosis of an endangered frog, Rana leptoglossa (Cope, 1868). International Journal of Advanced Research 1: 67-76. [ Links ]
218. Salazar-Nicholls, M.J. & Del Pino, E.M. 2015. Early development of the glass frogs Hyalinobatrachium fleischmanni and Espadarana callistomma (Anura: Centrolenidae) from cleavage to tadpole hatching. Amphibian & Reptile Conservation 8: 89-106 [ Links ]
219. Salica, M.J.; Haad, M.B.; Vera Candioti, M.F. & Faivovich, J. 2011. Early development of two species of Phyllomedusa (Anura: Phyllomedusinae). Salamandra 47: 144-154. [ Links ]
220. Sammouri, R.; Renous, S.; Exbrayat, J.M. & Lescure, J. 1990. Développement embryonnaire de Typhlonectes compressicaudus (Amphibia, Gymnophiona). Annales des Sciences Naturelles, Zoologie et Biologie Animale 11: 135-163. [ Links ]
221. Sandell, M. 1990. The evolution of seasonal delayed implantation. Quarterly Review of Biology 65: 23-42. [ Links ]
222. Sanger, T.J.; Losos, J.B. & Gibson-Brown, J.J. 2008. A developmental staging series for the lizard genus Anolis: a new system for the integration of evolution, development, and ecology. Journal of Morphology 269: 129-137. [ Links ]
223. Sayed, A.H.; Elballouz, A.I. & Wassif, E.T. 2015. Histological and Histochemical Studies on the Early Developmental Stages of the Egyptian Toad Bufo regularis Reuss. Open Journal of Animal Sciences 5: 142-156. http://dx.doi.org/10.4236/ojas.2015.52017 [ Links ]
224. Sayim, F. & Kaya, U. 2008. Embryonic development of the tree frog, Hyla arborea. Biologia 63: 588-593. [ Links ]
225. Scheld, S.; Bina Perl, R.G.; Rauhaus, A.; Karbe, D.; Van der Straeten, K.; Hauswaldt, S.; Randrianiania, R.D.; Gawor, A.; Vences, M. & Ziegler, T. 2013. Larval morphology and development of the Malagasy frog Mantidactylus betsileanus. Salamandra 49: 186-200. [ Links ]
226. Schmidt, B.R.; Schaub, M. & Anholt, B.R. 2002.Why you should use capture-recapture methods when estimating survival and breeding probabilities: on bias, temporary emigration, overdispersion, and common toads. Amphibia-Reptilia 23: 375-388. [ Links ]
227. Schreckenberg, G.M. & Jacobson, A.G. 1975. Normal stages of development of the axolotl, Ambystoma mexicanum. Developmental Biology 42: 391-399. [ Links ]
228. Schwenk, K. & Wagner, G.P. 2003. Constraint: 52- 61. En: Hall, B.K. & Olson, W.B. (eds), Keywords and Concepts in Evolutionary Developmental Biology. Harvard University Press, Cambridge. [ Links ]
229. Shi, D. & Boucaut J.C. 1995. The chronological development of the urodele amphibian Pleurodeles waltl (Michah). International Journal of Developmental Biology 39: 427-441. [ Links ]
230. Shimizu, S. & Ota, H. 2003. Normal development of Microhyla ornata: the first description of the complete embryonic and larval stages for the microhylid frogs (Amphibia: Anura). Current Herpetology 22: 73-90. [ Links ]
231. Shubin, N.H. & Alberch, P. 1986. A morphogenetic approach to the origin and basic organization of the tetrapod limb. Evolutionary Biology 20: 319-387. [ Links ]
232. Shumway, W. 1940. Stages in the normal development of Rana pipiens I. External form. The Anatomical Record 78: 139-147. [ Links ]
233. Smirnov, S.V. 1994. Postmaturation skull development in Xenopus laevis (Anura: Pipidae): late-appearing bones and their bearing on the pipida ancestral morphology. Russian Journal of Herpetology 1: 21-29. [ Links ]
234. Snover, M.L.; Balazs, G.H.; Murakawa, S.K.K.; Hargrove, S.K.; Rice, M.R. & Seitz, W.A. 2013. Age and growth rates of Hawaiian hawksbill turtles (Eretmochelys imbricata) using skeletochronology. Marine Biology 160: 37-46. [ Links ]
235. Streicher, J.W.; Sheehy III, C.M.; Flores-Villela, O. & Campbell, J.A. 2012. Morphological variation in a polychromatic population of Chiricahua leopard frogs (Lithobates chiricahuensis) from Durango, Mexico. Journal of Herpetology 46: 387-392. [ Links ]
236. Sussman, P. & Betz, T.W.1978. Embryonic stages: morphology, timing, and variance in the toad Bombina orientalis. Canadian Journal of Zoology 56: 1540-1545. [ Links ]
237. Swanepoel, J.H. 1970. The ontogenesis of the chondrocranium and of the nasal sac of the microhylid frog Breviceps adspersus Pentheri Werner. Annale Universiteit Van Stellenbosch 45A: 1-119. [ Links ]
238. Taylor, A.C. & Kollros, J.J. 1946. Stages in the normal development of Rana pipiens larvae. Anatomical Record 94: 7-23. [ Links ]
239. Tinsley, R.C. & Tocque, K. 1995. The population dynamcis of a desert anuran, Scaphiopus couchii. Australian Journal of Ecology 20: 376-384. [ Links ]
240. Tokita, M. & Kuratani, S. 2001. Normal Embryonic Stages of the Chinese Softshelled Turtle Pelodiscus sinensis (Trionychidae). Zoological Science 18: 705-715. [ Links ]
241. Townsend, D.S. & Stewart, M.M. 1985. Direct development in Eleutherodactylus coqui (Anura: Leptodactylidae): a staging table. Copeia 1985: 423-436. [ Links ]
242. Trowbridge, M.S.1941. Studies on the normal development of Scaphiopus bombifrons Cope: I. The cleavage period. Transactions of the American Microscopical Society 60: 508-526. [ Links ]
243. Trowbridge, M.S. 1942. Studies on the normal development of Scaphiopus bombifrons Cope. II. The later embryonic and larval periods. Transactions of the American Microscopical Society 61: 66-83. [ Links ]
244. Twitty, V.C. & Bodestein, D. 1948. Triturus torosus: 1-94. En: Rugh, R. (ed.), Experimental Embryology. Burgess Pub. Co., Minneapolis. [ Links ]
245. Tucker, A.D. 1997. Validation of skeletochronology to determine age of freshwater crocodiles (Crocodylus johnstoni). Marine and Freshwater Research 48: 343-351. [ Links ]
246. Valdecantos, S.; Lobo, F. & Martínez, V. 2007. Estimación de edades, tamaño corporal y adquisición de la madurez sexual en dos especies de Liolaemus (Iguania: Liolaemidae). Cuadernos de Herpetología 21: 31-44. [ Links ]
247. Vera, M.C. & Ponssa, M.L. 2014. Skeletogenesis in anurans: cranial and postcranial development in metamorphic and postmetamorphic stages of Leptodactylus bufonius (Anura, Leptodactylidae). Acta Zoologica 95: 44-62. [ Links ]
248. Vera, M.C.; Ponssa, M.L. & Abdala, V. 2015. Further data on sesamoid identity from two anuran species. Anatomical Record 298: 1376-1394. [ Links ]
249. Vera Candioti, M.F.; Úbeda, C. & Lavilla, E.O. 2005. Morphology and metamorphosis of Eupsophus calcaratus tadpoles (Anura: Leptodactylidae). Journal of Morphology 262: 161-177. [ Links ]
250. Vera Candioti, M.F., Nuñez, J.J. & Úbeda, C. 2011. Development of the nidicolous tadpoles of Eupsophus emiliopugini (Anura: Cycloramphidae) until metamorphosis, with comments on systematic relationships of the species and its endotrophic developmental mode. Acta Zoologica 92: 27-45. [ Links ]
251. Vieira, L.G.; Lima, F.C.; Santos, A.L.Q.; Mendonça, S.H.S.T.; Moura, L.R.; Iasbeck, J.R. & Sebben, A. 2011. Description of embryonic stages in Melanosuchus niger (Spix, 1825) (Crocodylia: Alligatoridae). Journal of Morphological Science 28: 11-22. [ Links ]
252. Vizotto, L.D. 1967. Desenvolvimento de anuros da região Norte-occidental do estado de São Paulo. Thesis. Facultade de Filosofia, Ciencias e Letras de São José do Rio Préto. Departamento de Zoologia. São Paulo, Brasil. [ Links ]
253. Volpe, E.P. 1961. Polymorphism in the anuran populations: 221-234. En: Blair, W.F. (ed.). Vertebrate Speciation. Univ. Texas Press, Austin. [ Links ]
254. Wake, M.H. 1980. The reproductive bilogy of Nectophrynoides malcolmi (Amphibia: Bufonidae), with comments on the evolution of reproductve modes in the genus Nectophrynoides. Copeia 1980: 193-209. [ Links ]
255. Wassersug, R.J. 1975. The adaptive significance of the tadpole stage with comments on the maintenance of complex life cycles in anurans. American Zoologist 15: 405-417. [ Links ]
256. Watson, S. & Russell, A.P. 2000. A posthatching developmental staging table for the long-toed salamander, Ambystoma macrodactylum krausei. Amphibia-Reptilia 21: 143-154. [ Links ]
257. Weisz, P.B. 1945. The normal stages in the development of the south african clawed toad, Xenopus laevis. Anatomical Record 93: 161-169. [ Links ]
258. Werneburg, I.; Hugi, J.; Müller, J. & Sánchez-Villagra, M.R. 2009. Embryogenesis and ossification of Emydura subglobosa (Testudines, Pleurodira, Chelidae) and pat-terns of turtle development. Developmental Dynamics 238: 2770-2786. [ Links ]
259. Werneburg, I.; Polachowskic, K.M. & Hutchinsond, M.N. 2015. Bony skull development in the Argus monitor (Squamata, Varanidae, Varanus panoptes) with comments on developmental timing and adult anatomy. Zoology 118: 255-280. [ Links ]
260. Werner, Y.L. 1971. The ontogenetic development of the vertebrae in some gekkonoid lizards. Journal of Morphology 133: 41-92. [ Links ]
261. Wernz, J.G. & Storm, R.M. 1969. Pre-hatching stages of the tailed frog, Ascaphus truei Stejneger. Herpetologica 25: 86-93. [ Links ]
262. Wise, P.A.D.; Vickaryous, M.K. & Rusell, A.P. 2009. An embryonic staging table for in ovo development of Eublepharis macularius, the Leopard Gecko. Anatomical Record 292: 1198-1212. [ Links ]
263. Xiong, R.C.; Jiang, J.P.; Fei, L.; Wang, B. & Ye, C.Y. 2010. Embryonic development of the concave-eared torrent frog with its significance on taxonomy. Zoological Research 31: 490-498. [ Links ]
264. Yntema, C.L. 1968. A series of stages in the embryonic development of Chelydra serpentina. Journal of Morphology 125: 219-252. [ Links ]
265. Zelditch, M. 2003. Space, time, and repatterning: 341-349. En: Hall, B.K. & Olson, W.B. (eds.), Keywords and Concepts in Evolutionary Developmental Biology. Harvard University Press, Cambridge. [ Links ]
266. Zehr, D.R. 1962. Stages in the normal development of the common garter snake, Thamnophis sirtalis sirtalis. Copeia 1962: 322-329. [ Links ]
267. Zug, G.R.; Balazs, J.G.; Wetherall, H.A.; Parker, D.M. & Murakawa, S.K.K. 2002. Age and growth of Hawaiian green sea turtles (Chelonia mydas): and analysis based on skeletochronology. Fishery Bulletin 100: 117-127. [ Links ]














