Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Cuadernos de herpetología
versión On-line ISSN 1852-5768
Cuad. herpetol. vol.32 no.1 San Salvador de Jujuy mayo 2018
TRABAJO
El auto-reconocimiento químico en Liolaemus pacha (Iguania: Liolaemidae) está influenciado por la estación
Natalin S. Vicente1, Monique Halloy2
1 UEL, Unidad Ejecutora Lillo, Fundación Miguel Lillo, CONICET. Miguel Lillo 251, San Miguel de Tucumán (4000), Tucumán, Argentina.
2 Instituto de Comportamiento Animal, Fundación Miguel Lillo. Miguel Lillo 251, San Miguel de Tucumán (4000), Tucumán, Argentina.
Recibido: 31/10/16
Revisado: 09/03/17
Aceptado: 23/01/18
ABSTRACT
Chemical self-recognition in Liolaemus pacha (Iguania: Liolaemidae) is influenced by season. Chemical signals play an important role in social and sexual recognition in several lizard species. Here, we investigated whether the lizard Liolaemus pacha can recognize their own chemical scents (i.e., self-recognition) from a control. In addition, the effect of reproductive vs. post-reproductive season was considered. We experimentally tested scent discrimination, using the terrarium previously occupied by the individual and an untreated terrarium as a control. We estimated the latency to the first tongue flick and the number of tongue flicks for 10 min. Only during the post-reproductive season, L. pacha lizards produced more tongue flicks when exposed to own scents than to a control, suggesting self-recognition. Chemical signals could be used as territorial scent marks, mediating the advertisement of boundaries. We discuss the lack of self-recognition during reproductive season. Lizards showed a short latency to the first tongue flick and a high number of tongue flicks during the reproductive season, which might be associated with physiological changes related mainly to reproduction.
Key words: Behavior; Communication; Pheromones; Lizards; Tongue flicks.
RESUMEN
Las señales químicas juegan un papel muy importante en el reconocimiento social y sexual de muchas especies de lagartijas. En este trabajo, se investiga si la lagartija Liolaemus pacha puede reconocer sus propios estímulos químicos (i.e., auto-reconocimiento) con respecto a un control. Además, se consideró el efecto de la estación reproductiva vs. post-reproductiva en dicho reconocimiento. Se testeó experimentalmente la discriminación química usando el terrario previamente ocupado por el individuo focal y un terrario neutral como control. Se estimó la latencia al primer lamido y el número de lamidos en 10 minutos. Sólo durante la estación post-reproductiva, las lagartijas L. pacha produjeron más lamidos al estar expuestas a sus propios estímulos químicos que en el control, sugiriendo auto-reconocimiento. Las señales químicas intervendrían en el marcado y el mantenimiento de los límites territoriales. Se discute la ausencia de auto-reconocimiento en la estación reproductiva. Las lagartijas tardaron menos en lamer y lamieron más durante la estación reproductiva, lo que podría estar asociado a los cambios fisiológicos relacionados con la reproducción.
Palabras clave: Comportamiento; Comunicación; Feromonas; Lagartijas; Lamidos.
INTRODUCCION
Los reptiles poseen el sentido químico muy desarrollado, usando las señales químicas para recibir información de su entorno (Halpern, 1992; Mason, 1992). El linaje de los Squamata posee un órgano vomeronasal altamente desarrollado, el cual recibe la información a través de la lengua que funciona como intermediaria (Halpern, 1992; Schwenk, 1995). De esta forma, los lamidos han sido utilizados como medida de recepción y de exploración química (Cooper y Burghardt, 1990; Cooper, 1994).
Las señales químicas, juegan un papel muy importante en la comunicación intraespecífica y en la selección sexual de las lagartijas, interviniendo en variados contextos (Müller-Schwarze, 2006; Mason y Parker, 2010; López y Martín, 2011). En diversas especies de lagartijas, se ha determinado que las señales químicas intervienen en el reconocimiento propio (Alberts, 1992; Labra y Niemeyer, 1999), de los conespecíficos (i.e., sexual; Labra et al., 2001; Barbosa et al., 2006; Vicente y Halloy, 2016) y de los individuos familiares y no familiares (Alberts y Werner, 1993; Cooper, 1996; Aragón et al., 2001a; 2001b). Además, las señales químicas pueden informar sobre el tamaño corporal (López et al., 1998; Aragón et al., 2000; Carazo et al., 2007), la edad (López et al., 2003; Martín y López, 2013), el estado de salud (López y Martín, 2005; Martín et al., 2007) y la condición reproductiva (Cooper y Vitt, 1984; Cooper y Pérez-Mellado, 2002).
Existen diversas fuentes de estímulos químicos en lagartijas, tales como las secreciones de la piel, de las glándulas femorales y precloacales, las secreciones cloacales y las heces (Mason, 1992, Mayerl et al., 2015; Valdecantos et al., 2014). Estas secreciones químicas pueden ser liberadas pasivamente o activamente a medida que la lagartija se mueve por su área de acción (Mason, 1992; Wyatt, 2003). Las secreciones de las glándulas femorales (Dipsosaurus dorsalis, Alberts, 1992; Iguana iguana, Alberts y Werner, 1993) o las heces (Lacerta monticola cyreni, López et al., 1998) pueden intervenir en la delimitación y en el anuncio del área de acción. Además, la producción y deposición de las secreciones químicas puede verse influida durante la estación reproductiva, cuando los niveles de hormonas sexuales aumentan (Martins et al., 2006). En los machos de Iguana iguana se ha registrado una asociación positiva entre los niveles de tesoterona y la producción de las secreciones femorales durante la estación reproductiva (Alberts, 1992).
Las lagartijas Liolaemus utilizan las señales químicas en el reconocimiento específico (Labra, 2011), propio (Labra y Niemeyer, 1999; Labra et al., 2001; 2002; 2003; Labra, 2008a; Aguilar et al., 2009) y de los conespecíficos (Labra, 2008b; Labra et al., 2001; 2002; Labra y Hoare, 2015; Valdecantos y Labra 2017). Previamente, Vicente y Halloy (2016) encontraron evidencia que sólo los machos de L. pacha reconocen a sus conespecíficos, mostrando mayor interés por los estímulos químicos de hembras. Debido a que se desconoce si esta especie presenta auto-reconocimiento químico, los objetivos de este trabajo son investigar si las lagartijas L. pacha discriminan las secreciones químicas propias con respecto a un control y analizar el efecto de la estación reproductiva en el auto-reconocimiento químico. Teniendo en cuenta que otras especies de Liolaemus han mostrado reconocer sus propias secreciones químicas, se espera que L. pacha discrimine entre sus propios estímulos con respecto de un estímulo control. Además, se ha encontrado que la estación reproductiva puede modular este reconocimiento (Labra et al., 2001; 2003; Labra, 2008a), por lo que se espera que L. pacha muestre mayor interés por sus propias secreciones durante la estación reproductiva.
MATERIALES Y METODOS
Liolaemus pacha es especie diurna y de hábitos terrestres, la cual se distribuye en el área de Los Cardones, ubicado a 20 km al este de la localidad de Amaicha del Valle, Departamento de Tafí del Valle, Provincia de Tucumán (26°40’1.5” S, 65°49’5.1” W; 2725 m). Registra dimorfismo y dicromatismo sexual, siendo los machos más grandes y coloridos que las hembras (Juárez Heredia et al., 2013). Es una especie ovípara, registrándose los apareamientos a finales de octubre y principios de noviembre (estación reproductiva: Ramírez Pinilla, 1992). La estación post-reproductiva se considera desde enero hasta marzo o abril, cuando machos y hembras comienzan a hibernar (Ramírez Pinilla, 1992). Durante la estación reproductiva, los machos establecen sus territorios (Halloy y Robles, 2002; Robles y Halloy, 2009), monitoreando a sus alrededores y defendiéndolos activamente de otros machos por medio de despliegues de cabeceos (Halloy, 2012; Vicente, 2017).
Se capturaron 9 machos y 10 hembras en la estación reproductiva (20-22 de octubre de 2013) y, 10 machos y 9 hembras en la estación post-reproductiva (17 de enero de 2014). Los mismos individuos fueron utilizados para un estudio previo (Vicente y Halloy, 2016). Las lagartijas fueron capturadas mediante una caña con lazo corredizo y se mantuvieron individualmente en bolsas de tela. Luego de la captura, las lagartijas fueron trasladadas a la Fundación Miguel Lillo, donde fueron expuestos a temperatura ambiente (20-35°C) y a un fotoperíodo natural (13D:11N). Las lagartijas fueron ubicadas en terrarios de acrílico individuales (Exo-Terra Faunarium, 37 x 22 x 25 cm). Debido a que los rayos de sol no alcanzaban en ningún momento los terrarios, se dispusieron tubos de luz ultravioleta (UV) por encima de los terrarios. Los mismos se encendían automáticamente a la mañana por tres horas, cada día. Los terrarios fueron ubicados en estanterías y se aislaron visualmente entre sí usando cartones. Cada terrario tenía una roca como percha y un refugio. Como sustrato se utilizó una cuerina sintética, que permitió limpiarla o cambiarla con facilidad luego de cada experimento. El agua fue provista ad libitum y se los alimentó con larvas de tenebrios, día por medio. Las lagartijas fueron mantenidas en su terrario por al menos 5 días, antes de comenzar los experimentos. Una vez finalizados, fueron devueltas al mismo sitio de captura.
Para testear la hipótesis de auto-reconocimiento químico en Liolaemus pacha, se usó un diseño de medidas repetidas, en el cual cada individuo fue expuesto de manera aleatoria a dos estímulos químicos: propio y control. Como estímulos químicos se usó el mismo terrario donde previamente se encontraba la lagartija, y uno sin utilizar que funcionaba como control. Los datos del estímulo control son los mismos que los de Vicente y Halloy (2016). Se grabó cada prueba con una filmadora digital (Sony HDR-Cx290), ubicada a 50 cm del terrario. Antes de cada experimento, las lagartijas fueron removidas de su terrario y mantenidas en las bolsas de tela por 30 minutos. Basándonos en pruebas preliminares, observamos que por lo general las lagartijas comienzan a lamer dentro de los primeros 15 minutos. Por lo tanto, se filmaron durante 30 minutos para asegurar 10 minutos de registro posteriores al primer lamido y debido a que las pruebas no fueron vistas mientras eran filmadas, para no alterar a los individuos. Luego, el individuo experimental se ubicó por debajo de una tapa oscura por un minuto, para disminuir el stress causado por la manipulación. Posteriormente se procedió a retirar la tapa lentamente y se daba por iniciado el experimento. Una vez finalizado, ese individuo fue devuelto a su terrario y no fue molestado hasta el siguiente día de pruebas. Todas las pruebas fueron realizadas entre las 10:00 y las 17:00 h, durante el periodo de actividad usual de las lagartijas y con una temperatura ambiente de 28° a 33°C.
En cada prueba se midieron las siguientes variables: latencia al primer lamido (i.e., tiempo en segundos desde que comienza el experimento hasta que la lagartija realiza el primer lamido), y el número de lamidos. Todas las frecuencias fueron calculadas por 10 minutos, iniciando luego del primer lamido. Los valores son mostrados como X ± ES. Para evaluar la variación en la latencia al primer lamido y el número de lamidos entre estímulos químicos, estación, sexo e interacciones entre ellas, se realizaron modelos lineales generalizados mixtos (GLMM: Zuur et al., 2009) con el software R (R Core Team, 2016). Los estímulos químicos, la estación y el sexo fueron establecidos como factores fijos, mientras que la identidad del individuo fue establecida como factor aleatorio. Los GLMM fueron ajustados siguiendo una distribución binomial negativa, ya que las variables respuesta eran conteos y presentaron sobredispersión (Zuur et al., 2009). Inicialmente, se incluyeron todas las variables y las interacciones entre ellas, para luego ir eliminando aquellas variables no significativas (p > 0.05) hasta obtener el modelo mínimo adecuado. El mejor modelo fue el que presentó todas las variables significativas (p ≤ 0.05).
RESULTADOS
La variación encontrada en la latencia al primer lamido sólo estuvo influida significativamente por la estación (Tabla 1; Fig. 1). En general, durante la estación reproductiva, las lagartijas mostraron una menor latencia frente a cualquier estímulo químico en relación con la estación post-reproductiva (Fig. 1). No se registraron diferencias significativas entre la latencia frente a un estímulo químico propio y control (Fig. 1). Los machos tardaron menos en lamer que las hembras, pero estas diferencias no fueron significativas (p > 0.05; Fig. 1).
Tabla 1. Valores estimados (± ES), límites de los intervalos de confianza al 95% (LC) y el p-valor de las variables explicativas (estímulo químico, sexo y estación), que describen la variación en la latencia al primer lamido y en el número de lamidos. Los valores estimados representan la diferencia esperada entre estímulos, sexos y estaciones, con respecto a los valores de referencia: estímulo control, hembra y estación reproductiva, según corresponda. Los símbolos de p corresponden a: *** p < 0.001; ** p < 0.01; * p ≤ 0.05; NS p > 0.05.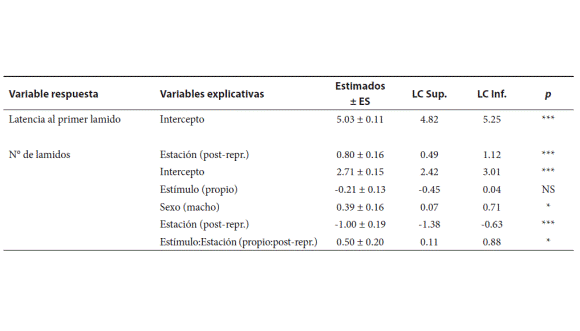
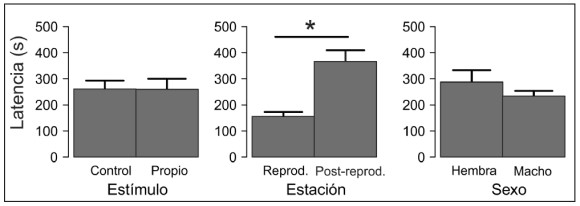
Figura 1. Efecto de los estímulos químicos, la estación y el sexo, sobre la latencia al primer lamido (en segundos), mostrando las medias y los errores estándar. El asterisco indica diferencias significativas (p ≤ 0.05).
El número de lamidos estuvo influido por los estímulos químicos, el sexo, la estación y, la interacción entre el estímulo y la estación (Tabla 1). Los machos lamieron en general más que las hembras (Fig. 2). Durante la estación reproductiva las frecuencias de lamidos en general fueron significativamente mayores (18.34 ± 1.86) que durante la estación post-reproductiva (8.68 ± 0.91). Durante la estación reproductiva, el número de lamidos frente al estímulo propio fue menor con respecto al control, aunque estas diferencias no fueron significativas (p > 0.05; Fig. 2). Sin embargo, durante la estación post-reproductiva, el número de lamidos frente a un estímulo propio fue significativamente mayor con respecto al control (p < 0.05; Fig. 2).

Figura 2. Efecto de los estímulos químicos, la estación y el sexo, sobre el número de lamidos, mostrando las medias y los errores estándar. El asterisco indica diferencias significativas (p ≤ 0.05).
DISCUSION
Los resultados sugieren que las lagartijas Liolaemus pacha, estarían mostrando auto-reconocimiento sólo en la estación post-reproductiva, debido a que el número de lamidos fue significativamente mayor en el estímulo químico propio que en el control. En la mayoría de las especies de Liolaemus se ha demostrado que existe auto-reconocimiento (Labra y Niemeyer, 1999; Labra et al., 2001; 2002, 2003; Aguilar et al., 2009; Troncoso-Palacios y Labra, 2012). Debido a que L. pacha reconoce sus propias secreciones químicas durante la estación post-reproductiva se sugiere que las mismas intervendrían en el marcado, el reconocimiento y en el mantenimiento de los límites territoriales (ej. Baird et al., 2015). Las lagartijas L. pacha establecen las áreas de acción durante la estación reproductiva (Halloy y Robles, 2002; Robles y Halloy, 2009), las cuales son activamente defendidas mediante los despliegues de cabeceos (Halloy, 2012; Vicente, 2017). Mientras que durante la estación post-reproductiva, las áreas de acción disminuyen (Robles y Halloy, 2009), así como también las frecuencias de despliegues visuales (Halloy, 2012; Vicente, 2017). Por lo tanto, las señales químicas ofrecerían la ventaja de advertir los límites territoriales, sobre todo cuando no son usadas las señales visuales para la misma función.
Notablemente durante la estación reproductiva no se encontró evidencia de auto-reconocimiento. La ausencia de una respuesta diferente entre el estímulo propio y control no excluye que exista reconocimiento (Sherman et al., 1997; Cooper, 1998), ya que puede ocurrir con sólo unos pocos lamidos (Shine et al., 2003). Sin embargo, debido a la variabilidad observada en la respuesta frente al estímulo control, una posibilidad es que hayan quedado remanentes de estímulos químicos de individuos que hayan sido testeados previamente y que no hayan sido limpiados. Futuros estudios que evalúen la discriminación de sustratos (p.ej. papeles absorbentes, hisopos) con diferentes estímulos químicos (p.ej. secreciones cloacales, precloacales y heces vs. control) durante la estación reproductiva, pueden ayudarnos a confirmar si existe auto-reconocimiento, eliminar la posible variabilidad del control y analizar las fuentes de estímulos químicos.
La estación reproductiva afectó tanto a la latencia al primer lamido como al número de lamidos. Durante la estación reproductiva, los individuos tardaron menos en lamer y lamieron más que en la estación post-reproductiva. Estos resultados coinciden con lo encontrado en L. tenuis, L. belli y L. fitzgeraldi (Labra y Niemeyer, 1999; Labra et al., 2001; Aguilar et al., 2009). La variación estacional en el comportamiento de las lagartijas L. pacha probablemente se vea influida por los cambios fisiológicos relacionados con la reproducción (p.ej. Cooper y Pérez-Mellado, 2002; Baeckens et al., 2016). Los niveles de hormonas reproductivas altas afectan la producción de secreciones epidérmicas y el comportamiento de marcaje del territorio en lagartijas (Cooper y Vitt, 1984; Alberts et al., 1992; Martins et al., 2006; Baeckens et al., 2016). En Podarcis hispanica este aumento de secreciones epidérmicas está asociado con una mayor proporción de compuestos volátiles, los cuales incrementan la detectabilidad de las señales químicas (Baeckens et al., 2016). De esta forma, los compuestos volátiles percibidos por el sistema olfativo, estimularían rápidamente la generación de lamidos. No obstante, son necesarios más estudios en Liolaemus que relacionen la fisiología reproductiva con la producción de las secreciones químicas y el reconocimiento químico.
Agradecimientos
NSV agradece especialmente a la Dra. M. Halloy por su invaluable formación en todos estos años, a L. Vivas, C. Cárdenas y S. Gamboa Alurralde por su ayuda en el campo. A Recursos Naturales y Suelos de la provincia de Tucumán por el permiso para trabajar en el sitio (Res: 169-13, Expte. No. 936-330-2012) y a CONICET por la beca doctoral.
LITERATURA CITADA
1. Alberts, A.C. 1992. Pheromonal self-recognition in desert Iguanas. Copeia 1992: 229-232. [ Links ]
2. Alberts, A.C. & Werner, D.I. 1993. Chemical recognition of unfamiliar conspecifics by green iguanas: functional significance of different signal components. Animal Behaviour 46: 197-199. [ Links ]
3. Alberts, A.C.; Pratt, N.C. & Phillips, J.A. 1992. Seasonal productivity of lizard femoral glands: relationship to social dominance and androgen levels. Physiology and Behavior 51: 729-733. [ Links ]
4. Aguilar, P.M.; Labra, A. & Niemeyer, H.M., 2009. Chemical self-recognition in the lizard Liolaemus fitzgeraldi. Journal of Ethology 27: 181-184. [ Links ]
5. Aragón, P.; López, P. & Martín, J. 2000. Size‐dependent chemosensory responses to familiar and unfamiliar conspecific faecal pellets by the Iberian rock‐lizard, Lacerta monticola. Ethology 106: 1115-1128. [ Links ]
6. Aragón, P.; López, P. & Martín, J. 2001a. Chemosensory discrimination of familiar and unfamiliar conspecifics by lizards: implications of field spatial relationships between males. Behavioral Ecology and Sociobiology 50: 128-133. [ Links ]
7. Aragón, P.; López, P. & Martín, J. 2001b. Discrimination of femoral gland secretions from familiar and unfamiliar conspecifics by male Iberian rock-lizards, Lacerta monticola. Journal of Herpetology 35: 346-350. [ Links ]
8. Baeckens, S.; Edwards, S.; Huyghe, K. & Van Damme, R. 2016. Chemical signalling in lizards: an interspecific comparison of femoral pore numbers in Lacertidae. Biological Journal of the Linnean Society 114: 44-57. [ Links ]
9. Baird, T.A.; McGee, A.A. & York, J.R. 2015. Responses to femoral gland secretions by visually adept male and female collared lizards. Ethology 121: 513-519. [ Links ]
10. Barbosa, D.; Font, E.; Desfilis, E. & Carretero, M.A. 2006. Chemically mediated species recognition in closely related Podarcis wall lizards. Journal of Chemical Ecology 32: 1587-1598. [ Links ]
11. Carazo, P.; Font, E. & Desfilis, E. 2007. Chemosensory assessment of rival competitive ability and scent-mark function in a lizard, Podarcis hispanica. Animal Behaviour 74: 895-902. [ Links ]
12. Cooper, W.E. 1994. Chemical discrimination by tongue-flicking in lizards: a review with hypotheses on its origin and its ecological and phylogenetic relationships. Journal of Chemical Ecology 20: 439-487. [ Links ]
13. Cooper, W.E. 1996. Chemosensory recognition of familiar and unfamiliar conspecifics by the scincid lizard Eumeces laticeps. Ethology 102: 454-464. [ Links ]
14. Cooper, W.E. 1998. Evaluation of swab and related tests as a bioassay for assessing responses by squamate reptiles to chemical stimuli. Journal of Chemical Ecology 24: 841-866. [ Links ]
15. Cooper, W.E. & Burghardt, G.M. 1990. A comparative analysis of scoring methods for chemical discrimination of prey by squamate reptiles. Journal of Chemical Ecology 16: 45-65. [ Links ]
16. Cooper, W.E. & Pérez-Mellado, V. 2002. Pheromonal discriminations of sex, reproductive condition, and species by the lacertid lizard Podarcis hispanica. Journal of Experimental Zoology 292: 523-527. [ Links ]
17. Cooper, W.E. & Vitt, L.J. 1984. Conspecific odor detection by the male broad‐headed skink, Eumeces laticeps: Effects of sex and site of odor source and of male reproductive condition. Journal of Experimental Zoology 230: 199-209. [ Links ]
18. Halloy, M. 2012. Visual display variations in neotropical lizards, Liolaemus quilmes (Iguania: Liolaemidae): relation to sex and season. Herpetological Journal 22: 265-268. [ Links ]
19. Halloy, M. & Robles, C. 2002. Spatial distribution in a neotropical lizard, Liolaemus quilmes (Liolaemidae): Site fidelity and overlapping among males and females. Bulletin of the Maryland Herpetolological Society 38: 118-129. [ Links ]
20. Halpern, M. 1992. Nasal chemical senses in reptiles: structure and function: 423-523. En: Gans, C. & David, C. (eds.), Biology of the Reptilia, Vol. 18. The University of Chicago Press, Chicago. [ Links ]
21. Juárez Heredia, V., Robles, C. & Halloy, M. 2013. A new species of Liolaemus from the darwinii group (Iguania: Liolaemidae), Tucumán province, Argentina. Zootaxa 3681: 524-538. [ Links ]
22. Labra, A. 2008a. Sistemas de comunicación en reptiles: 547-577. En: Vidal, M. & Labra, A. (eds.), Herpetología de Chile. Springer Verlag, Santiago de Chile.
23. Labra, A. 2008b. Multi-Contextual use of Chemosignals: 357-365. En: Hurst, J.L.; Beynon, R.J.; Roberts, S.C. & Wyatt, T.D. (eds.), Chemical Signals in Vertebrates 11. Springer, New York. [ Links ]
24. Labra, A. 2011. Chemical stimuli and species recognition in Liolaemus lizards. Journal of Zoology 285: 215-221. [ Links ]
25. Labra, A. & Hoare, M. 2014. Chemical recognition in a snake-lizard predator-prey system. Acta Ethologica 18: 173-179. [ Links ]
26. Labra, A. & Niemeyer, H.M. 1999. Intraspecific chemical recognition in the lizard Liolaemus tenuis. Journal of Chemical Ecology 25: 1799-1811. [ Links ]
27. Labra, A.; Beltrán, S. & Niemeyer, H.M. 2001. Chemical exploratory behavior in the lizard Liolaemus belli. Journal of Herpetology 35: 51-55. [ Links ]
28. Labra, A.; Escobar, C.A.; Aguilar, P.M. & Niemeyer, H.M. 2002. Sources of pheromones in the lizard Liolaemus tenuis. Revista Chilena de Historia Natural 75: 141-147. [ Links ]
29. Labra, A.; Cortéz, S. & Niemeyer, H.M. 2003. Age and season affect chemical discrimination of Liolaemus bellii own space. Journal of Chemical Ecology 29: 2615-2620. [ Links ]
30. López, P. & Martín, J. 2005. Female Iberian wall lizards prefer male scents that signal a better cell-mediated immune response. Biology Letters 1: 404-406. [ Links ]
31. López, P. & Martín, J. 2011. Pheromones and Reproduction in Reptiles: 141-167. En: Norris, D.O. & López, K.H (eds.), Hormones and Reproduction of Vertebrates, Volume 3-Reptiles. Academic Press, San Diego, USA. [ Links ]
32. López, P.; Aragón, P. & Martín, J. 1998. Iberian rock lizards (Lacerta monticola cyreni) assess conspecific information using composite signals from faecal pellets. Ethology 104: 809-820. [ Links ]
33. López, P.; Aragón, P. & Martín, J., 2003. Responses of female lizards, Lacerta monticola, to males' chemical cues reflect their mating preference for older males. Behavioral Ecology and Sociobiology 55: 73-79. [ Links ]
34. Martín, J. & López, P. 2013. Responses of female rock lizards to multiple scent marks of males: effects of male age, male density and scent over-marking. Behavioural Processes 94: 109-114. [ Links ]
35. Martín, J.; Moreira, P.L. & López, P. 2007. Status‐signalling chemical badges in male Iberian rock lizards. Functional Ecology 21: 568-576. [ Links ]
36. Martins, E.P.; Ord, T.J.; Slaven, J.; Wright, J.L. & Housworth, E.A. 2006. Individual, sexual, seasonal, and temporal variation in the amount of sagebrush lizard scent marks. Journal of Chemical Ecology 32: 881-893. [ Links ]
37. Mason, R.T. 1992. Reptilian pheromones: 114-228. En: Gans, C. & Crews, D. (eds.), Biology of Reptilia: Hormones, Brain and Behavior. The University of Chicago Press, Chicago. [ Links ]
38. Mason, R.T. & Parker, M.R. 2010. Social behavior and pheromonal communication in reptiles. Journal of Comparative Physiology A 196: 729-749. [ Links ]
39. Mayerl, C.; Baeckens, S. & Van Damme, R. 2015. Evolution and role of the follicular epidermal gland system in non-ophidian squamates. Amphibia-Reptilia 36: 185-206. [ Links ]
40. Müller-Schwarze, D. 2006. Chemical ecology of vertebrates. Cambridge, UK: Cambridge University Press. [ Links ]
41. R Core Team. 2016. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. Disponible en: <https://www.R-project.org/>. Último acceso: 3 de julio de 2017.
42. Ramírez Pinilla, M.P. 1992. Ciclos reproductivos y de cuerpos grasos en dos poblaciones de Liolaemus darwinii (Reptilia: Sauria: Tropiduridae). Acta Zoológica Lilloana 42: 41-49. [ Links ]
43. Robles, C. & Halloy, M. 2009. Home ranges and reproductive strategies in a neotropical lizard, Liolaemus quilmes (Iguania: Liolaemidae). South American Journal of Herpetology 4: 253-258. [ Links ]
44. Schwenk, K. 1995. Of tongues and noses: chemoreception in lizards and snakes. Trends in Ecology and Evolution 10: 7-12. [ Links ]
45. Sherman, P.W.; Reeve, H.K. & Pfennig, D. 1997. Recognition systems: 69-96. En: J. R. Krebs, J.R. & Davies, N.B. (eds.), Behavioural Ecology. Blackwell Science. Oxford, UK. [ Links ]
46. Shine, R.; Phillips, B.; Waye, H.; LeMaster, M. & Mason, R.T. 2003. Chemosensory cues allow courting male garter snakes to assess body length and body condition of potential mates. Behavioral Ecology and Sociobiology 54: 162-166. [ Links ]
47. Troncoso-Palacios, J. & Labra, A. 2012. Is the exploratory behavior of Liolaemus nitidus modulated by sex?. Acta Herpetologica 7: 69-80. [ Links ]
48. Valdecantos, S.; Martínez, V. & Labra, A. 2014. Comparative morphology of Liolaemus lizards precloacal glands. Acta Herpetologica 9: 147-158. [ Links ]
49. Valdecantos, S. & Labra, A. 2017. Testing the functionality of precloacal secretions from both sexes in the South American lizard, Liolaemus chiliensis. Salamandra 38: 209-216. [ Links ]
50. Vicente, N.S. & Halloy, M. 2016. Chemical recognition of conspecifics in a neotropical lizard, Liolaemus pacha (Iguania: Liolaemidae): relation to visual displays, season and sex. Journal of Ethology 34: 329-335. [ Links ]
51. Vicente, N.S. 2017. Comunicación visual y química en una lagartija del noroeste argentino, Liolaemus pacha (Iguania: Liolaemidae). Tesis Doctoral. Universidad Nacional de Tucumán. [ Links ]
52. Wyatt, T.D. 2003. Pheromones and animal behaviour. Comunication by smell and taste. Cambridge University Press. Cambridge, UK. [ Links ]
53. Zuur, A.F.; Ieno, E.N.; Walker, N.J.; Saveliev, A.A. & Smith, G.M. 2009. Mixed Effects Models and Extensions in Ecology with R. Springer-Verlag. New York. [ Links ]














