Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Cuadernos de herpetología
versión On-line ISSN 1852-5768
Cuad. herpetol. vol.32 no.1 San Salvador de Jujuy mayo 2018
NOTA
Dieta de la lagartija arenícola Liolaemus laurenti (Sauria: Liolaemidae) en un bioma de desierto de Argentina
Gabriela A. Gallardo1, María J. Barrionuevo2, Gustavo J. Scrocchi2
1 Dpto. de Cs. Básicas y Tecnológicas. Instituto de Ambientes de Montañas y Regiones Áridas. Universidad Nacional de Chilecito. Ruta Los Peregrinos s/n°. CP (5360). Chilecito, La Rioja, Argentina. La Rioja. Argentina.
2 UEL- CONICET, Fundación Miguel Lillo, Miguel Lillo 252. CP (4000). Tucumán, Argentina.
Recibido: 22/10/17
Revisado: 28/02/18
Aceptado: 07/03/18
ABSTRACT
Diet of the sand lizard Liolaemus laurenti (Sauria: Liolaemidae) in a desert biome of Argentina The feeding habits of a population of Liolaemus laurenti in northwest Argentina were studied in an annual period of activity. The objectives of the study were to determine the composition of the diet of the species, the trophic diversity and variations between sexes and among dry and wet seasons. From the analysis of 42 stomach contents, it was determined that ants constitute the main prey category of the diet, they comprise 93.15% of all present prey; it was also the most frequent category (100% of stomach contents). Lizard population also feeds on other insects and chelates. The trophic diversity was higher in females and in both in males and females increases during the wet season. Seasonal differences could be attributed to the fact that in arid ecosystems rainfall strongly affects productivity primary. Therefore the supply of resources for arthropods in general and therefore, for their predators.
Key Words: Monte; Trophic Ecology; Liolaemus; Northern Argentina.
Liolaemus es el género de lagartijas más diverso en Sudamérica, cuenta con alrededor de 260 especies (Lobo et al., 2010; Abdala y Quinteros, 2014). Las mismas se distribuyen principalmente en el oeste del continente ocupando las zonas áridas y semiáridas (Cei, 1993; Ávila et al., 2010). Muchas de sus especies tienen áreas de distribución pequeñas y varias son endémicas (Díaz Gómez, 2007). En cuanto a la dieta, se ha determinado que pueden ser carnívoras (e.g., L. bibroni, Belver y Avila, 2002; L. quilmes, L. ramirezae, Halloy et al., 2006; L. pseudoanomalus, Kozykarisky et al., 2011), otras son omnívoras (e.g. L. koslowskyi, Aun y Martori, 1998; L. elongatus, Quatrini et al., 2001; L. umbrifer, O’Grady et al., 2005; L. cuyanus, Moreno Azocar y Acosta, 2011) y también hay especies herbívoras (e.g., L. lutzae, Rocha, 2000; L. poecilochromus, Valdecantos et al., 2012; L. eleodori; Astudillo et al., 2015). En algunas especies la alimentación fluctúa entre la herbivoría, la omnivoría y la carnivoría, en coincidencia con los diferentes estadios ontogenéticos, el sexo o las estaciones (e.g., L. poecilochromus, Valdecantos, 2011; L. crepuscularis, Sheman et al., 2013; L. eleodori; Astudillo et al., 2015). Con respecto a las diferencias intersexuales en la dieta, las mismas se han asociado a las divergencias sexuales en el tamaño de la cabeza, al estado reproductivo de las hembras, o a las necesidades energéticas (e.g., L. scapularis, García et al., 1989; L. wiegmannii, Aún et al., 1999; L. multimaculatus, Vega, 1999; L. quilmes, Halloy et al., 2006; L. pseudoanomalus; Kozykariski et al., 2011; L. crepuscularis, Sheman et al., 2013; L. ramirazae, Sheman y Halloy, 2016).
Liolaemus laurenti (Etheridge, 1992) es una lagartija pequeña de hábitos psamófilos, perteneciente al grupo laurenti (Abdala, 2007). Se distribuye en el oeste de Argentina, en las provincias de Catamarca, La Rioja, Mendoza y San Juan. El hábitat de Liolaemus laurenti lo constituyen los montículos de arena generados por acciones eólicas, y controladas por arbustos y herbáceas (Gallardo, 2017). Esta especie ha sido categorizada como “no amenazada” y distribución restringida (Abdala et al., 2012). Presenta dimorfismo sexual dado por las proporciones de los segmentos corporales principales, cabeza y tronco (Cabrera et al., 2013). Los objetivos de este estudio fueron 1) describir la composición de la dieta, 2) analizar la variación estacional (estación seca vs húmeda) y entre sexos. Los ejemplares analizados (n=42) son parte de una investigación sobre la reproducción de un ensamble de lagartijas que se llevó a cabo en la provincia fitogeográfica del Monte (Cabrera y Willink, 1980) (28°49`11”S; 67°24`54”O), en la zona norte del Valle de Chilecito, ubicado en provincia de La Rioja-Argentina (Gallardo, 2017). Fueron capturados entre noviembre del año 2009 y marzo del año 2010. Los ejemplares se hallan depositados en la Colección Herpetológica de la Fundación Miguel Lillo bajo los números FML 30029 al FML 30071. El Monte se caracteriza por el predominio de vegetación xerófila y arbustiva, con escasas formaciones arbóreas tales como diferentes especies de Prosopis; entre los arbustos se destacan Larrea cuneifolia y Larrea divaricata, Bulnesia retama, Cassia aphylla y Geoffroea decorticans, entre otras (Cabrera y Willink, 1980). Según la clasificación climática de Köppen, la región tiene características hidrometereológicas de desierto; la precipitación media anual es de 162.50 mm. Dado que el 80 % de las lluvias se concentran a fines del verano, se optó por comparar el periodo seco (noviembre a enero) con el húmedo (febrero a marzo). La humedad media fue más alta entre febrero y marzo del 2010 (62.20 ± 2.00%), con respecto al período comprendido entre noviembre 2009 y enero 2010 (46.70 ± 1.27%) (Gallardo, 2017). Los datos de las variables climáticas fueron obtenidos de la estación meteorológica del Departamento Chilecito (29,14 S; 67,26 O; 945 m s.n.m.). Se registró la longitud hocico cloaca (LHC), o distancia entre el extremo anterior de la cabeza y la cloaca con un calibre electrónico (Essex™: precisión 0.01 mm); el análisis fue restringido a la población de adultos (LHC > 43 mm; Gallardo, 2017). Dado que las lagartijas grávidas en general dejan de alimentarse por la disminución de la cavidad abdominal (Martori, 2005; Semhan et al., 2013), se analizaron y compararon las hembras reproductivas (con huevos y/o folículos vitelogénicos en los oviductos) con las no reproductivas (hembras con folículos previtelogénicos). Se extrajeron los estómagos de cada espécimen y sus contenidos fueron inmersos en alcohol 70 %, luego se identificaron las presas y se cuantificaron. Las presas fueron identificadas al nivel taxonómico de orden y familia; en el caso del orden Hymenoptera, Formicidae fue evaluado como una categoría separada a causa de su importancia numérica. Por su escasa o nula movilidad, las larvas, pupas y ninfas de insectos fueron agrupadas como una categoría aparte denominada “estados inmaduros”.
Se analizó la composición de la dieta con base en histogramas y tablas, las variables fueron 1) frecuencia de ocurrencia de categorías (porcentaje de estómagos con cada categoría de presa) y, 2) abundancia relativa por categoría (porcentaje de individuos consumidos de cada una de las categorías de presas). Para comparar entre sexos la abundancia promedio de presas por estómago y número promedio de categorías de presas, se realizó la prueba no paramétrica U de Mann-Whitney (Zar, 1999). Las diferencias intersexuales en la abundancia de presas por categoría fueron analizadas utilizando tablas de contingencia. Se realizó, previamente a los análisis, una curva de acumulación de categorías presas para definir si el tamaño de la muestra es adecuado para realizar inferencias. Se comparó la diversidad trófica entre sexos y estaciones con base en el índice de dominancia (Simpson, 1949). Su fórmula es, D= 1-Σ (pi)2 donde pi es la abundancia relativa de cada categoría presa en los contenidos estomacales. El rango de este índice oscila entre 0 (baja diversidad) y un valor máximo dado por 1-1/S; donde S es el número de categorías presas (Krebs, 1985).
A partir de la curva de acumulación (Fig. 1) se determinó que el tamaño de muestra es adecuado para realizar inferencias. Del análisis realizado se desprende que la dieta de Liolaemus laurenti consiste en 12 categorías-presa que pertenecen a 11 taxones: adultos de Acarinae, Araneae, Coleoptera, Diptera, Formicidae, Hemiptera, Hymenoptera (no Formicidae), Lepidoptera, Neuroptera, Pseudoscorpionida, Thysanoptera y la categoría “estados inmaduros”. Formicidae fue la categoría más importante en la dieta de la población (la frecuencia de ocurrencia fue 95.00%), exhibiendo además la mayor abundancia relativa: 87.58% del número total de las presas ingeridas (Fig. 2).
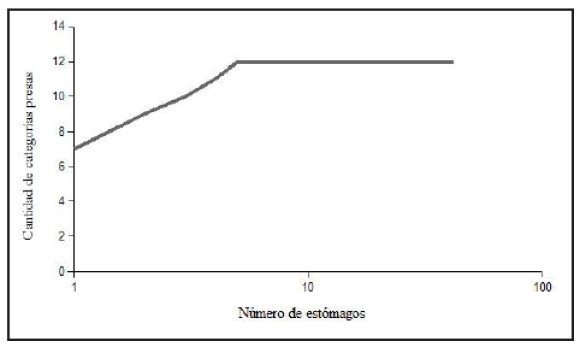
Figura 1. Curva acumulada de categorías de presas en los contenidos estomacales de Liolaemus laurenti.

Figura 2. Abundancia relativa de presas según las categorías (barras negras) b. Proporción de lagartijas que predaron sobre los distintos ítems (barras grises) en la población de Liolaemus laurenti.
La Tabla 1 resume la abundancia relativa y la frecuencia de ocurrencia de las categorías presa para las estaciones seca y húmeda. Se registraron 11 categorías presa en 23 muestras de estómagos de individuos colectados en la estación seca. En esta estación los estómagos tuvieron un promedio de 56.52 ± 57.47 presas y 2.91 ± 1.31 categorías presa. Se registraron un total de 9 categorías presa en 19 muestras de estómagos de individuos colectados en la estación húmeda, en dicha estación los estómagos tuvieron un promedio de 36.94 ± 23.37 presas y 2.63 ± 1.34 categorías presa. La dieta de la estación seca no contuvo significativamente más categorías presas que la estación húmeda (Mann Whitney prueba- U: z= 0.61; p= 0.53). No hubo diferencias significativas entre estaciones en la cantidad de presas por estómago (Mann Whitney: z= 0.21, p> 0.05). La abundancia relativa de presas por categoría difiere significativamente entre estaciones (χ2= 229.30, df = 7.00, p< 0.05). A partir de lo observado en la Tabla 1, se puede inferir que la variación en la abundancia relativa se debe a principalmente a Formicidae.
Tabla 1. Abundancia relativa (AR), frecuencia de ocurrencia (FO) de categorías de presas presentes en muestras de estómagos de Liolaemus laurenti capturados en la estación húmeda y en la estación seca.
La abundancia relativa de las presas en la estación seca fue dominada por el orden Formicidae, que comprende el 93.15% de todas las presas presentes y fue la categoría presa más frecuente (100% ocurrencia). Coleoptera fue una presa frecuente en la misma estación, el 65% de los ejemplares consumieron dicha categoría. Formicidae exhibió una alta abundancia relativa en las muestras de estómago de la estación húmeda, que comprendió el 77.77% del número total de las presas ingeridas. Asimismo, con base en la frecuencia de ocurrencia, Lepidoptera fue una categoría importante en la dieta (57.89%). La abundancia relativa baja de Coleoptera y de Lepidoptera en ambas estaciones (< 3.13%) indicaría que el aporte al volumen del estómago de dichas presas es significativo.
Se registraron 9 categorías presa en hembras no reproductivas (n= 8); los estómagos tuvieron un promedio de 48.37 ± 51.90 presas y 2.87 ± 1.27 categorías presas. Se registraron 10 categorías de presas en hembras reproductivas (n= 9), los estómagos tuvieron un promedio de 46.33 ± 34.36 presas y 4.00 ± 1.12 categorías presas. No hubo diferencias significativas entre hembras reproductivas y no reproductivas en la cantidad de categorías presa (Mann Whitney: z= 1.78, p= 0.07) así como tampoco en la cantidad de presas por estómago (Mann Whitney: z= 0.24, p= 0.81). Tampoco se halló diferencias significativas entre ambos grupos en la composición de la dieta, por lo tanto, se combinaron los datos para hacer los análisis posteriores.
Se registraron 11 categorías de presas en hembras; los estómagos tuvieron un promedio de 48.67 ± 41.16 presas y 4.05 ± 1.62 categorías presa. En machos se registraron 9 categorías presa; los estómagos tuvieron un promedio de 46.95 ± 50.04 presas y 2.54 ± 1.31 categorías presa (Tabla 1). La cantidad de categorías presa por contenido estomacal es considerada como un índice de diversidad de presas en la dieta de L. laurenti, y la dieta de las hembras tuvo significativamente más categorías presa que los machos (Mann Whitney: z= -3.19, p= 0.001). No hubo diferencias significativas en la cantidad de presas por estómago entre machos y hembras (Mann Whitney: z= -0.62, p= 0.53). La abundancia relativa de presas por categoría difiere significativamente entre machos y hembras (χ2= 183.07; df= 11; p< 0.00). A partir de lo observado en la Tabla 2, se puede inferir que la variación en la abundancia relativa se debe a principalmente a Lepidoptera, Coleoptera, Hemiptera, Diptera y “estados inmaduros”.
La abundancia relativa de las presas en las hembras fue dominada por la familia Formicidae, que comprende el 79.34% de todas las presas presentes (Tabla 2). Lepidoptera y Coleoptera fueron categorías importantes por su frecuencia de ocurrencia (61.11%), pero no por su abundancia relativa (< 3.00%); probablemente estas presas hacen una contribución alta por sus tamaños. Lo mismo se ha observado en las categorías presa Hemiptera y “estados inmaduros” (frecuencia de ocurrencia 55.56% y 44.44% respectivamente). Formicidae exhibió una alta abundancia relativa, que comprendió el 94.23% del número total de las presas ingeridas y fue la categoría más común en las muestras de estómago de los machos (96% de ocurrencia). Las otras categorías presas en la dieta de los machos son poco frecuentes (Tabla 1).
Tabla 2. Abundancia relativa (AR), frecuencia de ocurrencia (FO) de categorías de presas presentes en muestras de estómagos de hembras y machos Liolaemus laurenti.
El rango del índice de diversidad trófica obtenido para la población (0-0.92), indica que la dieta de los machos está dominada por menos categorías de presas (D= 0.36 y D= 0.11 para hembras y machos respectivamente). También señala que la dieta es más variada en la estación húmeda (D= 0.38) con respecto a la estación seca ( D= 0.13).
Liolaemus laurenti es una especie carnívora que consume preferentemente hormigas. La alta frecuencia de hormigas en la dieta está ampliamente difundida entre las lagartijas Liolaemus (e.g. Aun y Martori, 1998; Aun et al., 1999; Quatrini et al., 2001; Halloy et al., 2006; Vanhooydonck et al., 2010; Kozykarisky et al. 2011; Moreno Azocar y Acosta, 2011; Valdecantos et al., 2011; Semhan et al., 2013). La mirmecofagia podría estar asociada a la disponibilidad del recurso, ya que en zonas áridas y semiáridas, las hormigas son comunes y abundantes (Znari et al., 2000; Carretero, 2004). Por otro lado son presas gregarias, por lo que el costo de energía en la búsqueda de alimento disminuye; además, el pequeño tamaño del cuerpo de L. laurenti facilitaría la localización, prehensión y procesamiento de estas presas (Stephens y Krebs, 1986; Griffiths y Christian, 1996).
En cuanto a las variaciones entre estaciones, la riqueza de presas en la estación húmeda fue más baja, pero la dieta se diversificó en dicha estación a raíz del aumento del consumo de otras presas distintas a las hormigas. Esta variación interestacional en la diversidad trófica coincide con las variaciones ambientales asociadas a las precipitaciones que se concentran a fines de verano. En zonas semiáridas el agua es el principal recurso limitante y la cantidad y la estacionalidad de las precipitaciones afectan fuertemente la productividad primaria (Whitford, 2002). Si el aumento de vegetación en la estación húmeda influencia la disponibilidad de presas, L. laurenti sería una especie oportunista dado que parte de la dieta depende de la abundancia de los recursos en el ambiente (Pianka, 1973).
Con respecto a las comparaciones entre sexos, la dieta de las hembras tiene otras presas importantes además de Formicidae tales como Lepidoptera y Coleoptera. Las diferencias intersexuales halladas en algunas especies de Liolaemus (Aun et al., 1999; Halloy et al., 2006; Semhan et al., 2013) se han asociado al volumen ocupado por las gónadas y/o a las demandas energéticas de las distintas etapas reproductivas. Dado que en la población de L. laurenti no hubo diferencias en la dieta entre hembras reproductivas y no reproductivas, se propone que el valor de consumir presas de mayor tamaño radicaría en que maximizan la obtención de energía y minimizan el movimiento y por lo tanto el riesgo de predación (Griffiths y Christian, 1996).
La dominancia de las hormigas en la dieta de ambas estaciones y tanto en machos como en hembras, sugiere que la especie prefiere consumir dicha presa. Futuros trabajos sobre la ecología trófica de la especie deberían determinar si la especie es selectiva u oportunista en relación a la oferta ambiental que ofrece el tipo particular de hábitats que ocupan.
Agradecimientos
Este trabajo se realizó con fondos FICYT N° 332/12, Universidad Nacional de Chilecito y fondos PIUNT G519, Universidad Nacional de Tucumán.
LITERATURA CITADA
1. Abdala, C.S. 2007. Phylogeny of the boulengeri group (Iguania: Liolaemidae, Liolaemus) based on morphological and molecular characters. Zootaxa 1538: 1-84. [ Links ]
2. Abdala, C.S.; Acosta, J.L.; Acosta, J.C.; Álvarez, B.B.; Arias, F.; Avila, L.J., & Breitman, M.F. 2012. Categorización del estado de conservación de las lagartijas y anfisbenas de la República Argentina. Cuadernos de Herpetología 26: 215-248. [ Links ]
3. Abdala, C.S. & Quinteros, A.S. 2014. Los últimos 30 años de estudios de la familia de lagartijas más diversas de Argentina: Actualización taxonómica y sistemática de Liolaemidae. Cuadernos de Herpetología 28: 55-82. [ Links ]
4. Astudillo, G.V.; Acosta, J.C.; Villavicencio, H.J. & Córdoba, M.A. 2015. Ecología trófica y dimorfismo sexual del lagarto endémico Liolaemus eleodori (Iguania: Liolaemidae) del Parque Nacional San Guillermo, San Juan, Argentina. Cuadernos de Herpetología 29: 27-39. [ Links ]
5. Aun, L. & Martori, R. 1998. Reproducción y dieta de Liolaemus koslowskyi Etheridge 1993. Cuadernos de Herpetología 12: 100-107. [ Links ]
6. Aun, L.; Martori, R. & Rocha, C. 1999. Variación estacional de la dieta de Liolaemus wiegmanii (Squamata: tropiduridae) en un agroecosistema del sur de Córdoba, Argentina. Cuadernos de Herpetología 13: 69- 80. [ Links ]
7. Avila, L.J.; Morando, M.; Pérez, D.R. & Sites Jr, J.W. 2010. A new species of the Liolaemus elongatus clade (Reptilia: Iguania: Liolaemini) from Cordillera del Viento, northwestern Patagonia, Neuquén, Argentina. Zootaxa 2667: 28-42. [ Links ]
8. Belver, L.C. & Avila, L.J. 2002. Diet composition of Liolaemus bibronii (Iguania: Liolaemidae) in southern Rio Negro Province, Argentina. Herpetological Journal 12: 39-42. [ Links ]
9. Cabrera, A.L. & Willink, A. 1980. Biogeografía de América Latina. Monografía 13. Serie de Biología. Secretaria General de la Organización de Estados Americanos, Departamento de Asuntos Científicos y Tecnológicos, Washington DC., EEUU. [ Links ]
10. Cabrera, M.P.; Scrocchi, G.J. & Cruz, F.B. 2013. Sexual size dimorphism and allometry in Liolaemus of the L. laurenti group (Sauria: Liolaemidae): Morphologic lability in a clade of lizards with different reproductive modes. Zoologischer Anzeiger A Journal of Comparative Zoology 252: 299-306. [ Links ]
11. Carretero, M.A. 2004. From set menu to a la carte. Linking issues in trophic ecology of Mediterranean lacertids. Italian Journal of Zoology 71: 121-133. [ Links ]
12. Cei, J.M. 1993. Reptiles del noroeste, nordeste y este de la Argentina. Museo Regionale di Scienze Naturali Torino. [ Links ]
13. Díaz Gómez, J.M. 2007. Endemism in Liolaemus (Iguania: Liolaemidae) from the Argentinian Puna. South American Journal of Herpetology 2: 59-68. [ Links ]
14. Etheridge, R. 1992. A new psammophilus lizard of the genus Liolaemus (Squamata: Tropiduridae) from northwestern Argentina. Bollettino del Museo Regionale di Scienze Naturali 10: 1-19. [ Links ]
15. Gallardo, G.A. 2017. Ecología reproductiva de un ensamble de saurios del Valle de Chilecito, La Rioja- Argentina. Tesis de Doctorado en Ciencias Biológicas, Facultad de Ciencias Naturales, Universidad Nacional de Tucumán, Argentina. [ Links ]
16. García, S.; Chani, J.M. & Trivi De Mandri, M. 1989. Rasgos particulares en la dieta de Liolaemus scapularis Laurent, 1982 (Lacertilia: Iguanidae). Cuadernos de Herpetología 4: 1-3. [ Links ]
17. Griffiths, A.D. & Christian, K.A. 1996. Diet and habitat use of frillneck lizards in a seasonal tropical environment. Oecologia 106: 39-48. [ Links ]
18. Halloy, M.; Robles, C. & Cuezzo, F. 2006. Diet in two syntopic neotropical lizard species of Liolaemus (Liolaemidae): interspecific and intersexual differences. Revista Española de Herpetología 20: 47-56. [ Links ]
19. Kozykariski, M.L.; Belver, L.C. & Avila, L.J. 2011. Diet of the Desert Lizard Liolaemus pseudoanomalus (Iguania: Liolaemini) in Northern La Rioja Province, Argentina. Journal of Arid Environments 75: 1237-1239. [ Links ]
20. Krebs, C.J. 1985. The experimental analysis of distribution and abundance. Harper and Row. New York. [ Links ]
21. Lobo, F.; Slodki, D. & Valdecantos, S. 2010. Two new species of lizards of the Liolaemus montanus group (Iguania: Liolaemidae) from the northwestern uplands of Argentina. Journal of Herpetology 44: 279-293. [ Links ]
22. Martori, R.A. 2005. Reproduccion y reclutamiento en una población de Liolaemus koslowskyi Etheridge 1993 (Tropiduridae, Squamata). Tesis de Doctorado en Ciencias Biológicas, Facultad de Ciencias Fisicoquímicas y Naturales, Universidad Nacional de Rio Cuarto, Argentina. [ Links ]
23. Moreno Azócar, D.L. & Acosta, J.C. 2011. Feeding habits of Liolaemus cuyanus (Iguania: Liolaemidae) from the Monte Biogeographic Province of San Juan, Argentina. Journal of Herpetology 45: 283-286. [ Links ]
24. O’Grady, S.P.; Morando, M.; Avila, L. & Dearing, M.D. 2005. Correlating diet and digestive tract specialization: examples from the lizard family Liolaemidae. Zoology 108: 201-210.
25. Pianka, E.R. 1973. The structure of lizard communities. Annual Review of Ecology and Systematics 4: 53-74. [ Links ]
26. Quatrini, R.; Albino, A. & Barg, M. 2001. Variación morfológica y dieta en dos poblaciones de Liolaemus elongatus Koslowsky, 1896 (Iguania: Tropiduridae) del noroeste patagónico. Revista Chilena de Historia Natural 74: 639-651. [ Links ]
27. Rocha, C. F. 2000. Selectivity in plant food consumption in the lizard Liolaemus lutzae from southeastern Brazil. Studies on Neotropical Fauna and Environment 35: 14-18. [ Links ]
28. Semhan, R.V.; Halloy, M. & Abdala, C.S. 2013. Diet and reproductive states in a high altitude Neotropical Lizard, Liolaemus crepuscularis (Iguania: Liolaemidae). South American Journal of Herpetology 8: 102-108. [ Links ]
29. Semhan, R.V. & Halloy, M. 2016. Diet and reproductive states in a high altitude Neotropical lizard species, Liolaemus ramirezae (Iguania: Liolaemidae). Journal of Herpetology 50: 589-593. [ Links ]
30. Simpson, E. H. 1949. Measurement of diversity. Nature 163: 688. [ Links ]
31. Stephens, D.W. & Krebs, J.R. 1986. Foraging theory PrincetonUniversity Press. [ Links ]
32. Valdecantos, M.S. 2011. Coexistencia entre especies: competencia, agresión o indiferencia en lagartijas de la puna del genero Liolaemus (Squamata: Iguania: Liolaeminae). Tesis de Doctorado en Ciencias Biológicas, Facultad de Ciencias Exactas, Físicas y Naturales, Universidad Nacional de Córdoba, Argentina [ Links ]
33. Valdecantos, M.S.; Arias, F. & Espinoza, R.E. 2012. Herbivory in Liolaemus poecilochromus, a small, cold-climate lizard from the Andes of Argentina. Copeia 2012: 203-210. [ Links ]
34. Vanhooydonck, B.; Cruz, F.B.; Abdala, C.S.; Azócar, D.L. M.; Bonino, M. F., & Herrel, A. 2010. Sex-specific evolution of bite performance in Liolaemus lizards (Iguania: Liolaemidae): the battle of the sexes. Biological Journal of the Linnean Society 101: 461-475. [ Links ]
35. Vega, L.E. 1999. Ecología trófica de Liolaemus multimaculatus (Sauria: Tropiduridae). Bolletino del Museo Regionale di Scienze Naturali di Torino 16: 27-38. [ Links ]
36. Whitford, W.G. 2002. Ecology of desert systems. Academic Press. [ Links ]
37. Zar, J.H. 1999. Biostatistical analysis. Prentice-Hall Inc. New Jersey, USA. [ Links ]
38. Znari, M.; El Mouden, E.; Benfaida, H. & Boumezzough. A. 2000. Partage des ressources spatiales et trophiques au sein d’un peuplement de lezards insectivores des Jbilets centrales (Maroc occidental). Revue d’Ecologie (Terre et Vie) 55: 141-160.














