Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Kurtziana
On-line version ISSN 1852-5962
Kurtziana vol.35 no.1 Córdoba Jan./June 2010
ARTÍCULOS ORIGINALES
Micrografía foliar de arbustos y pequeños árboles medicinales de la Provincia Biogeográfica de las Yungas (Argentina)
Ana M. Arambarri 1, 3, Susana E. Freire 1, 2, Néstor D. Bayón 1, Marta N. Colares 1, Claudia Monti 1, María C. Novoa 1 & Marcelo P. Hernández 1
1 Área de Botánica, Facultad de Ciencias Agrarias y Forestales, Calle 60 y 119, C.C. 31, 1900 La Plata, Universidad Nacional de La Plata, Argentina.
2 Instituto de Botánica Darwinion, Labardén 200, C.C. 22, B1642 HYD San Isidro, Buenos Aires. Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), Argentina.
3 Autor para correspondencia: Tel. +54-221-423-6758, int. 461; Fax: +54-221-425-2346. E-mail: anaramba@yahoo.com.ar; botgral@agro.unlp.edu.ar
Resumen
Micrografía foliar de arbustos y pequeños árboles medicinales de la Provincia Biogeográfica de las Yungas (Argentina).
Entre los arbustos y pequeños árboles que forman parte de la Selva de la Provincia Biogeográfica de las Yungas (Argentina), 55 especies pertenecientes a 24 familias son citadas como medicinales. El objetivo de este trabajo es proveer parámetros micrográficos foliares que permitan determinar estos taxones y faciliten efectuar el control de calidad. Para el estudio se empleó material fresco y ejemplares de herbario recuperados y fijados en FAA. Algunos de los principales caracteres de identificación son: los tipos de tricomas y de estomas; la presencia de estrías cuticulares; epidermis papilosa y/o hipodermis; los tipos de haces vasculares, de cristales y de estructuras secretoras. Se incluye una clave dicotómica e ilustraciones para la determinación de las especies y una interpretación ecológica de los caracteres hallados, tales como el predominio de caracteres mesohigromórficos en los arbustos y meso-xeromórficos por la aparición de algunos rasgos esclerófilos y xeromórficos en los pequeños árboles.
Palabras clave: Argentina; Micrografía foliar; Plantas medicinales; Provincia Biogeográfica de las Yungas.
Abstract
Foliar micrography of medicinal shrubs and small trees from Biogeographic Yungas Province (Argentina).
Fifty five species of shrubs and small trees belonging to 24 families which inhabit the Biogeographic Province of the Yungas (Argentina) have been cited with medicinal properties. The aim of this study is to provide leaf micrographic parameters to recognize these taxa as a tool to allow quality control. Fresh material and hydrated herbarium specimens fixed in FAA were surveyed. The main differential traits are: trichome and stomata types; presence of striate cuticle, papillose epidermis and/or presence of hypodermis; vascular bundle types; crystal and secretory structures types. As a result, we offer a dichotomic key to distinguish these 55 species and illustrations to clarify it. An ecological interpretation of leaf structures is also given. Predominantly, meso-hygromorphic traits are found in shrubs, while meso-xeromorphic traits are found in small trees due to the presence of some sclerophyllous and xeromorphic features.
Key words: Argentina; Foliar micrography; Medicinal plants; Yungas Biogeographic Province.
Introducción
La Provincia Biogeográfica de las Yungas se extiende en una faja relativamente estrecha y discontinua a lo largo de las laderas orientales de las montañas del noroeste de la Argentina, desde el extremo norte de Salta, el este de Jujuy y nuevamente por el centro de Salta y de Tucumán, alcanzando su expresión más austral en Catamarca (Cabrera, 1971, 1994; Cabrera & Willink, 1973). Se prolonga unos 600 km en sentido N-S y cubre una superficie de 34.000 km2, con un rango de altitud que va desde los 500 a los 2500-3500 m.s.m. Al este limita con la Provincia Chaqueña y al oeste con la Provincia Prepuneña o directamente con la Provincia de la Puna (Fig. 1). Las Yungas es un ecosistema con gran diversidad biológica, cuya formación biótica dominante es la selva nublada, acompañada por selvas de transición, bosques montanos y praderas. Desde épocas remotas ha resultado una fuente de recursos maderables, ornamentales, aromáticos y/o medicinales (Martínez Crovetto, 1981; Arenas, 2003). Vervoorst (1979) y Brown & Grau (1993), ponen de manifiesto la necesidad de conocer y conservar esta formación florística heterogénea, ya que cumple una función indiscutible dentro del ecosistema. En los últimos años nuevamente han recobrado su importancia las plantas de la flora autóctona, ya sea por su utilización en la medicina vernácula o en la elaboración de medicamentos fitoterapéuticos. Si bien existen numerosos estudios botánicos, florísticos (Burkart, 1952; Milano, 1959; Escalante, 1961; Digilio & Legname, 1966; Cabrera, 1978, 1983, 1993; Legname, 1982; Bravo, 1983; Ezcurra, 1983; Zardini, 1984; Rotman, 1986; Biloni, 1990; Boelcke, 1981; Brown & Grau, 1993; Fabris, 1993; Troncoso, 1993; Muñoz, 2000; Barboza et al., 2006) y etnobotánicos (Hieronymus, 1882; Sorarú & Bandoni, 1978; Ratera & Ratera, 1980; Toursarkissian, 1980; Martínez Crovetto, 1964, 1965, 1967, 1981; Arenas, 2003; Rondina et al., 2003; Hilgert & Gil, 2008), así como otros que analizan la anatomía y/o la composición química (Abiusso, 1957; Cortadi & Gattuso, 1994; Lorca et al., 1995; Cortadi et al., 1996; Ponessa et al., 1998a, 1998b; Ponessa & Parrado, 2001 ; Yajía et al., 1999; Barboza et al., 2001; Leonardi et al., 2002; Mandrile, 2005; Alonso & Desmarchelier, 2005; Cantero et al., 2005). Sin embargo, no existe un estudio histológico de conjunto de la flora leñosa de las Yungas. En el presente estudio se analiza la estructura foliar de 55 especies de arbustos y pequeños árboles que representan 37 géneros y 24 familias (Tabla 1). Muchas de estas especies son utilizadas en el presente en herboristerías y farmacias. Sobre esta base se plantea proveer parámetros micrográficos foliares de identificación, con el fin de contar con una herramienta para efectuar el control de calidad.

Fig. 1.- Mapa de la Provincia Biogeográfica de las Yungas (Argentina).
TABLA 1
Arbustos y pequeños árboles medicinales de la Provincia de las Yungas. C: corteza. H: hojas. F: flores. Fr: frutos. G: gajos. L: látex. Le: leño. Pl: planta. R: raíz. S: semillas. T: tallos.
Materiales y métodos
Para realizar el estudio se utilizaron fundamentalmente materiales de herbario (BA, BAB, LIL, LP, LPAG y SI) (Holmgren et al., 1990) y material fresco cultivado en el Jardín Botánico y Arboretum "C. Spegazzini" de la Facultad de Ciencias Agrarias y Forestales, Universidad Nacional de La Plata, el cual fue coleccionado e incorporado al herbario LPAG. En la Tabla 1 se indican: familia, nombre científico, porte y tipo de hoja, nombres vernáculos, usos y material estudiado. Los nombres científicos fueron tomados de Zuloaga & Morrone (1999) y de la edición actualizada "on line", para los nombres vulgares se consultó a De la Peña & Pensiero (2004).
Se emplearon hojas en completo estado de desarrollo. La morfología externa de la hoja fue examinada con un microscopio estereoscópico Wild M8. Para el estudio de la anatomía, los materiales frescos se fijaron directamente en formalina acetoalcohólica (F.A.A.), mientras que las muestras de herbario se hidrataron en estufa a 30-35 °C durante 24-48 horas previo a su fijación (D'Ambrogio de Argüeso, 1986). Los estudios epidérmicos fueron hechos sobre ambas caras de la lámina, en la parte media del semilimbo y sobre ambos lados de la vena media, empleando las hojas diafanizadas según la técnica de Dizeo de Stritmatter (1973) y en algunos casos, la técnica de impronta (Freeman, 1984). Para analizar las estructuras se practicaron cortes a mano alzada en la parte media del pecíolo y de la lámina en las hojas simples. En las hojas compuestas se realizaron los cortes en las distintas partes (pecíolo, raquis, peciólulo y folíolo, alcanzando los de segundo orden en las bicompuestas). Las secciones logradas fueron decoloradas con hipoclorito de sodio al 50% y lavadas para seguir dos caminos: (1) una parte de las secciones decoloradas se montaron en gelatina-glicerina incolora; (2) otra parte de las secciones se colorearon con verde de iodo y carmín alumbre o con violeta de cresilo o con safranina O en solución alcohólica al 80% para luego montarlas en gelatinaglicerina. En el análisis de la epidermis vista en superficie y los cortes transversales, así como la realización de los esquemas de las observaciones, se empleó un microscopio óptico Leitz SM Lux equipado con tubo de dibujo. El recuento de las células epidérmicas y de los estomas se realizó en la parte media de la lámina (sobre ambas caras cuando fueron anfistomáticas); no menos de dos recuentos en cada semilimbo y en la mayoría de las especies sobre dos muestras de la misma. Los valores obtenidos fueron empleados en el cálculo del índice estomático aplicando la fórmula [número de estomas / (número de estomas + número de células epidérmicas)] x 100 (Salisbury 1927). En el texto se expresan los valores promedios de índice estomático. Dentro del campo de observación del microscopio, no se consideraron aquellas células y estomas ubicados en el borde del área de observación o con menos de la mitad dentro del área. Las medidas en micrómetros fueron tomadas con ocular micrométrico con no menos de 20 repeticiones. La terminología empleada en las descripciones se corresponde con Metcalfe & Chalk (1950, 1979). Las imágenes fueron obtenidas con microscopio óptico Gemalux equipado con una cámara color PAL CCD, capturadas y digitalizadas por medio del software Hyper Media Center.
Resultados y Discusión
Epidermis vista en superficie. Las células epidérmicas presentan predominantemente paredes anticlinales curvilíneas, tendiendo a rectilíneas en la cara adaxial (e.g., Aloysia gratissima var. gratissima, Alvaradoa subovata (Fig. 2 A), Bixa orellana, Bocconia integrifolia, Castela coccinea, Coccoloba argentinensis, Piper spp., Rauvolfia shuelii, Vallesia glabra, Zanthoxylum fagara). Por un lado, se observó que a medida que aumenta el porte del vegetal o su distribución hacia la zona de transición con la Provincia Chaqueña (e.g., Castela coccinea), las paredes tienden a ser rectas y gruesas, lo cual estaría asociado a condiciones de aridez y/o mayor exposición a la radiación solar. Por otra parte, las paredes anticlinales de las células de la epidermis abaxial siempre presentan mayor ondulación que en la superficie adaxial, coincidiendo con la observación de Stace (1965) y está de acuerdo con Roth (1984), quien expresa que esta característica es atribuible a las condiciones de mayor sombra y humedad a que está expuesta.

Fig. 2.- Tejido epidérmico. A, Alvaradoa subovata: epidermis papilosa, paredes anticlinales rectilíneas y base de un tricoma eglandular. B, Zanthoxylum fagara: epidermis con estrías cuticulares, paredes anticlinales rectilíneas. C, Piper aduncum var. aduncum: estomas ciclocíticos. D, Buddleja tucumanensis: tricoma candelabro. E, Dodonaea viscosa: escama multicelular del tricoma. F, Tecoma stans: estoma anomocítico levemente hundido y escama de un tricoma escamoso peltado. Escalas: 50 μm.
Las ceras epicuticulares no resultaron significativas en el estudio con microscopio óptico. Sin embargo, la ornamentación cuticular, puesta de manifiesto como estrías cuticulares, permite caracterizar algunas especies y/o familias: Bixa orellana (Bixaceae), Schinus gracilipes (Anacardiaceae) y Zanthoxylum fagara (Rutaceae) (Fig. 2 B). En algunas especies, tales como Croton saltensis, Lippia spp. y Sambucus nigra subsp. peruviana son evidentes las estrías sobre los lados laterales de los estomas. Otro carácter interesante es la presencia en la epidermis de las Myrtaceae del par de células heteromorfas que cubren las cavidades secretoras internas, resultando un rasgo diagnóstico constante para la familia (Lorca et al., 1995; Arambarri et al., 2006, 2008).
Estomas. Aproximadamente el 75% de las especies analizadas tienen estomas anomocíticos. Estomas paracíticos fueron hallados en la mayoría de las especies del género Senna, aunque Senna spectabilis presenta paracíticos, anisocíticos y anomocíticos en la misma epidermis. Los estomas paracíticos también se encuentran en Croton spp. (Euphorbiaceae) y en Coutarea hexandra y Pogonopus tubulosus (Rubiaceae). En las Myrtaceae a menudo hay estomas paracíticos, frecuentemente junto a los de tipo anomocítico (Lorca et al., 1995; Cortadi et al., 1996; Guantay, 2004a, 2004b; Arambarri et al., 2006). El género Piper (Piperaceae) quedó caracterizado por los estomas ciclocíticos (Fig. 2 C) y tetracíticos, como ya habían sido hallados en Piper hieronymi y P. tucumanum (Cantero et al., 2005). Estomas diacíticos fueron observados en Lantana camara y Lippia alba var. alba (Verbenaceae) conjuntamente con anomocíticos y anisocíticos. En la mayoría de las especies se encuentra más de un tipo de estomas en la misma epidermis, lo cual ha sido reconocido en numerosas publicaciones científicas (Bernardello, 1982; Cosa de Gastiazoro, 1991; Colares et al., 1999; Rigonatto et al., 2005; Freire et al., 2005; Stenglein et al., 2005; Arambarri et al., 2006). Con respecto a la posición de los estomas en relación a las restantes células epidérmicas, se ha observado que en los arbustos los estomas se ubican ligeramente elevados, incluso hasta en columna, e.g., Buddleja spp. (Buddlejaceae); Dodonaea viscosa (Sapindaceae). En la familia Verbenaceae los estomas tienen distinto grado de elevación sobre la epidermis. En Lippia turbinata f. magnifolia y Lippia turbinata f. turbinata se encuentran elevados pero dentro de criptas, donde los acompañan numerosos tricomas, lo cual fue previamente descripto e ilustrado por Bonzani et al. (1997), (Barboza et al., 2001) y Coll Aráoz & Ponessa (2007). Los caracteres morfo-histológicos de las Verbenaceae son una combinación de rasgos higromórficos con xeromórficos. En los pequeños árboles los estomas generalmente se hallan a nivel o más o menos hundidos, e.g., Alvaradoa subovata, la que además posee una epidermis papilosa (Fig. 2 A). En otras especies con epidermis papilosa los estomas quedan hundidos entre las papilas (Berberis lilloana, Bocconia integrifolia, Carica spp., Polylepis australis y Senna spectabilis). En general, se ubican elevados en los arbustos y a nivel o ligeramente hundidos en los pequeños árboles, lo cual es coincidente con la menor exposición a los vientos e intensidad lumínica a que están sometidas las especies de menor porte. Sin embargo, existen algunos pequeños árboles de las familias Caprifoliaceae, Piperaceae y Solanaceae en cuyas hojas los estomas se hallan elevados sobre las restantes células epidérmicas. Este carácter ha sido hallado junto a rasgos higromórficos tales como abundante parénquima y escaso tejido mecánico, debido a condiciones húmedas y sombreadas de su hábitat de crecimiento. El caso más extremo es el de Solanum betaceum que crece en lugares muy húmedos (del Valle Perea et al., 2007) y muestra un mesofilo indiferenciado formado por parénquima homogéneo. Por el contrario, en la especie arbustiva Castela coccinea encontramos estomas con un anillo peristomático (reborde cuticular rodeando al ostíolo), lo que constituye una adaptación a ambientes secos y con alta luminosidad. Este carácter se suma a otros rasgos xeromórficos, hallados en la misma especie, como las células epidérmicas con las paredes celulares rectilíneas, comparativamente gruesas y la presencia de hipodermis hacia ambas caras de la lámina.
Por lo general, en los arbustos el índice estomático es mayor al 10% y menor al 10% en los pequeños árboles. Sin embargo, ciertas variaciones son producidas como consecuencia de la adaptación al ambiente donde la especie crece, e.g., al considerar las tres especies de Carica estudiadas, todas ellas con un porte similar, se observa que C. glandulosa y C. papaya tienen un índice estomático mayor al 10 %, mientras que Carica quercifolia tiene un índice de 4-6%. Esto constituye una adaptación a ambientes más secos y luminosos.
La mayoría de las especies tienen láminas hipostomáticas. Sin embargo, se han encontrado anfistomáticas en: Abutilon grandifolium, Aloysia polystachya, Croton saltensis, Lippia spp., Nicotiana glauca, Piper aduncum var. aduncum, Sambucus nigra subsp. peruviana, Senna subulata, Solanum granulosum-leprosum, Tessaria spp. y Vallesia glabra. Esto se da preferentemente en arbustos y pequeños árboles que viven en lugares sombreados y por ende menos expuestos a factores deshidratantes (vientos y alta luminosidad). Este hecho concuerda con el concepto de Roth (1984) quien afirma que este rasgo es frecuente en hojas de especies con caracteres higromórficos que crecen en lugares donde siempre hay disponibilidad de agua. El caso de Vallesia glabra es peculiar y merece un análisis más profundo; en este arbusto se combinan caracteres higromórficos, tales como la ausencia de fibras esclerenquimáticas junto al tejido vascular, con rasgos esclerófilos, como es la presencia de esclereidas idioblásticas en el parénquima foliar. Probablemente, esta variabilidad de caracteres demuestra la plasticidad y capacidad de adaptación con que cuenta esta especie.
Tricomas. De las especies estudiadas el 95% presenta epidermis con indumento. Siguiendo la clasificación de tricomas de Metcalfe & Chalk (1979), entre las distintas formas de pelos estrellados se encuentran: (1) multiangulado pedunculado con forma de arbolito (Metcalfe & Chalk, 1979), descriptos por Petenatti et al. (1998) como multiangulados con tricopodio pluricelular, cuyas células se disponen en varias ringleras (Solanum granulosum-leprosum); (2) estrellado con una célula proyectada desde el centro, porrecto-estrellados (Croton saltensis), también previamente mencionados en Solanum granulosum-leprosum (Petenatti et al., 1998); (3) rotado-estrellados con un número variable de ramas (Abutilon grandifolium y Pavonia sepium subsp. sepium); (4) estrellado candelabriformes en Buddleja spp. (Fig. 2 D). Los tricomas escamoso-peltados, ubicados en depresiones de la epidermis se encuentran en Coccoloba argentinensis, Dodonaea viscosa (Fig. 2 E), Tecoma stans (Fig. 2 F) y Zanthoxylum fagara. Estos tricomas fueron previamente encontrados en otros géneros y especies de las familias Bignoniaceae, Rutaceae y Sapindaceae (Leonardi et al., 2002; Freire et al., 2005; Arambarri et al., 2006).
Los nidos pilosos se hallan en Baccharis salicifolia (Asteraceae), como fue mencionado e ilustrado para el género por diversos autores (Ariza Espinar, 1973; Freire et al., 2005, 2007). Las Verbenaceae presentan tricomas eglandulares simples sobre cojinete o pedestal o cistolíticos y los glandulares con un número variable de células (Metcalfe & Chalk, 1950; Bonzani et al., 1997, 2003; Bassols & Gurni, 1998; Barboza et al., 2001). Los géneros Aloysia, Lantana y Lippia están estrechamente relacionados (Bonzani et al., 1997), los resultados del presente estudio evidencian una similitud aún mayor entre Aloysia y Lippia.
Los tricomas hallados en las especies de Piper estudiadas, ya fueron descriptos e ilustrados para P. aduncum var. aduncum (Barboza et al., 2001) y P. hieronymi (Cantero et al., 2005). Entre los 55 arbustos y pequeños árboles analizados, más del 50% tiene tricomas glandulares. Los tricomas glandulares generalmente son de pie corto (1-2-celular), siendo menos comunes los de pie largo 5-6 celular (e.g., Sambucus nigra subsp. peruviana, Solanum betaceum); la cabeza es 1-celular globosa (e.g., Lantana camara, Lippia alba var. alba) (Fig. 3 A), 2-celular o 4-pluricelular globosa o alargada, bi o pluriseriados (e.g., Lippia spp., Piper spp., Sambucus nigra subsp. peruviana, Schinus gracilipes, Solanum betaceum, Tessaria spp.) (Fig. 3 B). Los tricomas observados son coincidentes con los reportados en trabajos previos (Freire et al., 2005; Arambarri et al., 2006, 2008), muchos de ellos caracterizan géneros y/o familias. Estos resultados están en concordancia con Metcalfe & Chalk (1979) quienes sugieren que la estructura de los tricomas es un carácter estable de significativo valor taxonómico.

Fig. 3.- Tricomas glandulares y características estructurales internas. A, Lippia alba var. alba: tricoma glandular con pie corto y cabeza unicelular globosa. B, Schinus gracilipes: pie unicelular, cabeza pluricelular, biseriada. C, Myrcianthes cisplatensis: corte transversal del mesofilo: mostrando la hipodermis. D, Solanum betaceum: corte transversal del mesofilo mostrando el parénquima indiferenciado, homogéneo. E, Piper aduncum var. aduncum: vista en superficie de células oleosas en el mesofilo. Escalas: 50 μm.
Lámina en corte transversal. Todas las especies tienen epidermis unistratas con cutícula delgada. En algunas especies de Aloysia se observa una capa discontinua de hipodermis adaxial, mientras que en Bocconia integrifolia, Myrcianthes cysplatensis (Fig. 3 C), Myrcianthes pungens y Polylepis australis dicha capa es continua. En Castela coccinea, Piper aduncum var. aduncum y Piper amalago se encuentra una capa de hipodermis hacia ambas caras de la lámina. La función de esta capa es acumular agua para reducir el efecto de la deshidratación y el exceso de radiación solar sobre el clorénquima (Roth, 1995), por tal razón es más frecuente su posición hacia la cara adaxial más expuesta, y sus células son de mayor tamaño que en la hipodermis abaxial.
Coincidentemente esta capa protectora está presente en arbustos y pequeños árboles de lugares húmedos pero luminosos (e.g., Myrcianthes spp.) y en especies que prosperan en lugares más rigurosos (e.g., Castela coccinea y Polylepis australis). De acuerdo con las observaciones se cree que el tipo de mesofilo está estrechamente relacionado con las condiciones predominantes del lugar donde crece la especie.
Frecuentemente el mesofilo es dorsiventral con un parénquima en empalizada formado por varias capas de células relativamente cortas y anchas. En algunos árboles pequeños (e.g., Zanthoxylum fagara), este tejido está integrado por una capa de células más largas y delgadas, lo que para Roth (1984) es parte de una adaptación a condiciones de elevada radiación solar. Las especies analizadas de Myrcianthes y Tessaria mostraron un mesofilo isolateral. En el caso de Aloysia gratissima var. gratissima, Lippia alba var. alba, Lippia turbinata f. magnifolia y Lippia turbinata f. turbinata el mesofilo isolateral está poco diferenciado tendiendo a uno indiferenciado de tipo empalizada. En Dodonaea viscosa y Nicotiana glauca se encontró que la estructura del mesofilo varía entre dorsiventral e isolateral según el origen de las muestras. Por último, una estructura netamente higromórfica se halló en Solanum betaceum con mesofilo indiferenciado de tipo homogéneo (Fig. 3 D).
La vena media en corte transversal presenta la cara adaxial convexa (Fig. 4 A), más raramente plana (Fig. 4 C) o cóncava (Fig. 4 G). El tejido vascular puede estar formado por un haz colateral (e.g., Senna spectabilis) (Fig. 4 C); un haz bicolateral (e.g., Rauvolfia schuelii) (Fig. 4 I, J); varios haces colaterales libres dispuestos en fila (e.g., Tessaria absinthioides) (Fig. 5 A) o varios haces dispuestos en círculo (e.g., Coccoloba argentinensis) (Fig. 5 C). Frecuentemente en la vena media se encuentra un arco abaxial de haces colaterales unidos y un número variable de haces adaxiales inversos, con el xilema interno (e.g., Coutarea hexandra) (Fig. 5 E, F); en algunas especies estos haces se unen tendiendo a formar un anillo vascular (e.g., Pogonopus tubulosus) (Fig. 5 G, H).

Fig. 4.- Secciones transversales de las partes de la hoja. A, B, Croton saltensis: A, vena media con cara adaxial convexa, fibras ausentes; B, pecíolo subcircular. C-F, Senna spectabilis: C, vena media con cara adaxial plana, haz vascular colateral con anillo de fibras; D, pecíolo bilobado; E, raquis bilobado; F, peciólulo asimétrico, corteza colenquimática. G, H, Buddleja tucumanensis: G, vena media con cara adaxial cóncava, parénquima medular lignificado; H, pecíolo bialado; I, J, Rauvolfia shuelii: I, vena media con cara adaxial convexa, haz vascular bicolateral, ausencia de fibras, presencia de tubos laticíferos; J, pecíolo bilobado. Escalas: A, C, G, I: 500 μm. B, D-F, H, J: 1 mm.
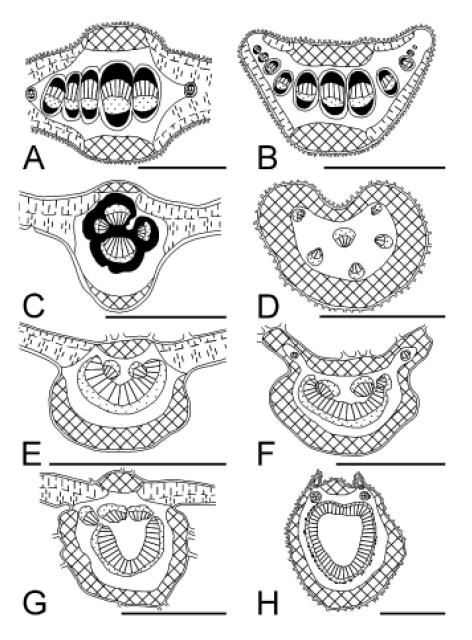
Fig. 5.- Secciones transversales de las partes de la hoja. A, B, Tessaria absinthioides: A, vena media con cara adaxial convexa, haces colaterales en fila con casquetes de fibras; B, pecíolo semicircular bilobado con arco de haces colaterales. C, D, Coccoloba argentinensis: C, vena media con cara adaxial convexa, haces vasculares dispuestos en círculo con abundante tejido esclerenquimático; D, pecíolo parenquimático con haces abaxiales y adaxial inverso. E, F, Coutarea hexandra: E, vena media con arco abaxial de tejido vascular y dos haces adaxiales inversos, con el xilema interno, ausencia de esclerénquima; F, pecíolo bilobado. G, H, Pogonopus tubulosus: G, vena media con un arco abaxial de tejido vascular y haces adaxiales inversos formado casi un anillo, esclerénquima ausente; H, pecíolo bilobado, con un anillo de tejido vascular. Escalas: A, C, E-G: 500 μm. B, D, H: 1 mm.
El tipo de haz vascular y la manera de disponerse han sido previamente observados en otras especies de los mismos géneros (Arambarri, 2003; Arambarri et al., 2006, 2008), por lo cual constituye un rasgo de importancia taxonómica a nivel de género y familia.
En la mayoría de las especies estudiadas el xilema y el floema están rodeados por parénquima (Figs. 4 A, I y 5 E, G), mientras que en una minoría hay fibras aisladas o pequeños paquetes de fibras junto al tejido vascular (Aloysia citriodora, A. virgata var. virgata, Brunfelsia uniflora, Lippia integrifolia, Pavonia sepium subsp. sepium, Senna pendula var. eriocarpa, Senna subulata, Tecoma stans y Zanthoxylum fagara), o las fibras forman verdaderos casquetes o anillos esclerenquimáticos (Allophylus edulis, Berberis lilloana, Coccoloba argentinensis, Eugenia uniflora, Myrcianthes cisplatensis, M. pungens, Senna spectabilis y Tessaria spp.) (Figs. 4 C y 5 A, C).
Este aumento del tejido mecánico coincide en general con un incremento del porte, de arbustivo hacia arbóreo, características que ya fueron registradas al estudiar la flora arbustiva y arbórea de Misiones (Arambarri et al., 2008). Este aumento del tejido mecánico estaría dado por una mayor exposición a condiciones climáticas más luminosas, lo cual se halla en concordancia con lo sostenido por Metcalfe & Chalk (1979) y Roth (1984) quienes adjudican a esa condición ambiental la aparición del carácter esclerófilo de presencia de fibras.
Pecíolo y raquis en corte transversal. Su contorno puede ser subcircular sin lóbulos (Fig. 4 B). Frecuentemente, la cara adaxial o ventral es plana o cóncava dando origen a un pecíolo o raquis bilobado (Figs. 4 D, E, J, 5 B, D, F y H) o bialado (Fig. 4 H). La anatomía se corresponde con la de la lámina, generalmente con un incremen to de los tejidos mecánicos, cristales y estructuras secretoras.
Peciólulo. Este presenta estructura similar al raquis o más frecuentemente presenta tejido cortical parenquimático o colenquimático rodeando al tejido vascular (Fig. 4 F).
Cristales y estructuras secretoras internas. Los cristales que predominan son las drusas. Tanto en las especies pertenecientes a Verbenaceae como en las del género Buddleja (Buddlejaceae) se encontraron drusas de menor tamaño (Arambarri et al., 2008), lo que sumado a sus estomas elevados en columna, denotaría la probable proximidad taxonómica entre estas familias. Se hallaron rafidios únicamente en Piper aduncum var. aduncum. Arena cristalina se encontró en: Coutarea hexandra y Pogonopus tubulosus (Rubiaceae); Sambucus nigra subsp. peruviana (Caprifoliaceae); Piper amalago (Piperaceae); Nicotiana glauca, Solanum betaceum, Solanum granulosum-leprosum, Vassobia breviflora (Solanaceae). Los tipos de células, cavidades y conductos secretores que se observaron en las distintas especies (Figs. 3 E; 4 A, B, I y J), están en estrecha coincidencia con los resultados de trabajos previos y citas tomadas de Metcalfe & Chalk (1950).
Clave para la determinación de arbustos y pequeños árboles medicinales de las Yungas
1. Hojas glabras
Grupo A
1'. Hojas pubescentes
2. Epidermis papilosa
Grupo B
2'. Epidermis no papilosa
3. Presencia de hipodermis
Grupo C
3'. Ausencia de hipodermis
4. Parénquima con arena cristalina
Grupo D
4'. Parénquima sin arena cristalina
5. Epidermis con tricomas escamoso-peltados o estrellados
6. Presencia de tricomas escamoso-peltados
Grupo E
6'. Presencia de tricomas estrellados
Grupo F
5'. Epidermis sin tricomas escamoso-peltados ni estrellados
7. Epidermis con tricomas urticantes, cistolíticos, con cojinete, pedestal o formando nidos pilosos
Grupo G
7'. Epidermis con tricomas no urticantes, no cistolíticos, sin cojinete ni pedestal, no formando nidos pilosos
Grupo H
Grupo A. Hojas glabras
1. Parénquima con arena cristalina
1. Nicotiana glauca
1'. Parénquima sin arena cristalina
2. Pecíolo en corte transversal notablemente bilobado. Parénquima con tubos laticíferos. Presencia de drusas
2. Rauvolfia schuelii (Fig. 4 J)
2'. Pecíolo en corte transversal sin lóbulos o sólo ligeramente lobado. Parénquima sin tubos laticíferos. Presencia de maclas y drusas
3. Eugenia uniflora
Grupo B. Hojas pubescentes. Epidermis papilosa
1. Ambas epidermis adaxial y abaxial papilosas
2. Vena media con el haz vascular sin esclerénquima o bien si presente, es escaso
3. Presencia de hipodermis adaxial
4. Polylepis australis
3'. Ausencia de hipodermis adaxial
5. Alvaradoa subovata (Fig. 2 A)
2'. Vena media con el haz vascular con conspicuos casquetes de fibras esclerenquimáticas
6. Berberis lilloana
1'. Solamente la epidermis abaxial papilosa
4. Vena media con el haz vascular rodeado por un anillo de fibras esclerenquimáticas
7. Senna spectabilis (Fig. 4 C)
4'. Vena media con el haz vascular rodeado por parénquima, sin fibras esclerenquimáticas
5. Vena media en corte transversal con la cara adaxial plana. Pecíolo en corte transversal bilobado
8. Bocconia integrifolia
5'. Vena media en corte transversal, con la cara adaxial notablemente convexa. Pecíolo en corte transversal sin lóbulos
6. Pecíolo fistuloso
7. Índice estomático 13-14%
9. Carica glandulosa
7'. Índice estomático 15-18%
10. Carica papaya
6'. Pecíolo macizo. Índice estomático 4-6%
11. Carica quercifolia
Grupo C. Hojas pubescentes. Epidermis no papilosa. Presencia de hipodermis
1. Epidermis vista en superficie con células heteromorfas apareadas. Hipodermis adaxial
2. Vena media en corte transversal y hacia la cara adaxial con presencia de clorénquima entre el colénquima y el tejido vascular
12. Myrcianthes pungens
2'. Vena media en corte transversal y hacia la cara adaxial con ausencia de clorénquima entre el colénquima y el tejido vascular
13. Myrcianthes cisplatensis (Fig. 3 C)
1'. Epidermis vista en superficie sin células heteromorfas apareadas. Hipodermis adaxial y abaxial
3. Estomas anomocíticos. Mesofilo isolateral. Presencia de drusas. Ausencia de células oleosas
14. Castela coccinea
3'. Estomas tetracíticos y ciclocíticos. Mesofilo dorsiventral. Ausencia de drusas. Presencia de células oleosas
4. Presencia de rafidios. Ausencia de arena cristalina
15. Piper aduncum var. aduncum (Figs. 2 C y 3 E)
4'. Ausencia de rafidios. Presencia de arena cristalina
16. Piper amalago
GRUPO D. Hojas pubescentes. Parénquima con arena cristalina
1. Vena media con un haz bicolateral
2. Pecíolo en corte transversal bilobado
3. Tricomas estrellados presentes. Parénquima sin drusas
17. Solanum granulosum-leprosum
3'. Tricomas estrellados ausentes. Parénquima con drusas
18. Vassobia breviflora
2'. Pecíolo en corte transversal sin lóbulos
4. Lámina hipostomática. Mesofilo indiferenciado de tipo parenquimático homogéneo
19. Solanum betaceum (Fig. 3 D)
4'. Lámina anfistomática. Mesofilo diferenciado, dorsiventral o isolateral
1. Nicotiana glauca
1'. Vena media con varios haces colaterales
5. Lámina anfistomática. Estomas anomocíticos
20. Sambucus nigra subsp. peruviana
5'. Lámina hipostomática. Estomas paracíticos
6. Pecíolo con un arco de haces abaxiales y dos haces adaxiales inversos. Ausencia de drusas
21. Coutarea hexandra (Fig. 5 F)
6'. Pecíolo con anillo de tejido vascular formado por unión de los haces abaxiales y adaxiales inversos. Presencia de drusas
22. Pogonopus tubulosus (Fig. 5 H)
Grupo E. Epidermis con tricomas escamoso-peltados
1. Presencia de drusas en el mesofilo
2. Vena media con un arco abaxial de haces colaterales unidos y algunos haces adaxiales inversos. Esclerénquima escaso. Epidermis con estrías cuticulares conspicuas
23. Zanthoxylum fagara (Fig. 2 B)
2'. Vena media con un anillo de haces colaterales. Esclerénquima abundante. Epidermis con estrías cuticulares inconspicuas.
24. Coccoloba argentinensis (Fig. 5 C)
1'. Ausencia de drusas en el mesofilo
3. Escama de los tricomas formada por más de 16 células. Vena media en corte transversal con la cara adaxial convexa
25. Dodonaea viscosa (Fig. 2 E)
3'. Escama de los tricomas formada por 10-16 células. Vena media en corte transversal con la cara adaxial cóncava
26. Tecoma stans (Figs. 2 F)
Grupo F. Epidermis con tricomas estrellados
1. Tricomas estrellados candelabriformes. Vena media en corte transversal con la cara adaxial cóncava. Pecíolo en corte transversal bialado
2. Indumento denso en ambas caras. Tricomas con artejos de 90-250 μm long. En la vena media, el arco formado por el tejido vascular encierra tejido parenquimático
27. Buddleja stachyoides
2'. Indumento escaso en la cara adaxial. Tricomas con artejos de 20 a 50 μm long. En la vena media, el arco formado por el tejido vascular encierra tejido parenquimático lignificado
28. Buddleja tucumanensis (Fig. 2 D; Fig. 4 G)
1'. Tricomas estrellados nunca candelabriformes. Vena media en corte transversal con la cara adaxial convexa. Pecíolo en corte transversal subcircular, sin lóbulos
3. Tricomas porrecto-estrellados. Estomas paracíticos. Vena media con varios haces vasculares colaterales abaxiales y adaxiales inversos con xilema interno. Parénquima con tubos laticíferos
29. Croton saltensis (Fig. 4 A y B)
3'. Tricomas nunca porrecto-estrellados. Estomas anomocíticos y anisocíticos. Vena media con un haz vascular colateral. Parénquima sin tubos laticíferos pero con células y cavidades mucilaginíferas
4. Lámina anfistomática. Estomas anomocíticos, ligeramente elevados con respecto a las restantes células epidérmicas
30. Abutilon grandifolium
4'. Lámina hipostomática. Estomas anomocíticos y anisocíticos dispuestos a nivel con respecto a las restantes células epidérmicas
31. Pavonia sepium subsp. sepium
Grupo G. Epidermis con tricomas urticantes, cistolíticos, con cojinete, pedestal o formando nidos pilosos
1. Indumento en forma de nidos pilosos (tricomas glandulares y eglandulares formando manojos ubicados en depresiones epidérmicas)
32. Baccharis salicifolia
1'. Indumento de otro tipo
2. Presencia de tricomas urticantes
33. Urera baccifera
2'. Ausencia de tricomas urticantes
3. Presencia de criptas en la epidermis abaxial
4. Pecíolo en corte transversal bilobado, un haz irriga cada lóbulo. Corteza con colénquima subepidérmico continuo
34. Lippia turbinata f. magnifolia
4'. Pecíolo en corte transversal bialado, dos a cuatro haces irrigan cada ala. Corteza con colénquima subepidérmico discontinuo
35. Lippia turbinata f. turbinata
3'. Ausencia de criptas en la epidermis abaxial
5. Tejido vascular de la vena media con grupos de fibras floemáticas
6. Lámina anfistomática. Estomas ligeramente hundidos. Tejido vascular formado por un arco abaxial de xilema y floema con casquete de fibras floemáticas. Vaina parenquimática inconspicua
36. Lippia integrifolia
6'. Lámina hipostomática. Estomas elevados, incluso en columna. Tejido vascular formado por un arco abaxial y un arco adaxial inverso de xilema y floema, ambos con casquetes de fibras floemáticas. Vaina parenquimática conspicua
37. Aloysia citriodora
5'. Tejido vascular de la vena media sin grupos de fibras floemáticas
7. Vena media en corte transversal con la cara adaxial convexa
8. Lámina anfistomática
38. Lippia alba var. alba (Fig. 3 A)
8'. Lámina hipostomática
9. Estomas anomocíticos. Índice estomático 17-18%
39. Aloysia virgata var. virgata
9'. Estomas diacíticos, anisocíticos y anomocíticos. Índice estomático18-21%
40. Lantana camara
7'. Vena media en corte transversal con la cara adaxial plano-cóncava o cóncava
10. Lámina hipostomática
41. Aloysia gratissima var. gratissima
10'. Lámina anfistomática
11. Vena media con un arco abaxial de floema y xilema y haces adaxiales inversos con floema y xilema. Pecíolo en corte transversal levemente bilobado
42. Aloysia polystachya
11'. Vena media con un arco abaxial de floema y xilema y haces adaxiales inversos reducidos a solamente floema. Pecíolo en corte transversal bialado
43. Lippia grisebachiana
Grupo H. Epidermis con tricomas no urticantes, no cistolíticos, sin cojinete ni pedestal, no formando nidos pilosos
1. Vena media con haces vasculares con conductos secretores en el parénquima del floema
44. Schinus gracilipes (Fig. 3 B)
1'. Vena media con haces vasculares sin conductos secretores en el parénquima del floema
2. Mesofilo isolateral
3. Mesofilo con cavidades secretoras. Pecíolo con un anillo de tejido vascular y un haz vascular en la médula
45. Bixa orellana
3'. Mesofilo sin cavidades secretoras. Pecíolo con un arco formado por haces colaterales libres con tamaño decreciente hacia los bordes
4. Pecíolo en corte transversal bilobado
46. Tessaria absinthioides (Fig. 5 A y B)
4'. Pecíolo en corte transversal sin lóbulos marcados
5. Tricomas 4-5-pluricelulares muy escasos. Predominio de tricomas glandulares pluriseriados ubicados en depresiones de la epidermis
47. Tessaria dodoneifolia
5'. Tricomas 2-3 celulares numerosos formando pubescencia muy densa.
48. Tessaria integrifolia
2'. Mesofilo dorsiventral
6. Vena media en corte transversal con la cara adaxial aquillada. Tejido vascular formado por varios haces abaxiales y adaxiales inversos
49. Allophylus edulis
6'. Vena media en corte transversal con la cara adaxial no aquillada. Tejido vascular formado por un haz colateral o bicolateral abaxial
7. Vena media con un haz vascular bicolateral
8. Presencia de esclereidas idioblásticas en el parénquima del mesofilo y en la corteza del pecíolo
50. Vallesia glabra
8'. Ausencia de esclereidas idioblásticas en el parénquima del mesofilo y en la corteza del pecíolo
51. Brunfelsia uniflora
7'. Vena media con un haz vascular colateral
9. Estomas anomocíticos. Presencia de conductos secretores asociados al tejido vascular
52. Eupatorium inulifolium
9'. Estomas paracíticos. Ausencia de conductos secretores asociados al tejido vascular
10. Lámina anfistomática. Vena media en corte transversal con la cara adaxial convexa
53. Senna subulata
10'. Lámina hipostomática. Vena media en corte transversal con la cara adaxial plana
11. Vena media con fibras junto al haz vascular
12. Epidermis abaxial papilosa
7. Senna spectabilis (Fig. 4 C-F)
12'. Epidermis abaxial no papilosa
54. Senna pendula var. eriocarpa
11'. Vena media sin fibras junto al haz vascular
55. Senna morongii
Conclusiones
Características estructurales de la hoja de valor taxonómico
Se ha podido confeccionar una clave de diferenciación entre las especies estudiadas basada en la micrografía foliar. Entre los caracteres estudiados con valor taxonómico se destacan: (1) epidermis con notable ornamentación cuticular (Bixa orellana, Schinus gracilipes y Zanthoxylum fagara); (2) epidermis adaxial con células heteromorfas apareadas sobre las cavidades secretoras internas (Myrtaceae); (3) estomas ciclocíticos y tetracíticos en Piper spp. (Piperaceae); (4) epidermis papilosa en una o ambas epidermis (Alvaradoa subovata, Berberis lilloana, Bocconia integrifolia, Carica spp., Polylepis australis y Senna spectabilis); (5) presencia de tricomas eglandulares cistolíticos y con pedestal (Verbenaceae); (6) tricomas urticantes y cistolitos en Urera baccifera (Urticaceae); (7) tricomas rotado-estrellados y cavidades mucilaginíferas en el mesofilo (Malvaceae); (8) tricomas estrellados candelabriformes (Buddlejaceae); (9) tricomas escamoso-peltados en depresiones de las epidermis en Coccoloba argentinensis (Polygonaceae), Dodonaea viscosa (Sapindaceae), Tecoma stans (Bignoniaceae) y Zanthoxylum fagara (Rutaceae); (10) presencia de hipodermis en Bocconia integrifolia, Castela coccinea, Myrcianthes cysplatensis, M. pungens, Piper aduncum var. aduncum, P. amalago, Polylepis australis; (11) presencia de haces bicolaterales (Apocinaceae, Myrtaceae, Solanaceae); (12) presencia de cristales (drusas) comparativamente pequeñas y estomas elevados hasta en columna en las especies de Buddleja (Buddlejaceae) y las especies de Aloysia, Lantana y Lippia (Verbenaceae). Los diferentes tipos de cristales son caracteres con valor diagnóstico para diferenciar especies y/o familias.
Características estructurales de la hoja en relación con el ambiente
Los arbustos de las Yungas presentan características foliares meso-higromórficas: (1) células de la epidermis adaxial vista en superficie, con paredes anticlinales curvilíneas; (2) cutícula delgada; (3) epidermis generalmente pubescente; (4) estomas ubicados desde ligeramente elevados a notablemente elevados con respecto a las restantes células epidérmicas; (5) ausencia de hipodermis; (6) mesofilo con parénquima en empalizada pluristrato; (7) empalizada de células cortas y anchas; (8) parénquima esponjoso abundante y laxo; (9) vena media con fibras escasas o ausentes.
Los pequeños árboles de las Yungas presentan características foliares mesoxeromórficas con cambios adaptativos a ambientes más expuestos a la radiación solar y a la influencia del viento que provocan la aparición de caracteres esclerófilos y xeromórficos, tales como: (1) células de la epidermis adaxial vista en superficie, con paredes anticlinales rectilíneas; (2) cutícula delgada; (3) epidermis glabrescente o glabra; (4) estomas ubicados a nivel o ligeramente hundidos con respecto a las restantes células epidérmicas; (5) frecuente presencia de hipodermis; (6) mesofilo con parénquima en empalizada unistrato; (7) empalizada de células comparativamente largas y angostas; (8) parénquima esponjoso más o menos abundante y denso; (9) vena media con grupos, casquetes o un anillo de fibras esclerenquimáticas y ocasionalmente presencia de esclereidas en el parénquima foliar.
Agradecimientos
Agradecemos al Sr. Santiago M. Martínez por su colaboración en la búsqueda de material fresco y de herbario y en la realización de preparaciones histológicas, lo cual hacemos extensivo a la Ing. Agr. Vanesa G. Perrotta. Gracias a los curadores de los Herbarios quienes gentilmente nos cedieron ejemplares para desarrollar nuestro estudio. A la Profesora María A. Migoya por la preparación del mapa y digitalización de los dibujos esquemáticos. Nuestro reconocimiento a los revisores anónimos y a la Comisión de Incentivos a los docentes-investigadores, Decreto 2427/93. (Secretaría de Política Universitaria, Ministerio de Educación de la Nación Argentina).
Referencias bibliográficas
1. Abiusso, N. G. 1957. Estudio químico de algunas especies argentinas del género Cassia. Revista de Investigaciones Agrícolas 11: 259-285. [ Links ]
2. Alonso J. & C. Desmarchelier. 2005. Plantas medicinales autóctonas de la Argentina. LOLA (Literature of Latin America), Buenos Aires. [ Links ]
3. Amat, A. G. & M. E. Yajía. 1991. Plantas medicinales y etnofarmacología en la provincia de Misiones (Argentina). Acta Farm. Bonaerense 10: 153-159. [ Links ]
4. Amat, A. G., G. A. De Battista & R. F. Uliana. 1999. Diuretic activity of Eugenia uniflora L. (Myrtaceae) aqueous extract. Acta Hort. 501: 155-158. [ Links ]
5. Arambarri, A.M. 2003. Morfología, Anatomía y formaciones cristalinas en especies del género Senna, sección Chamaefistula de la Argentina (Leguminosae- Caesalpinioideae-Cassieae-Cassinae). Tesis. Sitio para la difusión de la creación intelectual de la UNLP. http:///www.sedici.unlp.edu.ar [ Links ]
6. Arambarri, A. M., S. E. Freire, M. N. Colares, N. D. Bayón, M. C. Novoa, C. Monti & S. A. Stenglein. 2006. Leaf anatomy of medicinal shrubs and trees from Gallery forests of the paranaense province (Argentina). Part 1. Bol. Soc. Argent. Bot. 41: 233-268. [ Links ]
7. Arambarri, A. M., S. E. Freire, M. N. Colares, N. D. Bayón, M. C. Novoa, C. Monti & S. A. Stenglein. 2008. Leaf anatomy of medicinal shrubs and trees from Misiones forest of the paranaense province (Argentina). Part 2. Bol. Soc. Argent. Bot. 43: 31-60. [ Links ]
8. Arbo, M. & S. Tressens (eds.) 2002. Flora del Iberá. EUDENE, Universidad Nacional del Nordeste. [ Links ]
9. Arenas P. 2003. Etnografía y alimentación entre los Toba- Nachilamole'ek y Wichi-Lhuku'tas del Chaco central (Argentina). CONICET, CEFYBO, IBODA. [ Links ]
10. Ariza Espinar, L. 1973. Las especies de Baccharis (Compositae) de Argentina central. Bol. Acad. Nac. Ci., Córdoba 50: 175-305. [ Links ]
11. Arun M. & V. Asha. 2008. Gastroprotective effect of Dodonaea viscosa on various experimental ulcer models. J. Ethnopharmacol. 118: 460-465. [ Links ]
12. Barboza, G. E., N. Bonzani, E. M. Filippa, M. C. Luján, R. Morero, M. Bugatti, N. Decolatti & L. Ariza Espinar. 2001. Atlas histo-morfológico de plantas de interés medicinal de uso corriente en Argentina. Museo Botánico Córdoba, Serie Especial I. Córdoba. [ Links ]
13. Barboza, G. E., J. J. Cantero, C. O. Núñez & L. Ariza Espinar (eds). 2006. Flora medicinal de la provincia de Córdoba (Argentina). Museo Botánico Córdoba. [ Links ]
14. Bassols, G. B. & A. A. Gurni. 1996. Especies de Lippia empleadas en medicina popular latinoamericana. Dominguezia 13: 7-25. [ Links ]
15. Bassols, G. B. & A. A. Gurni. 1998. Posibles adulterantes del poleo (Lippia turbinata Griseb., Verbenaceae). Acta Farm. Bonaerense 17: 191-196. [ Links ]
16. Bassols, G. B. & A. A. Gurni. 2001. Estudio epidérmico comparativo entre el ¨Poleo criollo¨ (Lippia turbinata Griseb.-Verbenaceae) y el ¨Poleo europeo¨ (Mentha pulegium L.- Lamiaceae). Acta Farm. Bonaerense 20: 105-108. [ Links ]
17. Bernardello L. M. 1982. Estudios en Lycium (Solanaceae). I. Anatomía de hoja y tallo y sus diferencias con Grabowskia. Bol. Soc. Argent. Bot. 21: 153-185. [ Links ]
18. Bianco, C.A. y T. A. Kraus.1997. Observaciones sobre las especies de Senna (Leguminosae-Caesalpinoidea) del sur de la provincia de Córdoba. Multequina 6: 33-47. [ Links ]
19. Biloni, J. S. 1990. Árboles autóctonos argentinos. Tipográfica Editora Argentina. Buenos Aires. [ Links ]
20. Boelcke, O. 1981. Plantas vasculares de la Argentina, nativas y exóticas. FECIC, Buenos Aires. [ Links ]
21. Bonzani, N. E., E. M. Filippa & G. E. Barboza. 1997. Particularidades epidérmicas en algunas especies de Verbenaceae. Anales Inst. Biol. Univ. Nac. Autón. México, Ser. Bot. 68: 47-56. [ Links ]
22. Bonzani, N. E., E. M. Filippa & G. E. Barboza. 2003. Estudio anatómico comparativo de tallo en algunas especies de Verbenaceae. Anales Inst. Biol. Univ. Nac. Autón. México, Ser. Bot. 74: 31-45. [ Links ]
23. Bravo, L. D. 1983. Loganiaceae, en A. L. Cabrera (dir.), Flora de la provincia de Jujuy. Colecc. Cient. I.N.T.A. 8: 39-54. [ Links ]
24. Brown, A. D. & H. R. Grau. 1993. La naturaleza y el hombre en las selvas de montaña. Colección nuestros ecosistemas. Proyecto GTZ. Desarrollo agroforestal en comunidades rurales del noroeste argentino. Salta. [ Links ]
25. Burkart, A. 1952. Las Leguminosas Argentinas (ed. 2). ACME. Buenos Aires. [ Links ]
26. Cabrera, A. L. 1971. Fitogeografía de la República Argentina. Bol. Soc. Argent. Bot. 14: 1-42. [ Links ]
27. Cabrera, A. L. 1978. Flora de la provincia de Jujuy. 13(10). Colecc. Cient. I.N.T.A., Buenos Aires. [ Links ]
28. Cabrera, A. L. 1983. Flora de la provincia de Jujuy. 13(8). Colecc. Cient. I.N.T.A., Buenos Aires. [ Links ]
29. Cabrera, A. L. 1993. Flora de la provincia de Jujuy. 13(9). Colecc. Cient. I.N.T.A., Buenos Aires. [ Links ]
30. Cabrera, A. L. 1994. Regiones ftogeográficas argentinas, en W. F. Kugler (dir.), Enciclopedia Argentina de Agricultura y Jardinería (primera reimpresión), 2(1): 1-85. ACME. Buenos Aires. [ Links ]
31. Cabrera, A. L. & A. Willink. 1973. Biogeografía de América Latina. Programa Regional de Desarrollo Científico y Tecnológico, OEA, Washington, D.C. Serie Biológica, Monograf. 13. [ Links ]
32. Cantero, E. A., P. L. Albornoz, M. E. Arias & M. J. Álvarez. 2005. Anatomía foliar de Piper tucumanum C. DC. y Piper hieronymi C. DC. (Piperaceae) Tucumán, Argentina. Lilloa 42: 3-14. [ Links ]
33. Carrizo, E. del V., M. O. Palacio & L. D. Roic (ex aequo). 2005. Uso medicinal de algunas especies nativas en Santiago del Estero (República Argentina). Dominguezia 21: 25-32. [ Links ]
34. Colares, M. N., N. D. Bayón, S. A. Stenglein & A. M. Arambarri. 1999. Anatomía y etnobotánica de las especies medicinales de la Provincia Pampeana: Solanaceae (excepto Grabowskia y Solanum). Acta Farm. Bonaerense 18: 171-182. [ Links ]
35. Coll Aráoz, M. V. & G. I. Ponessa. 2007. Anatomía foliar y caulinar de Lippia turbinata f. magnifolia Moldenke -Verbenaceae- (Loc. Vipos, Dpto. Trancas, Tucumán, República Argentina). Dominguezia 23: 5-12. [ Links ]
36. Cortadi, A. A. & M. A. Gattuso. 1994. Caracterización anatómica e histoquímica de Eupatorium macrocephalum Less., E. inulaefolium H.B.K. y E. subhastatum Hook. et Arn. (Asteraceae). Dominguezia 2: 32-42. [ Links ]
37. Cortadi A. A., O. Di Sapio & M. Gattuso. 1996. Caracteres anatómicos de tres especies medicinales de la familia Myrtaceae. Acta Farm. Bonaerense 15: 109-123. [ Links ]
38. Cosa de Gastiazoro, M. T. 1991. Estudio morfoanatómico de órganos vegetativos en Cestroideae (Solanaceae) I: tribu Nicotianeae. Kurtziana 21: 11-152. [ Links ]
39. D'Ambrogio de Argüeso, A. 1986. Manual de técnicas en histología vegetal. Hemisferio Sur. Buenos Aires. [ Links ]
40. De la Peña, M. R. & J. F. Pensiero. 2004. Plantas Argentinas, Catálogo de nombres comunes. L.O.L.A. (Literature of Latin America), Buenos Aires. [ Links ]
41. Del Valle Perea M., G. Pedraza & J. del Valle Luceros. 2007. Relevamiento de la flora arbórea autóctona en la provincia de Catamarca. Consejo Federal de Inversiones. CFI, Buenos Aires. [ Links ]
42. Del Vitto, L. A., E. M. Petenatti & M. E. Petenatti. 1997. Recursos herbolarios de San Luis. Primera parte: Plantas nativas. Multequina 6: 49-66. [ Links ]
43. Digilio, A. P. & P. Legname. 1966. Los árboles Indígenas de la provincia de Tucumán. Opera Lilloana 15, ilust. Instituto Miguel Lillo, Universidad Nacional de Tucumán. [ Links ]
44. Dizeo de Strittmatter, C. 1973. Nueva técnica de diafanización. Bol. Soc. Argent. Bot. 15: 126-129. [ Links ]
45. Domínguez, J. A. 1928. Contribuciones a la materia médica argentina. Primera contribución. Peuser. Buenos Aires. [ Links ]
46. Escalante, M. G. 1961. El género Fagara en la Argentina. Bol. Soc. Argent. Bot. 9: 291-317. [ Links ]
47. Ezcurra, C. 1981. Revisión de las Apocinaceae de la Argentina. Darwiniana 23: 367-474. [ Links ]
48. Ezcurra, C. 1983. Apocynaceae, A. L. Cabrera (dir.), Flora de la provincia de Jujuy. Colecc. Cient. I.N.T.A. 8: 84-115. [ Links ]
49. Fabris, H. A. 1993. Bignoniaceae, en A. L. Cabrera (dir.), Flora de la provincia de Jujuy. Colecc. Cient. I.N.T.A. 13: 226-262. [ Links ]
50. Freeman, H. E. 1984. Leaf histology-two modern methods. J. Biol. Educ. 18: 271-272. [ Links ]
51. Freire, S. E., A. M. Arambarri, N. D. Bayón, G. Sancho, E. Urtubey, C. Monti, M. C. Novoa & M. N. Colares. 2005. Epidermal characteristics of toxic plants for cattle from the Salado River Basin (Buenos Aires) Argentina. Bol. Soc. Argent. Bot. 40: 241-281. [ Links ]
52. Freire, S. E., E. Urtubey & D. Giuliano. 2007. Epidermal characters of Baccharis (Asteraceae) species used in traditional medicine. Caldasia 29: 23-38. [ Links ]
53. González, M., A. Lombardo & A. J. Vallarino. 1939. Plantas de la medicina vulgar de Uruguay. Talleres Gráficos S.A., Uruguay. [ Links ]
54. González Torres, D. M. 1997. Catálogo de plantas medicinales (y alimenticias y útiles) usadas en Paraguay. Litocolor. Asunción, Paraguay. [ Links ]
55. Guantay, M. E. 2004a. Morfoanatomía y arquitectura foliar de Myrrhinium atropurpureum var. octandrum Benth. (Myrtaceae). Lilloa 41: 31-39. [ Links ]
56. Guantay, M. E. 2004b. Morfoanatomía y arquitectura foliar de Blepharocalyx salicifolius (Kunth) O. Berg (Myrtaceae). Lilloa 41: 85-92. [ Links ]
57. Hieronymus, J. 1882. Plantae diaphoricae florae argentinae. Bol. Acad. Ci. Córdoba 4: 199-598. [ Links ]
58. Hilgert N. I. & G. E Gil. 2008. Los cambios de uso del ambiente y la medicina herbolaria. Estudio de caso en Yungas argentinas. Boletin Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas 7: 130- 140. [ Links ]
59. Holmgren, P. K., N. H. Holmgren & L. C. Barnett. 1990. "Index herbariorum. Part I. The herbaria of the world". Eigth Edition. New York Botanical Garden., New York. [ Links ]
60. Hurrell, J. A. & D. H. Bazzano. 2003. Arbustos I. Nativos y exóticos. L.O.L.A. (Literature of Latin America), Buenos Aires. [ Links ]
61. Hurrell, J.A., E. A. Ulibarri, G. Delucchi & M. L. Pochetino. 2008. Plantas aromáticas condimenticias. L.O.L.A. (Literature of Latin America), Buenos Aires. [ Links ]
62. Lahitte, H. B. & J. A. Hurrell. 1994. Los árboles de la Isla Martín García. Comisión de Investigaciones Científicas (CIC), Buenos Aires. [ Links ]
63. Lahitte, H. B., J. A. Hurrell, M. J. Belgrano, L. Jankowski, P. Haloua & K. Mehltreter. 1998. Plantas medicinales rioplatenses. L.O.L.A. (Literature of Latin America), Buenos Aires. [ Links ]
64. Lahitte, H. B. & J. A. Hurrell. 1999. Árboles rioplatenses. L.O.L.A. (Literature of Latin America), Buenos Aires. [ Links ]
65. Legname, P. R. 1982. Árboles indígenas del noroeste argentino. Opera Lilloana 34: 1-226. [ Links ]
66. Leonardi, D., O. Di Sapio, M. Gattuso & S. Gattuso. 2002. Caracteres morfoanatómicos de la corteza y hojas de Tabebuia impetiginosa y T. heptaphylla (Bignoniaceae). Bol. Soc. Argent. Bot. 37: 51-61. [ Links ]
67. Lorca G. G., A. G. Amat & C. González. 1995. Análisis comparativo de caracteres diagnósticos para la identificación de tres especies argentinas de Myrtaceae empleadas en la medicina popular. Acta Farm. Bonaerense 14: 81-86. [ Links ]
68. Mandrile, E. L. 2005. Farmacognosia: Plantas medicinales que se dispensan en Argentina. T. I. Colegio de Farmacéuticos de la provincia de Buenos Aires. [ Links ]
69. Martínez Crovetto, R. 1964. Estudios etnobotánicos I. Nombres de plantas y su utilidad según los indios tobas del este del Chaco. Bonplandia 1: 279-333. [ Links ]
70. Martínez Crovetto, R. 1965. Estudios etnobotánicos II. Nombres de plantas y su utilidad según los indios vilelas del Chaco. Bonplandia 2: 3-23. [ Links ]
71. Martínez Crovetto, R. 1967. Tintorería toba. Bonplandia 2: 103-105. [ Links ]
72. Martínez Crovetto, R. 1981. Las plantas utilizadas en medicina popular en el noroeste de Corrientes. Fundación Miguel Lillo. Miscelánea 69: 7-139. [ Links ]
73. Metcalfe, C. R. & L. Chalk. 1950. Anatomy of the Dycotiledons. Vol I -II. Oxford, Clarendon Press. [ Links ]
74. Metcalfe, C. R. & L. Chalk. 1979. Anatomy of the Dicotyledons. Vol. I. Oxford, Clarendon Press. [ Links ]
75. Milano, V. A. 1959. Caricaceae, en A. E. Ragonese (dir.), Las plantas cultivadas en la República Argentina. Rev. Inst. Nac. Tecnol. Agropecu. 8, Fasc. 135, Buenos Aires. [ Links ]
76. Muñoz, J. D. 2000. Anacardiaceae, Flora Fanerogámica Argentina. 65: 1-28. [ Links ]
77. Nagata, K. 1970. Hawaiian medicinal plants http://www.cieer.org/geirs/regions/oc/usa_hi/ebot-46-3-241.html. [ Links ]
78. Novara, L. J. 1992. Caricaceae, Aportes Botánicos de Salta, ser. Flora 1: 1-14. [ Links ]
79. Orsi, M. C. 1976. Sinopsis de las especies argentinas del género Berberis (Berberidaceae). Bol. Soc. Argent. Bot. 17: 127-149. [ Links ]
80. Paccard, E. 1905. Plantas medicinales de las Repúblicas Oriental y Argentina. Carneiro & Ramos, Montevideo, Uruguay. [ Links ]
81. Peña-Chocarro, M. C., J. De Egea Juvinel, M. Vera, H. Maturo & S. Knapp. 2006. Guía de árboles y arbustos del Chaco húmedo. The Natural History Museum, Guyra Paraguay, Fundación Moisés Bertoni y Fundación Hábitat y Desarrollo, Asunción, Paraguay. [ Links ]
82. Petenatti, E. M., M. E. Petenatti & L. A. del Vitto. 1998. Medicamentos herbarios en el centro oeste argentino "ambay" control de calidad de la droga oficial y sus adulterantes. Acta Farm. Bonaerense 17: 197-212. [ Links ]
83. Pochettino M. L., M. R. Martínez, B. Itten & M. Zucaro. 1997. Las plantas medicinales como recurso terepéutico en una población urbana: estudio etnobotánico en Hernández (Pdo. La Plata, Prov. Buenos Aires, Argentina). Parodiana 10: 141-152. [ Links ]
84. Ponessa, G., M. L. Tereschuk & L. R. Abdala. 1998a. Morfología foliar de Polylepis australis Bitter (Rosaceae) en el Valle de Tafí, Tucumán, Argentina. Algunas consideraciones sobre el complejo de flavonoides. Lilloa 39: 147-155. [ Links ]
85. Ponessa G. & M. Parrado. 1998b. Morfoanatomía foliar de Allophylus edulis (St. Hil.) Radlk., Sapindaceae, utilizada en medicina popular. Libro de resúmenes del VI Simposio Argentino de Farmacobotánica. Posadas, Misiones. Pág. 17. [ Links ]
86. Ponessa, G. & M. Parrado. 2001. Caracterización anátomo foliar y aspectos etnobotánicos de Sambucus nigra L. subsp. peruviana (Kunth) R. Bolli (Caprifoliaceae). Acta Farm. Bonaerense 20: 173-179. [ Links ]
87. Ratera, E. & M. Ratera. 1980. Plantas de la flora argentina empleadas en medicina popular. Ed. Hemisferio Sur, Buenos Aires. [ Links ]
88. Rigonatto O., N. Dottori & M. T. Cosa. 2005. Anatomía en Solanum argentinum (Solanaceae). Kurtziana 31: 21-28. [ Links ]
89. Roig y Mesa, J. T. 1949. Algunas propiedades medicinales de plantas sudamericanas que se conocen poco en la América del sur. Lilloa 18: 191-201. [ Links ]
90. Rondina R.V. D., A. L. Bandoni & J. D. Coussio (eds). 2003. Plantas silvestres argentinas con reconocidas propiedades medicinales o tóxicas. Base de Datos. CYTED-OEA. [ Links ]
91. Roth, I. 1984. Stratification of tropical forests as seen in leaf structure. In Encyclopedia of plant anatomy, Gebrüder Borntraeger, Berlin. [ Links ]
92. Roth, I. 1995. Leaf structure: montane regions of Venezuela with an excursion into Argentina. In Encyclopedia of plant anatomy, Gebrüder Borntraeger, Berlin. [ Links ]
93. Rotman, A. D. 1986. Las Myrtaceae del noroeste argentino. Darwiniana 27: 507-526. [ Links ]
94. Salisbury E. 1927. On the causes and ecological significance of stomatal frequency with special reference to the woodland flora, Phil. Trans. R. Soc. Lond., Ser B, 216: 1-65. [ Links ]
95. Sawchuk, B. 2006. Catálogo Español-Portugués sobre las utilidades de las plantas medicinales. I.N.T.A. Cerro Azul, Misiones. [ Links ]
96. Sorarú, S. & A. Bandoni. 1978. Plantas de la medicina popular argentina. Albatros. Buenos Aires. [ Links ]
97. Stace C. A. 1965. Cuticular studies as an aid to plant anatomy. Bull. Br. Mus. (Nat. Hist.) Bot. 4: 1-78. [ Links ]
98. Stenglein, S. A., A. M. Arambarri, M. N. Colares, M. C. Novoa & C. E. Vizcaíno. 2005. Leaf epidermal characteristics of Lotus subgenus Acmispon (Fabaceae: Loteae) and a numerical taxonomic evaluation. Can. J. Bot. 81: 933-944. [ Links ]
99. Torres, G. F. & M. E. Santoni. 2003/2004. Algunos aspectos de la veterinaria folklórica del departamento La Caldera (Salta, Argentina). Kallawaya Nueva Serie 10/11. [ Links ]
100. Toursarkissian, M. 1980. Plantas medicinales de la Argentina. Hemisferio Sur. Buenos Aires. [ Links ]
101. Troncoso, N. S. 1993. Lippia, en A. L. Cabrera (ed.), Flora de la Provincia de Jujuy. Colecc. Cient. I.N.T.A. 13: 18-36. [ Links ]
102. Vervoorst, F. 1979. La vegetación del Noroeste argentino y su degradación. Serie Conservación de la naturaleza Nº 1, Fundación Miguel Lillo, Tucumán. [ Links ]
103. Xifreda, C. C. 1981. El género Rauvolfia (Apocynaceae) en la Argentina. Parodiana 1: 119-137. [ Links ]
104. Yajía M. E., D. A. Martí, C. J. Bidau & A. G. Amat. 1999. Genotoxicity evaluation of Allophylus edulis (Camb.) Radlk. (Sapindaceae) aqueous extract. Acta Hort. 501: 31-33. [ Links ]
105. Zardini E. 1984. Etnobotánica de compuestas argentinas con especial referencia a su uso farmacológico. Acta Farm. Bonaerense 3: 77-99. [ Links ]
106. Zuloaga, F. O. & O. Morrone. 1999 (eds.). Catálogo de las Plantas Vasculares de la República Argentina. II, Monogr. Syst. Bot. Missouri Bot. Gard. 74, St. Louis. Edición actualizada (www.darwin.edu.ar/). [ Links ]
Original recibido el 29 de octubre de 2008;
primera decisión: 19 de diciembre de 2008;
aceptado el 11 de febrero de 2009.
Editor responsable: Carlos Urcelay.














