Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Kurtziana
versión On-line ISSN 1852-5962
Kurtziana vol.36 no.1 Córdoba ene./jun. 2011
ARTÍCULOS ORIGINALES
Composición florística del Bosque Chaqueño Serrano de la provincia de Córdoba, Argentina
Melisa A. Giorgis*, Ana M. Cingolani, Franco Chiarini, Jorge Chiapella, Gloria Barboza, Luis Ariza Espinar, Rita Morero, Diego E. Gurvich, Paula A. Tecco, Rosa Subils & Marcelo Cabido
Instituto Multidisciplinario de Biología Vegetal (IMBIV). CONICET-Universidad Nacional de Córdoba.Casilla de Correo 495, 5000 Córdoba, Argentina.
* Autor para correspondencia: melisagiorgis@hotmail.com
Resumen
Si bien el Chaco Serrano constituye una de las principales unidades fitogeográficas de la provincia de Córdoba, son escasos y restringidos los relevamientos florísticos disponibles. Por ello, en este trabajo se analiza la composición florística del Chaco Serrano entre los 400 y 1700 m.s.m. A lo largo de los cuatro cordones montañosos que lo componen, realizamos 437 relevamientos completos de plantas vasculares, en cuadrados homogéneos de 20 × 20 m. Se registraron un total de 106 familias, 476 géneros y 896 especies de plantas vasculares. Las dos familias mejor representadas fueron Poaceae (157) y Asteraceae (143). Los géneros con mayor número de especies correspondieron a Baccharis, Eupatorium, Euphorbia, Gymnocalycium y Tillandsia. Las formas de vida con mayor número de especies fueron hierbas perennes siempre-verdes (221), graminoides (143) y arbustos (124); los árboles nativos registrados fueron 27. Del total de especies registradas, 102 (11%) fueron exóticas, 29 de ellas leñosas. Se registraron aproximadamente la mitad de especies previamente citadas para la provincia de Córdoba. Además, se mencionan 6 citas nuevas para la provincia. Estos resultados ponen de manifiesto la importancia de la unidad fitogeográfica del Chaco Serrano para la conservación de la flora de la provincia de Córdoba.
Palabras clave: Distrito Chaqueño Serrano; Especies nativas; Especies exóticas; Nuevas citas; Formas de vida; Conservación.
Abstract
Floristic composition of the Chaco Serrano Woodland in Córdoba province, Argentina.
The Chaco Serrano constitutes one of the main phytogeographic units of Córdoba province; however, available floristic information is limited and restricted. In this contribution we characterize the floristic composition of the Chaco Serrano between 400 and 1700 m a.s.l. We performed 437 comprehensive floristic samples of vascular plants in homogeneous quadrates of 20 × 20 m. A total of 106 families, 476 genera and 896 vascular plants species were recorded. Poaceae (157) and Asteraceae (143) are the best represented families while Baccharis, Eupatorium, Euphorbia, Gymnocalycium and Tillandsia are the genera with the highest number of species. Perennial evergreen herbs (221), graminoids (143) and shrubs (124) are the life forms with the highest number of species. We recorded 27 native trees species and 102 (11% of the total recorded species) alien species, 29 of them were woody. Approximately half of the species previously reported for the whole Córdoba province were recorded in this phytogeographic unit. Additionally, we provide six new records for Córdoba. These findings highlight the importance of the Chaco Serrano phytogeographic unit for the conservation of Córdoba flora.
Key words: Distrito Chaqueño Serrano; Native species; Alien species; New records; Life forms; Conservation.
Introducción
El conocimiento sobre la riqueza biológica es de fundamental importancia, tanto para estudios científicos, como para el desarrollo de estrategias de conservación (Schmeller et al., 2009; Lepetz et al., 2009). Sin embargo, dado el bajo número de estudios taxonómicos y sistemáticos orientados a conocer la diversidad (Gaston & May, 1992), y a la alta tasa de destrucción de los ecosistemas naturales (Millennium Ecosystem Assessment, 2005), existe un considerable riesgo de pérdida de la diversidad biológica antes de que ésta pueda ser descripta, registrada o monitoreada. Por ello, los relevamientos florísticos que permitan actualizar el listado de las especies en una región son de fundamental importancia.
En los faldeos de las sierras Pampeanas y Subandinas, que se extienden desde el sur de Bolivia hasta el centro de Argentina, se desarrolla uno de los ecosistemas montanos más importantes de Sudamérica, denominado como Distrito Chaqueño Serrano por Cabrera (1976) y Parque Chaqueño Serrano por Ragonese y Castiglioni (1970). La vegetación característica de este Distrito es un bosque xerófilo a subxerófilo dominado por Schinopsis marginata Engl. y Lithraea molleoides (Vell.) Engl. La composición florística de este bosques cambia con la latitud y la altitud a escala regional (Cabrera, 1976), y con las características edáficas y la historia de disturbio a escala local (Cabido et al., 1991; Suárez & Vischi, 1997; Cantero et al., 2001; Gurvich et al., 2005; Giorgis, en preparación). Esto determina que el sistema sea altamente heterogéneo y que haya variaciones importantes en la composición de especies en distancias muy cortas.
Los ambientes serranos ocupan el 25 % de la superficie de la provincia de Córdoba, proveen servicios ecosistémicos tales como la producción de agua, la producción de forraje y belleza paisajística, que se traducen en beneficios económicos directos, principalmente a través de la disponibilidad de agua para consumo y riego, la ganadería y el turismo, respectivamente. Al mismo tiempo, las sierras de Córdoba están experimentando grandes transformaciones, causadas principalmente por el avance de la red de urbanización, los incendios, la tala, el sobre-pastoreo y la invasión de especies exóticas (Gavier & Bucher, 2004; Zak et al., 2004; Giorgis et al., 2005, en prensa; Cingolani et al., 2008; Renison et al., 2010). Estas transformaciones condicionan fuertemente el establecimiento y supervivencia de algunas de las especies nativas (Giorgis et al., 2005), poniendo a numerosas especies serranas en alto riesgo de extinción local. A pesar de ello, no se cuenta en la actualidad con un listado de sus especies. Si bien existen algunos relevamientos detallados (por ejemplo, Cabido et al., 1991; Cingolani et al., 2003), corresponden generalmente a áreas pequeñas.
Este trabajo tiene como propósito proveer un listado de las especies vegetales relevadas en el Bosque Serrano de Córdoba, junto a una descripción de las características generales de su flora.
Materiales y Métodos
Área de estudio
Las Sierras Pampeanas de Córdoba están integradas principalmente por un basamento plutónico metamórfico compuesto por metamorfitas de grano grueso (gneises y migmatitas) (Gordillo, 1979), intruidas en el Paleozoico por batolitos graníticos (Rapela, 1982). La cubierta sedimentaria está compuesta por relictos aislados de areniscas, pelitas y conglomerados de edad Paleozoica superior y complejos volcano-sedimentarios del Cretácico inferior (Kay & Gordillo, 1990). Las sierras pueden dividirse en cuatro grandes unidades: Sierras Norte, Sierras Chicas-Las Peñas, Sierras Grandes-Comechingones, y las Sierras de Pocho-Guasapampa, que se extienden de los 29º 00' S a los 30º 30' S de Latitud, comprendiendo de Norte a Sur 430 km y 110 km de ancho (Vázquez et al., 1979; Carignano, 1999). Su altitud varía aproximadamente desde 500 m s.n.m. hasta los 2790 m s.n.m. en el «Cerro Champaquí» máxima elevación de las sierras.
Las sierras están divididas en dos dominios climáticos (Capitanelli, 1979). Por un lado, las Sierras Grandes y las Sierras Chicas presentan un clima semi-húmedo, con tendencia al semi-seco de montaña (tipo Ascochinga). El período de máximas precipitaciones se extiende de septiembre a marzo con un promedio anual de 725 mm para la localidad de Ascochinga (740 m.s.m). Para esta misma localidad, la temperatura media anual es de 13,9 ºC. Las Sierras de Pocho y Guasapampa, en cambio, pertenecen al dominio semi-desértico de las planicies del Noroeste, sin invierno térmico (tipo Quilino). En esta localidad, el promedio anual de precipitaciones es de 474 mm y la temperatura media anual es de 19,8 ºC. En ambos dominios las lluvias están concentradas mayormente en el período comprendido entre los meses de noviembre y marzo.
Históricamente la vegetación de las Sierras de Córdoba ha sido dividida en tres pisos o cinturones altitudinales de vegetación (Luti et al., 1979). El primero de ellos es el Bosque Serrano, que se ubica entre 500 y 1300 m.s.m., encontrándose principalmente en valles, quebradas y laderas escarpadas. Por arriba del bosque se encuentra el piso de Romerillar o Matorral serrano, entre los 1300 y 1700 m.s.m. y en la parte superior, se ubica el piso de los Pastizales y Bosquecillos de altura.
Este trabajo abarca todo el gradiente latitudinal y longitudinal de las sierras de Córdoba, pero se restringe a los dos primeros pisos de vegetación (367-1750 m.s.m.).
Toma de datos
Para estratificar el muestreo y cubrir toda la variación latitudinal y longitudinal de las sierras, se dividió el área de estudio en cinco grandes sectores; norte, sur y centro-este (perteneciente a las Sierras Chicas), centro-medio (en las Sierras Grandes) y centro-oeste (en territorios de las Sierras de Pocho y Guasapampa). En estos sectores se seleccionaron 437 sitios distribuidos de la siguiente manera: 50 en el sector sur, 65 en el norte, 192 en el centro-este, 97 en el centro-medio y 33 en el centro-oeste. Además, dentro de cada sector los sitios estuvieron distribuidos de forma que cubrieran todo el gradiente altitudinal, entre 367 y 1739 m.s.m. En cada uno de los sitios se registró la composición florística completa de plantas vasculares y el porcentaje de cobertura de cada especie, en una superficie aproximada de 20 × 20 m. Para este trabajo sólo se utilizaron los datos de presencia de cada una de las especies registradas.
Análisis de Datos
La ubicación de las especies en sus respectivas familias y la verificación de los nombres científicos se hizo en su mayor parte siguiendo el «Catálogo de las Plantas Vasculares del Cono Sur» (Zuloaga et al., 2008) y su actualización «on line» (www.darwin.edu.ar). Para el género Gymnocalycium, se siguió a Demaio et al. (En preparación), para Bidens a Ariza (2000) y para Pterocaulon a Ariza (2008).
Las especies fueron además ubicadas según su origen y forma de vida. Para el primer caso, se dividieron en exóticas y nativas y se distinguió además entre especies endémicas y no endémicas de Argentina. Se consideraron exóticas a todas las que son citadas como adventicias, introducidas, naturalizadas o exóticas en el catálogo de las Plantas Vasculares del Cono Sur (Zuloaga et al., 2008). Para la forma de vida, se siguió a Giorgis et al. (2005); así, las especies se clasificaron en: árboles, arbustos, arbustos parásitos, bromeliáceas rupícolas, bromeliáceas terrestres, cactáceas columnares, cactáceas globulares, cactáceas opuntioides, hierbas perennes caducifolias, hierbas siempre-verdes, hierbas anuales, epífitas, helechos, enredaderas, gramíneas en mata, graminoides y parásitas.
Resultados
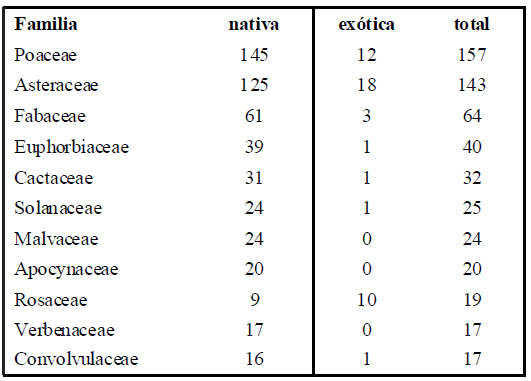
Se identificaron 896 especies que pertenecen a 106 familias y 476 géneros; 34 corresponden a especies de Lycophytae y Monilophytae, 6 a Gymnospermae y 856 a Angiospermae (209 Monocotyledoneae y 647 Dicotyledoneae). De este total, 102 (11,38 %) son especies exóticas. Las familias más representadas son Poaceae (157), Asteraceae (143) y Fabaceae (64). Las familias que presentan mayor número de especies exóticas son Asteraceae (18), Poaceae (12) y Rosaceae (10), destacándose esta última por presentar más de la mitad de las especies registradas (52,63 %) como exóticas (Tabla 1).
Tabla 1. Principales familias del Bosque Chaqueño Serrano de Córdoba y número de especies nativas y exóticas dentro de cada una de ellas
Entre los géneros con mayor número de especies se destacan Baccharis, Eupatorium, Euphorbia, Gymnocalycium y Tillandsia (Tabla 2). Es importante resaltar los dos últimos géneros, ya que si bien no pertenecen a las familias con mayor riqueza de especies de la región, contribuyen con un importante número de taxones.
Tabla 2. Principales géneros del Bosque Chaqueño Serrano de Córdoba y número de especies nativas y exóticas dentro de cada una de ellas.

Se registraron un total de 121 (13,50 %) especies endémicas de Argentina, con 12 exclusivas de Córdoba, la mayoría pertenecientes al género Gymnocalycium, y 17 especies que sólo se encuentran en la provincia de Córdoba y San Luis (Anexo 1). De estas especies con distribución regional más restringida, es importante destacar aquéllas encontradas sólo en un sitio (0,23 % de frecuencia relativa, Anexo 1); Aristida minutiflora Caro var. minutiflora y Berberis hieronymi C. K. Schneid. exclusivas de Córdoba y Blumenbachia hieronymi Urb., Euphorbia davidii Subils, Poa hubbardiana Parodi y Tridens nicorae Anton exclusivas de Córdoba y San Luis.
Las formas de vida más representativas de la región estudiada son las hierbas perennes siempre-verdes (221), seguidas por graminoides (143) y por arbustos (124) (Tabla 3). Dentro de las distintas formas de vida es importante destacar que de las 47 especies de árboles registradas, más del 42% (20) son exóticas, siendo las más frecuentes Gleditsia triacanthos L., Ligustrum lucidum W. T. Aiton, Morus alba L., Pinus elliotii Engelm. y Melia azedarach L. (Anexo 1).
Tabla 3. Principales formas de vida del Bosque Chaqueño Serrano de Córdoba y número de especies nativas y exóticas dentro de cada una de ellas.
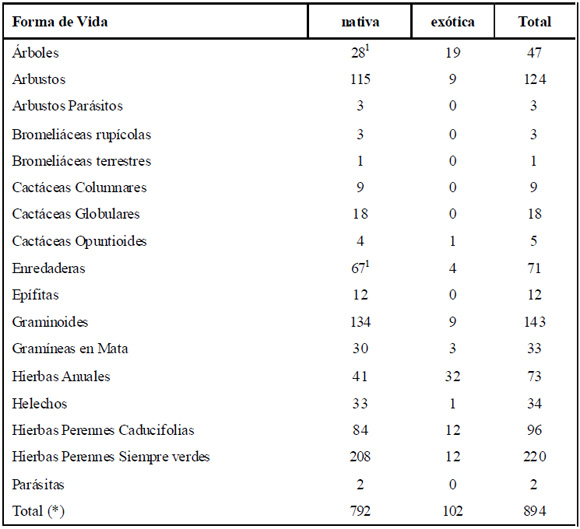
*Hay dos taxones que no pudieron identificarse a nivel específico, por lo cual no llegamos a conocer su estatus y por ello la suma total de exóticas y nativas no alcanza 896.
1 Hay tres especies de árboles (Phytolacca dioica L., Jacaranda mimosifolia D. Don y Manihot grahamii Hook.) y dos enredaderas (Vigna caracalla (L.) Verdc y Dolichandra unguis-cati (L.) L.G. Lohmann) (Anexo 1), que si bien son nativas de Argentina, según nuestro conocimiento serían especies exóticas en la unidad fitogeográfica correspondiente al área de estudio. No obstante, en el recuento de la tabla permanecen entre las nativas.
Citas nuevas para la provincia de Córdoba
Se registran seis citas nuevas para la flora de la provincia, que se describen brevemente a continuación. El material estudiado de referencia para cada una de ellas1, se encuentra depositado en el Museo Botánico de Córdoba (CORD).
1. Hoffmannseggia pumilio (Griseb.) B. B. Simpson, Syst. Bot. 29 (4): 938. 2004. Basónimo: Caesalpinia pumilio Griseb.
Iconografía.- Hosseus, Bol. Acad. Nac. Ci. 26: 147, f. 26. 1924 (sub nom. Caesalpinia riojana). Burkart, Revista Argent. Agron. 3: 80, f. 1a (sub nom. C. pumilio var. riojana), 1b (sub nom. C. pumilio); 99, f. 5 c-c'(sub nom. C. pumilio); f. 5 d-d'(sub nom. C. pumilio var. riojana); lám. 6. 1936.
Se trata de pequeños arbustos (hasta de 50 cm de alt.), pubérulos y con llamativos pelos glandulosos oscuros. Sus legumbres son generalmente falcadas, castaño-rojizas, glandulosas, cuya estructura la distingue de sus especies afines.
Hábitat y distribución geográfica.- Es una especie endémica de Argentina; sin embargo, probablemente también habite en el sur de Bolivia (Ulibarri, 1997). Es una planta que crece en cerros y planicies pedregosas, entre los 1500-4000 m, y hasta el momento se la había registrado para Catamarca, Jujuy, La Rioja y San Juan. En Córdoba, fue encontrada al norte de la provincia, en las sierras de Ambargasta (Dpto. Sobremonte), en una ladera muy degradada, cubierta por un matorral dominado por Acacia caven (Molina) Molina. Llama la atención la altitud en la que habita en las sierras cordobesas (apenas a 550 m.s.m.), por tratarse de una especie predominantemente andina.
Material estudiado.
ARGENTINA. Prov. Córdoba: Dpto. Sobre-monte: Sierras de Ambargasta, cercano a la localidad de Pozo Nuevo, 29º 40' 7,9'' S, 64º 2' 21,2'' W, 550 m.s.m., Giorgis s.n., 22-I-2008 (CORD 1208).
2. Tridens nicorae Anton, Kurtziana 10: 51, f. 1. 1977.
Se destaca por su hábito cespitoso, sus inflorescencias laxas, gráciles y paucies-piculadas, la lema cuculada, con densa pubescencia de largos tricomas llamativamente purpúreos, brillantes y divergentes y con sus tres aristas o nervios reducidos a pequeños mucrones y, por último, por la presencia de nectarios extraflorales sobre la mitad superior de las carinas de la pálea.
Hábitat y distribución geográfica.- Es la única especie del género endémica de Argentina; fue descripta para las regiones semiáridas del noroeste y centro de San Luis, entre 1000 y 1500 m.s.m; las etiquetas de los colectores la señalan como una especie «rara, en arbustal o pastizal serrano» (Anton, 1977). En la provincia de Córdoba, la encontramos al noroeste, en el Dpto. San Alberto, en un matorral degradado dominado por Flourensia oolepis S. F. Blake. Esta comunidad está ubicada en el extremo sur de las Sierras de Pocho y Guasapampa, en terrenos áridos, similares y cercanos a los sitios donde fue recolectada en la provincia de San Luis.
Material estudiado.
ARGENTINA. Prov. Córdoba: Dpto. San Alberto: Cercano a la localidad de Altautina, 31º 44' 49,4'' S, 64º 10' 23'' W, 902 m.s.m., Giorgis 1383, 13-II-2008 (CORD).
3. Rubus imperialis Cham. & Schltdl., Linnaea 2: 13. 1827.
Iconografía.- Novara, Flora del Valle de Lerma 2 (11): 30, lám 8. 1993.
Subarbustos o arbustos de hasta de 4 m de altura, con aguijones retrorsos y hojas trifolioladas pubescentes, albo-tomentosos cuando jóvenes, folíolos con márgenes finamente aserrados. Inflorescencias copiosas y laxas, con flores vistosas de 5 pétalos blancos, orbiculares de base atenuada. Fruto polidrupa, con drupas morado-oscuras a negras, comestibles.
Hábitat y distribución geográfica.- De las 5 especies nativas de Rubus que habitan en Argentina, R. imperialis es una de las que presenta mayor área de distribución en el país; esta especie crece desde Bolivia hasta el centro de Argentina (Novara, 1993; Zuloaga et al., 2008), siendo arbustos comunes y representativos de los bosques montanos húmedos del noroeste argentino. Se registra ahora para la provincia de Córdoba, entre los 1000 y 1700 m.s.m., en la cara este de las Sierras Grandes. Resulta interesante destacar que Hieronymus y Kurtz ya la habían recolectado en las zonas serranas hace más de 100 años atrás, pero sus ejemplares depositados en el herbario CORD pasaron inadvertidos por los botánicos hasta el presente.
Material estudiado.
ARGENTINA. Prov. Córdoba: Dpto. San Alberto: Pampa de Achala camino a La Pampilla por Ruta Prov. Nº 28, 31º40'34.5" S, 64º41'45,6" W, Giorgis s.n., 15-I-2008 (CORD 1337).- Pampa de Achala cuesta de Copina, Hieronymus s.n., 19-XI-1877 (CORD).- Pampa de Achala cuesta del Argel, Hieronymus s.n., 15-I-1876 (CORD). Dpto. Punilla: Piedras Grandes, cercano a La Falda, Kurtz 6560, 10-XI-1889 (CORD).
4. Chamaecrista nictitans var. patellaria (DC. ex Collad.) Kartesz & Gandhi, Phytologia 71: 93. 1991. Basónimo: Cassia patellaria DC. ex Collad.
Subarbustos bajos (hasta ca. 70 cm alt.), ramificados distalmente, con ramas castaño-oscuras a verdosas, pubescentes. Hojas hasta con 22 pares de folíolos. Inflorescencias con 1-3 (4) flores con corola amarilla y sépalos dorsalmente pubescentes. Legumbres pardo-oscuras, pubescentes, erectas, comprimidas, pauciseminadas.
Hábitat y distribución geográfica.- De acuerdo a Irwin & Barneby (1981) crece desde México hasta Argentina (Chaco, Corrientes, Formosa, Misiones y Santa Fe). En Córdoba fue encontrada al noroeste, en las cercanías del camino que va desde Capilla del Monte a San Marcos Sierras, en un matorral degrado dominado por Flourensia oolepis y Acacia caven. Al igual que la especie anterior, esta entidad ya había sido coleccionada en Córdoba en esta misma región, a principios del siglo XX.
Material estudiado.
ARGENTINA. Prov. Córdoba: Dpto. Punilla: Cercano a la localidad de San Marcos Sierras, 30º 50' 44,2'' S, 64º 63' 15,9'' W, 941 m.s.m., Giorgis 588, 8-I-2007 (CORD).-Ochoa, Stuckert 12715, 6-II-1903 (CORD).
5. Stevia mercedensis Hieron., Bot. Jahrb. Syst. 22: 735. 1897.
Stevia mercedensis var. mercedensis
Sufrútice con xilopodio, ramificado, con hojas angostamente aovadas, enteras o dentadas hacia el ápice; ramas, a veces, con braquiblastos. Capítulos pedunculados con cimas laxas (a veces algo contraídas). Involucro con pelos simples y glandulares puntiformes. Corolas con el tubo rosado y el limbo blanco. Aquenios con (7) 8-13 cerdas delgadas.
Hábitat y distribución geográfica.- Se encuentra en Bolivia y Argentina, llegando hasta el centro del país entre los 200 y 3000 m.s.m. (Cabrera & Freire, 1997). En Córdoba, se la encontró en el extremo norte del cordón de las Sierras de Pocho y Guasapampa, en un bosque sobre ladera con mucha pendiente, dominado por Schinopsis marginata.
Material estudiado.
ARGENTINA. Prov. Córdoba: Dpto. Minas: Cercano a la localidad de Agua de Ramón, 30º 50' 44,2'' S, 65º 21' 8,8'' W, 414 m.s.m., Giorgis 1271, 23-I-2008 (CORD).
6. Lobelia nana var. flagelliformis Wedd., Chloris Andina 2: 13. 1857.
Iconografía.- Pontiroli, en Cabrera (ed.), Flora Prov. Jujuy 9: 524, f. 212 G-I. 1993.
Pequeña hierba perenne, glabra, rastrera, con tallos laxamente foliosos. Hojas espatuladas, con margen dentado. Flores solitarias largamente pediceladas, con corola zigomorfa violácea o blanca. Fruto cápsula elipsoidal, cubierta parcialmente por el cáliz persistente.
Hábitat y distribución geográfica.- La variedad flagelliformis habita desde Bolivia hasta el noroeste de Argentina, entre los 1000 y 2500 m.s.m (Lammers, 2008). En la provincia de Córdoba, es muy frecuente en la parte alta de las Sierras Grandes.
Material estudiado.
ARGENTINA. Prov. Córdoba: Dpto. San Alberto: Pampa de Achala cercano a la Ea. San Miguel, Cocucci 193, 15-XII-1987 (CORD).- Pampa de Achala, alrededores de La Posta, Barboza et al. 2013, 1-II-2008 (CORD).
Especies escapadas de cultivo.
Se registraron por primera vez para la provincia de Córdoba tres especies más, que si bien son nativas de Argentina, su presencia acorde con nuestras observaciones de campo, se debe claramente a poblaciones escapadas de cultivo. De ellas, dos son especies arbóreas muy utilizadas en jardinería: Phytolacca dioica L., que fue encontrada invadiendo comunidades dominadas por bosque nativo en los alrededores de la localidad de Rio Ceballos (Dpto. Colón), y Jacaranda mimosifolia D. Don, que también invade los bosques nativos, en los alrededores de la localidad de La Calera (Dpto. Colón) y en el Cerro Colorado (Dpto. Río Seco). Por último, resta por mencionar a Vigna caracalla (L.) Verdc., enredadera que, al igual que las especies anteriores, aparece invadiendo comunidades boscosas en los alrededores de Río Ceballos y Salsipuedes.
Discusión
Se registran en este trabajo alrededor de la mitad de las especies citadas para Córdoba (Zuloaga et al., 2008) y seis nuevas citas para la provincia, lo que pone de manifiesto la relevancia del Bosque Serrano (500-1300 m.s.m.) y del Romerillar (1300-1700 m.s.m.) en la conservación de la biodiversidad del Distrito Chaqueño Serrano.
Las tres familias más numerosas que habitan el área de estudio coinciden con las mencionadas por Zuloaga et al. (1999), para la provincia de Córdoba (Fam. Poaceae, Asteraceae y Fabaceae). También es importante destacar a otras tres familias, típicamente americanas, que se encuentran bien representadas en el área: Solanaceae, Cactaceae y Bromeliaceae. La primera de ellas es predominantemente sudamericana ya que cuenta con sólo 3 géneros cosmopolitas: Solanum, Lycium y Nicotiana; en Argentina crecen 328 taxones, de los cuales 25 habitan las sierras de Córdoba (Barboza et al., 2008). Cactaceae y Bromeliaceae se destacan porque a ellas pertenecen dos de los géneros más numerosos de la región, Gymnocalycium y Tillandsia, respectivamente. El primero contribuye al área de estudio con la mayoría de las especies endémicas, aunque aún deben resolverse algunos problemas taxonómicos (Demaio, en preparación). Por su parte, Tillandsia cuenta con un total aproximado de 400 especies y subespecies, y con 53 especies representadas en Argentina (Zuloaga et al., 2008). En 1977, Smith y Downs realizaron una revisión completa del género; sin embargo, desde este trabajo a la actualidad, sólo se cuenta para nuestro país con el tratamiento de Subils (2009) recientemente publicado para la Flora de San Juan.
Se han registrado un porcentaje importante de especies endémicas de Argentina, destacando la importancia de las sierras de Córdoba como unidad de conservación. A fin de desarrollar adecuadas estrategias de conservación, sería prioritario conocer el estado de conservación de cada una de ellas, especialmente aquéllas con una distribución restringida y encontradas en muy baja frecuencia (por ejemplo: Aristida minutiflora var. minutiflora, Blumenbachia hieronymi, Euphorbia davidii y Tridens nicorae).
La invasión por especies exóticas es uno de los principales problemas ambientales a escala global (Mack et al., 2000; Pauchard & Alaback, 2004; Pimentel et al., 2005; Charles & Dukes, 2007), y en las Sierras de Córdoba (Giorgis et al., 2005, en prensa; Hoyos et al., 2010). En el presente trabajo se encontró que el 11 % de las especies serranas son exóticas, siendo la mayoría de ellas de origen Euroasiático. Este porcentaje es similar al registrado en otros lugares de Argentina, tales como en el noroeste de la Patagonia, con el 15 % (Speziael & Ezcurra, 2009), los pastizales de la Pampa con el 15 % (Weinzettel et al., 2009), y el doble de lo registrado por Cantero et al. (2003), para los pastizales de las montañas del centro de Argentina. Además el número de especies exóticas en las sierras de Córdoba (102) es levemente menor a la media de 147 especies encontrada en 13 sistemas montañosos del mundo (McDougall et al., 2011). De las exóticas es importante destacar a las leñosas, tanto arbóreas como arbustivas, por ser las que potencialmente pueden causar los mayores problemas ambientales (Cronk & Fuller, 1995; Reichard & Hamilton, 1997; Richardson, 1998). Se encontraron 20 especies arbóreas exóticas, casi la mitad dentro de esta forma de vida, y además 9 especies arbustivas. La mayoría de estos taxones han sido introducido con fines ornamentales (Acer negundo L., Ailanthus altissima (Mill.) Swingle, Liquidambar styraciflua L., Betula pendula Roth, Celtis australis L., Cotoneaster franchetii Bois, Crataegus monogyna Jacq., Cupressus macrocarpa Hartw., Gleditsia triacanthos L., Melia azedarach L., Maclura tinctoria (L.) D. Don ex Steud., Morus alba L., Ligustrum spp, Olea europaea L., Pyracantha spp. y Ulmus sp.), para la extracción de sus frutos (Prunus spp., Rosa spp. y Rubus ulmifolius Schott) y para la producción de madera (Pinus spp., Eucalyptus spp.). Ya existen antecedentes de impactos ambientales negativos promovidos por algunas de ellas en la región y en otras comunidades vegetales del país (De Pietri, 1992; Mazia et al., 2001; Chaneton et al., 2002; Ghersa et al., 2002; Zalba & Villamil, 2002; Aragón & Morales, 2003; Lichtstein et al., 2004; Giorgis et al., 2005; Tecco et al., 2006, 2007; Hoyos et al., 2010). Por otro lado, se encontraron varias gramíneas C exóticas, como Eragrostis curvula (Schrad.) Nees, Chloris truncata R. Br., Melinis repens (Willd.) Zizka y Chloris gayana Kunth. Si bien esta última no se registró en los inventarios, fue observada en algunos costados de camino y está siendo introducida como forrajera por productores en varias regiones de las Sierras (Observación personal). Estas especies podrían modificar el ciclado de nutrientes y regímenes de fuego como ha sido observado en otros lugares del mundo (D'Antonio & Vitousek, 1992; Ehrenfeld, 2003; Hoffmann et al., 2004; Hawkes et al., 2005). Además, es importante destacar que se encontraron cinco especies nativas de otras regiones fitogeográficas de Argentina, que según nuestro conocimiento serían especies exóticas al área de estudio. Estas son tres árboles: Phytolacca dioica, Manihot grahamii Hook. y Jacaranda mimosifolia, y dos especies de enredaderas: Vigna caracalla y Dolichandra unguis-cati (L.) L.G. Lohmann (Anexo 1). Finalmente cabe mencionar la presencia de a Lantana camara L. y Schinus areira L., especies consideradas como nativas, pero cuyo origen es dudoso. En conjunto, la amplia lista de exóticas registradas en este trabajo y los antecedentes de impactos ecosistémicos mediados por especies invasoras en esta y en otras regiones, pone de manifiesto que cualquier estrategia de conservación de esta unidad fitogeográfica deberá incluir explícitamente el monitoreo y eventual control de las especies exóticas más problemáticas.
La forma de vida de cada especie en el Anexo 1 fue asignada en base a la información disponible en las distintas floras y a observaciones personales de los autores de este trabajo. Es importante tener en cuenta que en muchas de las especies reportadas la estrategia de vida puede variar según el hábitat donde se localice o según los cambios estacionales, comportándose como hierbas anuales, bianuales, o bien como hierbas perennes siempre-verdes o hierbas perennes caducifolias. Sin embargo, la forma de vida de cada una de las especies está relacionada con los requerimientos de hábitats de las mismas (Díaz & Cabido, 2001), por lo que creemos que constituye una buena base de información para futuros trabajos de investigación.
La ubicación geográfica de la provincia determina que su flora contenga elementos de distintas regiones fitogeográficas. Ejemplo de ello son las nuevas citas encontradas; así, Tridens nicorae, sólo registrada para Córdoba y San Luis, comparte su distribución con un importante número de taxones endémicos para ambas provincias (por ejemplo: Poa stuckertii (Hack.) Parodi y Escallonia cordobensis (Kuntze) Hosseus); Rubus imperialis y Lobelia nana var. flagelliformis son habitantes de los bosques húmedos del noroeste del país hasta Bolivia, encontrándose también en el sur de Brasil; Hoffmannseggia pumilio y Stevia mercedensis var. mercedensis son elementos característicos de la región Chaqueña Occidental especialmente de lugares secos y degradados; Chamaecrista nictitans var. patellaria es una variedad con una amplia distribución desde México hasta Argentina, siendo en nuestro país característica de la región Chaqueña Oriental.
Los resultados presentados en este trabajo constituyen una base fundamental para desarrollar estrategias de conservación y monitoreo de la flora de las Sierras de Córdoba. Sin embargo, sería necesario realizar este tipo de estudios periódicamente, abarcando mayores áreas a fin de actualizar el listado de especies, y detectar no sólo las citas nuevas sino también aquellas especies que han sido citadas hace muchos años y de las cuales no se han tenido registros nuevamente.
Agradecimientos
A los siguientes colegas por su colaboración en el trabajo de campo: N. Pérez-Harguindeguy, S. Zeballos, J. Astegiano, P. Venier, A. Pais, M. Bonino, L. Enrico, B. Garro, I. Lezcano y J. Alinari. A los miembros del Museo Botánico (IMBIV), particularmente a su directora, Dra. A. M. Anton; a los asistentes del Herbario: J. Ponce, P. Hick, A. Bringas y de la Biblioteca: B. Pombo. Finalmente, a A. A. Coccuci y P. Demaio por su ayuda con la identificación de algunas especies. Este trabajo fue financiado por SECYT, Universidad de Córdoba, y el Inter-American Institute for Global Change Research (IAI) CRNII-2005. La primera autora es becaria doctoral de CONICET y aspirante al Doctorado en Ciencias Biológicas de la UNC.
Notas
1 Se citan en Material estudiado solamente los ejemplares de referencia para la Prov. de Córdoba, si bien los autores revisaron todas las colecciones depositadas en CORD para estas especies.
Listado de taxones encontrados en las Sierras de Córdoba entre 400 y 1700 m.s.m, según su Forma de vida: árboles (A), arbustos (AR), arbustos parásitos (ARParas), bromeliáceas rupícolas (BrR), bromeliáceas terrestres (BrT), cactáceas columnares (CC), cactáceas globulares (CG), cactáceas opuntioides (CO), enredaderas (E), epífitas (EP), hierbas anuales (HA), helechos (HE), hierbas perennes caducifolias (HPC), hierbas perennes siempre-verdes (HPS), graminoides (G) gramíneas en mata (GM) y parásitas (Paras). Y según Estatus (nativa y exótica); Familia y porcentaje de frecuencia relativa del total de censos realizados.
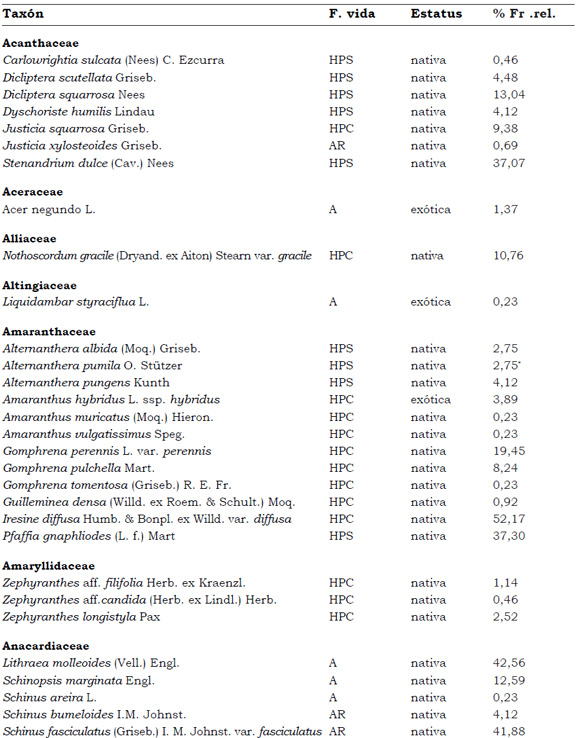
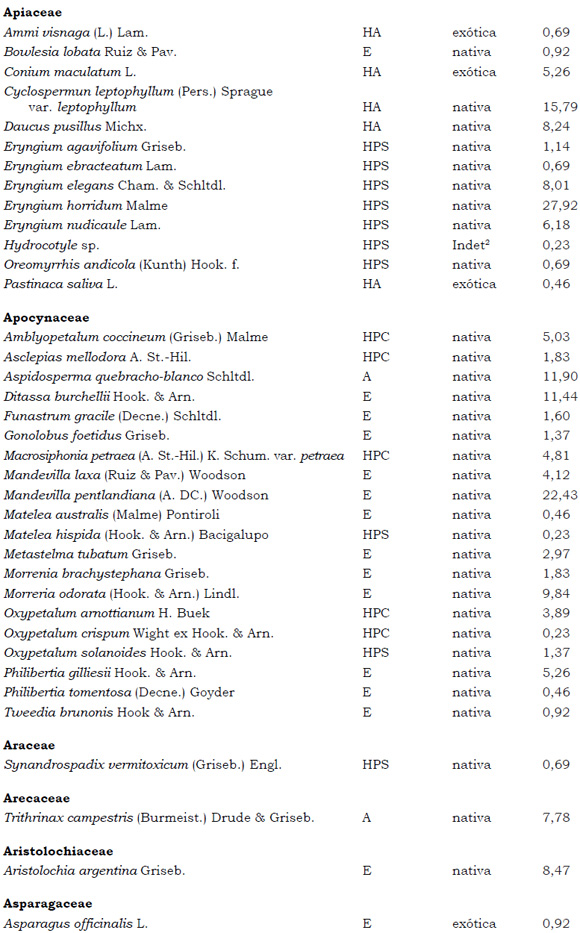
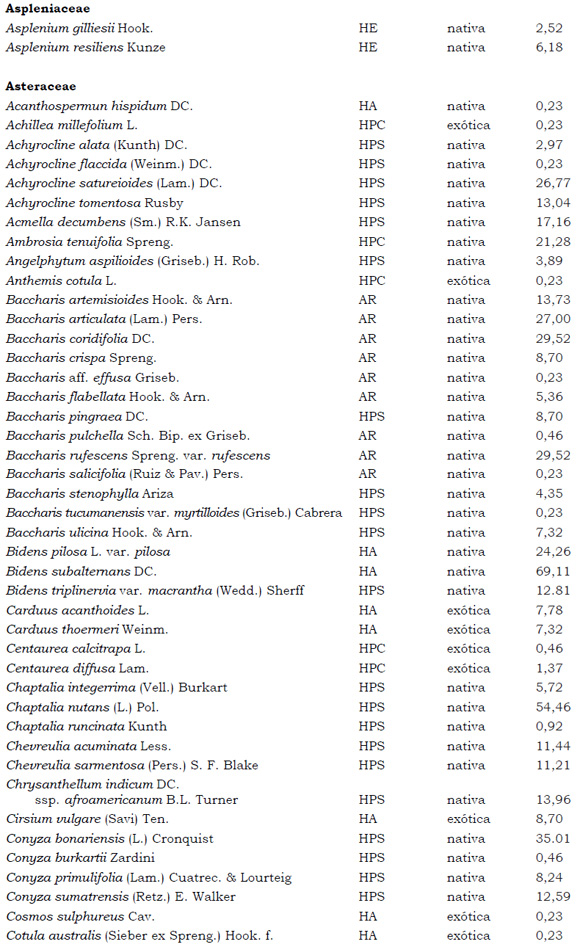

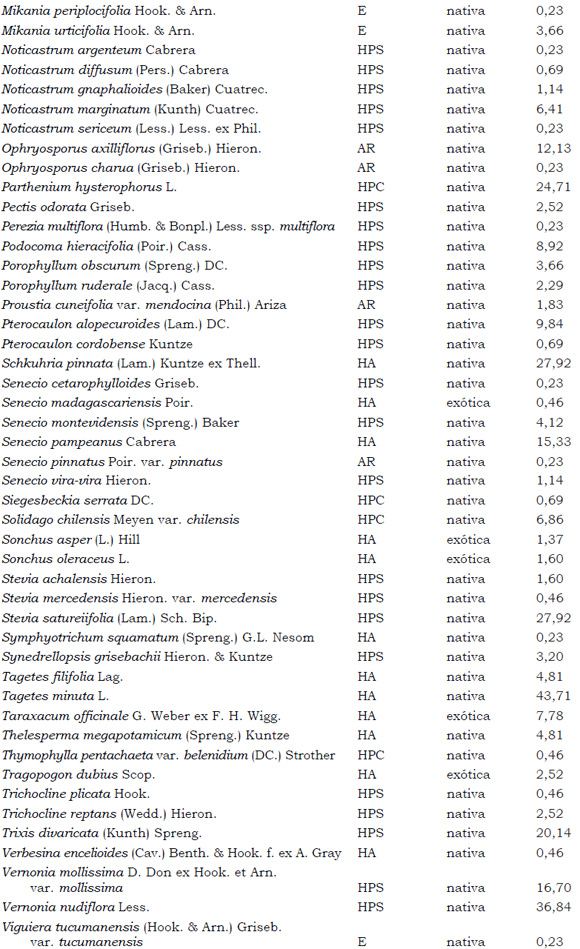
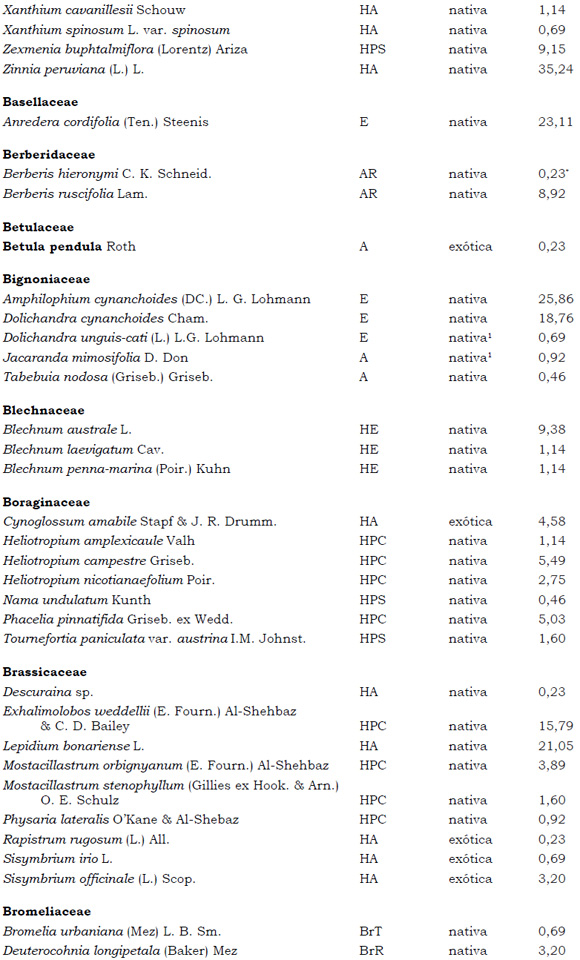
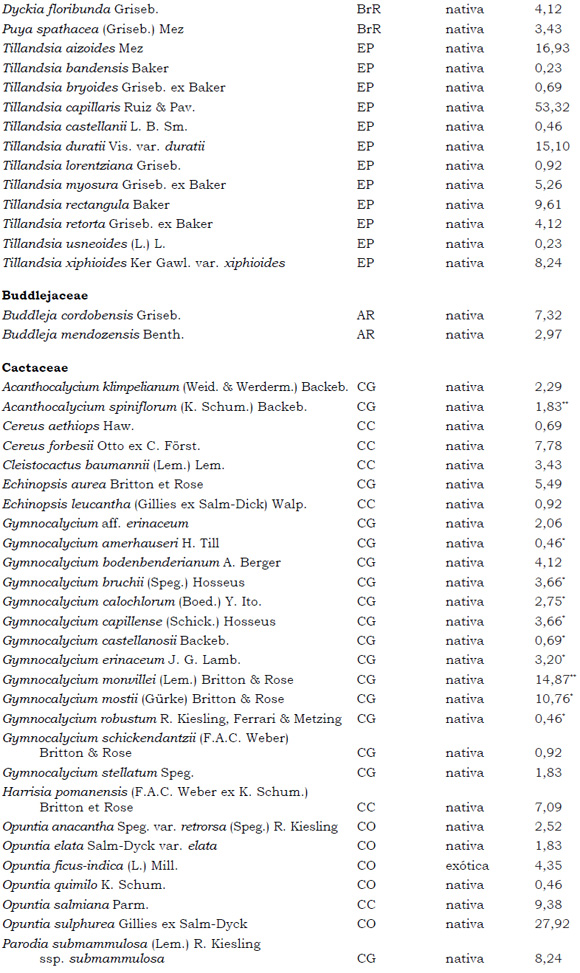
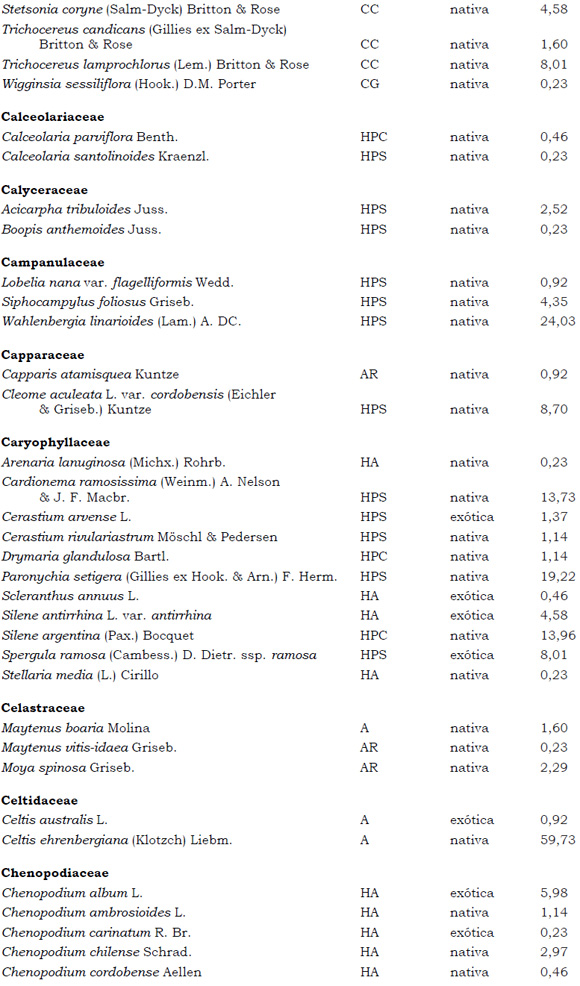
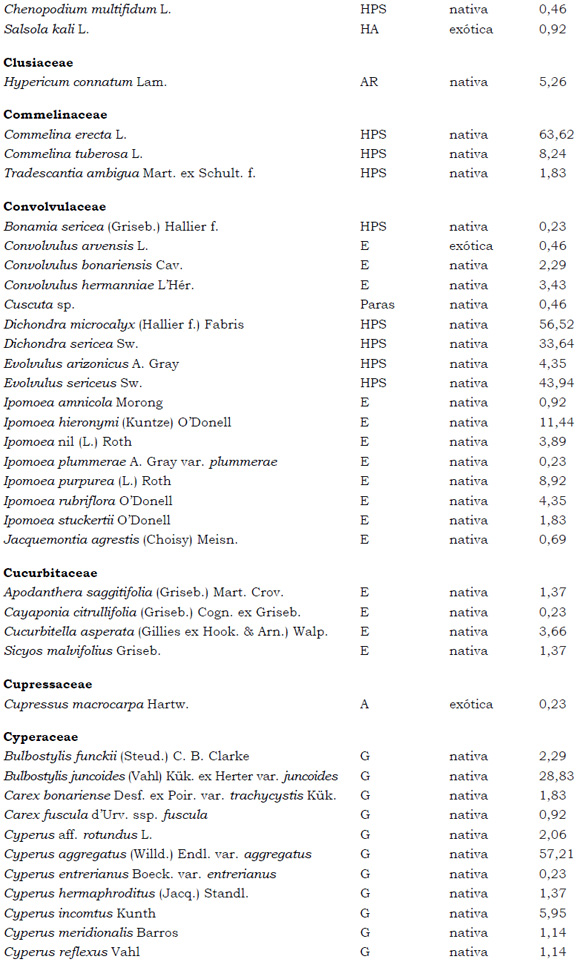

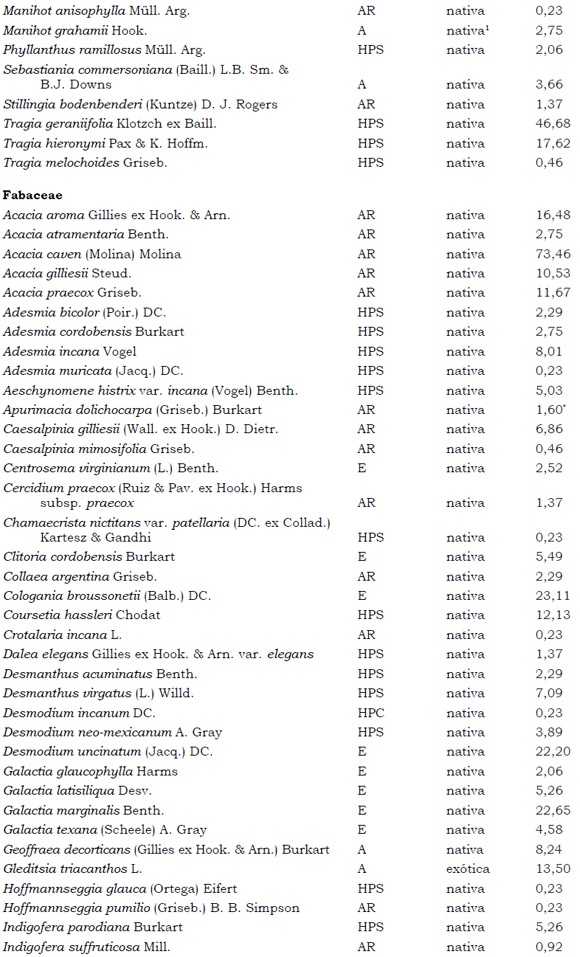


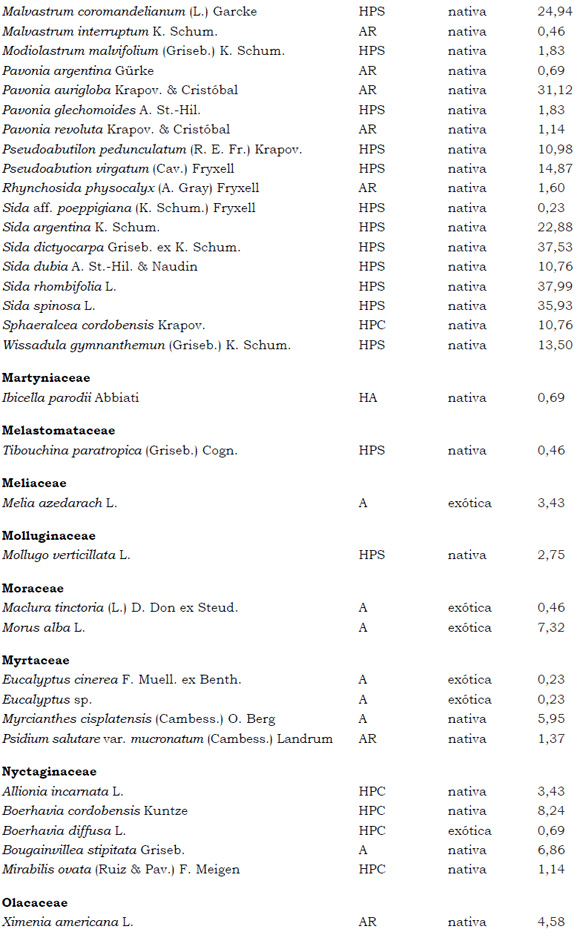

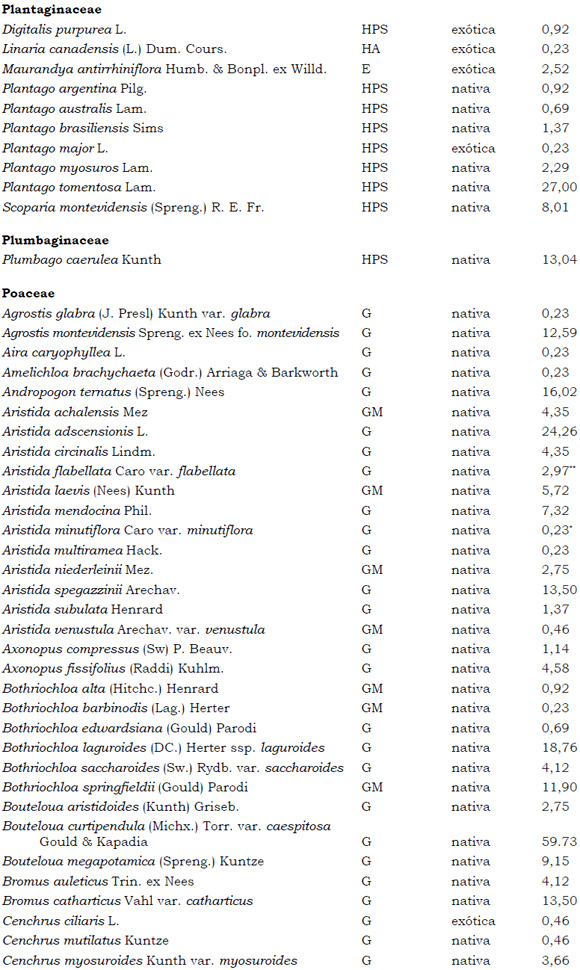
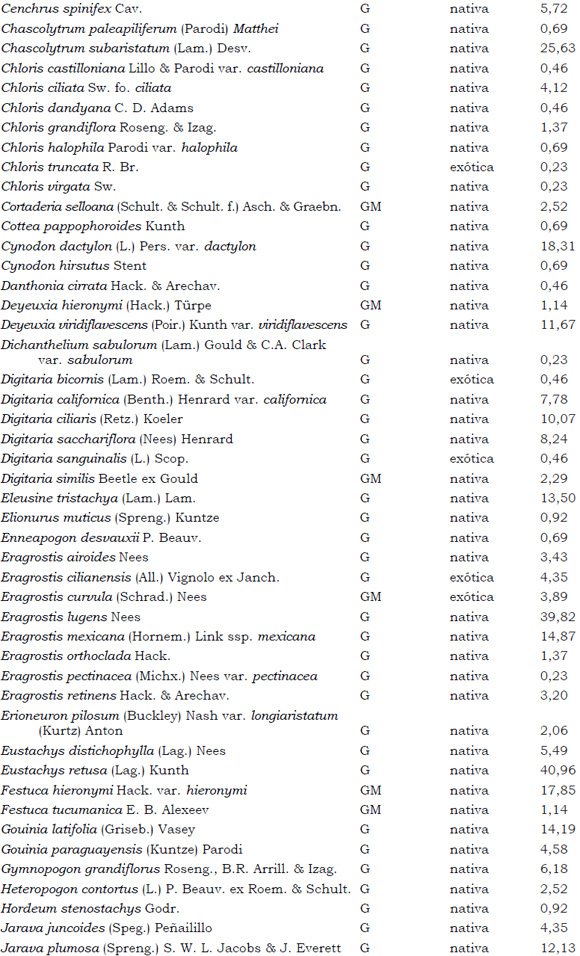
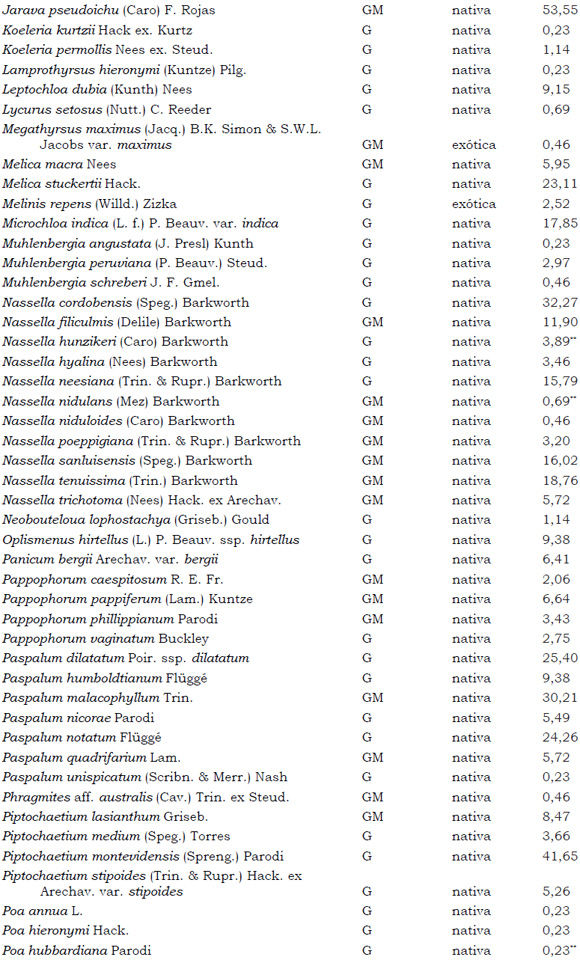
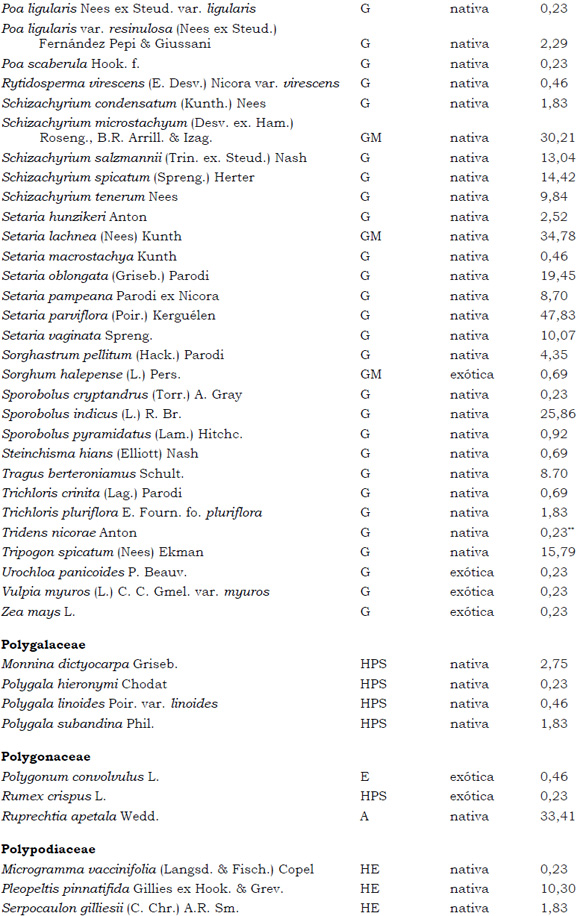
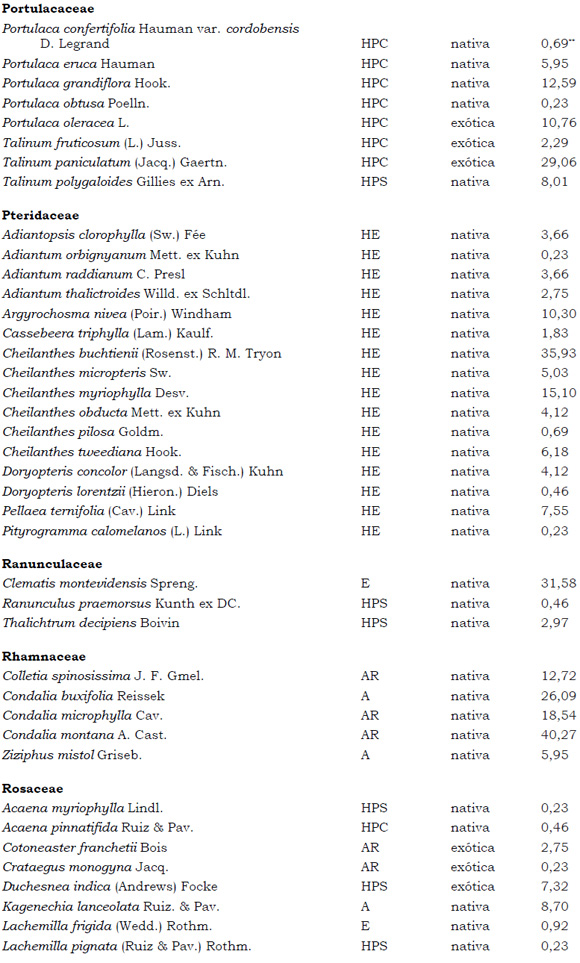
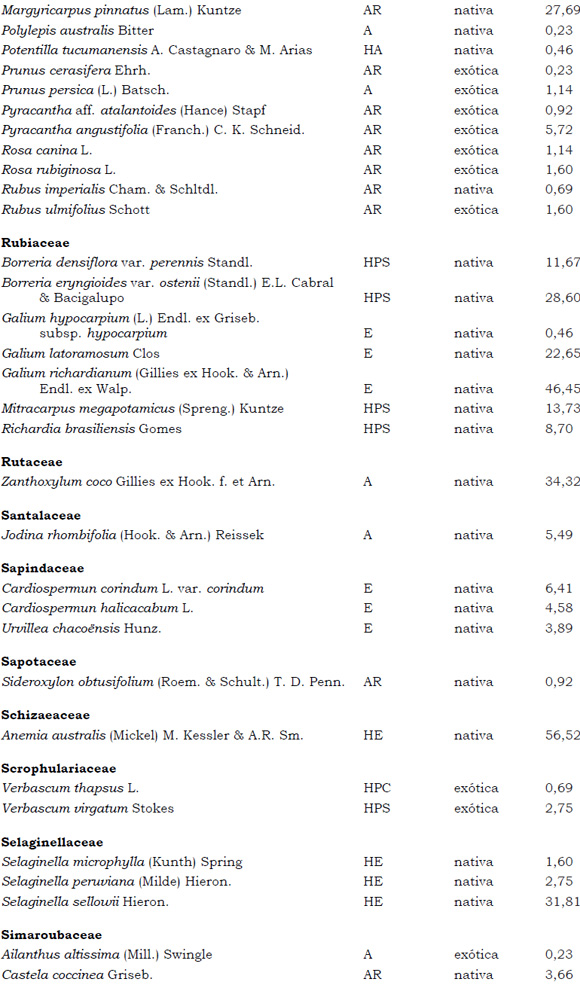
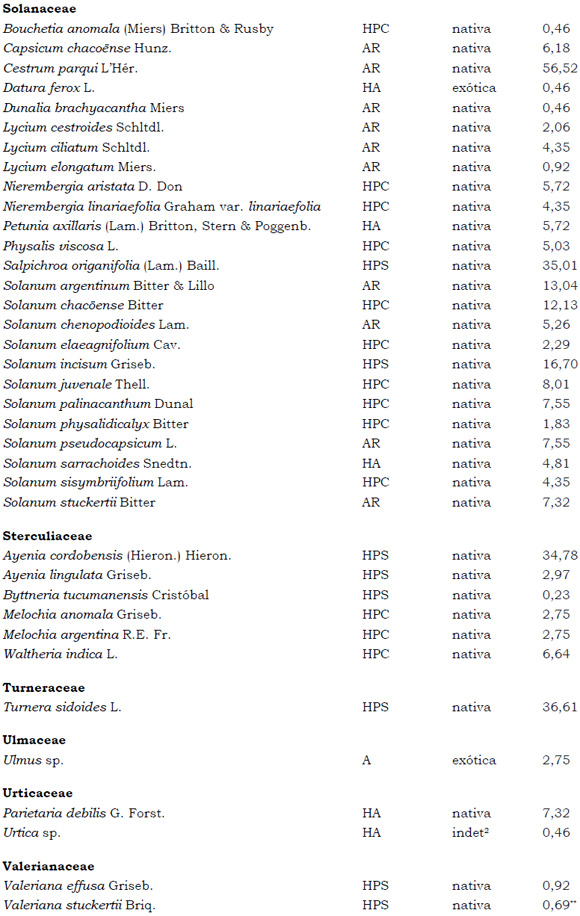
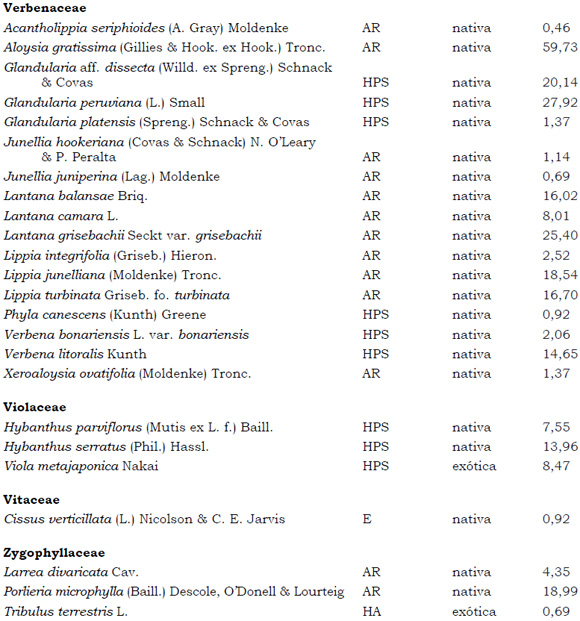
1. Estas especies si bien son nativas de Argentina, según nuestro conocimiento serían especies exóticas en la unidad fitogeográfica comprendida por el área de estudio.
2. Indet.: Especies que no se pudo establecer con precisión su estátus. *. Especies endémicas de la provincia de Córdoba. **. Especies endémicas de la provincia de Córdoba y San Luis.
Referencias bibliográficas
1. Anton, A. 1977. Notas críticas sobre Gramíneas de Argentina II. Kurtziana 10: 51-67. [ Links ]
2. Aragón, R. & J. M. Morales. 2003. Species composition and invasion in NW Argentinian secondary forests: Effects of land use history, environment and landscape. J. Veg. Sci. 14: 195-204. [ Links ]
3. Ariza, L. E. 2000. Familia Asteraceae: Tribu Heliantheae. Pródromo, de la flora fanerogámica de Argentina Central. N°2. Ed. Museo Botánico (IMBIV-UNC). [ Links ]
4. Ariza, L. E. 2008. Familia Asteraceae: Tribu Inuleae (excepto Achyrocline, Gamochaeta y Gnaphalium). Pródromo, de la flora fanerogámica de Argentina Central. N°4. Ed. Museo Botánico (IMBiV-UNC). [ Links ]
5. Barboza, G. E., M. Matesevach & L. Mentz. 2008. Solanaceae (excepto Petunia y Calibrachoa). En F. O. Zuloaga, O. Morrone & M. J. Belgrano (eds.). Catálogo de Plantas Vasculares del Cono Sur, 107: 2962-3056. Monogr. Missouri Bot. Garden (USA). [ Links ]
6. Cabido, C., M. L. Carranza, A. Acosta & S. Páez. 1991. Contribución al conocimiento fitosociológico del Bosque Chaqueño Serrano en la provincia de Córdoba, Argentina. Phytocoenología 19: 547-566. [ Links ]
7. Cabrera, A. 1976. Regiones fitogeográficas argentinas. 2 ed. Enciclop. Arg. Agric. Y Jardinería. ACME, Buenos Aires. [ Links ]
8. Cabrera, A. L. & S. E. Freire. 1997. Asteraceae, parte 8. Tribu II. Eupatorieae. en A. T. Hunziker (ed.). Flora Fanerogámica Argentina, 47: 79-98 (CONICET). [ Links ]
9. Cantero, J. J., J. Liira, J. M. Cisneros, J. González, C. Núñez, L. Petryna, C. Cholaky & M. Zobel. 2003. Species richness, alien species and plant traits in Central Argentine mountain grasslands. J. Veg. Sci. 14: 129-136. [ Links ]
10. Cantero, J. J., M. Cabido, C. Nuñez, L. Petryna, M. Zak & M. Zobel. 2001. Clasificación de los pastizales de suelos sobre rocas metamórficas de las Sierras de Córdoba, Argentina. Kurtziana 29: 27-77. [ Links ]
11. Capitanelli, J. 1979. Clima. En Vázquez, J., R. Miatello & M. Roque (eds). Geografía Física de la Provincia de Córdoba, pp. 45-138. Buenos Aires. [ Links ]
12. Carignano, C. A. 1999.Late Pleistocene to recent climate change in Córdoba Province, Argentina: Geomorphological evidence. Quatern. Int. 57/58: 117-134. [ Links ]
13. Chaneton, E. J., S. B. Perelman, M. Omacini & R. J. C. León. 2002. Grazing, environmental heterogeneity, and alien plant invasions in temperate Pampa grasslands. Biol. Invasions 4: 7-24. [ Links ]
14. Charles, H. & J. S. Dukes. 2007. Impacts of invasive species on ecosystem services. W. Nentwig (ed.), Biological invasions, pp. 217-237. Springer-Verlag, Berlin, Heidelberg. [ Links ]
15. Cingolani, A. M., D. Renison, P. A. Tecco, D. E. Gurvich & M. Cabido. 2008. Predicting cover types in a mountain range with long evolutionary grazing history: a GIS approach. J. Biogeogr. 35: 538-551. [ Links ]
16. Cingolani, A. M., M. Cabido, D. Renison & V. Solís Neffa. 2003. Combined effects of environment and grazing on vegetation structure in Argentine granite grasslands. J. Veg. Sci. 14: 223-232. [ Links ]
17. Cronk, Q. C. B. & J. L. Fuller. 1995. Plant Invaders, the threat to natural ecosystems. 1 edn. Chapman & Hall, London. [ Links ]
18. D'Antonio, C. M. & P. M. Vitousek 1992. Biological invasions by exotic grasses, the grass/fire cycle, and global change. Ann. Rev. Ecol. Syst. 23: 63-87. [ Links ]
19. De Pietri, D. E. 1992. Alien shrubs in a National park: can they help in the recovery of natural degraded forest? Biol. Conserv. 62: 127-130. [ Links ]
20. Díaz, S. & M. Cabido. 2001. Vive la différence: plant functional diversity matters to ecosystem processes. Trends Ecol. Evol. 11: 646-655. [ Links ]
21. Ehrenfeld, J. G. 2003 Effects of Exotic Plant Invasions on Soil Nutrient Cycling Processes. Ecosystems 6: 503-523. [ Links ]
22. Gaston, K. J. & R. M. May. 1992. Taxonomy of taxonomists. Nature 356: 281-282. [ Links ]
23. Gavier, G. I. & E. H. Bucher. 2004. Deforestación de las Sierras Chicas de Córdoba (Argentina) en el período 1970-1997. Acad. Nac. Ci. Miscelánea Nº 101. [ Links ]
24. Ghersa, C. M., E.de la Fuente, R. Suarez & L. J. C. León. 2002. Woody species invasion in the Rolling Pampa grassland, Argentina. Agric. Ecosyst. Environ. 88: 271-278. [ Links ]
25. Giorgis, M. A., A. M. Cingolani, D. E. Gurvich, N. Reynero & S. Rufini. 2005. Diferencias en la estructura de la vegetación del sotobosque entre una plantación de Pinus taeda L. (Pinaceae) y un matorral serrano (Cuesta Blanca, Córdoba). Kurtziana 31: 39-49. [ Links ]
26. Giorgis, M. A., P. Tecco, A. M. Cingolani, P. Marcora, D. Renison & V. Paiaro. En prensa. Factors associated with woody alien species distribution in a newly invaded mountain system of central Argentina. Biol. Invasion DOI 10.1007/s10530-010-9900-y [ Links ]
27. Gordillo, C. E. 1979. Observaciones sobre la petrología de las rocas cordieríticas de las Sierras de Córdoba. Bol. Acad. Nac. Cs. 53: 3-44. [ Links ]
28. Gurvich, D. E., L. Enrico & A. M. Cingolani. 2005. Linking plant functional traits with post-fire sprouting vigour in woody species in central Argentina. Austral Ecol. 30: 789-796. [ Links ]
29. Hawkes, C. V., I. F. Wren, D. J. Herman & M. K. Firestone. 2005. Plant invasion alters nitrogen cycling by modifying the soil nitrifying community. Ecol. Lett. 8: 976-985. [ Links ]
30. Hoffmann, W. A., V. M. P. C. Lucatelli, F. J. Silva, I. N. C. Azeuedo, M. Da S. Marinho, A. M. S. Albuquerque, A. de O. Lopes & S. P. Moreira. 2004. Impact of the invasive alien grass Melinis minutiflora at the savanna-forest ecotone in the Brazilian Cerrado. Div. Distrib. 10: 99-103. [ Links ]
31. Hoyos, L. E., G. I. Gavier-Pizarro, T. Kuemmerle, E. H. Bucher, V. C. Radeloff & P. A. Tecco. 2010. Invasion of glossy privet (Ligustrum lucidum) and native forest loss in the Sierras Chicas of Córdoba, Argentina. Biol. Invasions 12: 3261-3275. [ Links ]
32. Irwin, H. S. & R. C. Barneby. 1981. Cassieae. En: Polhill, R. M., Raven, P. H. (Eds.). Advances in Legume Systematics, pp 97-106. Kew: Royal Botanic Gardens. [ Links ]
33. Kay, S. M. & Gordillo C. E. 1990. Pocho volcanic rocks in the Sierra de Córdoba. Melting of depleted continental lithosphere above a shallow subduction zone. 10º Congreso Geológico Argentino, Actas 1: 60-63. [ Links ]
34. Lammers, T. G. 2008. Campanulaceae, en F. O. Zuloaga, O. Morrone & M. J. Belgrano (eds.). Catálogo de Plantas Vasculares del Cono Sur, 107: 1853-1865. Monogr. Missouri Bot. Garden (USA). [ Links ]
35. Lepetz, V., M. Massot, D. S. Schmeller & J. Clobert. 2009. Biodiversity monitoring: some proposals to adequately study species' responses to climate change. Biodivers. Conserv. 12: 3185-3203. [ Links ]
36. Lichstein, J. W., H. R. Grau & R. Aragón. 2004. Recruitment limitation in secondary forests dominated by an exotic tree. J. Veg. Sci. 15: 721-728. [ Links ]
37. Luti, R., M. A. Bertrán de Solís, M. F. Galera, N. Müller de Ferreira, M. Berzal, M. Nores, M. A. Herrera & J. C. Barrera. 1979. Vegetación. En J. Vázquez, R. Miatello & M. Roque (eds.), Geografía Física de la provincia de Córdoba, pp. 297-368. Ed. Boldt, Buenos Aires. [ Links ]
38. Mack, R. N., D. Simberloff, W. M. Londsdale, H. Evans, M. Clout & F. A. Bazzaz. 2000. Biotic invasions: causes, epidemiology, global consequences, and control. Ecol. Applic. 103: 689-710. [ Links ]
39. Mazia, C. N., E. J. Chaneton, C. M Ghersa & R. J. C. León. 2001. Limits to tree species invasion in pampean grassland and forest plant communities. Oecologia 128: 594-602. [ Links ]
40. McDougall, K. L., J. M. Alexander, S. Haider, A. Pauchard, N. G. Walsh & C. Kueffer. 2011. Alien flora of mountains: global comparisons for the development of local preventive measures against plant invasions. Div. Distrib. 17: 103-111 [ Links ]
41. Millennium Ecosystem Assessment. 2005. Ecosystems and human well-being: synthesis. Island Press, Washington, D.C., USA. [ Links ]
42. Novara, L. J. 1993. Rosaceae. Flora del Valle de Lerma. Aportes Bot. Salta, Ser. Fl. 2 (11): 1-44. [ Links ]
43. Pauchard, A. & P. B. Alaback. 2004. Influence of elevation, land use, and landscape context on patterns of alien plant invasions along roadsides in protected areas of South-Central Chile. Conserv. Biol. 18: 238-248. [ Links ]
44. Pimentel, D., R. Zuniga & D. Morrison. 2005. Update on the environmental and economic costs associated with alien-invasive species in the United States. Ecol. Econ. 52: 273-288. [ Links ]
45. Ragonese, A. & J. C. Castiglioni.1970. La vegetación del Parque Chaqueño. Bol. Soc. Argent. Bot. 11 (Supl.): 133-160. [ Links ]
46. Rapela, C. 1982. Aspectos geoquímicas y petrológicos del batolito de Achala. Provincia de Córdoba. Rev. Asoc. Geol. Arg. 37: 313-330 [ Links ]
47. Reichard, S. H. & C. W. Hamilton. 1997. Predicting invasions of woody plants introduced into North America. Conserv. Biol. 11: 193-203. [ Links ]
48. Renison, D., I. Hensen, A. M. Cingolani, P. Marcora & M. A. Giorgis. 2010. Soil conservation in Polylepis mountain forests of Central Argentina: Is livestock reducing our natural capital? Austral Ecol. 35: 435-443. [ Links ]
49. Richardson, D. M. 1998. Forestry Trees as Invasive Aliens. Conserv. Biol. 12, 18-29. [ Links ]
50. Schmeller, D. S., P-Y. Henry, R. Julliard, B. Gruger, J. Clobert, F. Dziock, S. Lengyel, P. Nowichi, E. Déri, E. Budrys, T. Kull, K. Tali, B. Bauch, J. Settele, C. Van Swaay, A. Kobler, V. Babij, E. Papastergiadou & A. Henle. 2009 Advantages of volunteer-based biodiversity monitoring in Europe. Conserv. Biol. 23: 307-316. [ Links ]
51. Smith, L. B. & R. J. Downs. 1977. Tillandsoideae (Bromeliaceae). Fl. Neotrop. Monogr. 14(2): 663-1492. [ Links ]
52. Speziael, K. L. & C. Ezcurra. 2009. Características de las invasiones de plantas exóticas en el Noroeste de la Patagonia Argentina. XXXII Jornadas Argentinas de Botánica, pp. 103. [ Links ]
53. Suárez, S. & N. Vischi. 1997. Caracterización fisonómico-estructural de la vegetación serrana (Alpa Corral-Córdoba-Argentina). Multequina 6: 21-32. [ Links ]
54. Subils, R. 2009. Tillandsia, en R. Kiesling (ed.). Flora de San Juan. Vol IV: 350-363. Mendoza. Argentina. [ Links ]
55. Tecco, P. A., D. E. Gurvich, S. Díaz, N. Pérez-Harguindeguy & M. Cabido. 2006. Positive interaction between invasive plants: the influence of Pyracantha angustifolia on the recruitment of native and exotic woody species. Austral Ecol. 31: 293-300. [ Links ]
56. Tecco, P. A., S. Díaz, D. E. Gurvich, N. Pérez-Harguindeguy, M. Cabido & G.A. Bertone. 2007. Experimental evidence of positive association between exotic woody species: facilitation by Pyracantha angustifolia on Ligustrum lucidum sapling survival. Appl. Veg. Sci. 10: 211-218. [ Links ]
57. Ulibarri, E. A. 1997. Fabaceae, parte 1. en A. T. Hunziker (ed.). Flora Fanerogámica Argentina 32: 1-26. (CONICET). [ Links ]
58. Vázquez, J., Miatello R. & Roque M. 1979. Vegetación. En (eds.), Geografía Física de la provincia de Córdoba. Ed. Boldt, Buenos Aires. [ Links ]
59. Weinzettel, C. M., G. L. Alfonso & A. O. Prina. 2009. Lista preliminar de la flora vascular de la reserva provincial Pichi Mahuida, La Pampa. XXXII Jornadas Argentinas de Botánica. Bol. Soc. Argent. Bot. 44: 104. [ Links ]
60. Zak, M. R., M. Cabido & J. G. Hodgson. 2004. Do subtropical seasonal forests in the Gran Chaco, Argentina, have a future? Biol. Conserv. 120: 589-598. [ Links ]
61. Zalba, S. M. & C. B. Villamil. 2002. Woody plant invasion in relictual grasslands. Biol. Invasions 4: 55-72. [ Links ]
62. Zuloaga, F. O., O. Morrone & D. Rodriguez. 1999 Análisis de la biodiversidad en plantas vasculares de la Argentina. (Biodiversity analysis of the vascular plants of Argentina.) Kurtziana 27: 17-167. [ Links ]
63. Zuloaga, F. O., O. Morrone & M. J. Belgrano. 2008. Catálogo de Plantas Vasculares del Cono Sur. Monogr. Missouri Bot. Garden (USA). [ Links ]
Original recibido el 17 de agosto de 2010;
primera decisión: 8 de octubre de 2010;
aceptado el 7 de noviembre de 2010.
Editor responsable: Leonardo Galetto.














