Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Kurtziana
versión On-line ISSN 1852-5962
Kurtziana vol.36 no.1 Córdoba ene./jun. 2011
ARTÍCULOS ORIGINALES
Crecimiento y colonización micorrícica de Polylepis australis Bitter (Rosaceae) en suelos con distinta historia de pastoreo
Julieta Martino 1, Carlos Urcelay 1* & Daniel Renison 2
1 Instituto Multidisciplinario de Biología Vegetal, CONICET-Universidad Nacional de Córdoba, CC 495, 5000 Córdoba, Argentina.
2 Centro de Ecología y Recursos Naturales Renovables - Dr. Ricardo Luti (CERNAR), Facultad de Ciencias Exactas, Físicas y Naturales, UNC - CONICET, Av. Vélez Sarsfield 1611, X5016GCA Córdoba, Argentina.
* Autor para correspondencia. E-mail address: curcelay@imbiv.unc.edu.ar
Resumen
Los grandes herbívoros afectan a las plantas por la remoción de biomasa, pero también debido a efectos indirectos sobre las comunidades de microorganismos del suelo incluyendo los hongos micorrícicos, los cuales han sido menos estudiados. Ponemos a prueba la hipótesis de que los suelos de sitios con diferentes densidades de herbívoros domésticos Europeos afectan diferencialmente al crecimiento y la colonización micorrícica arbuscular (HMA) de las plantas, usando a Polylepis australis Bitter (Rosaceae). Para examinar los efectos indirectos de la carga ganadera a través de las señales que ésta deja en el suelo, se realizó un experimento en invernadero donde se evaluó el crecimiento y la colonización micorrícica en plantas de P. australis en suelos provenientes de sitios con tres cargas ganaderas (nula, baja y alta). También se midió la densidad inicial y composición de esporas de HMA, así como las propiedades químicas del suelo. Después de 5 meses, la biomasa seca de P. australis fue mayor en los suelos con carga nula y menor en las plantas que crecieron en suelos con cargas ganaderas baja y alta. Por el contrario, la colonización micorrícica fue levemente mayor en las raíces de suelos con alta carga, intermedia a aquellos con baja carga y menor en las raíces de suelos sin carga ganadera. Estos resultados no parecen estar relacionados con las propiedades del suelo y la composición inicial de esporas de HMA, ya que no se encontraron diferencias significativas en las propiedades químicas del suelo entre los sitios. A su vez, la riqueza y la densidad de esporas fueron similares en suelos con nula y elevada carga ganadera. Nuestros resultados sugieren que el crecimiento y la colonización micorrícica de P. australis pueden estar mediados por las complejas interacciones de las redes tróficas del suelo que se suman a los efectos de remoción o eliminación de la biomasa por parte de los herbívoros.
Palabras clave: Efectos indirectos; Grandes herbívoros; Micorrizas; Tabaquillo; Argentina central.
Abstract
Growth and mycorrhizal colonization in Polylepis australis Bitter (Rosaceae) from soils with different grazing history.
Large herbivores directly affect plant performance through biomass removal, but also through indirect effects on plant-fungi symbiotic associations and soil fungal communities which have been less studied. We hypothesized that soils from sites with different domestic European herbivore densities would affect growth and arbuscular mycorrhizal colonization (AMF) of Polylepis australis Bitter (Rosaceae). In order to examine the indirect effects of livestock density through their signals in soil, we evaluated in the greenhouse the growth and AMF colonization of P. australis seedlings grown in soils belonging to sites with three domestic herbivore densities (null, low and high). We also measured initial AMF spore density and composition together with soil properties. After 5 months, P. australis dry mass was higher in soils collected from the treatment without grazing and lower in seedlings grown in soils with low and high livestock densities. In contrast, mycorrhizal colonization was marginally higher in roots at the high livestock density treatment, intermediate at low density and lower in roots from the treatment without livestock. These results do not seem to be related to soil properties and initial AMF spore composition, since there were no significant differences in soil chemical properties between sites while spore richness and density were similar in soils with null and high livestock density. Our results suggest P. australis growth and mycorrhizal colonization may be mediated by complex soil food web interactions which add to herbivore direct effects of clipping or removing of biomass.
Key words: Indirect effects; Large herbivores; Mycorrhizas; Tabaquillo; Central Argentina.
Introducción
Los grandes herbívoros afectan directamente a las plantas a través del ramoneo y el pisoteo e indirectamente alterando las propiedades del suelo, las asociaciones simbióticas en las raíces y las comunidades de microorganismos. Los efectos indirectos pueden persistir durante mucho tiempo aún después de que los herbívoros hayan sido excluidos (Crawley, 1997; Eom et al., 2001).
Los hongos micorrícicos arbusculares (HMA) son simbiontes obligados que, a cambio de carbohidratos, proveen a las plantas de acceso a nutrientes, protección frente a patógenos y reducción del estrés hídrico (Smith & Read, 2008). Ha sido propuesto que el pastoreo puede afectar negativamente la colonización de las raíces por HMA limitando la cantidad de carbohidratos que producen las plantas en la fotosíntesis y disminuyendo consecuentemente el carbono destinado a los HMA (Gehring & Whitham, 1994; Gange & Brown, 2002). La perturbación de la red de micelio fúngico por el pisoteo también puede afectar negativamente la colonización micorrícica (Jasper et al., 1991; Merryweather & Fitter 1998). Los cambios producidos en los HMA pueden afectar la relación simbiótica, especialmente en especies leñosas perennes que suelen ser dependientes de la asociación simbiótica para su crecimiento (Brundrett, 1991). Varios estudios han evaluado la colonización micorrícica de las raíces de plantas sometidas a diferentes niveles de pastoreo. Si bien los efectos negativos son más frecuentes (Gehring & Whitham, 2002), los resultados han mostrado que el pastoreo ejerce efectos positivos, neutrales o negativos sobre la colonización micorrícica (ej. Bethlenfalvay & Dakessian, 1984; Allen et al., 1989; Gange et al., 1993; Gehring & Whitham, 1994; 2002; Gange & Brown, 2002; Lugo et al., 2003). Menos estudiados han sido los efectos indirectos del pastoreo sobre el crecimiento y la colonización micorrícica a través de la influencia sobre las propiedades bióticas y abióticas del suelo. Es decir, los efectos no directamente relacionados con la eliminación directa de la biomasa vegetal.
El estudio de los efectos indirectos puede ser de relevancia en pastizales donde ya ha sido observado que el ganado ejerce considerables efectos directos sobre el crecimiento de las plantas y la estructura de las comunidades (Cingolani et al., 2005). Tal es la situación de las montañas de América del Sur, donde el género Polylepis Ruiz & Pav. (Rosaceae, Sanguisorbae) domina el dosel de los bosques de muchas pasturas y durante siglos han sido objeto de incendios, uso por el ganado, el pisoteo y la erosión del suelo (Fjeldså & Kessler, 1996; Renison et al., 2006; 2010; Cingolani et al., 2008a).
Los bosques de Polylepis son característicos de las montañas de América del Sur donde sustentan una alta diversidad de especies endémicas, regulan la escorrentía, erosión del suelo y proporcionan madera y combustible (Fjeldså & Kessler, 1996). A pesar de su importancia, los bosques de Polylepis son ahora considerados un ecosistema boscoso en peligro de extinción por lo que las medidas de reforestación han sido altamente recomendadas (Fjeldså & Kessler, 1996; United Nations Environment Programme -CMCM, 2004). Polylepis australis Bitter es la especie más austral del género y en las montañas del centro de Argentina crece desde los 900 a 2880 m.s.n.m. (Cantero & Bianco, 1987; Marcora et al., 2008). La extensión de los bosques ha disminuido en al menos el 80% en las montañas del centro de Argentina. La reforestación de las áreas protegidas es de importancia para acelerar la restauración de bosques, especialmente en zonas que carecen de árboles semilleros, ya que las semillas de las especies de Polylepis son dispersadas por el viento sólo a pocos metros de distancia (Renison et al., 2002; 2004; 2005; Enrico et al., 2004; Cingolani et al., 2008b; Torres et al., 2008).
Junto con la reforestación, la reducción de ganado europeo es una de las principales actividades desarrolladas para la restauración forestal en estas áreas (Renison et al., 2005). Sin embargo, la relación entre esta práctica, la colonización micorrícica y el crecimiento de las plantas es desconocida. Recientemente, Menoyo et al. (2009) no encontraron diferencias en la colonización total de HMA en plantas adultas a diferentes cargas ganaderas pero observaron mayor abundancia de esporas de HMA en los suelos de los sitios con alta carga ganadera. En el presente estudio, nos interesamos por efectos o señales en el suelo mediados por la carga ganadera en el crecimiento y la colonización micorrícica de plantas de P. australis. Con el fin de excluir los efectos directos de las interacciones complejas que ocurren por encima de la superficie del suelo (por ejemplo, la herbivoría) e incluir, además, un control sin ganado, se evaluó en invernáculo el efecto de suelos recolectados en sitios con tres cargas ganaderas (nula, baja y alta) sobre el crecimiento de plántulas de P. australis y la colonización por HMA. Nuestra hipótesis es que, a través de los efectos indirectos del pastoreo sobre las propiedades bióticas y abióticas del suelo, el crecimiento y la colonización micorrícica variarán de acuerdo a la carga ganadera en dichos suelos.
Materiales y métodos
Área de estudio
Las sierras grandes de Córdoba en el centro de Argentina, con elevaciones de hasta 2884 m.s.m. (31º 34' S, 64º 50' W), presentan a los 2100 m.s.m. una temperatura media en los meses más fríos y más cálidos de 5,0 y 11,4° C, respectivamente, sin período libre de heladas (Cabido, 1985). La precipitación media anual es de 920 mm, con 83% de la precipitación concentrada en los meses de verano, entre octubre y abril (Colladon, 2002; Renison et al., 2002). La región está compuesta por un mosaico de pajonales, céspedes de pastoreo, céspedes degradados, áreas erosionadas con roca expuesta y escasa vegetación, afloramientos naturales de granito, y bosques cerrados o arbustales abiertos de P. australis (2,5 y 9,4% de cobertura, respectivamente). La principal actividad económica es la cría de ganado (vacunos, ovinos, equinos y caprinos), que comenzó a principios del siglo 17 y que representa el principal factor que afecta la vegetación y composición de la biota a escala local (Cingolani et al. 2003; 2004; 2008a; Renison et al., 2006, 2011; García et al., 2008; Giorgis et al., 2010; Robledo & Renison, 2010).
Producción de plántulas
Se colectaron semillas de P. australis en el Parque Nacional Quebrada del Condorito (31º 40' S; 64º 41' W) a una altitud promedio de 1800 m.s.n.m. Se pusieron a germinar en arena esterilizada como en Renison & Cingolani (1998). Una vez germinadas, las plántulas se trasplantaron a los diferentes tratamientos. Se sembraron entre julio y diciembre de 2004 en un invernáculo con riego controlado y temperatura promedio de 25º C.
Diseño experimental
En invernáculo, las plantas de P. australis fueron cultivadas en suelos que fueron colectados en otoño de 2004 y provenientes de sitios con tres niveles de carga ganadera (un sitio por carga ganadera): 1. Alta (1,68 equivalentes ganado bovino ha-1), baja (0,08 equivalentes ganado bovino ha-1) y nula (sin carga ganadera). Los sitios con cargas ganaderas altas y baja poseen aproximadamente 61 árboles (>2 m de altura) por ha. mientras que el sitio sin carga ganadera posee 256 árboles por ha. La carga ganadera se determinó a través de la estimación de la frecuencia de heces y corroboración por observación directa de los animales (ver Teich et al. 2005). El ganado era en su mayoría bovino pero también ovino y equino y los sitios habían permanecido con esas cargas en últimos 8 años antes de la extracción de suelo (Giorgis et al. 2010). Todas las muestras de suelo fueron colectadas cerca de individuos de P. australis (seis por carga ganadera) y almacenadas en bolsas de plástico para ser mantenidas en heladera a 4º C hasta su uso. Las muestras de suelos de diferentes cargas ganaderas se homogeneizaron entre sí y luego se mezclaron con arena esterilizada en proporción 1:2 y estas mezclas se colocaron en macetas de 150 cm3. A partir de esa mezcla se prepararon las macetas para cada tratamiento (10 macetas por tratamiento).
Variables respuesta
Después de cinco meses las plantas fueron cosechadas y secadas durante tres días en una estufa a 60º C. La variable de respuesta fue peso seco de las plantas incluyendo las hojas que cayeron durante el crecimiento. Las raíces fueron separadas, rehidratadas y luego teñidas de acuerdo con Grace & Stribley (1991). Luego, fueron examinadas al microscopio para determinar la proporción de la longitud de raíz colonizada por los HMA (expresado en %) según el método de intersección magnificada por McGonigle et al. (1990) utilizando un microscopio compuesto (Kyowa óptica, Modelo LSCB-VC-2B-L), con aumentos de x150 y x400.
Densidad y riqueza de esporas de HMA
De las muestras provenientes de cada carga ganadera separamos 3 muestras (50 g cada una) para evaluar la composición de esporas de HMA al inicio del experimento. La extracción de esporas se realizó pasando suelo disuelto en agua a través de dos tamices, uno de 1 mm y otro de 38 mm. El material contenido por el tamiz de 38 mm se centrifugó en solución de sacarosa al 50 % (Daniels & Skipper, 1982) y las esporas extraídas se observaron con un microscopio óptico para ser identificadas a nivel de morfoespecie utilizando criterios morfo-taxonómicos (http://invam.caf.wvu.edu/). Se cuantificaron sólo las esporas que parecían ser viables (basados en la apariencia externa y el contenido).
Análisis de nutrientes
Se caracterizó cada tipo de suelo mediante la medición de pH, conductividad, el total de C, P, N, Ca, Mg, K y Na. Una muestra compuesta de suelo de diez submuestras de 10 cm de profundidad fue recolectada en cuatro áreas dentro de cada sitio. Después fueron secadas durante 48 horas a 105° C y se eliminaron las partículas gruesas del suelo (> 2 mm). Luego, las muestras fueron sometidas a los siguientes análisis químicos: el pH del suelo fue medido en agua (20 g de suelo, 50 ml de H2O) con una sonda Standard SenTix 21, (WTW, Alemania). La cantidad total de N y C se midió con el método Dumas (Analizador CN Vario EL, ELEMENTAR, Alemania). Los cationes se extrajeron con una solución de NH4Cl (0.1 mol/l). El Ca2+ y Mg2+ se analizaron con espectrometría de absorción atómica, K+ y Na+ con un espectrómetro de llamas (Flame-AAS Vario EL, Analytik Jena, Alemania). El P disponible se extrajo con Ca-lactato a pH 3,6 y luego fue medido con un fotómetro (EPPSTEIN, Alemania). Todos los datos se refieren a suelo fino seco (<2mm, 105º C). La conductividad fue medida con una relación suelo:agua 1:2,5 mediante Cond 315 i (WTW, Alemania).
Análisis de datos
Los datos de suelos con diferentes densidades de ganado se compararon mediante análisis de varianza utilizando el software Infostat (Di Rienzo et al., 2008). Las variables de respuesta fueron peso seco de las plantas (gr), colonización micorrícica (%), densidad de esporas, riqueza de morfotaxones y propiedades químicas del suelo. Se probaron los supuestos de distribución normal (prueba de Shapiro-Wilks) y la homogeneidad de varianza de los datos. Se utilizó la prueba de Fisher LSD para comparar las medias entre los tratamientos.
Resultados
Crecimiento de las plantas y colonización micorrícica
Después de 5 meses, la biomasa seca de P. australis fue significativamente mayor en los suelos pertenecientes al tratamiento con carga ganadera nula (F = 16,22, p <0,0001) en comparación con cargas baja y alta (Fig. 1A). Por el contrario, la colonización micorrícica fue mayor en las raíces de suelo con alta densidad de ganado, intermedia en el tratamiento de baja densidad y menor en las raíces del tratamiento con carga ganadera nula, aunque marginalmente significativa (F = 3,22, p <0,058) (Fig. 1B).
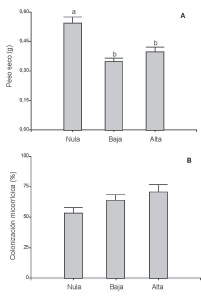
Fig. 1. A, biomasa seca de plantas de P. australis y B, colonización micorrícica luego de cinco meses de crecimiento en suelos provenientes de sitios con cargas ganaderas nula, baja y alta (n=10). Letras distintas indican diferencias significativas entre las barras (Fisher LSD Test, P < 0.05 and P = 0.057 respectivamente).
Esporas de HMA y propiedades del suelo
La densidad promedio de esporas HMA fue mayor en los suelos pertenecientes a los tratamientos con alta y nula carga ganadera, mientras que fue más baja en los suelos pertenecientes al tratamiento con baja densidad de ganado (F = 19,42, p <0,002) (Fig. 2A). Aunque las diferencias fueron marginalmente significativas, la riqueza de esporas siguió el patrón inverso (F = 3,50, p <0,098) (Fig. 2B). Esto podría atribuirse a la presencia de varios morfotaxones que no se encontraron en suelos de las otras dos situaciones (datos no mostrados).
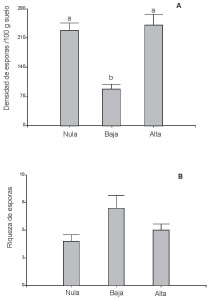
Fig. 2. A, densidad y B, riqueza de esporas micorrícicas arbusculares en suelos provenientes de sitios con cargas ganaderas nula, baja y alta (n=3). Letras distintas indican diferencias significativas entre las barras (Fisher LSD Test, P < 0.05 and P = 0.098 respectivamente).
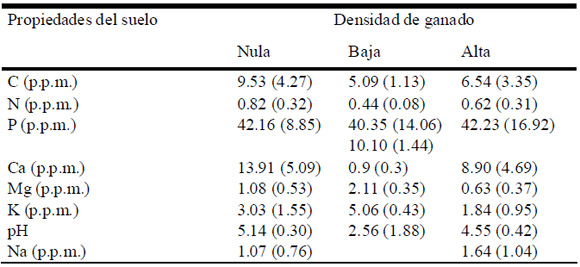
Si bien se observan algunas tendencias, las propiedades químicas de los suelos no fueron significativamente diferentes entre los tratamientos. En general, C, N, Ca, Mg, K y pH tendieron a ser mayores en los suelos con densidad nula y menor en suelos con alta densidad de ganado (Tabla 1).
Tabla 1. Análisis de las propiedades del suelo (media ± ES) de sitios con densidades de ganado nula, baja y alta (n=4). No se observaron diferencias significativas entre las variables (p<0.05).
Discusión
Crecimiento de las plantas en suelos con diferentes densidades de ganado
Los efectos directos del pastoreo sobre el crecimiento de plantas es un tema muy estudiado en ecología vegetal (Cingolani et al., 2003; 2008b; Albon et al., 2007; Vavra et al., 2007) incluyendo a P. australis (Giorgis et al., 2010). Sin embargo, se ha prestado menos atención a los efectos de la densidad de ganado, mediados por el suelo, sobre el crecimiento de las plantas y la colonización micorrícica. Aquí encontramos que los suelos pertenecientes a los sitios con diferentes historias de pastoreo también afectan el crecimiento de P. australis. Estos efectos del suelo sobre el crecimiento de las plantas no parecen estar relacionados con cambios en las propiedades químicas de los suelos ya que no existen diferencias significativas entre las diferentes densidades de pastoreo.
Colonización y esporas micorrícicas arbusculares
La mayor densidad y menor riqueza de esporas de HMA en suelos con cargas ganaderas alta y nula en comparación con la baja densidad de ganado sugieren que la competencia (sin pastoreo) y la perturbación (alta densidad de pastoreo) favorecen a unas pocas morfoespecies de HMA mientras que afectan negativamente a otras. Estos resultados son consistentes con la hipótesis de «disturbio intermedio» (sensu Connell, 1978) y podrían indicar que en estas comunidades de hongos, la alteración moderada del suelo podría aumentar la diversidad mediante la reducción de la exclusión competitiva (Wardle, 2002). Menoyo et al. (2009), observaron tendencias similares para cargas ganaderas alta y baja. Sin embargo, vale la pena mencionar que los datos de esporas en ambos estudios corresponden a submuestras de suelo homogeneizadas de los sitios de campo (n = 3 por situación) y podrían no reflejar la variabilidad espacial de la actual distribución de esporas en el campo, por lo tanto deben ser interpretados con precaución.
Aunque marginales, las diferencias en la colonización por HMA bajo diferentes condiciones de pastoreo en las plantas cultivadas en el invernáculo, es decir sin el efecto directo de los herbívoros, sugieren que el ganado afecta a la interacción planta-hongo indirectamente a través de sus señales en el suelo. Estos efectos no pueden atribuirse a la composición de esporas en el suelo ya que al inicio del experimento no hubo diferencias en las comunidades de esporas entre los suelos con nula y alta carga ganadera. La falta de relación entre los patrones de colonización de la raíz y la composición de esporas en el suelo no sorprende ya que es posible que no haya relación directa entre ellas (Sanders et al., 2004). Además, la ausencia de diferencias en las propiedades químicas del suelo en las tres situaciones implica que las diferencias en el crecimiento y la micorrización no pueden ser atribuidas a factores abióticos. Por lo tanto, las diferencias observadas en la micorrización y el crecimiento de plantas en los distintos tratamientos sugieren que otro tipo de interacción puede ser, al menos en parte, responsable de los resultados observados.
Una posibilidad podría ser que la historia de pastoreo afecta a otros componentes de las redes tróficas del suelo (Wardle, 2002). Por ejemplo, ha sido observado que el aumento de la densidad de ganado promueve una disminución en la densidad de nemátodos con diferentes hábitos alimentarios, incluyendo aquellos que se alimentan de hongos (Mulder et al., 2003). Por lo tanto, una menor colonización micorrícica en suelos de sitios que no tienen ganado podría ser la consecuencia de una mayor presión sobre el micelio extraradical por parte de microorgarnismos fungívoros. Esto es consistente con el hecho de que la interrupción de micelio del suelo por disturbio promueve menores tasas de colonización micorrícica (Jasper et al., 1991; Merryweather & Fitter, 1998, Urcelay et al., 2009).
Debido a que cambios en la composición de HMA que colonizan las raíces se relacionan con cambios en el porcentaje de colonización de las mismas (Jansa et al., 2008), otra posibilidad podría ser que las diferencias en las comunidades de fungívoros afecten a la composición de la comunidades de HMA mediante la selección de determinados morfotaxones, lo que implicaría cambios posteriores en la colonización micorrícica. Independientemente de los mecanismos, los datos sugieren que otro tipo de interacciones bióticas distintas a las consideradas aquí, podrían explicar, al menos en parte, los patrones y relaciones observadas entre variables bióticas que ocurren por encima y por debajo de la superficie del suelo. Este tipo de interacciones complejas son ampliamente reconocidas en ecología aunque no muy bien estudiadas, por lo que sin dudas merecen una mayor atención (Wardle, 2006).
Los porcentajes promedio de colonización de raíces en plantas crecidas en invernáculo son más bajos que los medidos en individuos adultos cuyas raíces fueron colectadas en el campo (Menoyo et al., 2009). Esto podría atribuirse a diferencias en la edad de las plantas y la exclusión en nuestro estudio de las interacciones que ocurren por encima de la superficie del suelo, pero también sugieren que los efectos de la intensidad de pastoreo mediados por el suelo podrían ser más fuertes en plantas pequeñas que en los individuos adultos. Los resultados de este estudio se refieren un solo sitio por carga ganadera por lo que el alcance de las conclusiones deben ser interpretados en ese contexto.
Conclusiones
Los resultados de este estudio muestran que: 1) la densidad del ganado afecta el crecimiento de plantas y la colonización micorrícica de P. australis a través de sus señales en el suelo; 2) el porcentaje de colonización no está relacionado con crecimiento de las plantas, 3) los efectos mediados por el suelo no parecen estar relacionados con cambios en sus propiedades químicas o la composición inicial de esporas de HMA, sino más bien, con interacciones complejas que ocurren en las redes tróficas del suelo, lo que sugiere un mecanismo complementario a los bien documentados efectos provocados por el pastoreo y la consecuente eliminación directa de la biomasa. Estos resultados sugieren que los esfuerzos para acelerar la restauración de bosques con P. australis en muchas áreas del sur de las montañas de América, incluyendo la exclusión del ganado europeo y la reintroducción de herbívoros nativos (García et al., 2008), deberían considerar las comunidades biótica subterráneas y sus complejas interacciones, así como sus relaciones con el crecimiento de las plantas.
Agradecimientos
Agradecemos a la Fundación Volkswagen Alemania por financiar este estudio y a Ricardo Suárez por los análisis de suelo. Las autoridades de Parques Nacionales gentilmente autorizaron la recolección de semillas y de suelo en el Parque Nacional Quebrada del Condorito. J. Nores y N. Bazan nos permitieron tomar muestras en sus campos. Los comentarios críticos de dos evaluadores incrementaron la calidad del manuscrito. C.U. y D.R. son investigadores de CONICET (Argentina).
Referencias
1. Albon, S. D., M. J. Brewer, S. O'Brien, S. J. Nolan & D. Cope. 2007. Quantifying the grazing impacts associated with different herbivores on rangelands. J. Appl. Ecol. 44: 1176-1187. [ Links ]
2. Allen, M. F., J. H. Richards & C. A. Busso. 1989. Influence of clipping and soil water status on vesicular-arbuscular mycorrhizae of two semi-arid tussock grasses. Biol. Fert. Soils 8: 285-289. [ Links ]
3. Bethlenfalvay, G. J. & S. Dakessian. 1984. Grazing effects on mycorrhizal colonization and floristic composition of the vegetation on a semiarid range in northern Nevada. J. Range. Manag. 37: 312-316. [ Links ]
4. Cabido, M. 1985. Las comunidades vegetales de la Pampa de Achala, Sierras de Córdoba, Argentina. Doc. Phytosociol. 9: 431-443. [ Links ]
5. Cantero, J. J. & C. A. Bianco. 1987. El límite austral de Polylepis australis Bitt. («Tabaquillo») en la R. Argentina. Parodiana 5: 65-71. [ Links ]
6. Cingolani, A. M., M. R. Cabido, D. Renison & V. Solís Neffa. 2003. Combined effects of environment and grazing on vegetation structure in Argentine granite grasslands. J. Veg. Sci. 14: 223-232. [ Links ]
7. Cingolani, A. M., D. Renison, M. R. Zak & M. R. Cabido. 2004. Mapping vegetation in a heterogeneous mountain rangeland using Landsat data: an alternative method to define and classify land-cover units. Remote Sens. Environ. 92: 84-97. [ Links ]
8. Cingolani, A. M., I. Noy-Meir & S. Díaz. 2005. Grazing effects on rangeland diversity: diversity-intensity and state and transition models. Ecol. Appl. 15: 757-773. [ Links ]
9. Cingolani, A. M., D. Renison, P. Tecco, D. Gurvich & M. Cabido. 2008a. Predicting cover types in a mountain range with long evolutionary grazing history: a GIS approach. J. Biogeogr. 35: 538-551. [ Links ]
10. Cingolani, A. M., I. Noy-Meir, D. Renison & M. Cabido. 2008b. La ganadería extensiva, ¿es compatible con la conservación de la biodiversidad y de los suelos? Ecol. Austral 18: 253-271. [ Links ]
11. Colladon, L. 2002. Anuario pluviométrico 1999-2000. Cuenca del Río San Antonio. Sistema del Río Suquía -Provincia de Córdoba. Instituto Nacional del Agua y del Ambienten (INA) y Centro de Investigaciones de la Región Semiárida (CIRSA). [ Links ]
12. Connell, J. H. 1978. Diversity in tropical rain forest and coral reefs. Science 199: 1302-1310. [ Links ]
13. Crawley, M. J. 1997. The structure of plant communities, en M.J. Crawley (ed.) Plant Ecology, pp. 475-531. Blackwell Science, Oxford. [ Links ]
14. Daniels, B. A. & H. D. Skipper. 1982. Methods for the recovery and quantitative estimation of propagules from soil, en N.C. Schenck (ed.). Methods and Principles of Mycorrhizal Research, p. 33. The American Phytopathological Society, St. Paul. [ Links ]
15. Di Rienzo, J. C., W. Robledo, F. Casanoves, M. G. Balzarini, L. A. González, A.W. Guzmán, & E. M. Tablada. 2008. Infostat. Versión Beta. Estadística y Biometría, Facultad de Ciencias Agropecuarias, Universidad Nacional de Córdoba, Córdoba. [ Links ]
16. Enrico, L., G. Funes & M. Cabido M. 2004. Regeneration of Polylepis australis Bitt. in the mountains of central Argentina. Forest Ecol. Manag. 190: 301-309. [ Links ]
17. Eom, A-H., G. W. T. Wilson & D. C. Hartnett. 2001. Effects of ungulate grazers on arbuscular mycorrhizal symbiosis and fungal community structure in tallgrass prairie. Mycologia 93: 233-242. [ Links ]
18. Fjeldså, J. & M. Kessler. 1996. Conserving the Biological Diversity of Polylepis woodlands of the highland of Peru and Bolivia. A Contribution to Sustainable Natural Resource Management in the Andes. NORDECO, Copenhagen. [ Links ]
19. Gange, A. C. & V. K. Brown. 1993. Interactions between soil dwelling insects and mycorrhizas during early plant succession, en I.J Alexander, A.H. Fitter, D.H. Lewis & D.J. Read (eds.). Mycorrhizas in Ecosystems, pp. 177-182. CAB International, Wallingford. [ Links ]
20. Gange, A. C. & V. K. Brown. 2002. Actions and interactions of soil invertebrates and arbuscular mycorrhizal fungi in affecting the structure of plant communities, en M. G. A. van der Heijden & I. Sanders (eds.). Mycorrhizal Ecology, pp. 321-344. Springer, Germany. [ Links ]
21. García, C., D. Renison, A. M. Cingolani & E. Fernández-Juricic. 2008 Avifaunal changes as a consequence of large scale livestock exclusion in the mountains of Central Argentina. J. Appl. Ecol. 45: 351-360. [ Links ]
22. Gehring, C. A. & T. G Whitham. 2002. Mycorrhizae-Herbivore interactions: Population and Community consequences, en M. G. A. van der Heijden & I. Sanders (eds.). Mycorrhizal Ecology, pp. 295-320. Springer, Germany. [ Links ]
23. Gehring, C. A. & T. G. Whitham T.G. 1994. Interactions between aboveground herbivores and the mycorrhizal mutualists of plants. Trends Ecol. Evol. 9: 251-255. [ Links ]
24. Giorgis, M. A., A. M. Cingolani, I. Teich, D. Renison & I. Hensen. 2010. Do Polylepis australis trees tolerate herbivory? Seasonal patterns of shoot growth and its consumption by livestock. Plant Ecol. 207: 307-310. [ Links ]
25. Grace, C. & P. A. Stribley. 1991. A safer procedure for routine staining of vesicular-arbuscular mycorrhizal fungi. Mycol. Res. 95: 1160-1162. [ Links ]
26. Jansa, J., F. A. Smith & S. E. Smith. 2008. Are there benefits of simultaneous root colonization by different arbuscular mycorrhizal fungi. New Phytol. 177: 779-789. [ Links ]
27. Jasper, D. A., L. K. Abbot & A. D. Robson. 1991. The effect of soil disturbance on vesicular-arbuscular mycorrhizal fungi, in soils from different vegetation types. New Phytol. 112: 101-107. [ Links ]
28. Lugo, M. A., M. González Maza & M. Cabello. 2003. Arbuscular mycorrhizal fungi in a mountain grassland II: seasonal variation in colonization studied, along with its relation to grazing and metabolic host type. Mycologia 95: 407-415. [ Links ]
29. Marcora, P., I. Hensen, D. Renison, P. Seltmann & K. Wesche. 2008. The performance of Polylepis australis trees along their entire altitudinal range: implications of climate change for their conservation. Divers. Distrib. 14: 630-636. [ Links ]
30. McGonigle, T. P., M. H. Miller, D. G. Evans, G. L. Fairchild & J. A. Swan. 1990. A method which gives an objective measure of colonization of roots by vesicular-arbuscular mycorrhizal fungi. New Phytol. 115: 495-501. [ Links ]
31. Menoyo, E., D. Renison & A. G. Becerra. 2009. Arbuscular mycorrhizas and performance of Polylepis australis trees in relation to livestock density. Forest Ecol. Manag. 258: 2676-2682. [ Links ]
32. Merryweather, J. W. & A. H. Fitter. 1998. Patterns of arbuscular mycorrhiza colonisation of the roots of Hyacinthoides non-scripta after disruption of soil mycelium. Mycorrhiza 8: 87-91. [ Links ]
33. Mulder, C., D. De Zwart, H. J. Van Wijnen, A. J. Schouten & A. M. Breure. 2003. Observational and simulated evidence of ecological shifts within the soil nematode community of agroecosystems under conventional and organic farming. Funct. Ecol. 17: 516-525. [ Links ]
34. Newsham, K. K., A. H. Fitter & A. R. Watkinson. 1995. Multi-funcionality and biodiversity in arbuscular mycorrhizas. Trends Ecol. Evol. 10: 407-411. [ Links ]
35. Renison, D. & A. M. Cingolani. 1998. Experiencias en germinación y reproducción vegetativa aplicadas a la reforestación con Polylepis australis (Rosaceae) en las Sierras Grandes de Córdoba, Argentina. Agriscientia 15: 47-53. [ Links ]
36. Renison, D., A. M. Cingolani & D. Schinner. 2002. Optimizing restoration of Polylepis australis forests through reforestation: when, where and how to transplant seedlings to the mountains? Ecotropica 8: 219-224. [ Links ]
37. Renison, D., I. Hensen & A. M. Cingolani. 2004. Anthropogenic soil degradation affects seed viability in Polylepis australis mountain forests of central Argentina. Forest Ecol. Manag. 196: 327-333. [ Links ]
38. Renison, D., A. M. Cingolani, R. Suarez, E. Menoyo, C. Coutsiers, A. Sobral & I. Hensen. 2005. The restoration of degraded mountain forests: effects of seed provenance and microsite characteristics on Polylepis australis seedling survival and growth in Central Argentina. Restor. Ecol. 13: 129-137. [ Links ]
39. Renison, D., I Hensen, R. Suarez & A. M. Cingolani. 2006. Cover and growth habit of Polylepis woodlands and shrublands in the mountains of central Argentina: human or environmental influence? J. Biogeogr. 33: 876-887. [ Links ]
40. Renison, D., I. Hensen, R. Suarez, A. M. Cingolani, P. Marcora & M. A. Giorgis. 2010. Soil conservation in Polylepis mountain forests of Central Argentina: Is livestock reducing our natural capital? Austral Ecol. 35: 435-443. [ Links ]
41. Renison, D., I. Hensen & R. Suarez. 2011. Landscape structural complexity of high-mountain Polylepis australis forests: A new aspect of restoration goals. Restor. Ecol. 19: 390-398. [ Links ]
42. Robledo, G. L. & D. Renison. 2010. Wood-decaying polypores in the mountains of central Argentina in relation to Polylepis forest structure and altitude. Fungal Ecol. 3: 178-184. [ Links ]
43. Sanders, I. R. 2004. Plant and arbuscular mycorrhizal fungal diversity: are we looking at the relevant levels of diversity and are we using the right techniques? New Phytol. 164: 415-418. [ Links ]
44. Smith, S. E. & D. J. Read. 2008. Mycorrhizal Symbiosis. Academic Press, Cambridge, UK. [ Links ]
45. Teich I., A. M. Cingolani, D. Renison, I. Hensen, M. A. Giorgis. 2005. Do domestic herbivores retard Polylepis australis woodland recovery in the mountains of Córdoba, Argentina? Forest Ecol. Manag. 219: 229-241. [ Links ]
46. Torres, R. C., D. Renison, I. Hensen, R. Suarez & L. Enrico. 2008. Polylepis australis' regeneration niche in relation to seed dispersal, site characteristics and livestock density. Forest Ecol. Manag. 254: 255-260. [ Links ]
47. United Nations Environment Programme, World Conservation Monitoring Center. 2004. URL: http://www.unep-wcmc.org. [consultado el 5 de enero 2010] [ Links ]
48. Urcelay, C., S. Díaz, D. E. Gurvich, F.S. Chapin III, E. Cuevas & L.S. Domínguez. 2009. Mycorrhizal community resilience in response to experimental plant functional type removals in a woody ecosystem. J. Ecol. 97: 1291-1301. [ Links ]
49. Vavra, M., C. G. Parks & M. J. Wisdom. 2007. Biodiversity, exotic plant species, and herbivory: The good, the bad, and the ungulate. Forest Ecol. Manag. 246: 66-72. [ Links ]
50. Wardle, D. A. 2002. Communities and Ecosystems: linking the aboveground and belowground components. Princeton University Press, Princeton. [ Links ]
51. Wardle, D. A. 2006. The influence of biotic interactions on soil biodiversity. Ecol. Letters 9: 870-886. [ Links ]
Original recibido el 2 de julio de 2010;
primera decisión: 9 de septiembre de 2010;
aceptado el 6 de octubre de 2010.
Editor responsable: Guillermo Funes.














