Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
BAG. Journal of basic and applied genetics
On-line version ISSN 1852-6233
BAG, J. basic appl. genet. vol.18 no.1 Ciudad Autónoma de Buenos Aires Jan./June 2007
ARTÍCULOS ORIGINALES
Nivel de ploidía, estabilidad citológica y fertilidad en cruzas de Triticale X trigopiro (tricepiros)
Víctor Ferreira, Marisel Scaldaferro, Ezequiel Grassi y Beatriz Szpiniak.
Facultad de Agronomía y Veterinaria, Universidad Nacional de Río Cuarto. RN 36 km 601 CP (X5804BYA) Río Cuarto, Córdoba.
Autor para correspondencia: V. Ferreira. Genética, Facultad de Agronomía y Veterinaria, Universidad Nacional de Río Cuarto. RN 36 km 601 CP (X5804BYA) Río Cuarto, Córdoba.
E-mail: vferreira@ayv.unrc.edu.ar
RESUMEN
Los híbridos denominados tricepiros se obtienen cruzando triticale (X Triticosecale Wittmack) y trigopiro (X Agrotricum A. Camus). En este trabajo se analizó el nivel de ploidía, la estabilidad citológica y la fertilidad en tricepiros obtenidos en la UN de Río Cuarto, Córdoba, Argentina, mediante cruzamientos de triticales hexaploides y trigopiros octoploides. En plantas F7 de cuatro cruzas se determinó el número de bivalentes en la meiosis de células madres del polen, la frecuencia de micronúcleos en las microsporas, el número de granos y espiguillas por espiga y su relación (índice de fertilidad). Las cruzas presentaron nivel de ploidía 6x con 20,86 ± 0,78 bivalentes por célula madre del polen. Las cruzas difirieron significativamente en la proporción de células con 21 II; las que tuvieron mayor porcentaje de células euhexaploides presentaron menor cantidad de micronúcleos en telofase II, resultando citológicamente más estables. Las cruzas también difirieron en fertilidad (F = 6,66***) y se verificó intermedia pero significativa relación de la fertilidad con los caracteres citológicos.
Palabras Clave : Tricepiro; Ploidía; Microsporas; Fertilidad.
ABSTRACT
Hybrids obtained crossing triticale (X Triticosecale Wittmack) and wheat x Agropyron (= X Agrotricum A. Camus) are called Tricepiros. The objectives of this work were to analyzed the ploidy level, the cytological stability, and the fertility in tricepiros obtained by crossing hexaploid triticale x octoploid Agrotricum at Río Cuarto National University, Córdoba, Argentina. Plants F7 from four crosses were used. In the pollen mother cells, the number of bivalents and micronuclei in microspores were determined. Also, grains and spikelets per spike and the fertility index in mature spikes was analyzed. The ploidy level was 6x with a mean of 20.86 ± 0.78 bivalents per pollen mother cell. The crosses showed a significantly difference in the proportion of cells with 21 II; those with the highest percentage of pollen mother cells with 21 II had the fewest micronuclei. They also differed in fertility (F = 6,66***). The relationship between fertility index and cytological characters was significant and intermediate.
Key Words: (Triticale x Agrotricum); Ploidy; Microspores; Fertility.
Introducción
En la Argentina, la producción primaria del sector ganadero bovino de carne asciende a unos 3.13 millones de toneladas anuales. A su vez, el ganado bovino lechero produce 10.000 millones de litros anuales (SAGPyA, 2005). La región suhúmeda seca y semiárida pampeana que ocupan las provincias de Córdoba, La Pampa y San Luis contiene casi 10.5 millones de cabezas bovinas (23,4 % del total nacional), correspondiendo 9.2 millones (88 %) a bovinos de carne y 1.3 millones (12 %) a bovinos de leche (INDEC, 2002).
En la región mencionada, la época invernal presenta escasas precipitaciones y heladas frecuentes, motivos por los que decae la producción de los pastizales y de las pasturas perennes implantadas. La continuidad de la producción animal demanda de forraje estacional fresco y suplementar la dieta. Las pasturas anuales invernales cumplen con el primer objetivo y ocupan 2.2 millones de hectáreas en las provincias mencionadas (INDEC, 2002). Por otro lado, la diversificación de los cultivos en un agroecosistema es un factor que contribuye a asegurar la producción y balancear racionalmente los componentes del mismo, por lo que es necesario disponer de nuevos cultivos y mejores cultivares.
La hibridación interespecífica e intergenérica en las tritíceas tiene gran importancia tanto para el mejoramiento, en particular del trigo, como para dilucidar las relaciones entre especies y su composición genómica (Sharma, 1995). Además, también permite intentar la síntesis de nuevos cultivos. El primer caso concreto es el del triticale (X Triticosecale Wittmack). Otro ejemplo, mucho más reciente lo constituye el "tricepiro", que es motivo de investigación y desarrollo tanto por las potenciales recombinaciones genómicas que se pueden obtener como por su productividad, rusticidad y valor nutritivo (Covas, 1989; Ferreira y Szpiniak, 1994; Brizuela et al., 1997).
El tricepiro puede constituirse en el segundo cereal sintético obtenido por el hombre; los primeros trabajos se realizaron en la década de 1970 (Covas, 1976). Este autor asignó el nombre vulgar "tricepiro" a las combinaciones de Triticum L., Secale L. y Agropyron (L.) Gaertn. s.l. obtenidas a través de cruzamientos entre triticales (Triticum x Secale) = X Triticosecale Wittmack, y trigopiros (Triticum x Agropyron) = X Agrotricum A. Camus.
Tales combinaciones son híbridos intergenéricos múltiples donde intervienen especies con diferentes sistemas de reproducción, genomas y citoplasmas. El desarrollo de germoplasma requiere estabilizar los derivados, superando la inestabilidad citológica y la baja fertilidad inicial, para luego realizar el mejoramiento de caracteres con importancia agronómica. Debido a su síntesis relativamente reciente, el desarrollo de germoplasma es aún incipiente.
Los antecedentes sobre la obtención y uso de tricepiros son muy escasos. En el exterior son casi inexistentes; Nowacki et al. (1979) en Polonia obtuvieron una combinación trigo-agropiro-centeno, estéril por indehiscencia de las anteras que, retrocruzada con triticale, originó el derivado TAS de 2n = 42, similar al triticale, con buen desarrollo del grano y contenido proteico levemente superior.
En nuestro país, el desarrollo de germoplasma se inició en La Pampa en 1972, año en el que se obtuvieron dos cruzas artificiales triticale x trigopiro y se identificó un híbrido natural (Covas, 1976). Luego de varias generaciones de selección, una de las líneas más promisorias (Frecentese y Covas, 1985) se registró como cultivar en 1994 con el nombre "Don René INTA" en homenaje al Dr. René Favaloro. Este tricepiro tiene 2n = 6x = 42 cromosomas y fórmula genómica AA BB RR con introgresión de "agropiro" (Poggio et al., 1997; Ferrari, 2004; Ferrari et al., 2005) y, a pesar de los años de selección, aún mantiene diversidad fenotípica. Además, varios autores han estudiado líneas hermanas de "Don René INTA" en cuando a su citología, variabilidad morfológica, producción de forraje y grano.
Por otro lado, en la década de 1990 se comenzó a desarrollar germoplasma de tricepiro en la UN de Río Cuarto, empleando triticales hexaploides (2n = 6x = 42) y trigopiros octoploides (2n = 8x = 56) (Ferreira y Szpiniak, 1994; Ferreira et al., 1998). La ploidía inicial de las cruzas y las diferentes contribuciones genómicas sugieren que, aún después de varias generaciones, los tricepiros pueden tener inestabilidad cromosómica, desórdenes meióticos y diferencias de fertilidad entre cruzamientos. El objetivo de este trabajo fue determinar el número cromosómico, el comportamiento meiótico y relacionar caracteres citológicos con los de fertilidad de la espiga en tricepiros obtenidos en la UN de Río Cuarto.
Materiales y Métodos
a) Nivel de ploidía y estabilidad citológica.
Se analizaron 61 individuos F7 de las siguientes cruzas entre triticale y trigopiro: Tizné UNRC x Don Noé INTA (28 plantas), LF 42 UNRC x Don Noé INTA (11 pantas), LF 42 UNRC x MAGNIF 106 INTA (10 plantas) y Genú UNRC x MAGNIF 106 INTA (12 plantas). Las F1 se cultivaron en vidriera. Las F2 se cultivaron a campo y se efectuó selección individual con particular énfasis en la fertilidad y cosecha en masa. Luego se cultivaron y cosecharon en masa hasta F7.
Las observaciones citológicas se realizaron en células madres del polen (CMP), fijadas en 6:3:1 (cloroformo- etanol 96º-ácido acético) durante 24 h y conservadas en etanol 70° a 4 °C. Los aplastados se realizaron en una antera por vez, teñidas con carmín acético y mordiente férrico. Se analizaron 20-25 CMP en cada individuo, efectuando recuento de bivalentes en diacinesis - metafase I (II/CMP). Además se observaron 200 microsporas de 10 individuos por cruza determinando la presencia y el porcentaje de microsporas con micronúcleos (% MCM).
Las diferencias entre cruzas se estudiaron mediante una clasificación anidada y el modelo lineal aditivo de efectos al azar Yij = ì+ ôi +åij, donde: ì es la media general, ôi el efecto cruza y åij el error experimental. Se realizó el ANVA a una vía de clasificación, considerando a las cruzas como tratamientos y a las plantas dentro de cruzas como repeticiones. Los valores promedio se compararon mediante la prueba de rangos múltiples de Duncan y se realizaron contrastes ortogonales para los efectos "trigopiro" y "triticale" (Sokal y Rohlf, 1981).
b) Relación entre estabilidad citológica y fertilidad
En las mismas F7 se fijaron espigas de 13 plantas de Tizné UNRC x D. Noé INTA, 9 de LF 42 UNRC x D. Noé INTA, 7 de LF 42 UNRC x MAGNIF 106 INTA y 12 plantas de Genú UNRC x MAGNIF 106 INTA. Se utilizó la metodología antes descrita y se determinó el % de CMP con 21 bivalentes en metafase I, observándose un mínimo de 50 CMP por planta; También se estableció el % de microsporas con micronúcleos en telofase II, empleando 150-200 observaciones por individuo.
Por otro lado, en 5 espigas maduras de las mismas plantas, se determinó el N° de granos por espiga (NGE), el N° de espiguillas por espiga (NEE) y el Indice de Fertilidad (IF = NGE/NEE). Para el análisis se utilizó un modelo lineal aditivo similar al del caso anterior y se realizó el análisis de la variancia a una vía de clasificación, considerando a las cruzas como tratamientos y a las plantas dentro de cruzas como repeticiones. Los promedios se compararon mediante la prueba de Duncan. Los conteos se transformaron a log x para el análisis. Además, se calcularon las correlaciones simples entre los caracteres (Sokal y Rohlf, 1981).
Resultados
a) Nivel de ploidía y estabilidad citológica
El promedio de bivalentes por CMP y el % de CMP con 21 II se presentan en la Tabla 1. La clase más frecuente de CMP fue la que contuvo 21 II, pero existieron células aneuploides con 18, 19, 20 y 22 II. Los bivalentes se presentaron cerrados en su gran mayoría. También se observaron ocasionales univalentes y multivalentes, bivalentes heteromórficos, asociaciones secundarias, cromosomas con extremos pegajosos, de 2-3 bivalentes asociados al nucleolo y ocasionales cromosomas retrasaos (Figura 1a-i). Las cruzas resultaron estadísticamente diferentes para el % de CMP con 21 II (F = 9,04, P<0,001).
Tabla I. Bivalentes (II) en células madres del polen (CMP): clases, promedios ponderados, porcentaje de células con 21 II y significación de las diferencias de medias entre cruzas.


Figura 1. Configuraciones meióticas en tricepiro. a-b) Genú x MAGNIF 106, 21 ll (x 2800 aprox.); c-d) Tizné x Don Noé, 21 ll (x 4200 aprox.); e) LF 42 x MAGNIF 106, 19 ll + 1 lV (x 4200 aprox.); f) LF 42 x MAGNIF 106, 17 ll + 2 lV (x 4200 aprox.); g) LF 42 x Don Noé, 20 ll + 2 l (x 2800 aprox.); h) LF 42 x Don Noé, cromosoma retrasado (x2800 aprox.); i) LF 42 x MAGNIF, cuarteta con 3 micronúcleos (x 2800 aprox.)
La cantidad de micronúcleos por microspora, el % de MCM y la significación entre cruzas se muestra en la Tabla II. El 27,4 ± 15,0 % de las microsporas presentaron cromatina fuera de los núcleos en telofase II (Figura 1h); el rango de variación de los promedios entre cruzas fue de 14,1 a 44,5 %, coincidiendo con las de mayor y menor porcentaje de CMP con 21 II respectivamente. Las diferencias entre cruzas fueron muy altamente significativas (F = 8,05) y el carácter presentó alto coeficiente de variación (54,97 %).
Tabla II. Número de Micronúcleos por Microspora, % de Microsporas con Micronúcleos (% MCM) y significación de la diferencia de medias entre cruzas.

Las cruzas donde intervino MAGNIF 106 INTA presentaron mayor % de CMP con 21 II (F = 8,99**) y menor % MCM (F = 8,54**) que aquellas con Don Noé INTA. Entre los triticales, se determinaron resultados similares para ambos caracteres en las cruzas que incluyeron Genú UNRC y Tizné-UNRC frente a la LF 42 UNRC. En las comparaciones entre Genú UNRC y Tizné UNRC los valores fueron F = 17,38*** y 10,83** para % CMP con 21 II, y F = 16,37*** y 5,65* para % MCM.
b) Relación entre estabilidad citológica y fertilidad
Los valores promedio de cada cruza para los cinco caracteres, los valores totales, coeficientes de variación (CV %), estimaciones de F y la significación estadística de las diferencias entre cruzas se incluyen en la Tabla III. Las diferencias entre cruzas fueron estadísticamente significativas para todos los caracteres, aunque con distintos niveles. El porcentaje de células euhexaploides fue 62,41 ± 9,49 %, con diferencias muy altamente significativas entre cruzas, al igual que el Indice de Fertilidad. El porcentaje de microsporas con micronúcleos tuvo el mayor coeficiente de variación (53 %). En todos los caracteres se verificaron muy altos rangos de variación. La tendencia entre los % de CMP con 21 II, % de MCM e IF se grafican en la Figura 2.
Tabla III. Citología y Fertilidad en tricepiros UN de Río Cuarto. Promedios, desvíos, coeficientes de variación (CV %), valor de F y significación estadística de las diferencias entre cruzas.

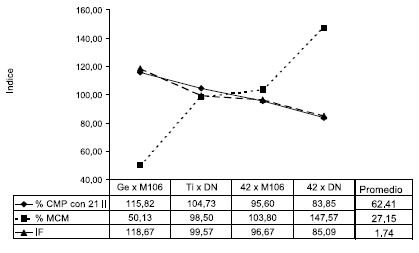
Figura 2. Valores relativos del porcentaje de Células Madres del Polen con 21 II (% CMP con 21 II), de Microsporas Con Micronúcleos (% MCM) e Indice de Fertilidad (IF), asignando valor 100 al promedio de cada carácter. Triticales: (Ge = Genú, Ti = Tizné, 42 = LF 42-UNRC). Trigopiros: (M106 = MAGNIF 106, DN = Don Noé).
Las correlaciones simples tuvieron valores acordes con el resultado anterior. El % de CMP con 21 II y el % de MCM presentaron fuerte asociación negativa (r = - 0,68***). El Índice de Fertilidad tuvo correlación baja pero significativa con el % de CMP con 21 II (r = 0,35*), y mediana pero negativa con el % de MCM (r = - 0,42**). Además, se asoció estrechamente con el NGE (r = 0,83**).
Discusión
a) Nivel de ploidía y estabilidad citológica
Los triticales empleados son hexaploides; Genú y Tizné-UNRC están registrados como cultivares por la UN de Río Cuarto, mientras que LF 42 UNRC es una línea experimental. Los trigopiros en cambio son octoploides. Don Noé INTA tiene como fuente de Agropyron (= Thinopyrum) en su constitución a la especie Thinopyrum ponticum ( sin. A. elongatum ) o una especie afín, de la que no hay certeza acerca de su nivel de ploidía, mientras que MAGNIF 106 INTA tiene la especie hexaploide Thinopyrum intermedium (= A. trichophorum).
Las cruzas analizadas constituyen parte de las realizadas con la finalidad de desarrollar germoplasma de tricepiro. En las F1 se constató alta esterilidad pero se obtuvo semilla F2. En esa generación se observó amplia segregación para caracteres morfológicos, coincidiendo con las observaciones de Bergés et al. (2002). El material segregante tuvo una sola intervención de selección artificial y la selección natural ha operado sobre el mismo sólo durante cuatro generaciones.
Teniendo en cuenta el número básico de las tritíceas x = 7, a partir del nivel de ploidía de los padres se deduce que las F1 resultaron 2n = 7x = 49. El análisis de la F1 triticale Don Santiago INTA x trigopiro Don Noé INTA obtenido por H. Paccapelo en la UN La Pampa (Poggio et al., 1997; Ferrari, 2004) da sustento a esta deducción. El alto grado de esterilidad de las cruzas se explica por la ploidía impar, pudiendo también contribuir a ello los problemas derivados de homologías parciales y homeología cromosómica de los genomas participantes (Löve y Suneson, 1945; Dvorák, 1976, 1980). Por lo tanto cabe esperar una rápida pérdida de al menos siete cromosomas en las primeras generaciones de autofecundación.
Las cuatro cruzas analizadas presentaron nivel hexaploide con 20,86 ± 0,78 II por CMP, verificándose la pérdida efectiva de siete cromosomas durante las generaciones tempranas. Genú UNRC x MAGNIF 106 INTA fue la cruza más cercana al nivel euhexaploide, con un valor promedio de 21,01 ± 0,64 II por CMP; las restantes, con valores levemente por debajo de 21 II igualmente pueden considerarse 6x. El número de cromosomas perdido equivale a un genoma pero a este nivel no es posible saber si corresponden a uno en particular o parcialmente a más de uno, dado los grados de homología y homeología cromosómica de los genomas participantes en los tricepiros y sus padres.
La mayoría de los bivalentes se presentaron cerrados, demostrando una alta frecuencia de quiasmas. La ocasional ocurrencia de multivalentes sugiere la presencia de translocaciones poco frecuentes, mientras que los también ocasionales univalentes son indicativos de algunas fallas en la sinapsis y/o de aneuploidías; ambos tipos de configuraciones explican la presencia de micronúcleos en las microsporas y coinciden con lo encontrado en el cv. Don René INTA (Poggio et al., 1997; Ferrari, 2004).
Otra posible contribución a la presencia de micronúcleos en telofase II es la formación de algunos bivalentes heteromórficos, los que pueden derivar del apareamiento entre homeólogos u homólogos parciales. Por otro lado, la presencia de varios bivalentes asociados al nucleolo es indicativa de la actividad de organizadores nucleolares de diferentes genomas, en tanto que los cromosomas con extremos pegajosos sugieren defectos estructurales en las regiones teloméricas.
Las células madres del polen con 21 II fueron 62,8 % considerando a las cuatro cruzas en conjunto y variaron desde 49,4 % en LF 42 UNRC x Don Noé INTA a 71 % en Genú UNRC x MAGNIF 106 INTA. La prueba para diferenciar promedios permitió comprobar que hay diferencias genéticas entre los materiales utilizados para formar los tricepiros, ya que si bien todas las cruzas tuvieron un nivel de ploidía 6x, Genú UNRC x MAGNIF 106 INTA presentó además la mayor cantidad de células euhexaploides. Esta comprobación sugiere que las líneas derivadas de ese cruzamiento pueden tener mayor valor fitotécnico pero no invalidan a los otros cruzamientos como forma de obtener tricepiros y ampliar la escasa variación disponible para desarrollar germoplasma.
Respecto a los micronúcleos, 27,4 ± 15,0 % de las micrósporas presentaron cromatina fuera del núcleo telofásico. El rango de variación de los promedios entre cruzas fue de 14,1 a 44,5 % y coincidió con las de mayor y menor porcentaje de células madres del polen con 21 II respectivamente. Las diferencias entre cruzas tuvieron significación estadística a pesar del alto coeficiente de variación del carácter (54,97 %); Genú UNRC x MAGNIF 106 INTA se destacó por tener el menor porcentaje de microsporas anormales, correspondiéndose con el hecho de que también fue la cruza con mayor porcentaje de células madres del polen con 21 II.
En la comparación de los diferentes germoplasmas de trigopiro utilizados, las cruzas donde participó MAGNIF 106 INTA presentaron mayor porcentaje de células madres del polen con 21 II y menor porcentaje de microsporas con micronúcleos (p<0,01) que aquellas con Don Noé INTA. Esta mayor estabilidad citológica puede atribuirse a las diferencias genómicas de los trigopiros empleados que se comentan más adelante. Entre los triticales, se observaron resultados similares en las cruzas que incluyeron Genú y Tizné UNRC frente a la LF 42 UNRC.
Por otro lado, las cruzas analizadas presentaron 27,4 % de microsporas con micronúcleos frente a 38,8 % de las líneas procedentes del cruzamiento Jenkins 6TA 203 x Don Noé INTA anteriormente estudiadas (Ferreira et al., 2001), y también tienen menos disturbios que los encontrados por Tosso et al. (2000) en otro grupo de líneas derivadas del ese mismo cruzamiento. Además, las cruzas UN de Río Cuarto presentan escasa cantidad de univalentes comparadas con el cv. Don René INTA, que tiene hasta 10 univalentes fuera de placa metafásica (Poggio et al., 1997; Ferrari, 2004). En consecuencia, desde el punto de vista de la estabilidad citológica, los triticales Genú y Tizné- UNRC, y el trigopiro MAGNIF 106 INTA, resultaron mejores progenitores para la obtención de tricepiros primarios que Jenkins 6TA 203 y Don Noé INTA.
En base a las observaciones efectuadas es posible concluir que luego de siete generaciones las líneas tienen un nivel de ploidía 6x, pero que la persistencia de univalentes y algunas fallas en la sinapsis contribuyen a la presencia de micronúcleos en las microsporas, las que pueden derivar en gametos aneuploides e individuos de igual condición en la descendencia, con inestabilidad fenocariotípica y esterilidad parcial.
En los tricepiros, al igual que en los triticales, es muy probable que el nivel 6x de ploidía sea el más conveniente. Por un lado, en la formación de los tricepiros hay una fuerte contribución cromosómica y más aún citoplásmica de trigos 6x. Por otro lado, en referencia a los padres, los triticales se pueden obtener de diversas formas, siendo las más comunes mediante cruzas de trigos 4x o 6x con centeno, resultando triticales 6x u 8x (Scoles y Kaltsikes, 1974; Gupta y Priyadarshan, 1982). Entre éstos, las formas 6x son las más viables y de mejores aptitudes agronómicas (Sánchez Monge, 1956; Kiss, 1966; Varughese et al., 1987).
Respecto a los trigopiros, se han realizado múltiples hibridaciones intentando transferir la perennidad y tolerancia a estrés bióticos y abióticos de los agropiros a los trigos pan y candeal. Las primeras referencias de hibridaciones entre trigo y agropiro (trigopiros o Agrotricum) se encuentran en los cruzamientos realizados en la Estación Experimental de Arlington, USA, por W. J. Sando desde 1923 (USDA, 1958), en Rusia (Verushkine y Shechurdine, 1933; Tzitzin, 1934) y en la División de Plantas Forrajeras en Ottawa, Canadá (Armstrong, 1936).
Al igual que Triticum, Agropyron s.l. es una serie poliploide con 2n = 2x = 14 hasta 2n = 10x = 70 cromosomas. Las especies que se hibridan con mayor facilidad con el trigo son Agropyron elongatum (2x y 10x) y Agropyron trichophorum (6x) (syn. A. glaucum y A. intermedium), pero también se han obtenido híbridos empleando especies 2x y 4x, lográndose formas 6x, 8x y 10x con diferentes constituciones genómicas según las especies paternas empleadas.
La nomenclatura del género Agropyron ha sido confusa y objeto de varios cambios. A través de revisiones basadas en las constituciones genómicas, las especies mencionadas se incluyen en el género Thinopyrum y se denominan de la siguiente manera: Th. elongatum (Host) Barkworth et Dewey (= Agropyron elongatum 2x), Th. ponticum (Podp.) Barkworth et Dewey (= A. elongatum 10x, "tall wheatgrass") y Th. intermedium (Host) Dewey (= A. trichophorum, A. intermedium, A. glaucum) (Löve, 1982, 1984; Dewey, 1984).
Th. ponticum es la especie de mayor cruzabilidad con trigos 6x y 4x (Sharma, 1995). Los híbridos son altamente estériles, pero numerosos autores han obtenido derivados 8x per se o en retrocruzamientos con trigo. Por el contrario, son muy escasos los antecedentes de cruzas donde se empleó Th. elongatum. Los híbridos de Th. intermedium (=A. trichophorum) con trigo también son factibles sin emplear técnicas adicionales. Normalmente son estériles por indehiscencia de las anteras, pero producen algunos gametos funcionales en retrocruza con trigo o no reducidos y numerosos autores han obtenido anfidiploides parciales.
El objetivo más importante buscado en estas hibridaciones es la transferencia de caracteres agronómicamente útiles del agropiro al trigo, la cual puede lograrse por sustitución o adición cromosómica, translocaciones o recombinación entre cromosomas de ambos géneros. Las primeras alternativas han ocurrido efectivamente en varios anfiploides parciales entre trigo y Th. ponticum y Th. intermedium o en líneas derivadas de la retrocruza con trigo (Dvorák, 1985; Zhang et al., 1992; Chen et al., 1999; Han et al., 2003, 2004; Li et al., 2003, 2004).
Sin embargo, la recombinación parece poco probable. Cauderon (1963) ha obtenido líneas de adición 2n = 43 y 44 en cruzas de trigo con Th. intermedium, algunas de las cuales fueron fértiles y estables, pero la autora indica que difícilmente puedan introducirse genes de Thinopyrum en trigo por el proceso normal de recombinación, dado que las líneas disómicas normales 2n = 42 de la misma descendencia resultaron morfológicamente iguales al trigo.
De acuerdo a lo anterior, la recombinación cromosómica trigo-Thinopyrum, que sería muy conveniente para el desarrollo de germoplasma de tricepiros, parece estar limitada por el fuerte efecto que ejercen los genes supresores del apareamiento homeólogo del genoma E sobre los promotores principales ubicados en 3E y 5E (Dvorák, 1987; Charpentier et al., 1988). Esta falta de recombinación cromosómica coincide en parte con lo observado en el tricepiro Don René INTA, que tiene sólo pequeños segmentos de introgresión de Thinopyrum (Ferrari, 2004, Ferrari et al., 2005).
Sin embargo, Sears (1973) obtuvo transferencia de cromatina de Agropyron elongatum (Thinopyrum elongatum) por apareamiento y sobrecruzamiento de los homeólogos 3D y 7D del trigo con los correspondientes 3Ag y 7Ag (syn. 3 y 7E) de Thinopyrum, aunque se verificó solamente en 30 % de las células y hubieron grandes diferencias en la transmisión de esos cromosomas "recombinados" vía microsporogénesis. Estos resultados, anteriores a los de Dvorák (1987) y Charpentier et al. (1988), confirman que el cromosoma 3E (3Ag) promovería en bajo grado el apareamiento de homeólogos.
El análisis de las posibles composiciones genómicas de los tricepiros UN de Río Cuarto permite plantear algunas hipótesis acerca de su constitución. Las cruzas se efectuaron entre triticales 6x y trigopiros 8x. Los triticales son secundarios, estables, con fórmula genómica AuAu BB RR, pero los trigopiros tienen orígenes diferentes.
El trigopiro Don Noé INTA es producto de una reselección efectuada en la EEA G. Covas, INTA Anguil, a partir de una cruza proveniente de la Universidad de Davis, California, entre trigo 6x y un "agropiro alargado". La especie de agropiro empleada y su nivel de ploidía permanecen inciertos. Covas (1989) señala que el trigopiro se obtiene cruzando trigo con el agropiro alargado Elytrigia pontica (actual Th. ponticum). Ferrari (2004) incluye un mensaje manuscrito de G. Covas con la genealogía del tricepiro cv. Don René donde señala que el "Agrotriticum" cv. Don Noé (trigopiro) es producto de T. aestivum x Elytrigia pontica e indica la siguiente sinonimia: Agropiro alargado (= Agropyron elongatum = Elytrigia pontica =Thinopyrum ponticum) o sea la forma 10x.
Ferreira et al. (2001) sugirieron que en la constitución de Don Noé INTA participan los genomas Au, B y D del trigo, y un genoma E? de Thinopyrum. Estudios posteriores mediante sondas moleculares indicaron que E? es el genoma J de Th. ponticum (Ferrari et al., 2003; Ferrari, 2004). Por lo tanto, las cruzas triticale x trigopiro D. Noé fueron AuAu BB RR x AuAu BB DD JJ, produciendo individuos F1 7x AuAu BB D R J que rápidamente tendieron al nivel 6x.
El otro trigopiro, MAGNIF 106 INTA, es un derivado del híbrido TA-I = Triticum aestivum x (Triticum durum x A. trichophorum ) obtenido por Horovitz (1969) en el ex Instituto de Fitotecnia del INTA Castelar, actualmente Instituto de Genética Ewald Favret. La cruza original T. durum x A. trichophorum (actual Th. intermedium) fue obtenida por W. J. Sando en USA en la década de 1930 (Horovitz, 1969) y sus derivados fértiles fueron estudiados por Löve y Suneson (1945) en Davis, California.
Uno de esos derivados, denominado 198d-2, tenía 2n = 10x = 70 cromosomas (Löve y Suneson, 1945), probablemente debido a la duplicación natural o la fusión de gametos no reducidos, ya que Triticum durum es 2n = 4x = 28 mientras que Thinopyrum intermedium) es 2n = 6x = 42. El derivado 198d-2 fue recibido en INTA Castelar en F4 y en 1950 se lo retrocruzó con el cultivar de trigo 6x Sinvalocho MA. La línea "MAGNIF 106 INTA" es producto de la selección individual en la F12 de ese cruzamiento (Horovitz, 1969).
Triticum durum es un alotetraploide genómico de composición AuAu BB (Wang et al., 1996). En cambio, Thinopyrum intermedium es una especie en la que aún no se ha definido la categoría de poliploide. Entre las composiciones genómicas sugeridas en los últimos años se encuentran EeEe EeEe StSt (Wang et al.,1996) y JJ JsJs SS, donde J es un genoma relacionado con el E de Th. elongatum y el J de Th. bessarabicum, Js es un genoma E o J modificado y S es homólogo del genoma de Pseudoroegneria strigosa (Chen et al., 1998).
Tomando esta última propuesta, la composición más probable del derivado decaploide 198d-2 era AuAu BB JJ JsJs SS. Sin embargo, no producía 35 bivalentes sino un máximo de 27 con un número variable de 9 a 30 univalentes en la células madres del polen (Löve y Suneson, 1945), todo lo cual indica la falla de la sinapsis y la disyunción anormal en varios genomas. La retrocruza de este derivado (Horovitz, 1969) con un trigo 6x (AuAu BB DD), teóricamente produjo un híbrido AuAu BB D J Js S sobre el cual no hemos hallado referencias acerca de su citología.
La relativa estabilidad de la retrocruza que mencionara Horovitz (1969) y los hallazgos en el trigopiro Don Noé INTA (Ferrari et al., 2003; Ferrari, 2004), permiten suponer que puede haber ocurrido la diploidización del genoma D y la pérdida del S, manteniéndose una situación desconocida respecto a J/Js. Esto concuerda parcialmente con la cercanía fenotípica al trigo mencionada por el obtentor. En base a esta suposición, las cruzas UN de Río Cuarto triticale x trigopiro MAGNIF 106 INTA serían AuAu BB RR x AuAu BB DD J?J?, con las F1 2n = 7x = 49 (AuAu BB D R J?), muy similares a las cruzas donde ha participado el trigopiro Don Noé INTA.
Por lo tanto, a partir de trigopiros paternos de distinto origen y composición genómica, parece haberse llegado a tricepiros similares. Queda planteada como hipótesis la posibilidad de que durante las sucesivas generaciones de autofecundación, hayan ocurrido procesos análogos a los verificados en el tricepiro Don René INTA, con pérdida de los genomas D y J, diploidización del R y escasa introgresión de germoplasma de Thinopyrum (Ferrari, 2004; Ferrari et al., 2005).
En un avance reciente, Fradkin et al. (2006) analizaron la constitución genómica de líneas derivadas de LF 42 UNRC x D. Noé y x MAGNIF 106 (= Horovitz) mediante sondas moleculares, donde se confirmó el número 2n = 6x = 42 y se determinó que la constitución genómica actual es similar a la del triticale progenitor, con 28 cromosomas de trigo y 14 de centeno. Por lo tanto, naturalmente se ha diploidizado el genoma R y se han perdido los genomas D y J/J?. Resta conocer si otras líneas tienen similar constitución y el posible grado de introgresión de Thinopyrum .
b) Relación entre estabilidad citológica y fertilidad
En las cruzas UN de Río Cuarto también se estudió la posible asociación entre el porcentaje de células madres del polen con 21 II y de microsporas con micronúcleos con la fertilidad de espiga. Para ello, en las mismas plantas algunos macollos se destinaron a fijar espigas inmaduras para las observaciones citológicas, mientras que sobre uno de los restantes tomado al azar se efectuó el recuento de granos y de espiguillas en la madurez.
Los individuos analizados corresponden a la misma población donde se determinó el nivel de ploidía y el grado de disturbio citológico expresado por los micronúcleos en las microsporas (Ferreira et al., 2001); por lo tanto era esperable que los valores fueran similares. Así, la media del porcentaje de células madres del polen con 21 II fue 62,41 ± 9,49 y para microsporas con micronúcleos resultó 27,15 ± 14,37 %, valores prácticamente iguales a los encontrados anteriormente, por lo que el análisis estadístico también reveló diferencias entre cruzas similares a las ya comentadas.
Por otro lado, a partir de las pruebas para diferenciar promedios se deduce una relación inversa entre ambos caracteres citológicos, ya que Genú UNRC x MAGNIF 106 INTA tuvo el más alto porcentaje de células madres del polen con 21 II y el más bajo de microsporas con micronúcleos, mientras que en LF 42 UNRC x Don Noé INTA ocurrió lo contrario. Este resultado coincide con la apreciación de que los micronúcleos tienen origen, al menos en parte, en univalentes u otras anormalidades citológicas como ocurre en triticale (Bennett y Kaltsikes, 1973; Thomas y Kaltsikes, 1976; Gupta y Priyadarshan, 1982).
A partir de los recuentos cromosómicos, resulta claro que prevalece el nivel 6x, pero a su vez existe una apreciable cantidad de células madres del polen aneuploides. Puede asegurarse entonces que aún en F7, todas las cruzas tienen inestabilidad meiótica con producción de gametos masculinos aneuploides, y seguramente también femeninos, los que normalmente trasmiten las aneuploidías en mucho mayor proporción que los masculinos.
En consecuencia, a pesar de que la inestabilidad meiótica y la fertilidad son fenómenos poco relacionados en generaciones avanzadas como se observara en las líneas JxDN de tricepiro (Ferreira et al., 2001), en generaciones tempranas, donde no han habido fuertes eventos selectivos, puede esperarse que exista relación entre las anormalidades meióticas y la fertilidad como ocurre en trigo x agropiro (Armstrong y McLennan, 1944) y triticale (Hsam y Larter, 1974).
El análisis estadístico de los caracteres reproductivos en la F7 de las cruzas UN de Río Cuarto reveló diferencias significativas entre ellas para los tres caracteres, acentuadas en particular en el Indice de Fertilidad. Además, se observaron grandes diferencias con las líneas JxDN (Ferreira et al., 2001). Así, en las cruzas aquí analizadas, la media de granos por espiga resultó 44,49 ± 12,28, la de espiguillas por espiga fue 25,57 ± 3,69 y el índice de fertilidad 1,74 ± 0,35, mientras que los valores para las líneas JxDN fueron 27,02± 11,13; 24,75 ± 3,82 y 1,06 ± 0,36 respectivamente.
Resulta notorio que las diferencias se deben a una mayor cantidad de granos por espiga, la que redunda en mayor índice de fertilidad, ya que el tamaño o la capacidad de la espiga medida por el número de espiguillas es similar o menor en las cruzas UN de Río Cuarto. A partir de ello es posible concluir que alguno de los padres empleados para obtener los tricepiros UN de Río Cuarto, en particular los triticales Genú UNRC y Tizné UNRC, resultaron más aptos para lograr mejor producción de semilla. Por lo tanto, fue posible establecer diferencias citológicas y de fertilidad entre las cruzas y también frente a las líneas JxDN.
Las diferencias constatadas pueden tener varias causas, tanto genéticas como ambientales. Entre las dos más importantes se encuentran las distintas respuestas varietales a la hibridación y el efecto año en el que se realizó el estudio, muy común en la zona subhúmeda y semiárida pampeana. Las primeras son una referencia habitual en fitomejoramiento en tanto que el segundo origina normalmente interacciones genotipo-ambiente, en particular en este tipo de regiones de alta variación climática, donde la disponibilidad de agua al momento de la diferenciación reproductiva resulta crucial en la definición del rendimiento futuro.
Con respecto a las correlaciones, se verificó fuerte asociación negativa entre porcentaje de células madres del polen con 21 II y el porcentaje de microsporas con micronúcleos (r = - 0,68***), indicando claramente que a mayor cantidad de células euploides con sinapsis normal se produce menor cantidad de microsporas anormales, coincidiendo con la observación generalizada acerca de que los micronúcleos tienen origen en las anormalidades meióticas (Bennett y Kaltsikes, 1973; Thomas y Kaltsikes, 1976; Gupta y Priyadarshan, 1982).
Sin embargo, el porcentaje de células madres del polen con 21 II no fue determinante del número de granos por espiga dado que la correlación fue no significativa, aunque tiene un leve efecto sobre el índice de fertilidad. Por un lado, esto confirma que la normal formación del grano es el final de una compleja sucesión de procesos donde la regularidad meiótica es sólo una componente inicial. Por otro lado, sugiere que las células madres del polen euploides con asociaciones bivalentes no aseguran suficientes gametos normales con ventajas competitivas al momento de la fecundación. Además, dada la condición poliploide, los gametos aneuploides podrían tener similar capacidad de fecundar que los euploides.
Al considerar la relación entre las microsporas con micronúcleos y los caracteres de espiga, se determinó correlación negativa y baja pero significativa con los granos por espiga, ausencia de correlación con las espiguillas, y un valor negativo y significativo al 5 % con el índice de fertilidad. Por lo tanto, en este material se verificó una situación contraria a la que ocurre con las líneas JxDN y con otros híbridos intergenéricos como Agrotricum, triticale e incluso trigo (Marshall y Schmidt, 1954; Del Duca y Moraes-Fernandes, 1980; Szpiniak, 1983; Falçao et al., 1990), donde hay ausencia de relación entre microsporas anormales y la formación de grano de esa generación.
De acuerdo a los resultados, en estos materiales las anormalidades meióticas inciden sobre la fertilidad y se reflejan mejor a través de las microsporas con micronúcleos que del porcentaje de células madres del polen con 21 II. Además, si se deseara diferenciar individuos o líneas de mayor estabilidad meiótica con fines de fitomejoramiento, resulta más rápido y simple hacerlo a través del porcentaje de microsporas normales, dada la alta correlación entre éstas y el porcentaje de células madres del polen con 21 II. Por otro lado, las correlaciones entre el índice de fertilidad y sus componentes indican que el número de granos por espiga es el carácter a emplear en la selección, concordando con trabajos anteriores en triticale (Szpiniak, 1983).
La incidencia negativa de las anormalidades citológicas sobre la fertilidad encontrada en estas cruzas es contradictoria con los resultados referentes a las líneas JxDN (Ferreira et al., 2001), así como también frente a otros antecedentes en trigo, triticale y Agrotricum, donde se determinó ausencia de asociación entre ambos caracteres (Marshall y Schmidt, 1954; Del Duca y Moraes-Fernandes, 1980; Szpiniak, 1983; Falçao et al., 1990). Tal contradicción puede tener origen en el tipo de material y la generación en que se efectuó el estudio. En los casos citados se trataba de trigo, una especie natural, triticales con historia fitotécnica o líneas de Agrotricum que luego de varios años de autofecundación exhibían características morfológicas estables.
En el caso de las cruzas UNRC, el material se encontraba en F7 y prácticamente no tenían historia fitotécnica. Sobre ellas sólo se había realizado selección individual en F2, la que no se realizó a favor de alta fertilidad sino contra esterilidad, buscando con ello mantener la mayor cantidad posible de germoplasma en desarrollo. Por lo tanto, a diferencia de los casos antes mencionados, el estudio de la asociación entre las anormalidades meióticas y fertilidad se realizó tempranamente; este puede ser el motivo del resultado no coincidente con la mayoría de los encontrados en materiales afines como trigo o derivados de hibridaciones entre trigo y centeno o trigo y agropiro.
En conclusión, las cruzas UN de Río Cuarto han perdido rápidamente siete cromosomas, tienen un 2n = 6x = 42 y en F7 aún persisten grados variables de inestabilidad cromosómica y pérdida de cromatina. Las cruza Genú-UNRC x MAGNIF 106 INTA resultó la más cercana al nivel euhexaploide y hay diferencias genéticas entre los materiales utilizados para formar los tricepiros. El porcentaje de micrósporas anormales tuvo relación inversa con el porcentaje de células madres del polen con 21 II y las cruzas donde intervino el trigopiro "MAGNIF 106 INTA" presentaron menores disturbios mióticos que aquellas con "Don Noé INTA". Las diferencias entre cruzas para los caracteres reproductivos fueron significativas, acentuándose en el Índice de Fertilidad y se debieron a una mayor cantidad de granos por espiga. El porcentaje de células madres del polen con 21 II no fue determinante del número de granos por espiga aunque tuvo un leve efecto sobre el Índice de fertilidad.
Referencias
1. Armstrong, J. M. (1936) Hybridization of Triticum and Agropyron. I. Crossing results and description of the first generation hybrids. Can. J. Res. Sec. C 14,190-202. [ Links ]
2. Armstrong, J. M., McLennan, H. A. (1944) Amphidiploidy in Triticum - Agropyron hybrids. Scient. Agriculture 24, 285-298. [ Links ]
3. Bennett, M. D., Kaltsikes, P. J. (1973) The duration of meiosis in a diploid rye, a tetraploid wheat and the hexaploid triticale derived from them. Can. J. Genet. Cytol. 15, 671-679. [ Links ]
4. Bergés, D. E., Cayssials, G. L., Paccapelo, H. A. (2002) Variabilidad fenotípica en las primeras generaciones segregantes de tricepiro (Triticum x Secale x Thinopyrum). Rev. Fac. Agron. UN La Pampa 1(2), 5-22. [ Links ]
5. Brizuela, M., Passarotti, J., Cseh, S. (1997) Rendimiento de forraje y valor nutritivo de tricepiro (Triticum x Secale x Thinopyrum) con diferente manejo de defoliación. Rev. Arg. Prod. Animal 17, 385-393. [ Links ]
6. Cauderon, Y. (1963) Genome analysis in the genus Agropyron. Proc. 2nd. Int. Wheat Genet. Symp., Hereditas (Suppl. 2), 218-234. Lund, Sweden. [ Links ]
7. Charpentier, A., Feldman, M., Cauderon, Y. (1988) the effect of different Agropyron elongatum chromosomes on pairing in Agropyron - common wheat hybrids. Genome 30, 978-983. [ Links ]
8. Chen, Q., Conner, R. L., Laroche, A., Thomas, J. B. (1998) Genome analysis of Thinopyrum intermedium and Thinopyrum ponticum using genomic in situ hybridization. Genome 41:580-586. [ Links ]
9. Chen, Q., Conner, R. L., Laroche, A., Ji, W. Q., Armstrong, K. C., Fedak. G. (1999) Genomic in situ hybridization analysis of Thinopyrum chromatin in a wheat-Th. intermedium partial amphiploid and six derived chromosome addition lines. Genome 42, 1217-1223. [ Links ]
10. Covas, G. (1976) Tricepiro, un nuevo verdeo sintético que involucra al trigo, centeno y agropiro. Inf. Tecnol. Agrop. para la Reg. Semiár. Pampeana. 68, 5. [ Links ]
11. Covas, G. (1989) Pampa semiárida: nuevos cultivos. Ciencia Hoy 1, 75-77. [ Links ]
12. Del Duca, L. J., Moraes-Fernandes, M. I. (1980) Meiotic inestability in some Brazilian common wheat cultivars. Cereal Res. Commun. 8, 619-625. [ Links ]
13. Dewey, D. (1984) The Genome System of classification as a guide to intergeneric hybridization with the perennial Triticeae. Stadler Genet. Symp. 16, 209-279. [ Links ]
14. Dvorák, J. (1976) The cytogenetic structure of a 56-chromosome derivative from a cross between Triticum aestivum and Agropyron elongatum (2n = 70). Can. J. Genet. Cytol. 18, 271-279. [ Links ]
15. Dvorák, J. (1980) Homeology between Agropyron elongatum chromosomes and Triticum aestivum chromosomes. Can. J. Genet. Cytol. 22, 237-259. [ Links ]
16. Dvorák, J. (1985) Transfer of salt tolerance from Elytrigia pontica (Podp.) Holub. to wheat by the addition of an incomplete Elytrigia genome. Crop Sci. 21, 306-309. [ Links ]
17. Dvorák, J. (1987) Chromosomal distribution of genes in diploid Elytrigia elongata taht promote or suppress pairing of wheat homoelogous chromosomes. Genome 29, 34-40. [ Links ]
18. Falçao, T. M., Moraes-Fernandes, M. I., Zanettini, M. H. (1990) Genotypic and enviromental effects on chromosomal abnormalities in hexaploid triticale grown in southern Brazil and correlation between meiotic behavior and fertility of progenies. Proc.2nd Int. Triticale Symp, 320-328. Passo Fundo, R.G. do Sul, Brasil. [ Links ]
19. Ferrari, M. R., Greizerstein, E., Naranjo, C. A., Poggio, L. (2003) Reconocimiento del genoma J de Thinopyrum en trigopiro Don Noé INTA. JBAG 15 Suppl. 2, 88. [ Links ]
20. Ferrari, M. R. (2004) Estudio de la composición genómica de forrajeras mediante técnicas electroforéticas y de citogenética clásica y molecular. Tesis Doctoral. Fac. Ciencias Exactas y Naturales, UBA. [ Links ]
21. Ferrari, M., Greizerstein, E., Paccapelo, H., Naranjo, C., Cuadrado, A., Jouve, N., Poggio, L. (2005) The genomic composition of Tricepiro, a synthetic forage crop. Genome 48, 154-159. [ Links ]
22. Ferreira, V., Szpiniak, B. (1994) Mejoramiento de triticale y tricepiro para forraje en la UN de Río Cuarto. En: Semillas Forrajeras: producción y mejoramiento: 110-120. Orient. Gráf. Ed., B. Aires. [ Links ]
23. Ferreira, V., Szpiniak, B., Grassi, E., Croatto, D. (1998) Tricepiros forrajeros [Triticale x (X Agrotricum)]: obtención y mejora. Rev. Arg. Prod. Animal 18 Supl. 1, 182. [ Links ]
24. Ferreira, V., Szpiniak, B., Grassi, E., Scaldaferro, M. (2001) Fertilidad en líneas selectas de tricepiro (triciale x trigopiro). J Basic Appl. Genet.14, 15-23. [ Links ]
25. Frecentese, M., Covas, G. (1985) Comportamiento de nuevos verdeos en la región pampeana semiárida. Inf. de Tecnol. Agrop. para la Reg. Semiár. Pampeana 84, 6-7. [ Links ]
26. Fradkin, M., Ferrari, M. R., Ferreira, V., Grassi, E., Greizerstein, E. J., Poggio, L. (2006) Estudios citogenéticos en líneas avanzadas de tricepiro mediante técnicas de FISH-GISH. 52° Cong. Brasilero y 12° Cong. Asoc. Latinoam. de Genética. Foz de Iguazú, Brasil. Actas en CD arch. pdf pág.1117. [ Links ]
27. Gupta, P. K., Priyadarshan, P. M. (1982) Triticale: Present status and future prospects. Advances in Genetics, Vol. 21. Academic Press Inc. N. York. [ Links ]
28. Han, F., Fedak, G., Benabdelmouna, A., Armstrong, K., Ouellet, T. (2003) Characterization of six wheat x Thinopyrum intermedium derivatives by GISH, RFLP, and multicolor GISH. Genome 46, 490-495. [ Links ]
29. Han, F., Liu, B., Fedak, G., Liu, Z. (2004) Genomic constitution and variation in five partial amphiploids of wheat - Thinopyrum intermedium as revealed by GISH, multicolor GISH and seed storage protein analysis. Theor. Appl. Genet. 109, 1070-1076. [ Links ]
30. Horovitz, N. (1969) Mejoramiento de híbridos entre especies de Triticum y Agropyron. Bol. Genético, Inst. Fitotécnico de INTA Castelar 6, 11-19. [ Links ]
31. Hsam, S. L., Larter, E. N. (1974) Effects of inbreeding on triticale selected for two levels of fertility and chiasma frequency. Crop Sci. 14, 213-215. [ Links ]
32. INDEC (2002) Instituto Nacional de Estadísticas y Censos. Encuesta Nacional Agropecuaria 2001. Información de prensa 8/2/2002. ISSN 0327-7968. Ministerio de Economía, Buenos Aires. [ Links ]
33. Kiss, A. (1966) Kreuzungsversuche mit Triticale. Der Züchter 36, 249-255. [ Links ]
34. Li, H., Chen, Q., Conner, R., Guo, B., Zhang, Y., Graf, R., Laroche, A., Jia, X., Liu, Gonsghe, Chu, Ch. (2003) Molecular characterization of a wheat- Thinopyrum ponticum partial amphiploid and its derivatives for resistanse to leaf rust. Genome 46, 906-913. [ Links ]
35. Löve, R. M., Suneson, C. A. (1945) Cytogenetics of certains Triticum-Agropyron hybrids and their fertile derivatives. Am. J. Bot. 32, 451-456. [ Links ]
36. Löve, R. M. (1982) Generic evolution of wheatgrasses. Biol. Zentralbl. 101, 199-212. [ Links ]
37. Löve, R. M. (1984) Conspectus of the Triticeae. Feddes Repert. 95, 425-521. [ Links ]
38. Marshall, H. G., Schmidt, J. W. (1954) A study of the meiotic stability of certain Agrotricum hybrids. Agron. J. 46, 383-388. [ Links ]
39. Nowacki, E., Aniol, A., Rudnicka, A. (1979) Trigeneric hybrid of Triticum x Agropyron x Secale (TAS). Genet. Polonica 20, 190-196. [ Links ]
40. Poggio, L., Ferrari, M. R., Paccapelo, H. A., Greizerstein, E., Jouve, N., Cuadrado, A., Naranjo, C. A. (1997) Tricepiro Don René INTA: su caracterización citogenética (meiosis e hibridación in situ) y bioquímica (electroforesis de proteínas seminales). XXVIII Cong. Arg. Genética, Actas, 62. Tucumán, Argentina. [ Links ]
41. SAGPyA 2005 Secretaría de Agricultura, Ganadería, Pesca y Alimentación de la Nación. www.sagpya.mecon.gov.ar. B. Aires, Argentina. [ Links ]
42. Sánchez-Monge, E. (1956) Fertility in Triticale. Wheat Inf. Service 3, 29. [ Links ]
43. Scoles, G.J., Kaltsikes, P. J. (1974) The cytology and cytogenetics of Triticale. Z. Pflanzenzüchtg. 73, 13-43. [ Links ]
44. Sears, E. R. (1973) Agropyron-wheat transfers induced by homoeologous pairing. Proc. 4th Int. Wheat Genet. Symp.,191-199. Missouri, Columbia. [ Links ]
45. Sharma, H. C. (1995) How wide can a wide cross be? Euphytica 82, 43-64. [ Links ]
46. Sokal, R. R., Rohlf, F. J. (1981) Biometry. The principles and practice of statistics in biological research. 2nd. Ed., Freeman Co., San Francisco. [ Links ]
47. Szpiniak, B. (1983) Relación entre fertilidad e índice meiótico en ocho cultivares de triticale (X Triticosecale Wittmack). Mendeliana 6, 43-52. [ Links ]
48. Thomas, J. B., Kaltsikes, P. J. (1976) The genomic origin of the unpaired chromosomes in triticales. Can. J. Genet. Cytol. 18, 687-700. [ Links ]
49. Tosso, H., Paccapelo, H. A., Covas, G. F. (2000) Caracterización de las líneas avanzadas de tricepiro. I. Descripción morfológica y citológica. Rev. Inv. Agrop. 29, 39-51. [ Links ]
50. Tzitzin, N. V. (1934) The Triticum x Agropyron hybrids. Plant. Breed. Abstr. 5(1), 24. [ Links ]
51. USDA. (1958) Experimental grass wheat hybrids. Agric. Res. 7, 8-9. [ Links ]
52. Varughese, G., Barker, T., Saari, E. (1987) Triticale. CIMMYT, México, D.F. 32 pp. [ Links ]
53. Verushkine, S., Shechurdine, A. (1933) Hybrids between wheat and couch grass. J. Heredity 24, 329-335. [ Links ]
54. Wang, R. R. C., von Bothmer, R., Dvorák, J., Fedak, G., Linde-Laursen, I., Muramatsu, M. (1996) Genome symbols in the Triticeae (Poaceae). In: Wang, R. R. C., Jensen, K. B., Jaussi, C. (Eds.) Triticeae. Proc. 2nd. Int. Triticeae Symp., 29-34. Logan, Utah. [ Links ]
55. Zhang, X. Y., Li, Z. S., Chen, S. Y. (1992) Production and identification of three 4Ag (4D) substitution lines of Triticum aestivum - Agropyron: relative transmission rate of alien chromosomes. Theor. Appl. Genet. 83, 707-714. [ Links ]














