Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
BAG. Journal of basic and applied genetics
versión On-line ISSN 1852-6233
BAG, J. basic appl. genet. vol.25 no.2 Ciudad Autónoma de Buenos Aires dic. 2014
ARTÍCULOS ORIGINALES
Suplementación de cultivos de sangre periférica con sulfato de zinc: inestabilidad genómica asociada a su deficiencia y exceso
Zinc sulfate supplementation of cultured peripheral blood lymphocytes: genomic instability related to its deficiency and excess
Padula G.1,2, Ponzinibbio M.V.2, Seoane A.I.1
1 Facultad de Ciencias Naturales y Museo, UNLP, La Plata, Argentina.
2 Instituto de Genética Veterinaria Ing. Fernando Noel Dulout (IGEVET), FCV, UNLP-CONICET, La Plata, Argentina. giselpadula@yahoo.com.ar
Fecha de recepción: 08/08/2014
Fecha de aceptación de versión final: 24/09/2014
RESUMEN
El Zinc (Zn) juega un papel vital en el crecimiento de los niños y participa en la síntesis y mantenimiento del ADN. Las actuales recomendaciones de ingesta de nutrientes no tienen en cuenta los niveles requeridos para el mantenimiento de la estabilidad genómica. El objetivo del trabajo es analizar el efecto citotóxico y genotóxico de la suplementación in vitro con Zn para evaluar la deficiencia y el exceso, así como las concentraciones dentro del rango fisiológico normal establecido para niños (80-280 μg/dl). Para lograr la deficiencia de Zn, el medio HAMF12 (HF12) fue quelado (HF12Q). Los linfocitos fueron aislados de donantes sanos y cultivados durante 7 días: 1-control (HF12, 60 μg/dl SO4Zn); 2-deficiente (HF12Q, 0 μg/dl SO4Zn); 3-80 (HF12Q + 80 μg/dl SO4Zn); 4-180 (HF12Q + 180 μg/dl SO4Zn); 5-280 (HF12Q + 280 μg/dl SO4Zn); 6-380 (HF12Q + 380 μg/dl SO4Zn). Se utilizaron los ensayos de micronúcleo y cometa y se determinó la viabilidad celular. Las diferencias fueron evaluadas con χ2 y ANOVA (p<0,05). El índice de daño, resultó significativamente más alto en el cultivo deficiente respecto de los demás. Sólo la dosis 380 μg/dl presentó frecuencias significativamente aumentadas en relación a los otros cultivos suplementados. La frecuencia de micronúcleos (MNi) fue significativamente mayor en los cultivos deficientes, 280 y 380 μg/dl, respecto del control, 80 y 180 μg/dl. La mayor fecuencia se observó en 380 μg/dl. La suplementación de los cultivos in vitro con zinc ayudaría a reducir la inestabilidad genómica. Las dosis más beneficiosas serían las de 80 y 180 μg/dl, en tanto que las de 280 y 380 μg/dl provocarían un aumento de daño en el ADN.
Palabras clave: Sulfato de zinc; Estabilidad genómica; Ingesta recomendada de nutrientes; Niños.
ABSTRACT
Zinc (Zn) plays a vital role in children growth and is involved in DNA synthesis and maintenance processes. The current nutrient intake recommendations do not consider the levels required for maintaining genomic stability. The objective of this study is to analyze the cytotoxic and genotoxic effect of in vitro Zn supplementation to evaluate deficiency and excess, and the concentrations within the normal physiological range established for children (80-280 μg/dl). To achieve Zn deficiency, the HAMF12 medium (HF12) was chelated (HF12Q). Lymphocytes were isolated from healthy donors and cultured for 7 days: 1-control (HF12, 60 μg/dl SO4Zn); 2-deficient (HF12Q, 0 μg/dl SO4Zn); 3-80 (HF12Q + 80 μg/dl SO4Zn); 4-180 (HF12Q + 180 μg/dl SO4Zn); 5-280 (HF12Q + 280 μg/dl SO4Zn); 6-380 (HF12Q + 380 μg/dl SO4Zn). Comet and micronucleus assays were performed, and cell viability was determined. Differences were evaluated with χ2 and ANOVA (p<0.05). The DNA damage index (comet assay) was significantly higher in the deficient culture respect to the others. Only the 380 μg/dl dose showed significantly increased frequency in DNA damage in relation to the other supplemented cultures. Micronuclei frequency was significantly higher in the deficient, 280 and 380 μg/dl cultures in comparison with the control, 80 and 180 μg/dl. The higher frequency of chromosomal damage was observed at 380 μg/dl SO4Zn. In vitro Zn supplementation reduced genomic instability. Supplementation with Zn at 80 μg/dl and 180 μg/dl proved to be the most beneficial in reducing genomic instability, whereas doses of 280 and 380 μg/dl would cause an increase in DNA damage.
Key words: Zinc sulfate; Genomic stability; Recommended dietary allowances; Children.
INTRODUCCIÓN
La transición nutricional de nuestro país se caracteriza por la disminución de la malnutrición aguda, un aumento de la obesidad y cifras relativamente altas de retraso crónico del crecimiento y desnutrición oculta (Carmuega, 1996; O`Donnell y Carmuega, 1999). La OMS y UNICEF han definido como desnutrición oculta a un conjunto de carencias específicas de micronutrientes que se caracterizan por ser altamente prevalentes, de importancia en la salud infantil y que requieren de cierta instrumentación para su diagnóstico. Entre los micronurientes más importantes para el crecimiento infantil se encuentran el zinc, el hierro, la vitamina A, algunas vitaminas del grupo B como la riboflavina, el ácido fólico, la niacina y los ácidos grasos esenciales.
No existe un criterio o indicador que por sí solo permita objetivar la calidad de la dieta. Sin embargo, cuando se considera sólo la composición de nutrientes, la densidad nutricional es un indicador más apropiado que la composición centesimal. Es decir, la proporción de cada nutriente relativo a la cantidad de energía que contiene un alimento o el conjunto de la dieta. Para esto, se utiliza como patrón de referencia las recomendaciones diarias de ingesta de nutrientes (RDAs) del National Research Council (1989), expresadas en forma absoluta como la cantidad de nutrientes recomendada por día.
Las actuales RDAs de vitaminas y minerales están basadas en la prevención de enfermedades tales como el escorbuto en el caso de la vitamina C, anemia en el caso del ácido fólico y la pelagra para la niacina. Sin embargo, los micronutrientes son importantes en la prevención de enfermedades degenerativas, tales como cáncer, enfermedades cardiovasculares, Alzheimer y envejecimiento prematuro, debido al rol que desempeñan en el mantenimiento de la estabilidad genómica (Ambrosse et al., 1999; Giovannucci, 1998; Morris, 1998; Zhang, 1998; Watkins, 2000). Es ampliamente reconocido, que la exposición in vivo a agentes mutagénicos y carcinogénicos puede incrementar la mutación genética y las aberraciones cromosómicas en las poblaciones humanas (Parry, 1988). Más tardíamente se reconoce que una dieta desbalanceada puede tener efectos similares (Ames, 1998). La dieta puede ser un factor clave en la estabilidad genómica dado su impacto sobre mecanismos relevantes tales como: exposición a carcinógenos dietarios, activación/detoxificación de carcinógenos, síntesis y reparación del ADN y apoptosis. Muchos minerales y vitaminas actúan como sustrato y/o cofactores en reacciones de mantenimiento del ADN, por lo que su concentración exacta en la célula es crítica. Así, niveles no óptimos de estos micronutrientes podrían imposibilitar la actividad de enzimas requeridas para la estabilidad genómica, al provocar fracturas de doble o simple cadena sobre el ADN, lesiones oxidativas o ambas (Fenech, 2001; 2005). Debido a lo anteriormente expuesto, existe una fuerte conciencia internacional sobre la necesidad de redefinir los requerimientos óptimos de minerales y vitaminas para prevenir el daño sobre el ADN.
La deficiencia severa de zinc (Zn) es rara, pero las deficiencias medias son relativamente frecuentes, especialmente en etapas tempranas del ciclo de vida como la infancia y la niñez (Hambidge, 1989). Dicha deficiencia provocaría una disminución en el crecimiento y el desarrollo de los niños (Walsh, 1994; Ruz et al., 1997), afectando principalmente la talla, por lo que habría una alta prevalencia de deficiencia de Zn en aquellas poblaciones con retardo crónico del crecimiento (Flores et al., 1985; Rosado, 1998; CESNI, 2001; González et al., 2006; Grandy et al., 2010), como la nuestra. La deficiencia de este micronutriente también afecta al sistema inmunológico, debido a que altera la división y multiplicación celular requeridas para la defensa del huésped ante un patógeno; suprime parcialmente la función del timo y disminuye la proliferación y función de los linfocitos T y B (Walsh, 1994; Solomons, 1998). También se ha notificado la inducción de alteraciones en el crecimiento y desarrollo del cerebro provocando trastornos cognitivos (Walsh, 1994; Beard, 1996). El Zn se transporta en plasma unido a la albúmina y, en menor medida, a las alfa2 macroglobulinas, por lo que su concentración plasmática varía en la infección, el estrés y el ejercicio físico intenso (CESNI, 2001). La explicación a todos estos efectos asociados a la deficiencia de Zn, sería el rol que éste desempeña en la síntesis del ADN y la proliferación celular.
El Zn es un componente esencial de aproximadamente 300 proteínas, entre ellas la superóxidodismutasa Cu/Zn, endonucleasa IV, p53 y proteínas “dedos” de Zn (como la PARP). Está involucrado en el proceso de estabilidad genómica y expresión génica en una variedad de modos, incluyendo la estructura de la cromatina, la replicación del ADN y la transcripción del ARN, a través de factores de transcripción y de las ARN y ADN polimerasas (Urrutia, 1997; Lin et al., 1998; Rosado, 1998). Asimismo, desempeña un rol importante en la reparación del ADN (Dreosti, 2001) y en la muerte celular programada o apoptosis (Richard et al., 1993; McGowan et al., 1994; Sunderman, 1995; Record et al., 1996; Parat et al., 1997; Falchuk, 1998; Favier, 1998; Leccia et al., 1999; Chimienti et al., 2001; Chung et al., 2005; Clegg et al., 2005; Bae et al., 2006; Chang et al., 2006). En la actualidad el conocimiento sobre los niveles óptimos para la estabilidad genómica es escaso y desordenado, sin embargo, existe suficiente evidencia que sugiere que la deficiencia marginal de Zn impacta significativamente en el porcentaje de daño cromosómico espontáneo (Fenech y Ferguson, 2001; Fenech, 2001; 2002; Sharif et al., 2011; 2012). Por otra parte, en trabajos realizados in vitro, se observó que el exceso de diversas sales de Zn, tales como cromato, citrato y sulfato, provocaría un efecto citotóxico y genotóxico en diferentes líneas celulares (Bae et al., 2007; Xie et al., 2009; Wise et al., 2010; Sharif et al., 2011) y animales de laboratorio (Tapisso et al., 2009).
Debido a que el Zn juega un papel vital en el crecimiento de los niños y participa en los procesos de síntesis y mantenimiento del ADN, el objetivo del presente estudio es evaluar el efecto citotóxico y el daño cromosómico y citomolecular provocado tanto por la deficiencia como por el exceso de Zn. Asimismo, se realizará la valoración citotóxica y de daño genético inducido por las dosis de Zn dentro del rango fisiológico normal de Zn establecido actualmente para niños.
MATERIALES Y MÉTODOS
Cultivos de linfocitos de sangre periférica y diseño experimental
Se ha demostrado que el modelo in vitro de cultivo de linfocitos de sangre periférica, es muy eficaz para determinar el efecto de los micronutrientes sobre la citotoxicidad y el daño genómico (Kimura et al., 2004; Wu et al., 2009; Fenech, 2010). Este modelo es esencial para definir la concentración óptima y el límite superior más seguro de los micronutrientes (Fenech, 2010). En este sentido, se trabajó con linfocitos aislados de sangre periférica obtenida de seis donantes sanos de sexo femenino, de edades comprendidas entre 5 y 10 años. Las muestras fueron obtenidas con expresa autorización del mayor responsable (Ley Provincial N° 11.044). Los linfocitos fueron cultivados en frascos T25, utilizando como medio base 10 ml de HAM F12 (Gibco BRL, Grand Island, NY, USA), sin suero fetal bovino, con la adición de antibióticos (60 UI de Penicilina y 50 μg/ml de Estreptomicina) (Bagó Laboratories, Buenos Aires, Argentina) y 100 μg/ml de fitohemaglutinina (Gibco-Invitrogen).
Para lograr la deficiencia de Zn, el medio HAMF12 (HF12) fue quelado (HF12 Q). Se utilizó Chelex-100 (95577 Sigma) al 10%, según procedimiento descripto por Sharif et al. (2011; 2012), con algunas modificaciones.
Se tomaron tres dosis de sulfato de Zn (SO4Zn) dentro del rango fisiológico normal determinado para niños (80-280 μg/dl) (Feliu et al., 2005) y dos dosis por fuera, para evaluar el efecto de la deficiencia y el exceso. De esta manera se establecieron 6 cultivos: 1- control negativo (HF12 Q, 60 μg/dl SO4Zn); 2- deficiente en Zn (HF12 Q, 0 μg/dl SO4Zn); 3- límite inferior (HF12 Q + 80 μg/dl SO4Zn); 4- límite medio (HF12 Q + 180 μg/dl SO4Zn); 5- límite superior (HF12 Q + 280 μg/dl SO4Zn); 6- exceso de Zn (HF12 Q + 380 μg/dl SO4Zn).
Para llevar a cabo la estimación de viabilidad celular mediante tinción con el colorante vital azul de tripano, el ensayo de electroforesis en gel de célula única (cometa) y el ensayo de micronúcleos por bloqueo de la citocinesis (CBMN), las muestras fueron cultivadas a 37º C en 5% de CO2, durante 7 días (Fenech, 2010; 2014), en las condiciones mencionadas. Al día 7, 100 μl de la suspensión celular se transfirieron a tubos cónicos (Eppendorf) para evaluar la viabilidad celular, 100 μl se utilizaron para el ensayo cometa, y el resto de las células se destinaron para el ensayo CBMN.
Cada cultivo se realizó por duplicado y el experimento se repitió 3 veces para permitir una estimación precisa de la variación experimental.
Espectrofotometría de Absorción Atómica
Se determinó la concentración de Zn al inicio y al finalizar los cultivos, a través de espectrofotometría de Absorción Atómica, previa dilución con ácido tricloroacético (Cátedra de Fisiología, Facultad de Ciencias Veterinarias, UNLP).
Estimación de necrosis celular mediante tinción con el colorante vital azul de tripano
Se contó el número de células inmediatamente después de los tratamientos. Para ello, las mismas fueron teñidas con el colorante vital azul de tripano y luego cuantificadas en cámara de Newbauer.
Ensayo de electroforesis de un sola célula (ensayo cometa versión alcalina)
El ensayo cometa permite cuantificar los fenómenos de daño en el ADN a nivel individual. La migración del ADN toma el aspecto de un cometa y, de allí, el nombre que se le ha dado a esta técnica. El ensayo se realizó en condiciones alcalinas, de acuerdo al método de Singh et al. (1988). Las células se embeben en agarosa de bajo punto de fusión (0,5%) y se depositan en portaobjetos previamente cubiertos con agarosa 150 mL, agarosa 0,5% de punto de fusión normal. Posteriormente, los portaobjetos se sumergen en solución de lisis pH 10 (2,5 M NaCl, 100 mM EDTA, 10 mM Tris, 10% DMSO, 1% Triton X-100) durante 24 hs. A continuación se procede a un tratamiento alcalino (300 mM NaOH, 1 mM EDTA) por 20 minutos antes de la electroforesis. Esta se realiza a 4º C, 20 V y 250 mA durante 20 minutos. Una vez finalizada la electroforesis, los portaobjetos se lavan con una solución de neutralización y las células se colorean con una solución 1/1000 SYBR Green I (Molecular Probes, Eugene, Oregon, USA). Se analizan 200 imágenes por punto experimental utilizando un microscopio de fluorescencia (Olympus BX40, equipado con filtros de excitación de 515-560 cm). La asignación de niveles o grados de daño se realiza según la extensión que adquiere la cola del cometa. Las células son clasificadas en 5 categorías, desde 0 (cola no visible) hasta 4 (cabeza de cometa detectable y más ADN en la cola) (Olive, 1999; Collins, 2004). A partir de esta clasificación se obtiene el índice de daño (ID) (Collins, 2004).
Ensayo de Micronúcleos por bloqueo de la citocinesis (CBMN)
Si bien existen muchos métodos para evaluar la estabilidad genómica, a la fecha, el CBMN sería el más indicado para valorar el efecto provocado por una ingesta inadecuada de micronutrientes (Fenech, 2010). La simplicidad del conteo y la aplicabilidad del ensayo de micronúcleos in vitro en diferentes tipos celulares, lo convierten en una herramienta atractiva para la evaluación de anomalías cromosómicas (Kirsch-Volders et al., 2003). La Citocalasina B, producida por el hongo Helminthosporium dematioideum, en bajas concentraciones bloquea la citocinesis y la movilidad celular dando como resultado células binucleadas (BN). El micronúcleo (MNi) se origina de un fragmento cromosómico o de un cromosoma entero que queda retrasado en anafase durante la división celular (Fenech, 2010). Asimismo, los puentes nucleoplásmicos (NPBs) entre los núcleos de una célula BN, proveen una medida de los rearreglos cromosómicos (Umegaki y Fenech, 2000; Fenech et al., 2003), ya que son el producto de cromosomas dicéntricos. En la década pasada, emergió otro mecanismo de formación de MNi conocido como brote nuclear (BUDs). Shimizu et al. (1998; 2000) demostraron que la amplificación del ADN se localiza en sitios específicos de la periferia del núcleo y se elimina a través de brotes nucleares que forman los MNi durante la fase S del ciclo celular. Debe demostrarse que la proliferación celular es suficiente para asegurar que la mayoría de las células contadas deriva de la primera o de la primera y segunda división luego del tratamiento (Fenech, 2007). Para ello se utiliza el índice de división nuclear (NDI):1 x nº de células mononucleadas + 2 x nº de células binucleadas + 3 x nº de células tri y tetranucleadas / nº total de células contadas (500 células). Aproximadamente 24 hs antes de la finalización del cultivo, las células se tratan con citocalasina B (3 μg/ml) (Sigma, St. Louis, MO, USA). La suspensión celular se centrifuga y el botón celular (pellet) se resuspende con 5 ml de fijador (methanol:ácido acético 3:1). Se realizan tres lavados con fijador, se resuspende y se gotean en portaobjetos limpios. Se tiñen con Giemsa 5% durante 10 minutos. Se analizan 1.000 células por punto experimental de acuerdo a los criterios de Fenech (2007).
Estadística
Los resultados del ensayo cometa y el análisis de micronúcleos fueron estadísticamente analizados por medio de la Prueba de χ2, mientras que la viabilidad celular fue evaluada a través de la Prueba de ANOVA con el programa Statgraphics® 5.1 (Manugistics Inc., Rockville, MD), considerando un p<0,05. Los resultados se expresan como media ± errores estándar.
RESULTADOS
La quelación del Zn del medio de cultivo analizado mediante espectrofotometría de absorción atómica fue total, mientras que otros metales divalentes (cobre y hierro) no fueron afectados (datos no mostrados).
Se estimó la viabilidad celular mediante tinción con el colorante vital azul de tripano, los resultados se resumen en la Tabla 1. El análisis de la varianza evidenció diferencias estadísticamente significativas entre los tratamientos (p<0,001). Por medio del análisis de componentes principales se observó que dichas diferencias fueron estadísticamente significativas para todas las comparaciones excepto para control y 80 μg/dl SO4Zn. La frecuencia de células necróticas fue significativamente superior en el cultivo deficiente, así como en los suplementados con 280 y 380 μg/dl SO4Zn, respecto de los cultivos control, 80 y 180 μg/dl SO4Zn. Es de resaltar que los cultivos suplementados con 380 μg/dl SO4Zn presentaron frecuencias significativamente superiores a las observadas en los cultivos deficiente y 280 μg/dl SO4Zn. Por su parte, los cultivos suplementados con 180 μg/dl SO4Zn fueron los que mostraron el mayor porcentaje de células viables.
Tabla 1. Estimación de la viabilidad celular mediante tinción con el colorante vital azul de tripano. Entre paréntesis se indica el error estándar.
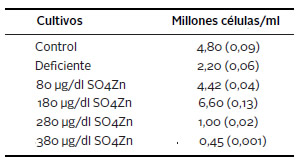
Prueba de ANOVA
F= 200,44; p<0,001
Se determinaron las fracturas de cadena del ADN así como los sitios lábiles al álcali a través del ensayo cometa (Tabla 2). El cultivo deficiente en Zn, presentó un incremento estadísticamente significativo del ID respecto a todos los demás cultivos (p<0,001). Los cultivos suplementados mostraron una reducción de este índice. Sin embargo, las dosis más altas mostraron frecuencias de daño aumentadas en relación a los cultivos control, 80 μg/dl SO4Zn y 180 μg/dl SO4Zn (valores de p se muestran en Tabla 2). Las dosis de 80 μg/dl SO4Zn y 180 μg/dl son las que presentan el menor ID.
Tabla 2. Determinación de los grados de daño (G0-G4) en el ADN y estimación del índice de daño (ID), a través del ensayo cometa. Entre paréntesis se indica el error estándar.

Prueba de χ2
1 Deficiente vs. Control (p<0,001); Deficiente vs. 80 μg/dl (p<0,001); Deficiente vs. 180 μg/dl (p<0,001); Deficiente vs. 280 μg/dl (p<0,001); Deficiente vs. 380 μg/dl (p<0,001).
2 280 μg/dl vs. 80 μg/dl (p<0,05).
3 380 μg/dl vs. Control (p<0,05); 380 μg/dl vs. 80 μg/dl (p<0,01); 380 μg/dl vs. 180 μg/dl (p<0,05).
En la Tabla 3, se muestran los resultados obtenidos con el ensayo CBMN. El efecto citotóxico fue evaluado a través del índice de división nuclear. Se observa una disminución del mismo tanto en los cultivos deficientes de Zn como en los suplementados con 280 y 380 μg/dl SO4Zn. El NDI más elevado se observa en los cultivos de 80 y 180 μg/dl. Ninguna de estas diferencias resultó significativa desde el punto de vista estadístico. Para valorar el daño cromosómico, se contabilizó la frecuencia de MNi, NPBs y NBuds en 1.000 células BN. La frecuencia de MNi fue significativamente superior desde el punto de vista estadístico en el cultivo deficiente, así como en los suplementados con 280 y 380 μg/dl SO4Zn, respecto de los cultivos control, 80 y 180 μg/dl SO4Zn, los cuales presentaron frecuencias similares (valores de p se muestran en la Tabla 3). Cabe destacar, que los cultivos suplementados con 380 μg/dl SO4Zn presentaron frecuencias de MNi superiores a las observadas en los cultivos deficientes. Por su parte, los cultivos suplementados con 80 y 180 μg/dl de SO4Zn fueron los que mostraron el menor daño cromosómico. Los resultados obtenidos para NPBs y NBuds fueron dispares, mostrando valores superiores para los cultivos suplementados con 80 y 280 μg/dl SO4Zn, respecto del resto de los cultivos. Estas diferencias no fueron estadísticamente significativas.
Tabla 3. Frecuencias de micronúcleos (MNi), puentes nucleoplásmicos (NPBs), brotes nucleares (BUDs) e índice de división nuclear (NDI), obtenidas con el ensayo de micronúcleos por bloqueo de la citocinesis (CBMN). Entre paréntesis se indica el error estándar.
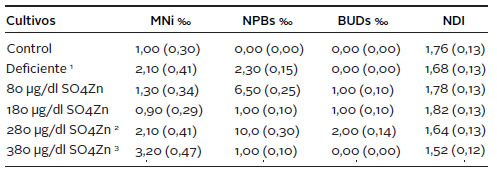
Prueba de χ2
1 Deficiente vs. Control (p<0,05); Deficiente vs. 180 μg/dl (p<0,05);
2 280 vs. Control (p<0,05); 280 vs. 180 μg/dl (p<0,05);
3 380 vs. Control (p<0,001); 380 vs. 80 μg/dl (p<0,01); 380 vs. 180 μg/dl (p<0,001).
DISCUSIÓN
En el presente trabajo, se utilizó el sulfato de Zn para suplementar los cultivos, debido a que en otros estudios se constató que esta sal presentaba mayor biodisponibilidad que otras (Sharif et al., 2011; 2012). El estado nutricio del Zn no depende sólo de la cantidad ingerida, sino también de su biodisponibilidad y del consumo en la dieta de inhibidores de la absorción de este nutriente, tales como los fitatos, las fibras, el hierro y el calcio, entre otros (Sandstead, 2000; CESNI, 2001; Pizarro y Calvo, 2009).
Los alimentos de origen animal, particularmente las carnes, los mariscos y el pescado, son fuentes ricas en Zn y su biodisponibilidad es alta, ya que durante su digestión se liberan ciertos aminoácidos y péptidos que contienen lisina y que forman complejos solubles con el Zn (Rosado, 1998). Sin embargo, por razones culturales y por su alto costo, la carne es consumida en bajas cantidades por las poblaciones de riesgo. Más aún, estas poblaciones, habitualmente, consumen dietas basadas en cereales y legumbres, las cuales contienen cantidades significativas de fitatos. A su vez, se ha registrado en la población infantil una incorporación tardía de los alimentos de origen animal durante la etapa de complementación, exponiendo así a los niños pequeños a la deficiencia de Zn y comprometiendo de manera irreversible su potencial de crecimiento. En Argentina, desde el punto de vista epidemiológico, el patrón de consumo alimentario sufrió modificaciones en los últimos treinta años en todos los estratos sociales, observándose una disminución del consumo de carnes, frutas y verduras (Aguirre, 2005).
Para analizar el efecto de la deficiencia y el exceso de Zn, se utilizaron el ensayo cometa y el ensayo CBMN, los cuales se complementan y brindan una amplia información acerca de la posible inducción de daño al material genético provocado por una inadecuada ingesta de nutrientes. El ensayo cometa alcalino, provee una medida de la inducción de fracturas de simple y doble cadena del ADN que permanecen sin reparar. Por otra parte, los MNi y los NPBs ocurren debido a una falla en la reparación de las fracturas de cadena del ADN que ocasionan la producción de fragmentos acéntricos y cromosomas dicéntricos. Los resultados de este estudio muestran que la deficiencia de Zn genera un incremento de las fracturas de cadena del ADN. En otros trabajos también se observaron frecuencias elevadas de daño en el ADN, medidas a través del ensayo cometa (Ho y Ames, 2002; Yan et al., 2008; Song et al., 2009a; 2009b; 2009c). La elevada frecuencia de daño en el ADN observada en este estudio producto de la deficiencia de Zn, puede ser el resultado del incremento en la oxidación del ADN. Existe numerosa evidencia, proveniente de trabajos experimentales in vitro, que indicaría que la adición de Zn protege a los grupos sulfhidrilos contra el daño
oxidativo (Bagchi, 1997; Bray y Bettger, 1990; Sunderman, 1995; Szuster et al., 2000). En otros estudios también realizados in vitro, se observó que las células deficientes en Zn presentaban fallas en los mecanismos de reparación del ADN, con elevados niveles de daño (Dreosti, 2001; Ho y Ames, 2002; Yan et al., 2008; Sharif et al., 2012). En el presente trabajo la suplementación con concentraciones dentro del rango fisiológico normal (80-280 μg/dl) redujo las fracturas en el ADN en relación al cultivo deficiente en Zn, mientras que concentraciones elevadas (380 μg/dl) habrían ocasionado un aumento del daño, sugiriendo un potencial efecto genotóxico para el sulfato de Zn cuando se encuentra en exceso.
Los resultados obtenidos con el ensayo CBMN muestran que tanto la deficiencia como el exceso provocan un incremento en la frecuencia de MNi, más marcado aún en el exceso. Es de resaltar que el nivel superior del rango fisiológico normal establecido para niños (280 μg/dl) provocó la misma magnitud de daño cromosómico que la deficiencia. En trabajos previos (Sharif et al., 2011) se observó un aumento de MNi y NPBs en la deficiencia (0 μM) y el exceso (32 μM), mientras que todas las concentraciones evaluadas dentro del rango fisiológico normal (4-16 μM) provocaron una disminución del daño.
En este estudio, el mayor porcentaje de células necróticas se observa en los cultivos que presentaban exceso de Zn, en los cuales el daño cromosómico también fue el más elevado. En un estudio reciente, se sugirió que la suplementación en exceso con este micronutriente, redujo la viabilidad de las células de rata INS-1E debido al aumento de la necrosis (Nygaard et al., 2014). En otros trabajos in vitro, se observó que el exceso de otras sales de Zn, tales como cromato y citrato, también provocó un efecto citotóxico y genotóxico en diferentes líneas celulares (Bae et al., 2007; Xie et al., 2009; Wise et al., 2010; Sharif et al., 2011) y animales de laboratorio (Tapisso et al., 2009). En nuestro trabajo, los cultivos deficientes presentaron una disminución de la viabilidad aunque no de modo tan marcado como en el exceso. En este sentido, en otros estudios se observó que la deficiencia de Zn indujo apoptosis en diversos tipos celulares, tales como fibroblastos, hepatocitos, precursores de células T, células del glioma y testiculares (Ho y Ames, 2002; Ho et al., 2003; Bao y Knoell, 2006; Yan et al., 2008; Yamaguchi et al., 2009).
Los resultados del presente trabajo sugieren que la suplementación de los cultivos in vitro con Zn ayudaría a reducir la inestabilidad genómica. Las dosis más beneficiosas serían las de 80 y 180 μg/dl. Por su parte, tanto los cultivos deficientes (0 μg/dl) como aquellos con las concentraciones más elevadas de Zn (280 y 380 μg/dl) inducirían una menor viabilidad y provocarían un mayor nivel de daño en el ADN y en los cromosomas. Asimismo, observamos que el nivel superior del rango fisiológico normal establecido para niños provocaría un incremento del efecto citotóxico resultando en una reducción de la viabilidad celular y, por otra parte, un aumento del daño cromosómico. En otros estudios, se observó que la suplementación con Zn dentro del rango fisiológico normal tuvo un efecto beneficioso sobre la estabilidad genómica en células WIL2-NS y queratinocitos de mucosa humana, mientras que el límite superior del rango farmacológico (100 μM) afectó de manera adversa algunos parámetros celulares (Sharif et al., 2011; 2012). En contraste, en otro trabajo donde se evaluó el efecto de la suplementación con 100 μM de sulfato de Zn no se observó que la viabilidad de linfocitos humanos estuviera afectada (Sliwinski et al., 2009).
En trabajos in vivo también se observó una relación entre el estado de Zn y el daño en el ADN (Bae et al., 2007; Sliwinski et al., 2009; Xie et al., 2009; Wise et al., 2010; Sharif et al., 2011). En un estudio realizado en hombres de entre 19 y 50 años (Song et al., 2009c), donde se restringió la ingesta de este micronutriente y luego se la restableció, se registró un aumento significativo de fracturas del ADN durante el período de depleción. Este incremento se revirtió luego de la repleción de Zn, sugiriendo que el daño está relacionado con el nivel de Zn.
Se requerirán nuevos estudios para determinar la adecuada ingesta diaria de este micronutriente. Ya que, en primera instancia, es necesario llevar a cabo estudios in vitro dosis-respuesta que permitan evaluar el efecto de la concentración del micronutriente sobre el daño genético y la citotoxicidad. Y, posteriormente, deben desarrollarse investigaciones in vivo de corte transversal, que sean útiles para valorar la asociación entre la ingesta de nutrientes y los marcadores utilizados para cuantificar el daño genético. Asimismo, futuras investigaciones en este tema, deberían poner énfasis en la elucidación de los mecanismos subyacentes por los cuales el Zn modularía la reparación del ADN, estudiando el daño oxidativo, los procesos epigenéticos de regulación de la reparación del ADN y los cambios en la expresión génica.
Las recomendaciones diarias de alimentos intentan dar una guía para la ingesta adecuada de nutrientes en la prevención de enfermedades causadas por la deficiencia o el exceso. Es claro que determinar estos extremos es importante, pero el mayor reto en la prevención de enfermedades del desarrollo y degenerativas, es definir la ingesta apropiada de micronutrientes, individuales o combinados (nutriomas) para optimizar el funcionamiento celular y del organismo. Esta optimización depende de la prevención del daño en el genoma nuclear y mitocondrial. Así, “poner a punto” el metabolismo humano podría ser el mejor camino para minimizar el daño en el ADN, mejorando la salud y prolongando la esperanza de vida.
AGRADECIMIENTOS
Este trabajo se realizó gracias al soporte financiero del CONICET (P.I.P. Nº 0187).
BIBLIOGRAFÍA
1. Aguirre P. (2005) Características de las canastas de consumo de diferentes sectores de ingresos. En: Aguirre P. (Ed.) Estrategias de consumo: qué comen los argentinos que comen. Buenos Aires, Ed. Miño y Dávila, pp. 69-106. [ Links ]
2. Ambrosse C.B., Freudenheim J.L., Thompson P.A., Bowman E., Vena J.E., Marshall J.R., Laughlin R., Nemoto T., Shields P.G., Graham S. (1999) Manganese superoxide dismutase genetic polymorphisms, dietary antioxidants and risk of breast cancer. Cancer Res. 59 (3): 602-606. [ Links ]
3. Ames B.N. (1998) Micronutrients prevent cancer and delay ageing. Toxicol. Lett. 102/103: 5-18. [ Links ]
4. Bae S.N., Kim J., Lee Y.S., Kim J.D., Kim M.Y., Park L.O. (2007) Cytotoxic effect of zinc citrate compound on choriocarcinoma cell lines. Placenta 28: 22-30. [ Links ]
5. Bae S.N., Lee Y.S., Kim M.Y., Kim J.D., Park L.O. (2006) Antiproliferative and apoptotic effects of zinc-citrate compound (CIZAR(R)) on human epithelial ovarian cancer cell line, OVCAR-3. Gynecol. Oncol. 103: 127-136. [ Links ]
6. Bagchi D., Bagchi M., Stohs S.J. (1997) Comparative In Vitro Oxygen Radical Scavenging Ability of Zinc Methionine and Selected Zinc Salts and Antioxidants. Gen. Pharmac. 28 (1): 85-91. [ Links ]
7. Bao S., Knoell D.L. (2006) Zinc modulates airway epithelium susceptibility to death receptor-mediated apoptosis. Am. J. Physiol. Lung Cell Mol. Physiol. 290: L433-441. [ Links ]
8. Beard J. (1996) Nutrient status and central nervous system function. In: Ziegler E.E., Filer Jr. L.J. (Eds.) Present Knowledge in Nutrition, ILSI Press, Washington, DC, pp. 612-622. [ Links ]
9. Bray T.M., Bettger W.J. (1990) The physiological role of zinc as an antioxidant. Free Rad. Biol. Med. 8: 281-291. [ Links ]
10. Carmuega E. (1996) Transición epidemiológica y nutricional de la Argentina. Documento país presentado en el taller subregional OPS/OMS transición nutricional en la región de las Américas. Quito, Ecuador. [ Links ]
11. CESNI (Centro de Estudios Sobre Nutrición Infantil), Boletín (2001) El zinc y el cobre en nutrición infantil. [ Links ]
12. Chang K.L., Hung T.C., Hsieh B.S., Chen Y.H., Chen T.F, Cheng H.L. (2006) Zinc at pharmacologic concentrations affects cytokine expression and induces apoptosis of human peripheral blood mononuclear cells. Nutr. 22: 465-474. [ Links ]
13. Chimienti F., Jourdan E., Favier A., Seve M. (2001) Zinc resistance impairs sensitivity to oxidative stress in HeLa cells: protection through metallothioneins expression. Free Radic. Biol. Med. 31: 1179-1190. [ Links ]
14. Chung M.J., Walker P.A., Brown R.W., Hogstrand C. (2005) ZINC-mediated gene expression offers protection against H2O2-induced cytotoxicity. Toxicol. Appl. Pharmacol. 205: 225-236. [ Links ]
15. Clegg M.S., Hanna L.A., Niles B.J., Momma T.Y., Keen C.L. (2005) Zinc deficiency induced cell death. IUBMB Life 57: 661-669. [ Links ]
16. Collins A. (2004) The comet assay for DNA damage repair: principles, applications, and limitations. Mol. Biotechnol. 26 (3): 249-261. [ Links ]
17. Dreosti I.E. (2001) Zinc and the gene. Mutat. Res. 475: 161-167. [ Links ]
18. Falchuk K. (1998) The molecular basis for the role of zinc in developmental biology. Mol. Cell. Biochem. 188: 41-48. [ Links ]
19. Favier A. (1998) Is zinc a cellular mediator in the regulation of apoptosis. In: Bratter P., de Bratter V.N., Khasanova L., Etienne J.C. (Eds.) Metal Ions in Biology and Medicine. John Libbey Eurotext, Paris, 5: 164-167. [ Links ]
20. Feliu S.M., Piñeiro A., López C., Slobodianik N.H. (2005) Valores de referencia de cobre, zinc y selenio en niños. Acta Bioquím. Clín. Latinoam. 39: 459-462. [ Links ]
21. Fenech M. (2001) Recommended dietary allowances (RDAs) for genomic stability. Mutat. Res. 480-481: 51-54. [ Links ]
22. Fenech M., Ferguson L.R. (2001) Vitamins/minerals and genomic stability in humans. Mutat. Res. 475: 1-6. [ Links ]
23. Fenech M. (2002) Micronutrients and genomic stability: a new paradigm for recommended dietary allowances (RDAs). Food Chem. Toxicol. 40 (8): 1113-1117. [ Links ]
24. Fenech M., Chang W.P., Kirsch-Volders M., Holland N., Bonassi S., Zeiger E. (2003) Human project: detailed description of the scoring criteria for the cytokinesis-block micronucleus assay using isolated human lymphocyte cultures. Mutat. Res. 534: 65-75. [ Links ]
25. Fenech M. (2005) The Genome Health Clinic and Genome Health Nutrigenomics concepts: diagnosis and nutritional treatment of genome and epigenome damage on an individual basis. Mutagenesis 20 (4): 255-269. [ Links ]
26. Fenech M. (2007) Cytokinesis-block micronucleus cytome assay. Nat. Protoc. 5: 1084-1104. [ Links ]
27. Fenech M. (2010) Dietary reference values of individual micronutrients and nutriomes for genome damage prevention: current status and a road map to the future. Am. J. Clin. Nutr. 91: 1438S. [ Links ]
28. Fenech M. (2014) Nutriomes and Personalised Nutrition for DNA Damage Prevention, Telomere Integrity Maintenance and Cancer Growth Control. Cancer Treat. Res. 159: 427-441. [ Links ]
29. Flores M.E., Ramírez J.A., Vargas E., Calivá J.B., de Céspedes C. (1985) El zinc plasmático y su relación con los percentiles de crecimiento de niños costarricenses en áreas urbanas. Rev. Costarric. Cienc. Méd. 6 (1): 38-50. [ Links ]
30. Giovannucci G., Stampfer M.J., Colditz G.A., Hunter D.J., Fuchs C., Rosner B.A., Speizer F.E., Willett W.C. (1998) Multivitamin use, folate and colon cancer in women in the Nurses' Health Study. Ann. Int. Med. 129: 517-524. [ Links ]
31. González H., Disalvo L., Varea A. (2006) Repercusión de las deficiencias de micronutrientes en salud pública. Ludovica Pediátrica VII, 1: 10-15. [ Links ]
32. Grandy G., Weisstaub G., López de Romaña D. (2010) Deficiencia de hierro y zinc en niños. Rev. Soc. Bol. Ped. 49 (1): 25-31. [ Links ]
33. Hambidge K.M. (1989) Mild zinc deficiency in human subjects. In: Mills C.F. (Ed.) Zinc in Human Biology, Springer, London, pp. 281-296. [ Links ]
34. Ho E., Ames B.N. (2002) Low intracellular zinc induces oxidative DNA damage, disrupts p53 NFkappa B, and AP1 DNA binding, and affects DNA repair in a rat glioma cell line. Proc. Natl. Acad. Sci. U.S.A. 99: 16770-16775. [ Links ]
35. Ho E., Courtemanche C., Ames B.N. (2003) Zinc deficiency induces oxidative DNA damage and increases p53 expression in human lung fibroblasts. J. Nutr. 133: 2543-2548. [ Links ]
36. Kimura M., Umegaki K., Higuchi M., Thomas P., Fenech M. (2004) Methylenetetrahydrofolate reductase C677T polymorphism, folic acid and riboflavin are important determinants of genome stability in cultured human lymphocytes. J. Nutr. 134: 48-56. [ Links ]
37. Kirsch-Volders M., Sofuni T., Aardema M., Albertini S., Eastmond D., Fenech M., Ishidate M., Kirchner S., Lorge E., Morita T., Norppa H., Surrallés J., Vanhauwaert A., Wakata A. (2003) Report from the in vitro micronucleus assay working group. Mutat. Res. 540: 153-163. [ Links ]
38. Leccia M.T., Richard M.J., Favier A. (1999) Zinc protects against ultraviolet A1-induced DNA damage and apoptosis in culture human fibroblast. Biol. Trace Elem. Res. 69 (3): 177-90. [ Links ]
39. Lin Y.L., Shivji M.K., Chen C. (1998) The evolutionarily conserved zinc finger motif in the largest subunit of human replication protein A is required for DNA replication and mismatch repair but not for nucleotide excision repair. J. Biol. Chem. 273: 1453-1461. [ Links ]
40. McGowan A., Fernandes R., Verhaegen S., Cotter T. (1994) Zinc inhibits UV radiation-induced apoptosis but fails to prevent subsequent cell death. Int. J. Radiat. Biol. 66: 343-349. [ Links ]
41. Morris M.C., Beckett L.A., Scherr P.A., Herbert L.E., Bennett D.A., Field T.S., Evans D.A. (1998) Vitamin E and Vitamin C supplement use and risk of incident Alzheimer disease. Alzheimer Dis. Assoc. Disord. 12 (3): 121-126. [ Links ]
42. National Research Council (1989) Food and Nutrition Board: Recommended daily dietary allowances, ed 10ª. National Academy of Sciences, National Research Council, Washington DC. [ Links ]
43. Nygaard S.B., Larsen A., Knuhtsen A., Rungby J., Smidt K. (2014) Effects of zinc supplementation and zinc chelation on in vitro ß-cell function in INS-1E cells. BMC Research Notes 7: 84. [ Links ]
44. O´Donnell A., Carmuega E. (1999) Hoy y Mañana. Salud y calidad de vida de la Niñez Argentina. Documentos y discusiones del taller realizado en Villa La Angostura. Buenos Aires: CESNI. [ Links ]
45. Olive P. (1999) DNA damage and repair in individual cells: applications of the comet assay in radiobiology. Int. J. Radiat. Biol. 75: 395. [ Links ]
46. Parat M.O., Richard M.J., Pollet S. (1997) Zinc and DNA fragmentation in keratinocyte apoptosis: its inhibitory effect in UVB irradiated cells. J. Photochem. Photobiol. 37: 101-106. [ Links ]
47. Parry J.M. (1988) Studies upon the genetic effects of environmental chemicals: the coordinated research programme of the European Economic Community. Mutagenesis 3 (2): 105-136. [ Links ]
48. Pizarro F., Calvo E. (2009) El significado a mediano y largo plazo de la deficiencia de hierro y zinc durante los primeros dos años de vida, para asegurar un buen crecimiento temprano. En: Uauy R., Carmuega E., Barker D. (Eds.) Impacto del crecimiento y desarrollo temprano sobre la salud y bienestar de la población: Perspectivas y Reflexiones desde el Cono Sur. Primera Ed. Instituto Danone, Cono Sur, Buenos Aires, pp. 49-64. [ Links ]
49. Record I.R., Jannes M., Dreosti I.E. (1996) Protection by zinc against UVA and UVB-induced cellular genomic damage in vivo and in vitro. Biol. Trace Elem. Res. 53: 27-43. [ Links ]
50. Richard M.J., Guiraud M.T., Leccia M.T., Beani J.C., Favier A. (1993) Effect of zinc supplementation on resistance of cultured human skin fibroblasts towards oxidant stress. Biol. Trace Elem. Res. 37: 187-199. [ Links ]
51. Rosado J.L. (1998) Deficiencia de zinc y sus implicaciones funcionales. Salud Pública Mex. 40: 181-188. [ Links ]
52. Ruz M., Castillo-Duran C., Lara X., Codoceo J., Rebolledo A., Atalah E. (1997) A 14-mo zinc-supplementation trial in apparently healthy Chilean preschool children. Am. J. Clin. Nutr. 66: 1406-1413. [ Links ]
53. Sandstead H.H. (2000) Causes of iron and zinc deficiencies and their effects on brain. J. Nutr. 130: 347S-9S. [ Links ]
54. Sharif R., Thomas P., Zalewski P., Graham R.D., Fenech M. (2011) The effect of zinc sulphate and zinc carnosine on genome stability and cytotoxicity in the WIL2- NS human lymphoblastoid cell line. Mutat. Res. 720: 22-33. [ Links ]
55. Sharif R., Thomas P., Zalewskib P., Fenech M. (2012) The role of zinc in genomic stability. Mutat. Res. 733: 111-121. [ Links ]
56. Shimizu N., Itoh N., Utiyama H., Wahl G.M. (1998) Selective entrapment of extra chromosomally amplified DNA by nuclear budding and micronucleation during S phase. J. Cell Biol. 140: 1307-1320. [ Links ]
57. Shimizu N., Shimuara T., Tanaka T. (2000) Selective elimination of acentric double minutes from cancer cells through the extrusion of micronuclei. Mutat. Res. 448: 81-90. [ Links ]
58. Singh N.P., McCoy M.T., Tice R.R., Schneider E.L. (1988) A simple technique for quantification of low levels of DNA damage in individual cells. Exp. Cell Res. 175: 184-191. [ Links ]
59. Sliwinski T., Czechowska A., Kolodziejczak M., Jajte J., Wisniewska-Jarosinska M., Blasiak J. (2009) Zinc salts differentially modulate DNA damage in normal and cancer cells. Cell Biol. Int. 33: 542-547. [ Links ]
60. Solomons N.W. (1998) Mild human zinc deficiency produces an imbalance between cell-mediated and humoral immunity. Nutr. Rev. 56: 27-28. [ Links ]
61. Song Y., Elias V., Loban A., Scrimgeour A.G., Ho E. (2009a) Marginal zinc deficiency increases oxidative DNA damage in the prostate after chronic exercise. Free Radic. Biol. Med. 48: 82-88. [ Links ]
62. Song Y., Leonard S.W., Traber M.G., Ho E. (2009b) Zinc deficiency affects DNA damage, oxidative stress, antioxidant defenses, and DNA repair in rats. J. Nutr. 139: 1626-1631. [ Links ]
63. Song Y., Chung C.S., Bruno R.S., Traber M.G., Brown K.H., King J.C., Ho E. (2009c) Dietary zinc restriction and repletion affects DNA integrity in healthy men. Am. J. Clin. Nutr. 90: 321-328. [ Links ]
64. Sunderman F.W. Jr. (1995) The influence of zinc on apoptosis. Ann. of Clin. Lab. Sci. 25: 134-142. [ Links ]
65. Szuster-Ciesielska A., Stachura A., Slotwinska M., Kaminska T., Sniezko R., Paduch R., Abramczyk D., Filar J., Kandefer-Szerszen M. (2000) The inhibitory effect of zinc on cadmium-induced cell apoptosis and reactive oxygen species (ROS) production in cell cultures. Toxicology 145: 159-171. [ Links ]
66. Tapisso J.T., Marques C.C., Mathias L., Ramalhinho G. (2009) Induction of micronuclei and sister chromatid exchange in bone-marrow cells and abnormalities in sperm of Algerian mice (Musspretus) exposed to cadmium, lead and zinc. Mutat. Res. 678: 59-64. [ Links ]
67. Umegaki K., Fenech M. (2000) Cytokinesis-block micronucleus assay in WIL2-NS cells: a sensitive system to detect chromosomal damage induced by reactive oxygen species and activated human neutrophils. Mutagenesis 15 (3): 261-269. [ Links ]
68. Urrutia R. (1997) Exploring the role of the homeobox and zinc finger proteins in pancreatic cell proliferation, differentiation and apoptosis. Int. J. Pancreatol. 22: 1-14. [ Links ]
69. Walsh C.T., Sandstead H.H., Prasad A.S., Newberne P.M., Fraker P.J. (1994) Zinc: health effects and research priorities for the 1990s. Environ. Health Perspect. 102 (2): 5-46. [ Links ]
70. Watkins M.L., Erickson J.D., Thun M.J., Mulinare J., Heath C.W. (2000) Multivitamin use and mortality in a large prospective study. Am J. Epidemiol. 152 (2): 149-162. [ Links ]
71. Wise S.S., Holmes A.L., Qin Q., Xie H., Katsifis S.P., Thompson W.D., Wise Sr. J.P. (2010) Comparative genotoxicity and cytotoxicity of four hexavalent chromium compounds in human bronchial cells. Chem. Res. Toxicol. 23: 365-372. [ Links ]
72. Wu J., Lyons G.H., Graham R.D., Fenech M. (2009) The effect of selenium, as selenomethionine, on genome stability and cytotoxicity in human lymphocytes measured using the cytokinesis-block micronucleus cytome assay. Mutagenesis 24: 225-232. [ Links ]
73. Xie H., Holmes A.L., Young J.L., Qin Q., Joyce K., Pelsue S.C., Peng C., Wise S.S., Jeevarajan A.S., Wallace W.T., Hammond D., Wise Sr. J.P. (2009) Zinc chromate induces chromosome instability and DNA double strand breaks in human lung cells. Toxicol. Appl. Pharmacol. 234: 293-299. [ Links ]
74. Yamaguchi S., Miura C., Kikuchi K., Celino F.T., Agusa T., Tanabe S., Miura T. (2009) Zinc is an essential trace element for spermatogenesis. Proc. Natl. Acad. Sci. U.S.A. 106: 10859-10864. [ Links ]
75. Yan M., Song Y., Wong C.P., Hardin K., Ho E. (2008) Zinc deficiency alters DNA damage response genes in normal human prostate epithelial cells. J. Nutr. 138: 667-673. [ Links ] [ Links ]














