Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
BAG. Journal of basic and applied genetics
versión On-line ISSN 1852-6233
BAG, J. basic appl. genet. vol.26 no.1 Ciudad Autónoma de Buenos Aires jun. 2015
ARTÍCULOS ORIGINALES
Identificación de hidrófitas dulceacuícolas para estudios de genotoxicidad de contaminantes acuáticos
Identification of freshwater hydrophytes for genotoxicity assessment of aquatic pollutants
Menone M.L.1,2,*, Pérez D.J.1,2, Lukaszewicz G. 1,2, Camadro E.L.2,3
1 Laboratorio de Ecotoxicología, Instituto de Investigaciones Marinas y Costeras (IIMYC) CONICET-UNMdP, Funes 3350 (7600) Mar del Plata, Argentina.
2 Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), Rivadavia 1917 (1033) Buenos Aires, Argentina.
3 Laboratorio de Genética, Estación Experimental Agropecuaria Balcarce (INTA)/ Facultad de Ciencias Agrarias, UNMdP, CC 276 (7620) Balcarce, Argentina.
Corresponding Author: mirta.menone@gmail.com
Fecha de recepción: 20/02/2014
Fecha de aceptación de versión final: 09/12/2014
RESUMEN
Con el objeto de explorar el uso de hidrofitas en ensayos de genotoxicidad de contaminantes acuaticos, como complemento o reemplazo del uso tradicional y estandarizado de macrofitas terrestres (Allium cepa (L.), Pisum sativum (L.), Tradescantia sp., entre otras), se llevo a cabo un estudio preliminar en un intento por seleccionar al menos una especie taxonomica silvestre dulceacuicola que debe cumplir los siguientes requisitos: poseer numero cromosomico basico bajo, indice mitotico (IM) elevado y ser facil de propagar en laboratorio. Para tal fin, se realizaron tres campanas de relevamiento de vegetacion en la Laguna La Brava (provincia de Buenos Aires, Argentina). Se recolectaron semillas de las especies mas representativas, y se dispusieron en placas de Petri para su germinacion. Luego se realizaron estudios citogeneticos en apices radicales. Las especies taxonomicas Bidens laevis (L.) y Solanum chenopodioides (Lam.) cumplieron los requisitos para su uso en el analisis de genotoxicidad de contaminantes acuaticos.
Palabras clave: Macrofitas acuaticas nativas; Numero cromosomico basico; Indice mitotico; Bioensayos citogeneticos; Genotoxicidad.
ABSTRACT
For exploring the potential use of hydrophytes in genotoxicity bioassays for aquatic contaminants, as a complement or replacement of the traditional and standardized use of terrestrial macrophytes (Allium cepa (L.), Pisum sativum (L.), Tradescantia sp. (L.), among others), a preliminary study was carried out in an attempt to select at least one wild wetland taxonomic species that had to meet the following requirements: to have a low basic chromosome number and a high mitotic index (MI), and to be easily propagated in the laboratory. Three field vegetation surveys were carried out in La Brava Lake (Buenos Aires province, Argentina). Seeds of the most representative species were collected and placed in Petri dishes for germination. Cytogenetic studies were, then, performed in root tips. Two of the species, Bidens laevis (L.) and Solanum chenopodioides (Lam.) fulfilled the requirements for their use in the analysis of genotoxicity of aquatic contaminants.
Key words: Native aquatic macrophytes; Basic chromosome number; Mitotic index; Cytogenetic bioassays, Genotoxicity.
INTRODUCCIÓN
El primer intento de evaluacion de ensayos de mutagenicidad con plantas fue llevado a cabo por la Agencia de Proteccion Ambiental de Estados Unidos de America (USEPA) con el programa Gene-Tox, publicado en 1982 (Constantin y Owens, 1982). Este programa tenia como fin la evaluacion del estado de los bioensayos de genetica toxicologica en microorganismos, animales y plantas. Los resultados mostraron que los ensayos en plantas tenian alta sensibilidad para predecir la actividad mutagenica de compuestos quimicos, es decir que se observaban pocos falsos negativos, por lo que resultaban ser sumamente confiables. En general el analisis de los datos mostro una alta concordancia entre los ensayos en plantas y mamiferos (Ennever et al., 1988). Sin embargo, algunas sustancias quimicas que daban respuestas negativas en animales tenian resultados positivos en plantas, como es el caso de la hidrazida maleica (HM) (Gichner et al., 1982; Alvarez Moya et al., 2001; Rank et al., 2002).
En 1984 se inicio un estudio colaborativo con plantas superiores, dentro del International Program on Chemical Safety (IPCS) bajo el auspicio del Programa de las Naciones Unidas para el Desarrollo (PNUD) y la Organizacion Mundial de la Salud (OMS). En dicho estudio, se proponia la evaluacion de ensayos en plantas a corto plazo para la deteccion de sustancias potencialmente mutagenicas y carcinogenicas, y la posibilidad de aplicar estos ensayos, en particular en paises en desarrollo. Entre otros utilizados, se encuentran los bioensayos de pelos estaminales en Tradescantia palludosa (E.S. Anderson & Woodson) para detectar mutaciones genicas, aberraciones cromosomicas en apices de raiz en Vicia faba (L.) y micronucleos (MN) en T. palludosa, para evaluar los quimicos hidrazida maleica (HM), N-nitroso-N-metilurea (MNU), azida sodica (NaN3), azidoglicerol (AG) y etil metanosulfonato (EMS). Se concluyo que los ensayos con plantas son sistemas eficientes y confiables para un monitoreo rapido de mutagenicidad y clastogenicidad de compuestos quimicos (Shandu et al., 1994). Si bien solamente fueron validados tres bioensayos a traves del programa internacional IPCS, cualquier sistema con plantas superiores que sea validado y demuestre ser eficiente para el monitoreo in situ o para ensayos de laboratorio, podria ser incluido en estudios futuros dentro de este marco (Ma, 1998). Particularmente, la Angiosperma terrestre Allium cepa (L.) fue introducida en 1938 como sistema de prueba para determinar los efectos de la colquicina (Maluszynska y Juchimiuk, 2005). Posteriormente se utilizo dicha especie para analizar la genotoxicidad de compuestos quimicos mediante el ensayo de aberraciones cromosomicas, restricciones en el crecimiento de raices y concentraciones efectivas (EC) de diferentes toxicos facilitandose asi la comparacion con otros ensayos de toxicidad (Fiskesjo, 1997). Este ensayo se puede aplicar para la evaluacion de aguas provenientes de fuentes naturales (rios, lagos, lagunas), de bebida, de efluentes domesticos e industriales y de quimicos solubles e insolubles en agua (Wulff y Andrioli, 2006), y presenta la ventaja de ser de rapida aplicacion, economico y facil de llevar a cabo. Sin embargo, en la literatura se reconoce la necesidad de hallar nuevas especies sensibles para realizar bioensayos de toxicidad (Vervliet- Scheebaum et al., 2006), entre los que pueden incluirse los de genotoxicidad como el ensayo de aberraciones cromosomicas en anafase-telofase (EACAT).
En la mayoria de los bioensayos previamente mencionados se utilizan plantas terrestres bioindicadoras (Rank, 2003), que resultan ser una herramienta de uso corriente en la evaluacion de efectos genotoxicos, pero los resultados son relevantes solo cuando se aplican en ambientes terrestres. Algunos autores, en contraposicion a este hecho, reconocen la gran utilidad de los bioensayos con plantas estandares terrestres para la deteccion de genotoxinas en el ambiente acuatico (Majer et al., 2005). Sin embargo, el uso de plantas terrestres no revela el impacto de compuestos genotoxicos sobre las poblaciones de plantas acuaticas cronicamente expuestas en su habitat natural, y es por ello que los estudios pueden llevar a resultados alejados de la realidad o falsos positivos (Latuzka et al., 2003). Estos problemas pueden ser solucionados si se utilizan especies indicadoras que son parte de la flora natural del lugar de monitoreo, porque los datos que se obtengan seran mas ajustados a la realidad del ambiente que se analiza. Por esta razon, el uso de hidrofitas como bioindicadoras de efectos genotoxicos constituye una herramienta irremplazable para el monitoreo y la conservacion de ecosistemas litorales (Ferrat et al., 2003). Asi, el objetivo general del presente trabajo fue seleccionar especies silvestres de ecosistemas dulceacuicolas que reunieran caracteristicas apropiadas para su utilizacion en bioensayos de genotoxicidad de toxicos presentes en el medio acuatico, para lo cual deben cumplir con los siguientes requisitos: ser faciles de propagar en laboratorio, y poseer bajo numero cromosomico basico y elevado indice mitotico (IM).
MATERIALES Y MÉTODOS
Área de muestreo y material biológico El relevamiento de especies fue realizado entre los meses de abril y mayo de 2004, y consistio de tres salidas de campo en las que se muestrearon macrofitas acuaticas y palustres en la Laguna La Brava, provincia de Buenos Aires (37o 53 Latitud Sur, 57o 59 Longitud Oeste). Las estaciones de muestreo se ubicaron en el tributario de dicha laguna, el arroyo El Peligro, y en su emisario, el arroyo Tajamar. La condicion taxonomica de los ejemplares recolectados se determino mediante el uso de las claves dicotomicas de Morton (1976), Petetin et al. (1977), Cabrera y Zardini (1978), Orchard (1981) y Boelcke y Vizinis (1987). La caracterizacion de las especies se realizo utilizando el Catalogo de Plantas Vasculares del Conosur (CPVC 2013).
De las especies seleccionadas acorde a su representatividad en el lugar, se recolectaron flores maduras en bolsas de papel, que se etiquetaron, y se aislaron las semillas. Una vez secas, las semillas se lavaron con una mezcla de agua destilada: hipoclorito de sodio 1:1 v/v, durante 5 min, con agitacion constante a 20° C, usando un agitador magnetico para lograr una correcta desinfeccion superficial. Para las especies acuaticas Myriophyllum quitense (Kunth), Ludwigia peploides (H.B.K.) e Hydrocotile ranunculoides (L.) se recolectaron ejemplares que fueron colocados en acuarios de vidrio, debido a que su modo de reproduccion es principalmente por propagacion vegetativa. Por ello, para estas especies no se calculo el poder germinativo de las semillas.
Cálculo del porcentaje de germinación y capacidad de propagación en laboratorio
Se acondicionaron semillas (n= 21) de cada especie en cajas de Petri, con algodon humedo y papel de filtro para su germinacion y posterior obtencion de plantulas, en camara de crecimiento a 22° C, y en oscuridad. El numero y distribucion de las semillas fue uniforme en cada caja con el proposito de estandarizar las condiciones de crecimiento de las plantulas. Luego de 15 dias se cuantifico el numero total de semillas germinadas por especie, evaluando la emergencia de cotiledones y radicula, y el poder germinativo se expreso como porcentaje del total de semillas evaluadas.
Cálculo del índice mitótico y del número cromosómico
Las semillas germinadas fueron transferidas a macetas que contenian como sustrato una mezcla de humus: turba 70:30 p/p aproximadamente, y las plantulas derivadas se cultivaron en invernaculo. Para el calculo del indice mitotico, se seleccionaron entre cinco y ocho plantulas de cada especie, de las que se cosecharon raices de no mas de 1 cm de longitud, las cuales se transfirieron a una solucion mezcla de etanol: acido acetico glacial 3:1 v/v durante 24 h, para la fijacion del tejido. Luego, las raices fijadas se transfirieron a etanol 70 % para su conservacion en heladera a 4° C hasta el procesamiento. La hidrolisis se realizo en una solucion de HCl 1N durante 10 min a 60° C en bano termostatico, luego del lavado de las raices con agua destilada. Las raices hidrolizadas se enjuagaron dos veces con agua destilada y se tineron con solucion de Feulgen (fucsina leucobasica) durante 2 h en oscuridad. Posteriormente, se colocaron en un portaobjetos con una gota de solucion de carmin 1-2 % en acido acetico 45 %. El extremo apical, localizado mediante observacion bajo lupa, fue separado del resto del material con un bisturi y desmenuzado con una varilla de vidrio. Por ultimo se realizo el aplastamiento de la muestra con cubreobjetos sobre portaobjetos (tecnica de squash). Los preparados realizados se observaron mediante microscopia optica, con un microscopio Olympus BH–2. El indice mitotico (IM) fue calculado como el numero de celulas en division mitotica (estadios de profase, metafase, anafase y/o telofase) cada 1.000 celulas observadas y fue expresado en porcentaje.
Para la determinacion del numero cromosomico se seleccionaron entre cinco y ocho plantulas de cada especie y se cosecharon raices de no mas de 1 cm de longitud. Dichas raices se transfirieron a una solucion de 8-hidroxiquinoleina durante 2-4 h, continuandose luego con el mismo procedimiento descripto previamente para el calculo del indice mitotico. El numero cromosomico fue determinado en al menos cinco campos microscopicos en c-mitosis.
RESULTADOS
Entre las especies taxonomicas mas frecuentes en las orillas de la Laguna La Brava se encontraron Cleome titubans (Speg.), Typha latifolia (L.), Ludwigia peploides (H.B.K.), Solanum chenopodioides (Lam.), Myriophyllum quitense (Kunth), Schoenoplectus californicus (C.A. Meyer), Bidens laevis (L.) Hydrocotile ranunculoides (L.), Polygonum persicaria (L.).
En la Tabla 1 se presenta la clasificacion taxonomica, habito de crecimiento y status para cada una de las especies seleccionadas. Las semillas de T. latifolia, S. californicus presentaron poder germinativo menor a 2 %, hecho que dificulto la obtencion de plantulas para realizar el recuento cromosomico y los bioensayos. Sin embargo, para ambas especies se observo que las celulas eran poliploides; aunque no se pudo establecer el numero cromosomico en forma precisa, se estimo que el mismo es mayor a 50. Del mismo modo, las especies L. peploides y H. ranunculoides resultaron ser poliploides, con numeros cromosomicos somaticos mayores a 50 (Tabla 2, Figura 1), teniendo en cuenta que poseen especies estrechamente emparentadas con n=x=8 y n=x= 12 (Raven y Tai, 1979; Murray et al., 2012).
Tabla 1. Clasificación taxonómica, hábito de crecimiento y status de las hidrófitas dulceacuícolas estudiadas

Tabla 2. Características citológicas de las hidrófitas dulceacuícolas estudiadas

n.a.: no analizado. * tomados de Darlington y Wylie (1961), excepto para Hydrocotyle ranunculoides. **Actualmente género Ludwigia.
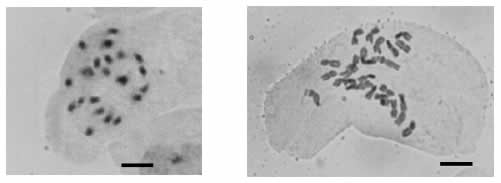
Figura 1. Cromosomas en las hidrófitas Bidens laevis y Solanum chenopodioides. Tamaño de la barra: 5 micrones.
El numero cromosomico somatico de la macrofita acuatica M. quitense fue 2n= 14, pero esta especie no presento un IM apropiado para ser utilizada en el EACAT, ni un numero suficiente de celulas interfasicas para el recuento de micronucleos (MN). Las especies B. laevis, C. titubans, S. chenopodioides y P. persicaria resultaron de facil propagacion, y con un numero cromosomico apropiado para realizar los bioensayos (2n= 24, 2n= 14, 2n= 22 y 24, y 2n= 22, respectivamente) (Figura 1). Cleome titubans y P. persicaria presentaron IM inferiores a 1 % mientras que S. chenopodioides y B. laevis mostraron valores entre 3-12 % (Tabla 2).
DISCUSIÓN
Para estudios de genotoxicidad in situ se ha propuesto transportar la especie terrestre Vicia faba a sitios de contaminacion potencial, por lo que se la haria crecer en ambientes que no son naturales para la especie (Grant y Owens, 2001). Por el contrario, el uso de hidrofitas en el biomonitoreo de contaminantes de ecosistemas acuaticos proporcionaria datos mas ajustados a la realidad que los que puedan obtenerse con las especies modelo terrestres usadas actualmente. Por eso, se plantea la necesidad de identificar especies vegetales vinculadas al medio acuatico que permitan revelar el verdadero impacto de compuestos genotoxicos sobre las poblaciones autoctonas. Ademas, hay que tener en cuenta que las poblaciones de especies introducidas pueden estar adaptadas a toxicos ambientales por lo que los resultados que se obtienen pueden estar alejados de la realidad o ser falsos negativos (Lazutka et al., 2003). En el presente estudio se evaluaron caracteristicas citologicas, habito de crecimiento y clasificacion taxonomica de especies pertenecientes a ecosistemas acuaticos lagunares, identificandose a B. laevis y S. chenopodioides como aquellas que cumplen con los requisitos para su utilizacion en la evaluacion de genotoxicidad de contaminantes acuaticos.
El genero Bidens es muy amplio, ya que contiene alrededor de 240 especies taxonomicas. En Argentina, crecen espontaneamente diez de dichas especies, de las cuales tres estan ampliamente distribuidas en la provincia de Buenos Aires, B. laevis, B. pilosa y B. subalternans (Cabrera y Zardini, 1978). B. laevis es la unica que habita en ecosistemas acuaticos, siendo nativa y representativa de los ambientes lagunares pampasicos. Presenta una amplia distribucion en toda America, desde Estados Unidos de America, Mexico y Colombia hasta Chile, Uruguay y Argentina (Lahitte y Hurrell, 1997). En Argentina, se halla en las provincias de Buenos Aires, Chaco, Cordoba, Corrientes, Entre Rios, Formosa, Jujuy, Misiones, Salta, Santa Fe y San Juan (Cabrera et al., 2000; Saenz y Tombesi, 2003), creciendo comunmente en suelos pantanosos, orillas de rios y arroyos, en esteros y sobre embalsados flotantes, hasta los 500 m sobre el nivel del mar siendo, asimismo, caracteristica de los pajonales de la ribera del Plata (Cabrera y Zardini, 1978; Saenz y Tombesi, 2003). Es una macrofita herbacea perenne que, similarmente a muchas otras plantas palustres o helofitas, durante los meses de invierno conserva solo un tallo subterraneo dentro del sedimento y se hace conspicua a partir de la primavera, floreciendo en el sudeste bonaerense entre enero y mayo, y atravesando luego un periodo de disecacion de la parte emergente en junio-agosto. Por su parte, el genero Solanum es tambien muy amplio, e incluye 243 especies taxonomicas en la Argentina (CPVC, 2013), tanto terrestres como palustres. Dos de ellas, S. tuberosum (papa) y S. lycopersicum (tomate), son de gran importancia para la alimentacion. La especie S. chenopodioides (sinonimo de S. sublobatum Willd) se encuentra en las provincias de Buenos Aires, Cordoba, Entre Rios, Misiones, Rio Negro, Santa Fe y Neuquen en Argentina, asi como en Brasil, Uruguay y Paraguay (CPVC, 2013).
Los ambientes pampasicos donde habitan B. laevis y S. chenopodioides son regiones de intensa actividad agricola, motivo por el cual la llegada de agroquimicos a los cuerpos de agua superficiales por fenomenos de escorrentia, lixiviacion, transporte atmosfericos, entre otros, es un factor crucial que puede determinar la dinamica poblacional de todo el ecosistema acuatico y, en particular, la bioacumulacion de estos compuestos en las macrofitas con los consiguientes efectos adversos.
La evaluacion de aberraciones cromosomicas consume tiempo pero es facilitada por el uso de especies indicadoras que poseen numero bajo de cromosomas de tamano grande, siendo las especies Tradescantia sp., Crepis capillaris, Vicia faba y Allium cepa las que cumplen con este criterio (Uhl et al., 2003). La especie B. laevis ya ha sido utilizada por nuestro grupo de trabajo en bioensayos de genotoxicidad, habiendose demostrado que es una especie de sensibilidad elevada en comparacion con Allium cepa (cebolla) cuando fue expuesta a reconocidos mutagenos como metil metanosulfonato (MMS), ENU y el herbicida HM (Perez et al., 2011). Ademas, esta especie mostro un incremento en la frecuencia de ACAT y cambios en enzimas de estres oxidativo al ser expuesta al insecticida organoclorado endosulfan (Perez et al., 2008; 2011; 2013). Entre las especies mas abundantes en biomasa en las lagunas pampasicas, y por esto las mas representativas, estan S. californicus y M. quitense (Lahitte y Hurrell, 1997). Sin embargo, y con respecto a las caracteristicas analizadas en este trabajo, ambas especies resultaron no ser aptas para ensayos de genotoxicidad debido a que la primera es poliploide y las semillas de la segunda presentan un poder germinativo extremadamente bajo; asimismo, el numero de celulas interfasicas es insuficiente para el recuento de MN posiblemente debido a la presencia de abundante aerenquima en la raiz, por lo que fueron descartadas como posibles especies modelo. Por otra parte, se debe resaltar que en el EACAT utilizando la especie terrestre Allium cepa para la evaluacion de diversos agentes mutagenicos es frecuente observar variaciones amplias en los IM de las muestras de los tratamientos controles (Rank, 2003). Por este motivo, se cuestiona si este indice debe ser utilizado como una medida cuantitativa de la genotoxicidad de los compuestos cuyo efecto se desea caracterizar. Varios autores consideran que solo hay que tenerlo en cuenta para determinar si en las muestras se encontrara la cantidad minima de celulas en division necesarias para llevar a cabo el recuento de celulas en anafase-telofase en el EACAT. Los IM obtenidos en las raices de plantulas de B. laevis y S. chenopodioides se corresponden con los valores recomendados por Rank (2003) (>1 %) para llevar a cabo el EACAT, cumpliendo asi con uno de los requisitos para que estas especies puedan ser utilizadas en analisis de genotoxicidad. Otra caracteristica importante que poseen ambas especies es el numero cromosomico relativamente bajo, lo que es recomendable (Majer et al., 2005), como en Tradescantia paludosa (2n= 24) (Sobham et al., 1991).
La identificacion de especies acuaticas y/o palustres potencialmente utiles para realizar bioensayos de genotoxicidad y/o biomonitoreo in situ en ambientes lagunares es de gran interes para el avance del conocimiento en ecogenotoxicidad, es decir, en la susceptibilidad genotoxica de la flora silvestre en vistas al desarrollo de estrategias para el mantenimiento de la biodiversidad de ciertos biomas. Por otro lado, estos estudios cobran relevancia por su posible uso en ambientes sustentables, disminuyendo el riesgo de la alteracion del equilibrio ante la exposicion a insecticidas propios de las economias agricolas de ciertas zonas de nuestro pais (Mudry com. pers., 2009). En conclusion, entre las especies taxonomicas nativas evaluadas, B. laevis y S. chenopodioides resultaron ser las mas adecuadas para su utilizacion en estudios de genotoxicidad, tanto para el biomonitoreo in situ como para bioensayos.
AGRADECIMIENTOS
Se agradece especialmente a Juan Espinillo por su inmensa ayuda en la determinacion de las caracteristicas citologicas de las especies estudiadas y a Virginia Mancini por su colaboracion en la descripcion de las especies. Este trabajo ha sido financiado por subsidios de UNMDP, PIP 6497 y PIP 112-200-801-02190 de CONICET.
BIBLIOGRAFÍA
1. Alvarez Moya C., Santerre-Lucas A., Zuniga-Gonzalez G., Torres-Burgarin O., Padilla-Camberos E., Feria- Velasco A. (2001) Evaluation of genotoxic activity of maleic hydrazide, ethyl methane sulfonate, and N-nitroso diethylamine in Tradescantia. Salud Publica de Mex. 43: 563-569. [ Links ]
2. Boelcke O., Vizinis A. (1987) Plantas Vasculares de la Argentina nativas y exoticas. Vol II. Casuarinacea a Leguminosas. Ed. Hemisferio Sur S.A. 1er Edicion, pp. 57. [ Links ]
3. Cabrera A.L., Crisci J.V., Deluchi G., Freire S.E., Giuliano D.A., Iharlegui L., Katinas L., Saenz A.A., Sancho G., Urtubey E. (2000) Catalogo ilustrado de las compuestas (= Asteraceae) de la provincia de Buenos Aires, Argentina: sistematica, ecologia y usos, Zavaro, C.A., Buenos Aires, Argentina, pp. 136. [ Links ]
4. Cabrera A.L., Zardini E.M. (1978) Manual de la flora de los alrededores de Buenos Aires. Ed. Acme S.A.C.I. Buenos Aires, Argentina. [ Links ]
5. CPVC: Catalogo de Plantas Vasculares del Conosur (2013) Instituto Darwinion. http://www.darwin.edu.ar/Publicaciones/CatalogoVascII/CatalogoVascII.asp. (Acceso Noviembre de 2013). [ Links ]
6. Constantin M.J., Owens E.T. (1982) Introduction and perspectives of plant genetic and cytogenetic assays. A report of the U.S. Environmental Protection Agency Gene-Tox Program. Mutat. Res. 99:1-12. [ Links ]
7. Darlington C.D., Wylie A.P. (1961) Chromosome atlas of flowering plants. George Allen and Umwin Ltd. London, pp. 519. [ Links ]
8. Ennever F.K., Andreano G., Rosenkranz H.S. (1988) The ability of plant genotoxicity assays to predict carcinogenicity. Mutat. Res. 205: 99-105. [ Links ]
9. Ferrat L., Pergent-Martini C., Romeo M. (2003) Assessment of the use of biomarkers in aquatic plants for the evaluation of environmental quality: application to seagrasses. Aquatic Toxicology 65: 187-204. [ Links ]
10. Fiskesjo G. (1997) Allium test for screening chemicals; evaluation of cytological parameters. In: Wang W., Gorsuch J.W., Hughes J.S. (Eds.) Plants for environmental studies. Chapter 11: Lewis Publishers, NY. [ Links ]
11. Gichner T., Veleminsky J., Pokorny V. (1982) Somatic mutations induced by maleic hydrazide and its potassium and diethanolamine salts in the Tradescantia mutation assay. Mutat. Res. 103: 289-293. [ Links ]
12. Grant W.F., Owens E.T. (2001) Chromosome aberration assays in Pisum for the study of environmental mutagens. Mutat. Res. 88: 93-118. [ Links ]
13. Lahitte H.B., Hurrell J.A. (1997) Plantas hidrofilas de la Isla Martin Garcia (Buenos Aires, Republica Argentina). Serie informe N° 52. CIC Ministerio de la Produccion Provincia Buenos Aires. La Plata, pp 236. [ Links ]
14. Lahitte H.B., Hurrell J.A. (1997) Plantas de la costa. Literature of Latin America (L.O.L.A). Ed. Colin Sharp, Buenos Aires, pp. 200. [ Links ]
15. Lazutka J.R., Stapulionyte A., Bjerketvedt D.K., Odland A. (2003) Seasonal variation in the frequency of abnormal anaphases and mitotic index values in wild populations of herb-Paris (Paris quedrifolia L., Trilliaceae): implications for genetic monitoring. Mutat. Res. 534:113-122. [ Links ]
16. Ma T.H. (1998) The International program on plant bioassays and the report of the followed-up study after the hands-on workshop in China. Mutat. Res. 426: 103-106. [ Links ]
17. Majer B.J., Grummet T., Uhl M., Knasmuller S. (2005) Use of plant bioassays for the detection of genotoxins in the aquatic environment. Acta Hydrochi. Hydrobiol. 33: 45-55. [ Links ]
18. Maluszynska J., Juchimiuk J. (2005) Plant genotoxicity: A molecular cytogenetic approach in plant bioassays. Journal of Plant Genotoxicity 56: 177-184. [ Links ]
19. Morton C.V. (1976) A revision of the Argentine species of Solanum. Ed. Academia Nacional de Ciencias. Cordoba, Argentina, pp. 260. [ Links ]
20. Murray B.G., Heenanb P.B., de Lange P.J. (2012) New chromosome counts in New Zealand species of Hydrocotyle (Apiaceae) New Zealand Journal of Botany, pp. 1-4. [ Links ]
21. Orchard A.E. (1981) A revision of South American Myriophyllum (Haloragaceae), and its repercussions on some Australian and North American species. Brunonia 4: 27-65. [ Links ]
22. Perez D.J., Menone M.L., Camadro E.L., Moreno V.J. (2008) Genotoxicity evaluation of the insecticide endosulfan in the wetland macrophyte Bidens laevis L. Environ. Poll. 153: 695-698. [ Links ]
23. Perez D.J., Lukaszewicz G., Menone M.L., Camadro E.L. (2011) Sensitivity of Bidens laevis L. to mutagenic compounds. Use of chromosomal aberrations as biomarkers of genotoxicity. Environ. Poll. 159: 281- 286. [ Links ]
24. Perez D.J., Lukaszewicz G., Menone M.L., Ame V., Camadro E.L. (2013) Genetic and biochemical biomarkers in the macrophyte Bidens laevis L. exposed to a commercial formulation of endosulfan. Environ. Toxicol. doi:10.1002/tox.21836. [ Links ]
25. Petetin C.A., Molinari E.P., Prego I., Marzocca A. (1977) Clave ilustrada para el reconocimiento de malezas en el campo al estado vegetativo. Ed. Coleccion Cinetica del INTA. Bs. As. Talleres Graficos Marcos Victor Durruty, pp. 243. [ Links ]
26. Rank J. (2003) The method of Allium anaphase-telophase chromosome aberration assay. Vilnius 1: 38-42. [ Links ]
27. Rank J., Lopez L.C., Nielsen N.H., Moretton J. (2002) Genotoxicity of maleic hydrazide, acridine and DEHP in Allium cepa root cells performed by two different laboratories. Hereditas 136: 3-18. [ Links ]
28. Raven P.H., Tai W. (1979) Annals of the Missouri Botanical Garden, 66: 862-879. [ Links ]
29. Saenz A.A., Tombesi T.S. (2003) Nuevas citas de Asteraceae, Tribu Heliantheae. En: Novedades sobre la flora de San Juan (Argentina) II. Hickenia 3, 45: 177-188. [ Links ]
30. Shandu S.S., de Serres F.J., Gopalan H.N.B., Grant W.F., Svendsgaard D., Veleminsky J., Becking G.C. (1994) Results and recommendations. Mutat. Res. 310: 257- 263. [ Links ]
31. Sobhan M.I., Alam S.S., Zaman M.A. (1991) Cytogenetics of commelinaceae in four taxa of Tradescantia. Bangladesh J. Bot. 20: 206. [ Links ]
32. Uhl M., Plewa M.J., Majer B.J., Knasmuller S. (2003) Basic principles of genetic toxicology with an emphasis on plant bioassays, 11-30. En: J. Maluszynska, M. Plewa (Eds.) Bioassays in plant cells for improvement of ecosystem and human health. Wydawnictvo Uniwersytetu Slaskiego. Katowice, pp. 150. [ Links ]
33. Vervliet-Scheebaum M., Knauer K., Maund S.J., Grade R., Wagner E. (2006) Evaluating the necessity of additional aquatic plant testing by comparing the sensitivities of different species. Hydrobiologia 570: 231-236. [ Links ]
34. Wulff A., Andrioli N. (2006) Evaluacion de dano genetico en modelos vegetales. En: Mudry M.D., Carballo M.A. (Eds.) Genetica Toxicologica. Ed. De Los Cuatro Vientos. Buenos Aires, Argentina, pp. 317-337. [ Links ]













