Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
BAG. Journal of basic and applied genetics
versión On-line ISSN 1852-6233
BAG, J. basic appl. genet. vol.26 no.2 Ciudad Autónoma de Buenos Aires dic. 2015
ARTÍCULOS ORIGINALES
Análisis mendeliano de la resistencia/susceptibilidad a un tumor trasplantable de mama en un modelo murino
Mendelian analysis of resistance/susceptibility to a transplantable breast tumor in a murine model
Cáceres J.M.1, Pagura L.1, Di Masso R.J.1,2, Rico M.J.1,3, Rozados V.R.1
1 Instituto de Genética Experimental, Facultad de Ciencias Médicas, Universidad Nacional de Rosario.
2 CIC-UNR.
3 CONICET.
Fecha de recepción: 03/10/2014
Fecha de aceptación de versión final: 04/08/2015
RESUMEN
Se estudió el comportamiento del adenocarcinoma de mama M-406, tumor trasplantable tipo B, semi-diferenciado y triple negativo (ER-, PR-, HER-2-), en las poblaciones de ratones F1 y F2 derivadas del cruzamiento entre las líneas endocriadas CBi (susceptible, toma 100 %, letalidad 100 %) y CBi- (resistente, toma 100 %, regresión 100 %). Los híbridos recíprocos se comportaron ambos como CBi (toma 100 %, letalidad 100 %), poniendo de manifiesto ausencia de efectos maternos. En las combinaciones F2, el tumor creció en forma exponencial en 74,9 % de los animales y fue rechazado en el 25,1 % restante; esta segregación compatible con el carácter autosómico dominante de la susceptibilidad al tumor observado en la F1. El análisis del tiempo de duplicación tumoral en las distintas combinaciones F2 mostró mayor velocidad de crecimiento del tumor en aquella con doble dosis genética CBi (susceptible) de origen materno que en aquella con doble dosis materna CBi- (resistente), respuesta que no se evidenció en las dos combinaciones F2 restantes. Esta respuesta sólo fue observada en hembras lo que permite suponer la existencia de fenómenos epigenéticos vinculados con el sexo del portador del tumor.
Palabras clave: Crecimiento tumoral; Tiempo medio de duplicación; Ratón; Tumores de mama triple negativos.
ABSTRACT
Behavior of breast adenocarcinoma M-406, a type B, semi-differentiated and triple negative (ER, PR-, HER2-) transplantable tumor was studied in the F1 and F2 mice populations derived from crosses between from the inbred lines CBi (susceptible: take 100 %, 100 % lethality) and CBi- (resistant: take 100 %, 100 % regression). Reciprocal hybrids behaved both as CBi (take 100 %, 100 % lethality), revealing the absence of maternal effects. In the F2 combinations, the tumor grew exponentially in 74.9 % of the animals and was rejected in the remaining 25.1 %, a segregation compatible with the autosomal dominant condition of tumor susceptibility observed in the F1. Analysis of tumor doubling time in the various F2 combinations showed a higher growth rate of the tumor when a double genetic load of maternal CBi (susceptible) origin was present in comparison with a double maternal CBi- (resistant) load; this response was not evinced in the remaining two F2 combinations. This response was only observed in females, suggesting the existence of epigenetic phenomena associated with the sex of the tumor carrier.
Key words: Tumor growth; Tumor doubling time; Mice; Triple negative breast cancer.
INTRODUCCIÓN
El cáncer de mama afecta al 10 % de las mujeres en los países industrializados (Szpirer y Szpirer, 2007). En la Argentina, las estadísticas más recientes publicadas por el Instituto Nacional del Cáncer indican que esta patología constituye un problema importante en salud pública, con una estimación de aproximadamente 18.000 nuevos casos cada año lo cual representa el 17,8 % del total de incidencia de cáncer en el país (Viniegra, 2010). El cáncer de mama, al igual que ocurre en otros tipos de cáncer, es una enfermedad heterogénea, multifactorial, que se presenta en varias formas clínicas e histológicas y en la que, dada su condición de fenotipo complejo, se ven involucrados determinantes genéticos y ambientales (Gould, 1995; Leamy et al., 2012), incluyendo estos últimos aspectos tales como la dieta y el estilo de vida (Bradbury y Olopade, 2007). Con respecto a los aspectos genéticos aproximadamente el 10 % de los cánceres de mama pueden explicarse por la presencia de genes de susceptibilidad, la mayoría de los cuales confieren a los portadores un riesgo moderado de contraer la enfermedad (Foulkes, 2008). Si bien se han descrito en seres humanos algunos genes mayores involucrados en la susceptibilidad al cáncer de mama, como es el caso de BRCA (Breast Cancer)1 y BRACA2, aún resta mucho por conocer al respecto. La identificación de estos genes es dificultosa debido, entre otras razones, a su baja penetrancia, al número limitado de individuos por familia y a la heterogeneidad genética existente en las poblaciones humanas (Dahlman et al., 2002). Dada la comprobada proximidad genética entre los ratones y los seres humanos, las líneas endocriadas de estos roedores proveen una herramienta interesante para la identificación de genes involucrados en los patrones de susceptibilidad/ resistencia a diferentes tipos de enfermedades entre las que pueden mencionarse las de origen infeccioso y el cáncer (Bedell et al., 1997). Cientos de genes y loci involucrados en diferentes patologías han sido identificados usando modelos murinos (Bedell et al., 1997) reafirmando la utilidad de los animales de laboratorio en la investigación biológica en general y biomédica en particular. Aún hoy, inmersos como estamos en el paradigma molecular, los modelos animales siguen siendo esenciales para comprender los mecanismos responsables de este tipo de fenotipos complejos como así también para identificar blancos moleculares que puedan ser utilizados tanto en el diagnóstico como en el tratamiento de diferentes enfermedades. En la actualidad, la identificación de los genes y las diferentes vías involucradas en los procesos tumorales han permitido el desarrollo de terapias dirigidas que determinan una mejor respuesta y una mejor calidad de vida de los pacientes (Sawyers, 2004; Collins y Workman, 2006; Workman y de Bono, 2008). La cepa de ratones CBi, generada en el Centro de Biología de la Facultad de Ciencias Médicas de la Universidad Nacional de Rosario mediante cruzamientos en los que participaron animales de las cepas BALB, Rockland, Swiss y NIH, se mantiene en el Instituto de Genética Experimental, como una población de cría libre sujeta a un proceso de endocría por limitación del número de individuos. Esta cepa fue utilizada como población base en un experimento de selección artificial por conformación corporal que dio origen a cuatro líneas: CBi/C, CBi/L, CBi+ y CBi- (Di Masso et al., 1991) las que han fijado distintas combinaciones alélicas como consecuencia de los efectos conjuntos de las respuestas directas y correlacionadas a la selección, de los efectos no direccionales de la endocría y la deriva génica y de la aparición de nuevas mutaciones (Hinrichsen y Di Masso, 2010).
El adenocarcinoma de mama M-406, surgió espontáneamente en el año 1996 en una hembra de la línea CBi y muestra diferente comportamiento en cada una de las líneas derivadas de ésta por selección. Cuando es inoculado en forma subcutánea (s.c.) M-406 crece en forma exponencial en el 100 % de los animales de la línea CBi mientras que comienza su crecimiento pero es finalmente rechazado en el 100 % de los animales de la línea CBi-. La tasa de crecimiento de un tumor es un indicador ampliamente utilizado no sólo con fines pronósticos sino también para cuantificar los efectos terapéuticos de diferentes modalidades de tratamiento (Usuda et al., 1994; Szereday et al., 2002; Chojniak y Younes, 2003; El Sharouni et al., 2003). Las funciones matemáticas representan una poderosa herramienta para modelizar el proceso dinámico del crecimiento tumoral y el tiempo de duplicación (TdT) del volumen de un tumor, es uno de los indicadores empleados para cuantificar dicho crecimiento (Mehrara et al., 2007). Zacarías Fluck et al. (2012) utilizando un modelo de linfoma de células T, demostraron que la expresión de galectina-1 se correlaciona fuertemente, entre otras variables, con el TdT sugiriendo que esta asociación podría ser utilizada como factor pronóstico y en el tratamiento de este tipo de tumores. El objetivo de este trabajo fue caracterizar, mediante un enfoque mendeliano clásico, el patrón hereditario de la interacción huésped-tumor a partir del análisis de los cruzamientos recíprocos entre dos líneas endocriadas de ratón con diferente comportamiento -CBi (susceptible) y CBi- (resistente) ante el desafío con un adenocarcinoma trasplantable de mama y de las cuatro combinaciones F2, utilizando un modelo matemático de crecimiento tumoral.
MATERIALES Y MÉTODOS
Animales
Líneas parentales: Se usaron hembras y machos de las líneas CBi y CBi- mantenidas en el Instituto de Genética Experimental de la Facultad de Ciencias Médicas de la Universidad Nacional de Rosario. CBi es la línea control de un experimento de selección artificial por conformación corporal del que proviene la línea CBi-. Durante la selección ambas poblaciones sufrieron un proceso de endocría por limitación del tamaño poblacional (Falconer y Mackay, 2001). Luego de más de cien generaciones de cría selectiva, momento en el que las líneas presentaban un coeficiente de consanguinidad teórico aproximadamente igual a 1 (F= 0,987), se comenzó a aplicar un sistema regular de endogamia basado en apareamientos hermano con hermano el que se mantuvo por más de treinta generaciones. Filial 1 (F1) y Filial 2 (F2): Para la producción de la F1 se llevaron a cabo los cruzamientos recíprocos entre individuos de las dos líneas endocriadas. Para generar la F2 se usaron machos y hembras de ambos híbridos recíprocos lo que permitió disponer de las cuatro combinaciones posibles entre ambas F1. Los grupos mencionados de detallan en la Tabla I.
Tabla 1. Grupos genéticos utilizados en el análisis mendeliano del patrón hereditario de la resistencia-susceptibilidad frente al desafío con el adenocarcinoma de mama M-406

Todos los animales utilizados provenían de camadas estandarizadas a ocho individuos al nacimiento. A partir del destete fueron criados en grupos de cuatro, en cajas de polipropileno (32 x 24 x 10 cm) provistas de viruta de madera, con una temperatura de 23 ± 1º C, en ciclos de 12 horas luz/oscuridad y recibieron alimento balanceado peletizado Ratón-Ratas (Cargill Laboratory Chow) y agua ad libitum. Los animales fueron tratados según las normas del Canadian Council on Animal Care (Canadian Council of Animal Care, 2007).
Tumor
M-406 es un adenocarcinoma de mama tipo B, semi-diferenciado según la clasificación de Squartini (Squartini y Pingitore, 1994), triple negativo (ER- , PR-, HER-2-) (Rico et al., 2012), espontáneo de la línea endocriada CBi que se mantiene in vivo por pasajes intraperitoneales (i.p.) en su huésped singeneico.
Modelo experimental
Todos los experimentos fueron realizados con aprobación del Comité de Bioética de la Facultad de Ciencias Médicas de la UNR (Proyecto IMED 246. Resolución Nº 1563/2008). El día cero los animales fueron desafiados con trocar en el flanco derecho con tres fragmentos (¡Ö8x105 células) de M-406. El comportamiento del tumor y el estado general de los animales se monitorearon diariamente.
Tamaño tumoral y modelo matemático
Tres veces por semana, a partir del momento en el que el tumor se hizo palpable (día 3-5 post-desafío), se registraron sus diámetros mayor y menor con calibre y se estimó su volumen (V) de acuerdo con la formula [V= (diámetro menor)2 x diámetro mayor x 0,4]. Los pares de valores volumen tumoral - tiempo se ajustaron a un modelo exponencial creciente [Vt= Vi*e^(k*t)], donde Vt es el volumen tumoral (mm3) alcanzado en el tiempo t, Vi es el volumen inicial del tumor (mm3), k es la constante de crecimiento exponencial y t es tiempo (días) transcurrido desde el desafío. A partir de los ajustes individuales se calculó el tiempo medio de duplicación tumoral (TdT) que es función de la tasa de crecimiento exponencial (TdT= 0,69/k).
Análisis estadístico
Para la evaluación de las diferencias entre grupos genéticos se utilizaron las pruebas U de Mann– Whitney o el análisis de la variancia por rangos de Kruskal-Wallis seguido del test de Dunn (GraphPad, version 3.0) según la comparación involucrara dos o más grupos respectivamente. Las diferencias se consideraron estadísticamente significativas si P<0,05.
RESULTADOS
Líneas parentales
CBi y CBi- Ante el desafío con el M-406, ambas líneas parentales, independientemente del sexo, mostraron 100 % de toma. En CBi, el tumor creció exponencialmente en el 100 % de los animales (Figura 1A y 1B) hasta alcanzar el tamaño máximo permitido por las normas éticas. En CBi- el tumor creció inicialmente en todos los animales hasta aproximadamente los días 12 a 16 postdesafío, momento a partir del cual comenzó a regresar espontáneamente siendo totalmente eliminado entre los días 26 a 36 en los machos (Figura 1C) y entre los días 16 a 36 en las hembras (Figura 1D). El volumen tumoral (media aritmética ± EE) en el día 7 fue mayor (P= 0,0504) en los machos (124,3 ± 25,55 mm3) que en las hembras (70,3 ± 14,40 mm3).

Figura 1. Crecimiento del adenocarcinoma de mama M-406 en machos y hembras de las líneas parentales CBi y CBi.
Híbridos Recíprocos (F1A y F1B)
El tumor mostró el 100 % de toma en ambas combinaciones de híbridos F1 y creció exponencialmente en todos los animales hasta alcanzar el tamaño máximo permitido por las normas éticas (Figura 2). No se observaron diferencias significativas en el crecimiento tumoral ni entre las combinaciones híbridas, ni entre sexos para cada combinación.

Figura 2. Crecimiento del adenocarcinoma de mama M-406 en machos y hembras en los híbridos recíprocos.
Combinaciones F2 (F2A, F2B, F2C y F2D)
El tumor mostró 100 % de toma en las cuatro combinaciones F2. Creció exponencialmente en el 75 % de los animales hasta alcanzar el máximo tamaño tumoral permitido por las normas éticas (Figura 3) y regresó espontáneamente en el 25 % restante hasta su eliminación total (Figura 4). El porcentaje de regresión fue mayor en las hembras (33,33 %) que en los machos (10,41 %) (P< 0,0001) (Figura 4).

Figura 3. Crecimiento del adenocarcinoma de mama M-406 en machos y hembras de las cuatro combinaciones F2

Figura 4. Proporción de animales que rechazan el adenocarcinoma de mama M-406 en las cuatro combinaciones F2, discriminados por sexo
Tiempo medio de duplicación tumoral (TdT)
La Tabla 2 resume los valores del tiempo medio de duplicación tumoral en machos y hembras de los diferentes grupos genéticos analizados. No se observaron diferencias entre sexos en los animales de la línea CBi. En CBi- el tumor fue rechazado en todos los animales independientemente del sexo. No se observó efecto significativo del sexo sobre el comportamiento de la variable al considerar a ambas combinaciones F1 en forma conjunta ni al analizar cada híbrido recíproco por separado (Figura 5A). El TdT no mostró diferencias entre sexos cuando se consideraron las cuatro combinaciones F2 como un único grupo. Igual resultado se observó en el caso de las combinaciones F2B y F2C, mientras que en la combinación F2A el TdT fue mayor en las hembras que en los machos (P= 0,0188) (Figura 5B) y en la F2D fue mayor en los machos que en las hembras (P= 0,0407) (Figura 5B1).
Tabla 2. Tiempo medio de duplicación tumoral en las líneas parentales y en las diferentes combinaciones F1 y F2
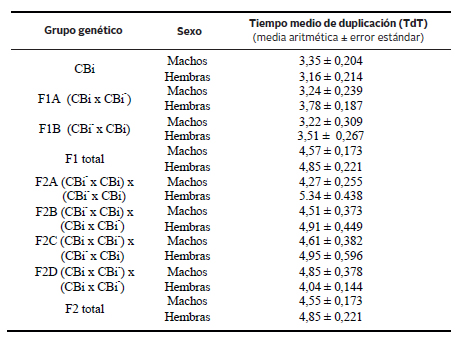

Figura 5. Tiempo medio de duplicación tumoral en la línea parental CBi, en los híbridos recíprocos y en las cuatro combinaciones F2
DISCUSIÓN
El cáncer de mama es una patología de la cual se dispone de abundante información tanto sobre la enfermedad en general como sobre las posibles modalidades de herencia, pero aún queda mucho por dilucidar respecto del papel que juegan los diferentes genes implicados en la susceptibilidad/ resistencia a la misma (Schoeps et al., 2014). La información derivada de la utilización de modelos animales puede ser una herramienta de trascendencia en la medida en que el enfoque genómico comparativo posibilite extrapolar a la población humana los avances en el conocimiento de los genes que controlan el cáncer de mama en dichos modelos (Aitman et al., 2011). Las líneas de ratón utilizadas en este trabajo presentan comportamientos extremos contrastantes frente al desafío con el adenocarcinoma de mama M-406. Mientras en la línea CBi, el adenocarcinoma M-406 crece en forma exponencial en el 100 % de los animales desafiados, en la línea CBi- el mismo es rechazado en el 100 % de los casos, comportamiento que permite considerar a la línea CBi como un fenotipo susceptible y a la línea CBi- como un fenotipo resistente. La respuesta de los híbridos recíprocos, similar a la observada en la línea parental CBi, junto con la segregación del carácter en la F2 permite concluir que, aún admitiendo una base poligénica para los fenómenos de susceptibilidad y resistencia involucrados en este modelo, la línea CBi sería portadora de alelos de susceptibilidad, en tanto posibilitan el crecimiento de M-406, mientras que la línea CBi- portaría alelos de resistencia cuya expresión llevan al rechazo tumoral. La respuesta observada es compatible con el comportamiento de la resistencia/susceptibilidad como un carácter umbral, hipótesis formulada recientemente para explicar la respuesta de la línea CBi/L derivada del mismo experimento de selección, frente al desafío con el mismo tumor (Pagura et al., 2014). La constatación de una F2 segregante abre la posibilidad futura de identificar regiones cromosómicas (QTL) vinculadas con el crecimiento o el rechazo de este tumor, que teniendo en cuenta la proximidad genética entre los seres humanos y el ratón, podría en un futuro permitir el rastreo de regiones similares en seres humanos (Bedell et al., 1997). Mediante estrategias de este tipo, a partir de cruzamientos entre ratones BALB/C susceptibles y C57BL/6 resistentes al desarrollo de tumores mamarios espontáneos, se identificó el gen Dmbt1 involucrado en la defensa inmune contra tumores (Blackburn et al., 2007) y los loci Mtsm1, dominantes en la línea BALB/ cJ, ligados al proceso de tumorigénesis (Koch et al., 2007). Asimismo, en un modelo de carcinogénesis inducida en el que se cruzaron ratas Wistar Furth susceptibles con ratas Copenhague resistentes, se identificaron en estas últimas los loci MCS2 y MCS3 que interactúan de manera aditiva en la supresión del desarrollo de tumores mamarios y el locus MCS4 que actúa aumentando el número de carcinomas, lo que sugiere una base poligénica para la susceptibilidad a la carcinogénesis inducida en estas líneas. Coincidentemente, un polimorfismo humano homólogo a la región rata MCS4 se asocia con un mayor riesgo de cáncer de mama en las mujeres afroamericanas (Shepel et al., 1998). A diferencia de lo observado en humanos, especie en la cual la incidencia de carcinomas mamarios en hombres es de alrededor del 0,6 % de todos los carcinomas mamarios y menor del 1 % de todas las enfermedades malignas de los varones (Giordano et al., 2004; Reiner y Badve, 2012), al discriminar por sexo la susceptibilidad/ resistencia en la F2, se observó que la proporción de individuos que rechazaron el tumor fue significativamente mayor en las hembras que en los machos (33,3 % versus 10,4 %; P<0,0001). La modelización matemática del comportamiento dinámico del volumen tumoral en función del tiempo transcurrido desde el desafío permitió disponer de una nueva variable de utilidad para la caracterización propuesta. Mehrara sugirió la posibilidad de utilizar el tiempo medio de duplicación (TdT) como un indicador del crecimiento tumoral (Mehrara et al., 2007). En este modelo el análisis de los TdT en la línea CBi y en los híbridos recíprocos no mostró diferencias significativas ni dimorfismo sexual, probablemente debido a la ausencia en el tumor de receptores hormonales (Rico et al., 2012). Si bien los resultados observados en las líneas parentales y en las F1 sugieren que los genes involucrados en la susceptibilidad/resistencia al M-406 serían autosómicos y no estarían influenciados en su expresión por el sexo ni por fenómenos epigenéticos de impronta, el análisis de los TdT en las distintas combinaciones de la F2 permitió hipotetizar cierta vinculación con los genotipos maternos, dado que la doble carga genética de origen materno CBi (susceptible) en la F2D o CBi- (resistente) en la F2A se tradujo en una mayor o menor velocidad de crecimiento tumoral respectivamente, respuesta no evidenciada en las dos combinaciones (F2B y F2C) restantes. Esta respuesta diferencial sólo fue observada en hembras [F2A>F2D (P=0,019)] hecho que permite especular acerca de la existencia de fenómenos epigenéticos relacionados con el sexo del portador del tumor.
Se puede concluir que en este modelo el proceso de selección artificial junto con la acción de procesos simultáneos de deriva y/o mutación genética, han generado diferencias determinantes de los fenotipos de susceptibilidad y resistencia ante el desafío con este adenocarcinoma trasplantable de mama, triple negativo. Los estudios realizados aplicando la metodología mendeliana clásica, indican que el fenotipo susceptible es dominante frente al resistente y están asociados a procesos epigenéticos.
En un reciente editorial de la revista Nature (Anonymous, 2014) a la vez que se remarca la utilidad de los ratones knock-out como herramientas para la comprensión de las alteraciones a nivel celular que tienen lugar en procesos patológicos tales como el cáncer o la enfermedad de Alzheimer, también se mencionan las limitaciones de este enfoque. En este sentido se enfatiza que considerar que la manipulación de un gen o dos puede reproducir la complejidad de una enfermedad multifactorial en una especie diferente es una de las razones por las cuales las terapias que “curan” a los ratones mutantes luego fracasan en la clínica y llevan al descrédito al modelo en cuestión. De acuerdo con Balling (2007) la modelización del comportamiento de los sistemas biológicos complejos representa un desafío para la biología actual. Dado que la identificación de sus componentes mediante las tecnologías “ómicas” constituye una estrategia insuficiente para ello, este autor propone hacer uso de un enfoque sistémico que informe respecto de la arquitectura de las redes involucradas. El conocimiento de la dinámica de esa estructura de redes requiere perturbarla para, posteriormente, poder caracterizar fenotípicamente los cambios producidos. La selección artificial constituye una antigua pero aún vigente estrategia de perturbación de los sistemas biológicos. El grupo de líneas de ratón CBi producto de un proceso selectivo a largo plazo han sido reconocidas como un recurso de utilidad para el estudio sistémico de diversos fenotipos complejos (Di Masso et al., 2007; Vasconi et al., 2008; Di Masso et al., 2010). La resistencia/susceptibilidad ante el desafío con un tumor trasplantable de mama representa un ejemplo más en este sentido.
BIBLIOGRAFÍA
1. Aitman T.J., Boone C., Churchill G.A., Hengartner M.O., Mackay T.F., Stemple D.L. (2011) The future of model organisms in human disease research. Nat. Rev. Genet. 12: 575-582. [ Links ]
2. Anonymous (2014) Still much to learn about mice. Nature 509: 399. [ Links ]
3. Balling R. (2007) From mouse genetics to systems biology. Mamm. Genome 18: 383-388. [ Links ]
4. Bedell M.A., Jenkins N.A., Copeland N.G. (1997) Mouse models of human disease. Part I: techniques and resources for genetic analysis in mice. Genes and development. 11: 1-10. [ Links ]
5. Blackburn A.C., Hill L.Z., Roberts A.L., Wang J., Aud D., Jung J., Nikolcheva T., Allard J., Peltz G., Otis C.N., Cao Q.J., Ricketts R.S., Naber S.P., Mollenhauer J., Poustka A., Malamud D., Jerry D.J. (2007) Genetic mapping in mice identifies DMBT1 as a candidate modifier of mammary tumors and breast cancer risk. Am. J. Pathol. 170: 2030- 2041. [ Links ]
6. Bradbury A.R., Olopade O.I. (2007) Genetic susceptibility to breast cancer. Rev. Endocr. Metab. Disord. 8: 255-267. [ Links ]
7. Canadian Council of Animal Care (2007) Guidelines on procurement of animals used in science Ottawa, Canada, CCAC. [ Links ]
8. Chojniak R., Younes R.N. (2003) Pulmonary metastases tumor doubling time: assessment by computed tomography. Am. J. Clin. Oncol. 26: 374-377. [ Links ]
9. Collins I., Workman P. (2006) New approaches to molecular cancer therapeutics. Nat. Chem. Biol. 2: 689-700. [ Links ]
10. Dahlman I., Eaves I.A., Kosoy R., Morrison V.A., Heward J., Gough S.C., Allahabadia A., Franklyn J.A., Tuomilehto J., Tuomilehto-Wolf E., Cucca F., Guja C., Ionescu- Tirgoviste C., Stevens H., Carr P., Nutland S., McKinney P., Shield J.P., Wang W., Cordell H.J., Walker N., Todd J.A., Concannon P. (2002) Parameters for reliable results in genetic association studies in common disease. Nat. Genet. 30: 149-150. [ Links ]
11. Di Masso R.J., Abdala S.B., Sánchez S.M., Font M.T. (1991) Respuesta a la selección divergente por conformación corporal en el ratón. Mendeliana 9: 79-82. [ Links ]
12. Di Masso R.J., Pippa C., Silva P.S., Font M.T. (2010) Componentes principales como fenotipos de sistemas biológicos complejos. Relación músculo-hueso en el ratón (Mus musculus). BAG J. Basic Appl. Genet. 21: 10. [ Links ]
13. Di Masso R.J., Zerpa C.M., Silva P.S., Font M.T. (2007) Femoral morphometry and femur length in mice selected for different body conformations. A potential animal model suitable for QTLs mapping. Arch. Tierz. 50: 10. [ Links ]
14. El Sharouni S.Y., Kal H.B., Battermann J.J. (2003) Accelerated regrowth of non-small-cell lung tumours after induction chemotherapy. Br. J. Cancer 89: 2184-2189. [ Links ]
15. Falconer D.S., Mackay T.F.C. (2001) Introducción a la Genética Cuantitativa. Acribia Editorial, Zaragoza, España. [ Links ]
16. Foulkes W.D. (2008) Inherited susceptibility to common cancers. N. Engl. J. Med. 359: 2143-2153. [ Links ]
17. Giordano S.H., Cohen D.S., Buzdar A.U., Perkins G., Hortobagyi G.N. (2004) Breast carcinoma in men: a population-based study. Cancer 101: 51-57. [ Links ]
18. Gould M.N. (1995) Rodent models for the study of etiology, prevention and treatment of breast cancer. Semin. Cancer Biol. 6: 147-152. [ Links ]
19. Hinrichsen L.I., Di Masso R.J. (2010) Empleo de un modelo murino original de Argentina en la caracterización de fenotipos complejos. BAG J. Basic Appl. Genet. 21: 7-19. [ Links ]
20. Koch J.G., Gu X., Han Y., El-Naggar A.K., Olson M.V., Medina D., Jerry D.J., Blackburn A.C., Peltz G., Amos C.I., Lozano G. (2007) Mammary tumor modifiers in BALB/cJ mice heterozygous for p53. Mamm. Genome 18: 300-309. [ Links ]
21. Leamy L.J., Gordon R.R., Pomp D. (2012) Epistatic Control of Mammary Cancer Susceptibility in Mice may Depend on the Dietary Environment. Hereditary Genet. 1: 108. [ Links ]
22. Mehrara E., Forssell-Aronsson E., Ahlman H., Bernhardt P. (2007) Specific growth rate versus doubling time for quantitative characterization of tumor growth rate. Cancer Res. 67: 3970-3975. [ Links ]
23. Pagura L., Caceres J.M., Cardinale A., Scharovsky O.G., Di Masso R.J., Zacarias-Fluck M.F., Rico M.J., Rozados V.R. (2014) A mammary adenocarcinoma murine model suitable for the study of cancer immunoediting. J. Biomed. Sci. 21: 52. [ Links ]
24. Reiner A., Badve S. (2012) Carcinoma of the male breast. IARC Press. [ Links ]
25. Rico M.J., Roggero E.A., Scharovsky O.G., Di Masso R.J., Rozados V.R. (2012) Avances en la caracterización de un modelo murino de cáncer de mama a partir del estudio de los receptores de progesterona, estrógenos y Her2/neu. Jornadas de Divulgación técnico-científica, Casilda, Santa Fe, UNR editora. [ Links ]
26. Sawyers C. (2004) Targeted cancer therapy. Nature 432: 294- 297. [ Links ]
27. Schoeps A., Rudolph A., Seibold P., Dunning A.M., Milne R.L., Bojesen S.E., Swerdlow A., Andrulis I., Brenner H., Behrens S., Orr N., Jones M., Ashworth A., Li J., Cramp H., Connley D., Czene K., Darabi H., Chanock S.J., Lissowska J., Figueroa J.D., Knight J., Glendon G., Mulligan A.M., Dumont M., Severi G., Baglietto L., Olson J., Vachon C., Purrington K., Moisse M., Neven P., Wildiers H., Spurdle A., Kosma V.M., Kataja V., Hartikainen J.M., Hamann U., Ko Y.D., Dieffenbach A.K., Arndt V., Stegmaier C., Malats N., Arias Perez J.I., Benitez J., Flyger H., Nordestgaard B.G., Truong T., Cordina-Duverger E., Menegaux F., dos Santos Silva I., Fletcher O., Johnson N., Haberle L., Beckmann M.W., Ekici A.B., Braaf L., Atsma F., van den Broek A.J., Makalic E., Schmidt D.F., Southey M.C., Cox A., Simard J., Giles G.G., Lambrechts D., Mannermaa A., Brauch H., Guenel P., Peto J., Fasching P.A., Hopper J., Flesch-Janys D., Couch F., Chenevix-Trench G., Pharoah P.D., Garcia-Closas M., Schmidt M.K., Hall P., Easton D.F., Chang-Claude J. (2014) Identification of new genetic susceptibility loci for breast cancer through consideration of gene-environment interactions. Genet. Epidemiol. 38: 84-93. [ Links ]
28. Shepel L.A., Lan H., Haag J.D., Brasic G.M., Gheen M.E., Simon J.S., Hoff P., Newton M.A., Gould M.N. (1998) Genetic identification of multiple loci that control breast cancer susceptibility in the rat. Genetics 149: 289-299. [ Links ]
29. Squartini F., Pingitore R. (1994) Tumours of the mammary gland. IARC scientific publications, pp. 47-100. [ Links ]
30. Szereday Z., Schally A.V., Nagy A., Plonowski A., Bajo A.M., Halmos G., Szepeshazi K., Groot K. (2002) Effective treatment of experimental U-87MG human glioblastoma in nude mice with a targeted cytotoxic bombesin analogue, AN-215. Br. J. Cancer 86: 1322-1327. [ Links ]
31. Szpirer C., Szpirer J. (2007) Mammary cancer susceptibility: human genes and rodent models. Mamm. Genome 18: 817-831. [ Links ]
32. Usuda K., Saito Y., Sagawa M., Sato M., Kanma K., Takahashi S., Endo C., Chen Y., Sakurada A., Fujimura S. (1994) Tumor doubling time and prognostic assessment of patients with primary lung cancer. Cancer 74: 2239-2244. [ Links ]
33. Vasconi M.D., Malfante P., Bassi A., Giudici C., Revelli S., Di Masso R., Font M.T., Hinrichsen L. (2008) Phenotypic differences on the outcome of the host-parasite relationship: behavior of mice of the CBi stock in natural and experimental infections. Vet. Parasitol. 153: 157-163.
34. Viniegra M. Cáncer de mama en Argentina : organización, cobertura y calidad de las acciones de prevención y control (2010) http://www.msal.gov.ar/inc (accessed mayo 2014). [ Links ]
35. Workman P., de Bono J. (2008) Targeted therapeutics for cancer treatment: major progress towards personalised molecular medicine. Curr. Opin. Pharmacol. 8: 359-362. [ Links ]
36. Zacarias Fluck M.F., Hess L., Salatino M., Croci D.O., Stupirski J.C., Di Masso R.J., Roggero E., Rabinovich G.A., Scharovsky O.G. (2012) The aggressiveness of murine lymphomas selected in vivo by growth rate correlates with galectin-1 expression and response to cyclophosphamide. Cancer Immunol. Immunother. 61: 469-480. [ Links ]














