Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Multequina
On-line version ISSN 1852-7329
Multequina vol.21 no.1 Mendoza Jan./June 2012
ARTÍCULO ORIGINAL
Ecología térmica de la lagartija endémica Liolaemus eleodori (Iguania: Liolaemidae) en el Parque Nacional San Guillermo, San Juan, Argentina
Thermal ecology of the endemic lizard Liolaemus eleodori (Iguania: Liolaemidae) in National Park San Guillermo, San Juan, Argentina
Héctor J. Villavicencio1, Juan C. Acosta1, Graciela M. Blanco1 y José A. Marinero1
1Departamento de Biología, Facultad de Ciencias Exactas, Físicas y Naturales, Universidad Nacional de San Juan. Argentina. <hjvillavicencio@gmail.com>
Resumen
La ecología térmica de la lagartija endémica Liolaemus eleodori fue estudiada en el Parque Nacional San Guillermo, provincia de San Juan, Argentina. Los datos fueron colectados durante diciembre de 2004 y febrero de 2005. Se registró la temperatura cloacal (Tb), substrato (Ts) y aire (Ta), con un termómetro de lectura rápida. Liolaemus eleodori presentó una estrategia termorregulatoria de tipo termoconformista con un patrón de actividad de tipo unimodal y uso preferencial del microhábitat suelo desnudo (desprovisto completamente de vegetación). Nuestros datos sugieren que la estrategia termorregulatoria, el uso del espacio y el tiempo están estrechamente relaciondos con las condiciones climáticas rigurosas del sitio de estudio.
Palabras clave: Altoandino; Clima; Termorregulación
Summary
The thermal ecology of the endemic lizard Liolaemus eleodori was studied at the San Guillermo National Park, Province of San Juan, Argentina. Data were collected during December 2004 and February 2005. Cloacal (Tc), substrate (Ts) and air (Ta) temperatures were registered using a quick reading thermometer. Liolaemus eleodori exhibited a thermo-conformist thermoregulatory strategy with a unimodal pattern of activity, showing a marked preference for a naked ground microhabitat (completely free of vegetation). Our data suggest that the thermoregulatory strategy and use of space and time is strictly related to the harsh climatic conditions of the study site.
Key words: Climate; High Andes; Thermoregulation
Introducción
La temperatura corporal es la variable ecofisiológica más influyente en el funcionamiento de ectotermos, ya que afecta directamente su adecuación biológica a través del efecto en el desempeño de la locomoción, habilidad de caza, funciones inmunológicas, tasas de forrajeo, crecimiento y metabolismo (Espinoza & Tracy, 1997; Angilletta et al., 2002, Labra & Vidal, 2003; Clarke, 2006; Labra et al., 2008).
Por ser animales ectotérmicos la temperatura corporal de las lagartijas varía directamente con las temperaturas del ambiente. Los termogeneralistas, definidos como las especies que pueden ganar energía en amplios rangos de temperatura corporal, muestran un gran cambio en la temperatura corporal y una alta dependencia de las temperaturas ambientales, a diferencia de los especialistas, que mantienen su temperatura corporal alrededor de un valor determinado y presentan menos ajuste con las temperaturas ambientales (Huey & Slatkin, 1976).
El comportamiento juega un rol fundamental en el mantenimiento de la temperatura corporal de las pequeñas lagartijas, siendo la alternancia entre microhábitats de distinta oferta térmica, uso diferencial del tiempo de actividad y cambios en la postura corporal los principales mecanismos de ajuste termorregulatorio (Bennett, 1980; Halloy & Laurent 1987; Espinoza & Tracy, 1997; Pough et al., 2001; Smith & Ballinger, 2001; Martori et al., 2002; Zug et al., 2003; Labra & Vidal, 2003; Labra et al., 2008). Inclusive, se ha propuesto que la conducta puede reducir e inhibir las presiones selectivas impuestas por la rigurosidad ambiental, actuando como un factor evolutivo inercial y siendo la responsable de la fisiología térmica de tipo conservativa (Huey et al., 2003).
Liolaemus eleodori es una especie endémica del Parque Nacional San Guillermo (Acosta et al., 2007) categorizada como especie insuficientemente conocida (Lavilla et al., 2000). La única información ecológica con la que se cuenta es la realizada al momento de la descripción (Cei et al., 1983) y la confirmación del modo reproductivo vivíparo de la especie (Cabrera & Monguillot, 2007).
El objetivo de esta investigación es determinar: a) la temperatura corporal de campo y su rango de variación; b) la estrategia termorregulatoria; c) el patrón de actividad; y d) el microhábitat más utilizado por Liolaemus eleodori.
Material y método
El estudio se realizó en el Parque Nacional San Guillermo, San Juan, Argentina (29º 20' S, 69º 17' W, 3500 m) en la región de Los Llanos. Esta es un área de clima frío y árido, elevada heliofanía, temperatura media anual de 6.7 ºC, temperaturas máximas y mínimas absolutas de 27 ºC y -23 ºC, precipitación media anual de 150 mm, con vientos frecuentes de 10 km/h (Salvioli, 2007).
La región fitogeográfica se caracteriza por una estepa de arbustos bajos y escasa cobertura de Maihueniopsis ovata, Adesmia nanolignea, Lycium chanar y gramíneas de los géneros Stipa y Jarava (Martínez Carretero et al., 2007). Otros reptiles comunes en la región son Pristidactylus scapulatus, Liolaemus parvus y Phymaturus punae (Acosta et al., 2007).
La recolección de los datos se realizó durante diciembre de 2004 (del 5 al 10) y febrero de 2005 (del 5 al 12). Se buscaron sistemáticamente las lagartijas a lo largo de transectas revisando arbustos y áreas desprovistas de vegetación (Tellería, 1986), desde las 8:00 hasta las 20:00 horas. Cada individuo fue capturado manualmente. La temperatura corporal (Tc), del sustrato (Ts) y del aire (Ta) fueron medidas con un termómetro de lectura rápida Miller & Weber (precisión 0.1 ºC). Para cada individuo capturado se registró la Ts en el punto exacto donde se lo observó por contacto del bulbo con el sustrato, y la Ta a 1 cm sobre el sustrato. Para cada animal se registró también: a) la hora de observación (para determinar el patrón de actividad), b) el microhábitat donde se lo observó como también la condición de radiación del microhábitat (completamente soleado, sombra, o sol filtrado). No se encontraron diferencias estadísticas entre fechas (diciembre vs. febrero) por lo que los datos se agruparon para los análisis. Los análisis estadísticos fueron realizados con Statistica 7.0 (2004). Las pruebas estadísticas se realizaron con análisis no paramétrico debido a la ausencia de normalidad de los datos con los que se trabajó. El nivel de significación de los análisis fue de 0,05.
Resultados
Liolaemus eleodori presenta Tc media de 30.2 ºC y un rango de variación de 12 ºC (Tabla 1).
Tabla 1. Temperatura corporal de campo (Tc), temperatura del aire (Ta) y temperatura sustrato (Ts) de Liolaemus eleodori. DS= desviación estándar; N= número de mediciones realizadas
Table 1. Activity field temperature (Tc), air temperature (Ta) and substrate temperature (Ts) of Liolaemus eleodori. DS= standard desviation; N= number of measurements taken

La temperatura corporal de campo se relacionó significativamente con las temperaturas microambientales (Rangos de Spearman, rs tc-ta= 0.49, p = 0.0001, n = 55; rs tc-ts= 0.56, p = 0.000008, n = 55, Figura 1).
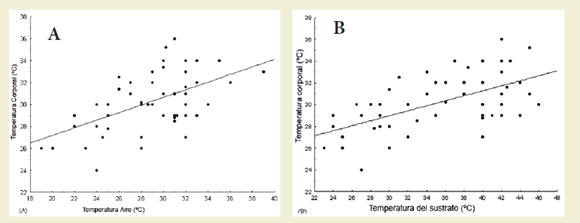
Figura 1. Temperatura corporal de Liolaemus eleodori versus la temperatura del aire (A) y la temperatura del sustrato (B)
Figure 1. Body temperature of Liolaemus eleodori versus air temperature (A) and substrate temperature (B)
Liolaemus eleodori mostró un patrón de actividad unimodal permaneciendo activo de 10 a 18 hs (Figura 2).
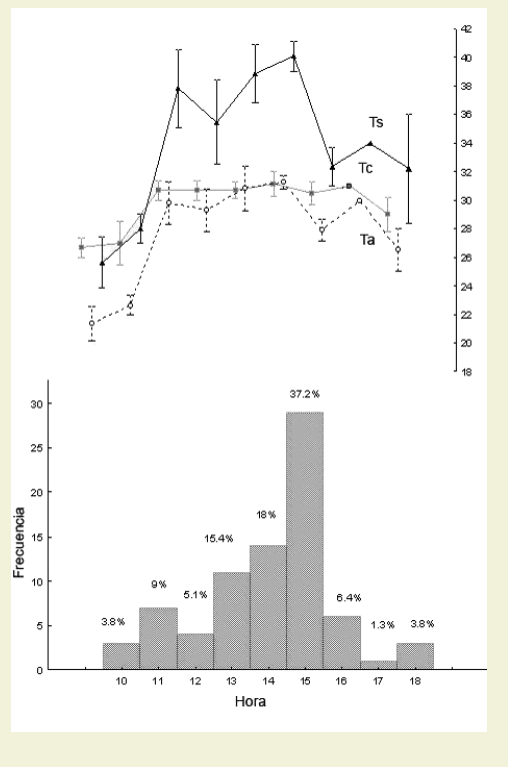
Figura 2. Patrón de actividad diario de Liolaemus eleodori (n= 78). El porcentaje de actividad es indicado por hora. Se indica también las medias de temperaturas microambientales en relación a las horas de actividad, los bigotes indican el error estándar
Figure 2. Daily activity patterns of Liolaemus eleodori (n= 78). The activity percentage is indicated per hour. It is also indicated the means temperatures micro environmental according to the hour of activity, the whiskers indicate the standard error
Las lagartijas fueron observadas predominantemente en el suelo desnudo (X2 = 23,12, df = 1, p = 0,000002, n =50), solo una baja proporción (8/50) fue observada bajo arbustos a la sombra.
Discusión
Liolaemus eleodori presenta temperaturas corporales similares a las registradas para otras especies de Liolaemus, de regiones templadas y frías (Labra et al., 2008). Éste es un fenómeno común en especies de un mismo género, independientemente de las características del hábitat que ocupen (Bogert, 1949; Marquet et al., 1989; Andrews, 1998; Carothers et al., 1998) lo que sugiere que la biología térmica de lagartijas es evolutivamente estable (Navas, 2003; Labra et al., 2008). Hertz et al. (1983) plantean que la biología térmica podría ser de tipo conservativa o lábil en función de su repuesta a las presiones selectivas. La evidencia para el género es controvertida y existe información que apoya ambas posturas (Labra & Vidal, 2003; Navas, 2003; Labra et al., 2008; Rodríguez Serrano et al., 2009).
Liolaemus eleodori es altamente dependiente de las temperaturas microambientales comportándose como un termoconformista. Esta estrategia es frecuente en ambientes con poca disponibilidad de recursos térmicos (Huey & Slatkin, 1976; Villavicencio et al., 2007) como el Parque Nacional San Guillermo.
Los estudios de termobiología realizados en Liolaemus jamesi y L. alticolor (Marquet et al., 1989), L. elongatus, Phymaturus patagonicus (Ibargüengoytía, 2005), L. sanjuanensis (Acosta et al., 2004), Phymaturus punae y P. tenebrosus (Ibargüengoytía et al., 2008) presentan evidencias de que las lagartijas de climas fríos son mejores termorreguladoras que las de climas templados. Sin embargo, L. eleodori muestra una alta dependencia térmica del ambiente al igual que Phymaturus zapalensis (Ibargüengoytía et al., 2008).
Liolaemus eleodori presenta un patrón de actividad unimodal, con máxima actividad en horas de mayor temperatura diaria. Esta estrategia se ha observado en L. alticolor y L. jamesi (Marquet et al., 1989), también de climas fríos. Esto sugiere una fuerte restricción del ambiente térmico sobre el tiempo de actividad de L. eleodori.
Liolaemus eleodori fue encontrado casi exclusivamente utilizando el suelo desnudo, por lo que se podría considerar como una especie microhábitat-especialista. La alta permanencia de esta lagartija al sol sugiere que la ganancia térmica por radiación representa una vía de ganancia calórica fundamental para el mantenimiento de la temperatura corporal.
En síntesis, los resultados sugieren que las condiciones climáticas rigurosas del Parque Nacional San Guillermo, pueden ser moduladas o amortiguadas en Liolaemus eleodori, mediante la selección de microhábitats con alta radiación solar, y permaneciendo activo en los horarios de mayor temperatura ambiental diaria.
Agradecimientos
Agradecemos a A. Carrizo, A. Montáñez, (Parque Nacional San Guillermo) y a D. Recabarren y M . Jordán (Subsecretaría de Medio Ambiente de la Provincia de San Juan) por la logística y asistencia en el campo. A los revisores anónimos que contribuyeron a mejorar sustancialmente el manuscrito inicial. Este trabajo fue parcialmente financiado por la Universidad Nacional de San Juan CICITCA- 21E/633.
Bibliografía
1. ACOSTA, J. C., R. BUFF, P. GÓMEZ & J. MARINERO, 2004. Liolaemus sanjuanensis (NCN). Body temperature. Natural History Notes. Herpetological Review 35(2): 171. [ Links ]
2. ACOSTA. J.C., H.J. VILLAVICENCIO & J.A. MARINERO, 2007. Anfibios y Reptiles. Biodiversidad, bio-ecología y especies de valor especial para monitoreo. En: E. Martínez Carretero (ed). Diversidad biológica y cultural de los altos Andes Centrales de Argentina - Línea de Base de la Reserva de Biosfera San Guillermo-San Juan. Editorial Fundación Universidad Nacional de San Juan. 283 pp. [ Links ]
3. ANDREWS, R.M., 1998. Geographic variation in field body temperature of Sceloporus lizards. Journal of Thermal Biology 23(6): 329-334. [ Links ]
4. ANGILLETTA, M.J., P.H. NIEWIAROWSKI & C.A. NAVAS, 2002. The evolution of thermal physiology in ectotherms. Journal of Thermal Biology 27: 249-268. [ Links ]
5. BENNETT, A.F., 1980. The thermal dependence of lizards behavior. Animal Behavior 28: 752-762. [ Links ]
6. BOGERT, C.M., 1949. Thermoregulation in reptiles. A factor in evolution. Evolution 3: 195-211. [ Links ]
7. CABRERA, R.A. & J. MONGUILLOT, 2007. Liolaemus eleodori (San Guillermo's lizard): Reproduction. Herpetological Bulletin 101: 34-35. [ Links ]
8. CAROTHERS, J. H., P.A. MARQUET & F.M. JAKSIC, 1998. Thermal ecology of a Liolaemus lizard assemblage along an Andean altitudinal gradient in Chile. Revista Chilena de Historia Natural 71: 39-50. [ Links ]
9. CEI, J.M., R. ETHERIDGE & F. VIDELA, 1983. Especies nuevas de Iguánidos del noroeste de la provincia de San Juan (Reserva Provincial San Guillermo), Argentina. Deserta 7: 316-323. [ Links ]
10. CLARKE, A., 2006. Temperature and metabolic theory of ecology. Functional Ecology 20: 405-412. [ Links ]
11. ESPINOZA, R.E. & C.R. TRACY, 1997. Thermal biology, metabolism, and hibernation. In: L. J. Ackerman (ed). The Biology, Husbandry and Health Care of Reptiles. Biology of Reptiles 1: 149-184. TFH Publications, Neptune City, N.J. [ Links ]
12. HALLOY, S. & R. LAURENT, 1987. Notes éco-ethologiques sur Liolaemus huacahuasicus Laurent (Iguanidae) du nord-Onest argentin. Revue Francaise de I`Aquariologie 14: 137-144. [ Links ]
13. HERTZ, P. E., R.B. HUEY & E. NEVO, 1983. Homage to Santa Anita: Thermal sensitivity of sprint speed in agamid lizards. Evolution 37: 1075-1084. [ Links ]
14. HUEY, R.B. & M. SLATKIN, 1976. Cost and benefits of lizards thermoregulation. The Quarterly Review of Biology 51(3): 363- 384. [ Links ]
15. HUEY, R. B., P. E. HERTZ & B. SINERVO, 2003. Behavioral drive versus behavioral inertial in evolution: A null model approach. American Naturalist 161: 357- 366. [ Links ]
16. IBARGüENGOYTÍA, N. R., 2005. Field, selected body temperature and thermal tolerance of the syntopic lizards Phymaturus patagonicus and Liolaemus elongatus (Iguania: Liolaemidae). Journal of Arid Environments 62:435-448. [ Links ]
17. IBARGüENGOYTÍA N. R., J.C. ACOSTA, J.M. BORETTO, H.J. VILLAVICENCIO, J.A. MARINERO & J.D. KRENZ, 2008. Thermal biology of Phymaturus lizards: comparisons from the Andes to the Patagonian steppe in Argentina. Journal of Arid Environments 72: 1620-1630. [ Links ]
18. LABRA, A. & M. VIDAL, 2003. Termorregulación en reptiles: Un pasado veloz y un futuro lento. En: F. Bozinovic (ed). Fisiología Ecológica y Evolutiva. Teoría y casos de estudios en animales. Universidad Católica de Chile. Santiago, Chile. 531 pp. [ Links ]
19. LABRA, A., M. VIDAL, R. SOLIS, & M. PENNA, 2008. Ecofisiología de Anfibios y reptiles. En: M. A. Vidal and A. Labra (eds). Herpetología de Chile. Science Verlag. Santiago, Chile. 583 pp. [ Links ]
20. LAVILLA, E.O., E. RICHARD & G.J. SCROCCHI, 2000. Categorización de los anfibios y reptiles de la República Argentina. Asociación Herpetológica Argentina. 97 pp. [ Links ]
21. MARQUET, P. A., J. C. ORTÍZ, F. BOZINOVIC & F.M. JAKSIC, 1989. Ecological aspects of thermoregulation at high altitudes: the case of Andean Liolaemus lizards in northen Chile. Oecologia 81: 16-10. [ Links ]
22. MARTÍNEZ CARRETERO, E., A. DALMASSO, J. MÁRQUEZ & G. PASTRÁN, 2007. Vegetación. En: E. Martínez Carretero (ed). Diversidad biológica y cultural de los altos andes centrales de Argentina - Línea de Base de la Reserva de Biosfera San Guillermo-San Juan. Editorial Fundación Universidad Nacional de San Juan. 283 pp. [ Links ]
23. MARTORI, R., L. AUN & S. ORLANDINI, 2002. Relaciones térmicas temporales en una población de Liolaemus koslowskyi. Cuadernos de Herpetología 16(1): 33-45. [ Links ]
24. NAVAS, C. A., 2003. Herpetological diversity along Andean elevational gradients: links with physiological ecology and evolutionary physiology. Comparative Biochemistry and Physiology. Part A 133: 469-485. [ Links ]
25. POUGH, F. H, R.M. ANDREWS, J.E. CADLE, M.L. CRUMP, A.H. SAVITZKY & K.D. WELLS, 2001. Herpetology. Prentice Hall, New Jersey. 612 pp. [ Links ]
26. RODRIGUEZ-SERRANO, E., C.A. NAVAS & F. BOZINOVIC, 2009. The comparative field body temperature among Liolaemus lizards: Testing the static and the labile hypotheses. Journal of Thermal Biology 34: 306-309. [ Links ]
27. SALVIOLI, G., 2007. Caracterización Hidrometeorológica. En: E. Martínez Carretero (ed). Diversidad biológica y cultural de los altos Andes Centrales de Argentina - Línea de Base de la Reserva de Biosfera San Guillermo-San Juan. Editorial Fundación Universidad Nacional de San Juan. 283 pp. [ Links ]
28. SMITH, G. R. & R.E BALLINGER, 2001. The ecological consequences of habitat and microhabitat use in lizards: A review. Contemporary Herpetology 3: 1-37. [ Links ]
29. TELLERÍA, J.L., 1986. Manual para el censo de los vertebrados terrestres. Editorial Raíces. 277 pp. [ Links ]
30. VILLAVICENCIO H. J., J. C. ACOSTA, A. MARINERO & M.G. CÁNOVAS, 2007. Thermal ecology of a population of the lizard, Liolaemus pseudoanomalus in western Argentina. Amphibia- Reptilia 28: 163-165. [ Links ]
31. ZUG, G. R., L.J. VITT & J. P. CALDWELL, 2003. Herpetology. Prentice Hall, New Jersey. 630 pp. [ Links ]
Recibido: 10/2012
Aceptado: 12/2012














