Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Multequina
versión On-line ISSN 1852-7329
Multequina vol.24 no.1 Mendoza jun. 2015
ARTICULO ORIGINAL
Temperatura corporal de campo y actividad temporal de las lagartijas Liolaemus vallecurensis y Liolaemus ruibali en clima riguroso de los Andes centrales de Argentina
Field body temperature and temporal activity of lizards Liolaemus vallecurensis and Liolaemus ruibali in rigorous climate of the central Andes of Argentina
Natalio Castillo Gabriel, Héctor José Villavicencio, Juan Carlos Acosta y José Marinero
Diversidad y Biología de Vertebrados del Árido (DIBIOVA), departamento de Biología, Facultad de Ciencias Exactas, Físicas y Naturales, Universidad Nacional de San Juan. Av. José Ignacio de la Roza 590 (Oeste) Rivadavia, San Juan CPA: J5402DCS. Argentina <nataliocastillo@gmail.com>, <hjvillavicencio@gmail.com>, <jcacostasanjuan@gmail.com>
RESUMEN
Se estudiaron aspectos de la temperatura corporal de campo y tiempo de actividad de dos lagartos andinos que forman parte de un ecosistema a 3700 m de altitud en el departamento Iglesia, provincia de San Juan, Argentina. Los datos fueron colectados en el mes de enero del 2007, se registró la temperatura cloacal (Tc), substrato (Ts) y aire (Ta), con un termómetro de lectura rápida, los registros de actividades se realizaron sistemáticamente entre las 8 y 20 hs. Liolaemus vallecurensis presentó una media corporal de 31,13 °C siendo la temperatura mínima 24,20 °C y la máxima 35 °C, la temperatura corporal de campo no se relacionó con la temperatura del aire y sustrato. En Liolaemus ruibali la media corporal fue de 30,40 °C, siendo la mínima 21,40 °C y la máxima de 34,80 °C, la temperatura corporal se relacionó levemente con la temperatura del aire, pero no se halló asociación con la temperatura de sustrato. No se encontró diferencia en la temperatura corporal entre sexos y entre especies. Ambos presentaron un patrón de actividad bimodal, con diferencia en el horario de máxima actividad. En L. vallecurensis las frecuencias de actividad no fueron diferentes entre sexos, en cambio en L. ruibali las hembras fueron más activas. El comportamiento de asoleamiento durante la mayor parte del tiempo de actividad parece ser fundamental para lograr temperaturas corporales estables en este ambiente riguroso.
Palabras claves: Liolaemus vallecurensis; L. ruibali; Temperatura corporal; Patrón de actividad; Argentina.
ABSTRACT
We studied aspects of the field body temperature and time of activity of two Andean lizards that are part of an ecosystem at 3700 m altitude in the Iglesia department, province of San Juan, Argentina. The data were collected in the month of January 2007, the cloacal temperature (Tc), substrate (Ts) and air (Ta) were recorded with a quick-read thermometer, the records of activities were done systematicaly between 8 and 20 hs. Liolaemus vallecurensis presented a body average of 31,13 °C being the minimum temperature 24,20 °C and the maximum 35 °C, the body temperature of field was not related to the temperature of the air and substrate. In the lizard Liolaemus ruibali body average was 30,40 °C, being the minimum 21,40 °C and the maximum of 34,80 °C, the body temperature is related to the temperature of the air, but no association was found with the substrate temperature. No differences were found in body temperature between sexes or between species. Both showed a pattern of activity bimodal, with difference in the time of maximum activity. In L. vallecurensis frequencies of activity showed no differences between the sexes, while in L. ruibali females were more active. The basking behavior during most of the time of activity seems to be crucial for achieving stable body temperatures in this harsh environment.
Keys words: Liolaemus vallecurensis; L. ruibali; Body temperature; Pattern of activity; Argentina
INTRODUCCIÓN
La rigurosidad del clima en alta montaña se manifiesta con las extremas temperaturas invernales en la cordillera (de hasta -30°C), atmósfera muy diáfana e insolación diurna considerable debido a la muy escasa nubosidad, grandes amplitudes térmicas, humedad ambiente mínima, nevadas invernales y escasísimas precipitaciones pluviales (Salvioli, 2007; Perucca & Martos, 2009), además de intensa radiación ultravioleta, velocidad de viento alta y disponibilidad de oxígeno limitada (Navas, 2003). Considerando la clasificación climática de Viers, el clima en la zona es extremadamente seco, desértico, del tipo “Sirio” pero con lluvias estivales (Salvioli, 2007). Esto resulta de importancia ya que el clima modela ciertos aspectos de la distribución y de la historia natural en el género Liolaemus (Cruz et al., 2014).
La temperatura ejerce efectos dominantes en todos los procesos fisiológicos y por ello los animales cuentan con estrategias térmicas, una combinación de respuestas conductuales, bioquímicas y fisiológicas que permiten que la temperatura corporal (Tc) se encuentre dentro de los límites aceptables. La influencia ambiental más importante sobre la estrategia térmica es la temperatura ambiental (Ta) por lo que los animales deben sobrevivir a las temperaturas máximas y mínimas de sus hábitats (Moyes & Schulte, 2007).
Los lagartos obtienen el calor a través de la radiación directa del sol (heliotermia) o por contacto con el sustrato (tigmotermia) (Pianka & Vitt, 2003). Esta forma de obtención del calor influye en la estrategia de regulación térmica que puede ocurrir por una termorregulación activa donde mantiene la temperatura corporal por encima o por debajo de la del ambiente o por medio del termoconformismo, donde la temperatura corporal se incrementa conforme aumenta la del ambiente (Huey & Slatkin, 1976; Zug et al., 2001).
Es fundamental evaluar la calidad térmica en ambientes de alta montaña; la altitud y el tipo de vegetación tienen influencia en la calidad térmica (Lara Reséndiz et al., 2014). Se ha propuesto que las especies más afectadas por el cambio climático podrían ser aquellas que se distribuyen en zonas de gran altitud, donde la migración hacia nuevos hábitats favorables está limitada por las montañas y la capacidad de dispersión de las especies (Sinervo et al., 2010; Herzog et al., 2012). Los incrementos de temperaturas proyectados en los Andes superan a los de las tierras bajas circundantes. Las extrapolaciones de las tendencias climáticas actuales dejan claro que los ecosistemas se verán aun más afectados. Las respuestas de las especies al cambio climático continuado pueden incluir tolerancia y adaptación, migración para seguir gradientes emergentes o la incapacidad de adaptarse o trasladarse, resultando en extinción (Herzog et al., 2012). Por lo tanto, las respuestas de las especies al cambio climático dependerán en gran medida de su comportamiento termorregulador, periodo de actividad, requerimientos térmicos, modo de reproducción, historia de vida y calidad térmica ambiental; elementos que deben ser tomados en cuenta en las proyecciones debidas al cambio climático (Lara-Reséndiz et al., 2014).
Pearson & Bradford (1976) mencionan que la termorregulación en climas fríos, al igual que en alta montaña, es particularmente costosa; las lagartijas que ocupan estos hábitats deben dedicar una gran parte de su tiempo en termorregular. Sin embargo existen registros de que las especies de climas fríos son mejores termorreguladoras que las de climas templados, aunque existen especies como L. eleodori que muestra una alta dependencia térmica (Villavicencio et al., 2012). Además hay una tendencia que muestra que las especies vivíparas que están asociadas a climas de altura presentan una capacidad termorreguladora más precisa que las especies ovíparas (Cruz et al., 2014).
El estudio sobre aspectos térmicos fue abordado en varias especies del género Liolaemus; entre ellos podemos mencionar: Liolaemus nitidus (Valencia & Jaksíc, 1981), L. nigromaculatus y L. nitidus (Cortes et al., 1992), L. altissimus, L. chiliensis, L. fuscus, L. lemniscatus, L. leopardinus, L. monticola, L. nigroviridis, L. nitidus, L. schroederi y L. tenuis (Carothers et al., 1997), L. koslowskyi (Martori et al., 2002), L. elongatus y L. pictus (Ibargüengoytía & Cussac, 2002), L. sanjuanensis (Acosta et al., 2004), L. parvus (Acosta et al., 2006), L. olongasta (Canovas et al., 2006), L. ruibali (Villavicencio et al., 2006), L. chacoensis (Laspiur et al., 2007), L. pseudoanomalus (Villavicencio et al., 2007), L. tenuis (Vidal et al., 2008), L. bibronii (Medina et al., 2009), L. irregularis, L. multicolor, L. yanalcu y L. albiceps (Valdecantos et al., 2013), y especies del grupo L. goetschi (Azócar et al., 2013).
Con respecto al patrón de actividad, el tamaño corporal afecta la inercia térmica, al infulir en las tasas de enfriamiento y calentamiento. Estas dos características asociadas pueden determinar los períodos de actividad diarios, dado que los individuos más pequeños se encuentran activos más temprano que aquellos más grandes (Carothers, 1997). Por lo tanto la frecuencia de actividad se encuentra asociada con estas variaciones en la temperatura diaria (Verrastro & Bujes, 1998) y representa una importante variable ecológica para la comprensión en el estudio de la ecología en reptiles (Carretero & Llorente, 1993). Pianka (1973) plantea que las especies que conviven particionan los recursos de acuerdo a las dimensiones trófias y que las variaciones en las actividades de un lagarto junto con el uso diferencial del microhábitat, representan los mecanismos termorregulatorios más importantes en ectotermos (Labra et al., 2001). Simonetti (1984) indica que la conducta de refugio de cierta especie como la lagartija L. nigromaculatus podría relacionarse con actividades termorregulatorias usando distintos refugios durante el día. Por lo tanto los factores que controlan el uso de microhábitat están relacionados con aspectos termorregulatorios, evasión de la competencia interespecífica, selección de tamaño de territorio, entre otros (Mella, 2007). Además la temperatura corporal de los lagartos es un refljo del hábitat que usan, de la táctica de alimentación y del tiempo de actividad (Schall, 1977).
Entre los registros de actividad dentro del género Liolaemus podemos mencionar entre otros: L. darwinii y L. gracilis (Videla & Puig, 1994) L. acostai (Villavicencio et al., 2002), L. quilmes (Halloy & Robles, 2003), L. occipitalis (Bujes & Verrastro, 2008), L. Koslowskyi (Belver et al., 2010), L. eleodori (Villavicencio et al., 2012).
Liolaemus vallecurensis y L. ruibali habitan en un clima riguroso de alta montaña, por lo que resulta importante contribuir a comprender la bio-ecología de estas especies. Esta información no solo contribuye a comprender los ajustes de estas especies a los climas rigurosos sino que aportan información valiosa para diseñar estrategias de conservación.
El objetivo del presente trabajo es aportar los primeros datos biológicos sobre temperaturas de campo y actividad en L. vallecurensis y la especie simpátrica, L. ruibali, y resaltar la importancia de L. vallecurensis por ser una especie endémica de la provincia de San Juan, cuya biología es totalmente desconocida y por estar actualmente categorizada como especie vulnerable (Abdala et al., 2012).
MATERIALES Y MÉTODOS
Descripción de la especie
Liolaemus vallecurensis es un lagarto perteneciente a la familia Liolaemidae, procedente del Valle del Cura, provincia de San Juan, presenta como características diagnósticas escamas dorsales pequeñas polígono cuadrangulares y lisas, en los machos de 7 a 8 poros precloacales. Su distribución originalmente fue citada en el Valle del Cura, departamento de Iglesia; la localidad tipo es “La sepultura” a 3815 m s.n.m. (Pereyra, 1992).
Liolaemus ruibali es un lagarto pequeño o mediano de hasta 65 mm de largo, de cola corta. Presenta un patrón dorsal con una serie longitudinal de manchitas negras breves, flanqueadas por una ancha banda de manchas irregulares oscuras y azules. Se distribuye en la cordillera y precordillera del centro-oeste de Argentina, en las provincias de San Juan y Mendoza (Cei, 1986).
Área de estudio
El área de estudio se localiza en el valle del Cura, el mismo está ubicado en el extremo norte de la provincia de San Juan. Fundamentalmente se trata de una región montañosa, que forma parte de la unidad estructural denominada Cordillera de Colangüil; la misma presenta una altura de hasta 5000 m s.n.m (Perucca & Martos, 2009). Las dos unidades morfológicas de la zona son las montañas y las llanuras (“llanos”). Los individuos de L. vallecurensis y L. ruibali fueron capturados en los típicos ambientes de bajadas pedemontanas a 3700 m de altitud (coordenadas 29° 19' 00” S, 69° 30' 00” O). Fitogeográficamente la zona corresponde a la provincia Altoandina, donde dominan matorrales arbustivos bajos y medianos (Cabrera, 1994).
Temperatura corporal de campo y patrón de actividad
Los datos fueron colectados desde el 5 al 13 de enero del 2017 en forma continuada e ininterrumpida. Se realizaron recorridos en forma sistemática con revisión aleatoria de arbustos y áreas desprovistas de vegetación (Tellería, 1986; Villavicencio et al., 2007). El esfuerzo de muestreo se mantuvo constante a lo largo de los días y durante cada día ya que las recorridas fueron realizadas por dos personas separadas 5 metros una de la otra, barriendo un área aproximada de 5 metros a cada lado de los observadores. Los individuos fueron colectados con horquetas y luego del registro de las temperaturas los individuos fueron liberados. Cada vez que se detectó y capturó una lagartija se procedió inmediatamente a la toma de la temperatura cloacal (Tc). En el lugar donde se observó la lagartija por primera vez se midió la temperatura del sustrato (Ts) y la temperatura del aire (Ta) a 1 cm del sustrato, las medidas fueron tomadas con un termómetro de lectura rápida Miller & Weber (precisión 0.1 °C). Se obtuvo un total de 26 muestras térmicas para L. ruibali y 28 para L. vallecurensis. Para determinar el patrón de actividad cada vez que una lagartija fue avistada se registró: especie, hora y sexo.
Tratamiento de datos
Se usaron estadísticos descriptivos media, varianza y desvíos estándar. En todos los casos se aseguró la independencia de los datos, la normalidad se comprobó gráficamente y con el test de Shapiro Wilks. El nivel de significación de los análisis fue de 0,05 y se trabajó con el programa Statistica 10.0 e Infostat y se consultó a Zar (1984) y Sokal & Rohlf (1999). Se realizaron regresiones simples entre la Tc vs. Ta y Tc vs. Ts; para detectar diferencias en la Tc entre sexos y entre especies se realizó la prueba t-Student. Se realizaron gráficos de frecuencias y se utilizó el test de Kolmogorov-Smirnov (González et al., 2006) para determinar diferencias existentes en las distribuciones entre sexos y especies; para revelar diferencias en las frecuencias de aparición entre sexos se empleó χ2 (Chi-cuadrado).
RESULTADOS
Liolaemus vallecurensis presentó una Tc media de 31,13 °C D.E = ± 2,93, siendo la temperatura mínima 24,20 °C y la máxima de 35 °C. La temperatura corporal de campo no se relacionó con la temperatura del aire y sustrato (Regresiones simples rtc-ta = -0,03; p = 0,85; rtc-ts = 0,14; p = 0,46). No se encontraron diferencias en la Tc entre sexos (t-Student, t 26 = 1,60; p = 0,12). Con respecto a Liolaemus ruibali presentó Tc media de 30,40 °C D.E = ± 3,25, siendo la temperatura mí- nima 21,40 °C y la máxima de 34,80 °C. La temperatura corporal de campo en L. ruibali se relacionó levemente con la temperatura del aire (Regresión simple rtc-ta = 0,37; p = 0,05), no hubo asociación con la temperatura de sustrato (r tc-ts = 0,27; p = 0,17). Asimismo no se encontraron diferencias en la Tc entre sexos (t-Student, t 23 = -1,89; p = 0,07) ni entre especies (t-Student, t51 = 0,64, p = 0,52). Los patrones de actividad entre las especies fueron significativamen te diferentes (Kolmogorov-Smirnov K.S = 0,52; P = ,01).
Liolaemus vallecurensis (machos y hembras) mostró un patrón de actividad bimodal con un máximo de actividad entre las 19 y 20 h, permaneciendo activo entre las 10 y las 20 h; no se encontraron registros entre las 15 y 16 h (Figura 1).
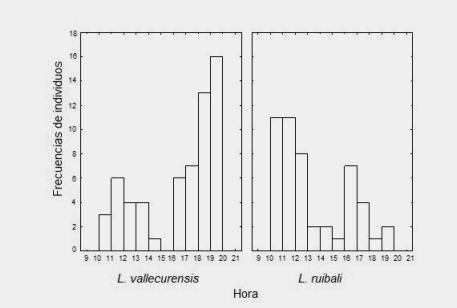
Figura 1. Histograma de actividad (machos y hembras) de L. vallecurensis y L. ruibali. Test de Kolmogorov-Smirnov indica diferencia en las distribución entre especie (K.S = 0,52; P = 0,01).
Figure 1. Histogram of activity (males and females) of L. vallecurensis and L. ruibali Kolmogorov-Smirnov test indicates difference in the distribution between species (K.S = 0,52; P= 0,01)
Entre hembras y machos no se encontraron diferencias en el número de individuos (χ2 = 0,27 df= 1, p = 0,59). No se encontraron diferencias en las distribuciones entre sexos (Kolgomorov Smirnov, K.S = 0,18; p = 0,20) (Figura 2) y en relación a la proporción de tamaños registrados (LHC) el 86 % fueron adultos, el 10 % juveniles y el 4 % infantiles.

Figura 2. Histograma de actividad por sexos en L. vallecurensis. Test de Kolmogorov-Smirnov, no se encontró diferencia en las distribución entre sexos (Kolgomorov-Smirnov, K.S = 0,18; p = 0,20)
Figure 2. Histogram of activity by sexes in L. vallecurensis. Kolmogorov-Smirnov test, no difference was found in the distribution between sexes (Kolgomorov-Smirnov, K.S = 0,18; p = 0,20)
Liolaemus ruibali (machos y hembras) mostró un patrón de actividad bimodal con un máximo de actividad entre las 10 y 13 h, permaneciendo activo entre las 10 y 20 h (Figura 1), siendo las hembras más frecuentes que los machos (χ2 = 34,30, df= 1, p < 0,0001) y los machos solo se encontraron activos a las 11 h y entre las 16 y 20 h. No se encontraron diferencias en las distribuciones entre sexos (Kolgomorov-Smirnov, K.S = 0,39; p = 0,20) (Figura 3).

Figura 3. Histograma de actividad por sexos en L. ruibali. Test de Kolmogorov-Smirnov, no se encontró diferencia en la distribucion entre sexos (Kolgomorov-Smirnov, K.S = 0,39; p = 0,20)
Figure 3. Histogram of activity by sexes in L. ruibali. Kolmogorov-Smirnov test, no difference was found in the distribution between sex (Kolgomorov-Smirnov, K.S = 0,39; p = 0,20)
DISCUSIÓN
Las especies de Liolaemus estudiadas habitan en los típicos ambientes de bajadas pedemontanas a 3700 m de altitud. Sus temperaturas medias fueron 31,13 °C para Liolaemus vallecurensis, similar a la registrada por Labra et al. (2009), y 30,40 °C para Liolaemus ruibali, similares a las registradas en L. eleodori (Villavicencio et al., 2012) y L. parvus (Acosta et al., 2006). Estas temperaturas son inferiores a las obtenidas para otras especies de Liolaemus de la puna. Valdecantos et al. (2013) registran para tres de las cuatro especies estudiadas temperaturas corporales por encima de 36 °C (L. irregularis, L. multicolor y L. albiceps), mientras que L. yanalcu muestra valores moderados de 34,2 °C. Otros datos térmicos obtenidos en L. ruibali en la reserva Don Carmelo (24 °C) (Villavicencio et al., 2006) son extremadamente bajas en comparación con San Guillermo, de todas formas el género Liolaemus en general presenta temperaturas bajas (Medina et al., 2012). Una comparación con lagartos de pisos altitudinales más bajos en San Juan (700 m) muestra temperaturas de campo similares próximas a 32 °C en L. olongasta y L. pseudoanomalus (Canovas et al., 2006; Villavicenvio et al., 2007). Por lo tanto el género parece mantener una temperatura estable a lo largo de un gradiente altitudinal, teniendo en cuenta que L. olongasta y L. pseudoanomalus se encuentran en los 700 m de altitud.
La temperatura corporal en L. ruibali y L. vallecurensis no se relacionó con la temperatura del sustrato, y existe solo una leve asociación en L. ruibali con la temperatura del aire. Estas características las comparten con otros miembros del género como L. parvus (Acosta et al., 2004), L. olongasta (Canovas et al., 2006), L. chacoensis (Laspiur et al., 2007), que son también especies termorreguladoras como L. wiegmanni (Martori et al., 1998), L. koslowskyi (Martori et al., 2002), L. darwinii (Villavicencio, 2010). Sin embargo difieren de otras especies de altitud como L. eleodori la cual se comporta como termoconformista (Villavicencio et al., 2012).
Es notable observar cómo la temperatura corporal de L. vallecurensis y L. ruibali se mantiene constante en horarios de alta temperatura del aire y sustrato. Es importante notar las implicancias que tiene desde el punto de vista alimenticio y de depredación, el estar la mayor parte del tiempo asoleándose, quedando expuesto a los depredadores y a una mayor tasa de evaporación (Hertz, 1992), por lo que deberá consumir alimentos con gran proporción de agua. Es posible que la tigmotermia y heliotermia no jueguen un papel importante en ninguna de ambas especies debido a la falta de relación entre la temperatura corporal con la del aire y sustrato. En cuanto al comportamiento térmico de campo, ambas especies mantienen su temperatura corporal independiente de las variables ambientales.
En la actividad temporal, los resultados indican que ambas especies presentan un patrón de actividad bimodal. Aun & Martori (1998) mencionan que los patrones de actividad podrían estar relacionados con las alturas a las que se encuentran las especies. Sin embargo, para otras especies como L. lutzae y L. occipitalis (alternancia entre unimodal y bimodal) la variación de la actividad en el tiempo está relacionanda con el tipo de búsqueda de alimento (Rocha, 1988).
Para estas especies simpátricas no hay solapamiento en los períodos de mayor frecuencia de actividad. En L. ruibali se observó mayor frecuencia de aparición en hembras que en machos, en L. vallecurensis tanto hembras como machos mostraron el mismo patrón de actividad.
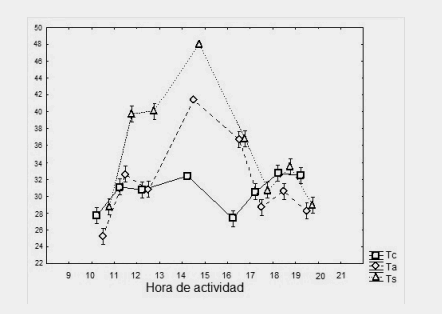
Figura 4. Variación de la temperatura corporal (Tc), temperatura del sustrato (Ts) y temperatura del aire (Ta) en función de las horas de actividad en L. vallecurensis
Figure 4. Variation in body temperature (Tc), substrate temperature (Ts) and air temperature (Ta), depending on the hours of activity in L. vallecurensis
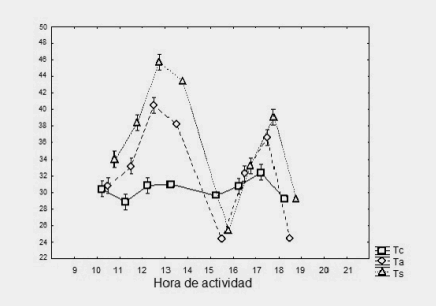
Figura 5. Variación de la temperatura corporal (Tc), temperatura del sustrato (Ts) y temperatura del aire (Ta) en función de las horas de actividad en L. ruibali
Figure 5. Variation in body temperature (Tc), substrate temperature (Ts) and air temperature (Ta), depending on the hours of activity in L. ruibali
El comportamiento de asoleamiento durante la mayor parte del tiempo de actividad parece ser fundamental para lograr temperaturas corporales estables en estos ambientes rigurosos principalmente en los horarios de temperaturas máximas diarias. Es importante destacar que esta información de la ecofisiología térmica y patrones de actividad de L. vallecurensis, representa la única existente para la especie.
BIBLIOGRAFÍA
1. ABDALA, C., J.L. ACOSTA, J.C. ACOSTA, B. ÁLVAREZ, F. ARIAS, L. ÁVILA, G. BLANCO, M. BONINO, J. BORETTO, G. BRANCATELLI, M. BREITMAN, M. CABRERA, S. CAIRO, V. CORBALÁN, H. HERNANDO, N. IBARGÜENGOYTÍA, F. KACOLIRIS, A. LASPIUR, R. MONTERO, M. MORANDO, N. PELEGRIN, C. HERNÁN, F. PÉREZ, A. QUINTEROS, R. SEMHAN, R. TEDESCO, L. VEGA & S. ZALBA, 2012. Categorización del estado de conservación de las lagartijas y anfisbenas de la República Argentina. Cuadernos de Herpetología 26: 215-248. [ Links ]
2. ACOSTA, J.C., H.J. VILLAVICENCIO & J.A. MARINERO, 2006. Liolaemus cf. elongatus (NCN). Body Temperature. Herpetological Review 37(4): 466-467. [ Links ]
3. ACOSTA, J.C., R. BUFF, P. GÓMEZ & J. MARINERO, 2004. Liolaemus sanjuanensis (NCN). Body temperature. Natural History Notes. Herpetological Review 35(2): 171. [ Links ]
4. AUN, L. & R. MARTORI, 1998. Reproducción y dieta de Liolaemus koslowskyi Etheridge 1993. Cuadernos de Herpetología 12(1): 1-9. [ Links ]
5. AZÓCAR, D.L.M., B. VANHOOYDONCK, M.F. BONINO, M.G. PEROTTI, C.S. ABDALA, J.A. SCHULTE, & F.B. CRUZ, 2013. Chasing the Patagonian sun: comparative thermal biology of Liolaemus lizards. Oecologia 171(4): 773-788. [ Links ]
6. BELVER, L.C., M.L. KOZYKARISKI & L.J. AVILA, 2010. Diferencias sexuales y etarias en la actividad diaria y estacional de una población de Liolaemus koslowskyi (Liolaemini). Cuadernos de Herpetología 24(2): 71-79. [ Links ]
7. BUJES, C.S. & L. VERRASTRO, 2008. Annual activity of the lizard Liolaemus occipitalis (Squamata, Liolaemidae) in the coastal sand dunes of southern Brazil. Iheringia, Série Zoología, Porto Alegre 98(1): 156-160. [ Links ]
8. CABRERA, A, 1994. Regiones fitogeográficas Argentinas. Enciclopedia Argentina de agricultura y Jardinería, tomo II. Editorial Acme. 84 pp. [ Links ]
9. CÁNOVAS, M.G., J.C. ACOSTA, H.J. VILLAVICENCIO & A.J. MARINERO, 2006. Liolaemus olongasta (NCN). Body Temperature. Herpetological Review 37(1): 87-88. [ Links ]
10. CAROTHERS, J.H., S.F. FOX, P.A. MARQUET & F.M. JAKSIC, 1997. Thermal characteristics of ten Andean lizards of the genus Liolaemus in central Chile. Revista Chilena de Historia Natural 70: 297-309. [ Links ]
11. CARRETERO, M.A. & G.A. LLORENTE, 1993. Ecología térmica y actividad en una población costera de Pammodromus hispanicus. Revista Española de Herpetología 7: 21-23. [ Links ]
12. CEI, J.M, 1986. Reptiles del centro, centro oeste y sur de la Argentina: herpetofauna de las zonas áridas y semiáridas. 527 pp. [ Links ]
13. CORTES, A., C. BAEZ, M. ROSENMANN & C. PINO, 1992. Dependencia térmica del Teiido Callopistes palluma, una comparación con los iguanidos Liolaemus nigromaculatus y L. nitidus. Revista Chilena de Historia Natural 65: 443-451. [ Links ]
14. CRUZ, F.B., MORENO AZÓCAR, D.L., BONINO, M.F., SCHULTE II, J.A., ABDALA, C.S., & PEROTTI, M.G, 2014. Clima, distribución geográfica y viviparismo en especies de Liolaemus (Reptilia; Squamata): cuando las hipótesis se ponen a prueba. Ecosistemas 23 (1):37-45 [ Links ]
15. GONZÁLEZ, C.G., A.B. FELPETO, I.M. ESTRAVIZ, I.R. ALARCÓN, A.R.V. CASTAÑO & A.V. LISTE, 2006. Tratamientos de datos. Edición Díaz de Santos. 367 pp. [ Links ]
16. HALLOY, M. & C. ROBLES, 2003. Patrones de actividad y abundancias relativas en un lagarto del noroeste Argentino, Liolaemus quilmes (Iguania: Liolaemidae). Cuadernos de Herpetología 17(1- 2): 65-71. [ Links ]
17. HERTZ, P.E, 1992. Temperature regulation in Puerto Rican Anolis lizards: A field test using null hypotheses. Ecology 73: 1405-1417 [ Links ]
18. HERZOG, S.K., R. MARTINEZ, P.M. JØRGENSEN, & H. TIESSEN. 2012. Cambio climático y biodiversidad en los Andes tropicales. Instituto Interamericano para la Investigación del Cambio Global (IAI), Sao José dos Campos, y Comité Científico sobre Problemas del Medio Ambiente (SCOPE), Paris. 410 pp. [ Links ]
19. HUEY, R.B. & M. SLATKIN, 1976. Cost and benefits of lizards thermoregulation. The Quartely Review of Biology 51(3): 363- 384. [ Links ]
20. IBARGÜENGOYTÍA, N.R. & V.E. CUSSAC, 2002. Body temperatures of two viviparous Liolaemus lizard species, in Patagonian rain forest and steppe. Herpetological Journal 12: 131-134. [ Links ]
21. LABRA, A., J. PIENAAR & T. HANSEN, 2009. Evolution of thermal physiology in Liolaemus lizards: Adaptation, phylogenetic inertia, and niche tracking. The American Naturalist 174: 204-220. [ Links ]
22. LABRA, A., M. SOTO-GAMBOA & F. BOZINOVIC, 2001. Behavioral and physiological thermoregulation of Atacama desert-dwelling Liolaemus lizards. Ecoscience 8(14): 413-420. [ Links ]
23. LARA-RESÉNDIZ, R.A., B.C. LARRAÍNBARRIOS, A.H.D. DE LA VEGA, & F.R. MÉNDEZ-DE LA CRUZ, 2014. Calidad térmica a través de un gradiente altitudinal para una comunidad de lagartijas en la sierra del Ajusco y el Pedregal de San Ángel, México. Revista Mexicana de Biodiversidad 85(3), 885-897. [ Links ]
24. LASPIUR, A., H.J. VILLAVICENCIO & J.C ACOSTA. 2007. Liolaemus chacoensis (NCN). Body Temperature. Herpetological Review 38(4): 458-459. [ Links ]
25. MARTORI R., L. AUN & S. ORLANDINI, 2002. Relaciones térmicas temporales en una población de Liolaemus koslowskyi. Cuadernos de Herpetología 16(1): 144- 155. [ Links ]
26. MARTORI, R., P. BIGNOLO & L. CARDINALE, 1998. Relaciones térmicas en una población de Liolaemus wiegmannii (Iguania: Tropiduridae). Revista Española de Herpetología 12:19- 26. [ Links ]
27. MEDINA, M., A. SCOLARO, F. MENDEZ DE LA CRUZ, B. SINERVO, D.B. MILES, & N. IBARGÜENGOYTÍA, 2012. Thermal biology of genus Liolaemus: A phylogenetic approach reveals advantages of the genus to survive climate change. Journal of Thermal Biology 37(8): 579-586. [ Links ]
28. MEDINA, M., J. GUTIERREZ, A. SCOLARO & N. IBARGÜENGOYTÍA, 2009. Thermal responses to environmental constraints in two populations of the oviparous lizard Liolaemus bibronii in Patagonia, Argentina. Journal of Thermal Biology 34: 32-40. [ Links ]
29. MELLA, J.E, 2007. Reptiles en el monumento natural El Morado (Region Metropolitana, Chile): Abundancia relativa, distribución altitudinal y preferencia por rocas de distinto tamaño. Gayana 71(1): 16-26.
30. MOYES C.D. & P.M. SHULTE, 2007. Principios de fisiología animal. Artmed. [ Links ]
31. NAVAS, C., 2003. Anfibios y lagartos de alta montaña: ecofisiología evolutiva y límites altitudinales. En: Bozinovic, F. (Ed.), Fisiología Ecológica y Evolutiva (pp. 249- 271). Ediciones Universidad Católica de Chile. Santiago, Chile. [ Links ]
32. PEARSON, O.P. & D.F. BRADFORD, 1976. Thrmoregulation of lizards and toads at high altitudes in Peru. Copeia, pp. 155-170.
33. PEREYRA, E.A, 1992. Nueva especie de lagarto andino: Liolaemus vallecurensis (Tropiduridae, Liolaeminae). Noticiario Mensual, pp. 10-14. Museo Nacional de Historia Natural. Santiago. [ Links ]
34. PERUCCA, L.P. & L.M. MARTOS, 2009. Análisis preliminar de la evolución del paisaje cuaternario en el valle de Iglesia, San Juan. Revista de la Asociación Geológica Argentina 65(4): 624- 637. [ Links ]
35. PIANKA, E.R, 1973. The structure of lizard comunities. Annual Review of Ecology And Systematics 4: 53-74. [ Links ]
36. ROCHA C.F.D, 1988. Ritmo de atividade e microclimatologia do habitat de Liolaemus lutzae (Sauria-Iguallidae). Annais do Seminário Regional de Ecologia de São Carlos 6: 269-28l. [ Links ]
37. SALVIOLI, G., 2007. Caracterización hidrometeorológica. En: Martínez Carretero, E. (Ed.), Diversidad biológica y cultural de los Altos Andes Centrales de la Argentina: Línea de base de la Reserva de la Biosfera San Guillermo. San Juan (pp. 63-87). 1ª Ed. San Juan: Universidad Nacional de San Juan, Argentina. [ Links ]
38. SCHALL, J. 1977. Thermal ecology of fie sympatric species of Cnemidophorus (Sauria: Teiidae). Herpetologica 33(3): 261-272. [ Links ]
39. SIMONETTI, J, 1984. Utilización de refugio por Liolaemus nigromaculatus: compromiso entre riesgos de predación y necesidades termorregulatorias. Studies on Neotropical Fauna and Environment 19(1): 47-51. [ Links ]
40. SINERVO B., F. MÉNDEZ-DE-LA-CRUZ, D.B. MILES, B. HEULIN, E. BASTIAANS, M. VILLAGRÁN-SANTA CRUZ, R. LARA-RESENDIZ, N. MARTÍNEZ-MÉNDEZ, M. L. CALDERÓN-ESPINOSA, R. N. MEZA-LÁZARO, H. GADSDEN, L.J. AVILA, M. MORANDO, I.J. DE LA RIVA, P.V. SEPULVEDA, C.F.D. ROCHA, N. IBARGÜENGOYTÍA, C.A. PUNTRIANO, M. MASSOT, V. LEPETZ, T.A. OKSANEN, D.G. CHAPPLE, A.M. BAUER, W.R. BRANCH, J. CLOBERT & J.W. SITES JR, 2010. Erosion of lizard diversity by climate change and altered thermal niches. Science 328(5980): 894-899. [ Links ]
41. SOKAL, R.R. & F.J. ROHLF, 1999. Introducción a la bioestadística. Editorial Reverté, S.A. 363 pp. [ Links ]
42. TELLERÍA J.L, 1986. Manual para el censo de los vertebrados terrestres. Editorial Raíces. 32 pp. [ Links ]
43. VALDECANTOS, S., V. MARTÍNEZ, F. LOBO & F.B. CRUZ, 2013. Thermal biology of Liolaemus lizards from the high Andes: Being efficient despite adversity. Journal of Thermal Biology 38: 126-134. [ Links ]
44. VALENCIA, J. & F.M. JAKSÍC, 1981. Relations between activity temperature and preferred temperatures of Liolaemus nitidus in Central Chile (Lacertidae: Iguanidae). Studies on Neotropical Fauna and Environment 16: 165-167. [ Links ]
45. VERRASTRO, L. & C.S. BUJES, 1998. Ritmo de atividade de Llolaemus occipitalis Boulenger (Sauria, Tropiduridae) na Praia de Quintão, Rio Grande do Sul, Brasil. Revista brasilera de Zoología 15(4): 913-920. [ Links ]
46. VIDAL, M.A., J.C. ORTIZ & A. LABRA, 2008. Intraspecific variation in a physiological thermoregulatory mechanism: Th case of the lizard Liolaemus tenuis (Liolaeminae). Revista Chilena de Historia Natural 81: 171-178.
47. VIDELA, F. & S. PUIG, 1994. Estructura de una comunidad de lagartos del Monte. Patrones de uso espacial y temporal. Multequina 3: 99-112. [ Links ]
48. VILLAVICENCIO H.J., J.C. ACOSTA, A. MARINERO & M.G. CÁNOVAS, 2007. Thrmal ecology of a population of the lizard, Liolaemus pseudoanomalus in western Argentina. Amphibia–Reptilia. western Argentina. Amphibia–Reptilia. 28(1):163-165.
49. VILLAVICENCIO, H.J., J.C. ACOSTA, G.M. BLANCO & J.A. MARINERO, 2012. Ecología térmica de la lagartija endémica Liolaemus eleodori (Iguania: Liolaemidae) en el Parque Nacional San Guillermo, San Juan, Argentina. Multequina 21: 17-23. [ Links ]
50. VILLAVICENCIO, H.J., M.G. CÁNOVAS & J.C. ACOSTA, 2006. Liolaemus ruibali (NCN). Body Temperature. Herpetological Review 37(1): 89. [ Links ]
51. VILLAVICENCIO, J., J.C. ACOSTA, M.G. CÁNOVAS & J.A. MARINERO, 2002. Patrones de actividad temporal diaria y estacional de Liolaemus pseudoanomalus (Squamata: Tropiduridae) en el centro-oeste de la Argentina. Multequina 11: 51-60. [ Links ]
52. VILLAVICENCIO, J.H. 2010, Ecofisiología térmica de Liolaemus darwinii (Iguania: Liolaemidae) en el centro oeste del Monte argentino. Tesis para optar al Doctorado en Ciencias Biológicas, Universidad Nacional de Río Cuarto Facultad de Ciencias Exactas Físico Químicas y Naturales. 85 pp. [ Links ]
53. ZAR, J.H, 1984. Biostatistical analysis. Prentice-Hall. 718 pp. [ Links ]
54. ZUG, G., L. VITT & J. CALDWELL, 2001. Herpetology. Academic Press. San Diego, USA. 249 pp. [ Links ]
Recibido: 04/2015
Aceptado: 08/2015














