Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Diaeta
versión On-line ISSN 1852-7337
Diaeta vol.28 no.132 Ciudad Autónoma de Buenos Aires jul./set. 2010
ARTÍCULO DE ACTUALIZACIÓN
Prebióticos, probióticos y simbióticos en la dietoterapia de los pacientes quemados
Prebiotics, probiotics and synbiotics in the diet therapy of burned patients
Toyama, Gabriela Paula1
1 Licenciada en Nutrición. Hospital de Quemados.
Correspondencia: toyamagabriela@yahoo.com.ar
Recibido: 1 de octubre de 2009.
Aceptado en su versión corregida: 23 de agosto de 2010.
Resumen
La composición de la microflora del tracto gastrointestinal es esencial en el mantenimiento de la función de barrera. Ésta se altera en los pacientes quemados inmediatamente después de sufrir la injuria y el consecuente aumento de la permeabilidad intestinal conlleva una mayor posibilidad de infecciones incontroladas que pueden conducir a la muerte en estos pacientes inmunocomprometidos. Los alimentos funcionales con pre-, pro- y simbióticos surgen como una estrategia terapéutica de contar con inmunomoduladores biológicos que limiten el desarrollo y la translocación de bacterias patógenas y endotoxinas, la infección nosocomial y la respuesta inflamatoria sistémica de origen intestinal.
Los objetivos de este trabajo fueron describir el fenómeno de translocación bacteriana y la alteración de la permeabilidad de la mucosa intestinal en el paciente quemado, y reconocer los productos alimenticios y nutroterápicos funcionales con efecto pre-, pro-y simbiótico más adecuados que puedan ser ofrecidos oportunamente.
Los mecanismos que favorecen la translocación son: la pérdida de la función de barrera, la modificación en el contenido de las bacterias de la luz intestinal y las alteraciones inmunológicas del huésped. Los prebióticos pueden ocasionar síntomas gastrointestinales secundarios al efecto osmótico y a la fermentación en la luz intestinal. El uso de la bacterioterapia con probióticos y simbióticos requiere una consideración juiciosa de los potenciales efectos adversos de determinadas cepas bacterianas, como son las infecciones por transmigración y la acidosis Dláctica.
La experiencia en el abordaje del paciente quemado con alimentos y nutroterápicos con función pre-, pro-o simbiótica es aún insuficiente para poder formular recomendaciones en cuanto a su consumo y más aún de aquellos disponibles en el mercado.
Palabara clave: Prebióticos; Probióticos; Simbióticos; Inmunocompetencia; Pacientes quemados.
Abstract
The composition of the gastrointestinal tract microflora is essential to maintain the barrier function. This is altered in burn patients immediately after suffering the injury and the consequential increase in intestinal permeability entails a greater possibility of uncontrolled infections that can lead to death in these immunocompromised patients. Functional foods with pre-, pro-and synbiotics emerge as a therapeutic strategy consisting in biological immunomodulators that limit the development and translocation of pathogenic bacteria and endotoxins, as well as nosocomial infection and systemic inflammatory response of intestinal origin.
The aim of this review is to describe the phenomenon of bacterial translocation and the alteration of intestinal mucosa's permeability in burn patients, and to recognize the functional foods and nutritional products with pre-, pro-and synbiotic effect that would be more adequate to offer in due time.
The mechanisms that favor translocation are: the loss of barrier function, the modification of bacteria content in the intestinal lumen and the impaired host immune defenses. Prebiotics can bring about gastrointestinal symptoms which are secondary to the osmotic effect and fermentation in the intestinal lumen. The use of bacteriotherapy with probiotics and synbiotics needs a judicious consideration of the potential adverse effects of certain bacterial strains, such as infections due to transmigration and Dlactate acidosis.
The experience in treating burn patients with foods and nutritional products having a pre-, pro-or synbiotic function is still not enough to make recommendations on their consumption and even less as regards those products available in the market.
Keywords: Prebiotics; Probiotics; Synbiotics; Immunocompetence; Burn patients.
La composición de la microflora del tracto gastrointestinal (TGI) es esencial en el mantenimiento de la función de barrera intestinal y cumple tres funciones primarias, a saber: nutrición y metabolismo, como resultado de la actividad bioquímica; protección, previniendo la invasión de agentes infecciosos o el sobrecrecimiento de especies residentes oportunistas con potencial patógeno, y trofismo, ya que las bacterias intestinales pueden controlar la proliferación y diferenciación de las células epiteliales. (1-4)
La función de barrera gastrointestinal se altera en los pacientes quemados inmediatamente después de sufrir la injuria, lo que culmina en un aumento de la permeabilidad intestinal. (5) Esto conlleva una mayor posibilidad de infecciones incontroladas que pueden conducir a la muerte en los pacientes quemados, los cuales - por otra parte - tienen una función inmunológica deteriorada que facilita la colonización y posterior infección sistémica. (6)
En los últimos años, se han sucedido diversas estrategias terapéuticas tendientes a limitar el crecimiento de bacterias patógenas en el TGI. En Terapia Intensiva, el aporte de pre-, pro- y simbióticos asociados a la nutrición enteral temprana o precoz (NET) podría ser capaz de modular la respuesta inmune e inhibir el crecimiento bacteriano, disminuyendo la translocación bacteriana (TB), la infección nosocomial y la respuesta inflamatoria sistémica de origen intestinal. (2,7)
El concepto de alimentos funcionales tiene su origen en una mayor comprensión de las bases moleculares de la relación existente entre alimentación y salud y la posibilidad de contar con reguladores biológicos (donde los pre-, pro- y simbióticos juegan un papel protagónico) que disminuyan el riesgo de contraer enfermedades por sus características inmunomoduladoras y de restablecimiento de la flora intestinal, entre otras. (8-12) Por este motivo y en base a los conocimientos actuales, se plantea el presente trabajo monográfico con el objetivo de analizar la información disponible acerca de los conceptos, los mecanismos de acción y los efectos tanto beneficiosos como colaterales de algunos de estos alimentos y nutroterápicos, a fin de considerar su aplicación dietoterápica en los pacientes quemados.
Los objetivos del presente trabajo fueron: 1) Identificar los diferentes pre-, pro- y simbióticos, sus propiedades, mecanismos de acción, dosis recomen-dadas y efectos colaterales de su uso; 2) describir la ecología bacteriana intestinal normal; 3) describir el fenómeno de translocación bacteriana y la alteración de la permeabilidad de la mucosa intestinal en el paciente que sufre injurias por quemaduras, y 4) reconocer los productos alimenticios y nutroterápicos funcionales con efecto pre-, pro- y simbiótico más adecuados que puedan ser ofrecidos oportunamente al paciente quemado.
Prebióticos, probióticos y simbióticos
Antes de abordar el tema de los prebióticos, debemos conocer el concepto de fibra ya que la definición de aquellas sustancias se solapa en parte con la de ésta. Desde un punto de vista práctico, se considera apropiado clasificar a las fibras según su grado de fermentación, lo que da lugar a dos grupos claramente diferenciados: el de la fibra fermentable, soluble y viscosa; y el de la fibra escasamente fermentable, insoluble y no viscosa. (4,13,14 )
Algunos componentes presentes de la fibra fermentable son denominados prebióticos, definidos como ingredientes alimenticios que:
-
Resisten la hidrólisis y la absorción en la parte alta del TGI;
-
Son fermentados por la microbiota intestinal.
-
Son capaces de estimular selectivamente el crecimiento y/o la actividad de las bacterias intestinales benéficas, por ejemplo especies de Lactobacillus y Bifidobacterium. (15-17)
La dosis diaria recomendada para los prebióticos es mayor a 10 g/día (18) y de elección, 20 a 30 g (2,19); en la población infantil, 1 a 3 g por día. (20) De acuerdo con Bengmark, todos los pacientes críticos sometidos a nutrición enteral deberían recibir en forma rutinaria más de 10 g/día de pectina, con los siguientes objetivos: protección contra las úlceras pépticas, prevención de la oxidación, estímulo y promoción de la flora intestinal. (2,21)
Los prebióticos son capaces de provocar dolor y distensión abdominal así como flatulencias y diarrea. Estos síntomas son secundarios al efecto osmótico y a la fermentación en la luz intestinal del colon y/o intestino delgado. Sin embargo, estos síntomas raramente son observados con una dosis diaria menor a 20 g, existiendo amplia variabilidad interindividual dosis -respuesta. (2,18) De ahí, que algunos autores propongan como dosis efectivas en adultos cantidades menores a las mencionadas más arriba: 5 a 15 g de prebióticos al día. (20,22)
El término probiótico significa "a favor de la vida". Según la FAO (2002), son "microorganismos vivos que ejercen una acción benéfica sobre la salud del huésped al ser administrados en cantidades adecuadas"/"alimentos susceptibles de producir un efecto benéfico sobre una o varias funciones específicas en el organismo, más allá de los efectos nutricionales habituales, de mejorar el estado de salud y de bienestar y/o de reducir el riesgo de una enfermedad". Definiciones más recientes los indican como "ingrediente alimentario microbiano vivo, que al ser ingerido en cantidades suficientes, ejerce efectos benéficos sobre la salud de quien lo consume". (23)
La dosis recomendada de probióticos ha sido motivo de controversia existiendo amplia variabilidad de dosis en los diferentes ensayos clínicos realizados. No obstante, el número de bacterias viables que alcanzan o colonizan el intestino depende de otros factores además de la dosis, particularmente de la fórmula probiótica (cuya acidez y fecha de elaboración inciden en la viabilidad de los microorganismos), la co-administración de alimentos o leche (que pueden proteger al probiótico del ácido gástrico), y el pH estomacal del individuo, su motilidad intestinal y la composición previa de su flora. (20,24-26) De ahí que aún no sea posible establecer una dosis general para los probióticos; la dosificación tiene que estar basada en estudios en humanos que muestren un beneficio para la salud. (27)
Por otra parte, los probióticos pueden, teóricamente, ser responsables de cuatro tipos de efectos colaterales:
-
Infecciones sistémicas por transmigración. (28-32)
-
Actividades metabólicas perjudiciales, p. ej. acidosis D-láctica.(2,32)
-
Excesiva estimulación inmune en individuos susceptibles. (33-35)
-
Resistencia bacteriana cruzada secundaria a la transferencia de genes.(2,28,29)
Los simbióticos constituyen un grupo diferente a los probióticos y se definen como "una mezcla de pre-y probióticos destinada a aumentar la supervivencia de las bacterias que promueven la salud, con el fin de modificar la flora intestinal y su metabolismo". El término debe reservarse exclusivamente para los productos que poseen verificación científica de la simbiosis, es decir en los cuales los prebióticos favorecen selectivamente a los probióticos adicionados con este simbiótico en particular. (23) La evidencia actual, aún escasa e incipiente, parece demostrar que el uso de un simbiótico es capaz de optimizar los resultados con relación a los probióticos en términos de modulación inmune y control bioecológico intestinal. (36)
En el mercado actual de nuestro país existen numerosos alimentos lácteos y nutroterápicos funcionales adicionados con pre- y probióticos, de los cuales se han analizado algunos de ellos, teniendo en cuenta como criterio de selección el valor calórico de los mismos dado que se considera que la dieta general del paciente quemado debe cubrir elevados requerimientos de energía. (Tablas 1 y 2)
Tabla 1. Alimentos funcionales prebióticos, probióticos y simbióticos analizados: información nutricional.

* Sólo se describen los yogures en cuya formulación se adicionaron cultivos probióticos distintos de los propios, es decir, diferentes de Lactobacillus bulgaricus y Streptococcus thermophilus.
Tabla 1. Continuación

Fuente: Elaboración propia a partir de información recopilada de los rótulos de los productos.
Tabla 2. Producto (y laboratorio que lo elabora) Prebiótico o probiótico Concentración Fórmulas para nutrición enteral en polvo
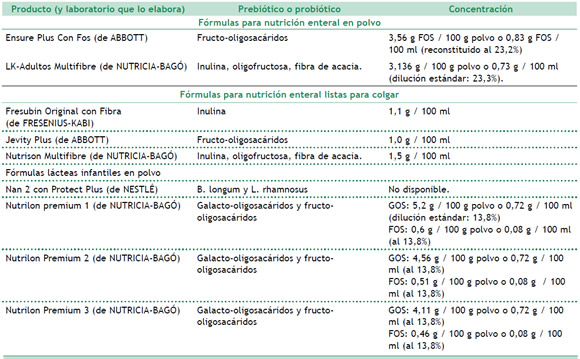
Fuente: Elaboración propia a partir de información recopilada de los rótulos de los productos.
El intestino de estrés
El intestino tiene funciones endocrinas e inmunológicas, además de las habituales de digestión, metabolismo y absorción de nutrientes. (3,4) Normalmente el intestino delgado es estéril, a diferencia del intestino grueso donde existe una interacción competitiva entre las distintas especies de bacterias, adecuadas a la disponibilidad de sustratos metabólicos. Otra importante función, es la de actuar de barrera entre los medios interno y externo. (37) La mucosa gastrointestinal posee la condición única de ser una interfase frágil pero vital entre el medio interno y el medio externo del cuerpo. A lo largo de casi todo el TGI, una sola capa de epitelio columnar simple constituye la barrera entre el medio corporal interno estéril y la luz intestinal, con su alta concentración bacteriana. La capacidad regenerativa del epitelio intestinal es notable. (38)
La función de protección está determinada por los efectos de barrera atribuibles, entre otros, a la integridad celular de la mucosa y a los complejos de unión entre las células epiteliales. (39) Las células altamente especializadas producen moléculas de alto peso molecular con radicales proteicos y numerosos polisacáridos en las cadenas laterales, así como la mucina que forma una superficie protectora de gel. (40)
La translocación se debe a:
a. la pérdida de la función de barrera (debido a acidosis de la mucosa, hipoxia, estrés oxidativo y depleción de energía como ocurre en quemaduras, traumatismos, shock hemorrágico o séptico, obstrucción e isquemia intestinal, en los que disminuye el flujo sanguíneo a la mucosa intestinal) (38,39);
b. la modificación en el contenido cuantitativo y cualitativo de las bacterias de la luz intestinal (al detenerse el tránsito intestinal -íleo- y el barrido que éste provoca en el contenido luminal, se favorece la proliferación de los gérmenes y la adherencia de éstos al enterocito) (41), y
c. las alteraciones inmunológicas del huésped (secundarias a administración de glucocorticoides, inmunosupresión o agotamiento proteico). (42)
Prebióticos, probióticos y simbióticos en el paciente quemado
El individuo con lesiones por injuria térmica, química, eléctrica o biológica es un enfermo muy lábil, anormal en cuanto a sus sistemas y con gran posibilidad de presentar disfunción inmunitaria. Las infecciones constituyen actualmente la principal amenaza vital en los pacientes que superan la fase inicial de shock-resucitación tras una quemadura severa. (43)
En relación a esto, en los últimos años ha surgido el concepto de que aquellos pacientes que sufren los efectos del hipercatabolismo como consecuencia de un procedimiento quirúrgico, cáncer o quemaduras extensas son candidatos para la inmunonutrición. No obstante, cabe destacar que el uso de la inmunonutrición requiere una consideración juiciosa de los potenciales efectos indeseables de determinados agregados a preparados dietoterápicos, donde una sobreestimulación de la respuesta inmunológica puede traducirse en daño tisular y alteración de las defensas de las mucosas. (44)
La función de barrera gastrointestinal se altera en los pacientes quemados observándose que la permeabilidad intestinal se incrementa hasta cuatro veces inmediatamente después de sufrir la quemadura. La permeabilidad intestinal retorna a los niveles basales dos semanas después de la injuria, mientras que la gástrica se recupera más lentamente, desconociéndose aún las causas de dicha diferencia en el tiempo de normalización. (6)
El fallo de la barrera gastrointestinal que ocurre luego de la quemadura resulta probablemente de la vasoconstricción esplácnica y la isquemia intestinal inducida por la liberación masiva de hormonas catabólicas. Este fenómeno posiblemente esté asociado con un aumento de la apoptosis que ocurre en el epitelio digestivo o con las alteraciones del desarrollo del citoesqueleto limitante. (45)
El estrés que sigue al descenso del flujo sanguíneo mesentérico durante una quemadura severa no provocaría por sí solo la TB, pero una vez que es acompañado por un trauma, sobreviene la translocación. (39,46) Además, la composición de la flora gastrointestinal contribuye al grado de pasaje de bacterias y toxinas. Cuanto mayor es la concentración de bacterias patógenas, mayor es la incidencia de translocación, con lo cual el mantenimiento de la flora normal en el TGI disminuiría el nivel de pasaje de bacterias y endotoxinas. (47)
La antibioticoterapia, también muy común en el tratamiento de quemaduras, contribuye a la TB ya que altera la flora digestiva. (39,47) Ha sido demostrado en modelos animales que dicha injuria en sí produce TB, hallándose que la severidad de aquélla está directamente relacionada con la translocación. (5,48)
Por otra parte, se ha observado en roedores con quemaduras un marcado descenso de la microbiota intestinal anaeróbica, incluyendo las bifidobacterias, y al mismo tiempo, un incremento de las bacterias aeróbicas y los hongos. Como consecuencia, se produce un desequilibrio de la relación aerobios/anaerobios y una disminución de la resistencia a la colonización. Esto resulta en un aumento pronunciado de la translocación de bacterias y endotoxinas asociado a lesiones histológicas de la mucosa, un descenso de la cantidad de mucina e IgA secretora intestinal, y un incremento de los niveles de citoquinas proinflamatorias. (49,50) Alteraciones similares se observaron en pacientes quemados. (39,51)
La suplementación a ratas quemadas con una preparación de bifidobacterias redujo el desequilibrio de la relación aerobios/anaerobios, la endotoxemia y las lesiones mucosas (52), y también estimuló la expresión y la excreción de IgAs (50,53); la administración de una preparación con las mismas bacterias restauró la flora intestinal y detuvo la diarrea en humanos que sufrieron quemaduras. (51) Con respecto al empleo de probióticos como lactobacilos o levaduras, los estudios arrojaron resultados contradictorios tanto en modelos animales (54) como humanos. (47,55-57) Por otro lado, Olguín et al. hipotetizaron que la estimulación de las bifidobacterias y los lactobacilos endógenos mediante prebióticos podría proteger contra alteraciones de la mucosa gastrointestinal. No obstante, hallaron que la ingesta de oligofructosa no mejora la función de barrera gastrointestinal de los pacientes quemados. (45)
Conclusiones
La piel indemne representa una barrera infranqueable para los microorganismos. La pérdida de este órgano tan importante por efecto de una quemadura permite la colonización, la infección y la invasión por gérmenes.
La isquemia esplácnica y los fenómenos multifactoriales de translocación pueden suceder precozmente luego de la injuria inicial (ya sea antes o durante la reanimación del paciente gran quemado), actuando a su vez el intestino como un órgano blanco de injurias a distancia, lo que genera inflamación, local o sistémica, y alteración de la permeabilidad intestinal.
Todos estos mecanismos - sumados, entre otros, a la disrupción de la flora normal por el uso de antibióticos de amplio espectro - facilitan la adherencia y la penetración de microorganismos y macromoléculas antigénicas en un individuo cuya función inmunológica se encuentra de por sí alterada. De esta forma, el aumento de la permeabilidad gastrointestinal conlleva una mayor posibilidad de infecciones incontroladas que pueden conducir a la muerte en los pacientes quemados. De hecho, una vez dañada la barrera, la penetración de antígenos tiende a perpetuarse a través de los mecanismos descritos, en los que cobra especial relevancia la cascada inflamatoria.
En el pasado, las posibilidades de sobrevivir a una quemadura grave eran muy escasas; ahora, debido al mayor conocimiento de la respuesta del organismo a la lesión (endocrina, metabólica e inmunitaria), se ha logrado un avance importante en su tratamiento mejorando, entre otras cosas, la calidad del aporte nutricional. En efecto, actualmente el enfoque de tratamiento dietoterápico se orienta a incluir en los esquemas de alimentación los productos que pueden no sólo nutrir, sino también aquellos que mejoran la respuesta anabólica en todos sus aspectos.
Partiendo de la premisa de que el soporte nutricional no sólo debe servir al paciente quemado para alimentarlo y acelerar una buena cicatrización de sus heridas, sino realmente para nutrirlo, mejorar y estimular su respuesta inmunitaria, la selección de un alimento o una fórmula enteral funcional se debe evaluar detenidamente ya que en el mercado existe una gran variedad de productos de los cuales no necesariamente se conoce siquiera el contenido cuantitativo de la sustancia que le otorga la supuesta funcionalidad.
Los prebióticos tienen una fuerte bioactividad y su ingestión ha mostrado reducir la tasa de infección y mejorar la flora intestinal en pacientes enfermos y post-operados. Si bien ya se recomienda su administración de rutina en pacientes críticos, son necesarias más investigaciones que estudien el efecto sobre la función de barrera y la permeabilidad de la mucosa en aquellos que sufren quemaduras. Con respecto al adulto quemado que puede cubrir sus requerimientos por vía oral, se sugiere mantener un adecuado aporte de prebióticos en su dieta a través de alimentos fuente de aquéllos, y considerar en cada caso en particular la inclusión de lácteos funcionales que pudieran eventualmente otorgar un beneficio adicional distinto del logrado por un plan de alimentación saludable, sabiendo no obstante que el contenido de fructanos en dichos productos es bajo. En cuanto a las fórmulas lácteas infantiles que contienen prebióticos se podría obtener una respuesta satisfactoria en términos de un incremento de la cantidad relativa de bifidobacterias intestinales. En este caso se sugiere considerar la cantidad de prebióticos que aportan y el volumen total de leche que recibiría el niño con injuria por quemadura, dada la sintomatología que pueden llegar a ocasionar.
Para garantizar la seguridad en el uso de probióticos, es importante considerar las contraindicaciones potenciales dada la disminución de la inmunocompetencia en el paciente quemado, así como tener pruebas de su utilización previa segura conforme a la dosis recomendada y la vía de administración, la frecuencia de asociación de las especies con infecciones, la probabilidad de generación de productos finales nocivos en su metabolismo y la asociación con transferencia de resistencia a antibióticos. Los efectos terapéuticos que arroja la literatura acerca de la utilización de productos con pro- y simbióticos en el tratamiento del adulto quemado son en general modestos, siendo fundamental la realización de más estudios sistemáticos de dosis-respuesta para poder formular recomendaciones en cuanto a su consumo y más aún de aquellos disponibles en el mercado. Cada cepa debe ser cuidadosamente seleccionada, con investigaciones realizadas tanto en animales como en humanos para detectar posibles efectos secundarios. Incluso en el caso del yogur, se sugiere retrasar su inclusión en la dieta del paciente quemado crítico. Tampoco está aún garantizada la inocuidad de las fórmulas lácteas infantiles adicionadas con probióticos en el paciente pediátrico que sufre este tipo de injuria.
El tratamiento inmunonutricional con fórmulas enterales y alimentos funcionales adicionados con pre-, pro-y simbióticos aún está en su infancia. La experiencia en el abordaje del paciente quemado con dichos productos es limitada, existiendo no obstante resultados prometedores que hacen necesarios nuevos estudios clínicos controlados que permitan la acumulación de evidencia científica sobre los efectos y la seguridad de esta estrategia terapéutica en los pacientes inmunocomprometidos por injuria por quemadura
1. Moreno Villares JM. Flora bacteriana intestinal. An Pediatr (Barc).2006 Ago;4(1):12-9. [ Links ]
2. Manzanares W, Alonso M, Biestro A. Probióticos, Prebióticos y Simbióticos en pacientes críticos. Rev Bras Nutr Clin. 2006 May;21(2):155-62. [ Links ]
3. Guarner Aguilar F. Funciones de la microflora intestinal. Alim Nutri Salud. 2006;13(2):41-7. [ Links ]
4. Guarner F. Papel de la flora intestinal en la salud y en la enfermedad. Nutr Hosp. 2007;22(2):14-9. [ Links ]
5. Deitch E. Intestinal permeability is increased in burn patients shortly after injury. Surgery. 1990 May;107(4):411-6. [ Links ]
6. Olguín F, Rivera R, Brunser O, Olguín R, Gotteland M. Estudio de la función de barrera gástrica e intestinal y su evolución en el tiempo en pacientes quemados. Cir Plást Iberolatinoam. 2007 Dic;33(4):203-8. [ Links ]
7. Gatt M, Reddy BS, MacFie J. Review article: bacterial translocation in the critically ill - evidence and methods of prevention. Aliment Pharmacol Ther. 2007 Apr 1;25(7):741-57. [ Links ]
8. Bengmark S, Gil A. Control bioecológico y nutricional de la enfermedad: prebióticos, probióticos y simbióticos. Nutr Hosp. 2006;21(2):73-86. [ Links ]
9. Olveira Fuster G, González-Molero I. Probióticos y prebióticos en la práctica clínica. Nutr Hosp. 2007; 22(2):26-34. [ Links ]
10. Duggan C, Gannon J, Walker WA. Protective nutrients and functional foods for the gastrointestinal tract. Am J Clin Nutr. 2002 May;75(5):789-808. [ Links ]
11. Watzl B, Girrbach S, Roller M. Inulin, oligofructose and immunomodulation. Br J Nutr. 2005; 93(1):S49-55. [ Links ]
12. Taranto MP, Médici M, Font de Valdez G. Alimentos funcionales probióticos. Química Viva. 2005 May;1(4):26-34. [ Links ]
13. García Peris P, Velasco Gimeno C. Evolución en el conocimiento de la fibra. Nutr Hosp. 2007 May;22(2):20-5. [ Links ]
14. Escudero Álvarez E, González Sánchez P. La fibra dietética. Nutr Hosp. 2006;21(2):61-72. [ Links ]
15. Gibson GR. Fibre and effects on probiotics (the prebiotic concept). Clin Nutr Suppl. 2004;1(2):25-31. [ Links ]
16. Roberfroid M. Prebiotics: The Concept Revisited. J Nutr. 2007 Mar;137(3 Suppl 2):830-7. [ Links ]
17. Lomax AR, Calder PC. Prebiotics, immune function, infection and inflammation: a review of the evidence. Br J Nutr. 2009 Mar; 101(5):633-58. [ Links ]
18. Tuohy KM, Rouzaud GC, Brück WM, Gibson GR. Modulation of the Human Gut Microflora Towards Improved Health Using Prebiotics - Assessment of Efficacy. Curr Pharm Des. 2005 Jan;11(1):75-90. [ Links ]
19. Madrigal L, Sangronis E. La inulina y derivados como ingredientes claves en alimentos funcionales. ALAN. 2007 Dic;57(4):387-96. [ Links ]
20. Arenas Márquez H, Anaya Prado R. Nutrición enteral y parenteral. 1ª edición. México, DF. McGraw-Hill-Interamericana, 2007. [ Links ]
21. Bengmark S, Ortiz de Urbina JJ. Simbióticos: una nueva estrategia en el tratamiento de pacientes críticos. Nutr Hosp. 2005 Abr;20(2):147-56. [ Links ]
22. Macfarlane GT, Steed H, Macfarlane S. Bacterial metabolism and health-related effects of galactooligosaccharides and other prebiotics. J Appl Microbiol. 2008 Feb;104(2):305-44. [ Links ]
23. Olagnero G, Genevois C, Irei V, Marcenaro J, Bendersky S. Alimentos funcionales: conceptos, definiciones y marco legal global. DIAETA. 2007 Sept;25(121):20-33. [ Links ]
24. Ortega R, Marcos A, Aranceta J, Mateos J, Requejo A, Serra Majem L. A-limentos Funcionales. Probióticos. 1ª Edición. Madrid. Médica Panamericana, 2002. [ Links ]
25. Acevedo CG, Romero JO, Espejo RT. Actividad de distintas presentaciones comerciales de Saccharomyces boulardii. Rev Chil Nutr. 2003 Abr;31(1):33-8. [ Links ]
26. Spindler-Vesel A, Bengmark S, Cerovic O. Synbiotics, Prebiotics, Glutamine, or Peptide in Early Enteral Nutrition: A Randomized Study in Trauma Patients. J Parenter Enteral Nutr. 2007 Abr;31(2):119-26. [ Links ]
27. Organización Mundial de Gastroenterología. Guías prácticas: Probióticos y Prebióticos. 2008 http://www.worldgastroenterology.org/assets/downloads/es/pdf/guidelines/19_probioticos_prebioticos_es.pdf (última consulta: diciembre de 2008). [ Links ]
28. ftp://ftp.fao.org/docrep/fao/009/a0512s/a0512s00.pdf/ (consultada en octubre de 2008). [ Links ]
29. Boyle RJ, Robins-Browne RM, Tang ML. Probiotic use in clinical practice: what are the risks?. Am J Clin Nutr. 2006 Jun;83(6):1256-64. [ Links ]
30. Liong MT. Safety of probiotics: translocation and infection. Nutr Rev. 2008 Apr;66(4):192-202. [ Links ]
31. Land MH, Rouster-Stevens K, Woods CR, Cannon ML, Cnota J, Shetty AK. Lactobacillus sepsis associated with probiotic therapy. Pediatrics 2005 Jan;115(1):178-81. [ Links ]
32. Ishibashi N, Yamazaki S. Probiotics and safety. Am J Clin Nutr. 2001 Feb;73(2 Suppl):465-70. [ Links ]
33. Schlegel L, Lemerle S, Geslin P. Lactobacillus species as opportunistic pathogens in immnunocompromised patients. Eur J Clin Microbiol Infect Dis. 1998 Dic;17(12):887-8. [ Links ]
34. Riquelme AJ, Calvo MA, Guzmán AM, Depix MS, García P, Pérez C, Arrese M, Labarca JA. Saccharomyces cerevisiae fungemia after Saccharomyces boulardii treatment in immunocompromised patients. J Clin Gastroenterol. 2003 Jan;36(1):41-3. [ Links ]
35. Muñoz P, Bouza E, Cuenca-Estrella M, Eiros JM, Pérez MJ, Sánchez-Somolinos M, Rincón C, Hortal J, Peláez T. Saccharomyces cerevisiae Fungemia: An Emerging Infectious Disease. Clin Infect Dis. 2005 Jun;40(11):1625-34. [ Links ]
36. Bengmark S. Synbiotics to strengthen gut barrier function and reduce morbidity in critically ill patients. Clin Nutr. 2004 Feb;23(4):441-5. [ Links ]
37. Doyle MP, Beuchat LR, Montville TJ. Microbiología de los alimentos. Fundamentos y fronteras. 1ª Edición. Zaragoza. Acribia, 1997. [ Links ]
38. Cotran RS, Kumar V, Collins T. Robbins, Patología estructural y funcional. 6ª Edición. Mexico, DF. McGraw-Hill Interamericana, 2000. [ Links ]
39. Magnotti LJ, Edwin A, Deitch E. Burns, bacterial translocation, gut barrier function, and failure. J Burn Care Rehabil. 2005 Oct;26(5):383-91. [ Links ]
40. Patiño Restrepo J. F., Metabolismo, nutrición y shock. 4ª Edición. Bogotá. Médica Panamericana, 2006. [ Links ]
41. Velasco FN. Barrera intestinal del paciente crítico: realidades y tendencias. Rev Méd Chile. 2006 Ago;134(8):1033-9. [ Links ]
42. Shils ME, Olson JA, Shike M, Ross AC. Nutrición en salud y enfermedad. 9ª Edición. Mexico, DF. McGraw-Hill Interamericana, 2002. [ Links ]
43. Robles Gris J. Nutrición en el paciente críticamente enfermo. 1ª Edición. Mexico, DF. McGraw-Hill Interamericana, 1996. [ Links ]
44. Levy J, Turkish A. Protective nutrients. Curr Opin Gastroenterol. 2002 Nov;18(6):717-22. [ Links ]
45. Olguín F, Araya M, Hirsch S, Brunser O, Ayala V, Rivera R, Gotteland M. Prebiotic ingestion does not improve gastrointestinal barrier function in burn patients. Burns. 2005 Jun;31(4):482-8. [ Links ]
46. Deitch EA, Bridges RM. Effect of stress and trauma on bacterial translocation from the gut. J Surg Res. 1987 May;42(5):536-42. [ Links ]
47. Koren L, Gurfinkel R, Glezinger R, Perry ZH, Lev-Ari S, Rosenberg L. The effect of Lactobacillus bacteria supplement on sepsis and its complications in patients with acute burns. Burns. 2007 Aug;33(5):594-8. [ Links ]
48. Ryan CM, Yarmush ML, Burke JF, Tompkins RG. Increased gut permeability early after burns correlates with the extent of burn injury. Crit Care Med. 1992 Nov;20(11):1508-12. [ Links ]
49. Chen J, Zhang Y, Xiao G. A preliminary study of the postburn intestinal biological barrier injury in severely burned rats. Chin J Burns. 2002 Aug;18(4):216-9. [ Links ]
50. Wang Z, Xiao G, Yao Y, Guo S, Lu K, Sheng Z. The role of bifidobacteria in gut barrier function after thermal injury in rats. J Trauma. 2006 Sep;61(3):650-7. [ Links ]
51. Chen J, Zhang Y, Xiao G. A preliminary clinical study of bifidobacteria preparation on the treatment of diarrhea in severely burned patients. Chin Med J (Engl). 1998 Apr;111(4):381-2. [ Links ]
52. Wang ZT, Yao YM, Xiao GX, Sheng ZY. Improvement of bifidobacterial supplement on the barrier function of intestinal mucosa and microbe flora induced by thermal injury in rats. Chin Crit Care Med. 2003 Mar;15(3):154-8. [ Links ]
53. Wang ZT, Yao YM, Xiao GX, Cao WH, Sheng ZY. Bifidobacterial supplement enhances the expression and excretion of intestinal sIgA in severely burned rats. Chin J Surg. 2003 May;41(5):385-8. [ Links ]
54. Gun F, Salman T, Gurler N, Olgac V. Effect of probiotic supplementation on bacterial translocation in thermal injury. Surg Today. 2005;35(9):760-4. [ Links ]
55. Herek O, Kara IG, Kaleli I. Effects of Antibiotics and Saccharomyces boulardii on Bacterial Translocation in Burn Injury. Surg Today. 2004;34(3):256-60. [ Links ]
56. Viggiano M, Badetti C, Bernini V, Garabedian M, Manelli JC. Saccharomyces boulardii fungemia in a patient with severe burns. Ann Fr Anesth Reanim. 1995;14(4):356-8. [ Links ]
57. Lu X, Han CM, Yu JX, Fu SZ. Preliminary comparative study on the effects of early enteral supplementation of synbiotics on severely burned patients. Chin J Burns. 2004 Aug;20(4):198-201. [ Links ]














