Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Diaeta
On-line version ISSN 1852-7337
Diaeta vol.33 no.150 Ciudad Autónoma de Buenos Aires Mar. 2015
COMUNICACIÓN BREVE
¿Es la ingesta de sodio una barrera al consumo de agua en una alimentación saludable?
Is sodium intake a barrier to water consumption in a healthy diet?
Lic. Sergio Britos
Profesor Asociado, Escuela de Nutrición (Facultad de Medicina, UBA) Director del Centro de Estudios sobre Políticas y Economía de la Alimentación (CEPEA)
Correspondencia: sbritos@nutrinfo.com.ar
Recibido: 21/02/2014.
Aceptado en su versión corregida: 27/10/2014
Resumen
La preocupación por una elevada ingesta de sodio a través del consumo de alimentos y bebidas deriva en varias ocasiones en recomendaciones restrictivas de productos que no se caracterizan por ser fuente del mismo, como es el caso de las aguas envasadas.
La población argentina (promedio) consume diariamente un volumen de líquidos ajustado a las recomendaciones definidas por grupos de expertos. Sin embargo, el perfil de calidad no es el mejor, no a causa del sodio sino, a la alta proporción de azúcar incorporada a las bebidas.
A la vez, algunos profesionales de salud y nutrición manifiestan confusión acerca de los criterios de rotulación y declaración de propiedades relativas al sodio, factor que puede incidir en recomendaciones erróneas a la población.
Por último, el propio Código Alimentario Argentino propicia esta confusión ya que prescribe un tratamiento diferencial para la rotulación y declaración de contenido de sodio entre aguas envasadas y bebidas.
Palabras clave: Sodio; Agua; Bebidas; Recomendación; Rotulado.
Abstract
Concern about high sodium intake through consumption of food and beverages usually derives in restrictive recommendations of products that are not source of such, as in the case of packaged waters.
The Argentine population (average) consumes daily a liquids volume adjusted to the recommendations defined by a group of experts. However, the quality profile is not the best, not because of sodium but due to a high proportion of sugar incorporated to the drinks.
At the same time, some health and nutrition professionals express confusion about the criteria for labeling and declaration of properties of sodium, a factor that can help in giving the population erroneous recommendations.
Lastly, the Argentine Food Code itself encourages this confusion as it prescribes a differential treatment for labeling and declaration of properties of sodium in packaged waters and beverages.
Keywords: Sodium; Water; Drinks; Recommendation; Labeling.
Introducción
Las Guías Alimentarias (1) para la población argentina destacan la importancia del consumo de agua, sugiriendo un volumen de 2 lt. diario como cantidad recomendada. Sin embargo y siendo, según algunos autores (2), un componente esencial de la alimentación, la preocupación por una elevada ingesta de sodio a través de alimentos y bebidas deriva en que algunos profesionales de salud y nutrición enfatizan el sodio de las aguas envasadas como una barrera hacia su inclusión en una alimentación saludable (3).
El propósito de este artículo de opinión es realizar una revisión de las recomendaciones y patrones de ingesta de sodio en el contexto del conocimiento y actitudes de los profesionales de salud al indicar agua según su condición o no de fuente de este mineral.
La información sobre patrones de consumo de agua o líquidos es escasa. En 2009, el Centro de Estudios sobre Nutrición Infantil (CESNI) realizó una investigación (HidratAr) sobre hábitos de hidratación en cuatro grandes conglomerados urbanos (4). Sus resultados revelaron una ingesta diaria promedio de 2,05 lt/persona, un volumen similar a las recomendaciones promedio del Instituto de Medicina de Estados Unidos (IOM) y la Autoridad Europea de Seguridad Alimentaria (EFSA) (5,6) lo que refleja que una proporción de la población tenía un consumo inferior a las mismas. Sin embargo, uno de los hallazgos más importantes de la investigación fue la escasa proporción de agua ingerida, tan solo un 21% del total. Por el contrario, la mitad de los líquidos fueron bebidas e infusiones con azúcar agregado (4).
De los resultados de HidratAr se desprende que el consumo de agua aporta una baja cantidad de sodio al consumo total diario (4), tal como también se describe en otros trabajos sobre el patrón de ingesta en la población (7). Sin embargo, algunos profesionales de salud y nutrición recomiendan (3) una selectividad no justificada de aguas envasadas argumentando su condición de fuente de sodio.
Al respecto, la Organización Mundial de la Salud (OMS) ha manifestado explícitamente que el agua no es una fuente alimentaria significativa en la ingesta de sodio excepto para personas bajo indicación médica de restricción severa del mineral (menos de 400 mg/día), situación limitada a algunos casos severos de insuficiencia cardíaca o enfermedad renal (8). En su reciente Guía sobre calidad de agua, la OMS afirma que no está demostrada una asociación entre el contenido de sodio de las aguas y la ocurrencia de hipertensión (9).
En condiciones de máxima adaptación las personas pueden subsistir con ingestas de sodio tan bajas como 200 mg diarios (5,6). Sin embargo, dada la presencia natural del mineral acompañando otros nutrientes, aquellos niveles conducirían a otras carencias. Por lo cual su recomendación fue establecida en 2004 por el IOM en 1,5 gr diarios (población general y adultos en particular) (2). El criterio es que esa cantidad compensa las pérdidas corporales y a la vez asegura la incorporación adecuada de otros principios nutritivos esenciales. En niños (mayores de 1 año) la recomendación es de 1 gr y en mayores de 70 años de 1,2 gr. Mientras tanto, el valor máximo en adultos es de 2,3 gr (5).
También es conocida la recomendación de OMS (10) de una ingesta menor a 2 gr en adultos.
La ingesta de sodio en Argentina en cambio, difiere y es significativamente mayor que la recomendación (73% más sin contar el sodio proveniente de la sal de mesa)(7). Según datos de la Encuesta Nacional de Nutrición y Salud (ENNyS, 2007) (11) la ingesta de niños entre 6 y 23 meses de edad es de 921 mg diarios.
En población general, el único dato disponible corresponde a la Hoja de Consumo Aparente de alimentos elaborada por la Escuela de Nutrición de la UBA y correspondiente a información del año 2011 (12). La Hoja de Consumo Aparente (HCA) refleja la cantidad de alimentos y bebidas disponibles para su consumo por el conjunto de la población, sin desagregación por niveles socioeconómicos, etarios o geográficos. Y se elabora a partir de información de los Ministerios de Economía, Agricultura, cámaras empresarias y estudios de mercado. Sus datos no son comparables con los de encuestas alimentarias, pero su información es muy valiosa, de fácil elaboración y replicable anualmente.
Según la HCA 2011, el consumo (disponible) de sodio proveniente de alimentos y bebidas es de 2,6 gr, claramente por encima de la recomendación. De este conjunto, solo 3,7% corresponden a aguas y bebidas (12).
Cualquier estrategia poblacional que pretenda tener impacto en una reducción significativa de sodio en la dieta debe concentrarse en la sal que se agrega a las comidas y en muy pocos productos: pan (de panadería), fiambres y chacinados, carnes (frescas) y quesos (12). El cambio en los patrones de comidas y preparaciones con mayor grado de procesamiento fuera del hogar ha contribuido a una mayor densidad de sodio por unidad de energía (kcal). Este dato surge al comparar la HCA 2011 con otras elaboradas en los años ´80, habiendo pasado de 690 a 866 mg de sodio por cada 1000 kcal (13).
Consumo de agua y bebidas en el contexto de las recomendaciones y patrones de ingesta de sodio
Solo considerando el aporte de sodio de alimentos y bebidas (HCA 2011), el 92% de la ingesta se distribuye como sigue (12): (Gráfico 1)
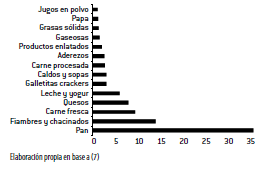
Gráfico 1. Distribución de la ingesta (según consumo aparente) de sodio, Argentina 2011. (% sobre el total de ingesta de sodio)
Según el contenido de sodio de los alimentos (de acuerdo a los valores de una tabla ad-hoc desarrollada por el Centro de Estudios sobre Políticas y Economía de la Alimentación) (7), en el gráfico 2 se observa la cantidad de porciones que se necesitarían para cubrir el 50% de la recomendación diaria de sodio de un conjunto seleccionado de preparaciones y bebidas, ordenadas en forma decreciente.
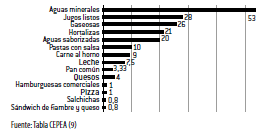
Gráfico 2. Porciones de bebidas y otros alimentos equivalentes a un 50% de la recomendación diaria de sodio
La Tabla 1 refleja los consumos aparentes de diferentes tipos de bebidas según la HCA 2011 y la contribución de cada ítem a la ingesta total de sodio. Los datos demuestran que el aporte de cualquier forma de agua o bebida es irrelevante en el contexto de la dieta global. En conjunto, las bebidas aportan 3,7% de la ingesta de sodio (prácticamente unos 100 mg). Según el estudio HidratAr (4), la suma total de agua (sin sabor dulce ni calorías) representa el 21% de la ingesta total de líquidos y de hecho según datos de consumo medidos por consultoras de mercado, las aguas embotelladas comerciales representan no más del 10% del consumo total de bebidas comerciales (dato suministrado por The Nielsen Company).
Tabla 1. Consumo aparente y contribución a la ingesta de sodio de aguas y bebidas

En ocasión del Panel de Expertos sobre Hidratación Saludable (Sociedad Argentina de Nutrición, setiembre 2011), se analizó el perfil nutricional de un conjunto de 155 bebidas disponibles en el mercado (14). El 37% de las mismas resultaron jugos; 29% aguas saborizadas; 24% gaseosas y el resto se reparte entre aguas minerales (6%), bebidas deportivas y otras.
El contenido promedio de sodio de ese conjunto de productos es de 18 mg/100 ml, el 80% tiene menos de 25 mg/100 ml (12) y el 100% de las aguas se encuentran en el 1ro o 2do quintil de contenido de sodio (del conjunto de bebidas del mercado). Sin embargo, en no pocos casos el consejo médico, aún en personas sanas, es la selección de aguas bajas en el mineral (3).
Conocimientos y actitudes de profesionales de la salud en la indicación de aguas según su condición o no de fuente de sodio
El capítulo XII del Código Alimentario Argentino (CAA) se refiere a aguas y bebidas, mientras que en el capítulo V se establece la referencia (porción) que debe utilizarse para informar el contenido de nutrientes y los criterios para las declaraciones o claims referidos a los mismos.
De ello resulta que para todas las bebidas (capítulo V), la referencia es una porción de 200 ml (de la que quedan exceptuadas las aguas minerales) y el criterio para declarar "bajo en sodio" es un con tenido inferior a 120 mg /100 ml. Mientras que en el caso de las aguas (capítulo XII), la referencia es un litro y el criterio "baja en sodio" es un contenido inferior a 20 mg/ 1000 ml (una quinta parte en un volumen diez veces mayor).
Paradójicamente, varias bebidas con más sodio que un agua mineral pueden ser consideradas bajas en sodio mientras la segunda no.
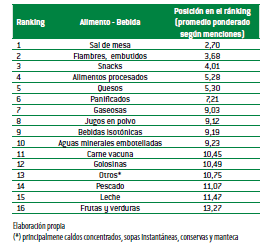
Teniendo en cuenta que lo anterior puede generar alguna confusión, en junio de 2011, el portal Nutrinfo realizó una encuesta on-line a una muestra de 462 profesionales (85% nutricionistas o estudiantes avanzados y el resto principalmente médicos nutricionistas y otros profesionales). El foco fue el contenido de sodio en aguas y bebidas y los conocimientos y criterios de indicación de los profesionales (3). Casi el 10% de las respuestas identifica a las aguas minerales como fuente de sodio, aún cuando su frecuencia de consumo y contenido del mineral son bajos. Una mayoría significativa (85%) reconoce que la sal de mesa es la fuente alimentaria más importante de sodio, mientras un porcentaje muy bajo de respuestas (20%) menciona al pan, siendo que ocupa el segundo lugar en aporte de sodio a la alimentación. El ranking resultante se observa en la Tabla 2.
Tabla 2. Ranking ponderado de alimentos según aporte de sodio
Al momento de consultar acerca de la recomendación, las bebidas más recomendadas fueron el agua (46,5%) y entre ellas las aguas minerales, y en segundo lugar los jugos y gaseosas de contenido reducido en calorías (32,7%).
El principal atributo mencionado por los profesionales como motivo para recomendar agua como "saludable" fue el contenido de sodio (81% de menciones), con un margen muy amplio sobre otros motivos (confiabilidad, composición, "natural", sabor). Por el contrario, las bebidas de mayor frecuencia de no recomendación fueron las gaseosas sin especificar, jugos y aguas saborizadas y la principal causa el contenido de azúcar (o calorías).
Siendo que aguas y bebidas tienen diferente unidad de medida en relación con la rotulación de sodio, un 44% de los encuestados lo desconoce (gráfico 3). Sin embargo, entre quienes reconocen esa diferencia, la mayoría no acierta en la unidad de medida correcta. Resultando que tan solo 23% de los consultados tiene un conocimiento completo de estos aspectos de rotulación de sodio en bebidas.
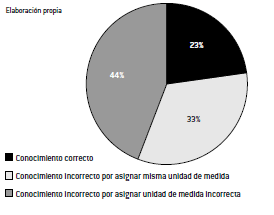
Gráfico 3. Conocimiento sobre unidades de medida de rotulación de sodio en aguas y bebidas (% de respuestas)
Por último, tan solo el 45% de los encuestados sigue la indicación de OMS de limitar el sodio del agua en pacientes con restricción severa del mineral (gráfico 4).
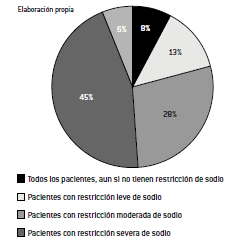
Gráfico 4. Indicación de profesionales en relación con la restricción del sodio de aguas (% de respuestas)
Mientras que 49% indica innecesariamente una restricción aún en pacientes que por su condición de salud no lo requieren.
Conclusión
Los resultados del estudio HidratAr (4) sumado al análisis de los consumos alimentarios (según la HCA 2011) (12) reflejan que el principal problema nutricional asociado al patrón de consumo de bebidas es su condición de vehículo de calorías y no de sodio. El consumo de agua y bebidas representa menos del 4% de su ingesta total y dentro de la categoría, el de agua mineral resulta insignificante (0,16%) (12). De allí se deriva la importancia de promover un mayor consumo de agua y en relación a las demás bebidas, realizar un salto de calidad en cuanto a su contenido calórico. Esto ya que el 50% de los líquidos ingeridos son azucarados, lo que se convierte en un aporte de 350 kcal "ocultas" (14% de la ingesta energética total) (4).
Sin embargo, en la consulta nutricional y aún en el caso de personas sanas, al menos un 10% de profesionales aconseja una conducta restrictiva de bebidas en relación con el sodio, en contraposición a la evidencia (15,16,17).
Peor aún, hay una ventana importante de desconocimiento en las fuentes alimentarias de sodio en la dieta y en la unidad de referencia que se utiliza para informar el contenido del mineral (200 cc en todas bebidas y 1000 ml en las aguas). Además se verifican conductas restrictivas o indicaciones inapropiadas: las aguas de mayor contenido de sodio son consideradas "altas en sodio" por el 44% de los encuestados en el estudio de Nutrinfo (3), cuando en realidad todas las aguas se encuentran como máximo en el segundo quintil de contenido de sodio del universo de bebidas. La diferencia cuantitativa entre un agua con bajo sodio y el resto no justifica una identificación basada en el contenido de ese mineral.
El diferente tratamiento que hace el CAA de las normas de rotulado y declaraciones de contenido de nutrientes entre bebidas y aguas es otro factor que provoca confusión en la indicación profesional y en el propio consumidor.
Varias recomendaciones emergen del análisis efectuado. En primer lugar y en el marco de diferentes programas y campañas de promoción de estilos alimentarios más saludables parece necesario no solo reforzar el mensaje acerca de la necesidad de consumir más agua sino desmitificar el concepto de que la misma es fuente alimentaria de sodio y por lo tanto no se justifica una conducta restrictiva en tal sentido en la población general, tal como lo sostiene la OMS (8, 9,10, 18).
En segundo término, la propia formación de profesionales de nutrición y éstos en tanto multiplicadores hacia otros profesionales de salud debe incorporar con más énfasis información acerca del contenido de sodio y sus fuentes alimentarias en el contexto del consumo observado en la población.
Solo en las personas con restricción severa de sodio en la dieta (menos de 400 mg diarios) se justifica una conducta vigilante y restrictiva en el ingreso de ese mineral en todas sus formas alimentarias, incluyendo en este caso las aguas y bebidas (14).
Por último, siendo el agua un producto que debe promoverse en su conjunto en el marco de las estrategias de promoción de una alimentación más saludable, sería deseable que las normas de rotulación y los criterios de declaración de contenido nutricional del Código Alimentario no excluyan de manera explícita a las aguas como ocurre en la versión actualmente vigente. De hecho, desde la perspectiva de la salud y teniendo en cuenta el bajo aporte de sodio, la misma clasificación que el Código Alimentario prescribe para las bebidas puede aplicarse al caso de aguas.
1. AADyND. Guías Alimentarias para la población argentina. Buenos Aires, 2006 [ Links ]
2. Jéquier E, Constant F.; Water as an essential nutrient: the physiological basis of hydration; Eur J Clin Nutr. 2010; 64(2):115-23 [ Links ]
3. Encuesta sobre conocimientos y actitudes de profesionales de salud en la indicación de agua. Nutrinfo (resultados no editados de encuesta online), 2011 [ Links ]
4. Carmuega E.; Patrón de consumo de agua y bebidas en nuestra población. Estudio HidratAr; Actualización en Nutrición 2012; 13(Supl 1):16-17. [ Links ]
5. IOM. NAS. Dietary Reference Intake for water, potassium, sodium, chloride and sulfate. Washington, 2004 [ Links ]
6. EFSA. Scientific opinion on dietary reference values for water. EFSA Journal 2010; 8(3): 1459 [ Links ]
7. Britos S, Saraví A, Chichizola N, Vilella F; Hacia una alimentación saludable en la mesa de los argentinos; Orientación Gráfica Editora; Buenos Aires, 2012 [ Links ]
8. OMS. Nutrients in drinking water. Ginebra, 2005 [ Links ]
9. OMS. Guidelines for drinking water quality; 4th edition. Ginebra, 2011 [ Links ]
10. OMS. Guideline: Sodium intake for adults and children. Ginebra, 2012 [ Links ]
11. Ministerio de Salud de la Nación. Encuesta Nacional de Nutrición y Salud. Documento de Resultados. Buenos Aires, Argentina 2007 [ Links ]
12. Britos S, Saraví A, Chichizola N; Estado de la Alimentación Saludable 2011; Escuela de Nutrición, Buenos Aires, 2012; disponible en www.cepea.com.ar [ Links ]
13. FAO; Hojas de balance de alimentos; FAOSTAT; disponible en www.fao.org (acceso 19/12/2013) [ Links ]
14. Sociedad Argentina de Nutrición. Suplemento especial sobre Hidratación; Actualización en Nutrición 2012; 13(Supl 1).
15. Practice quideline: Management of adult patients with ascitis due to cirrhosis. Hepatology 2004;39. 841-56 [ Links ]
16. Hernandez A; Ramon JR; Martell N; Cuenca E; Marquez J. Human lipid peroxidation and blood pressure changes in normotensive and hypertensive patients crenotherapy-treated with sulphured mineral waters and peloids. Proceedings of 17º Congress of the International Association of Gerontology. 2000. Vancouver. Canadá. P398. [ Links ]
17. Schoppen R, Perez Granados AM, Carvajal A, Oubina P, Sanchez-Mumiz FJ, Gomez-Gerique JA, Vaquero MP. A sodium-rich carbonated mineral water reduces cardiovascular risk in postmenopausal women. J Nutr 2004; 134: 1058-63. [ Links ]
18. OMS. Sodium in drinking water. 2003 [ Links ]^rND^sJéquier^nE^rND^sConstant^nF^rND^sCarmuega^nE^rND^sHernandez^nA^rND^sRamon^nJR^rND^sMartell^nN^rND^sCuenca^nE^rND^sMarquez^nJ^rND^sSchoppen^nR^rND^sPerez Granados^nAM^rND^sCarvajal^nA^rND^sOubina^nP^rND^sSanchez-Mumiz^nFJ^rND^sGomez-Gerique^nJA^rND^sVaquero^nMP^rND^1A01^sBenitez^nCecilia Alicia^rND^1A01^sYapura^nAna Liliana^rND^1A01^sCravero Bruneri^nAndrea Paula^rND^1A01^sMillán^nMónica Patricia^rND^1A01^sBenitez^nCecilia Alicia^rND^1A01^sYapura^nAna Liliana^rND^1A01^sCravero Bruneri^nAndrea Paula^rND^1A01^sMillán^nMónica Patricia^rND^1A01^sBenitez^nCecilia Alicia^rND^1A01^sYapura^nAna Liliana^rND^1A01^sCravero Bruneri^nAndrea Paula^rND^1A01^sMillán^nMónica Patricia
ARTÍCULO ORIGINAL
Utilización de mezclas de harinas de trigo-chía y fitoesteroles en polvo para la elaboración de un producto de panificación dietético
Use of mixtures of wheat-chia flours and phytosterol powder for the preparation of a dietary bakery product
Benitez Cecilia Alicia1, Yapura Ana Liliana1, Cravero Bruneri Andrea Paula1, Millán Mónica Patricia1
1Licenciada en Nutrición. Facultad de Ciencias de la Salud. Universidad Nacional de Salta. República Argentina.
Correspondencia: andreapaulacravero@gmail.com
Recibido: 3/10/2014.
Aceptado en su versión corregida: 7/04/2015
Resumen
Introducción: Los productos de panificación son una alternativa para desarrollar alimentos funcionales incorporando agentes bioactivos (fitoesteroles) y utilizando ingredientes no tradicionales (harina de chía) destinados a población con enfermedades crónicas no transmisibles (ECNT).
Materiales y método: Se utilizaron mezclas de harinas trigochía parcialmente desgrasada (70:30 y 80:20); aceite de oliva, leche descremada, levadura, azúcar y extracto de malta. Se seleccionó la mezcla preferida con 40 panelistas mediante test pareado simple. Se elaboraron panes con tres concentraciones de fitoesteroles en polvo (2, 4 y 6 g%), seleccionando la fórmula óptima por prueba de preferencia (Ranking u ordenamiento) en 100 consumidores. Al producto preferido se le determinó: composición química (AOAC), fibra alimentaria; fitoesteroles y aceptabilidad (Escala hedónica). Se determinaron porcentajes de adecuación de los valores diarios recomendados de fibra y fitoesteroles. Se seleccionó envase y se diseñó el rótulo según normas vigentes.
Resultados: La mezcla de harinas preferida fue 80:20 y con 4 g% de fitoesteroles. La composición del producto obtenido fue: humedad 37,93%; Carbohidratos 42,64%; Proteínas 6,79%; Grasa 5,15%; Cenizas 1,53%; Fibra alimentaria 17,5 g%; Sodio 43,07 mg%; Fitoesteroles 1,47 g%. El valor energético fue de 244 Kcal%. El pan formulado presentó 93% de aceptabilidad general. 50 g/ día cubren el 35% y 25% de la IDR de fibra y fitoesteroles respectivamente. El envase fue de polietileno de baja densidad y el rótulo "Vertical A".
Conclusión: El producto obtenido fue de fácil obtención y puede considerarse como alimento funcional. Puede denominarse como "Alimento de Bajo Contenido en Sodio", "Sin sal añadida" y "de Alto Contenido en Fibra Alimentaria", recomendado para personas con ECNT.
Palabras clave: Harina de chía; Fibra; Fitoesteroles; Aceptabilidad; Ingesta diaria recomendada; ECNT.
Abstract
Introduction: Bakery products are an alternative to develop functional foods by incorporating bioactive agents (phytosterols) and using non-traditional ingredients (chia flour) for people with chronic non-communicable diseases (NCD).
Materials and Method: The following were used: wheat-chia flour mixes partially defatted (70:30 and 80:20); olive oil, skim milk, yeast, sugar and malt extract. The preferred mixture was selected with 40 panelists by simple paired test. Breads with three concentrations of phytosterol powder (2, 4 and 6 g%) were prepared, selecting the optimal formula through preference test (Ranking test) in 100 consumers. In the preferred product, the following was determined: chemical composition (AOAC), dietary fiber; phytosterols and acceptability (hedonic scale). Adequacy percentages of recommended daily values of fiber and phytosterols were determined. Package was selected and the label was designed following valid norms.
Results: The preferred flour mixture was 80:20 and 4 g% of phytosterols. The product composition was the following: moisture 37.93%; carbohydrates 42.64%; protein 6.79%; fat 5.15%; Ashes 1.53%; Dietary fiber 17.5 g%; Sodium 43.07mg%; Phytosterols 1.47 g%. The energy value was 244 Kcal%. The formulated bread presented 93% overall acceptability. 50 g/day cover 35% and 25% of the RDI for fiber and phytosterols respectively. The package was of low density polyethylene and labeled "Vertical A".
Conclusion: The obtained product was easy to get and can be considered as a functional food. It can be termed as "Low Sodium Food ", "No added salt" and "High fiber content", recommended for people with NCD.
Keywords: Chia flour; Fiber; Phytosterols; Acceptability; Recommended daily intake; NCD.
Introducción
Un excesivo consumo de energía a base de hidratos de carbono, grasas saturadas y trans, ingesta alta de colesterol, sodio (sal de mesa) y un bajo consumo de fibra junto con estilos de vida sedentarios, son uno de los responsables de la epidemia mundial de Enfermedades Crónicas no Transmisibles (ECNT). La prevención de las mismas está basada en un enfoque de riesgo para identificar aquellos factores que puedan ser modificados mediante intervenciones poblacionales y clínicas oportunas con una adecuada relación costo-beneficio (1).
En nuestro país, el pan es un alimento básico de la dieta habitual, considerado "de consumo masivo". Se estima que cada persona ingiere en promedio el doble de lo recomendado por día (200 g/ día per cápita, es decir 70 kg/habitante/año) (2). Debe considerarse también el consumo de sal de 3,4 a 4,2 g/día/persona, valores que se aproximan al consumo máximo diario recomendado por la Organización Mundial de la Salud (OMS) de 5 g/ dia de sal o su equivalente, 2000 mg de sodio/día. Una reducción del 25% de sal en productos de panificación y un adecuado consumo de los mismos, podría significar un impacto muy beneficioso en la salud de la población (3). Por otra parte, el pan aporta grasas saturadas y no es fuente de fibra alimentaria.
El Ministerio de Salud de la Nación (Plan Argentina Saludable) junto con el Instituto Nacional de Tecnología Industrial (INTI), Centro Cereales y Oleaginosas y la Federación Argentina de la Industria del Pan y Afines (FAIPA), desarrollan acciones tendientes a elaborar panes y productos panificados con menor contenido de sodio y sin grasas trans. Los productos de panificación son matrices alimentarias adecuadas para vehiculizar componentes bioactivos como los fitoesteroles, los que consumidos regularmente tendrían un efecto positivo en la disminución del colesterol sanguíneo (4) y pueden elaborarse utilizando harinas de cereales distintos al trigo o con harinas no tradicionales.
Por todo lo mencionado anteriormente el objetivo de este trabajo fue formular un producto de panificación dietético con mezclas de harinas de trigo - chía adicionado con fitoesteroles, de contenido calórico reducido, bajo tenor graso, hiposódico y alto contenido de fibra alimentaria.
Materiales y método
El estudio fue de tipo experimental, a escala de laboratorio. Se realizaron varios ensayos previos utilizando mezclas de harinas de trigo - chía en dos proporciones: 80:20 (A) y 70:30 (B). Para la elaboración de los productos se siguieron los pasos detallados en el Diagrama Nº 1.
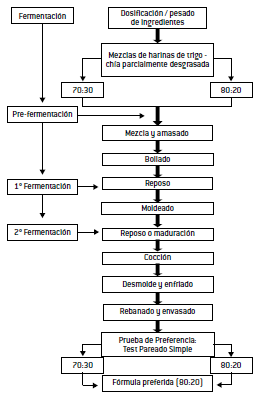
Diagrama Nº 1: Elaboración de panes dietético según dos proporciones de harinas trigo-chía (70:30 y 80:20)
Para la selección de la mezcla óptima se realizó una Prueba de Preferencia (Test Pareado Simple) con un panel de 40 evaluadores no entrenados
Con la mezcla preferida (A) se elaboraron panes variando solo la concentración de fitoesteroles: 2 (C); 4 (D) y 6 (E) g% según peso de harinas (trigo-chía). Estas cantidades se determinaron teniendo en cuenta la recomendación internacional de 1 a 3 gramos de fitoesteroles por día (5) y la porción establecida por el Código Alimentario Argentino (C.A.A.) para productos panificados, envasados, feteados o en rodajas de 50 g para adultos sanos (6). La selección de la concentración óptima de fitoesteroles se evaluó mediante una prueba de preferencia de Ranking u Ordenamiento, con un panel de 100 evaluadores no entrenados. Los datos obtenidos fueron analizados a través de la Tabla de Newell y Mc Farlane, para un nivel de significación del 5% (7). Al producto preferido, se le realizó una Prueba de Aceptabilidad en 100 evaluadores no entrenados utilizando una Escala Hedónica verbal de nueve puntos, categorizada desde "me gusta muchísimo" hasta "me disgusta muchísimo". También se solicitó opinión desde su propia percepción (subjetiva) con respecto al color, sabor, aroma y textura (de la miga y de la corteza) del producto.
La selección de panelistas para las pruebas sensoriales mencionadas anteriormente se realizó por muestreo aleatorio simple en la población de docentes y personal de apoyo universitario (PAU) de Facultad de Ciencias de la Salud de la Universidad Nacional de Salta (panel interno o piloto), mayor de 21 años y usuarios del producto (pan). Las evaluaciones se llevaron a cabo en laboratorio perteneciente al Instituto de Evaluación Sensorial de la mencionada Facultad. En todos los casos las muestras se presentaron en envases descartables, de plástico transparente, codificados con números aleatorios y en una cantidad de 30 ± 2 g. El neutralizante utilizado entre una muestra y otra fue agua a temperatura ambiente. Todo esto servido en bandejas de acero inoxidable.
Al producto formulado se le realizaron las siguientes determinaciones analíticas (por triplicado) según la Asociación de Químicos Analíticos Oficiales (AOAC) (8):
Humedad: método físico directo por Deshidratación en Estufa.
Hidratos de carbono: método de Felling Cause Bonans.
Proteínas: método Micro-kjeldahl.
Extracto etéreo: Hidrólisis Ácida (extracción por solubilización).
Fibra alimentaría total: método enzimático - gravimétrico (9). Cátedra de Bromatología de la Facultad de Farmacia y Bioquímica de la Universidad Nacional de Buenos Aires.
Cenizas: destrucción de la materia orgánica por Calcinación en Mufla.
Sodio: Espectrofotometría de Absorción Atómica.
Fitoesteroles: por cromatografía capilar de gases. Instituto Analítico Especializado S.R.L. Buenos Aires. Con cromatógrafo SHIMADZU GC-17ª. Se tomaron y registraron las siguientes variables durante todo el proceso de elaboración:
Peso: se determinó en crudo y cocido (a temperatura ambiente) con Balanza electrónica Kretz (capacidad máxima de 6 Kg y mínima de 10 g) y Balanza Scout II (capacidad de 0,6 kg y precisión de 0,1 g).
Variación de peso: se calculó a través de la fórmula: peso en cocido – peso en crudo % peso en crudo x 100.
Temperatura: se tuvieron en cuenta las temperatura del aire confinado (según termóstato propio del horno) y las internas de la preparación (al finalizar la cocción y durante el enfriamiento), registradas con Termómetro T-BAR digital Multi-Stem Thermometer (-50ºC - 150ºC y de 1ºC de precisión).
Tiempos de elaboración y cocción: fueron controlados con un cronómetro digital.
Rendimiento del producto: se estableció por el número de porciones obtenidas según la normativa vigente (6).
Características sensoriales: se realizó una descripción cualitativa de los atributos sensoriales: color, sabor - aroma y textura.
Se calculó el porcentaje de adecuación de la Ingesta Diaria Recomendada (IDR) para fibra total y fitoesteroles con las tablas de referencia para la población adulta (5), aplicando la fórmula: Cantidad aportada por pan / Cantidad recomendada x 100. Para fibra se tuvo como referencia la recomendación especificada en el C.A.A. de 25 gramos de fibra/día en base a una dieta de 2.000 kcal para adultos. Para fitoesteroles se consideró una Ingesta Diaria Recomendada (IDR) de 1 a 3 gramos/ día (5).
Para el envasado del pan dietético se utilizaron bolsas de polietileno de baja densidad (10). El modelo seleccionado para el rotulado nutricional fue el modelo Vertical A, conforme a lo establecido por el C.A.A (6). Los fitoesteroles se consignaron en el rotulado según lo establecido por la FDA (5).
Resultados
De la prueba de preferencia por Test Pareado Simple, se obtuvo que el 70% de los panelistas prefirieron el producto elaborado con la mezcla trigochía 80:20 ("A") (Gráfico Nº1). La estandarización del pan elaborado con la mezcla preferida (80:20 o A) se observa en la Tabla Nº 1.
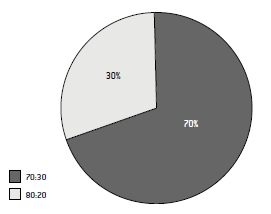
Gráfico Nº 1: Preferencia de los panes dietéticos según mezclas de harinas de trigo-chía (80:20 y 70:30) por Test Pareado Simple.
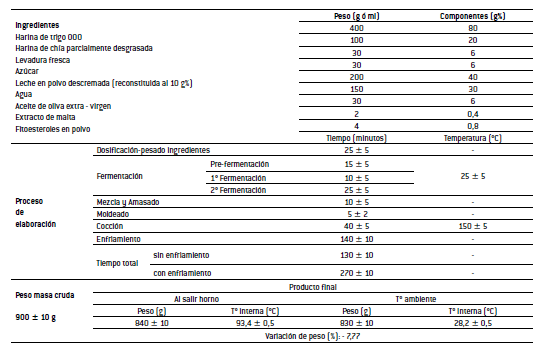
Tabla Nº 1: Estandarización de ingredientes y del proceso de elaboración del pan dietético (80:20) con fitoesteroles (4g%). Fórmula "D".
Al realizar la Prueba de Ranking o Suma de Ordenamiento de los panes dietéticos elaborados con la proporción 80:20 trigo-chía y en diferentes concentraciones de fitoesteroles ("C", "D" y "E") se obtuvo que el producto "C" (2 g% de fitoesteroles) fue asignado en primer lugar de preferencia por los panelistas obteniendo la menor sumatoria. Éste no presentó diferencias significativas con la muestra "D" (4g% de fitoesteroles) ni ésta última con la muestra "E" (6g% de fitoesteroles) (Tabla N° 2). Sin embargo, se optó por la formulación "D" al corresponder mejor con la recomendación nutricional dada tanto por el CAA (6) como por la FDA (5) de 1 a 3 g de fitoesteroles por porción/día.
Tabla Nº 2: Prueba de Preferencia del pan dietético elaborado con la mezcla de harinas de trigo–chía (80:20) y fitoesteroles en tres concentraciones.

El pan dietético "D" presentó una aceptabilidad general del 93%. Un 6% manifestó indiferencia y al 1% restante, le disgustó el producto (Gráfico Nº 2). El mayor porcentaje de respuestas (38%) se registró en el punto 8 de la escala hedónica, correspondiente a la categoría "Me gusta mucho" con un valor promedio de 7,5 (Tabla N° 3). Los evaluadores describieron en su opinión que el color fue "marrón, grisáceo"; el sabor "agradable", "con poca sal"; la textura de la corteza "crocante" y la de la miga "blanda, húmeda".
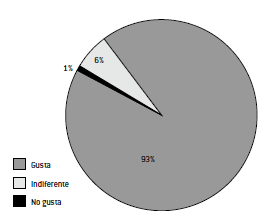
Gráfico Nº 2: Aceptabilidad general del pan formulado "D".
Tabla N° 3. Porcentaje de aceptabilidad del pan formulado (80:20 y 4g%fitoesteroles: fórmula "D" según Escala Hedónica

En la Tabla Nº 4 pueden observarse los valores promedios de la composición química del pan dietético formulado ("D"). En la Tabla Nº 5 se observan las IDR y porcentaje de adecuación de fibra total y fitoesteroles correspondiente a una porción de 50 g/día de pan.
Tabla Nº 4: Composición química del pan formulado "D"
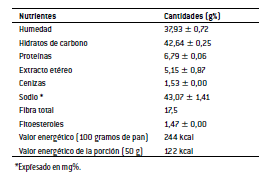
Tabla Nº 5: Porcentaje de adecuación de fibra alimentaria total y fitoesteroles del pan formulado "D"

El pan dietético formulado (Ilustración Nº 1), fue envasado para su conservación final en bolsas de polietileno de baja densidad cerradas con precinto de seguridad. En el rótulo diseñado se colocó denominación "Pan dietético lacteado con harina de chía parcialmente desgrasada y fitoesteroles", alimento de bajo contenido en sodio, sin sal añadida y de alto contenido en fibra. Se incluyeron claims: "Una porción de pan lacteado (2 rodajas) proporciona 0.74 g de fitoesteroles. Un consumo regular menor a 3 g/día como parte de una dieta equilibrada y variada que incluya frutas y verduras permite reducir los niveles de colesterol".

Ilustración Nº 1: Pan dietético formulado "D"
"Mujeres embarazadas, en periodo de lactancia y niños menores de 5 años ¡Consulte a su médico!", y la leyenda: "no es un alimento libre de sodio" (Figura N° 1).
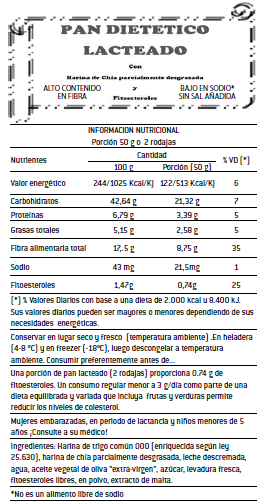
Figura Nº 1: Modelo visual del rotulado nutricional (anverso y reverso) del pan dietético formulado "D"
Discusión
El proceso de elaboración del pan dietético "D" fue de fácil realización, con un tiempo total de elaboración de 270±10 minutos aproximadamente desde la fermentación hasta el enfriamiento, listo para su consumo. La variación de peso crudococido fue del -7,7% y el peso obtenido por pieza entera de 840±10 gramos acorde con los panes integrales consultados en la bibliografía.
El valor energético del producto testeado (244kcal%) fue similar a los panes de la línea Fargo tales como pan lacteado (244 kcal%) y salvado doble (247 kcal%) e inferior al pan salvado doble con fitoesteroles (260 kcal%) (11). Por lo tanto, el producto formulado no puede ser considerado "Alimento Dietético de Valor Energético o Calórico Reducido" ya que el contenido de carbohidratos representó un 84,13% del valor calórico total del alimento de referencia, superior al límite propuesto por el CAA (70%). Sin embargo, se redujo el aporte de hidratos de carbono provenientes de harinas refinadas (trigo) por carbohidratos complejos fuente de fibra (chía).
El contenido de fitoesteroles fue de 1,47 g%, superior a los panes de salvado doble con fitoesteroles sin sal de la línea Fargo (0,2 g%); del pan común con fitoesteroles (0,3 g%) (11) y pan negro con semillas de canola y fitoesteroles (0,3 g%) elaborados en el Programa PROPIA (12). El valor obtenido se encuentra dentro del rango establecido por la recomendación internacional de 1 a 3 gramos de fitoesteroles por día ya que una porción de 50 gramos cubriría el 25% de la recomendación para la población adulta.
El contenido de fibra alimentaria (17,5g%) fue superior a todos los panes integrales de la bibliografía consultada. Las diferencias podrían deberse a la utilización de harina de chía la cual es fuente de fibra alimentaria (35-35,2 g%) (13). Al producto formulado se lo puede denominar como "Alimento de Alto Contenido en Fibra Alimentaria", debido a que el porcentaje total de la misma fue superior a 6 g/100 g de producto, tal como lo establece el CAA (6).
El contenido de Sodio fue de 43,07 mg%, lo que responde a las exigencias del C.A.A para alimentos de "Bajo Contenido en Sodio" (40-120 mg%) destacando que no se añadió ClNa (sal de mesa) en ninguna etapa de la elaboración. No sería por tanto, un alimento libre de sodio según la reglamentación vigente, pero presentó una reducción mayor al 50% con respecto al pan tradicional o de consumo corriente.
Por todo lo mencionado, el pan formulado ("D") sería considerado un alimento funcional, ya que contiene en su composición agentes bioactivos como fitoesteroles y fibra alimentaria, pudiendo ser consumido como parte de una dieta habitual saludable (14) y por personas con ECNT (dislipemia, hipertensión arterial, diabetes, entre otras). Sensorialmente el producto dietético "D" fue aceptado por la mayoría de los panelistas que lo consideraron un producto agradable, de corteza crocante y miga blanda y húmeda.
1. Ferrante D, Linetzky B, Konfino J. y col. Encuesta Nacional de Factores de Riesgo: Evolución de la Epidemia de Enfermedades Crónicas no Transmisibles en Argentina. 2009 Revista Argentina Salud Pública Vol. 2 Nº 6: 34-41. Disponible en: www.msal.gov.ar/rasp/rasp/articulos/ [Citado 27 de setiembre 2013] [ Links ]
2. Gioberchio G. El Pan, la Carne y los Lácteos, los que más Calorías Aportan. Informe de la UBA sobre la dieta argentina. Buenos Aires, Argentina. Disponible en: www.clarin. com/.../pan-carne-lacteos-calorias-aportan_0_344965563 [Citado 06 de abril 2013]
3. Michaelides J. Un estudio sobre la sal en el pan. Heladería Panadería Latinoamericana. Nº 198: 64-67. Editorial Publitec S.A. Argentina. [ Links ]
4. Olivera Carrión M. Alimentos Funcionales en Argentina. Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires, Argentina. Disponible en: www.Fao.org/waidocs/who/ac911500 [Citado 22 de junio 2013] [ Links ]
5. Food and Drug Administration. Código de Regulación Federal, título 21, sección 101.83 Disponible en: www.fda.org [Citado 03 de setiembre 2013] [ Links ]
6. Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT), Código Alimentario Argentino. Disponible en: www.anmat.gov.ar/ alimentos/normativas_alimentos _caa.asp - [Citado 22 de febrero 2013] [ Links ]
7. Watts B M, Ylimaki G L, Jeffery L E, Elías L G . Métodos Sensoriales Básicos para la Evaluación de Alimentos. Otawa Ont. CIID. Disponible en: Idl-bnc.idrc.ca/dspace/ bitstream/10625/12666/1/89276.pdf [Citado 31 de agosto 2013] [ Links ]
8. ASSOCIATION OF CHEMICAL AGRICULTURAL CHEMISTS. (1970). Washington. Official Methods of Analysis of the A.O.A.C. N° 2090. [ Links ]
9. Lee S C, Prosky L, DeVries J W Determination of Total, Soluble and Insoluble, Dietary Fiber in Foods – Enzimatic - Gravimetric Method, mes-tris buffer: Collaborative study. J. Assoc. Off. Anal. Chem. 75: 395-416. Citado en: Megazyme International Ireland 2012 Total Dietary Fibre Assay Procedure k – tdfr 05/12 (200 Assays per kit) For use with AOAC Method 985.29; 991.42; 991.43; 993.19; AACC Method 32 – 05.01; 32 – 06.01; 32 -07.01; 32 – 21.01 Disponible en: www.megazyme.com/downloads/.../K-TDFR.pdf [Citado 07 de setiembre 2013]
10. Kenneth M, Bugusu B. Envasado de Alimentos: Funciones, Materiales y Aspectos Ambientales. Revista La Alimentación Latinoamericana Nº 269:8. [ Links ]
11. Compañía de Alimentos FARGO SA. Productos de Panificación. 2006. [En línea] Disponible en: www.fargo.com.ar [Citado 31 de agosto 2013] [ Links ]
12. Programa de Prevención del Infarto en Argentina (PROPIA) Disponible en: http://www.emagister.com.ar/propia-programa-prevencion-del-infarto-argentinacursos-66980-centrodetalles.htm [Citado 07 de setiembre 2013] [ Links ]
13. Bautista J. y cols. Propiedades Funcionales y Valor Nutritivo de Panes Integrales con Chía y Linaza. 2005. Disponible en: www.respyn.uanl.mx/especiales/2005/ ee-13-2005/.../CNA63.pdf [Citado 31 de agosto 2013] [ Links ]
14. Córdova-Villalobos, J. A. et al. Las Enfermedades Crónicas no Transmisibles en México: Sinopsis Epidemiológica y Prevención Integral Vol. 50, Nº 5 2008. pp 419- 427 Disponible en: www.medigraphic.com/pdfs/salpubmex/sal-2008/sal085j.pdf. [Citado 28 de agosto 2013] [ Links ]^rND^sFerrante^nD^rND^sLinetzky^nB^rND^sKonfino^nJ^rND^sGioberchio^nG^rND^sMichaelides^nJ^rND^sLee^nS C^rND^sProsky^nL^rND^sDeVries^nJ W^rND^sKenneth^nM^rND^sBugusu^nB^rND^sCórdova-Villalobos^nJ. A^rND^1A01^sGallardo Fuentes^nFrancisco Javier^rND^1A02^sGallardo Fuentes^nJorge Eduardo^rND^1A03^sRuiz Aguilar^nCristian Alejandro^rND^1A01 A04^sRamírez-Campillo^nRodrigo^rND^1A05^sRodríguez Rodríguez^nFernando Javier^rND^1A01^sGallardo Fuentes^nFrancisco Javier^rND^1A02^sGallardo Fuentes^nJorge Eduardo^rND^1A03^sRuiz Aguilar^nCristian Alejandro^rND^1A01 A04^sRamírez-Campillo^nRodrigo^rND^1A05^sRodríguez Rodríguez^nFernando Javier^rND^1A01^sGallardo Fuentes^nFrancisco Javier^rND^1A02^sGallardo Fuentes^nJorge Eduardo^rND^1A03^sRuiz Aguilar^nCristian Alejandro^rND^1A01 A04^sRamírez-Campillo^nRodrigo^rND^1A05^sRodríguez Rodríguez^nFernando Javier
ARTÍCULO ORIGINAL
Caracterización del consumo de suplementos nutricionales en población físicamente activa de gimnasios del sur de Chile
Characterization of nutritional supplements consumption in physically active population in gyms of southern Chile
M.Sc. Gallardo Fuentes, Francisco Javier1, B.Sc. Gallardo Fuentes, Jorge Eduardo2, B.Sc. Ruiz Aguilar, Cristian Alejandro3, Ph.D. Ramírez-Campillo, Rodrigo1,4, Ph.D. Rodríguez Rodríguez, Fernando Javier5
1Departamento Ciencias de la Actividad Física, Universidad de Los Lagos, Osorno (Chile). 2Universidad de Los Lagos, Osorno (Chile). 3Dirección Gestión y Aseguramiento de la Calidad, Universidad de Los Lagos, Osorno (Chile). 4Department of Physical Education, Sport and Recreation, Universidad de La Frontera, Temuco (Chile). 5 Pontificia Universidad Católica de Valparaíso .
Correspondencia: fgallardo@ulagos.cl.
Recibido: 22/10/2014.
Aceptado en su versión corregida: 7/04/2015
Resumen
Introducción: El consumo de suplementos nutricionales (SN) se ha investigado generalmente en relacion al rendimiento deportivo. Menos informacion existe en relacion a poblacion nodeportista pero fisicamente activa.
Objetivo y metodología: El objetivo fue conocer las caracteristicas de los consumidores de SN en 412 usuarios (179 mujeres) de gimnasios de cuatro ciudades del sur de Chile. El instrumento utilizado para recolectar datos correspondio a un cuestionario previamente validado (1), estructurado con preguntas cerradas, alternativas y preguntas abiertas en relacion al consumo de SN. Para su interpretacion se utilizaron estadisticos descriptivos y de comparacion (i.e. Chi cuadrado). El nivel de significancia estadistica se establecio en p<0,05.
Resultados: Los resultados revelan que 22% de los usuarios consumen SN. De los hombres consumidores, 37% lo realiza para aumentar masa muscular y 36% para mejorar el rendimiento fisico. Entre las mujeres, 32% los consume por motivos relacionados a salud. Los SN mas consumidos fueron: proteinas (36%), vitaminas y minerales (11%), creatina (10%), aminoacidos y carbohidratos (8%). En cuanto al perfil del consumidor, esta representado por jovenes de entre 15 a 25 anos, dedicados en su mayoria al estudio y al trabajo, con menos de un ano de asistencia al gimnasio y una frecuencia de asistencia ≥ 3 sesiones/semana.
Conclusión: Un relativamente bajo consumo de SN fue observado, en comparacion con deportistas, influenciado por la edad, el genero y el uso de dieta o alimentacion especial. Varones jovenes (i.e. 15 a 25 anos de edad) que trabajan, con una alta frecuencia de asistencia a gimnasios (≥ 3 sesiones/semana) son los principales consumidores de SN.
Palabras clave: Ayudas ergogenicas; Suplementos; Dieta; Gimnasios; Deporte.
Abstract
Introduction: The consumption of nutritional supplements (NS) has generally been researched in relation to sports performance. There is not so much information about non-athlete population but physically active.
Objective and method: The objective was to determine the characteristics of consumers of NS in 412 users (179 women) in gyms of four cities in southern Chile. The method used for data collection corresponded to a previously validated questionnaire (1), structured with closed questions, questions with alternatives answers and open questions regarding the use of NS. For interpretation, descriptive and comparison statistics were used (ie Chi square). The level of statistical significance was set at p <0.05.
Results: The results show that 22% of users consume NS. Among male consumers, 37% do it to increase muscle mass and 36% to improve their physical performance. Among women, 32% consume them for reasons related to health. The most consumed NS were: protein (36%), vitamins and minerals (11%), creatine (10%), amino acids and carbohydrates (8%). Regarding the consumer profile, it is represented by young people aged 15-25 mostly dedicated to studying and working, with less than one- year- attendance to the gym and frequency of attendance≥ 3 sessions / week.
Conclusion: A relatively low NS consumption was observed, compared to athletes, influenced by age, gender and the use of diet or special food. Young men (ie 15-25 years old) that work, with a high frequency of attendance at gyms (≥ 3 sessions / week) are the main consumers of NS.
Keywords: Ergogenic aids; Supplements; Diet; Gyms; Sport.
Introducción
En la actualidad, el uso de toda clase de sustancias para mejorar el rendimiento deportivo y la forma física se ha extendido a las personas que acuden a gimnasios regularmente buscando entre otros, mejorar la forma física o la estética, sin que en ningún caso se tengan en cuenta los posibles efectos perjudiciales que su uso puede conllevar (2-3). "Suplementos dietéticos", "ayudas ergogénicas nutricionales", "suplementos deportivos" y "suplementos nutricionales (SN) terapéuticos" son algunos términos usados para referirse a la variedad de productos que ofrece la industria de suplementos deportivos. Al igual que hay una variedad de nombres para estos productos, hay un gran número de definiciones. Se ha señalado (3) que los suplementos y las comidas para deportistas tienen que ser un adecuado y práctico instrumento que cubra un requerimiento nutritivo para optimizar el entrenamiento diario o el rendimiento en la competición (4) (e.g. bebidas deportivas, geles de carbohidratos, barras deportivas). Deben contener una cantidad cuantiosa de macronutrientes para cubrir el déficit nutricional, aumentar el rendimiento deportivo o mantener y restaurar la salud y la función inmune (5-9).
Solo en Estados Unidos, hace más de una década, el mercado de los SN generó 3,3 billones de dólares, creciendo hasta un total de 12 billones anuales en 1999 (9). En ocasiones estas sustancias suelen obtenerse en el mercado informal, por lo que no puede garantizarse su calidad, detectándose la inclusión de otros componentes no declarados que significan riesgos para la salud (2-10). En este sentido, existe la preocupación de que algunos SN no sean seguros o estén contaminados (16) y en Estados Unidos, la Food and Drug Administration (FDA), tiene la autoridad de supervisar los casos de productos problemáticos (17).
Una parte importante de la población que utiliza SN, corresponde a estudiantes adolescentes, pertenecientes al segmento más joven de la población (18), que son más influenciables y que presentan menores niveles de instrucción educacional al respecto. En esta misma línea, algunos estudios definen que a mayor edad, existe menor consumo de SN (19-20). Referente al género de quienes los consumen, aún sigue en discusión la existencia de diferencias en los tipos de SN consumidos según el sexo del usuario (21). Por el contrario, en gimnasios existe un mayor consumo de SN por quienes llevan mayor tiempo realizando actividad física y que acuden varias horas a la semana, realizando además modificaciones en la dieta habitual (18). Sin embargo, en una investigación de revisión (22) se evidencian las múltiples y frecuentes incongruencias en el uso de SN, respecto de las razones que justifican su utilización.
El interés por el consumo de SN ha aumentado, y conocer las motivaciones, los tipos de productos, entre otras características es lo fundamental de esta investigación. Por tanto, nuestro objetivo fue conocer las características de los consumidores de SN que concurren a gimnasios de cuatro ciudades del sur de Chile.
Materiales y método
El universo de sujetos está compuesto por el número de inscriptos en cuatro gimnasios de las ciudades de Osorno, Frutillar, Puerto Varas y Puerto Montt, registrados en el último mes previo a la aplicación del instrumento de medición. Este universo presenta una rotación constante de usuarios, determinada por diversos horarios, irregularidad en asistencia y número de inscripciones por estacionalidad. Todas estas características hacen que este universo sea de difícil acceso para el llenado del instrumento, invalidando la opción de una muestra con características de aleatoriedad, por lo cual se seleccionó una muestra intencionada con el objetivo de abarcar el mayor número posible de sujetos. Los sujetos fueron voluntarios, quienes accedieron a participar firmando un consentimiento informado. Se aplicó un cuestionario previamente validado (1). El instrumento es estructurado en base a preguntas cerradas, con alternativas, para recabar información acerca del consumo de SN, objetivos de consumo, frecuencia, hábitos de entrenamiento y relación entre consumo y objetivos a alcanzar.
El proceso de validación original del instrumento de medición fue realizada en dos etapas, en una primera instancia se validó en un grupo de deportistas a través de formato electrónico, realizándose las modificaciones pertinentes. Posteriormente, se volvió a aplicar en usuarios regulares de cinco gimnasios de la comuna de Viña del Mar, distintos de los gimnasios correspondientes a la muestra. Luego de este proceso, se realizaron las últimas modificaciones en la estructura del cuestionario obteniendo el instrumento definitivo, aplicándose a usuarios regulares de once gimnasios de las ciudades de Osorno, Frutillar, Puerto Varas y Puerto Montt.
La población objetivo fueron hombres y mujeres asistentes a los gimnasios con un rango de edad entre 15 a 68 años en donde algunos encuestados practicaban deporte, pero de manera recreativa. La encuesta se aplicó en un período de dos semanas, en la jornada de mañana y tarde y en los horarios de asistencia de los encuestados a los gimnasios definidos, a través de encuestadores previamente capacitados.
Los datos fueron analizados utilizando el software estadístico Statistical Package for the Social Sciences (SPSS, versión 22.0), considerando un nivel de significancia de p<0,05 para la comparación entre variables (i.e., ocupación, sexo, edad, tipo de dieta, hábitos de entrenamiento) a través de la prueba Chi cuadrado.
Resultados
Se encuestaron 412 sujetos, el 22% del total de encuestados señala consumir algún tipo de SN, mientras que 78% declaró no consumirlos. 57% pertenece al sexo masculino, mientras que 43% son de sexo femenino. Siendo el número de hombres (n = 70) que consumen SN mayor vs las mujeres (n = 20), en forma estadísticamente significativa (p<0.05).
En cuanto al tipo de ocupación de los encuestados, 53% señala ser trabajador, seguido por estudiantes (32%), dueñas de casa (11%) y sólo un pequeño porcentaje de personas sin ocupación (2%) y jubilados/ pensionados (2%) (Tabla 1). El análisis con Chi cuadrado indicó que no existe una relación significativa entre la ocupación de los sujetos y el consumo de SN (Tabla 1).
TABLA 1. Consumo de suplementos nutricionales según sexo, rango de edad y ocupación.
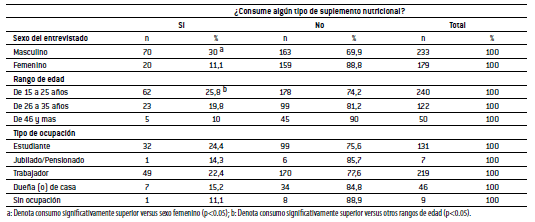
El 58% de los encuestados tenía un rango de edad entre 15 a 25 años, seguido por el rango de edad que varía entre los 26 a los 35 años (30%) y un grupo menor que pertenece al rango de 46 años o más (12%) (Tabla 1). Siendo el número de sujetos que consumen SN entre los 15 y 25 años de edad (n = 62), mayor, se comparó con los sujetos entre 26 a más de 46 años de edad (n = 28). El análisis con Chi cuadrado indicó una relación significativa (p<0.05) entre el rango de edad de los sujetos y el consumo de SN, siendo mayor el consumo entre sujetos de 15 a 25 años y disminuyendo a medida que aumenta el rango de edad.
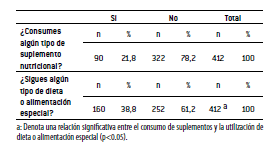
61% de los encuestados señaló no seguir algún tipo de dieta o alimentación especial (Tabla 2). El análisis con Chi cuadrado indicó una relación significativa (p<0.05) entre el consumo de SN y el consumo de dieta o alimentación especial.
TABLA 2. Caracterización del consumo de suplementos y dieta.
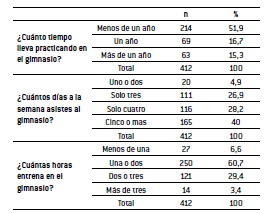
El 52% de los encuestados lleva menos de 1 año asistiendo al gimnasio. Un alto porcentaje (40%) asiste al gimnasio 5 o más veces por semana. También, 61% de los encuestados entrena entre 1 y 2 horas cada vez que asiste al gimnasio (Tabla 3). El análisis con Chi cuadrado no indicó una relación significativa entre el tiempo de entrenamiento, frecuencia de entrenamiento u horas de entrenamiento semanal y el consumo de SN.
TABLA 3. Caracterización de la muestra según años, días y horas de práctica de actividad física y dieta.
Los SN más consumidos según preferencia son proteínas (36%), vitaminas y minerales (11%), creatina (10%), aminoácidos (8%), carbohidratos (8%), cafeína (6%), L-carnitina (6%), glutamina (5%), entre otros (Tabla 4).
TABLA 4. Distribución de los tipos de suplementos nutricionales y objetivos de su consumo.
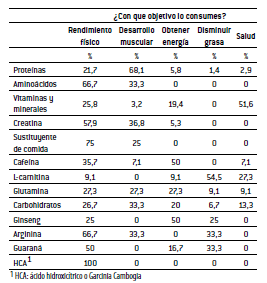
Respecto a los objetivos por los cuales los sujetos consumen SN, los hombres tienen como principales objetivos: desarrollo muscular (36%), rendimiento físico (37%), obtener energía (12%), salud (8%) y disminuir grasa corporal (7%). Entre las mujeres, los principales objetivos de consumo son: salud (32%), obtener energía (24%), desarrollo muscular (20,5%), rendimiento físico (20,5%) y disminuir grasa corporal (3%) (Tabla 4).
Respecto del tipo de SN consumido y el objetivo del mismo, se observa que entre los SN más consumidos (proteínas, vitaminas, minerales y creatina): 68% de quienes consumen proteínas tienen por objetivo el desarrollo muscular. Con respecto al consumo de vitaminas y minerales, 52% tiene por objetivo la salud. Y en cuanto al consumo de creatina, 58% tiene por objetivo el rendimiento físico. En relación al consumo de L-carnitina, 55% tiene por objetivo disminuir grasa (Tabla 4).
Respecto al tipo de "asesoría" que incentivó el consumo de SN, los hombres señalaron las siguientes opciones: entrenador (23%), amigo (16%), nutricionista (13%), farmacéutico (11%), publicidad (6%), médico (4%) u "otro" tipo de asesoría (27%). Las mujeres señalaron las siguientes opciones: médico (20%), farmacéutico (15%), entrenador (10%), amigo (10%), nutricionista (5%) u "otro" tipo de asesoría (40%).
Discusión
Nuestros resultados indican una prevalencia en el consumo de SN de 22%, consumo que estuvo asociado a alguna dieta especial. En comparación a otros estudios realizados en deportistas (23-25), en donde se ha reportado prevalencia de consumo de SN hasta 99%, la cifra observada por nuestro grupo fue baja, y podría deberse a que los sujetos asisten al gimnasio con objetivos distintos al de los deportistas. Estos últimos, por amplia mayoría, tienen por objetivo mejorar el rendimiento competitivo y consumen SN en mayor proporción. Además, observamos que los consumidores encuestados son principalmente de ocupación "trabajador", lo que refuerza la idea respecto a los motivos "recreativos" (no deportivos) por los cuales estos asisten al gimnasio. Al respecto, un estudio desarrollado con 77 nadadores de elite Australianos (23), observó 94% de prevalencia en el consumo de SN en forma de píldoras o en polvo, porcentaje que aumentaba a 99% si a esto se le sumaba el consumo de bebidas deportivas. En otro estudio (24) también observaron un alto consumo de SN en 310 deportistas de elite seguidos durante 2 años en torneos internacionales y campeonatos mundiales de atletismo. En ellos se observó que 83% y 85% de los hombres y mujeres, respectivamente, consumían SN, valores porcentuales que se mantuvieron bastante estables para los deportistas de diferentes etnias y nacionalidades. En esta misma línea, un estudio realizado con 82 deportistas de Singapur (25) de 16 diferentes disciplinas, evidenció un 77% en el uso de SN.
Respecto de la edad y el consumo, nuestros resultados muestran que el grupo de sujetos más joven es el que presentó mayor consumo de SN, coincidiendo con estudios que han mostrado que el rango etario que mayoritariamente consume SN varía entre los 15 a 25 años de edad (20). De forma similar, en deportistas el promedio de edad de los que consumen SN estaría entre 22 (25) y 26 años (24). En un estudio hecho en gimnasios de Belo Horizonte se obtiene un promedio de edad de consumo de 31 + 10 años (26). Hipotéticamente, los más jóvenes podrían practicar ejercicio a mayor intensidad vs otros grupos de edad, lo que incrementaría la posibilidad de consumir SN. Por otra parte, los más jóvenes son más susceptibles a la información "buena o mala" disponible en diversas fuentes en relación a SN, lo cual también podría influir respecto a su mayor consumo de SN. Finalmente, los motivos por los cuales los más jóvenes asisten al gimnasio son distintos vs grupos etarios mayores, pudiendo esto también influir en el mayor consumo de SN de los primeros (19).
En referencia al sexo de los consumidores de SN, nuestros resultados indican mayor consumo en hombres (57%) vs. mujeres (43%). Esto coincide con los resultados de un estudio realizado en Chile (1), donde en los hombres prevalece el consumo, pero con diferencias más importantes entre géneros (70% en los hombres y 32% en las mujeres). Otros autores (19) han observado que la diferencia según sexo podría estar mediada por el tipo de actividad realizada por los sujetos, donde no existirían diferencias entre hombres y mujeres deportistas (51% vs. 54%, respectivamente), aunque si entre hombres y mujeres sedentarios (32% vs 52%, respectivamente). Entre hombres y mujeres también se aprecian diferencias respecto de la recomendación del consumo, donde en los hombres son principales los "entrenadores" y "amigos" los que recomiendan el consumo de SN, mientras que en las mujeres son los "médicos" y "farmacéuticos", lo cual sugiere que las mujeres tendrían una asesoría más "profesional" al momento de decidir sobre el consumo.
En cuanto a los SN más consumidos, la preferencia principal son los batidos de proteína, preferentemente entre los sujetos jóvenes, de sexo masculino, que buscan una mejora en el rendimiento o en la estética (i.e., aumento de masa muscular). Luego de las proteínas el SN más consumido son los suplementos de vitaminas y minerales, superando incluso al consumo de creatina o aminoácidos. En la tabla 5 se muestran las cinco preferencias principales de consumo en diversos estudios, en comparación con los resultados de nuestra investigación.
TABLA 5. Principales hallazgos encontrados en la bibliografía, referentes a suplementos consumidos en gimnasios por grupos etarios de entre 15 a 30 años.

En cuanto a las razones del consumo de SN, nuestros resultados indican que el desarrollo muscular y el rendimiento físico son las principales motivaciones entre hombres y mujeres, coincidiendo parcialmente con diversos estudios (10, 27- 28). Además, en este estudio se aprecia que el objetivo por el cual los sujetos consumen SN se relaciona con la función que un determinado SN ha evidenciado científicamente. Por lo que podemos atribuir un cierto conocimiento previo de los consumidores o una asesoría que es al menos correcta y no hay tantos errores en la prescripción o en el consumo, al contrario de lo que se ha evidenciado en otros estudios (1), en donde se observó incongruencia significativa entre el efecto evidenciado científicamente y el objetivo de consumo. Interesantemente, un alto porcentaje de sujetos manifestó el logro de su objetivo, lo cual podría relacionarse con un efecto placebo. Por tanto, es relevante siempre poner atención a quienes asesoran y recomiendan los SN, idealmente con la supervisión de profesionales de la nutrición, quienes deben realizar esta tarea y procurar entregar la información adecuada, de acuerdo a las necesidades de cada persona que realiza ejercicio.
En conclusión, la prevalencia de consumo de SN en usuarios de gimnasios del sur de Chile es relativamente baja (22%) en comparación con población deportista, siendo mayor entre hombres jóvenes (15 a 25 años de edad) que deciden realizar dietas especiales. Los principales motivos para consumir SN son el desarrollo de masa muscular y rendimiento físico, preferentemente a través de suplementos de proteínas.
1. Rodríguez F, M. C, A. G, Morant N, Santibáñez F. Nutritional supplement intake in gymnasium, consumer profile and charateristics of their use. Rev Chil Nutr. 2011;38(2):157-66. [ Links ]
2. Medical aspects of drug use in the gym. Drug Ther Bull. 2004;42(1):1-5. [ Links ]
3. Burke L, Cort M, Cox G, Crawford R, Desbrow B, Farthing L, et al. Supplements and Sports Foods. In: Burke L, Deakin V, editors. Clinical Sports Nutrition. Sydney: McGraw-Hill; 2006. p. 485-579. [ Links ]
4. Goldfarb AH, Garten RS, Cho C, Chee PD, Chambers LA. Effects of a fruit/berry/ vegetable supplement on muscle function and oxidative stress. Med Sci Sports Exerc. 2011;43(3):501-8. [ Links ]
5. Tarnopolsky MA. Caffeine and creatine use in sport. Ann Nutr Metab. 2010;57 Suppl 2:1-8. [ Links ]
6. Quesnele JJ, Laframboise MA, Wong JJ, Kim P, Wells GD. The effects of betaalanine supplementation on performance: a systematic review of the literature. Int J Sport Nutr Exerc Metab. 2014;24(1):14-27. [ Links ]
7. Campbell BI, Wilborn CD, La Bounty PM. Supplements for strength-power athletes. Strength & Conditioning Journal. 2010;32(1):93-100. [ Links ]
8. Slater G, Phillips SM. Nutrition guidelines for strength sports: sprinting, weightlifting, throwing events, and bodybuilding. J Sports Sci. 2011;29 Suppl 1:S67-77. [ Links ]
9. Blendon RJ, DesRoches CM, Benson JM, Brodie M, Altman DE. Americans' views on the use and regulation of dietary supplements. Arch Intern Med. 2001;161(6):805-10. [ Links ]
10. Ambrose PJ. Drug use in sports: a veritable arena for pharmacists. J Am Pharm Assoc (2003). 2004;44(4):501-14; quiz 14-6. [ Links ]
11. Ayotte C, Levesque JF, Cle roux M, Lajeunesse A, Goudreault D, Fakirian A. Sport nutritional supplements: quality and doping controls. Can J Appl Physiol. 2001;26 Suppl:S120-9. [ Links ]
12. Green GA, Catlin DH, Starcevic B. Analysis of over-the-counter dietary supplements. Clin J Sport Med. 2001;11(4):254-9. [ Links ]
13. Kamber M, Baume N, Saugy M, Rivier L. Nutritional supplements as a source for positive doping cases? Int J Sport Nutr Exerc Metab. 2001;11(2):258-63. [ Links ]
14. Kanayama G, Gruber AJ, Pope HG, Jr., Borowiecki JJ, Hudson JI. Over-the-counter drug use in gymnasiums: an underrecognized substance abuse problem? Psychother Psychosom. 2001;70(3):137-40. [ Links ]
15. Pipe A, Ayotte C. Nutritional supplements and doping. Clin J Sport Med. 2002;12(4):245-9. [ Links ]
16. Corrigan B, Kazlauskas R. Medication use in athletes selected for doping control at the Sydney Olympics (2000). Clin J Sport Med. 2003;13(1):33-40. [ Links ]
17. Cellini M, Attipoe S, Seales P, Gray R, Ward A, Stephens M, et al. Dietary supplements: physician knowledge and adverse event reporting. Med Sci Sports Exerc. 2013;45(1):23-8. [ Links ]
18. Tscholl P, Alonso JM, Dolle G, Junge A, Dvorak J. The use of drugs and nutritional supplements in top-level track and field athletes. Am J Sports Med. 2010;38(1):133-40. [ Links ]
19. Sánchez A, Miranda MT, Guerra E. Estudio estadístico del consumo de suplementos nutricionales y dietéticos en gimnasios. ALAN. 2008;58(3):221-7. [ Links ]
20. Domingues SF, Marins J. Ergogenic aids and nutritional supplement use among resistance training practitioner in Belo Horizonte. Fit Perf J. 2007;6(4):218-26 [ Links ]^rND^sRodríguez^nF, M. C, A. G^rND^sMorant^nN^rND^sSantibáñez^nF^rND^sBurke^nL^rND^sCort^nM^rND^sCox^nG^rND^sCrawford^nR^rND^sDesbrow^nB^rND^sFarthing^nL^rND^sGoldfarb^nAH^rND^sGarten^nRS^rND^sCho^nC^rND^sChee^nPD^rND^sChambers^nLA^rND^sTarnopolsky^nMA^rND^sQuesnele^nJJ^rND^sLaframboise^nMA^rND^sWong^nJJ^rND^sKim^nP^rND^sWells^nGD^rND^sCampbell^nBI^rND^sWilborn^nCD^rND^sLa Bounty^nPM^rND^sSlater^nG^rND^sPhillips^nSM^rND^sBlendon^nRJ^rND^sDesRoches^nCM^rND^sBenson^nJM^rND^sBrodie^nM^rND^sAltman^nDE^rND^sAmbrose^nPJ^rND^sAyotte^nC^rND^sLevesque^nJF^rND^sCle roux^nM^rND^sLajeunesse^nA^rND^sGoudreault^nD^rND^sFakirian^nA^rND^sGreen^nGA^rND^sCatlin^nDH^rND^sStarcevic^nB^rND^sKamber^nM^rND^sBaume^nN^rND^sSaugy^nM^rND^sRivier^nL^rND^sKanayama^nG^rND^sGruber^nAJ^rND^sPope^nHG, Jr^rND^sBorowiecki^nJJ^rND^sHudson^nJI^rND^sPipe^nA^rND^sAyotte^nC^rND^sCorrigan^nB^rND^sKazlauskas^nR^rND^sCellini^nM^rND^sAttipoe^nS^rND^sSeales^nP^rND^sGray^nR^rND^sWard^nA^rND^sStephens^nM^rND^sTscholl^nP^rND^sAlonso^nJM^rND^sDolle^nG^rND^sJunge^nA^rND^sDvorak^nJ^rND^sSánchez^nA^rND^sMiranda^nMT^rND^sGuerra^nE^rND^sDomingues^nSF^rND^sMarins^nJ^rND^1A01^sOliva^nMaría Laura^rND^1A01^sBelén^nLorena^rND^1A01^sBouza^nMalena^rND^1A01^sCastelao^nMalena^rND^1A01^sMehring^nJuliana^rND^1A01^sNarbon Alegre^nRocío^rND^1A01^sVillarrica^nSofía^rND^1A01^sTorresani^nMaría Elena^rND^1A01^sOliva^nMaría Laura^rND^1A01^sBelén^nLorena^rND^1A01^sBouza^nMalena^rND^1A01^sCastelao^nMalena^rND^1A01^sMehring^nJuliana^rND^1A01^sNarbon Alegre^nRocío^rND^1A01^sVillarrica^nSofía^rND^1A01^sTorresani^nMaría Elena^rND^1A01^sOliva^nMaría Laura^rND^1A01^sBelén^nLorena^rND^1A01^sBouza^nMalena^rND^1A01^sCastelao^nMalena^rND^1A01^sMehring^nJuliana^rND^1A01^sNarbon Alegre^nRocío^rND^1A01^sVillarrica^nSofía^rND^1A01^sTorresani^nMaría Elena
ARTÍCULO ORIGINAL
Compulsión glucídica en mujeres adultas y su relación con el consumo de psicofármacos
Carbohydrate compulsion in adult women and its relationship with psychotropic drug
Oliva, María Laura, Belén, Lorena, Bouza, Malena, Castelao, Malena, Mehring, Juliana, Narbon Alegre, Rocío, Villarrica, Sofía, Torresani, María Elena.
Escuela de Nutrición – Facultad de Medicina – Universidad de Buenos Aires
Correspondencia: marialauraoliva@gmail.com
Recibido: 04/11/2014.
Aceptado en su versión corregida: 06/05/2015
Resumen
Introducción: En la mujer adulta declina la función ovárica y la producción de estrógenos, con sintomatología física y psíquica, alteración en la regulación del apetito y tendencia a la ingesta de hidratos de carbono. Los psicofármacos empleados para el manejo del estado anímico podrían provocar efectos secundarios, como modificación de la ingesta y peso corporal y efectos neuroendocrinos como regulación de la serotonina, entre otros.
Objetivos: Identificar la asociación entre el consumo de psicofármacos y la compulsión glucídica en mujeres adultas.
Materiales y Método: Se realizó un estudio analítico de corte transversal sobre 114 mujeres mayores de 40 años que asistieron al consultorio de climaterio del Hospital General de Agudos "Bernandino Rivadavia". Se analizaron variables biológicas, antropométricas, conducta alimentaria y consumo de psicofármacos, recabadas mediante encuestas estructuradas, voluntarias y anónimas, y mediciones antropométricas. Para el análisis estadístico se utilizó SPSS 15.0, calculando medidas de tendencia central, comparación de medias y Odds Ratio (OR) con intervalo de confianza (IC) del 95%, test chi cuadrado (x2) y correlación de Pearson con nivel de significación p< 0,05.
Resultados: El 67,5% de la muestra presentó sobrepeso u obesidad y el 48,2% circunferencia de cintura (CC) aumentada. El 69,3% refirió compulsión glucídica, siendo los panificados y el chocolate los alimentos de mayor elección en estos episodios. No se observó significación estadística entre las mujeres que consumían psicofármacos para mejorar la calidad de vida, y la presencia de compulsión o estado nutricional alterado.
Conclusión: Las mujeres que consumieron psicofármacos no presentaron diferencias en la prevalencia de compulsión glucídica o el estado nutricional alterado.
Palabras clave: Menopausia; Compulsión glucídica; Sobrepeso; Obesidad; Psicofármacos.
Abstract
Introduction: In adult females, ovarian function and estrogen production decline, with physical and mental symptoms, altered regulation of appetite and tendency to carbohydrate intake. The psychotropic drugs used to deal with mood could cause side effects, such as modification of food intake and body weight modification, and neuroendocrine effects on serotonin regulation, among others.
Objectives: To identify the association between the consumption of psychotropic drugs and the carbohydrate compulsion in adult women.
Materials and Method: An analytical cross-sectional study was carried out on 114 women over 40 years old who attended the climacteric clinic of the Acute General Hospital "Bernardino Rivadavia". The following were analyzed: biological and anthropometric variables, eating behavior and consumption of psychotropic drugs, collected through structured, voluntary and anonymous surveys, and anthropometric measurements. For statistical analysis SPSS 15.0 was used, calculating measures of central tendency, comparison of means and Odds Ratio (OR) with confidence interval (CI) of 95%, Chi-squared test and Pearson correlation with significance level of p <0.05.
Results: 67.5% of the sample were overweight or obese and 48.2% presented an increase in waist circumference. 69.3% reported carbohydrate compulsion, being bakery foods and chocolate the most chosen foods in these episodes. No statistical significance was observed among women who consumed psychoactive drugs to improve their quality of life, and the presence of compulsion or altered nutritional status.
Conclusion: Women who consumed psychoactive drugs did not present differences in the prevalence of carbohydrate compulsion or altered nutritional status.
Keywords: Menopause; Carbohydrate Compulsion; Overweight; Obesity; Psychotropic Drugs.
Introducción
En la mujer adulta la declinación de la función ovárica y la irregularidad de los ciclos menstruales se producen naturalmente como consecuencia del envejecimiento normal.
La menopausia se asocia con factores que repercuten en la salud de la mujer, prevaleciendo el aumento del riesgo cardiovascular, las modificaciones óseas, la modificación del perfil lipídico, la hipertensión arterial, la redistribución de la masa grasa, el aumento de peso y el desarrollo o agravamiento de la obesidad.(1) La mayoría de los estudios poblacionales han demostrado un aumento significativo pero pequeño (1-2 kg) del peso durante la menopausia.(2) A pesar de estos hallazgos, la etiología del incremento del peso durante este periodo aún no está totalmente aclarada.(1)
Durante el climaterio el deterioro anímico es el síntoma que más a menudo lleva a las mujeres a consultar, siendo la perimenopausia la etapa de mayor riesgo(3). Las manifestaciones más referidas por las mujeres incluyen alteraciones de la conducta emocional como cambios en el estado de ánimo, irritabilidad, ansiedad, depresión, síntomas vasomotores como sofocos, así como disminución de la libido y de las relaciones psicosociales.(4)
Los estrógenos y progestágenos pueden antagonizar la acción de los glucocorticoides, cuya liberación parece jugar un importante rol en la generación de cuadros de ansiedad. Los estrógenos han demostrado poseer un efecto ansiolítico al mejorar la eficiencia de la neurotransmisión serotoninérgica, actuando también sobre otros sistemas de neurotransmisión, incluyendo catecolaminas, acetilcolina, ácido γ-aminobutírico (GABA) y glutamato, entre otros(5). El descenso de los niveles de estrógenos observado en la menopausia, provoca alteraciones en la liberación de la secreción de leptina, en la regulación del apetito, en el metabolismo del triptófano y en la disminución del turnover de la serotonina y de la dopamina, aumentando la expresión de cuadros de ansiedad en mujeres vulnerables(6).
A su vez, los niveles séricos de leptina y de serotonina se han correlacionado significativamente con el índice de masa corporal (IMC) y el aumento de la grasa abdominal medida por la circunferencia de cintura (CC)(7,8).
Siendo el triptófano el único precursor de la serotonina, y ésta el principal inhibidor de la ingesta de hidratos de carbono, su déficit podría explicar modificaciones en la conducta alimentaria de las mujeres perimenopáusicas(9). Así, para alcanzar el efecto serotoninérgico, se describe la aparición de una conducta compulsiva por el consumo de alimentos ricos en hidratos de carbono(10).
Diversos estudios demuestran que tras la ingesta de dulces, chocolates y alimentos ricos en azúcares se favorece la síntesis de serotonina a nivel cerebral, lo cual produce sensación de calma luego de los episodios de compulsión(11).
De esta manera, las comidas ricas en hidratos de carbono y pobres en proteínas estimulan la secreción de insulina y generan una disminución de los niveles plasmáticos de aminoácidos como leucina, isoleucina y valina, los cuales compiten con el triptófano para ser transportados al cerebro. Resulta entonces un aumento del flujo de triptófano al otro lado de la barrera hematoencefálica y por lo tanto el aumento de su concentración a nivel cerebral. En contraste las comidas ricas en proteínas contribuyen a una mayor cantidad de aminoácidos que compiten con el triptófano, generando así una disminución de la entrada de éste aminoácido al cerebro(12).
Dentro de los denominados Trastornos de la Conducta Alimentaria No Específicos (TANES), se describe el picoteo de alimentos compulsivo (Craving), definido como ingestas repetidas, sin hambre, de pequeñas cantidades selectivas de alimentos, de carácter placentero y que por lo general ocurre en horarios vespertinos.(13) Se postula entonces a la compulsión glucídica como un craving específico de alimentos ricos en hidratos de carbono.
La asociación entre los TANES y el estado nutricional ha demostrado tener un valor predictivo para el desarrollo de alteraciones metabólicas, sobrepeso y obesidad a través de diferentes trabajos de investigación(14,15,16).
Está demostrado en varios estudios que las mujeres que comienzan la perimenopausia tienen mayor probabilidad de sufrir una depresión mayor (DM) que aquellas que están en edad fértil. El riesgo de DM es así mismo más alto en las mujeres que presentan síntomas vasomotores o en aquellas que hayan estado expuestas a acontecimientos vitales negativos(17,18). Si bien la terapia con estrógenos es una de las estrategias para tratar los síntomas depresivos leves que se presentan en mujeres menopáusicas, el consenso actual es que los antidepresivos son el tratamiento de elección cuando se presentan alteraciones mayores(19).
Todos los reguladores del estado anímico que se disponen actualmente alteran la función de la serotonina o de la noradrenalina a nivel del sistema nervioso central (SNC), pudiendo interferir en varias de las funciones que controlan este sistema, siendo la regulación del apetito una de ellas. En ocasiones, estas sustancias son utilizadas con el fin de producir un efecto sobre la ingesta de alimentos y, por lo tanto, en la variación del peso corporal, como puede ser en el tratamiento de trastornos de la conducta alimentaria u obesidad. A diferencia de esto, en el uso de psicofármacos para el tratamiento de la depresión, la modificación de la ingesta es uno de los varios efectos secundarios comprobados(20).
Una encuesta llevada a cabo en la Ciudad Autónoma de Buenos Aires, demostró que cada vez es mayor el consumo de psicofármacos en la población, especialmente en la Ciudad de Buenos Aires donde las cifras alcanzan alrededor de un 30%, siendo significativamente superior en las mujeres y con una edad promedio de 46 años(21).
El objetivo general de este trabajo fue identificar la asociación entre el consumo de psicofármacos y la compulsión glucídica en un grupo de mujeres adultas ambulatorias que concurrieron por demanda espontánea a un consultorio externo de climaterio en un hospital público de la Ciudad Autónoma de Buenos Aires (CABA). El objetivo específico fue describir las características de la compulsión glucídica, en aquellas que la presentaban.
Materiales y método
Se realizó un estudio de diseño observacional y transversal en una muestra voluntaria no probabilística de mujeres adultas aparentemente sanas, concurrentes al consultorio de Climaterio del Hospital General de Agudos "Bernardino Rivadavia" de la Ciudad Autónoma de Buenos Aires (CABA) en el período comprendido entre los meses de Julio y Octubre de 2012.
Los criterios de inclusión fueron mujeres mayores de 40 años, que acudieron por primera vez a la consulta, sin restricción alimentaria ni tratamiento dietoterápico de ningún tipo, que consintieron su participación en el estudio. Se excluyeron mujeres embarazadas, en período de lactancia o con menopausia quirúrgica o precoz, con trastornos psiquiátricos declarados y/o con el uso terapia de reemplazo hormonal.
Se dividió a la muestra en dos grupos, según la presencia o no de compulsión glucídica y se analizó el consumo de psicofármacos. Cada grupo fue controlado por el estado nutricional, la etapa biológica y el tiempo de consumo del fármaco.
Recolección de datos
Los datos se obtuvieron por interrogatorio directo mediante encuestas estructuradas voluntarias y anónimas y a través de información obtenida de la historia clínica.
Se interrogó a las mujeres sobre la conducta alimentaria: hábito de picoteo entre comidas, presencia de compulsión glucídica (CG)(22) (definida como el deseo irresistible e inevitable de ingerir alimentos ricos en hidratos de carbono), frecuencia de los episodios, tipo de alimentos consumidos durante los mismos, sabores de preferencia, sensación de hambre y momento del día de los episodios. El consumo de psicofármacos fue obtenido de la Historia Clínica.
Los parámetros antropométricos (peso, talla y circunferencia de la cintura), se obtuvieron a partir de la medición directa por un Licenciado en Nutrición, según las técnicas estandarizadas. El Peso se registró en kilogramos (Kg.), pesando a la paciente en balanza tipo CAM, con precisión de 0,1kg con el mínimo de ropa y de preferencia en ayunas. La Talla se midió en metros (m), por medio de un tallímetro con una precisión de 0,01m, con la paciente de pie en posición firme con la cabeza mantenida de manera que el plano de Frankfort se conserve horizontal, sin calzado y en inspiración profunda. La circunferencia de la cintura se midió con cinta métrica flexible no extensible, con el sujeto parado en espiración forzada.
Se consideró sobrepeso u obesidad a valores de IMC iguales o superiores a 25,0 Kg/m2 y circunferencia de cintura aumentada a valores superiores a 88 cm (23).
Para la construcción de la variable ganancia de peso perimenopausica, se tuvo en cuenta el peso anterior a la menopausia (obtenido por referencia de las mujeres del peso recordado estando en condiciones de salud, durante la mayor parte de su vida anterior a la menopausia) y el peso al momento del estudio por medición directa. A partir de estos dos valores, se determinó la ganancia de peso ocurrida durante este periodo (ganancia perimenopaúsica), teniendo en cuenta para su posterior categorización hasta 4,5 kg, según un estudio poblacional realizado por Wing2.
La etapa biológica fue categorizada en pre y postmenopausia a partir de la menopausia según la definición dada por la OMS, como el cese definitivo de los ciclos menstruales determinado retrospectivamente luego de 12 meses consecutivos de amenorrea que no responda a otra causa fisiológica o patológica(24).
Análisis estadístico
Los datos fueron analizados con el paquete estadístico SPSS 15.0. Se utilizaron medidas de tendencia central, expresando los resultados como proporciones, medias y desvíos estándar. Las diferencias entre grupos se determinaron mediante Anova, χ2 o prueba exacta de Fisher según el tipo de variables y el tamaño muestral. Se calculó el Odds Ratio (OR), con intervalo de confianza (IC) del 95% y correlación de Pearson con nivel de significación estadística p< 0,05.
Consideraciones éticas y declaración de conflictos de interés
Se respetaron las consideraciones éticas según la Declaración de Helsinki con la finalidad de salvaguardar los derechos, la seguridad y el bienestar de las pacientes encuestadas. Los autores manifiestan no presentar ningún conflicto de interés que haya afectado el informe final del presente trabajo.
Resultados
Sobre el total de mujeres analizadas (n= 114), la edad promedio fue de 55,5± 6,3años. El 92,1% de la muestra eran mujeres postmenopáusicas, siendo la edad media de la menopausia 47,4 ± 5,2 años.
El 67,5% presentó sobrepeso u obesidad según el IMC y el 48,2% distribución de grasa abdominovisceral según la CC aumentada, pudiendo observar en la Tabla 1 los valores medios y desvíos estándares correspondientes. En cuanto a la ganancia de peso perimenopáusica, se obtuvo como resultado que el 40,3% de las mujeres tuvo una ganancia mayor de la esperada.
Tabla 1: Valores medios y DE del perfil antropométrico de la muestra.
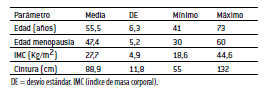
El 25,4% de la muestra consumía psicofármacos al momento del estudio, haciéndolo por más de 12 meses el 75,9% de este grupo. No se observó asociación entre el consumo de psicofármacos y los parámetros nutricionales tomados de las mujeres (Tabla 2).
Tabla 2: Asociación entre consumo de psicofármacos y estado nutricional.
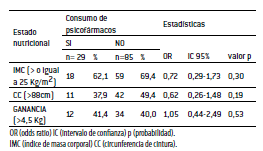
El 72,8% picoteaba entre comidas y el 69,3% de las mujeres refirió presentar compulsión glucídica.
En la Tabla 3 se observa la distribución de la muestra según presencia de compulsión glucídica y el estado nutricional, la etapa biológica, el consumo de psicofármacos y el tiempo de consumo del mismo. En ninguna de las variables analizadas se encontró asociación significativa con la presencia de compulsión glucídica.
Tabla 3: Prevalencia porcentual de las variables estudiadas en los dos grupos de mujeres adultas según la presencia de compulsión glucídica.
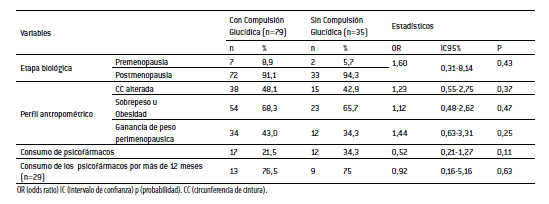
En cuanto a las características de la conducta alimentaria, se observó que el 48,2% de las mujeres prefería el sabor dulce, el 19,3% salado y para el 32,5% era indistinto el sabor al momento de elegir alimentos. Acerca de las características de los episodios compulsivos (n=79), los alimentos más elegidos fueron los panificados (60,8%) y el chocolate (41,8%) (Gráfico 1). La mayoría de las mujeres lo hacían sin la sensación de hambre (43,1%) y con una frecuencia superior a 2 veces por semana (36,7%). El 82,3% de las mujeres refirió que dichos episodios se presentaban durante la tarde/noche (41,8% y 40,5% respetivamente); mientras que en el 17,7% se presentaban por la mañana o de forma indistinta en cualquier momento del día.
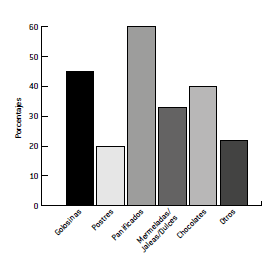
Gráfico N°1. Preferencia de alimentos durante episodios de compulsión glucídica.
Discusión
Durante la perimenopausia, por causa de variaciones en los niveles hormonales, la mujer sufre una serie de cambios, que repercuten en forma directa sobre su calidad de vida, como ser alteraciones del estado de ánimo, aumento de peso a expensas de tejido graso y redistribución de éste a nivel central, de tipo androide.(25)
En el estudio de Wing y cols. (2) el 20% de la población estudiada ganó 4,5 kg de peso o más, siendo éste valor el esperado para el período perimenopáusico. En el presente trabajo los resultados para la ganancia de peso mayor a la esperada alcanzan valores superiores al 40%, duplicando los encontrados por Wing y coincidentes con diversos estudios poblacionales realizados en los últimos años respecto de obesidad en la menopausia.(9)
Por otro lado, teniendo en cuenta el IMC, más de la mitad de las mujeres evaluadas (67,5%), se ubicaron en la categoría de sobrepeso/obesidad. Esta gran proporción de mujeres afectadas, podría no atribuirse únicamente a los niveles de estrógenos disminuidos, característicos de esta etapa, sino también al carácter multifactorial de estas condiciones, es posible que influyan otros factores como el estrato socioeconómico, la falta de actividad física y los hábitos alimentarios inadecuados, entre otros.
Estudios realizados en Venezuela, en mujeres postmenopáusicas reportan un IMC promedio indicativo de malnutrición por exceso, en porcentajes similares a los encontrados en este estudio.(26)
La distribución de la grasa corporal se ve modificada, como consecuencia de la declinación de los niveles de estrógenos,(27) ubicándose en el área central o androgénica, lo que conlleva a un aumento del riesgo de enfermedades cardiovasculares. En el presente estudio aproximadamente la mitad de las mujeres encuestadas presentaron circunferencia de cintura aumentada, coincidente con los resultados arrojados por la Encuesta Nacional de Salud realizada en Chile en 2003, para mujeres adultas(28).
Otra de las consecuencias de la disminución de las concentraciones de estrógenos, ocurre sobre el metabolismo del triptófano, el cual se encuentra disminuido y al ser precursor de serotonina, los niveles de este neurotransmisor también decrecen. Este efecto podría determinar la aparición de una conducta compulsiva por alimentos ricos en hidratos de carbono en mujeres perimenopáusicas, dado el efecto serotoninérgico encontrado en los dulces(9). Los resultados obtenidos en el presente trabajo muestran que del total de mujeres encuestadas, el 70% padecía compulsión glucídica, definida como un deseo (o necesidad psicológica) intenso e irrefrenable que conduce al individuo a abandonar la abstinencia sobre una sustancia en particular(22). Entre ellas, casi la mitad refirió preferir el sabor dulce, y un porcentaje similar asumió realizar estas comidas sin sentir hambre.
Parker y Crawford, realizaron un estudio que consistía en un cuestionario online, donde participaron 3.000 personas que padecían de una depresión clínica. En el mismo, se halló que la mitad de los participantes presentaban compulsión glucídica por el chocolate destacándose así, las mujeres sobre los hombres(29). Asimismo el chocolate ha sido el alimento más consumido en episodios de compulsión glucídica por mujeres postmenopáusicas que fueron estudiadas en el trabajo de Torresani y cols.(22).
En relación a lo dicho, en el presente trabajo, los panificados fueron el grupo de alimentos de preferencia elegido por las mujeres de la muestra durante dichos episodios (60,8%); mientras que el chocolate ocupa el segundo lugar de elección. Se cree que las diferencias encontradas podrían deberse a la facilidad de acceso al grupo de panificados, preferidos principalmente por una clase social de tipo media-baja como la encuestada.
Tal como se muestra en los resultados expuestos, la mayoría de las mujeres encuestadas refirieron la tarde/noche como los momentos del día más frecuentes para el picoteo compulsivo. Esto podría explicarse dado que se produce un descenso en la producción de serotonina cerebral a lo largo del día.(30)
Durante la perimenopausia ocurren alteraciones de la conducta emocional en los que podrían estar implicados factores psicológicos y hormonales. Son varios los estudios que sugieren que dentro de los trastornos psicológicos que ocurren, el más frecuente es la depresión(31). Por otro lado, un estudio realizado en el país demuestra que cada vez es mayor el consumo de psicofármacos en la población general(21).
En el presente estudio, el 25% de las mujeres encuestadas consume algún tipo de psicofármaco, y entre ellas, el 75% lo hace desde hace más de un año.
La hipótesis planteada afirma que el consumo de psicofármacos al inhibir el centro del apetito, se asocia con la disminución en la frecuencia de la compulsión glucídica en mujeres adultas. Esto se ha evidenciado por las diferencias porcentuales encontradas, ya que entre las mujeres que no consumían psicofármacos, un 73% refirió sufrir compulsión glucídica; mientras que para aquellas mujeres que sí consumían este tipo de fármacos, esta cifra descendió a 57%. Sin embargo, en ninguno de estos factores analizados se encontró asociación estadística significativa con la aparición del evento.
Los efectos de los antidepresivos en relación al apetito y al peso corporal difieren según el grupo al que pertenezcan los fármacos(20). Algunos de ellos producen un aumento del apetito y, en consecuencia, de peso; mientras que otros traen aparejado el efecto contrario. Se cree que por esta razón, en el presente trabajo, no se observaron diferencias significativas en los valores de las medidas antropométricas entre las mujeres que consumían psicofármacos y aquellas que no lo hacían.
Limitaciones del Estudio
Planteamos como limitación la falta de análisis de posibles factores socioeconómicos y culturales predictivos de la presencia de compulsión glucídica y el tipo de alimento elegido por las diferentes clases sociales. Algunas investigaciones muestran que mujeres postmenopáusicas, solteras, separadas o viudas, que no tienen hijos y que no trabajan serían más propensas a presentar esta conducta alimentaria(31).
Finalmente se sugiere en estudios futuros, analizar las diferentes variables diferenciando por cada tipo de fármacos consumidos. Y si su consumo mejora la calidad de vida en esta etapa biológica.
Conclusión
A partir de los resultados de este trabajo se puede concluir que:
• Fue alta en la muestra la prevalencia de sobrepeso u obesidad con una distribución de grasa de tipo abdominovisceral.
• La mayoría de las mujeres picoteaban alimentos entre las comidas principales y presentaron episodios de compulsión glucídica.
• Los panificados fueron los alimentos más elegido por las mujeres en los episodios de compulsión, sin sensación de hambre, preferentemente durante la tarde o noche y con una frecuencia de dos veces o más por semana.
• Fue bajo el porcentaje de mujeres con indicación de psicofármacos para mejorar la calidad de vida en esta etapa biológica.
• Las mujeres que recibieron psicofármacos, independientemente de su tiempo de consumo, no presentaron asociación con las compulsiones glucídicas, ni con el perfil antropométrico alterado.
Agradecimientos:
Este estudio forma parte del Proyecto de Investigación UBACYT 2010-2012 y contó con el subsidio de Ciencia y Técnica de la Universidad de Buenos Aires. Se expresa el agradecimiento a las autoridades y personal del Hospital General de Agudos "Bernardino Rivadavia" que permitieron la realización del presente trabajo.
1. Duval F, Jautz-Duval M, González F, Rabia H. Bases neurobiológicas de vulnerabilidad psiquiátrica a lo largo de las etapas de la vida hormonal de la mujer. Rev chil neuro-psiquiat 2010; 48: 292-306. [ Links ]
2. Wing RR, Matthews KA, Kuller LH, Meilahn EN, Plantinga PL. Weight gain at the time of menopause. Department of Psychiatry, University of Pittsburgh, PA 1991 Jan; 151(1):97-102. [ Links ]
3. Parry B. Perimenopausal depression. Am J Psychiatry 2008; 165 (1): 23-27. [ Links ]
4. Lugones Botell M, Navarro Despaigne D. Síndrome climatérico y algunos factores socioculturales relacionados con esta etapa. Rev Cubana Obstet Ginecol. 2006 Abr; 32(1). Disponible en: http://scielo.sld.cu/. [ Links ]
5. Benmansour S, Weaver RS, Barton AK, Adeniji OS, Frazer A. Comparison of the effects of estradiol and progesterone on serotonergic function. Biol Psychiatry. 2012 Apr 1;71(7):633-4. [ Links ]
6. Forero, J. Trastorno de ansiedad en el climaterio. Revista de menopausia. 2003; 9: 329. [ Links ]
7. Barrios Y, Díaz N, Meertens L, Naddaf G, Solano L. Leptina sérica, su relación con peso y distribución de grasa corporal en mujeres posmenopáusicas. Nutrición Hospitalaria 2010; 25(1): 80-84. [ Links ]
8. Vásquez-Machado M, Ulate-Montero G. Regulación del peso corporal y del apetito. Acta Médica Costarricense, 2010; 52 (2): 79-89. [ Links ]
9. Pavón de Paz, C. Alameda Hernando y J. Olivar Roldán. Obesidad y menopausia. Nutr Hosp. 2006; 21(6):633-637 [ Links ]
10. Torresani ME, Somoza MI. Lineamientos para el cuidado nutricional. 3ra Edición. Buenos Aires: Eudeba; 2009. [ Links ]
11. Susan Yanovski. Sugar and Fat: Cravings and Aversions.J. Nutr. 2003; 133: 835S–837S
12. Wurtman RJ, Wurtman JJ. Carbohydrate craving, obesity and brain serotonin. Appetite 1986; 7(Suppl): 99-103. [ Links ]
13. American Psychiatric Association. The Diagnostic and Statistical Manual of Mental Disorders: DSM 5. Bookpoint US, 2013. [ Links ]
14. Field AE, Sonneville KR, Micali N, Crosby RD, Swanson SA, Laird NM.l Prospective Association of Common Eating Disorders and Adverse Outcomes. Pediatrics 2012; 130(2): e289-e295. [ Links ]
15. Errandonea, U. Isabel. Obesidad y trastornos de alimentación. Revista Médica Clínica Las Condes, 2012; 23(2): 165-171. [ Links ]
16. Carrard, I; Linden, M V; Golay, A. Comparison of Obese and Nonobese individuals with Binge Eating Disorder: Delicate Boundary between BingeEating Disorder and Non Purging Bulimia Nervosa. European Eating Disorders Review, 2012; 20(5): 350-354. [ Links ]
17. Freeman EW, Sammel MD, Lin H et al. Associations of hormones and menopausal status with depressed mood in women with no history of depression. Arch Gen Psychiatry 2006; 63: 375-382. [ Links ]
18. Cohen LS, Soares CN, Vitonis AF et al. Risk for new onset of depression during the menopausal transition: the Harvard study of moods and cycles. Arch Gen Psychiatry 2006; 63: 385-390. [ Links ]
19. Jadresic E. Climaterio: depresión y alteraciones del ánimo. Rev Med Clin 2009; 20(1) 61-65. [ Links ]
20. Quiñones, Alaya, G. Efecto de los medicamentos en el apetito.Trastornos de la conducta alimentaria 2011; 13: 1437-1460. [ Links ]
21. Leiderman EA, Mugnolo JF, Bruscoli N, Massi J. Consumo de psicofármacos en la población general de la Ciudad de Buenos Aires. VERTEX Rev Arg de Psiquiat 2006; 17: 85-91. [ Links ]
22. Torresani ME, Alvizua M, Buyukkurt MN, Chaika I, De Lorenzi P, Direnzo J, Vazquez V. Compulsión glucídica y estado de ansiedad en mujeres postmenopáusicas. Actualización en Nutrición 2011; 12 (2): 147-153 [ Links ]
23. Clinical guidelines on the identification, evaluation, and treatment oh overweight and obesity in adults. The evidence report National Institutes of Health. Obes Res.1998; 6(Suppl 2): 51S-209S. [ Links ]
24. Report of a WHO Scientific Group. Research on the menopause in the 1990s. World Health Organ Tech Rep Ser.1996; 866:1-107. [ Links ]
25. Gambacciani M, Ciaponi M, Cappagli B, Benussi C, De Simone L, Genazzani AR. Climacteric modifications in body weight and fat tissue distribution. Climaterio. 1999; 2 (1):37-44. [ Links ]
26. Meertens, L Y Cols. Estado nutricional, indicadores antropométricos y homocisteína sérica en mujeres posmenopáusicas venezolanas. Rev Chil Nutr 2011; 38(3): 278-284. [ Links ]
27. Gavaler J, Rosenblum E. Predictors of postmenopausal body mass index and waist hip ratio in the Oklahoma Postmenopausal Health Disparities Study. J Am Coll Nutr 2003; 22 (4): 269-276. [ Links ]
28. Ministerio de Salud de Chile. Departamento de Epidemiología. Encuesta Nacional de Salud, 2003. [ Links ]
29. Parker G, Crawford J. Chocolate craving when depressed: a personality marker. Br J Psychiatry 2007; 191, 351-352. [ Links ]
30. Van Cauter E, Blackman J, Roland D, Spire J, RefetoffS, Polonsky K. Modulation of glucose regulation and insulin secretion by circadian rhythmicity and sleep. J Clin Invest 1991; 88: 934. [ Links ]
31. Fava M, Cassano P. Mood disorders: Major depressive disorder and dysthymic disorder. Massachusetts General Hospital Comprehensive Clinical Psychiatry; 1st ed. Philadelphia 2008 [ Links ]^rND^sDuval^nF^rND^sJautz-Duval^nM^rND^sGonzález^nF^rND^sRabia^nH^rND^sWing^nRR^rND^sMatthews^nKA^rND^sKuller^nLH^rND^sMeilahn^nEN^rND^sPlantinga^nPL^rND^sParry^nB^rND^sLugones Botell^nM^rND^sNavarro Despaigne^nD^rND^sBenmansour^nS^rND^sWeaver^nRS^rND^sBarton^nAK^rND^sAdeniji^nOS^rND^sFrazer^nA^rND^sForero^nJ^rND^sBarrios^nY^rND^sDíaz^nN^rND^sMeertens^nL^rND^sNaddaf^nG^rND^sSolano^nL^rND^sVásquez-Machado^nM^rND^sUlate-Montero^nG^rND^sPavón de Paz^nC^rND^sAlameda^nHernando^rND^nJ^sOlivar Roldán^rND^nSusan^sYanovski^rND^sWurtman^nRJ^rND^sWurtman^nJJ^rND^sField^nAE^rND^sSonneville^nKR^rND^sMicali^nN^rND^sCrosby^nRD^rND^sSwanson^nSA^rND^sLaird^nNM^rND^sErrandonea^nU. Isabel^rND^sCarrard^nI^rND^sLinden^nM V^rND^sGolay^nA^rND^sFreeman^nEW^rND^sSammel^nMD^rND^sLin^nH^rND^sCohen^nLS^rND^sSoares^nCN^rND^sVitonis^nAF^rND^sJadresic^nE^rND^sQuiñones, Alaya^nG^rND^sLeiderman^nEA^rND^sMugnolo^nJF^rND^sBruscoli^nN^rND^sMassi^nJ^rND^sTorresani^nME^rND^sAlvizua^nM^rND^sBuyukkurt^nMN^rND^sChaika^nI^rND^sDe Lorenzi^nP^rND^sDirenzo^nJ^rND^sVazquez^nV^rND^sGambacciani^nM^rND^sCiaponi^nM^rND^sCappagli^nB^rND^sBenussi^nC^rND^sDe Simone^nL^rND^sGenazzani^nAR^rND^sMeertens^nL^rND^sGavaler^nJ^rND^sRosenblum^nE^rND^sParker^nG^rND^sCrawford^nJ^rND^sVan Cauter^nE^rND^sBlackman^nJ^rND^sRoland^nD^rND^sSpire^nJ^rND^sRefetoff^nS^rND^sPolonsky^nK^rND^1A01^sNastasi^nVictoria^rND^1A02^sCanicoba^nMarisa^rND^1A01^sNastasi^nVictoria^rND^1A02^sCanicoba^nMarisa^rND^1A01^sNastasi^nVictoria^rND^1A02^sCanicoba^nMarisa
ARTÍCULO INVITADO
Efecto de la dieta reducida en FODMAPs en el manejo de síntomas gastrointestinales
Effect of a low-fodmaps diet in gastrointestinal symptoms
Nastasi Victoria1, Canicoba Marisa2
1Licenciada en Nutrición. Residencia de Nutrición de la Provincia de Buenos Aires.
2Licenciada en Nutrición. Dpto. de Alimentación. Hospital Nacional "Prof. A. Posadas". El Palomar, Provincia de Buenos Aires. Argentina.
Resumen
Introducción: El enfoque de la dieta reducida en Oligosacáridos, Disacáridos, Monosacáridos y Polialcoholes Fermentables (FODMAPs) con el fin de controlar los Síntomas Gastrointestinales (GI), ha sido estudiado principalmente en pacientes con Síndrome de Intestino Irritable (SII). La absorción deficiente, el efecto osmótico y la fermentación bacteriana de los FODMAPs en el intestino son fenómenos normales, donde la aparición de síntomas (distensión, dolor abdominal y alteración de la motilidad intestinal) ocurrirá si la respuesta subyacente es exagerada o anormal.
Discusión: La implementación de la Dieta Reducida en FODMAPs (DRF) requiere de una etapa de restricción de los mismos, seguida por una de reintroducción. La evidencia que se dispone a la fecha resulta prometedora en el control de síntomas GI, tanto del SII, Sensibilidad al Gluten No Celíaca (SGNC) y Enfermedad Inflamatoria Intestinal (EII). Asimismo, se ha vinculado el contenido de FODMAPs de las fórmulas enterales con la diarrea asociada a la nutrición enteral. El impacto a largo plazo de la restricción de FODMAPs sobre la microbiota intestinal es aún desconocido.
Conclusión: Se requiere de mayor evidencia para poder recomendar la DRF como tratamiento de primera línea. El asesoramiento dietético por parte de un licenciado en nutrición sobre la misma es indispensable para su eficacia.
Palabras clave: FODMAPs; Síndrome de Intestino Irritable; Enfermedad Inflamatoria Intestinal; Nutrición Enteral.
Abstract
Introduction: The focus of the diet reduced in oligosaccharides, disaccharides, monosaccharides and fermentable polyalcohols (FODMAPs) in order to control the gastrointestinal symptoms (GI) has been studied mainly in patients with Irritable Bowel Syndrome (IBS). Malabsorption, osmotic effects and bacterial fermentation of FODMAPs in the intestine are normal phenomena, where the appearance of symptoms (bloating, abdominal pain and altered bowel motility) will appear if the underlying response is exaggerated or abnormal.
Discussion: The implementation of a Low-FODMAPs Diet (LFD) requires a phase of restriction, followed by reintroduction. The evidence available to date is promising in the control of GI symptoms, both of IBS, Non-Celiac Gluten Sensitivity (NCGS) and Inflammatory Bowel Disease (IBD). The content of FODMAPs of enteral formulas has also been linked with diarrhea associated with enteral nutrition. The long-term impact of FODMAPs restriction on intestinal microbiota is still unknown.
Conclusion: More evidence is required in order to recommend the LFD as first-line treatment. Dietary advice from a registered dietitian is essential to its effectiveness.
Keywords: FODMAPs; Irritable Bowel Syndrome; Inflammatory Bowel Disease; Enteral Nutrition.
Introducción
El dolor abdominal es uno de los principales motivos de consulta médica, dentro de los Síntomas Gastrointestinales (GI), estimando 15,9 millones de consultas anuales en Estados Unidos (1), siendo su prevalencia en la población argentina del 31% (2). El plan de alimentación puede ser utilizado para controlar los síntomas y modificar los procesos de enfermedad, de manera independiente de su rol nutricional (3), como es el caso de la Dieta Reducida en FODMAPs (DRF). El acrónimo "FODMAP", el cual surgió en la Universidad de Monash, Australia, corresponde a la expresión en inglés: "Fermentable Oligisaccharides, Disaccharides, Monosaccharides And Polyols" (Oligosacá ridos, Disacáridos, Monosacáridos y Polialcoholes Fermentables) (4).
Se considera que los hidratos de carbono mencionados comparten tres propiedades funcionales, las cuales contribuyen a agravar los síntomas GI, en los trastornos funcionales gastrointestinales y más aún, en el Síndrome de Intestino Irritable (SII). En primer lugar, son pobremente absorbidos en el intestino delgado, es decir, existe una absorción deficiente en virtud de los mecanismos epiteliales de transporte lento, de baja capacidad (fructosa), menor actividad de las hidrolasas del borde en cepillo (lactosa), ausencia de hidrolasas (oligosacáridos), o el tamaño de las moléculas no es el propicio para difundir (polialcoholes). En segundo lugar, son moléculas pequeñas y osmóticamente activas, por lo que aumentan el contenido hídrico luminal, alterando la motilidad intestinal. Por último, son rápidamente fermentados por las bacterias, con la consecuente producción de ácidos grasos de cadena corta tales como ácido butírico, y gases como dióxido de carbono (CO2), metano (CH4) e hidrógeno (H2). Éste último difunde junto al metano al torrente sanguíneo, pudiendo ser cuantificado mediante la prueba de hidrógeno en el aire espirado, cuyo fin es identificar aquellos sujetos que no pueden absorber completamente una carga de hidratos de carbono que podría ser ingerida de manera habitual en la dieta (5, 6, 7).
La razón de los síntomas tras la ingestión de FODMAPs en un individuo, es la respuesta del Sistema Nervioso Entérico (SNE) a la distensión luminal (debido a la hipersensibilidad visceral, la producción de gas excesivo relacionada con la naturaleza de la microbiota residente, o disturbios en la motilidad), y no debido a que los fenómenos ocasionados por la misma sean anormales o se traten de una afección patológica (5, 8, 9, 10).
Discusión
Absorción de fodmaps
La fructosa libre es absorbida por el transportador GLUT-5, el cual posee una baja capacidad de absorción y se encuentra en la membrana apical de los enterocitos en el intestino delgado. Cuando la fructosa se encuentra junto con la glucosa, la eficiencia de la absorción es mayor (alrededor del 85%). Se considera que esta absorción, está relacionada con la inserción del transportador GLUT-2 en la membrana apical, permitiendo la absorción de hexosas. Este mecanismo adaptativo a distintas concentraciones de glucosa, asegura la máxima utilización de nutrientes (4, 11). Por consiguiente, la Malabsorción de Fructosa (MF) se manifiesta cuando la misma se encuentra libre, en exceso respecto a la glucosa, hecho que fue observado por Murray et al a través de imágenes por resonancia magnética (12). Se estima que el 30% de la población la experimenta (13, 14), siendo su prevalencia mayor en sujetos con trastornos funcionales gastrointestinales que en aquellos sanos (15), aunque Goebel- Stengel et al (6) observaron un valor más elevado (64%). Respecto a la Malabsorción de Lactosa, su prevalencia presenta una amplia variación (2% al 90%), entre los distintos grupos étnicos y países. La absorción de los polialcoholes (sorbitol, manitol, xilitol, maltitol) por difusión pasiva es deficiente, acentuándose cuando el sorbitol se encuentra junto con la fructosa (9, 15). Más del 90% de los oligosacáridos (Fructooligosacáridos -FOS- y Galactooligosacáridos -GOS-) son fermentados en el colon, debido a la deficiencia enzimática (Figura 1).
Figura 1: Mecanismo de acción propuesto que participa en el desarrollo de síntomas GI luego de la ingesta de FODMAPs.
Traducido de: Simren M. Diet as a therapy for irritable bowel syndrome: progress at last. Gastroenterology. 2014.
Características de la dieta reducida en fodmaps
Sobre la base de los principios fisiológicos mencionados de los FODMAPs se confeccionó una lista de alimentos potencialmente problemáticos, donde se restringe fructosa, FOS, GOS, lactosa y polialcoholes como sorbitol y manitol, utilizando tablas de composición de alimentos provenientes de la Autoridad Nacional Australiana de Alimentos, el Departamento de Agricultura de Estados Unidos y artículos de revistas científicas. Los alimentos reducidos en FODMAPs tienen valores de corte arbitrarios para el contenido de fructosa y fructanos, considerando que valores superiores representan un riesgo para la inducción de síntomas (más de 0,5g de fructosa en exceso de glucosa por cada 100g de alimento, más de 3g de fructosa en una porción promedio independientemente de la can tidad de glucosa, y más de 0,2g de fructanos por porción (16)). En la Tabla 1 puede observarse un listado de alimentos con elevado y bajo contenido en FODMAPs (5, 10, 16).
Tabla 1: Fuentes Alimentarias de FODMAPs

Existe escasa información sobre el contenido de FODMAPs de las dietas habituales. Recientemente, Halmos et al (17) estimaron que el contenido promedio diario de la dieta australiana es de 23,7g, con un rango de 16,9 - 30,6g. En relación a la ingesta de FODMAPs en la población con SII, Liljebo et al (18) observaron en Suecia, mediante un registro alimentario de cuatro días, que era de 30,9g/día.
La implementación de la DRF incluye dos etapas. La primera etapa (Fase de Inducción) suele tener una duración de por lo menos 6 a 8 semanas e incluye la estricta restricción de todos los alimentos ricos en FODMAPs para obtener alivio de los síntomas GI. En la segunda etapa (Fase de Exposición), se orienta a los pacientes a introducir FODMAPs en su alimentación, eligiendo alimentos que contengan un tipo de FODMAPs a la vez, para así determinar la tolerancia individual a cada tipo y cantidad de FODMAPs. Esto permite la individualización de la alimentación del paciente, estimulan do la variedad a largo plazo y evitando restricciones innecesarias, mientras se mantiene el control de los síntomas alcanzado en la primera etapa. El asesoramiento dietético de la DRF por parte de un Licenciado en Nutrición es esencial en la eficacia de la misma (8, 9, 10, 19).
Cabe señalar que la mayoría de las investigaciones referidas al efecto de los FODMAPs sobre los síntomas GI utilizaron, en la etapa de restricción, una DRF que aportaba entre 3 y 9g/día de los mismos. Respecto a la Fase de Exposición, no se dispone demasiada información acerca de ciertos aspectos intrínsecos de la misma tales como el periodo entre cada introducción o el orden de la introducción de cada tipo de FODMAPs y su cantidad. El nivel máximo de tolerancia cuali-cuantitativa a los FODMAPs, luego de la etapa de restricción, es propio de cada individuo.
Utilización de una dieta reducida en fodmaps en patologías gastrointestinales
Síndrome de intestino irritable El SII es un trastorno complejo, con una prevalencia del 10% al 20% (20, 21), cuya fisiopatología implica diversos factores que interactúan, produciendo síntomas crónicos y comorbilidades psicológicas (22, 23, 24). La asociación entre el consumo de alimentos y la inducción de sintomatología ha sido referida por un 70% de los sujetos con SII (25). Distintas modificaciones en la dieta han sido propuestas en el tratamiento del mismo; tal es el caso de la dieta libre de aditivos, baja en salicilatos y aminas, la cual no ha sido evaluada vastamente (8, 22, 26), y de la restricción de algún tipo de FODMAPs (como fructosa, con o sin sorbitol, y lactosa), cuyo limitado éxito se cree que se debe a la restricción parcial de FODMAPs, y no de todos ellos (13, 27).
En los últimos años, diversas investigaciones fueron llevadas a cabo con el fin de conocer el efecto de la restricción global de FODMAPs de la alimentación sobre los síntomas GI. El estudio retrospectivo realizado en 2006 por Shepherd et al (16), mostró que el 74% de los 62 sujetos con SII y MF presentaron una reducción de los síntomas GI, observando una mejoría significativamente mayor en aquellos adherentes a la DRF que aquellos no adherentes (85% vs 36%; p<0.01). Similares hallazgos obtuvieron De Roest et al (28) en su estudio prospectivo zelandés (n=91 con SII) al emplear una DRF, y Staudacher et al (29), quienes señalaron una mayor eficacia por parte de la DRF respecto al asesoramiento dietético tradicional en el control de síntomas (86% vs 49%).
El primer estudio doble ciego, aleatorizado, placebo- control se realizó en 2008, donde Shepherd et al (30) implementaron una DRF sobre 25 pacientes con SII y MF y se asignó al azar la introducción de dosis graduales (baja, media y alta; durante tres días cada una) de 4 sustancias diferentes (fructosa, fructanos, mezcla de fructosa y fructanos, y glucosa) en forma de bebidas saborizadas. Los síntomas GI evaluados (dolor abdominal, distensión, meteorismo) fueron significativamente mayores con la ingesta de fructosa, fructanos y la mezcla fructosafructanos (70%, 77% y 79% respectivamente) que con la ingesta de glucosa (14%), infiriendo que la respuesta intestinal frente a la presencia de FODMAPs contribuye a la aparición de síntomas.
El segundo estudio con un diseño doble ciego, cruzado, fue realizado por Ong et al (31), en 2010, donde compararon los síntomas GI y los resultados de las pruebas de hidrógeno espirado durante dietas bajas (9g/día) y altas (50g/día) en FODMAPs, las cuales fueron implementadas durante dos días, en 15 sujetos sanos y 15 con SII, observando en ambos grupos niveles elevados de hidrógeno espirado cuando recibían la dieta alta en FODMAPs. Los síntomas GI y el letargo fueron inducidos significativamente por la dieta alta en FODMAPs en pacientes con SII, mientras que los voluntarios sanos reportaron sólo aumento de meteorismo. Este no se trató del único estudio que incluyó intervenciones con dietas altas y bajas en FODMAPs.
Halmos et al (32), mediante un estudio aleatorizado, controlado, ciego, cruzado, investigaron el efecto de los síntomas GI de una DRF (3,05g/d) en comparación con la dieta tradicional australiana (23,7g/d), en 30 pacientes con SII. Ambas dietas contenían gluten, aunque la DRF tenía menor cantidad debido a la restricción de alimentos como trigo, centeno y cebada. El contenido de fibra de ambas dietas fue igualado mediante el agregado de 3g de psyllium y 5g de almidón resistente a la DRF. Los su jetos con SII mostraron una reducción significativa en los síntomas GI cuando se encontraban bajo una DRF en comparación al periodo en que recibían la dieta australiana. Por lo que los autores, refieren que la investigación realizada proporciona un alto nivel de evidencia sobre la eficacia de la DRF en el SII. No obstante, otros autores (33) han cuestionado algunos de sus aspectos metodológicos como el tamaño muestral, la selección de los sujetos y el análisis estadístico empleado, así como también han señalado la presencia de confusores en el mismo (gluten, psyllium, almidón resistente) y la falta de cegamiento en la mayoría (83%) de los sujetos, no pudiendo arribar a la misma conclusión.
La comparación del efecto de la DRF y el probiótico Lactobacillus rhamnosus GG (LGG) sobre los síntomas GI en sujetos con SII, fue llevada a cabo por Pedersen et al (34), donde ambos parecieron inducir alivio en la sintomatología. Ha sido observado que algunos pacientes con SII presentan sobrecrecimiento bacteriano, el cual se encuentra vinculado al incremento de la permeabilidad intestinal y del dolor abdominal (26, 35). La microbiota intestinal presenta diferencias entre individuos (36), e impacta sobre el estado nutricional (37). Staudacher et al (2012) investigaron el efecto de la restricción de FODMAPs sobre la microbiota, observando menor proporción de bifidobacterias, aunque sin modificación en el total de bacterias luminales, y una mejora en el control de síntomas (68%) (38). Posteriormente, Halmos et al (17) obtuvieron resultados similares a partir de su investigación, no siendo así en el caso de Pedersen et al (39), quienes no encontraron diferencias significativas en la microbiota de sujetos con EII y SII. No obstante, actualmente, se carece de análisis detallados sobre la composición de la microbiota, funcionalidad y productos de fermentación en relación a la reducción de FODMAPs y la generación de síntomas (40).
Los estudios recientes sobre el uso de DRF en la población pediátrica son escasos. El estudio doble ciego, aleatorizado y cruzado, realizado por Chumpitazi et al (41), sobre 33 niños con SII, observó que presentaron menor dolor abdominal durante el periodo en el que recibieron una DRF (9g/d), en comparación con su dieta habitual. De modo similar, la investigación de Escobar et al (42), con un tamaño muestral mayor (n=222), señaló que el 76,9% presentó una mejora de los síntomas GI al implementar una dieta reducida en fructosa, concluyendo que la misma puede ser un enfoque terapéutico efectivo en dicha población. Pese a las investigaciones mencionadas, se requieren más estudios para poder realizar inferencias respecto al uso de la DRF en niños con SII.
Finalmente, vale señalar que las directrices de la Asociación Dietética Británica (43) para el tratamiento dietético del SII, han establecido como recomendación de grado B, el uso de una DRF en sujetos con SII (con diagnóstico o sospecha de MF).
Sensibilidad al gluten no celiaca
En los últimos años, varios estudios han mencionado la Sensibilidad al Gluten No Celíaca (SGNC), síndrome caracterizado por síntomas GI, cutáneos, hematológicos, entre otros, que usualmente ocurren luego de la ingesta de gluten, sin padecer celiaquía ni alergia al trigo (44, 45). Se estima que una proporción de pacientes con SII presentan SGNC (46). Sanders DS y Aziz I (47), señalan que aunque la evidencia disponible a la fecha sugiere el efecto benéfico de una dieta libre de gluten en pacientes con SII, es posible que la restricción de gluten per se no sea lo que origine alivio en la sintomatología. En el estudio cruzado, doble ciego, aleatorizado, realizado sobre una muestra de 37 pacientes con SII y SGNC, Biesiekierski et al (48) observaron que los síntomas GI mejoraban significativamente mientras consumían una DRF, y se agravaban significativamente cuando se incluía gluten o proteínas de suero en la dieta. No obstante, dicho estudio presenta como limitación un corto periodo de realización y una elevada respuesta nocebo.
En contraste a los resultados mencionados, la revisión realizada por Catassi et al (49), destaca que los FODMAPs no pueden ser completa y exclusivamente desencadenantes de los síntomas GI, ya que los sujetos presentan un alivio en los mismos cuando se encuentran bajo una dieta libre de gluten, a pesar de ingerir FODMAPs de otras fuentes. Sin embargo, basados en los resultados arrojados por Biesiekierski et al, es posible que haya casos de SII donde los síntomas se deban a la ingesta de FODMAPs.
Es necesario definir biomarcadores específicos de SGNC para lograr una adecuada selección de sujetos en las investigaciones sobre dicho tema.
Enfermedad inflamatoria intestinal (EII)
Algunos autores han evaluado la DRF en pacientes con EII, bajo la hipótesis de que el sobrecrecimiento bacteriano (debido a la presencia luminal de FODMAPs y la microbiota residente) puede resultar en un aumento de la permeabilidad intestinal e inflamación intestinal. En el 2007, Croagh et al (50), con el objetivo de conocer si los FODMAPs dietarios aumentan el debito a través de una ostomía intestinal, formaron dos cohortes a partir de una muestra de 15 pacientes con EII (donde 13 presentaban una ileostomía). En la primera cohorte (n=7) se realizó un análisis retrospectivo de los aspectos dietéticos y síntomas GI antes y después de que recibieran una DRF; en la segunda (n=8) se realizó un análisis prospectivo donde se evaluaron los síntomas GI luego de seis semanas de implementación. En la cohorte retrospectiva se observó que 5 de 7 sujetos presentaron mejoras en la frecuencia y consistencia del debito. Sin embargo, en la prospectiva, no se observaron mejorías, lo cual se cree que se encuentra asociado a la existencia de pouchitis en la mayoría de los sujetos, ocurriendo un efecto contrario en aquellos que no la presentaron.
Posteriormente, Gearry et al (51), a través de un estudio retrospectivo sobre 72 pacientes con EII, observaron que los síntomas GI (dolor abdominal, distensión y diarrea) mejoraron en un 56%, siendo el estreñimiento el único síntoma que empeoró (no significativamente) luego de iniciar la DRF. Los resultados obtenidos por Joyce et al (52) sobre una muestra de 35 sujetos que presentaban EII fueron similares.
Respecto a la MF, Barrett et al (7), encontraron una mayor prevalencia de la misma en los pacientes que presentaban Enfermedad de Crohn (61%) respecto a otros grupos.
A pesar de la evidencia mencionada, es necesario contar con datos objetivos respecto a los cambios inflamatorios asociados con la intervención dietética (8, 53).
Adherencia a la dieta reducida en fodmaps
La DRF requiere de un asesoramiento realizado por un Licenciado en Nutrición experto en este tema, quién desarrollará e implementará un plan individualizado, basado en la evaluación nutricional previa (5). Además de la indicación dietoterápica, estará a cargo de las técnicas para manejar situaciones donde la preparación de las comidas no puede ser controlada (como por ejemplo, comidas fuera del hogar), así como la reintroducción de FODMAPs en la alimentación, vigilando la tolerancia a los mismos y asegurando la máxima variedad en la dieta, reduciendo el riesgo de un aporte nutricional inadecuado (46). Los estudios publicados (16, 17, 28, 32, 50, 51, 52) que presentan en su metodología el asesoramiento nutricional sobre la DRF como parte de la intervención terapéutica sobre los sujetos, mostraron hallazgos favorables en la adherencia a la misma (70-80%).
Fodmaps en nutrición enteral
Distintos estudios muestran que la Nutrición Enteral (NE) puede resultar en efectos deletéreos sobre la microbiota, tales como reducción de bifidobacterias y aumento del riesgo de diarrea asociado a Clostridium difficile (54). Una investigación restrospectiva reciente, conducida por Halmos et al (55) sobre 160 pacientes hospitalizados que recibían NE, mostró que las fórmulas con menor contenido de FODMAPs reducían la probabilidad de diarrea, a pesar que los niveles de FODMAPs administrados (entre 10,6g a 36,5g/día) eran superiores a los niveles aportados por los alimentos en otros estudios. La naturaleza retrospectiva así como la imposibilidad de excluir la diarrea de origen infeccioso, son limitaciones del estudio que deben ser tenidas en cuenta. La hipótesis planteada por Halmos EP, se contrapone con otros estudios disponibles en la literatura; los cuales concluyeron que las fórmulas enterales que contienen fibra pueden reducir la incidencia de la diarrea, al actuar como sustratos de los colonocitos (54). La estimación del contenido de FODMAPs de las fórmulas enterales a partir de las listas de ingredientes puede no ser precisa, pudiendo subestimarlo (56). Muchas fórmulas enterales en el mercado parecen tener un alto contenido de FODMAPs, lo que plantea un nuevo desafío para los laboratorios.
Limitaciones de la reducción de fodmaps
Los GOS y FOS inducen una proliferación bacteriana selectiva, especialmente de bifidobacterias, produciendo un efecto prebiótico, el cual provee beneficios para la salud. Se considera que los mismos favorecen la apoptosis de las células epiteliales del colon, razón por la cual, serían capaces de suprimir la carcinogénesis (4, 57).
Paradójicamente, se ha planteado que los FODMAPs pueden producir efectos adversos; tales como lesión epitelial y deterioro de la función de barrera, debido a las modificaciones que generan en el contenido luminal colónico (35), favoreciendo el pasaje de antígenos bacterianos a través de la lámina propia, con la consiguiente estimulación de Interleuquinas y Factor de Necrosis Tumoral (36). En el estudio realizado por Bovee-Oudenhoven et al (2003) se observó que cuando las ratas eran infectadas con una especie de salmonella, aquellas alimentadas con FODMAPs desarrollaban colitis severa en comparación con el grupo control (58). Debe considerarse que la DRF podría conllevar un posible efecto perjudicial, debido a la reducción en gran medida de la ingesta de fibra y de algunos hidratos de carbono, como inulina (cuyo efecto prebiótico ha sido mencionado), aún cuando se encuentra compuesta por una amplia variedad de alimentos. Por este motivo, la restricción estricta de FODMAPs, en quellos que la tienen indicada, podría no ser recomendada a largo plazo (59)
Conclusiones
• El potencial efecto benéfico de la restricción de FODMAPs sobre el control de la sintomatología del SII resulta prometedor. Dado el alivio sintomático que produce, la DRF podría llegar a ser un enfoque terapéutico de primera línea a considerar en pacientes con SII y otras patologías.
• Es posible que los pacientes con EII o con una ileostomía puedan beneficiarse de una DRF.
• El contenido FODMAPs de las fórmulas enterales podría estar relacionado con la diarrea observada en los pacientes que reciben NE.
• La seguridad y eficacia de la DRF a largo plazo así como el efecto de la reintroducción de FODMAPs en los síntomas GI y las alteraciones sobre la microbiota, son aún desconocidos, requiriendo de estudios adicionales.
• La indicación de la DRF requiere de un equipo conformado por un médico gastroenterólogo y un Licenciado en Nutrición, siendo la educación alimentaria nutricional primordial en la implementación y reintroducción de FODMAPs en cada caso particular, debido a su complejidad y al riesgo de una inadecuada ingesta de nutrientes.
1. Peery AF, Dellon ES, Lund J et al. Burden of gastrointestinal disease in the United States: 2012 update. Gastroenterology. 2012; 143(5): 1179-1187. [ Links ]
2. Quigley EM, Locke GR, Mueller-Lissner S et al. Prevalence and management of abdominal cramping and pain: a multinational survey. Alimentary Pharmacology & Therapeutics. 2006; 24(2): 411-419. [ Links ]
3. Gibson PR, Muir JG. Non-nutritional effects of food: An underutilized and understudied therapeutic tool in chronic gastrointestinal diseases. Journal of Gastroenterology and Hepatology. 2013; 28(4): 37–40.
4. Gibson PR, Shepherd SJ. Personal view: food for thought-western lifestyle and susceptibility to Crohn's disease. The FODMAP hypothesis. Alimentary Pharmacology & Therapeutics. 2005; 21(12): 1399-1409. [ Links ]
5. Gibson PR, Shepherd SJ. Evidence-based dietary management of functional gastrointestinal symptoms: The FODMAP approach. Journal of Gastroenterology and Hepatology. 2010; 25(2): 252-258. [ Links ]
6. Goebel-Stengel M, Stengel A, Schmidtmann M et al. Unclear abdominal discomfort: pivotal role of carbohydrate malabsorption. Journal of Neurogastroenterology and Motility. 2014; 20(2): 228. [ Links ]
7. Barrett JS, Irving PM, Shepherd SJ et al. Comparison of the prevalence of fructose and lactose malabsorption across chronic intestinal disorders. Alimentary Pharmacology & Therapeutics. 2009; 30(2): 165-174. [ Links ]
8. Gibson PR, Shepherd SJ. Food choice as a key management strategy for functional gastrointestinal symptoms. The American Journal of Gastroenterology. 2013; 107(5): 657-666. [ Links ]
9. Shepherd SJ, Lomer MC, Gibson PR. Short-chain carbohydrates and functional gastrointestinal disorders. The American Journal of Gastroenterology. 2013; 108(5): 707-717. [ Links ]
10. Barrett JS. Extending our knowledge of fermentable, short-chain carbohydrates for managing gastrointestinal symptoms. Nutrition in Clinical Practice. 2013; 28(3): 300-306. [ Links ]
11. Fedewa A, Rao SS. Dietary fructose intolerance, fructan intolerance and FODMAPs. Current Gastroenterology Reports. 2014; 16(1): 1-8. [ Links ]
12. Murray K, Wilkinson-Smith V, Hoad C et al. Differential effects of FODMAPs (fermentable oligo-, di-, mono-saccharides and polyols) on small and large intestinal contents in healthy subjects shown by MRI. The American Journal of Gastroenterology. 2014; 109(1): 110-119. [ Links ]
13. Gibson PR, Newnham E, Barrett JS et al. Review article: fructose malabsorption and the bigger picture. Alimentary Pharmacology & Therapeutics. 2007; 25(4): 349-363. [ Links ]
14. Biesiekierski JR. Fructose-induced symptoms beyond malabsorption in FGID. United European Gastroenterology Journal. 2014; 2(1): 10-13. [ Links ]
15. Skoog SM, Bharucha AE. Dietary fructose and gastrointestinal symptoms: a review. The American Journal of Gastroenterology. 2004; 99(10): 2046-2050. [ Links ]
16. Shepherd SJ, Gibson PR. Fructose malabsorption and symptoms of irritable bowel syndrome: guidelines for effective dietary management. Journal of the American Dietetic Association. 2006; 106(10): 1631-1639. [ Links ]
17. Halmos EP, Christophersen CT, Bird AR et al. Diets that differ in their FODMAP content alter the colonic luminal microenvironment. Gut. 2015; 64: 93-100. [ Links ]
18. Liljebo TM, Bohn L, Tornblom H et al. Patients With IBS Have Lower Intake of Fodmaps Compared With the General Population. American Gastroenterology Association. 2013; 144(5); S-550. [ Links ]
19. Magge S, Lembo A. Low-FODMAP diet for treatment of irritable bowel syndrome. Gastroenterology & Hepatology. 2012; 8(11): 739-745. [ Links ]
20. Harkness EF, Harrington V, Hinder S et al. GP perspectives of irritable bowel syndrome–an accepted illness, but management deviates from guidelines: a qualitative study. BMC family practice. 2013; 14(1): 92.
21. Halpin SJ, Ford AC. Prevalence of symptoms meeting criteria for irritable bowel syndrome in inflammatory bowel disease: systematic review and meta-analysis. The American Journal of Gastroenterology. 2012: 107(10); 1474-1482. [ Links ]
22. Cuomo R, Andreozzi P, Zito FP et al. Irritable bowel syndrome and food interaction. World Journal of Gastroenterology. 2014; 20(27), 8837-8845. [ Links ]
23. El-Salhy M, Ostgaard H, Gundersen D et al. The role of diet in the pathogenesis and management of irritable bowel syndrome (Review). International Journal of Molecular Medicine. 2012; 29(5): 723-731. [ Links ]
24. Zar S, Kumar D, Benson MJ. Food hypersensitivity and irritable bowel syndrome. Alimentary Pharmacology & Therapeutics. 2014; 15(4): 439-449. [ Links ]
25. Monsbakken KW, Vandvik PO, Farup PG. Perceived food intolerance in subjects with irritable bowel syndrome–etiology, prevalence and consequences. European Journal of Clinical Nutrition. 2006; 60(5): 667-672.
26. Barrett JS, Gibson PR. Fermentable oligosaccharides, disaccharides, monosaccharides and polyols (FODMAPs) and nonallergic food intolerance: FODMAPs or food chemicals?. Therapeutic Advances in Gastroenterology. 2012; 5(4): 261-268. [ Links ]
27. Ledochowski M, Widner B, Bair H et al. Fructose-and sorbitol-reduced diet improves mood and gastrointestinal disturbances in fructose malabsorbers. Scandinavian Journal of Gastroenterology. 2000; 35(10): 1048-1052. [ Links ]
28. De Roest RH, Dobbs BR, Chapman BA et al. The low FODMAP diet improves gastrointestinal symptoms in patients with irritable bowel syndrome: a prospective study. International Journal of Clinical Practice. 2013. DOI: 10.1111/ ijcp.12128 [ Links ]
29. Staudacher HM, WhelanK, Irving P et al. Comparison of symptom response following advice for a diet low in fermentable carbohydrates (FODMAPs) versus standard dietary advice in patients with irritable bowel syndrome. Journal of Human Nutrition and Dietetics. 2011; 24(5): 487-495. [ Links ]
30. Shepherd SJ, Parker FC, Muir JG et al. Dietary triggers of abdominal symptoms in patients with irritable bowel syndrome: randomized placebocontrolled evidence. Clinical Gastroenterology and Hepatology. 2008; 6(7): 765-771. [ Links ]
31. Ong DK, Mitchell SB, Barrett JS et al. Manipulation of dietary short chain carbohydrates alters the pattern of gas production and genesis of symptoms in irritable bowel syndrome. Journal of Gastroenterology and Hepatology. 2010; 25(8): 1366-1373. [ Links ]
32. Halmos EP, Power VA, Shepherd SJ et al. A diet low in FODMAPs reduces symptoms of irritable bowel syndrome. Gastroenterology. 2014; 146(1): 67-75. [ Links ]
33. Schwender B, Floch MH. Should FODMAP Withdrawal be Tried in Inflammatory Bowel Disease Patients With Irritable Bowel Syndrome?. Journal of Clinical Gastroenterology. 2014; 48(5): 393-394. [ Links ]
34. Pedersen N, Andersen NN, Vegh Z et al. Ehealth: Low FODMAP diet vs Lactobacillus rhamnosus GG in irritable bowel syndrome. World Journal of Gastroenterology. 2014; 20(43): 16215-16226. [ Links ]
35. Barrett JS, Gearry RB, Muir JG et al. Dietary poorly absorbed, shortchain carbohydrates increase delivery of water and fermentable substrates to the proximal colon. Alimentary Pharmacology & Therapeutics. 2010; 31(8): 874-882. [ Links ]
36. Man F, Fernandez LMB. Sindrome de intestino irritable:. Un trastorno funcional?. Acta Gastroenterologica Latinoamericana. 2013; 43(4): 321-334. [ Links ]
37. O'Connor EM. The role of gut microbiota in nutritional status. Current Opinion in Clinical Nutrition & Metabolic Care. 2013; 16(5): 509-516. [ Links ]
38. Staudacher HM, Lomer MC, Anderson JL et al. Fermentable carbohydrate restriction reduces luminal bifidobacteria and gastrointestinal symptoms in patients with irritable bowel syndrome. The Journal of Nutrition. 2012; 142(8): 1510-1518. [ Links ]
39. Pedersen N, Vinding KK, Vegh Z et al. Gut Microbiota in IBD Patients With IBS Before and After 6 Weeks of Low FODMAP Diet. American Gastroenterology Association. 2014; 146(5): S-241. [ Links ]
40. Rajilić-Stojanović M, Jonkers DM, Salonen A et al. Intestinal Microbiota And Diet in IBS: Causes, Consequences, or Epiphenomena&quest. The American Journal of Gastroenterology. 2015. DOI: 10.1038/ajg.2014.427 [ Links ]
41. Chumpitazi BP, Tsai CM, McMeans AR et al. A Low FODMAPS Diet Ameliorates Symptoms in Children With Irritable Bowel Syndrome: A Double Blind, Randomized Crossover Trial. Gastroenterology. 2014; 146(5), S-144. [ Links ]
42. Escobar Jr MA, Lustig D, Pflugeisen BM et al. Fructose intolerance/malabsorption and recurrent abdominal pain in children. Journal of Pediatric Gastroenterology and Nutrition. 2014; 58(4): 498-501. [ Links ]
43. McKenzie YA, Alder A, Anderson W et al. British Dietetic Association evidencebased guidelines for the dietary management of irritable bowel syndrome in adults. Journal of Human Nutrition and Dietetics. 2012; 25(3): 260-274. [ Links ]
44. Sapone A, Bai JC, Ciacci C et al. Spectrum of gluten-related disorders: consensus on new nomenclature and classification. BMC Medicine. 2012; 10(1), 13. [ Links ]
45. Czaja-Bulsa G. Non coeliac gluten sensitivity–A new disease with gluten intolerance. Clinical Nutrition. 2014: http://dx.doi.org/10.1016/j. clnu.2014.08.012
46. Mullin GE, Shepherd SJ, Roland BC et al. Irritable Bowel Syndrome Contemporary Nutrition Management Strategies. Journal of Parenteral and Enteral Nutrition. 2014; 38(7): 781-799. [ Links ]
47. Sanders DS, Aziz I. Editorial: Non-Celiac Wheat Sensitivity: Separating the Wheat from the Chat!. The American Journal of Gastroenterology. 2012; 107(12): 1908-1912. [ Links ]
48. Biesiekierski JR, Peters SL, Newnham ED et al. No effects of gluten in patients with self-reported non-celiac gluten sensitivity after dietary reduction of fermentable, poorly absorbed, short-chain carbohydrates. Gastroenterology. 2013; 145(2): 320-328. [ Links ]
49. Catassi C, Bai JC, Bonaz B et al. Non-celiac gluten sensitivity: the new frontier of gluten related disorders. Nutrients. 2013; 5(10): 3839-3853. [ Links ]
50. Croagh C, Shepherd SJ, Berryman M et al. Pilot study on the effect of reducing dietary FODMAP intake on bowel function in patients without a colon. Inflammatory bowel diseases. 2007; 13(12): 1522-1528. [ Links ]
51. Gearry RB, Irving PM, Barrett JS et al. Reduction of dietary poorly absorbed short-chain carbohydrates (FODMAPs) improves abdominal symptoms in patients with inflammatory bowel disease—a pilot study. Journal of Crohn's and Colitis. 2009; 3(1): 8-14.
52. Joyce T, Staudacher H, Whelan K et al. Symptom Response Following Advice On A Diet Low In Short-chain Fermentable Carbohydrates (fodmaps) For Functional Bowel Symptoms In Patients With Ibd. Gut. 2014; 63(1): A164-A164. [ Links ]
53. Hou JK, Lee D, Lewis J. Diet and inflammatory bowel disease: review of patienttargeted recommendations. Clinical Gastroenterology and Hepatology. 2014; 12(10): 1592-1600. [ Links ]
54. Chang SJ, Huang HH. Diarrhea in enterally fed patients: blame the diet?. Current Opinion in Clinical Nutrition & Metabolic Care. 2013; 16(5): 588-594. [ Links ]
55. Halmos EP, Muir JG, Barret JS et al. Diarrhoea during enteral nutrition is predicted by the poorly absorbed shortchain carbohydrate (FODMAP) content of the formula. Alimentary Pharmacology & Therapeutics. 2010; 32(7): 925-933. [ Links ]
56. Halmos EP. Role of FODMAP content in enteral nutritionassociated diarrhea. Journal of Gastroenterology and Hepatology. 2013; 28(4): 25-28. [ Links ]
57. Eswaran S, Muir J, Chey WD. Fiber and functional gastrointestinal disorders. The American Journal of Gastroenterology. 2013; 108(5): 718-727. [ Links ]
58. Bovee-Oudenhoven IMJ, Ten Bruggencate SJM, Lettink-Wissink MLG et al. Dietary fructo-oligosaccharides and lactulose inhibit intestinal colonisation but stimulate translocation of salmonella in rats. Gut. 2003; 52(11): 1572-1578. [ Links ]
59. Mansueto P, Seidita A, D'Alcamo A et al. Role of FODMAPs in Patients With Irritable Bowel Syndrome A Review. Nutrition in Clinical Practice. 2015. DOI: 10.1177/0884533615569886 [ Links ]














