Introducción
Las enfermedades crónicas, la hospitalización prolongada y la edad se asocian con un deterioro del estado nutricional, pérdida de fuerza y masa muscular, alteración en la calidad de vida y aumento de la morbimortalidad (1). En los últimos años las enfermedades crónicas degenerativas han ganado gran interés e importancia en el ámbito de la salud. Esto sucede debido a que constituyen más de la mitad de la carga mundial de morbilidad, muchas veces con su trágico curso hacia la invalidez y el deterioro de vida de las personas (2,3), situación que puede acentuarse debido a su estrecha relación con el estado nutricional.
La prevalencia de desnutrición varía ampliamente según los criterios utilizados para su diagnóstico, el tipo de enfermedad del que se trate y el entorno analizado (ambulatorio o institucionalizado). De manera global, la desnutrición afecta un 25-50% de los pacientes hospitalizados, lo que supone un aumento de los costos sanitarios, mayor morbimortalidad y aumento de las tasas de discapacidad (4). Por otra parte, la Federación Latinoamericana de Terapia Nutricional, Nutrición Clínica y Metabolismo (FELANPE) organizó el Estudio Latinoamericano de Nutrición que incluyó a 13 países de América Latina y 9348 pacientes, en donde se encontró un 50.2% de desnutrición medido a través de la Valoración Global Subjetiva (VGS) (5). Una revisión sistemática del 2016 arrojó una prevalencia de desnutrición al ingreso hospitalario del 40-60%, con una tasa más alta en adultos mayores y pacientes quirúrgicos. Este mismo estudio concluyó que la prevalencia de la desnutrición aumenta significativamente durante el curso de la hospitalización, por lo que remarcan la importancia de la intervención nutricional temprana, sobre todo en aquellas estadías hospitalarias de mayor duración. (6)
Diversos conceptos surgen en la literatura que relacionan la pérdida de masa muscular, la enfermedad y la desnutrición. Es necesario diferenciar cada uno de ellos para lograr su diagnóstico oportuno y comprender los mecanismos fisiopatológicos que subyacen para poder implementar una terapia nutricional oportuna que mejore, o en algunos casos atenúe, el deterioro en el estado de salud.
El objetivo del presente artículo es definir los conceptos de desnutrición, fragilidad, caquexia y sarcopenia. Se buscó describir su prevalencia, diferenciar los mecanismos que generan cada situación y su impacto en la composición corporal.
Metodología
Se llevó a cabo una búsqueda bibliográfica no sistemática. Se consultaron 4 bases de datos electrónicas: MEDLINE, PUBMED, Lilacs y Scientific Electronic Library Online (SciELO) en el período comprendido desde el 2001 hasta noviembre del 2020.
Los términos de búsqueda fueron desnutrición, caquexia, sarcopenia, fragilidad, masa muscular. Se incluyeron artículos originales de investigación, revisiones sistemáticas y consensos en idioma inglés y español. Fueron excluidas las cartas al editor, comentarios y los resúmenes debido a la falta de información detallada al igual que estudios en modelos experimentales animales y estudios en población pediátrica.
Resultados
Desnutrición:
En el año 2017, la Sociedad Europea para la Nutrición Clínica y el Metabolismo (ESPEN) definió a la desnutrición como “un estado resultante de la falta de ingesta o malabsorción de nutrientes que conduce a una composición corporal alterada y disminución de la masa celular del cuerpo que conlleva a una alteración de la función física y mental”. Sugiriendo que para su detección, como primer paso, se debe implementar un tamizaje nutricional a través de una herramienta de screening validada. Los casos detectados como de riesgo deben ser luego sometidos a una evaluación nutricional completa que incluya parámetros clínicos, bioquímicos, alimentarios y antropométricos para, de esta forma, arribar a un diagnóstico nutricional (7).
Recientemente fue publicado un consenso que reúne representantes de diversas sociedades de nutrición, en donde se propone una definición de desnutrición basada en los criterios de Liderazgo Global sobre Desnutrición (GLIM). El primer paso corresponde a la identificación del riesgo de malnutrición del paciente mediante cualquier herramienta de tamizaje válida. Un segundo paso, incluye la evaluación para el diagnóstico y la clasificación de gravedad mediante criterios fenotípicos y etiológicos, realizándose el diagnóstico de malnutrición con la presencia de uno de cada categoría; siendo los fenotípicos los marcadores de la gravedad de la malnutrición. En las siguientes tablas (Tabla 1 y 2), se detallan los criterios GLIM para el diagnóstico de malnutrición y la gravedad de la misma (8, 9).
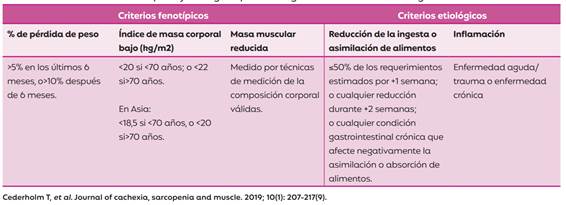
Tabla 1: Criterios fenotípicos y etiológicos para el diagnóstico de desnutrición según los criterios GLIM
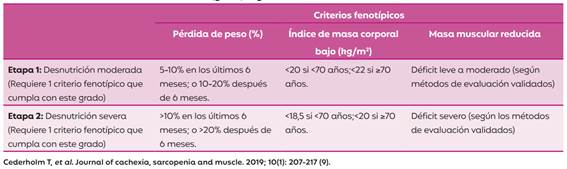
Tabla 2: Umbrales para la clasificación de la gravedad de la malnutrición en la etapa 1 (moderada) y en la etapa 2 (grave) según los criterios GLIM
La desnutrición afecta a todos los grupos de edad, siendo especialmente vulnerable el paciente hospitalizado y/o institucionalizado. En el ámbito hospitalario la desnutrición se estima en un 25-30% mientras que asciende a un 80% en el paciente institucionalizado (10).
Los cambios metabólicos que se van a producir en la desnutrición dependen de la etiología, pudiendo manifestarse con un aumento del metabolismo basal o con una disminución del mismo.
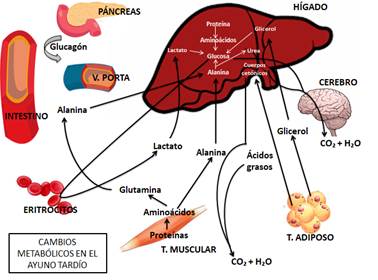
Cuando la desnutrición responde a una situación de restricción de energía, se desencadenan mecanismos adaptativos en ausencia de un estado inflamatorio como sucede en los estadios tempranos de la anorexia, en pacientes con alteraciones en la deglución sin enfermedades concomitantes o situaciones carenciales de índole socio-económica. El tejido graso es movilizado para la formación de ácidos grasos libres y cuerpos cetónicos, disminuyendo sus depósitos (10). En las primeras horas de ayuno, y una vez que se consumieron las reservas de glucosa circulante y de glucógeno hepático y muscular, se producen alteraciones orgánicas activadas por la hipoglucemia. Se observa una reducción de la tasa plasmática de insulina y elevación de glucagón, cortisol y catecolaminas que inducen a la producción de glucosa a partir de precursores gluconeogénicos (lactato, glicerol y aminoácidos) en el hígado y riñón. Al mismo tiempo, se produce la oxidación de ácidos grasos utilizando las grasas como fuente energética. Además, se acompaña una disminución del gasto calórico y del consumo de oxígeno. Hasta este momento, la proteólisis muscular va a aportar los aminoácidos para la formación de glucosa (Ilustración 1). En la Ilustración 2 se observa que luego de las 72 hs de ayuno, se producen mecanismos adaptativos, evidenciados por una mayor movilización de grasa y reducción de la degradación proteica con utilización de lípidos como fuente energética (11).
I
Ilustración de elaboración propia
Ilustración de elaboración propia
En estos pacientes, las condiciones de inmunocompetencia, de cicatrización y de resistencia al estrés están relativamente conservadas. La pérdida de peso se produce de forma gradual y está dada por el adelgazamiento llevando a funciones corporales disminuidas, temperatura por debajo de lo normal, disminución de la frecuencia cardíaca y de la tasa metabólica. Se produce una disminución de la necesidad energética y de la secreción de insulina, con hormonas contrarreguladoras a nivel basal. Este tipo de desnutrición responde positivamente al tratamiento nutricional, el cual debe realizarse de forma cautelosa para evitar los desbalances metabólicos y electrolíticos característicos del síndrome de realimentación (11) (Tabla 3).
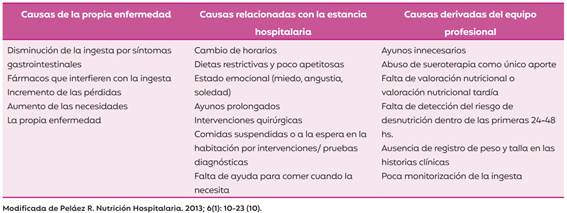
Si bien la propia enfermedad es un factor importante que condiciona la desnutrición, es un error considerar que la desnutrición será inherente al proceso evolutivo de la enfermedad y por ende, intratable: las causas de la disminución de la ingesta son múltiples y, muchas veces, evitables (10). En la Tabla 4 se resumen algunos de los factores causantes de la desnutrición en el paciente hospitalizado.
La pérdida de peso relacionada con la desnutrición conlleva una pérdida de masa muscular y cambios funcionales: aumento de la fatiga, reducción de la relajación máxima, atrofia de las fibras musculares, alteraciones en las concentraciones intracelulares de electrolitos, micronutrientes y compuestos ricos en energía -como el ATP- y alteraciones en el potencial de membrana, entre otros. Esto supone un descenso del nivel de actividad física, una reducción de la movilidad y un aumento en la debilidad (10). Acá entra en juego nuestro segundo término a analizar: la fragilidad, que hace referencia a un estado de vulnerabilidad, debilidad y disminución de la reserva fisiológica presente en algunos pacientes (12).
- Fragilidad:
Según ESPEN, es un estado de vulnerabilidad y no resiliencia con capacidad de reserva limitada en los órganos de los principales sistemas. Esto conduce a una capacidad reducida para soportar tensiones como trauma o enfermedad y, por lo tanto, la fragilidad es un factor de riesgo para la dependencia y discapacidad (7).
La fragilidad se caracteriza por pérdida de peso, cansancio, debilidad, marcha lenta y disminución de la actividad física. Un individuo frágil tiene mayor vulnerabilidad a la morbimortalidad y/o dependencia si se lo expone a un factor estresante (13). Como se muestra en la tabla 2, es secundaria a una desregulación endócrina, del sistema muscular y a un estado proinflamatorio y protrombótico (12).
El fenotipo de fragilidad definido por Fried LP,et al. (14) considera la presencia de 3 de los siguientes 5 criterios:
1. Pérdida no intencional mayor o igual a 4 kg de peso en el último año,
2. Sensación de cansancio reportada por el paciente
3. Debilidad (medida por la fuerza de agarre)
4. Marcha lenta
5. Poca actividad física
Si bien en un principio el valor predictivo de estos criterios fue establecido en base a un estudio en pacientes mayores de 65 años, se trata de un modelo de valoración de la fragilidad que es útil, certero y rápido de realizar y por tanto reviste importancia su detección en poblaciones seleccionadas (14) como en pacientes ambulatorios (15), con enfermedad renal (16), mujeres obesas (17) y pacientes con infección por VIH (18). Por lo expuesto, no debemos entender a la fragilidad como un estado exclusivo de las personas adultas mayores, sino también puede presentarse en otras patologías, incluyendo a la obesidad (13).
La prevalencia de fragilidad varía según la población estudiada y el tipo de definición que se haya utilizado. Sin embargo, los resultados son concluyentes en que la fragilidad aumenta el riesgo de comorbilidades, complicaciones, discapacidad, institucionalización y mortalidad (12).
En cuanto a los mecanismos fisiopatológicos, múltiples alteraciones relacionadas con la genética, el envejecimiento y las comorbilidades están implicados en la fragilidad. Los sistemas con mayor intervención, así como más estudiados son el sistema inmune (debido al aumento del estado proinflamatorio y protrombótico), el endócrino (disminución de la concentración plasmática de hormonas sexuales, hormona del crecimiento, cortisol y vitamina D) y, por último, el musculo-esquelético. Aquí aparece nuestro tercer concepto: la sarcopenia (12).
La sarcopenia, se caracteriza por la pérdida progresiva y generalizada de la fuerza, la masa muscular y el rendimiento físico. La fragilidad, se trata de un concepto mucho más amplio, resultado del deterioro progresivo de múltiples sistemas fisiológicos, con alteración de la reserva homeostática y reducción de la capacidad del organismo para soportar estrés; produciendo aumento de la vulnerabilidad a eventos adversos en salud. Las dos condiciones, son considerados factores de riesgo mutuos y pueden coexistir en un mismo individuo, situación que condiciona mayor probabilidad de desenlaces adversos como limitación para realizar las actividades básicas de la vida diaria, osteoporosis, caídas, estancia hospitalaria prolongada, reingreso y muerte (19).
- Sarcopenia:
La sarcopenia, es un trastorno muscular progresivo y generalizado asociado con una mayor probabilidad de resultados adversos que incluyen caídas, fracturas, discapacidad física y mortalidad. La sarcopenia es parte y un componente clave de la fragilidad. Actualmente la baja fuerza muscular es el principal parámetro utilizado para la sospecha de sarcopenia, la cual se confirma cuando se asocia con baja cantidad/calidad muscular. Cuando, además, va acompañada con bajo rendimiento físico, se considera sarcopenia grave (20). Es interesante destacar que a partir del 2016 la Organización Mundial de la Salud (OMS) incluye a la sarcopenia como enfermedad en su Clasificación Internacional de Enfermedades y Problemas Relacionados con la Salud (CIE) con el código ICD-10-CM (M62.84) (21).
A partir de los 50 años de edad la masa muscular disminuye 1 a 2% por año y la fuerza muscular tiene una disminución anual del 1,5% entre los 50 y 60 años, y posteriormente 3% cada año. Entre el 5- 13% de las personas entre 60 y 70 años y el 11-50% de las de 80 años o más, tienen sarcopenia. A su vez, la sarcopenia es más prevalente que la fragilidad, lo que implica que la sarcopenia por sí sola, no conduce a la fragilidad (22).
En la sarcopenia se observa una denervación de las unidades motoras, una disminución del número y del tamaño de las fibras musculares con una conversión de fibras musculares rápidas (tipo II) a fibras lentas (tipo I) y un aumento del depósito de lípidos y tejido conectivo en el tejido muscular. Existen múltiples procesos internos y externos que contribuyen al desarrollo de la sarcopenia: disminución de hormonas anabólicas (testosterona, estrógenos, hormona del crecimiento, factor de crecimiento símil insulina, IGF-1), aumento de la actividad apoptótica en las miofibrillas, aumento de las citoquinas proinflamatorias (factor de necrosis tumoral alfa e IL-6), el estrés oxidativo, los cambios de la función mitocondrial de las células musculares y una disminución en el número de motoneuronas. A su vez, se suman influencias externas tales como la ingesta deficiente de energía y proteínas y disminución del aporte de vitamina D que juntos contribuyen a una reducción de la actividad física y un aumento de los periodos de reposo y mayor expresión de citoquinas proinflamatorias, alimentando un círculo vicioso (23, 24) (Tabla 3).
Aunque la sarcopenia se considera una afección del envejecimiento, su desarrollo puede asociarse con otras condiciones presentes aún en pacientes jóvenes como la presencia de enfermedades inflamatorias, endócrinas o neurológicas, la inactividad física (ya sea por un estilo de vida sedentario o por inmovilidad y/o discapacidad) o la ingesta inadecuada en energía o proteínas (ya sea por anorexia, malabsorción o acceso ilimitado a alimentos de calidad). Por lo tanto, el Grupo de Trabajo Europeo sobre Sarcopenia en Personas Mayores (EWGSOP, sus siglas en inglés) propone considerar la sarcopenia primaria, cuando la edad es la que explica la pérdida de masa y función muscular, diferenciándola de sarcopenia secundaria, cuando está relacionada con una o más causas (20). Así, la sarcopenia no es pura y exclusivamente una entidad del adulto mayor.
Mención aparte merece la obesidad sarcopénica, definida como la presencia de obesidad en combinación con la sarcopenia. Actualmente, no existen criterios comúnmente aceptados para la obesidad sarcopénica más allá de los criterios para la sarcopenia y la obesidad por separado (7). Se trata de una entidad clínica y fisiopatológica que se ha asociado con mayor discapacidad y morbimortalidad que las dos enfermedades por separado (25). La etiopatogenia de la obesidad sarcopénica es multifactorial, existiendo una relación entre la edad, estilo de vida sedentario, hábitos dietéticos poco saludables y factores como la resistencia a la insulina, inflamación sistémica y estrés oxidativo, resultando en una reducción cuantitativa y cualitativa de la masa y fuerza muscular y en un aumento concomitante de la masa grasa. Una progresiva reducción de la actividad física y de la ingesta proteica, dan como resultado una reducción del gasto energético y un aumento de la resistencia a la insulina provocando cambios en el tejido adiposo (aumento del número y del tamaño de los adipocitos), con infiltración de células inmunes al tejido adiposo; provocando un aumento del número de adipocinas y citoquinas que crean un ambiente inflamatorio de bajo grado. Esta inflamación genera aún más resistencia a la insulina, produciendo un círculo vicioso entre resistencia a la insulina, estrés oxidativo e inflamación en el que se mantendrá una interacción negativa entre músculo y el tejido adiposo (26).
- Caquexia:
El último concepto que se definirá en la presente revisión es el de caquexia. También definida como “malnutrición relacionada con la enfermedad crónica” (7), la característica principal de la caquexia se basa en la reducción del peso y se asocia con anorexia, inflamación, resistencia a la insulina y aumento de la degradación de proteínas musculares (1).Un consenso publicado en 2011 propone como definición la pérdida de peso en ausencia de edemas (al menos 5% durante los últimos doce meses) o bien Índice de Masa Corporal (IMC) menor a 20 kg/m2 junto con la presencia de al menos tres de los siguientes cinco criterios: disminución de la fuerza muscular, fatiga, anorexia, bajo índice de masa libre de grasa y alteraciones bioquímicas, entre ellas aumento de proteína C reactiva (PCR) o IL-6, hemoglobina (Hb) <12g/dL o albúmina <3,2g/dL (27).
El mismo año, otro consenso de expertos clasificó la caquexia en tres estadíos clínicos de relevancia: precaquexia, caquexia y caquexia refractaria, considerando que no todos los pacientes atraviesan todo el espectro. Durante la precaquexia, los primeros signos clínicos y metabólicos como la anorexia y alteración de la tolerancia a la glucosa pueden preceder a una pérdida de peso involuntaria sustancial, que es menor al 5%. La caquexia propiamente dicha incluye a aquellos pacientes que hayan perdido más del 5% de peso corporal durante los últimos 6 meses o tengan un índice de masa corporal menor de 20 kg/m² y pérdida de peso continua de más del 2%, o sarcopenia y pérdida de peso continua de más de 2%. La caquexia se vuelve refractaria como resultado de un cáncer muy avanzado (preterminal) que no responde a la terapia médica. Esta etapa está asociada con el catabolismo activo que hace que la pérdida de peso ya no sea posible de controlar. En esta etapa es probable que la carga y los riesgos del apoyo nutricional artificial superen cualquier beneficio potencial. Las intervenciones terapéuticas se enfocan típicamente en aliviar las consecuencias y síntomas de la caquexia (28).
Dentro de los cambios producidos en la composición corporal en la caquexia, se encuentran una reducción importante del peso a expensas de la masa magra y grasa. En formas avanzadas, la retención de agua se puede producir como consecuencia de hipoalbuminemia severa, pudiendo enmascarar esta pérdida ponderal (1).
En su fisiopatología resultan relevantes los cambios metabólicos (Ilustración 3) y la aparición de anorexia, con una alteración en el metabolismo de los carbohidratos, proteínas y lípidos. La caquexia implica un proceso importante de deterioro físico en comparación con el cuadro de desnutrición anteriormente nombrado, debido a que se presenta una acelerada pérdida de masa muscular esquelética en relación con el tejido adiposo, un aumento de citoquinas proinflamatorias y el aumento de proteínas de fase aguda que contribuyen al incremento del gasto energético y pérdida de peso. La inflamación provoca gran pérdida de proteínas musculares y resistencia a la insulina (Tabla 3) (29). El éxito terapéutico frecuentemente está limitado por las alteraciones metabólicas presentes (30) sumado al estadio tardío de la enfermedad de base en donde suele aparecer la caquexia.
Ilustración de elaboración propia. En su origen, la caquexia está vinculada a la activación del sistema inmune debido a la presencia de enfermedad. Una vez el sistema inmunológico es activado se desencadena una serie de eventos conocidos todos ellos, en conjunto, como respuesta inflamatoria. Esta respuesta es regulada a través de las citoquinas, proteínas que regulan la función celular y la comunicación intercelular. Entre las citoquinas más conocidas se encuentran el Factor de Necrosis Tumoral (FNT) alfa, conocida inicialmente con el nombre de “caquectina” por su poder de suprimir el apetito y alterar el metabolismo como se observa en la caquexia
La inflamación juega el papel clave en la patogenia de la caquexia y es la que permite su identificación. Ya sea definido como síndrome anorexia/caquexia en pacientes con cáncer o wasting syndrome/síndrome de desgaste en pacientes con SIDA o caquexia cardíaca en pacientes con insuficiencia cardíaca crónica, a pesar de su origen distinto comparten mecanismos comunes: un escenario inflamatorio.
¿Qué se puede hacer desde lo nutricional?
Todas las entidades antes descriptas comparten un escenario en común: la pérdida de masa muscular. El mejor tratamiento se logra con la identificación temprana de esta condición, el correcto diagnóstico diferencial y la implementación oportuna de las intervenciones nutricionales, farmacológicas y rehabilitación. La estimación de las necesidades metabólicas y nutricionales del paciente es el punto de partida de una correcta y efectiva intervención nutricional (31).
En cuanto a la fragilidad, en varios estudios se observó el papel protector de una ingesta adecuada en proteínas y calorías, evitando el exceso en estas últimas debido a que contribuye al aumento de la masa grasa corporal y la infiltración de ésta en el tejido muscular. Las recomendaciones recientes se centran en la ingesta diaria de proteínas, que debe ser de al menos de 1,0 a 1,2 g/kg al día para personas mayores sanas y de 1,2 a 1,5 g/kg al día para pacientes geriátricos con enfermedades agudas y crónicas (32).
La fuente de proteína también es importante debido a su contenido de aminoácidos esenciales, particularmente de leucina debido a su acción directa en el inicio de la síntesis proteica. Por lo tanto, dada la resistencia anabólica de los músculos de personas mayores a las dosis bajas de aminoácidos, el contenido proteico de la dieta debe incluir, por lo menos 25 a 30g. de proteína de alto valor biológico por comida que contengan aproximadamente 3g. de leucina para estimular la síntesis proteica (33). Las guías ESPEN (33) introducen al β-hidroxi-β-metilbutirato (HMB) dentro de sus recomendaciones, avalando el uso de una fórmula hipercalórica, hiperproteica con HMB y vitamina D para el mantenimiento de masa muscular y reducción de mortalidad.
Otros nutrientes que se han investigado en el síndrome de fragilidad son la carnitina, los ácidos grasos omega 3, la vitamina D, el calcio y los antioxidantes. Sin embargo, al tratarse de un síndrome de etiología compleja y multifactorial, las intervenciones deben ser multidimensionales y orientadas siempre a preservar la función y la autonomía del paciente. Ninguna intervención de forma aislada ha demostrado tener beneficio sobre el desarrollo de la fragilidad, y tampoco se han evaluado ensayos clínicos para valorar la relevancia de cada uno y poder hacer recomendaciones consistentes (32).
Sin embargo, al ser un síndrome multifactorial, las intervenciones no deben considerarse de forma aislada, y un correcto plan de alimentación debe ir acompañado con un plan de ejercicio físico. Incluso, la sinergia entre el ejercicio y la nutrición se potencian para mejorar los resultados. El tipo de ejercicio físico más beneficioso en el anciano frágil es el denominado “entrenamiento multicomponente”, que combina entrenamiento de fuerza, resistencia, equilibrio y marcha (34).
En cuanto al tratamiento de la sarcopenia, las intervenciones propuestas han estado basadas en las hipótesis que explican su desarrollo. Así, se encuentran en la literatura reportes en cuanto al uso de la testosterona, insulina, hormona del crecimiento y vitamina D (Tabla 4). El ejercicio físico se ha propuesto como estímulo fundamental para el mantenimiento y el crecimiento del tejido muscular, reportando buenos resultados en la mejoría de la sarcopenia. En lo que respecta a la intervención nutricional se propone el uso de suplementos nutricionales en aquellos pacientes que no logren cubrir sus requerimientos basales. Los nutrientes que se han vinculado son la vitamina D, las proteínas, antioxidantes como carotenos, selenio, vitamina C y los ácidos grasos poliinsaturados de cadena larga omega 3. Ninguno de estos ha probado ser la solución definitiva, lo cual refuerza la hipótesis de su carácter multifactorial (34).
Las guías ESPEN (35) recomiendan una ingesta proteica de al menos entre 1,0 y 1,2 g de proteína/kg de peso corporal/día en adultos mayores sanos y aumentarla a 1,2 a 1,5 g de proteína/kg de peso corporal/día en aquellos adultos mayores que tienen enfermedades agudas o crónicas, con una ingesta aún mayor para las personas con enfermedades o lesiones graves, sin embargo aún continua el debate sobre si se necesita una cantidad umbral de ingesta de proteínas por comida para estimular la síntesis de proteínas en los adultos mayores o si la síntesis de proteínas está relacionada linealmente con la ingesta de proteínas. Al igual que con la fragilidad, estas guias mencionan el papel de la leucina y el HMG en la síntesis de la masa muscular.
En cuanto al ejercicio físico, aumenta el anabolismo, aumenta la sensibilidad a la insulina y mejora la disminución de la masa muscular en las piernas. El ejercicio de resistencia puede respaldar estos beneficios mediante una mayor sensibilidad a la insulina para una mejor utilización de la glucosa y una mejor síntesis de proteínas miofibrilares (36,37).
Por último, como ya se nombró anteriormente, la caquexia no responde a la terapia nutricional, al menos que sea identificada y tratada en una primera instancia (precaquexia). Por lo tanto, se debe identificar primero el evento desencadenante para corregirlo y así lograr la mejoría clínica y la supervivencia del paciente (31). Las estrategias de manejo multimodales para la caquexia que incluyan nutrición, ejercicio y fármacos pueden ser efectivas durante las primeras etapas de la caquexia, siendo la intervención temprana vital para mejorar los resultados y la calidad de vida de un paciente. Antes de llegar a la fase de caquexia, la precaquexia se puede tratar aumentando la ingesta de calorías y proteínas mediante planes de alimentación individualizados y suplementos orales. La terapia nutricional, a través de una dieta que proporcione 1,5 g de proteína kg/día, se puede utilizar durante la caquexia. Además, es de vital importancia el tratamiento de los síntomas gastrointestinales que repercuten en la mala calidad de vida del paciente y llevan a la anorexia, como los cambios en el gusto y el olfato, la saciedad temprana, náuseas, diarrea, estreñimiento, dolor o fatiga (38). Otro escenario en donde la terapia nutricional no contribuye en la mejora de los resultados es en pacientes severamente inflamados. Un análisis secundario del estudio EFFORT demostró que, en pacientes con PCR >100 mg/L, el soporte nutricional no tiene impacto en la modulación de la respuesta inflamatoria (39).
Como resumen, en la Tabla 3 se presentan los aspectos más importantes de cada una de las entidades descriptas.
Conclusión
A lo largo de este artículo se buscó definir correctamente a las diferentes entidades abordadas de forma tal de establecer un correcto diagnóstico diferencial. A pesar de esta búsqueda por esclarecer las diferencias, las cuatro condiciones tienen numerosos factores que se superponen, pudiéndose confundir e incluso, ser indistinguibles en determinados pacientes. En la práctica clínica cotidiana, a veces resulta difícil identificar cuál es la causa de la pérdida de masa muscular, reflejando la complejidad y superposición de las múltiples vías que intervienen en ella. Entendemos que tratar de diferenciar cada entidad es el punto de partida para plantear los objetivos nutricionales acordes los cuales serán fundamentales para un tratamiento efectivo.
En lo que respecta al tratamiento nutricional se han incrementado notablemente las publicaciones en los últimos años, por lo cual, si bien se han mencionado algunos aspectos relacionados, creemos necesario continuar la revisión detallada sobre los diferentes nutrientes y su impacto sobre la masa muscular.
Cada vez cobra más importancia el estudio de la masa muscular ya que la disminución significativa de la masa magra no solo afecta la composición corporal, sino que repercute sobre la funcionalidad y, sobre todo, la calidad de vida del paciente.