Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Asociación Argentina de Ortopedia y Traumatología
versión On-line ISSN 1852-7434
Rev. Asoc. Argent. Ortop. Traumatol. vol.75 no.4 Ciudad Autónoma de Buenos Aires oct./dic. 2010
ACTUALIZACIÓN
Medicina regenerativa. Su aplicación en traumatología
María Eulalia Landro, Verónica Francalaccia y Ana Laura Douglas Price
Laboratorio de Cultivos Celulares, Hospital General de Agudos Dr. Juan A. Fernández, División Ortopedia y Traumatología. GCBA
Recibido el 15-6-2010.
Correspondencia:
Lic. MARÍA EULALIA LANDRO
mlandro@gmail.com
Introducción
Células
Durante los últimos cincuenta años, los avances científico-técnicos en el campo de la biología celular y molecular han permitido restaurar o mejorar la función de órganos y tejidos lesionados por ciertas enfermedades o traumatismos. Tales adelantos, estrechamente vinculados a los nuevos conocimientos sobre las células madre, han puesto a la medicina regenerativa en un primer plano. Esta rama de la medicina, de carácter interdisciplinario, involucra la investigación y la aplicación clínica centrándose en la reparación, el reemplazo o la regeneración de células, tejidos u órganos para restaurar una función dañada por cualquier causa, como los defectos congénitos, los traumatismos y el envejecimiento. Estos procedimientos pueden incluir el uso de moléculas, terapia génica, trasplante de células madre, ingeniería de tejidos y terapia celular avanzada, como la reprogramación celular.
Aunque en un principio algunos autores consideraron equivalentes los términos ingeniería de tejidos y medicina regenerativa, esta situación se ha ido esclareciendo y ahora se acepta que la ingeniería de tejidos, tanto la efectuada in vivo como in vitro, no es más que uno de los procederes sobre los que se basa la medicina regenerativa.13
El término ingeniería de tejidos agrupa las estrategias por emplear, las células, las citocinas, los genes, las matrices y el microambiente necesarios para la regeneración del tejido dañado, teniendo en cuenta la interacción entre todos estos factores. El primer desafío al encarar las investigaciones en este campo es lograr la combinación óptima de estos factores para el tratamiento de un problema clínico particular (Fig. 1).
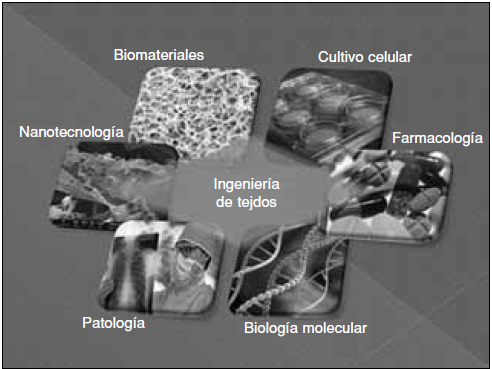
Figura 1. La ingeniería de tejidos agrupa: estrategias por emplear, células, citocinas, genes, matrices y microambiente necesarios para la regeneración del tejido dañado.
Uno de los aspectos críticos en la estrategia de ingeniería de tejidos es la expansión celular en cultivo a fin de obtener un mayor número de células para la producción de tejido in vitro o la implantación de células en matrices para la regeneración de tejido in vivo. Las investigaciones básicas y clínicas realizadas en los últimos años sobre las células madre y sus posibilidades terapéuticas han constituido lo que se ha calificado como "una revolución en la medicina regenerativa".13
Las células madre mesenquimáticas (MSC) han cobrado gran importancia por su potencial en las terapias celulares. Son células estromales no hematopoyéticas que fueron aisladas primero de la médula ósea (MO) y luego de otros tejidos conectivos.6 Se caracterizan por tener tres propiedades: autorrenovación, proliferación y capacidad de diferenciación a múltiples tipos celulares. Descritas en 1968 por Friedenstein, las MSC del adulto son las más utilizadas. Pueden diferenciarse en distintos tipos celulares mesenquimáticos, como hueso y cartílago, pero ahora se ha comprobado que mantienen su plasticidad, lo que les permite diferenciarse en otros tipos celulares no mesenquimáticos, como las neuronas5 (Fig. 2).

Figura 2. Diferenciación de células madre mesenquimáticas obtenidas de médula ósea.
Las MSC son bastante fáciles de obtener y pueden expandirse in vitro mediante técnicas de cultivo celular. Resumidamente, el cultivo de células adherentes consiste en colocar una suspensión celular en un soporte de cultivo, con el medio de crecimiento apropiado para dicho tipo celular e incubar este sistema en condiciones específicas de temperatura, atmósfera y humedad. Así, las células se adhieren a la superficie del soporte y luego comienzan a dividirse y a incrementar su número. De esta manera, con sucesivos subcultivos, es posible obtener grandes cantidades de una población celular determinada a partir de un número de células inicial relativamente bajo (Fig. 3).

Figura 3. Cultivo de condrocitos de rodilla de oveja. (Laboratorio de cultivo celular, Hospital Juan A. Fernández).
La gran ventaja de usar MSC para terapias in vivo es que no plantean problemas éticos. Han sido descritas como complejo mayor de histocompatibilidad I positivas (CMH I) y complejo mayor de histocompatibilidad II negativas (CMH II); además, carecen de expresión de moléculas coestimuladoras como CD 40, CD 80 y el CD 86, lo que las hace no inmunogénicas. No es necesaria la inmunosupresión del huésped en el trasplante alogénico de estas células, ya que son inmunoevasivas y pueden suprimir el sistema inmunitario.17
Hasta la fecha no se dispone de criterios fenotípicos bien definidos para caracterizar a las MSC, pues no existe un marcador de superficie único que las identifique. Algunos de los antígenos que expresan son CD29, CD76, CD90, CD105 y CD44.17
El implante de células expandidas en cultivo está siendo estudiado para el tratamiento de distintas patologías: reparación del cartílago articular, hernias de disco, lesiones de la médula espinal, infarto de miocardio, entre otros. Los mecanismos de reparación propuestos para la regeneración de tejidos por las células madre adultas son:
1) diferenciación en células del tejido dañado; 2) emisión de señales desde el tejido lesionado que favorece el reclutamiento de otras células madre o progenitoras; 3) liberación de moléculas solubles con efectos autocrinos o paracrinos; 4) inhibición de la apoptosis; 5) incremento de la vascularización del tejido dañado.8
Biomateriales
Existe evidencia de que ya desde la era prehistórica el hombre ensayó distintos biomateriales para realizar intervenciones médicas diversas.
Se define biomaterial como cualquier sustancia o combinación de sustancias, de origen natural o sintético, diseñada para actuar interfacialmente con sistemas biológicos a fin de evaluar, tratar, aumentar o sustituir algún tejido, órgano o función del organismo humano. Según su origen, los biomateriales pueden ser naturales: son complejos, heterogéneos y difícilmente caracterizables y procesables (colágeno, seda); o sintéticos: metales, cerámicas y polímeros.
En el caso particular de los biomateriales poliméricos, se puede hacer una clasificación según el tiempo que deben mantener su funcionalidad cuando se aplican como implantes quirúrgicos. En el primer grupo se incluyen todos aquellos implantes que deben tener un carácter permanente, como los sistemas o dispositivos utilizados para sustituir parcial o totalmente tejidos u órganos destruidos como consecuencia de una enfermedad o traumatismo. En el segundo grupo, se incluyen los biomateriales degradables de aplicación temporal, es decir, aquellos que deben mantener una funcionalidad adecuada durante un período limitado, ya que el organismo humano puede desarrollar mecanismos de curación y regeneración tisular para reparar la zona o el tejido afectado.
Actualmente, gracias al desarrollo de la "nanotecnología" (técnicas y dispositivos a escala nanométrica), nace la posibilidad de interaccionar con componentes celulares, y dirigir la proliferación y diferenciación celular, la producción y organización de la matriz extracelular. Esta combinación de la terapia celular con la nanotecnología permitiría usar predominantemente la capacidad regenerativa del propio organismo con un empleo mínimo de materiales artificiales.3 Mediante esta nueva tecnología se está trabajando en el desarrollo de nanomateriales: compuestos cerámica-cerámica, cerámica-metal, intermetálicos, aleaciones metálicas que tengan una estructura de fases modulada en una escala inferior a 100 nm.
En la reparación de los defectos óseos y cartilaginosos tiene un futuro prometedor la aplicación de matrices nanofibrosas tridimensionales, pudiéndose utilizar como transportadores de condrocitos cultivados o de factores de crecimiento óseo.
El mayor impacto a corto plazo de la nanomedicina en el campo de la cirugía ortopédica probablemente se produzca en el diagnóstico precoz y el tratamiento específico de los tumores óseos mediante quimioterapia dirigida liberada a través de nanopartículas.
Factores solubles
Se ha comentado que gran parte de las enfermedades que podrían beneficiarse con la aplicación de la medicina regenerativa se deben a trastornos en que interactúan diferentes factores celulares y no a la falta de una sola proteína. Ante esta situación, se ha planteado que la terapia celular regenerativa sería capaz de aportar no sólo células madre, sino también diversas moléculas activadoras y reguladoras producidas o inducidas por ellas, con capacidad para favorecer la diferenciación de las células implantadas y también la estimulación de las células propias del tejido receptor, lo que contribuiría a la regeneración del tejido dañado.9
Estudios recientes han permitido identificar un importante número de moléculas solubles producidas por las células madre, que una vez liberadas en los sitios dañados, ejercen allí una acción autocrina y paracrina. También se han señalado las ventajas del uso de plaquetas como fuente de factores regenerativos, teniendo en cuenta la cantidad de estos elementos solubles que ellas contienen.12 Esto no excluye la posibilidad de combinar la terapia celular con factores regenerativos específicos o con el aporte de factores plaquetarios, lo que podría potenciar la regeneración de los tejidos afectados.8
Las MSC representan el reservorio de células reparadoras, con reconocida plasticidad y capacidad proliferativa que pueden circular en la sangre periférica y migrar a diferentes tejidos distantes, en los que pueden asentarse y contribuir a la regeneración de sitios dañados. La señal que dispara el proceso podría ser la propia lesión, la inflamación o la necrosis, en que las células progenitoras migran desde el nicho al lugar de la lesión y se diferencian en el tipo celular requerido.4
Trasplante de genes
Otro método de avanzada aplicado en medicina regenerativa es el trasplante de genes, reconocido como terapia génica. El fundamento básico de este tratamiento plantea el uso de genes con fines terapéuticos para diversas enfermedades.
Existe gran interés en combinar la terapia génica con la terapia con células madre, por ejemplo para el tratamiento de la seudoartrosis, la osteogénesis imperfecta (OI), las lesiones individuales o las fracturas que podrían corregirse reemplazando el osteoprogenitor mutado o defectuoso con ingeniería genética (Fig. 4).

Figura 4. Estrategias posibles con el uso de células madre mesenquimáticas en traumatología.
La terapia génica puede ser desarrollada de dos formas: ex vivo, transferencia génica a una célula o tejido y cultivarse in vitro, o in vivo: el gen es transferido directamente al paciente. Pero la transferencia genética in vivo con vectores virales induce una respuesta inmunitaria que limita la duración y el efecto del tratamiento. Otra opción sería modificar genéticamente MSC autólogas ex vivo para que produzcan los genes o proteínas necesarias en el sitio afectado.
El uso de ingeniería genética con células madre para la práctica clínica necesita más desarrollo en cuanto a consistencia y seguridad.
Aplicaciones en traumatología
Las investigaciones están dirigidas a la aplicación de células madre para la regeneración de hueso y cartílago. La medicina regenerativa apunta al tratamiento de las lesiones condrales principalmente de la rodilla; en el campo de las lesiones óseas se centra en el tratamiento de los retrasos de consolidación y la seudoartrosis, así como en las necrosis óseas avasculares no traumáticas de la cadera y el hombro.
Cartílago
El cartílago articular no se regenera espontáneamente, y es bien sabido que su función a largo plazo está relacionada con su composición y arquitectura, asociadas a las propiedades mecánicas de este.15
Se propusieron diferentes técnicas quirúrgicas para el tratamiento de las lesiones del cartílago articular, como las microfracturas, la mosaicoplastia y los injertos osteocondrales, con buenos resultados. La reparación de cartílago articular por medio de mosaicoplastia es eficaz, pero no puede aplicarse en defectos de gran tamaño.19
Para las lesiones osteocondrales de pequeño y gran tamaño se realiza el trasplante autólogo de condrocitos, que consiste en la obtención de los condrocitos mediante la biopsia de cartílago tomado por artroscopia simple de la rodilla dañada en zonas de no apoyo, su posterior expansión celular por medio del cultivo, las cuales son devueltas al cirujano e inyectadas en el defecto, que se sella con un parche de periostio fijado con puntos de sutura y adhesivo biológico como sellante.
Desde el informe de Brittberg en los primeros 23 pacientes en 1994, se realizaron trasplantes en más de 30.000 pacientes en el mundo.1
El trasplante de condrocitos autólogo con células en suspensión cubiertas con parche de periostio se denomina de primera generación; cuando el periostio es reemplazado por una membrana de colágeno es de segunda generación y la tercera generación de la reparación de cartílago involucra una combinación de productos y células que crecen en una membrana carrier o matriz.18
El cartílago articular es extensamente estudiado como fuente de células condrogénicas para el trasplante, pero los resultados muestran limitaciones en su expansión y capacidad para diferenciarse en cartílago hialino.
El trabajo de Hossein Nejadnik y cols., que comparó el trasplante autólogo de condrocitos con el trasplante autólogo de MSC, demostró que ambos son igualmente eficaces, pero el segundo tiene la ventaja de que la toma de muestra de la médula ósea es menos invasiva que la artroscopia necesaria para tomar una muestra de cartílago, con el consiguiente menor costo y morbilidad para el paciente.14 Hoy, el trasplante autólogo de condrocitos se usa para el tratamiento de defectos del cartílago; sin embargo, estas técnicas no pueden utilizarse en la artrosis y la artritis reumatoide, ya que las propiedades biológicas de los condrocitos se encuentran alteradas.
Hueso
El hueso está en continua remodelación y necesita la formación de muchos nuevos osteoblastos. La activación de las células madre y la proliferación de los progenitores celulares para formar nuevos osteoblastos se aceleran como resultado de un trauma, fractura, inflamación, necrosis o tumor. La movilización y la diferenciación de las células madre mesenquimáticas estarían influidas por la quimiotaxis y las interacciones con la matriz extracelular a través de las proteínas transmembrana como las integrinas. Las MSC parecen diferenciarse en las células de la población local bajo la influencia del microambiente.
La osteonecrosis (ON) de la cabeza femoral, una de las patologías que generan más dolor en la cadera, suele asociarse con el tratamiento prolongado con corticosteroides y alcoholismo, y frecuentemente termina en el colapso de la cabeza del fémur con el subsecuente reemplazo total de la cadera. Hermigou fue el primero que sugirió que la ON podría también ser una enfermedad de las células del hueso o MSC. Estos descubrimientos permitieron el acercamiento a la fisiopatología y el tratamiento de la ON, como la implantación en la lesión necrótica de células madre de tejidos mesenquimáticos, obtenidos después de la concentración de médula ósea autóloga.10
El retraso de consolidación y la seudoartrosis son dos patologías frecuentes en los pacientes que sufrieron un politraumatismo con fracturas expuestas o en los que tienen una estabilización deficitaria. El tratamiento habitual es el cambio de la osteosíntesis más el aporte biológico a través de injerto óseo autólogo, tomado casi siempre de la cresta ilíaca. Es una posibilidad la utilización de MSC en los defectos pequeños a través de aporte percutáneo teniendo una osteosíntesis estable.11 Existen varios estudios clínicos en los últimos treinta años en los cuales se usó el trasplante autólogo de células madre mesenquimáticas en el tratamiento del retraso de consolidación o seudoartrosis de los huesos largos. Aunque todavía no se demostró una ventaja sobre los tratamientos anteriores, se probó que la aplicación de estas células no produce efectos adversos.2 En cambio, hay varios informes que muestran éxito en la combinación de MSC con matriz de sostén (scaffolds), para la fusión de los huesos largos y la desaparición de los defectos cavitarios.16
Estudios recientes realizados en la Universidad de Columbia muestran, en defectos óseos particularmente, la posibilidad de fabricar piezas funcionales de hueso humano in vitro usando MSC y un sistema de scaffold-biorreactor. Esta práctica tiene un gran potencial para la reconstrucción ósea después de defectos congénitos, cáncer, resecciones y traumas.7
Conclusiones
La información precedente da una idea general de los avances experimentados por este campo de la medicina en un tiempo relativamente corto, pero debe tenerse en cuenta que la medicina regenerativa y, en particular, la terapia con células madre, es un tema en pleno desarrollo. A pesar de que las investigaciones en células madre son muy prometedoras, necesitamos saber más sobre su biología y los mecanismos que permiten su especialización, en paralelo con el diseño de mejores tecnologías que posibiliten su aislamiento y manipulación en cultivos in vitro.
Hay muchas maneras de utilizar las células madre humanas para la investigación básica y clínica. Actualmente, no existe en nuestro país legislación en esta materia, pero se encuentran trabajando en ello los legisladores del Gobierno de la Ciudad Autónoma de Buenos Aires.
Si bien todavía resta mucho por conocer, las terapias de regeneración de tejidos y órganos serán la clave para mejorar la calidad de vida en un futuro cercano.
Agradecemos el apoyo de la Fundación Fernández y de la Cooperadora del Hospital Juan A. Fernández
1. Brittberg M. Autologous Chondrocyte transplantation. Clin Orthop Relat Res 1999;367S:S147-S155. [ Links ]
2. Ehnert S, Glanemann M, Schmitt A,Vogt S, Shanny N, Nussler NC, Stöckle U, Nussler A. The possible use of stem cells in regenerative medicine: dream or reality? Langenbecks Arch Surg 2009 Nov;394(6):985-97. [ Links ]
3. Engel E, Michiardi A, Navarro M, Lacroix D, Planell JA. Nanotechnology in regenerative medicine: The material side. Trend Biotechnol 2008;26:39-47. [ Links ]
4. Forriol F, Esparza R. Ingeniería tisular: aplicación de las células troncales pluripotenciales en cirugía ortopédica traumatología. Trauma Fundación MAPFRE 2008;19(1-3):15-28. [ Links ]
5. Friedenstein AJ, Gorskaja U, Kulagina N. Fibroblast precursors in normal and irradiated mouse hematopoietic organs. Exp Hematol 1976;4:267-74. [ Links ]
6. Gangii V. Cellular-based therapy for osteonecrosis. Orthop Clin N Am 2009;213-21. [ Links ]
7. Grayson WL, Frohlich M, Yeager K, Bhumiratana S, Chan M, Cannizzaro C, Wan LQ, Liu XS, Guo E, Vunjak-Nvakovic G. Engineering anatomically shaped human bone grafts. PNAS 2010:107(8):3299-304. [ Links ]
8. Hernández P. Regeneración biológica. Secretos de la naturaleza. Rev Cubana Hematol Inmunol Hemoter 2006;22(3). [ Links ]
9. Hernández P. Medicina regenerativa II. Aplicaciones, realidad y perspectivas de la terapia celular. Rev Cubana Hematol Inmunol Hemoter 2006;(1). [ Links ]
10. Hermingou P, Beaujean F, Lambotte FC. Decrease in the mesenchymal stem-cell pool in the proximal femur in corticoste-roid-induced osteonecrosis. J Bone Joint Surg 1999;81B;349-55. [ Links ]
11. Hernigou P, Poignard A, Manicom O, Mathieu G, Rouard H. The use of percutaneous autologous bone marrow transplantation in nonunion and avascular necrosis of bone. J Bone Joint Surg 2005;87(7);896-902. [ Links ]
12. Lange C, Cakiroglu F, Spiess AN, Cappallo-Obermann H, Dierlamm J, Zander AR. Accelerated and safe expansion of human mesenchymal stromal cells in animal serum-free medium for transplantation and regenerative medicine. J Cell Physiol 2007;213:18-26. [ Links ]
13. Mimeault M, Hauke R, Batra SK. Stem cells: A revolution in therapeutics-recent advances in stem cell biology and their therapeutic applications in regenerative medicine and cancer therapies. Clin Pharmacol Ther 2007;82:252-64. [ Links ]
14. Nejadnik H, Hui JH, Choong E, Tai BC, Lee E. Autologous bone marrow-derived mesenchymal stem cells versus autologous chondrocyte implantation: an observational cohort study. Am J Sports Med 2010;38;1110-6. [ Links ]
15. Spector M. Biomaterials-based tissue engineering and regenerative medicine solutions to musculoskeletal problems. Swiss Med WKLY 2008;136:293-301. [ Links ]
16. Tseng S, Lee MA, Hari redid A. Nonunions and the potential of stem cells in fracture-healing. J Bone Joint Surg Am 2008; 90;92-8. [ Links ]
17. Undale AH, Westendorf J, Yaszmemsky MJ, Khosla S. Mesenchymal stem cells for bone repair and metabolic bone diseases. Mayo Clin Proc. October 2009;84(10):893-902. [ Links ]
18. Van Osch G, Brittberg M, Dennis JE, Bastiaansen-Jenniskens YM, Erben RG, Konttinen YT, Luyten FP. Cartilage repair: past and future-lessons for regenerative medicine. J Cell Mol Med 2009;13(5):792-810. [ Links ]
19. Wakitani S, Imoto K, Yamamoto T, Saito M, Murata N, Yoneda M. Human autologos cultura expanded bone marrow mesenchymal cell transplantation for repair of cartilage defects in osteoarthritic knees. Osteoartritis Cartilage 2002;10:199-206. [ Links ]














