Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Asociación Argentina de Ortopedia y Traumatología
versión On-line ISSN 1852-7434
Rev. Asoc. Argent. Ortop. Traumatol. vol.76 no.2 Ciudad Autónoma de Buenos Aires abr./jun. 2011
ESTUDIOS CLÍNICOS
Resultados de los estudios experimentales y evolución clínica en la cirugía reconstructiva con polímero osteointegrable
Julio R. Mauras
Segunda Cátedra de Clinica Traumatológica, UNC, Córdoba
Recibido el 5-7-210.
Aceptado luego de la evaluación 5-1-2011.
Correspondencia:
Dr. JULIO R. MAURAS
julioraulmauras @hotmail.com
Resumen
Introducción: Los sustitutos óseos son todos aquellos materiales elaborados. Se comercializan en diversas formas y han demostrado gran eficacia en diversos tipos de reconstrucción.
Materiales y métodos: En el período comprendido entre marzo de 2003 y marzo de 2010 se realizaron 28 intervenciones quirúrgicas (17 mujeres y 11 varones) sobre la articulación de la cadera. En 26 casos fueron cirugías de revisión y sólo dos, artroplastias primarias. La edad promedio en el momento de la cirugía fue de 62,6 años (rango 52 a 88).
Resultados: Los resultados se clasificaron en clínico-radiológicos y experimentales debiendo diferenciar distintos parámetros, a saber: la resistencia de carga a la compresión en diseños de cotilos, en fémures cadavéricos y en cotilos recuperados; imágenes de microscopia electrónica y el comportamiento volumétrico al final de su fase de expansión. Los resultados clínico-radiológicos se observaron a través de sus ventajas en la rehabilitación, la recuperación funcional, la ausencia de dolor, la osteointegración a lo largo del tiempo y la ausencia de subsidencias o migración de los implantes. Conclusiones: Como en el caso de todas las experiencias en medicina, este es el comienzo de nuevas técnicas que hasta el momento han servido para resolver problemas difíciles, de forma más rápida, práctica y segura.
Palabras clave: Sustitutos óseos; Cirugía reconstructiva con polímero osteointegrable; Resultados clínico-radiológicos y experimentales del polímero osteointegrable.
Results of Experimental Studies and Clinical Evolution in Reconstructive Surgery with Osteointegrated Polymer
Abstract
Background: bone substitutes are man-made materials. They are supplied in various forms and have proven their effectiveness in different reconstruction types.
Methods: From March 2003 to March 2010 twenty eight (17 females and 11 males) surgical interventions were performed on the hip joint. 26 cases were revision surgery and only 2 were primary arthroplasties. Average age at the time of surgery was 62.6 years (range 52-88).
Results: The results were classified in clinical-radiological and experimental; different parameters were considered: resistance to compression in acetabular designs, cadaver femurs, and recovered acetabuli. Electron microscopy images were obtained and the volumetric behavior at the end of the expansion phase was measured. Clinical-radiological results were rated according to their advantages in the rehabilitation, functional recovery, absence of pain, osteointegration in time, and absence of implant subsidence or migration.
Conclusions: As with all experiences in medicine, this is the beginning of new techniques that have served so far to solve difficult problems in a faster, safer and more practical manner.
Key words: Bone substitutes; Reconstructive surgery with osteointegrated polymer; Clinical-radiological and experimental results with osteointegrated polymer.
Existen controversias conceptuales respecto de los sustitutos óseos. Estos son todos aquellos materiales que se incorporan al organismo e incluyen los injertos óseos de banco, que tanto auge tienen hoy en la reconstrucción. Se comercializan en diversas formas y han demostrado gran eficacia en diversos tipos de reconstrucción. En la reparación ósea, el tejido se repara con su propia estructura, por lo que un sustituto al final del proceso deberá ser reemplazado por la estructura del receptor. Es deseable que el material que se incorpore como sustituto mantenga las propiedades básicas de porosidad y resistencia propias del hueso, además de favorecer la osteoconducción a través de su matriz y su resorción gradual, como ocurre con los injertos después de un tiempo de implantados o con los biomateriales reabsorbibles.3,4,13,23
Para que esta propiedad se desarrolle se necesita una estrecha relación entre el material y el hueso húesped a fin de que las células osteogénicas tengan viabilidad, aprovechando las matrices porosas que ofrecen los sustitutos.
Otras propiedades, como la osteoinducción, la osteogénesis y la osteopromoción, no se consideran -dentro de este tipo de sustituto polimérico- virtudes esenciales, pero deberían procurar la formación local de hueso reclutando células que sirvan de soporte para la deposición ósea y para constituir la fuente de formación de células óseas 2,3,13,27
Materiales y métodos
En el período comprendido entre marzo de 2003 y marzo de 2010 se realizaron 28 intervenciones quirúrgicas sobre la articulación de la cadera. En 26 casos fueron cirugías de revisión y en sólo dos, artroplastias primarias. La edad promedio en el momento de la cirugía fue de 62,6 años (rango 52 a 88); 17 eran mujeres y 11, varones. Las causas de la cirugía primaria fueron una artritis reumatoide con protrusión acetabular de grado III y necrosis cefálica masiva asociada en un caso, y una hidatidosis del extremo proximal del fémur, que se sustituyó con aloinjerto, prótesis y cementado al fémur distal con el polímero, en el otro caso. Las causas de revisión se asociaron, en su mayoría, con defectos femorales de distinto grado, acetabulares segmentarios, cavitarios o mixtos; fracturas periprotésicas y revisiones de artroplastias sépticas en dos tiempos, con reconstrucción y cementado del tallo en el segundo tiempo de implantación.
En 26 de los casos se utilizó polímero en uno de los componentes de la articulación y no en el otro, ya sea porque no se lo revisó o no existía indicación para su uso. En dos de los casos se revisaron ambos componentes por la pérdida masiva del capital óseo acetabular asociada a pérdida femoral con fractura de distinto grado en el fémur proximal.
Existieron también defectos femorales distales al tallo (ventana ósea) en dos casos. Otra causa poco frecuente (un caso) fue la rotura del tallo protésico. Se realizó una osteotomía extendida del fémur a fin de llegar a la base distal de la rotura para extraerla, luego se recementó el tallo con polímero y se ancló en él la osteotomía con cables. Otro caso fue un tallo doblado en varo asociado a pérdida del capital óseo proximal externo que incluía la zona trocantérea. Después de extraer el tallo se reparó, combinando la técnica con un segmento de polímero estructurado y el cementado al fémur distal. En un caso de fractura subtrocantérea en un paciente con enfermedad de Paget se extrajo el fémur proximal de la fractura, se reconstruyó con polímero segmentario proximal y se fijó con metacrilato, además de fijar el tendón del psoas y el trocánter mayor, y se obtuvo la consolidación y la función.
En un caso de reconstrucción acetabular por revisión, con defecto masivo mixto con pérdida del fondo acetabular, se combinaron las técnicas reconstruyendo el fondo sólo con polímero y luego, con injerto óseo de banco, el resto del defecto del fondo morsalizado e injerto en el techo estructurado de condilo atornillado, agregando un anillo de Kerboul y cementando luego la copa.
En cinco casos se revisó el acetábulo mediante la reconstrucción del defecto, sea cavitario, segmentario o mixto, y luego se implantó el cotilo cementado con metacrilato. En un paciente de 89 años (caso 1) con una evolución de 12 años (Fig. 1) del reemplazo total de cadera, que tenía un defecto mixto (Fig. 2), se reconstruyó (Fig. 3) con polímero el defecto y, después, se cementó la copa (Fig. 4). En la imagen radiológica posoperatoria (Fig. 5), a los 2 años de evolución, se observaban signos de osteointegración, sin subsidencias de las interfases (Fig. 6). A los 6 años (Fig. 7), había signos claros de integración, sin subsidencias, migración ni colapso.
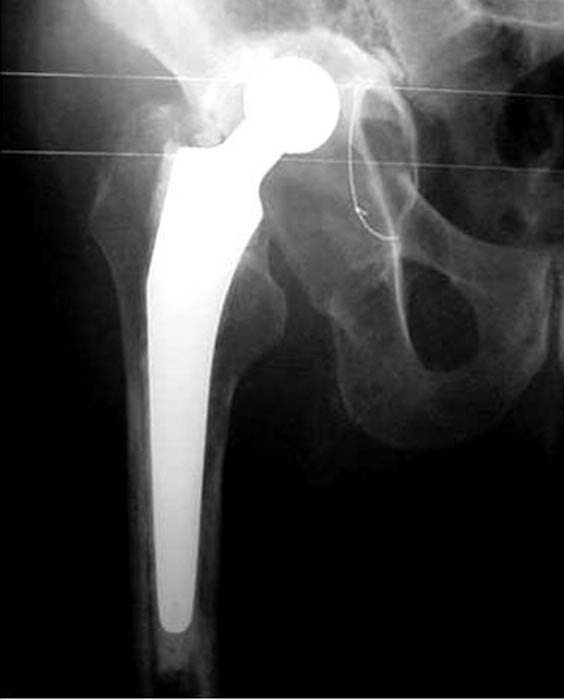
Figura 1. Caso 1. Paciente de 89 años. Evolución preoperatoria.

Figura 2. Defecto óseo correspondiente al paciente del caso 1.

Figura 3. Caso 1. Reconstrucción.
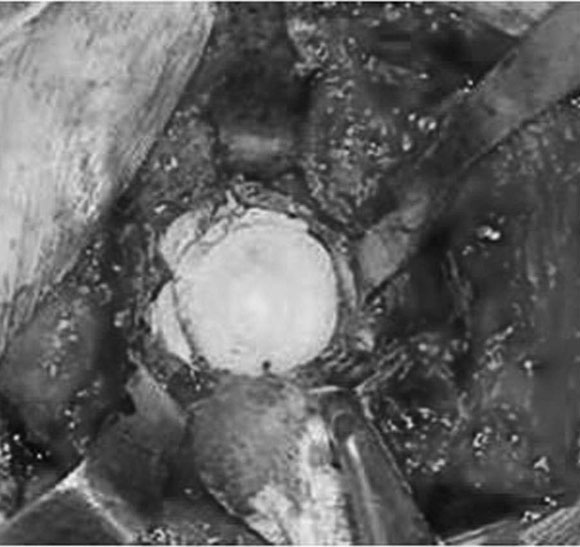
Figura 4. Cementación.

Figura 5. Posoperatorio.
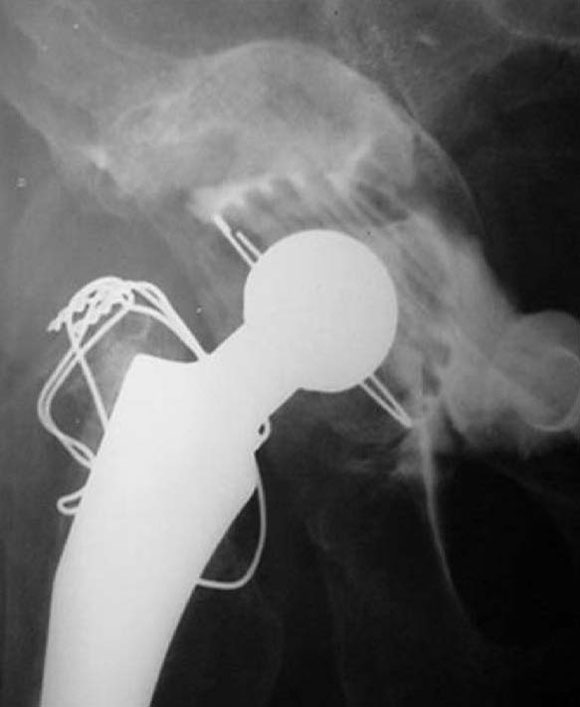
Figura 6. Posoperatorio a los 2 años.
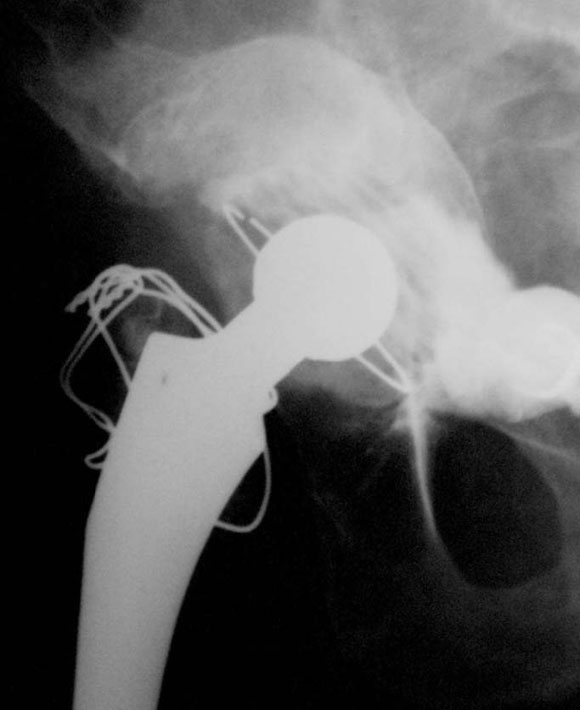
Figura 7. Posoperatorio a los 6 años.
En cuatro casos de revisión acetabular se realizó la reconstrucción con polímero y la cementación de la copa híbrida sin tornillos de fijación adicionales.
En uno de ellos, un paciente de 52 años (caso 2), se observó una luxación inveterada, con una imagen de resorción sobre el cotilo no cementado (Fig. 8). Se revisó el componente acetabular, ya que su evolución era de 10 años. Luego de observar la imagen intraoperatoria (Fig. 9) del defecto acetabular, se colocó el polímero reconstruyendo el defecto y cementando el cotilo híbrido sin tornillos de fijación adicional (Figs. 10 y 11). En la Figura 12 puede verse la evolución a los 36 meses del implante.
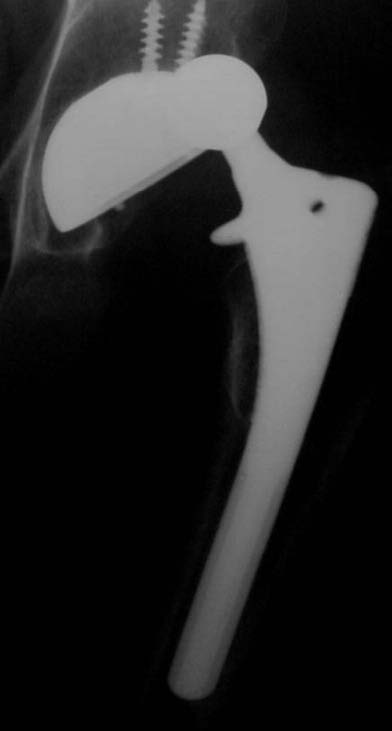
Figura 8. Caso 2. Paciente de 52 años.Preoperatorio.

Figura 9. Intraoperatorio. Defecto acetabular.

Figura 10. Cementación del cotilo.
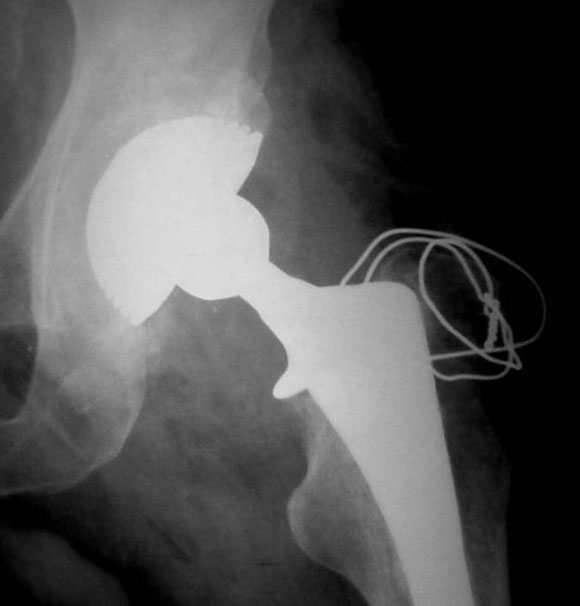
Figura 11. Posoperatorio inmediato.
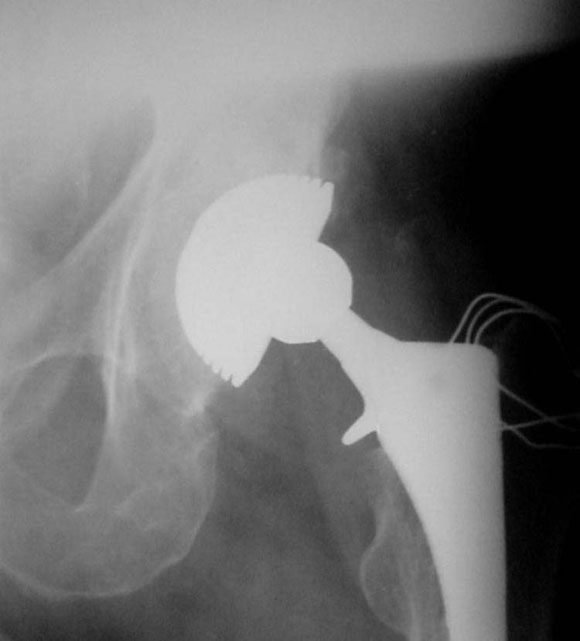
Figura 12. Posoperatorio a los 36 meses.
En dos casos se trató la seudoartrosis. Un caso correspondió a una seudoartrosis acetabular pososteotomía de Chiari, de 11 años de evolución, en la que se realizó la reconstrucción y cementación de la copa. El otro caso fue una seudoartrosis del fémur en su sección media, posfractura infectada y tratada con clavo endomedular retrógrado, asociada a una fractura del cuello tratada con clavo-placa, relacionada con una osteotomía valguizante, que evolucionó a una necrosis cefálica a los 2 años. Después de 4 años de esperar la consolidación, se retiró el implante, se trató la infección, se colocó un RTC con tallo largo que pasara la seudoartrosis y se cementó con polímero. Se obtuvo una fijación de ambos cabos de la seudoartrosis y la artroplastia simultánea.
En tres casos de revisión séptica en dos tiempos, en dos pacientes se utilizó el cementado del tallo y reconstrucción del fémur simultáneo, con distintos grados de defectos femorales
(tipos II y IV) cada uno. En el tercer caso, una necrosis cefálica infectada pososteosíntesis del acetábulo y defecto óseo sobre la pared posterior, luego de tratar la infección se planificó la artroplastia, se utilizó una copa no cementada, fijándola con polímero y se realizó la reconstrucción acetabular del defecto simultáneamente.
Se trataron seis casos de fracturas periprotésicas, una de tipo I, tres de tipo II, dos con tallo fijo y una con tallo flojo, dos de tipo II, todas ellas con distinta pérdida de capital óseo. En todas se recambió el tallo y se colocó uno nuevo fijándolo con polímero y trasvasando al menos dos diámetros del fémur distales a la fractura.
En un paciente de 58 años, con una evolución de 22 años de RTC cementada (caso 3) (Fig. 13), con defectos en el acetábulo mixtos (segmentario y cavitario) (Fig. 14) y defecto femoral de tipo III, se efectuó la reconstrucción acetabular y femoral.
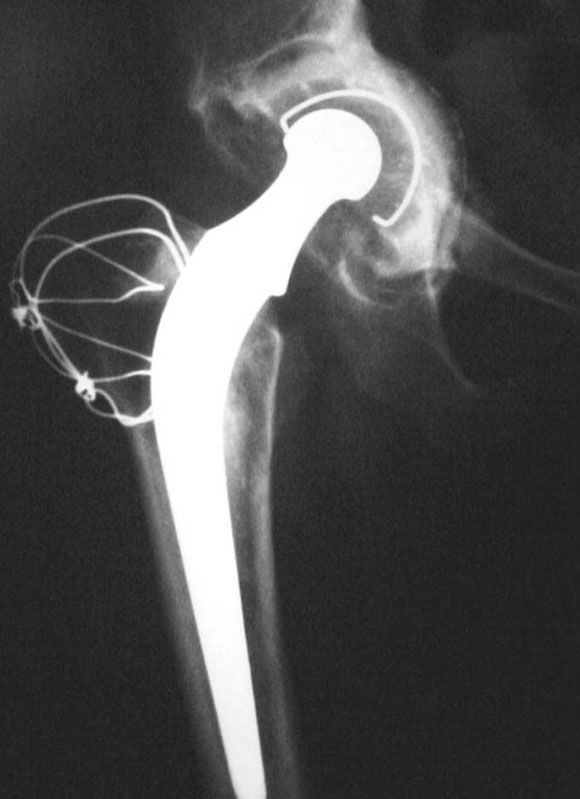
Figura 13. Caso 3. Paciente de 58 años. Preoperatorio.

Figura 14. Defecto acetabular.
Durante la revisión femoral se fracturó el fémur proximal (Fig. 15). Se realizó la reconstrucción y cementación (Fig. 16) de la copa con polímero, y la reconstrucción y cementación del tallo asociado a cerclajes del extremo proximal. En las radiografías a los 3 meses (Fig. 17), 6 meses (Fig. 18) y 9 meses (Fig. 19) se observaba un aumento de la densidad ósea con signos de osteointegración. Se muestra la evolución a los 18 meses (Fig. 20) y a los 42 meses (Fig. 21), la función (Fig. 22) y la carga posoperatoria (Fig. 23).

Figura 15. Caso 3. Fractura femoral proximal.

Figura 16. Reconstrucción y cementación.
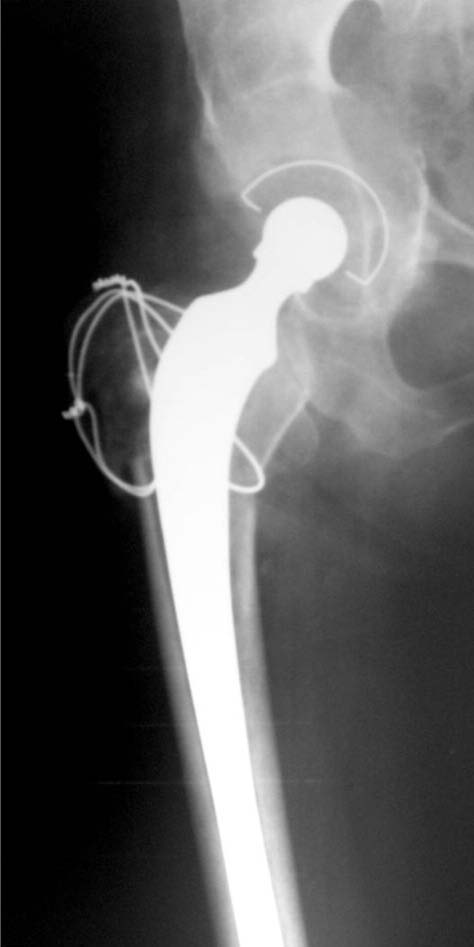
Figura 17. Caso 3. Posoperatorio a los 3 meses.
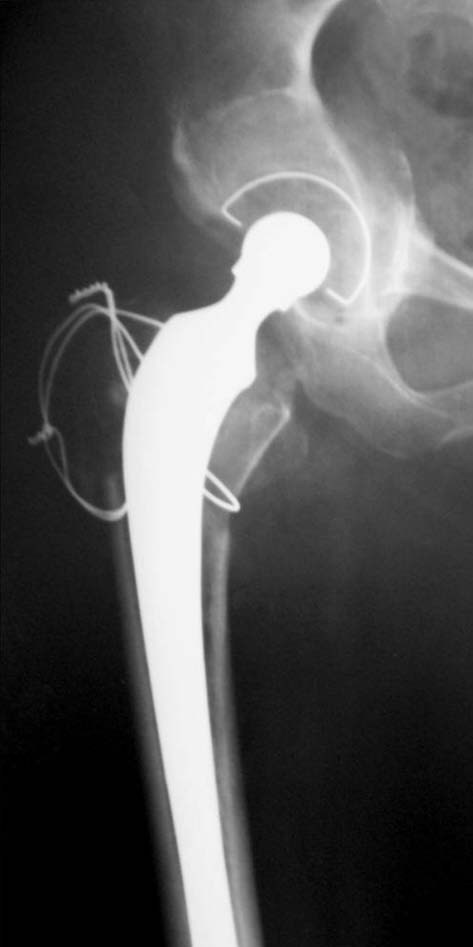
Figura 18. Posoperatorio a los 6 meses.
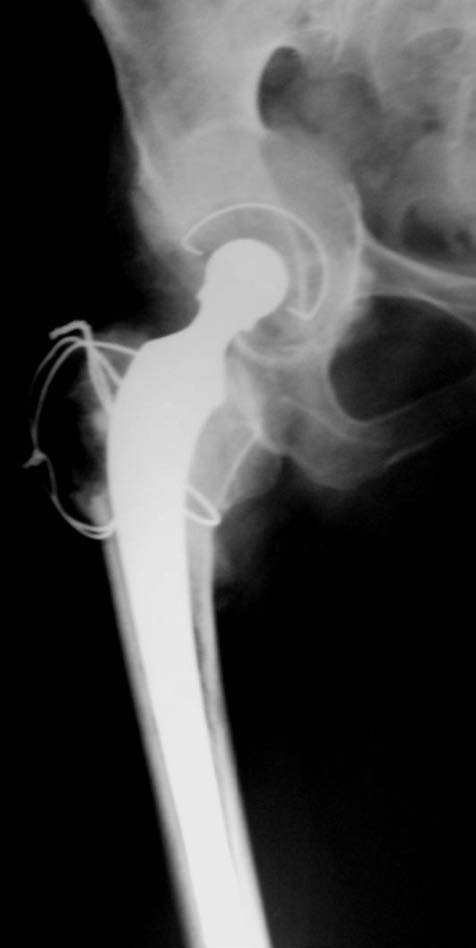
Figura 19. Posoperatorio a los 9 meses.

Figura 20. Posoperatorio a los 18 meses.
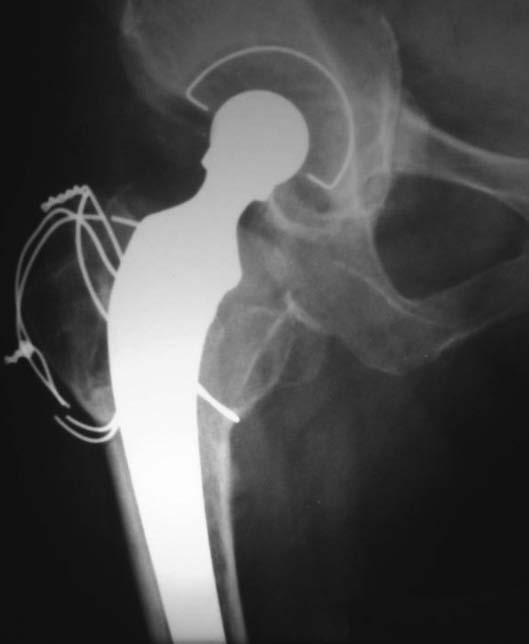
Figura 21. Posoperatorio a los 42 meses.

Figura 22. Función a los 18 meses..

Figura 23. Carga.
En la metodología utilizada se ampliaron progresivamente las aplicaciones, las indicaciones y las formas de utilización. El concepto inicial es el de sustituto óseo, al igual que los aloinjertos, pero con ventajas claras sobre este. La capacidad de soportar cargas en forma inmediata por su resistencia mecánica es notable. Luego de realizar reconstrucciones y determinar su capacidad de integración al huésped se observó que, al igual que con los materiales similares con capacidad de adhesión, era posible utilizarlo progresivamente en la reconstrucción asociada a la cementación de implantes, en cotilos de polietileno, metálicos y tallos en forma directa, y se notó una estrecha relación en el momento de la polimerización.
En el proceso de polimerización su exotermia es baja (40 Cº) y no produce necrosis tisular ni elimina radicales libres al final del proceso, lo que lo hace atóxico frente al resto de los tejidos y órganos. Se puede considerar una desventaja técnica el tiempo final de fraguado (entre 40 y 50 minutos), pero con la asistencia técnica adecuada y la pericia del cirujano se adelantó su preparación para acortar los tiempos de implantación y se redujo el tiempo quirúrgico a 20 minutos; asimismo, son tiempos de espera que se utilizaron para mejorar la orientación de los componentes, la reducción de las fracturas y la presurización de la prótesis en el período expansivo del producto.
Todas estas alternativas metodológicas fueron creando distintas interfases, el polímero al hueso, al metacrilato, al polietileno y a los metales, tanto en los tallos como en los cotilos híbridos.
Sólo dos casos condujeron al fracaso, uno de ellos después de 18 meses de la implantación, por una artritis reumatoide muy agresiva que produjo lisis sobre el hueso huésped y migración del polímero y su cotilo. Se tomaron muestras del hueso huésped para estudio anatomopatológico (necrosis ósea, ausencia de células granulomatosas) y muestras del polímero para microscopia electrónica. Se revisó con éxito del mismo modo agregando un anillo de Kerboul. En el segundo caso, un paciente con una evolución asintomática de 4 años, quedaron dos restos de tornillos sepultados en el techo acetabular del procedimiento
de extracción anterior. Se realizó la reconstrucción del defecto con cementación de la copa de polietileno simultánea. A los cuatro años y medio de evolución, la infección recidivó, con osteólisis simultánea sobre el techo acetabular, produciendo colapso y migración del polímero y de la copa en bloque. Después de la recidiva se retiraron los implantes y se trató la infección.
En ninguno de los dos casos se alteró la estructura del polímero. En el segundo caso, después de las pruebas de carga, se observó un cambio de comportamiento más cristalino semejante al hueso. En todos los otros casos las interfases presentaron buen comportamiento clínico y radiológico; los signos de osteointegración fueron progresivos y claros, denotaron un aumento de radiodensidad y con la evolución se remodeló tanto el lado femoral como el acetabular. Los más evolucionados denotaron cambios del trabeculado óseo, según las líneas de carga.
Resultados
Los resultados se clasificaron en clínico-radiológicos y experimentales y se debieron diferenciar distintos parámetros, a saber: la resistencia de carga a la compresión en los diseños de cotilos, en fémures cadavéricos y en cotilos recuperados; las imágenes de microscopia electrónica y el comportamiento volumétrico al final de su fase de expansión. Los resultados clínico-radiológicos se observaron por las ventajas en la rehabilitación, la recuperación funcional, la ausencia de dolor, la osteointegración a lo largo del tiempo y la ausencia de subsidencias o migración en los implantes.
En pruebas de compresión el polímero osteointegrable demostró un grado de recuperación del 30% de su deformidad luego de la carga máxima de 3.000 kgf En condiciones similares a las biológicas (en solución isotónica de NaCl a 36 ºC), el grado de resistencia a la carga fue más sostenido, con similar recuperación de la deformidad. El comportamiento plástico permite, además, que la absorción de cargas sea mayor y favorece la integridad de la interfase. Se halló el polímero osteointegrable muy competitivo en las pruebas de carga, soportando a los 40 minutos 600 kgf y a las 72 horas, en su fraguado final, 2.800 kgf, lo que lo hace de inmediato muy resistente a las cargas de compresión luego de implantado.18,19,32,33,36,40
En las pruebas de adhesión el polímero mostró mayor eficacia sobre superficies metálicas porosas. También fue suficiente para mantener el cotilo de polietileno contenido. Sobre tallos metálicos implantados en fémures cadavéricos se observó gran resistencia inicial a 600 kgf con deformidad plástica a la compresión hasta la rotura ósea a 1.900 kgf, por impronta del tallo.20,34
Observando los procedimientos de implantación del material se notó un proceso de expansión del polímero en la fase final, entre el estado de biomasa y el sólido, proceso autolimitado y que favorecía el relleno de los defectos y la presurización protésica, además de la interdigitación con el hueso huésped. Se logró cuantificar dicha propiedad con procedimientos experimentales, siendo en este período un aumento volumétrico del 64% entre los estados mencionados.1
En el estudio de microscopia electrónica realizado de un cotilo recuperado a 18 meses de implantado, se procesó la muestra para someterla al estudio de barrido en diferentes aumentos desde 10x, 20x, 40x, 160x (Fig. 24), hasta 1.250x. Se observó claramente una estructura trabecular con canalículos en toda su estructura, semejantes al hueso en forma y tamaño, lo que permitiría el proceso osteoconductivo.38
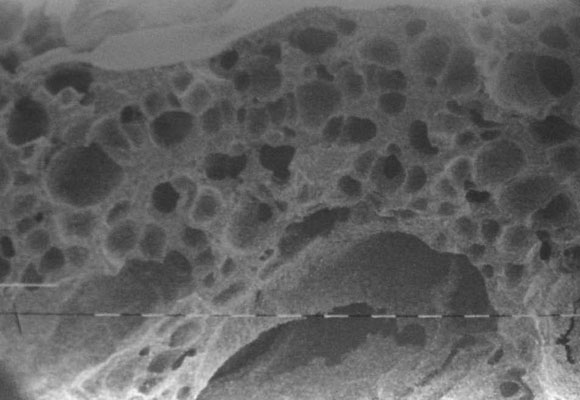
Figura 24. Imagen de microscopia electrónica de barrido a 160 x. Se observa una estructura similar a la esponjosa del hueso, osteoconductora.
Desde el punto de vista clínico se observa su capacidad como material osteconductivo, ya que radiológicamente presenta osteointegración, aumento de la radiodensidad y cambio del trabeculado semejando a la matriz esponjosa ósea. En las reconstrucciones femorales se observó un aumento progresivo de la densidad ósea y el engrosamiento de todo el segmento que contenía polímero en relación con el hueso y el tallo.26,37,45 En las dos revisiones por migración de la masa del polímero con el cotilo de polietileno contenido se realizaron pruebas de compresión, en ambos con diferente evolución a los 18 meses de implantado y, a los cuatro años y medio, se observó en este ultimo un cambio de resistencia mecánica de duro plástico a duro cristalino, semejando el comportamiento del hueso y modificando así su comportamiento mecánico, análisis que indica que este cambio es equivalente al comportamiento del hueso, con una resistencia sostenida hasta su fractura.31 Luego de la prueba, continuó su potencial de adhesión al polietileno a pesar de soportar la prueba de carga y la fractura, y permaneció intacto luego de esta.
Se diseñaron procedimientos en distintas situaciones patológicas, creando diferentes interfases. Por las cargas que soportó el polímero implantado y sus diferentes interfases estimadas, los resultados clínicos y radiológicos son, en su mayoría, buenos (96%). La osteointegración al huésped fue progresiva e inmediata a la implantación, con signos claros a los 3 meses. La remodelación continuó posteriormente observándose cerca del octavo mes. No se hallaron causas como dolor posoperatorio, radiolucencias que sugirieran la presencia de membranas fibrosas o neosinovial en diferentes implantes en ninguno de los casos de la serie. El comportamiento de todas esas interfases (hueso-polímero, tallo metálico-polímero, cotilo polietileno-polímero, cotilo no cementado-polímero, metacrilato-polímero) no mostró indicios clínicos o radiológicos de subsidencias, migración o colapso. En los casos en que se asoció a aloinjertos la osteointegración fue progresiva y completa, incluido el polímero. Dado que la incorporación del aloinjerto lleva más tiempo, la carga fue progresiva de acuerdo con los índices de osteointegración.
Existió, en algunos casos de revisión femoral, remodelación perióstica de todo el segmento proximal donde se colocó el polímero cementando el tallo. Estas reacciones periósticas se mencionan en la bibliografía como signos osteogénicos.23,28 Tanto en los casos de reconstrucción como en los de fracturas periprotésicas se logró la estabilidad y la consolidación en un corto período (3 a 4 meses). Cabe destacar que dicho material se interpone sobre los segmentos fracturados y, a diferencia del polimetilmetacrilato, se integra a ellos y favorece la consolidación.
Para la correcta evaluación radiológica de los implantes cementados con el polímero se tomaron los siguientes parámetros: desplazamiento vertical a partir de la imagen en lágrima, desplazamiento horizontal en relación con la línea de Koehler, ángulo de inclinación acetabular, lucidez periacetabular en su ancho y progresión en el lado acetabular.
En el segmento femoral no se observaron signos de resorción del cuello menores de 5 mm, radiolucencias del tallo menores de 2 cm, índices de resorción periprotésica en los casos de cementaciones del tallo, colapso en los casos de fracturas periprotésicas ni migración del implante. En los controles actuales no se halló osteólisis del sustituto producida por partículas de polietileno. A pesar de que la edad promedio era alta, los procesos de integración en todos los casos se mantuvieron en todos, independientemente de esta. Además, los procesos de remodelación por la presencia de la prótesis no influyeron en la integración del sustituto.10,45
Las ventajas de la fijación que da el polímero sobre todas las superficies (óseas, metálicas, polietileno), además de la carga total luego de las 72 horas de implantado, permite ampliar en forma progresiva el rango articular, recuperar precozmente la propiocepción, mejorar el tono y el trofísmo muscular, reeducar la marcha y el equilibrio, y abandonar el uso de soportes externos, logrando así acortar los tiempos de rehabilitación, como en una artroplastia primaria, con independencia de las causas que condujeron a la revisión.5,39,51
La evolución clínica varió de un máximo de 6 años a un mínimo de 5 meses, con un promedio de 3,7 años. De todos los casos, se perdió el seguimiento clínico por distintos motivos; óbito en tres casos: un paciente murió en el posoperatorio por una falla hemodinámica; uno evolucionó a un año con signos de consolidación, buena función y sin dolor, pero sufrió una fractura contralateral que no fue asistida en el geriátrico y murió; el tercer paciente evolucionó durante 18 meses con signos de consolidación sin dolor, interfases conservadas y excelente función; su muerte no tuvo relación con el procedimiento. En tres casos se perdió el control debido a la distancia desde la zona de residencia rural hasta el hospital. En cinco pacientes se pudo efectuar un buen control durante 18 meses.
Si bien la evolución no es suficiente frente a otras técnicas, los casos de mayor evolución sugieren que otros pueden seguir el mismo camino. Con respecto a la implantación en la artritis reumatoide, existieron resultados controvertidos según cada caso. Cuando se utilizaron en defectos acetabulares contenidos se observó buena evolución de la osteointegración, pero en los casos en que los defectos no fueron contenidos fracasaron las interfases a expensas de la osteoporosis y la lisis del hueso huésped en la artritis reumatoide activa, que condujo a la falla en la osteointegración. No hubo infecciones secundarias en ninguno de los pacientes de la serie y en los casos de revisión por infección en dos tiempos sólo uno recidivó por los motivos mencionados.
Como sucede en todas las experiencias en medicina, este es el comienzo de nuevas técnicas que hasta el momento han servido para resolver problemas difíciles, de una forma más rápida, práctica y segura.
Discusión
Diversos autores describen las pérdidas óseas posartro-plastias, tanto en prótesis cementadas como híbridas. Encontraron diversas circunstancias en relación con el género y la localización del tallo protésico, recalcando, además, que la pérdida de la densidad es progresiva, debe repararse en una revisión y que luego de esta la pérdida continúa, por lo que se hace imprescindible este procedimiento (Cohen y Rushton, Sychterz y Engh, Maloney y cols). Lo importante es entender que lo esencial es la reconstrucción ósea y transformar sus deficiencias, para lograr una cavidad reconstruida del tamaño original.14 Por lo tanto, se aconseja una estrategia de diseño y de materiales que consiga la máxima conservación del capital óseo. Para esto se debe contar con más de una alternativa de diseño técnico de reconstrucción en los defectos óseos y tener en cuenta las distintas técnicas reconstructivas.
El injerto actúa como un enrejado o estructura sobre la cual se produce un proceso de resorción simultáneo al crecimiento del nuevo hueso.2 Esta estructura trabecular porosa favorece la revascularización más rápidamente en relación con el hueso cortical, con una incorporación más temprana y completa.2,6,7,16
Sin duda, los aloinjertos han sabido ganar terreno en la reconstrucción de los grandes defectos, pero en este camino no se debe olvidar que persisten las reacciones inmunitarias, según la temperatura de congelación y conservación.48 El aloinjerto libera antígenos en forma lenta y continua durante cierto número de años, y produce una reabsorción persistente que provoca, a su vez, una nueva liberación de antígenos6,7,11,23,42,49. Su potencial es sólo osteoconductivo y logra soportar la carga después de la consolidación.2,16,24,28
Otros hallazgos más frecuentes de su uso son la falta de unión, la resorción y las fracturas. Las tasas de retrasos de consolidación varían según los autores entre el 9% y el 23%, y la incidencia de fracturas, entre el 10% y el 16%. El aloinjerto comienza como un material extraño y necrótico, no vascularizado, que sirve de medio de cultivo para las infecciones, cuya incidencia es entre 10% y 15% 11,12,17,29,47
En relación con otros materiales, como las matrices óseas desmineralizadas, se consideran sustancias óseas desmineralizas y desengrasadas con capacidad osteoconductiva pero, además, parte de sus propiedades se pierden en el proceso de liofilización al desnaturalizar las proteínas, lo que explica la reacción de cuerpo extraño del receptor, la reabsorción y el elevado número de osteoclastos.13,27
Existen en la actualidad numerosos sustitutos óseos, materiales artificiales sintéticos o biológicos, derivados de animales o vegetales, que pueden integrarse con los tejidos vivos y permiten así la reparación ósea. Son materiales osteoconductivos y, en algunos casos, inductores y requieren un proceso de elaboración complejo. Los polímeros son algunos de ellos; también se mencionan en la bibliografía las cerámicas y los compuestos minerales, que no son eficaces en las grandes sustituciones en las que se requiere carga 9,21,22,23,25,41,44,46
Se los puede dividir en irreabsorbibles, como el polimetilmetacrilato, de amplio uso en cirugía ortopédica, entre otros, y reabsorbibles o biodegradables por hidrólisis, que liberan y alteran el pH local (producen inflamación y quistes en su estructura) y que son eliminados sin problemas de los líquidos corporales.41,43
Los diferentes trabajos mecánicos, biológicos y clínicos relacionados con el polímero de mamona lo presentan con propiedades de osteointegración. Su estructura permite una buena adhesión de las células sobre la superficie.13,15 Los conceptos modernos exigen que los biomateriales utilizados para la reparación ósea tengan una producción suficiente de células y tejido para conseguir una reparación completa, organización tridimensional e integración con el tejido local. Deben combinar simultáneamente el factor crecimiento y la degradación, de manera de mantener la integridad mecánica. Para eso se recomiendan sustancias porosas que favorezcan la osteoconducción, propiedad lograda por el polímero de mamona.8,13,26,30
Este polímero proviene de un arbusto herbáceo de la familia de euforbiáceas Ricinus communis o mamona. Es un oleopolímero o biopolímero compuesto por un 81% a 96% de triglicéridos del ácido ricinoleico. Estructuralmente es un poliéster. Su compuesto químico, llamado poliuretano, es un poliol combinado a un diisocianato y es estable en las uniones químicas a la hidrólisis. El prepolímero es un líquido viscoso que se combina con el poliol para la polimerización.
El tiempo final de polimerización es de 72 horas. A temperatura ambiente y corporal es altamente estable y no existe posibilidad de descomposición térmica con el tiempo. El carbonato de calcio que se incorpora en la mezcla en un 30% aumenta su dureza y favorece la osteoconducción.21,22
El polímero es un sustituto óseo capaz de soportar las solicitaciones mecánicas casi inmediatamente en el momento de implantarlo, tanto en compresión como en te nsión. Además, cumple con todos los requisitos de un biomaterial: atóxico, estable química y térmicamente, y capaz de adherirse a diferentes superficies sin generar reacciones inmunitarias ni granulomatosas 8,15,18,19,20,21,35,40,41,43
Un material que promueva el factor de crecimiento, que simultáneamente se degrade y que permita la revascularización manteniendo la integridad mecánica es difícil de obtener, todo esto dentro de un marco no inflamatorio, sin reacciones inmunitarias ni liberación de sustancias tóxicas que inhiban el proceso de reparación.2613,28,50
Conclusiones
Realizamos una experiencia que nos aporta como resultado un sustituto ampliamente versátil, por sus formas de presentación, con gran resistencia a la carga de compresión y de tensión, con poder osteoconductivo, que persiste en el tiempo, con señales radiológicas de remodelación y osteointegración, que es estable en el medio orgánico a las agresiones iónicas y térmicas sin generar reacciones inmunitarias o granulomatosas. Hemos podido solucionar, de una forma práctica, rápida y eficiente, situaciones patológicas diversas y difíciles, simplificando los procedimientos y mejorando la morbilidad.
1. Alvarez C. Facultad de Ciencias Químicas. Informe técnico 0906234. Determinación de volumen final de polímero. CEQUIMAP Córdoba 2009. [ Links ]
2. Axhausen W. The osteogenic phases of regeneration of bone. A historical an experimental study. J Bone Join Surg Am 1956; 38-A(3):593-600 . [ Links ]
3. Barrows TH. Degradable implant materials: review of absorbable polymers and their applications. Clin Mater 1986;233-57. [ Links ]
4. Blasier RD, Bucholz R, Cole W, Jonson LI, Makela EA, Bioresobable implants applications in orthopaedic surgery. Instr Course Lec 1997; 46:531-46 . [ Links ]
5. Ehmer B. Fisioterapia en Ortopedia y Traumatología. 2.ª ed. MacGraw-Hill Interamericana; 2005. [ Links ]
6. Burchardt H. The biology of bone graft repair. Clin Orthop 1983,174:28-423. [ Links ]
7. Burwel RG, Friedlaenderm GE, Mankin HJ. Current perspectives and future directions; the 1983 international conference on osteochondral allografts. Clinic Orthop 1985;197:141-57. [ Links ]
8. Chierice GO. Tesis doctoral. Instituto Químico de San Carlos Universidad de San Pablo. 1994. [ Links ]
9. Clarke SA, Brooks RA, Lee PT, et al. The effect of osteogenic growth factors on bone growth into ceramic filled defect around an implant. J Orthop Res 2004:22(5):1016-24 . [ Links ]
10. De Souza MG. Biopolimero da Mamona para recontruçao defalhas osseas pos-ressecçao tumoral, Aplicaçao Clinica. Tese Doutorado. Recife Universidad Federal de Pernanbuco BR, 2004. [ Links ]
11. Enneking WF, Mindel ER. Observations on massive retrived human allograf. J Bone Joint Surg Am 1991 ;73. [ Links ]
12. Friedlaender GE. Bone allografts; the biological consequences of immunological events. J Bone Joint Surg Am 1991;73(8); 1119-21. [ Links ]
13. Forriol F. Los sustitutos óseos y sus posibilidades actuales. Laboratorio de ortopedia experimental. Facultad de Medicina. Universidad de Navarra, España. Rev AAOT 2005;70(1). [ Links ]
14. Garrido A, Gómez H. Revisión acetabular con copas no cementadas. Rev AAOT 2009;74(4):331-40. [ Links ]
15. Ghirardi G. Análisis de biopsias óseas en revisiones de artroplastias de cadera. Estudio histopatólogico. Córdoba, Noviembre 2008. [ Links ]
16. Goldenberg VM, Stevenson S. Natural history of autografts and allografts. Clin Orthop 1987;225:7-16 . [ Links ]
17. Gosain AK, Song L, Riordan P, et al. A 1-year study of osteoinduction in hydroxiapatite- derived biomaterials in an adult sheep model: part I. Plas Reconstr Surg 2002;109(2):619-30. [ Links ]
18. Helale J, Mancini R. Estudios de ensayos en pruebas de resistencia a la compresión y tracción sobre implantes protésicos. Informe Técnico 55703 INTI Córdoba, 2008. [ Links ]
19. Helale J, Mancini R. Estudios de ensayos en pruebas de resistencia a la compresión y tracción sobre implantes protésicos. Informe Técnico 55860. INTI Córdoba, 2008. [ Links ]
20. Helale J, Mancini R. Estudios de ensayos en pruebas de resistencia a la compresión y tracción sobre implantes protésicos. Informe Técnico 55992. INTI Córdoba 2008. [ Links ]
21. Ignacio H, Mazzer CH, Chierice GO. Estudo sobre aplicabilidade medica da poliuretana derivada da mamona Resenha Ortopedica Orgao oficial da area de ortopedia y traumatologia da facultade de Medicina.Universidad de Sao Paulo 1994 . [ Links ]
22. Ignácio A. Utilização do cimento derivado do polímero da mamona no preenchimento de falha óssea. Estudo experimental em coelhos. [Dissertação de Mestrado]. Faculdade de Medicina de Ribeirão Preto - USP São Paulo, 1995. [ Links ]
23. Kenley RA, Yim K, Abrams J. Roan E, Turek T Marden LJ, Hollinger JO. Biotechnology and bone graft substitutes. Pharmacetical Research 1993. [ Links ]
24. Krebsbach PH, Kuznetsov SA, Satomura K, et al. Bone formation in vivo: comparison of osteogenesis by transplanted mousse and human marrow stromal fibroblast. Transplantation 1997;63(8): 1059-69. [ Links ]
25. Kfuri JR, Paccola CAJ, Chierie GO, Shimano AC. Comparaçao entre pinos absorviveis de poliparadioxanona e de poliuretana de mamona na fixaçao de segmentos osteocondrais do femur distal de coelhos. Rev Bra Ortop 2001; 36:125-31. [ Links ]
26. Kharmandayan P. Estudo da interface de contato entre osso e implantes de poliuretano com e sem carbonato de calico, empregado microscopia de luz e electronica de varredura, em coelhos. Tese de doutoramento, Universidade Federal Sao Paulo-Escola Paulista de Medicina, Sao Paulo 1997. [ Links ]
27. Leniz P, Ripalda P. Forriol F. The incorporation of different sorts of cancellous bone graft and the reaction of the host bone. A histomorphometric study in sheep. Int Orthop 2004;28(1);2-6. [ Links ]
28. Lieberman JR, Daluiski A, Einhorn TA. The role of growth factors in repair of Bone Biology and clinical applications. J Bone Joint Surg Am 2002;84-A(6): 1032-44. [ Links ]
29. Lord CF, Gebhardt MC, Tomford WW, et al. Infection in bone allografts. Incidence, nature, and treatment. J Bone Joint Surg Am 1988;70(3);369-76. [ Links ]
30.Magro Filho. Implante de polimero de mamona em cavidades cirurgicas experimentais realizadas em tibia. Estudo histologico em ratos. Innovations Magazine 1998; 10-4. [ Links ]
31. Mauras J, Pereira A, Ibañez I. Análisis del comportamiento mecánico y biológico de cotilos implantados y revisados con polímero osteointegrable. Póster Congreso AAOT. Salta. Diciembre 2009. [ Links ]
32. Mauras J, Ibañez I, Pereira A. Ensayos mecánicos de compresión del polímero osteointegrable comparativos al PMMA en diseños acetabulares. Póster Congreso AAOT Salta. Diciembre 2009 . [ Links ]
33. Mauras J, Ibañez I, Pereira A. Ensayos mecánicos de tracción del polímero osteointegrable comparativos al PMMA en diseños acetabulares. Póster Congreso AAOT Salta. Diciembre 2009. [ Links ]
34. Mauras J, Ibañez I, Pereira A. Ensayos físicos del polímero osteointegrable comparativos al PMMA en aloinjertos femorales. Póster Congreso AAOT Salta Diciembre 2009. [ Links ]
35. Mauras J, Ibañez I, Pereira A. Estudio comparativo del polímero vegetal biocompatible implantado en animales y resultado de biopsias de pacientes con cirugía de revisión de cadera. Póster Congreso AAOT Buenos Aires 2008. [ Links ]
36. Mauras J, Ibañez I, Pereira A. Ensayos físicos y químicos del polímero vegetal osteointegrable. Revisión Bibliográfica y Estudios Experimentales. Poster Congreso AAOT Buenos Aires 2008. [ Links ]
37. Mauras J, Ibañez I, Pereira A. resultados clínicos en cirugía de revisión de cadera utilizando polímero osteointegrable comparados con aloinjertos. Póster Congreso AAOT, Salta 2009. [ Links ]
38. Mighetti A, Mancini R. Estudio de fragmento con microscopia electrónica. Informe técnico 56516, INTI, Córdoba 2009. [ Links ]
39. Nieva M, Mauras J, Pereira A. Evaluación del programa de rehabilitación en cirugías de revisión de cadera con polímero osteointegrable. Poster Congreso AAOT Salta, diciembre 2009. [ Links ]
40. Neto SC. Caracterizaciones físico-químicas de un poliuretano derivado de óleo de mamona utilizado para implantes óseos. Universidad de Sao Paulo, Instituto de Química de Sao Carlos; 1994. [ Links ]
41. Ohara GH, Kojima KE, Rossi JC, Telles M, Soares TVC, Salomão C, Sanda M. Estudo experimental da biocompatibilidade do polímero da mamona implantada intra-óssea e intra articular em coelhos. Acta Ortop Bras 1995;3. [ Links ]
42. Reddi AH, Weintroub S, Muthukumaran N. Biologic principles of bone induction. Orthop Clin North Am; 18(2);207-212;1987. [ Links ]
43. Rossi JC, Telles ML, Soares TC. Estudo experimental da biocompatibilidade do polímero poliuretana da mamona implantada intaossea e intraarticular em coelhos. Congresso da Sociedade Brasileira de Ortopedia e Traumatologia. Salvador 1994. [ Links ]
44. Ruhe PQ, Hedeberg EL, Padrón NT, et al. RhBMP-2 release from injectable Poly(DL- Lactic-co-gliycolic acid/calcium phosphate cement composites. J Bone Joint Surg Am 2003;85-A(Suppl 3):75-81. [ Links ]
45. Scmitt-Fournier JA, Sert GO, Skondia V. The use of biocompatible orthopaedic polymer in the treatment of loose total hip prostheses. J Research 1989;17:254-61 . [ Links ]
46. Texeira HM, Vilarinho RH. Ramalho LTO. Reacao a resina de mamona no processo de reparo osseo induzido no corpo da mandíbula. Reuniao de SBPQO,13, 1996, Sao Pedro (SP) Anais. Sao Pedro, 1996. [ Links ]
47.Tomford WW. Transmission of disease through transplantation of musculoskeletal allografts. J Bone Join Surg Am 1995;77(11);1742-54. [ Links ]
48.Urist MR. Bone, formation by autoinduction. Science 1965;150(698):893-9 . [ Links ]
49. Urist MR Introduction to update on osteochondral allograft surgery. In Aebi M Regazzoni P. Bone transplantation. Berlin Springer-Verlag; 1989. p.1-6. [ Links ]
50. Vats A, Tolley NS, Buttery LDK, et al. The stem cell in orthopaedic surgery. J Bone Joint Surg Br 2004;86(2): 159-64. [ Links ]
51. Vilar E, Sureda S. Fisioterapia del aparato locomotor. Madrid: McGraw-Hill Interamericana; 2005. [ Links ]














