Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Asociación Argentina de Ortopedia y Traumatología
versión On-line ISSN 1852-7434
Rev. Asoc. Argent. Ortop. Traumatol. vol.79 no.1 Ciudad Autónoma de Buenos Aires mar. 2014
ACTUALIZACIÓN
Lesiones del nervio torácico largo de Bell
Revisión de conceptos terapéuticos
Sebastián E. Valbuena
Sector Miembro Superior y Microcirugía, Servicio de Ortopedia y Traumatología, Hospital "El Cruce-Néstor Kirshner", Buenos Aires
Clínica del Deporte, La Plata, Buenos Aires
Correspondencia: Dr. Sebastián E. Valbuena valbuena.sebastian@gmail.com
Recibido el 17-9-2013.
Aceptado luego de la evaluación el 10-2-2014.
Resumen
Las lesiones del nervio torácico producen parálisis del serrato anterior y originan una deformidad característica (escápula alata), que genera debilidad y alteraciones importantes en la movilidad del hombro. En esta revisión, se analizan conceptos sobre anatomía, etiología, presentación clínica y alternativas terapéuticas.
Palabras clave: Nervio torácico largo; Serrato anterior; Plexo braquial; Parálisis.
Abstract
Long thoracic nerve of Bell. Review of therapeutic management
The long thoracic nerve injuries are manifested by a characteristic deformity called scapula alata, causing weakness, and impaired shoulder mobility. In this review current concepts of the anatomy, etiology, clinical presentation and therapeutic management are analyzed.
Key words: Long thoracic nerve; Serratus anterior muscle; Brachial plexus; Palsy.
Introducción
El nervio torácico largo (NTL), llamado también nervio respirador externo o nervio de Charles Bell, inerva solamente al músculo serrato anterior. Este músculo cumple un rol protagónico en la estabilidad de la escápula, y su parálisis produce una deformidad característica, denominada "escápula alata", que genera debilidad y alteraciones importantes en la movilidad del hombro.
La afección del NTL es rara. Narakas, en su serie personal de aproximadamente 1000 lesiones del plexo braquial, observó solo 11 casos de compromiso solitario del NTL.1
La mayoría de las comunicaciones sobre la parálisis del NTL se ocupan de observaciones retrospectivas de pocos casos, de nuevas causas etiológicas, o bien describen detalles técnicos quirúrgicos.2
Anatomía y biomecánica
a) Nervio torácico largo: Es un nervio motor puro que nace de las raíces nerviosas cervicales C5, C6 y C7. Con menos frecuencia, participan en su formación la raíz C4 o C8 y, en el 8% de los casos, C7 no participa.3
Inmediatamente las ramas destinadas de C5 y C6 se unen formando la división alta del NTL corriendo de forma paralela y en íntima relación con el nervio supraescapular. La rama originaria de C7 o división baja del NTL se dirige hacia distal pasando sobre el escaleno medio y por detrás del escaleno anterior. La división alta del NTL pasa a través del escaleno medio. Esta disposición anatómica lo hace particularmente susceptible a compresiones o a la lesión durante la cirugía del síndrome del opérculo torácico.4
Para Bertelli y Ghizon, el NTL a nivel supraclavicular discurre paralelo al plexo braquial y no perpendicular, como está descrito clásicamente en la mayoría de los textos de anatomía.5
Las divisiones alta y baja del NTL se unen antes de pasar por debajo de la primera costilla y la clavícula introduciéndose en el paquete pléxico. El nervio desciende oblicuamente de adelante atrás pasando próximo a las bursas subcoracoidea y subescapular. 6 A nivel de la segunda costilla se han informado particularidades anatómicas que predisponen a su lesión. Para Hester y cols., aquí el nervio se coloca verticalmente atravesando una corredera fibrosa sobre la parte superior del músculo serrato.7 Para Ebraheiem y cols., el NTL es cubierto por la fascia superficial del serrato a ese nivel y, luego, desciende por detrás de la línea axilar media dando ramas para las indentaciones del serrato anterior.6 En ambos casos, ya sea por la corredera fibrosa de Hester que envuelve al NTL o por la fascia superficial de Ebraheim, en maniobras de abducción y rotación externa se produce una acodadura del nervio, y ambos autores coinciden en que, a ese nivel, se produce la compresión del nervio al abducir el hombro. A pesar de estas descripciones, Kauppila en 40 disecciones anatómicas no encuentra tales estructuras, y descarta la posibilidad de compresión sobre ese sitio.8
El trayecto del NTL a nivel del tórax es relativamente constante por detrás de la línea medio axilar y emerge en la axila por debajo de los pectorales a nivel de la cuarta o quinta indentación del serrato anterior, a partir de este lugar comienza a dar ramas para las diferentes fracciones del músculo, de manera variable, según los diferentes autores. 2
En la parte distal de su trayecto, la rama anterior de la arteria toracodorsal, destinada al fascículo medial del serrato anterior, pasa por delante del nervio, donde este penetra debajo de la fascia del serrato anterior, de manera constante, según Cuadros y cols.9 Aquí existiría un potencial sitio de compresión, debido a que el nervio es móvil en la parte media del trayecto torácico, y sería fijado por esta encrucijada anatómica.10
El trayecto completo del nervio es variable, de 20 a 30 cm, y finaliza en tres ramas terminales para los segmentos medio e inferior del músculo.2,11
b) Serrato anterior: Anatómicamente está dividido en tres porciones separadas por tejido conectivo, la porción superior cilíndrica o cónica cuyo origen proviene de la primera y segunda costilla ascendiendo suavemente para insertarse en el borde supero-medial de la escápula.5 Este fascículo sirve de ancla e impide que la escápula rote cuando el brazo está por encima de la cabeza.12,13 La porción media es delgada, se inserta en la cara lateral y anterior de la segunda, tercera y cuarta costilla. Presenta una trayectoria divergente y se inserta en el borde medial de la escápula.5 Funciona como protractor de la escápula. 13
La porción inferior más gruesa y fuerte se origina de la tercera a la octava costilla, y se dirige, de forma convergente, al ángulo inferior de la escápula.5 Para otros autores su inserción torácica va de la sexta a la novena costilla. Funciona como protractor y rotador del ángulo inferior de la escápula hacia anterior y lateral.12,13
Para Bertelli y Ghizoli, este fascículo sólo funciona como estabilizador de la escápula.5 Zancolli y Cozzi proponen que la inervación del serrato anterior es consecuente con el nacimiento topográfico del nervio, y C5 es responsable de la inervación de la parte superior del serrato; C6, de la parte media y C7, de la parte inferior.14 Herringhan, citado por Hovelacque,15 en disecciones intraneurales encuentra que la parte superior es inervada por C5; la parte media, por C5 y C6; y la parte inferior, por C7. Bertelli y Ghizon demuestran que la estimulación intraquirúrgica de la división alta del NTL (C5 y C6) produce protracción del hombro y, al ser estimulada la división baja del NTL , se produce contracción del serrato sin protracción de la escápula (C7). Estas observaciones intraoperatorias se contraponen con las clásicas presentaciones en las que se afirma que, en la protracción de la escápula, participa también el fascículo inferior del serrato.5
La información sigue siendo controvertida y se necesitan otros estudios para confirmar estas teorías.
El músculo serrato anterior cumple roles fundamentales en la función del hombro, junto con el trapecio son rotadores de la escápula y facilitan la abducción del brazo, ambos músculos son sinérgicos y mantienen la escápula pegada al tórax.16,17 Sin el serrato anterior esta rotación es prácticamente nula y la abducción del brazo no supera los 90°. El serrato es el único músculo que participa en los tres momentos de la elevación del brazo estabilizando la escápula.16 Durante la abducción del brazo, la escápula es movilizada y fijada, y permite la rotación de la cabeza humeral; la contracción del serrato anterior es mayor a mayor elevación humeral.18,19
La parálisis del NTL produce que la escápula rote posteriormente sobre su eje vertical generando no solo escápula alata, sino también una pérdida en su estabilización, 20 lo que puede causar dolor, disminución de la fuerza del hombro y de la movilidad de la cintura escapular y una deformación estética importante.12,21,22
Etiología
El NTL es propenso a lesionarse debido a su trayecto superficial, su largo recorrido y su pequeño diámetro en comparación con los demás nervios del plexo braquial.4,21 La tracción parece ser el mecanismo más implicado, la rotación de la cabeza hacia el lado opuesto más una elevación del brazo dobla la distancia del trayecto del nervio entre sus dos puntos fijos. A nivel de la segunda costilla y sobre el entrecruzamiento con la arteria toracodorsal son los dos lugares más afectados. A su vez, el ejercicio puede producir compresión directa sobre el nacimiento del NTL a nivel del escaleno anterior.4
Se han comunicado diferentes causas: traumáticas, compresivas, iatrogénicas, infecciosa, inmunizaciones, neurológicas, malformaciones cervicales, deportivas e idiopáticas. 2,4,13,21-23
La cirugía oncológica axilar es la principal causa de lesiones del NTL. Los deportes que generan abducción del hombro sobre los 90°, extensión del brazo y tracción brusca predisponen al estiramiento del nervio (levantamiento de pesas, básquet, golf, fútbol americano, tenis, sobre todo durante el saque).
Presentación clínica
Dolor: Depende de la causa, puede ser intenso y continuo en neuralgias, neuritis o el síndrome de Parsonage Turner, o mínimo o inexistente.2
Debilidad muscular: Varía según la gravedad del cuadro, en las formas severas, la limitación de la movilidad es grave, disminuye la abducción y la elevación anterior a menos de 90° con el paciente de pie, pero son posibles cuando el paciente está acostado.
Escápula alata: La separación del borde medial de la escápula del tórax es más marcada al comienzo de la elevación, con el brazo en extensión y en supinación. En casos menos graves, aparece cuando se le pide al paciente que empuje con las manos la pared. Se la debe diferenciar en primaria, secundaria o, más raramente, voluntaria: 24
Primaria: debido a lesión neurológica del NTL , del nervio espinal accesorio o del nervio dorsal escapular.
Secundaria: a causa de trastornos glenohumerales o subacromiales (lesión del manguito rotador, capsulitis adhesivas, impingement) que producen movimientos escapulo- torácicos anormales.
Voluntaria: rara. Factores psicológicos intervienen como factor desencadenante. Según el músculo afectado clínicamente pueden advertirse patrones diferentes. Cuando la lesión es del músculo serrato anterior, la deformación en reposo es mínima (Figs. 1 y 2), la escápula migra hacia arriba, la punta superior interna se desplaza lateralmente y el polo inferior se acerca a las apófisis espinosas. Si el trapecio es el músculo debilitado la escápula toma una posición baja, el ángulo superior medial se acerca a las apófisis espinosas y el polo inferior se aleja de ellas. Cuando el romboides está comprometido, la escápula alata es similar, pero menor a la deformidad adoptada en la parálisis del trapecio.21
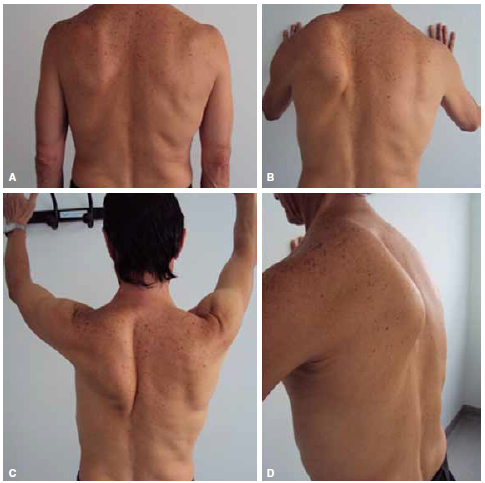
Figura 1. Parálisis del serrato anterior por lesión del nervio torácico largo, de 3 meses de evolución. Trabajador de la construcción. A. Posición de reposo sin evidencia de la deformidad. B. Maniobra de empuje donde se intensifica la deformidad por parálisis del serrato anterior. B, C, D. Nótese la buena troficidad del trapecio, el ángulo inferior de la escápula acercándose a la línea interespinosa, escápula elevada y borde superointerno desplazado a lateral.

Figura 2. Maniobra para evaluar el romboides. Paciente con escápula alata por lesión del nervio torácico largo. A. Posición de reposo donde se observa leve protrusión de la punta de la escápula. B. Empuje posterior. C. Empuje anterior. Se observa buena función de los romboides sin escápula alata.
En general, la evolución natural es la recuperación en un período de 6 a 12 meses, salvo en el síndrome de Parsonage Turner, en el que la recuperación puede demorar hasta dos años. La restitución ad integrum parece rara. 2,21
Tratamiento
Salvo que la etiología compresiva o iatrogénica esté documentada, en general, se plantea una conducta expectante, y la deformidad escapular suele mejorar entre los 3 y 9 meses, en algunos casos, puede tardar dos años, con excepción de las lesiones directas del NTL. El 25% de los pacientes sufre dolor o deformidad remanente que no mejora con el tratamiento conservador, por lo que suele ser necesaria una solución quirúrgica.22
Alternativas quirúrgicas
Microcirugías nerviosas
a) Neurólisis supraclavicular: Nath y cols. proponen la descompresión microquirúrgica, neurólisis externa e interna del NTL a nivel supraclavicular. Sostienen que la mayoría de los pacientes tienen como antecedente una actividad física con contracción del escaleno medio que produciría la compresión del NTL, o un traumatismo a nivel supraclavicular. Comunican resultados excelentes o buenos en el 92% de 50 pacientes. Estos autores afirman que la neurólisis debe ser el primer gesto quirúrgico por realizar cuando se sospecha lesión supraclavicular (antecedentes de vigorosas maniobras atléticas, portadores de mucho peso, traumatismos externos, como masajes profundos, sospecha de afección del tronco primario superior con debilidad del bíceps M3 o M4). Indican el procedimiento hasta 7 años después de producida la lesión; si han transcurrido 7-10 años, la indicación es relativa y no lo realizan después de 10 años de evolucion.4
b) Neurólisis torácica: Lascar y Laulan muestran que, cuando se detecta el signo de Tinel latero-torácico a nivel de la quinta costilla con electromiografía positiva, al realizar una neurólisis torácica del NTL, el dolor desaparece y se recupera por completo el músculo serrato anterior.10 Un estudio multicéntrico muestra buenos resultados con esta estrategia.25
c) Transferencias nerviosas: El nervio toracodorsal, motor puro, es responsable de la inervación del dorsal ancho, se origina del tronco posterior de las raíces C7 y C8, en ocasiones, C6 también participa.26 Su transferencia al NTL fue descrita por Novack y Mackinon, en 2002.27 Ellos transfirieron la rama medial del nervio toracodorsal al NTL y obtuvieron un buen resultado en un paciente, a los 7 años de seguimiento. Uerpairojkit y cols. proponen transferir la rama lateral del nervio toracodorsal debido a que tiene un diámetro mayor y un poder de electroestimulación superior a los de la rama medial; estos autores detectaron la mejoría de la escápula alata en 5 pacientes con parálisis del tronco superior del plexo braquial. Sostienen que, en los pacientes con lesiones altas del plexo braquial sometidos a transferencias múltiples (de espinal accesorio a supraescapular, procedimiento de Oberlin y de tríceps a circunflejo), la calidad del resultado mejora cuando el NTL funciona, por lo que indican esta transferencia como complemento a la reconstrucción.26
La transferencia del nervio pectoral medial al NTL fue presentada por Tomaino, quien comunicó un resulta Esta técnica posee más desventajas que la transferencia del nervio toracodorsal, debido a que esta última presenta mayor integridad cortical, tiene más cantidad de fibras motoras, y es técnicamente menos demandante sin necesidad de injerto nervioso.
Procedimiento de estabilización estática
No permite un natural movimiento de la escápula y produce una pérdida en la movilidad del brazo. Se indica cuando otros músculos, además del serrato anterior, están comprometidos. a) Fijación escapulo-torácica: Consiste en fijar la escápula al tórax sin realizar una artrodesis de la articulación. Se han comunicado diferentes técnicas, como el procedimiento de Whitman,29 quien usa injerto de fascia lata entre el borde medial de la escápula y las apófisis espinosas; el procedimiento de Lowman30 que une ambos ángulos inferiores de la escápula con injerto de fascia lata; el procedimiento de Ketenjian31 que fija la escápula a la caja torácica con hilos de poliéster trenzado no reabsorbible; la modificación de Atasoy y Majd30 de este procedimiento usando injertos de fascia lata en lugar de poliéster, o Gianini y cols. que realizan la fijación con alambres, sin artrodesis.32
b) Fusión escapulo-torácica: Procedimiento de salvataje recomendado cuando hay una alteración muscular de varios músculos de la cintura escapular, como en la distrofia muscular fascio-escapulo-humeral.33 Produce una pérdida de un tercio de la elevación anterior, pérdida de la rotación interna y de la extensión del hombro.34,35 Se describió hasta un 30% de no uniones, pero funcionarían como una escapulopexia.36
Procedimientos de estabilización dinámica (transferencias tendinosas)
a) Pectoral mayor: Es la transferencia más utilizada, debido a la sinergia con el serrato anterior y a la mínima alteración que produce su transferencia. La cirugía consiste en desinsertar el pectoral mayor del húmero y transferirlo al tercio inferior en el borde lateral de la escápula. Se han descrito muchas variaciones técnicas, como la transferencia completa, la transferencia del fascículo esternal, el aumento con injerto tendinoso (fascia lata, semitendinoso y recto interno, plantar delgado), etc.37-41.
b) Pectoral menor: En 1951, Chaves propone transferir la inserción del pectoral menor de la coracoides al borde vertebral de la escápula. Refiere como beneficio que reproduce la orientación anatómica del serrato y reduce la oposición desarrollada por los músculos que se insertan en la coracoides.42 Vastamak, en 1984, presenta 5 casos con buenos resultados.43
c) Redondo mayor: Descrito, por primera vez, por Hass, en 1931, quien propone desinsertar del húmero al redondo mayor y transferirlo a la quinta y sexta costilla.44 Michel Merle presentó en el Simposio de secuelas de parálisis del miembro superior, desarrollado en París, en 2008, su técnica personal y los resultados. Desinserta el músculo redondo mayor a nivel de la escápula y lo transfiere al borde medial de esta. En sus 6 casos, obtuvo una mejoría de 52° promedio de la flexión anterior y de 15° de rotación externa del hombro. Como grandes ventajas se pueden mencionar la técnica simple y la cosmética cicatriz. Como contrapunto la falta de desaparición completa de la escápula alata en todos los casos.45
d) Romboides: En 1951, Herzmark presenta un caso de transferencia del romboides mayor para el tratamiento de la escápula alata. El autor propone desinsertarlo y reinsertarlo en la fosa del infraespinoso. Comunica un resultado funcional y cosmético aceptable un año después de la cirugía. 46 Esta técnica no ha sido evaluada en el tiempo por otros autores.
Discusión
El primer reporte de escápula alata secundario a lesión del NTL fue publicado por Velpeau, en 1897.47
Históricamente el tratamiento de la parálisis del músculo serrato anterior ha estado centrado en dos tipos de procedimientos: fijación estática de la articulación escapulotorácica y transferencias dinámicas tendinosas. La fusión escapulo-torácica se ha reservado para casos de debilidad de otros grupos musculares escapulares o para casos de rescate.
En 1904, Tubby48 fue el primero en proponer un tratamiento quirúrgico para la escápula alata. Transfiere el pectoral mayor a las diferentes indentaciones del serrato, esta técnica falla debido a la unión sobre un músculo denervado.
En 1932, Withman29 fue el primero en proponer un procedimiento de fijación estática uniendo el borde inferior de la escápula a la cuarta a séptima vértebra torácica con cintas de fascia lata. En 1937, Dickson49 propone utilizar injerto de fascia para unir el borde inferior del pectoral mayor al borde inferior de la escápula. Durman,50 en 1945, sugiere utilizar fascia lata para prolongar el tercio inferior del pectoral mayor y fijarlo al ángulo inferior de la escápula, enrollándolo sobre sí, a manera de tubo para evitar el estiramiento. Los procedimientos de fijación estática son eficaces en el corto tiempo, suelen perder eficacia en el seguimiento y no reemplazan la función dinámica del músculo lesionado. 34,35
Estos resultados aleatorios han dado lugar a que diferentes autores prefieran los procedimientos dinámicos de transferencias tendinosas o la fusión escapulo-torácica. No obstante, Atasoy y Majd30 presentan los resultados de 5 pacientes con lesión iatrogénica del NTL , a quienes se sometió a la fijación de la escápula al tórax utilizando el procedimiento de Ketenjian modificado por ellos. Utilizan tiras cilíndricas de fascia lata que pasan por orificios escapulares y alrededor de cada costilla, para luego ser suturadas a ellas mismas, con buenos y excelentes resultados a los 6 años y 4 meses de seguimiento promedio. Giannini y cols. comunican 18 casos de distrofia fascio-escapulo-humeral que fueron tratados con escapulopexia con alambres sin fusión, con buenos resultados a los 9 años de seguimiento promedio.32
La diferencia que existe entre este procedimiento y la fijación es que la escapulopexia es menos rígida, permite algún tipo de movimiento escapulo-torácico mínimo y una movilización posoperatoria más rápida. Evita la posible no unión, las fracturas por estrés y el compromiso respiratorio secundario a la limitación de la excursión costal de la fusión.34
La fusión escapulo-torácica es un procedimiento recomendado en alteraciones, como la distrofia fascio-escapulo- humeral.34 Algunos autores defienden su uso en parálisis del serrato anterior de más de dos años de evolución, en personas que utilizan mucha fuerza del miembro superior y en casos de debilidad grave.35 Sostienen que, a pesar de que se pierde un 30% de movilidad del hombro, la fijación mejora la fuerza del deltoides y los músculos del manguito rotador, lo que mejora la movilidad. Indican este procedimiento en parálisis del NTL en pacientes que quieran volver al trabajo pesado, deportes extremos o de contacto; y a quienes no deseen padecer la morbilidad asociada a los procedimientos de transferencia o luego del fracaso de un procedimiento de transferencia.35 Este procedimiento tienen una alta tasa de complicaciones. Glenn y Romeo comunican un 75% de complicaciones, como no unión, fractura de escápula, infección, trombosis venosas, lesiones de la pleura, neumonía y parálisis del plexo braquial, de las cuales un 22% requirió cirugía.34
Para evitar la no unión, Bizot y cols.35 recomiendan el procedimiento de Bunch y Siegel,33 utilizando dos alambres por costillas, incluir un mínimo de 4 costillas e inmovilizar por 3 meses. No detectaron no uniones cuando siguieron estos detalles técnicos.
Tanto para la fijación como para la fusión escapulo-torácica, es controvertida la correcta posición para colocar la escápula: si es fijada en posición de aducción, la función de la articulación glenohumeral será limitada y la abducción del hombro no mejorará con la cirugía. Si la escápula es posicionada en abducción, la abducción del hombro mejora, pero el hombro aparecerá excesivamente alto. Si la escápula es posicionada demasiado lateral perderá contacto con las costillas y, por lo tanto, perderá posibilidad de fijación; si la escápula es posicionada demasiado baja puede estirar los nervios del plexo braquial. Giannini y cols. la fijan en posición de 15°-20° entre el borde medial de la escápula y la línea interapófisis espinosas y no han detectado ninguna complicación neurovascular.32 Glenn y Romeo la fijan a 20°-30° y de 5 a 7 cm del polo inferior del omóplato a la línea interapofisaria espinosa.34
Buch y Siegel recomiendan que el polo inferior de la escápula esté a nivel de la séptima costilla y el borde vertebral de la escápula forme un ángulo no superior a los 20° con la línea interespinosa.33 La contraindicación absoluta a la fijación escapular es la lesión del nervio axilar o patología neuromuscular que incluya al deltoides, debido a que este es el principal motor del hombro cuando se anula la articulación escapulotorácica. Las contraindicaciones relativas de la fusión son la osteoporosis, el tabaquismo excesivo o la enfermedad respiratoria grave.34 Las transferencias tendinosas preservan la movilidad escapular intentando reproducir la anatomía, las más populares son aquellas en las que se utiliza el fascículo esternal del pectoral mayor con prolongación de la fascia o sin ella.21
En 1995, Post presenta la primera serie publicada de transferencia del fascículo esternal del pectoral mayor con aumento de fascia lata en 8 pacientes, con excelentes resultados en todos los casos a los 27 meses de seguimiento promedio.37 Conor y cols.38 confirman estos resultados con esta técnica en su serie de 11 pacientes. Similares resultados muestran Steimain y Wood51 en 9 casos. Warner y Navarro52 utilizan el semitendinoso y el recto interno para aumentar la transferencia, con el fin de evitar la secuela cicatricial sobre el muslo, con buenos resultados en 7 de 8 casos a los 32 meses de seguimiento promedio.
Sobre la base de estudios anatómicos, Povacz y Resch39 describen la transferencia del fascículo esternal al ángulo inferior de la escápula sin necesidad de alargar o utilizar injerto tendinoso. Stein y Murthi realizan este procedimiento directo con dos pequeñas incisiones sin inconvenientes, muestran una serie de 10 casos, con 3 pacientes que requirieron reforzar el tendón con tendón sintético (Graft Jacket, Wright Medical Technology).53
Tauber y cols. recientemente describen la desinserción del haz esternal del pectoral mayor unida a pequeños fragmentos óseos humerales e insertado en la parte inferior lateral de la escápula sin injerto tendinoso, y resaltan las ventajas de la fijación hueso-hueso de la transferencia. Comunican buenos resultados a los 96 meses de seguimiento promedio en 12 pacientes. Otro interesante detalle de estos autores es que evalúan el músculo transferido electromiográficamente y en resonancia magnética. Detectan que este presenta actividad eléctrica normal, con imagen del músculo transferido sin degeneración grasa o signos de atrofia muscular.54
Las principales objeciones para las transferencias tendinosas del pectoral mayor son: las cicatrices poco estéticas, la posible morbilidad del área dadora, como la hernia muscular; la pérdida del relieve anatómico del pectoral mayor cuando se lo utiliza completo, el riesgo de rotura o de elongación del injerto con una frecuencia que oscila entre el 0% y el 30%, la dificultad técnica de insertar el pectoral mayor sin refuerzo tendinoso.2
Steinman y Wood muestran que los resultados son buenos, pero menos buenos que los publicados por otros autores; comunican un 84% de elevación anterior, un 62% de rotación externa, un 59% de aducción, un 68% de abducción y un 73% de rotación interna con respecto al lado sano.51
Conclusión
La bibliografía no es concluyente sobre el tratamiento ideal para las lesiones del NTL. Es claro que ninguno de los procedimientos de fijación estática o dinámica aporta resultados óptimos cuando se compara la función con el miembro contralateral.
Las técnicas microquirúrgicas se presentan como el futuro de la reconstrucción, pero es demasiado pronto para dar resultados concluyentes.
La mejor técnica quirúrgica debe ser adaptada en cada caso particular, el tipo de procedimiento debe discutirse con el paciente. Cuando hay más de un músculo escapular comprometido, la elección del procedimiento deberá orientarse a las fijaciones escapulo-torácicas. En avulsiones C5-C6, la transferencia del nervio toracodorsal mejora la función global del hombro. Ante la sospecha de un síndrome compresivo a nivel de los escalenos o torácico, debe intentarse la neurólisis microquirúrgica del NTL .
Las transferencias tendinosas hoy parecen ser las alternativas más apropiadas en lesiones únicas del serrato con conservación de la movilidad; la transferencia del fascículo esternal del pectoral mayor es la técnica más elegida por los diferentes autores. La modificación propuesta sin aumento de fascia se presenta como la más seductora, porque evita la morbilidad de la toma de injerto, aunque técnicamente no es sencilla. La transferencia del redondo mayor propuesta por Merle es un procedimiento muy interesante cuando se desea realizar un gesto simple.
1. Narakas AO. Les atteintes paralytiques de la ceinture scapulohumérale et de la racine du membre. En: Tubiana R. Traité de chirurgie de la main. Masson; 1991:113-55. [ Links ]
2. Dumontier Ch, Soubeyran M, Lascar T, Laulan J. Compression du nerf thoracicus longus (Nerf de Charles-Bell). Chir Main 2004; 23S:63-76. [ Links ]
3. Horwitz MT, Tocantins LM. An anatomical study of the role of the long thoracic nerve and the related scapular bursae in the pathogenesis of local paralysis of the serratus anterior muscle. Anat Rec 1938;71:375-85. [ Links ]
4. Nath R, Lyons AB, Bietz G. Microneurolysis and decompression of long thoracic nerve injury are effective in reversing scapular winging: Long-term results in 50 cases. BMC Musculoskelt Disord 2007;8:25. [ Links ]
5. Bertelli JA, Ghizoni MF. Long thoracic nerve: anatomy and functional assessment. J Bone Joint Surg Am 2005;87(5):993-8. [ Links ]
6. Ebraheim NA, Lu J, Porshinsky B, Heck BE,Yeasting RA. Vulnerability of long thoracic nerve: an anatomic study. J Shoulder Elbow Surg 1998;7(5):458-61. [ Links ]
7. Hester P, Caborn DN, Nyland J. Cause of long thoracic nerve palsy: a possible dynamic fascial sling cause. J Shoulder Elbow Surg 2000;9(1):31-5. [ Links ]
8. Kauppila LI. The long thoracic nerve: possible mechanisms of injury based on autopsy study. J Shoulder Elbow Surg 1993;2:244-8. [ Links ]
9. Cuadros CL, Driscoll CLW, Rothkopf DM. The anatomy of the lower serratus anterior muscle: a fresh cadaver study. Plast Reconstr Surg 1995;95:93-7. [ Links ]
10. Lascar T, Laulan J. Intérêt de la neurolyse du nerf thoracique long dans les paralysies isolées du muscle serratus antérieur d'origine mécanique. Ann Orthop Ouest 2002;34:81-3. [ Links ]
11. Schultes G, Karcher H, Gaggl A, Anderhuber F. Anatomic basis of vascularized nerve graft using the long thoracic nerve. Surg Radiol Anat 1999;21(2):91-4. [ Links ]
12. Martin RM, Fish DE. Scapular winging: anatomical review, diagnosis, and treatments. Curr Rev Musculoskelet Med 2008;1:1- 11. [ Links ]
13. Gregg JR, Labosky D, Harty M, Lotke P, Ecker M, DiStefano V, Das M. Serratus anterior paralysis in the young athlete. J Bone Joint Surg 1979;61:825-32. [ Links ]
14. Zancolli E, Cozzi E. Plexo braquial (Topografía funicular de las partes indivisas y aplicaciones quirúrgicas). En: Atlas de anatomía quirúrgica de la mano. Buenos Aires: Editorial Médica Panamericana; 1993:652-60. [ Links ]
15. Hovelacque A. Anatomie des nerfs craniens et rachidiens et du systéme grand sympatique chez l'homme. Paris: Gaston Doin et Cie Editeurs; 1927:416. [ Links ]
16. Hamada J, Igarashi E, Akita K, Mochizuki T. A cadaveric study of the serratus anterior muscle and the long thoracic nerve. J Shoulder Elbow Surg 2008;17(5):790-4. [ Links ]
17. Coelho de Morais Faria CD, Fuscaldi Teixeira-Salmela L, Figueiredo Gomes P. Applicability of the coactivation method in assessing synergies of the scapular stabilizing muscles. J Shoulder Elbow Surg 2009;18:764-72. [ Links ]
18. Ludewig PM, Cook TM, Nawoczenski DA. Three-dimensional scapular orientation and muscle activity at selected positions of humeral elevation. J Orthop Sports Phys Ther 1996;24(2):57-65. [ Links ]
19. Ebaugh DD, McClure PW, Karduna AR. Three-dimensional scapulothoracic motion during active and passive arm elevation. Clin Biomech (Bristol, Avon) 2005;20(7):700-9. [ Links ]
20. Foo Cl, Swann M. Isolated paralysis of the serratus anterior. A report of 20 cases. J Bone Joint Surg Br 1983;65(5):522-56. [ Links ]
21. Kippe M, Nguyen D, Bigliani LU. Scapular winging secondary to trapezius and serratus anterior palsy: thoughts and current treatment options. Curr Opin Orthop 2007;18:369-72. [ Links ]
22. Wiater JM, Flatow EL. Long thoracic nerve injury. Clin Ortop Relat Res 1999;368:17-27. [ Links ]
23. Vastamaki M, Kauppila LI. Etiologic factors in isolated paralysis of serratus anterior muscle: a report of 197 cases. J Shoulder Elbow Surg 1993;2:240-3. [ Links ]
24. Kuhn JE, Plancher KD, Hawkins RJ. Scapular winging. J Am Acad Orthop Surg 1995;3:319-25. [ Links ]
25. Laulan J, Lascar T, Saint-Cast Y, Chammas M, Le Nen D. Isolated paralysis of the serratus anterior muscle successfully treated by surgical release of the distal portion of the long thoracic nerve. Chir Main 2011;30(2):90-6. [ Links ]
26. Uerpairojkit C, Leechavengvongs S, Witoonchart K, Malungpaishorpe K, Raksakulkiat R. Nerve transfer to serratus anterior muscle using the thoracodorsal nerve for winged Scapula in C5 and C6 brachial plexus root avulsions. J Hand Surg Am 2009;34:74-8. [ Links ]
27. Novak CB, Mackinnon SE. Surgical treatment of a long thoracic nerve palsy. Ann Thorac Surg 2002;73(5):1643-5. [ Links ]
28. Tomaino MM. Neurophysiologic and clinical outcome following medial pectoral to long thoracic nerve transfer for scapular winging: a case report. Microsurgery 2002;22(6):254-7. [ Links ]
29. Whitman A. Congenital elevation of the scapula and paralysis of serratus magnus muscle. JAMA 1932;99:1332-4. [ Links ]
30. Atasoy E, Majd M. Scapulothoracic stabilisation for winging of the scapula using strips of autogenous fascia lata. J Bone Joint Surg Br 2000;82:813-7. [ Links ]
31. Ketenjian AY. Scapulocostal stabilization for scapular winging in facioscapulohumeral muscular dystrophy. J Bone Joint Surg Am 1978;60:476-80. [ Links ]
32. Giannini S, Ceccarelli F, Faldini C, Pagkrati S, Merlini L. Scapulopexy of winged scapula secondary to facioscapulohumeral muscular dystrophy. Clin Orthop Relat Res 2006;449:288-94. [ Links ]
33. Bunch WH, Siegel IM. Scapulothoracic arthrodesis in facioscapulohumeral muscular dystrophy. Review of seventeen procedures with three to twenty-one-year follow-up. J Bone Joint Surg Am 1993;75:372-6. [ Links ]
34. Glenn Jr RE, Romeo A. Scapulothoracic arthrodesis: Indications and surgical technique. Tech Shoulder Elbow Surg 2005;6(3):178-87. [ Links ]
35. Bizot P, Teboul F, Nizard R, Sedel L. Scapulothoracic fusion for serratus anterior paralysis. J Shoulder Elbow Surg 2003;12:561-5. [ Links ]
36. Krishnan SG, Hawkins RJ, Michelotti JD, Litchfield R, Baxter Willis R, Kyu Kim Y. Scapulothoracic arthrodesis. Indication, technique, and results. Clin Orthop Relat Res 2005;435:126-33. [ Links ]
37. Post M. Pectoralis major transfer for winging of the scapula. J Shoulder Elbow Surg 1995;4:1-9. [ Links ]
38. Connor PM, Yamaguchi K, Manifold SG, Pollock RG, Flatow EL, Bigliani LU. Split pectoralis major transfer for serratus anterior palsy. Clin Orthop Relat Res 1997;341:134-42. [ Links ]
39. Povacz P, Resch H. Dynamic stabilization of winging scapula by direct split pectoralis major transfer: a technical note. J Shoulder Elbow Surg 2000;9:76-8. [ Links ]
40. Marmor L, Bechtol CO. Paralysis of the serratus anterior muscle due to electric shock relieved by transplantation of the pectoralis major muscle. J Bone Joint Surg Am 1963;45:156-60. [ Links ]
41. Galano GJ, Bigliani LU, Ahmand CS, Levine WN. Surgical treatment of winged scapula. Clin Orthop Relat Res 2008;466:652- 60. [ Links ]
42. Chaves JP. Pectoralis minor transplant for paralysis of the serratus anterior. J Bone Joint Surg Br 1951;33:228-30. [ Links ]
43. Vastamaki M. Pectoralis minor transfer in serratus anterior paralysis. Acta Orthop Scand 1984;55(3):293-5. [ Links ]
44. Hass J. Muskelplastik bei serratuslähmung. (Erstaz des gelähmten musculus serratus anterior durch den musculus teres major). Zeitschr Orthop Chir 1931;55:617-22. [ Links ]
45. Merle M. Scapula Alata. Symposium Institut de la Main: Paralytic disorder of the upper limb, May 2008, Paris. [ Links ]
46. Herzmark MH. Traumatic paralysis of the serratus anterior relieved by transplantation of the rhomboidei. J Bone Joint Surg Am 1951;33:235-8. [ Links ]
47. Velpeau A. Luxations de l'epaule. Arch Gen Med 1837;14:269-305. [ Links ]
48. Tubby AH. A case illustrating the operative treatment of paralysis of the serratus magnus muscle by muscle grafting. Br Med J 1904;2:1159-60. [ Links ]
49. Dickson FD. Fascial transplants in paralytic and other conditions. J Bone Joint Surg 1937;19:405-12. [ Links ]
50. Durman DC. An operation for paralysis of the serratus anterior. J Bone Joint Surg 1945;27:380-2. [ Links ]
51. Steinmann SP, Wood MB. Pectoralis major transfer for serratus anterior paralysis. J Shoulder Elbow Surg 2003;12(6):555-60. [ Links ]
52. Warner JJ, Navarro RA. Serratus anterior dysfunction. Recognition and treatment. Clin Orthop Relat Res 1998;349:139-48. [ Links ]
53. Stein JA, Murthi AM. Split pectoralis major transfer for serratus anterior palsy. Tech Shoulder Elbow Surg 2006;7(3):127-30. [ Links ]
54. Tauber M, Moursy M, Koller H, Schwartz M, Resch H. Direct pectoralis major muscle transfer for dynamic stabilization of scapular winging. J Shoulder Elbow Surg 2008;17:29-34. [ Links ]














