Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Asociación Argentina de Ortopedia y Traumatología
versión On-line ISSN 1852-7434
Rev. Asoc. Argent. Ortop. Traumatol. vol.82 no.1 Ciudad Autónoma de Buenos Aires mar. 2017
INVESTIGACIÓN CLÍNICA
Tomografía computarizada de doble energía: nueva tecnología para la reducción de artefactos de metal
Exequiel Reynoso, Patricia Carrascosa, Carlos Capuñay, Alejandro Rasumoff, Javier Vallejos, Jimena Carpio, Karen Lago
Diagnóstico Maipú, Buenos Aires
Dr. Exequiel Reynoso • reynoso.exequiel@gamail.com
Conflicto de intereses: Los autores no declaran conflictos de intereses.
Recibido el 26-11-2015.
Aceptado luego de la evaluación el 23-9-2016.
Resumen
Introducción: El objetivo fue explorar la utilidad de la tomografía computarizada de doble energía mediante tecnología de imágenes espectrales gemstone y de un programa destinado a la reducción de artefactos de metal (MARS), para evaluar tejidos periprotésicos, y la interpretabilidad diagnóstica de patologías relacionadas con implantes.
Materiales y Métodos: Se comparó la densidad ósea, de partes blandas y de grasa en el tejido periprotésico y en tejido de control sin implante, utilizando un escáner de alta definición de tomografía computarizada de doble energía tanto en imágenes policromáticas convencionales, como en monocromáticas virtuales con MARS, en 80 pacientes con prótesis metálicas en diversas regiones musculoesqueléticas. Se valoró la calidad de imagen y la interpretabilidad diagnóstica mediante la escala de Likert.
Resultados: Con imágenes policromáticas hubo diferencias significativas entre el área periprotésica en los tres tejidos respecto a los controles (p <0,0001); sin diferencias significativas utilizando imágenes espectrales monocromáticas virtuales-MARS (hueso p = 0,053, partes blandas p = 0,32 y grasa p = 0,13), con más similitud con el tejido normal. Los niveles de ruido fueron significativamente mayores con imágenes policromáticas (p <0,0001) que con imágenes espectrales monocromáticas virtuales-MARS. Se consideraron no interpretables todas las regiones periprotésicas en las imágenes policromáticas y 11 (9%) en las imágenes espectrales monocromáticas virtuales-MARS. No hubo diferencias significativas en la dosis de radiación comparada con la del grupo control (p = 0,21).
Conclusiones: La tomografía computarizada de doble energía puede reducir los artefactos periprotésicos, logrando un significativo incremento en la capacidad de identificar tejidos y la interpretabilidad diagnóstica de posibles patologías relacionadas con implantes.
Palabras clave: Implante; Prótesis; Imágenes espectrales; Diagnóstico.
Nivel de Evidencia: II
Abstract
Dual-energy computed tomography: new technology for metal artifacts reduction
Introduction: To explore the usefulness of dual energy imaging using gemstone spectral imaging technology and a dedicated software for metal artifact reduction (MARS) for the evaluation of periprosthetic tissues, and to assess image interpretability of implant-related complications.
Methods: Signal density measurements were performed in periprosthetic and remote (control) areas in bone, soft tissue, and fat among 80 patients using a high definition scanner. Polychromatic images and virtual monochromatic spectral images with MARS were obtained, and image quality and diagnostic interpretability were evaluated using a Likert scale.
Results: Using polychromatic images, the periprosthetic area showed significant differences compared to the remote areas among the three tissue explored (p<0.0001 for all); with no significant differences using virtual monochromatic spectral images-MARS (bone p=0.053, soft tissue p=0.32, fat p=0.13), suggesting similar signal density compared to normal (remote) tissue. Furthermore, periprosthetic polychromatic image noise levels were significantly higher than with virtual monochromatic spectral images-MARS (p<0.0001). All periprosthetic areas were deemed non-interpretable using polychromatic images, compared to 11 (9%) using virtual monochromatic spectral images-MARS. There were no differences in radiation dose compared to control group (p=0.21).
Conclusions: Virtual monochromatic spectral images-MARS technology has the ability to reduce periprosthetic artifacts, achieving a significant increase to identify tissues and diagnostic interpretability of complications related to the implants.
Key words: Implant; Prosthesis; Spectral images; Diagnosis.
Level of Evidence: II
Introducción
La tomografía computarizada desempeña un papel muy importante en la evaluación de los pacientes con prótesis metálicas, y es de vital importancia para el profesional tratante en el seguimiento posquirúrgico y de posibles complicaciones. Sin embargo, aún no se ha podido eludir uno de los principales problemas relacionados con esta técnica: los artefactos periprotésicos generados por los implantes metálicos.1 En este sentido, el reciente desarrollo de equipos de tomografía computarizada de doble energía (TCDE) permite la síntesis de imágenes espectrales monocromáticas virtuales (IEMV) que tienen la capacidad de mostrar al objeto como si fuera estudiado por tomógrafos convencionales (de energía simple), pero cuentan con el potencial de reducir artefactos periprotésicos mejorando la interfase entre tejidos.2-7 Se han desarrollado también otros enfoques con el fin de afrontar esta problemática, como el uso de algoritmos de reconstrucción iterativa estadística adaptativa (adaptive statistical iterative reconstruction, ASIR)8-10 y de programas específicamente diseñados para la reducción de artefactos de metal (metal artifact reduction software, MARS).11,12
No se registran estudios que comuniquen el rendimiento combinado de estas técnicas para la evaluación cuantitativa de tejidos periprotésicos mediante valores densitométricos. Por lo tanto, exploramos la utilidad de la TCDE de fuente única en combinación con el MARS y la ASIR desarrollados por la misma tecnología. El objetivo fue valorar la reducción de artefactos en el área periprotésica y la interpretabilidad diagnóstica de eventuales patologías relacionadas con los implantes.
Materiales y Métodos
Diseño y población del estudio
Se reclutaron pacientes consecutivos, de forma prospectiva, remitidos para la evaluación posquirúrgica de prótesis metálicas en diferentes regiones anatómicas del sistema osteoarticular, entre marzo de 2013 y junio de 2015. Las imágenes fueron adquiridas, al menos, 15 días después del procedimiento quirúrgico, según el requerimiento y la indicación clínica. Se excluyeron mujeres con sospecha o confirmación de embarazo y pacientes con un índice de masa corporal >32 kg/m2.
Adquisición de las imágenes
Los pacientes fueron examinados utilizando un escáner de 64 filas de detectores de doble energía (DiscoveryTM HD 750, GE Healthcare, Milwaukee, EE.UU.) que permite la generación de IEMV para su análisis. El procesamiento de los datos obtenidos se realizó fuera de línea, en una estación de trabajo equipada con un programa específico disponible en el mercado (AW 4.6, GE Healthcare, Milwaukee, EE.UU.). Las imágenes inicialmente adquiridas con este tipo de escáner brindan, además de la información monocromática (IEMV), información policromática (IP) similar a la obtenida con tomógrafos convencionales de energía simple, lo que hace posible un análisis comparable; por lo tanto, se utilizaron en su representación, para evitar volver a examinar al paciente (Figura 1).4,13
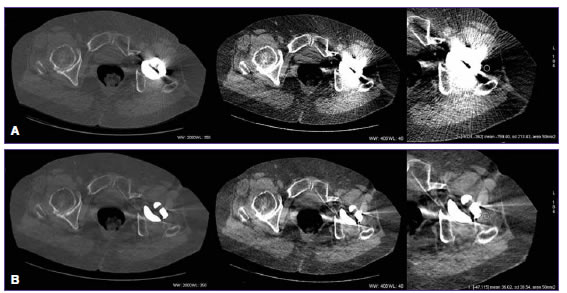
Figura 1. Hombre de 71 años con reemplazo de cadera izquierda. Tomografía computarizada de doble energía en plano axial. A. Imágenes policromáticas con ajuste de la ventana para la evaluación del tejido óseo (primer panel superior) y de partes blandas (segundo panel superior). Región de interés de 50 mm2 para medir la densidad del tejido dentro del componente de baja atenuación del artefacto relacionado con el implante (tercer panel superior). B. Mismo procedimiento con imágenes monocromáticas espectrales (IEMV-MARS). Nótese una reducción significativa de los artefactos.
En todos los casos, se realizaron reconstrucciones para obtener IEMV con nivel energético elevado (140 keV) en combinación con el MARS desarrollado por la misma tecnología (Figura 1), ya que se ha observado que las IEMV con mayores niveles energéticos son las que mejor atenúan los artefactos metálicos.6,14,15 Asimismo, siempre se aplicó la ASIR a los datos crudos obtenidos al 50%, porque se ha observado que esta tecnología puede mejorar la calidad de imagen y así facilitar el uso de menores dosis de radiación.8-10
Análisis cuantitativo de las imágenes
Los datos imagenológicos fueron analizados en la misma estación de trabajo donde se procesaron las imágenes. Se evaluó la detección de tres tipos de tejidos elementales adyacentes a la prótesis, en el sitio de los artefactos, mediante la colocación de regiones de interés para efectuar mediciones en unidades Hounsfield: óseo, partes blandas y grasa (Figura 1). Como componente de partes blandas se consideraron los tejidos muscular, fibrocicatrizal, parenquimatoso y otros de densidad similar, como el tejido inflamatorio.
El artefacto periprotésico se definió como aquel que se produce cuando el haz de rayos X o porciones del haz pasan a través de ciertos objetos, como los metales, y muestran un comportamiento diferente cuando pasan por el mismo objeto en distintas posiciones del tubo generador de los rayos X, lo que se traduce en rayas negras (componente de baja atenuación) y brillantes (componente de alta atenuación).4 Las evaluaciones periprotésicas se efectuaron en los sitios de mayor artefacto, definidos como aquellos donde se proyecta el componente de más baja atenuación del artefacto (rayas negras) (Figura 1). También, se evaluó, de la misma manera, la desviación estándar de cada medición para calcular el ruido de la imagen y la relación señal/ruido. Este procedimiento se efectuó en cada paciente, en el mismo sitio, para los tres tejidos, tanto en las IP, como en IEMV-MARS. El mismo procedimiento se llevó a cabo en los mismos pacientes, en el sitio contralateral sin prótesis (grupo control). Cuando los pacientes tenían prótesis bilateral (como en el caso de caderas) o no era posible obtener datos en el sitio contralateral, las mediciones se tomaron en el sitio anatómico próximo con características similares a las de los tejidos no afectados por el artefacto (como la pelvis). En los casos que involucraron la columna, se obtuvieron mediciones en los niveles vertebrales próximos sin prótesis ni artefactos.
Se estimó también la dosis de radiación efectiva suministrada utilizando el factor de corrección para cada área anatómica sugerido por estándares internacionales.16 Como grupo de control para este análisis, se utilizó un grupo de igual número de pacientes, pareados por sexo y edad, que fueron evaluados por otras causas mediante exámenes de las mismas áreas anatómicas, empleando el mismo escáner con IP convencionales.
Análisis cualitativo de las imágenes
Se analizó la calidad de imagen de cada uno de los tejidos estudiados dentro del área del artefacto, así como la interpretabilidad diagnóstica del estudio en conjunto (Figura 2).
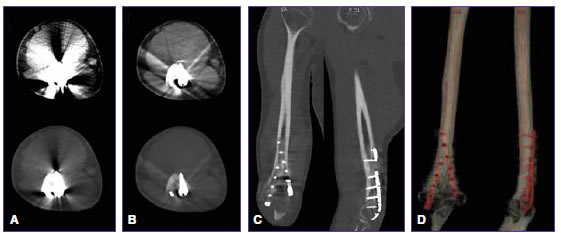
Figura 2. Hombre de 26 años con antecedente de fractura en la extremidad distal del húmero derecho, tratado mediante placas de fijación con tornillos. Tomografía computarizada de doble energía. A. Imágenes axiales convencionales que muestran importantes artefactos con deterioro periprotésico que imposibilita valorar los tejidos adyacentes, tanto con ventana para valoración de tejido de partes blandas (panel superior) como de tejido óseo (panel inferior). B. Imágenes axiales monocromáticas virtuales con MARS que reducen significativamente los artefactos, lo que permite una mejor valoración del tejido óseo (panel inferior), las partes blandas y el tejido graso (panel superior) periprotésico. C. Imagen monocromática en planos coronal y sagital, y tridimensional (D), que permite una adecuada valoración de la disposición de las placas y los tornillos de fijación.
La calidad de imagen se evaluó mediante una escala de tipo Likert de seis puntos (Tabla 1): 1) total invisibilidad de estructuras oscurecidas por los artefactos, 2) severos artefactos con identificación insuficiente de estructuras anatómicas, 3) moderados artefactos con identificación insuficiente de estructuras cercanas a la prótesis, 4) moderados artefactos que permiten identificar las estructuras anatómicas y los tejidos, 5) artefactos leves con adecuada identificación de estructuras anatómicas y tejidos, 6) tejido normal sin artefactos. Siempre se utilizaron la misma amplitud y el nivel de ventana prestablecidos para la visualización de tejido óseo (nivel = 350, amplitud = 2000) y de partes blandas (nivel = 40, amplitud = 400), en la misma imagen axial tanto en IP como IEMV-MARS.
Tabla 1. Análisis de la calidad de imagen en cada tejido examinado, interpretabilidad diagnóstica y tasa de estudios no diagnósticos

La interpretabilidad diagnóstica se evaluó por consenso de dos observadores experimentados (CC y ER) mediante una escala de tipo Likert de cinco puntos, midiendo la capacidad de identificación de imágenes consideradas patológicas (Tabla 1), a criterio del observador y visualizando todo el examen: 1) total invisibilidad de estructuras oscurecidas por los artefactos, 2) calidad de imagen deteriorada debido a los artefactos que impiden su evaluación apropiada, 3) subóptima, reducción de la calidad de imagen debido a los artefactos, pero suficiente para realizar una aproximación diagnóstica, 4) bueno, presencia de leves artefactos, leve ruido en la imagen, con adecuada distinción de las estructuras anatómicas y patológicas, 5) excelente, ausencia o mínimos artefactos, con excelente delimitación de las estructuras anatómicas periprotésicas y de los hallazgos anormales, sin inconvenientes para la determinación diagnóstica, similar a las imágenes sin prótesis.
Como análisis post hoc prespecificado, se llevó a cabo un análisis discriminado según las diferentes áreas anatómicas estudiadas, agrupadas en cinco regiones: cadera, rodilla, huesos largos, columna y otras regiones. Todos los procedimientos se efectuaron según los estándares de ética del Comité de investigación institucional y en cumplimiento con la declaración de Helsinki de 1964 y sus adendas posteriores. Se obtuvo el consentimiento informado escrito de todas las personas incluidas en el estudio.
Análisis estadístico
Las variables categóricas se expresaron como cuentas y porcentajes; y las variables continuas, como media ± desviación estándar (DE) en caso de distribución normal y como mediana con rango intercuartil (RIC) para las variables de distribución anormal. Las comparaciones no paramétricas entre grupos se realizaron mediante pruebas de rango con signo de Wilcoxon. El nivel de significación estadística se estableció en p <0,05. Se utilizó el programa de estadística SPSS, versión 22.0 (Chicago, Illinois, EE.UU .).
Resultados
De los 87 pacientes evaluados inicialmente, cuatro fueron excluidos, porque los parámetros de adquisición del examen fueron diferentes de los prestablecidos, y tres, porque los parámetros de reconstrucción y procesamiento fueron inadecuados. Por lo tanto, 80 pacientes completaron todo el protocolo y fueron incluidos en el análisis. La mediana de la edad fue de 63.5 (RIC 41.0-73.8) y 32 (40%) pacientes eran hombres. De todas las regiones examinadas, 23 (29%) fueron caderas; 14 (18%), rodillas; 16 (20%), columna vertebral; ocho, huesos largos (10%; húmero, fémur, cúbito y radio, tibia y peroné) y 19 (24%), otras regiones (hombro, codo, mano y muñeca, tobillo y pie, clavícula, esternón, costilla y cráneo).
Análisis cuantitativo de las imágenes
Tejido óseo: En el total de las regiones estudiadas, se registraron diferencias significativas entre las mediciones en unidades Hounsfield periprótesis comparadas con el tejido de control (contralateral) en las reconstrucciones de IP (p <0,0001), mientras que no se registraron diferencias significativas en IEMV-MARS (p = 0,053). El ruido de la imagen fue menor en IEMV-MARS que en IP (Tabla 2).
Tabla 2. Análisis de tejido óseo

Partes blandas: También se registraron diferencias significativas en cuanto a los niveles de atenuación entre prótesis y controles en el grupo IP (p <0,0001), sin diferencias en el grupo IEMV-MARS (p = 0,32). El ruido de la imagen también fue menor en IEMV-MARS que en IP (Tabla 3, Figura 1).
Tabla 3. Análisis de partes blandas

Tejido graso: Se observaron diferencias significativas en los niveles de densidad entre prótesis y controles en el grupo de IP (p <0,0001), sin diferencias significativas en el grupo de IEMV-MARS (p = 0,13). El ruido de las imágenes también fue menor en IEMV-MARS (Tabla 4).
Tabla 4. Análisis de tejido graso

Análisis cualitativo de las imágenes
Evaluación de la calidad de imagen
La calidad de imagen fue significativamente mejor en las reconstrucciones IEMV-MARS, en tejido óseo (IP 1,58 ± 0,8 e IEMV-MARS 3,39 ± 0,9; p <0,0001), partes blandas (IP 1,38 ± 0,7 e IEMV-MARS 3,55 ± 1,0; p <0,0001) y tejido graso (IP 1,80 ± 0,9 e IEMV-MARS 3,70 ± 1,0; p <0,0001) (Tabla 1, Figura 3).
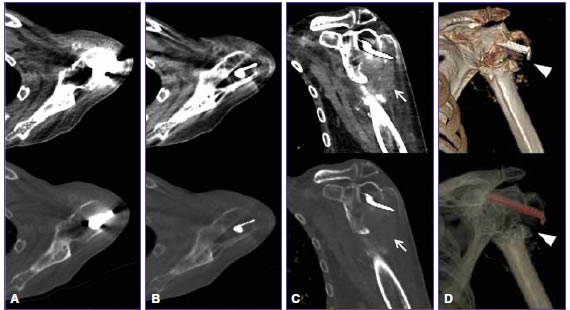
Figura 3. Hombre de 87 años con antecedente de fractura de la extremidad proximal del húmero izquierdo, postratamiento quirúrgico. Tomografía computarizada de doble energía. A. Imágenes axiales policromáticas que muestran artefactos periprotésicos que dificultan seriamente la evaluación de la región del hombro. B y C. Imágenes monocromáticas virtuales con MARS en planos axial y coronal oblicuo, que reducen significativamente los artefactos y ponen en evidencia la fractura con desprendimiento epifisario y signos de resorción ósea y tejido de granulación/fibrosis asociado. D. Imágenes tridimensionales resultantes de los datos monocromáticos virtuales que ponen claramente en evidencia la fractura y la disposición del elemento protésico.
Evaluación de la interpretabilidad diagnóstica
Todos los casos examinados mediante reconstrucciones con IP fueron considerados no interpretables, comparados con solo 11 (9%) en IEMV-MARS (p <0,0001) (Tabla 1, Figura 4).
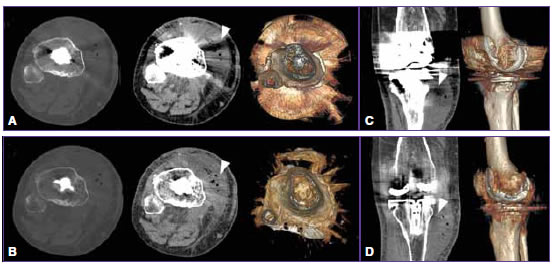
Figura 4. Hombre de 70 años con artroplastia de rodilla derecha. Tomografía computarizada de doble energía. A. Imágenes policromáticas convencionales con ventana para la valoración ósea (primer panel) y de partes blandas (segundo panel), donde se observa un artefacto (punta de flecha) que deteriora la imagen sobre el sector anterolateral interno de la articulación. También se visualiza una imagen tridimensional en vista inferior (tercer panel) afectada por los artefactos. B. Importante reducción de los artefactos que pone en evidencia una colección periarticular con pequeñas imágenes de densidad aérea, probablemente por proceso infeccioso/inflamatorio. Imagen tridimensional (tercer panel) con franca reducción de los artefactos. C. Imagen coronal policromática y tridimensional que muestra los artefactos sobre la colección mencionada (punta de flecha). D. Imagen coronal monocromática con MARS y tridimensional resultante, igualmente con franca reducción de los artefactos y mejoría de la calidad de imagen.
Dosis de radiación efectiva No se observaron diferencias significativas en la dosis de radiación efectiva entre la población estudiada y el grupo de control con imágenes convencionales de energía simple (IP) [mediana 4,7 mSv, RIC 0,50; 7,44) frente a 3,6 mSv (RIC 0,30; 6,54); p = 0,21].
Discusión
Nuestra investigación describe la capacidad de la tecnología de TCDE para la reducción de artefactos relacionados con implantes metálicos tanto en forma subjetiva como objetiva, con niveles de densidad del tejido periprotésico comparables a aquellos del tejido contralateral normal del mismo paciente. Nuestros resultados sugieren que tanto en el tejido óseo, las partes blandas y el tejido graso periprotésico, las IEMV-MARS reducen significativamente los artefactos comparadas con las obtenidas con escáneres convencionales de energía simple (Figuras 2-4), sin diferencias significativas en los niveles de atenuación respecto de los controles, en ninguno de los tres tipos de tejidos estudiados (Tablas 2-4). Es importante mencionar que esta estrategia no implica un incremento de las dosis de radiación.
Lee y cols. describieron en 26 individuos que la IEMVMARS es particularmente sensible a la composición, la forma y el tamaño de la prótesis, que también pueden influir en la calidad de la imagen;14 estas circunstancias también fueron comunicadas en otras investigaciones utilizando tecnologías similares.6,7,12,15,17,18 En nuestro trabajo, observamos, en algunas áreas anatómicas específicas, una leve heterogeneidad en el tejido periprotésico, en sitios diferentes del original del artefacto, al que denominamos "artefacto secundario" (Figura 5). Una de las ventajas del sistema de energía doble es la posibilidad de obtener IEMV sin MARS, que también ha demostrado reducir los artefactos originales observados con IP sin generar artefactos secundarios, y contar, al mismo tiempo, con las IEMV-MARS (Figura 5).3,4,6,7,13 De este modo, se generaría un efecto incremental para la evaluación integral del paciente (interpretabilidad diagnóstica), ya que el observador puede contar con todos los conjuntos de datos disponibles de ese examen, elemento fundamental en la valoración posoperatoria de pacientes con sospecha de complicaciones relacionadas con el implante, como aflojamiento aséptico, resorción ósea u osteólisis, infección, luxación y fractura ósea periprotésica.19 En este sentido, la aproximación diagnóstica fue superior con IEMV-MARS que con IP: solo un 11% de los pacientes con IEMV-MARS tuvieron datos insuficientes para el diagnóstico, mientras que ninguno de los tejidos periprotésicos en IP fue considerado interpretable.
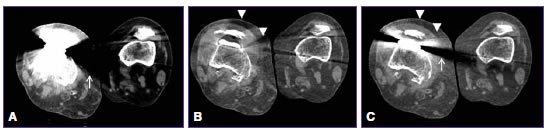
Figura 5. Mujer de 65 años con artroplastia de rodilla derecha. Tomografía computarizada de doble energía en plano axial. A. Imagen policromática con ajuste de la ventana para la evaluación de partes blandas, donde se observa importante artefacto que deteriora la calidad de la imagen (flecha blanca). B. Mismo nivel de corte y plano que muestra una imagen monocromática espectral con MARS con significativa reducción de los artefactos, se observa un artefacto secundario (punta de flecha) sobre el sector anterior de la articulación. C. Imagen monocromática virtual sin MARS donde se observa igualmente la reducción de los artefactos (aunque en menor medida), sin artefactos adicionales.
Limitaciones
Cabe reconocer algunas limitaciones. No se incluyeron datos quirúrgicos ni artroscópicos. Tampoco se estudió la variabilidad de los artefactos relacionada con el material, el tamaño y la superficie de la prótesis, ni de los diferentes niveles energéticos dentro del sistema de TCDE; aunque se tuvieron en cuenta las observaciones hechas por investigaciones anteriores.
Conclusiones
En este estudio prospectivo, la tecnología de TCDE demostró la capacidad de reducir los artefactos metálicos y de mejorar la interpretabilidad diagnóstica del tejido periprotésico osteoarticular comparada con las imágenes convencionales.
1. Barrett JF, Keat N. Artifacts in CT: recognition and avoidance. Radiographics 2004;24:1679-1691. [ Links ]
2. Matsumoto K, Jinzaki M, Tanami Y, Ueno A, Yamada M, Kuribayashi S. Virtual monochromatic spectral imaging with fast kilovoltage switching: improved image quality as compared with that obtained with conventional 120-kvp CT. Radiology 2011;259:257-262. [ Links ]
3. Bamberg F, Dierks A, Nikolaou K, Reiser MF, Becker CR, Johnson TR. Metal artifact reduction by dual energy computed tomography using monoenergetic extrapolation. Eur Radiol 2011;21:1424-1429. [ Links ]
4. Pessis E, Campagna R, Sverzut JM, Bach F, Rodallec M, Guerini H, et al. Virtual monochromatic spectral imaging with fast kilovoltage switching: reduction of metal artifacts at CT. Radiographics 2013;33:573-583. [ Links ]
5. Mangold S, Gatidis S, Luz O, Konig B, Schabel C, Bongers MN, et al. Single-source dual-energy computed tomography: use of monoenergetic extrapolation for a reduction of metal artifacts. Invest Radiol 2014;49:788-793. [ Links ]
6. Wang Y, Qian B, Li B, Qin G, Zhou Z, Qiu Y, et al. Metal artifacts reduction using monochromatic images from spectral CT: Evaluation of pedicle screws in patients with scoliosis. Eur J Radiol 2013;82:e360-366. [ Links ]
7. Meinel FG, Bischoff B, Zhang Q, Bamberg F, Reiser MF, Johnson TR. Metal artifact reduction by dual-energy computed tomography using energetic extrapolation: A systematically optimized protocol. Invest Radiol 2012;47:406-414. [ Links ]
8. Nakamoto A, Kim T, Hori M, Onishi H, Tsuboyama T, Sakane M, et al. Clinical evaluation of image quality and radiation dose reduction in upper abdominal computed tomography using model-based iterative reconstruction; comparison with filtered back projection and adaptive statistical iterative reconstruction. Eur J Radiol 2015;84:1715-1723. [ Links ]
9. Morsbach F, Bickelhaupt S, Wanner GA, Krauss A, Schmidt B, Alkadhi H. Reduction of metal artifacts from hip prostheses on ct images of the pelvis: Value of iterative reconstructions. Radiology 2013;268:237-244. [ Links ]
10. Zhu Z, Zhao XM, Zhao YF, Wang XY, Zhou CW. Feasibility study of using gemstone spectral imaging (GSI) and adaptive statistical iterative reconstruction (ASIR) for reducing radiation and iodine contrast dose in abdominal CT patients with high BMI values. PloS One 2015;10:e0129201. [ Links ]
11. Han SC, Chung YE, Lee YH, Park KK, Kim MJ, Kim KW. Metal artifact reduction software used with abdominopelvic dualenergy CT of patients with metal hip prostheses: assessment of image quality and clinical feasibility. AJR Am J Roentgenol 2014;203(4):788-795. [ Links ]
12. Schwahofer A, Bar E, Kuchenbecker S, Grossmann JG, Kachelriess M, Sterzing F. The application of metal artifact reduction (MAR) in CT scans for radiation oncology by monoenergetic extrapolation with a DECT scanner. Z Med Phys 2015;25(4): 314-325. [ Links ]
13. Jia Y, Zhang J, Fan J, Li C, Sun Y, Li D, Xiao X. Gemstone spectral imaging reduced artifacts from metal coils or clips after treatment of cerebral aneurysms: a retrospective study of 35 patients. Br J Radiol 2015;88(1055):2015-2022. [ Links ]
14. Lee YH, Park KK, Song HT, Kim S, Suh JS. Metal artefact reduction in gemstone spectral imaging dual-energy ct with and without metal artefact reduction software. Eur Radiol 2012;22:1331-1340. [ Links ]
15. Lewis M, Reid K, Toms AP. Reducing the effects of metal artefact using high keV monoenergetic reconstruction of dual energy CT (DECT) in hip replacements. Skeletal Radiol 2013;42:275-282. [ Links ]
16. European guidelines on quality criteria for computed tomography. Disponible en: http://www.Drs.Dk/guidelines/ct/quality/index.Htm. (Consulta: abril 2016). [ Links ]
17. Guggenberger R, Winklhofer S, Osterhoff G, Wanner GA, Fortunati M, Andreisek G, et al. Metallic artefact reduction with monoenergetic dual-energy CT: systematic ex vivo evaluation of posterior spinal fusion implants from various vendors and different spine levels. Eur Radiol 2012;22:2357-2364. [ Links ]
18. Schneider D, Apfaltrer P, Sudarski S, Nance JW, Jr., Haubenreisser H, Fink C, et al. Optimization of kiloelectron volt settings in cerebral and cervical dual-energy CT angiography determined with virtual monoenergetic imaging. Acad Radiol 2014;21: 431-436. [ Links ]
19. Liu PT, Pavlicek WP, Peter MB, Spangehl MJ, Roberts CC, Paden RG. Metal artifact reduction image reconstruction algorithm for CT of implanted metal orthopedic devices: a work in progress. Skeletal Radiol 2009;38:797-802. [ Links ]














