Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Asociación Argentina de Ortopedia y Traumatología
versión On-line ISSN 1852-7434
Rev. Asoc. Argent. Ortop. Traumatol. vol.82 no.4 Ciudad Autónoma de Buenos Aires dic. 2017
INVESTIGACIÓN BÁSICA
Seudoartrosis atrófica. Efecto de la aplicación de ondas de choque extracorpóreas en un modelo experimental en tibia de conejos
Jorge J. del Vecchio,* Marcos Galli Serra,** Rafael Martínez Gallino,
*Sección Pie y Tobillo, Fundación Favaloro, Ciudad Autónoma de Buenos Aires
**Servicio de Ortopedia y Traumatología, Hospital Universitario Austral, Buenos Aires
#Centro de Ortopedia y Traumatología, Sanatorio Allende, Córdoba
##Laboratorio de Patología Ortopédica, Ciudad Autónoma de Buenos Aires
Dr. Jorge J. del Vecchio • javierdv@mac.com
Conflicto de intereses: Los autores no declaran conflictos de intereses.
Recibido el 26-3-2017.
Aceptado luego de la evaluación el 17-6-2017
Resumen
Introducción: Los efectos de las ondas de choque extracorpóreas se han investigado en osteoblastos humanos, focos fracturarios, seudoartrosis y células periósticas. Los mejores resultados del tratamiento de la seudoartrosis con ondas de choque extracorpóreas se han documentado para seudoartrosis hipertróficas. El objetivo de este estudio fue investigar el efecto de la terapia con ondas de choque extracorpóreas sobre un foco de seudoartrosis “atrófica” generado en tibia de conejo.
Métodos: Se establecieron tres grupos: A, fracturados sometidos a ondas de choque extracorpóreas; B (“control”), fracturados no sometidos a ondas de choque y C, no fracturados (pierna derecha). Se trataron 37 conejos (cuniculus NV) blancos y esqueléticamente maduros de Nueva Zelanda. Se practicó la cauterización del periostio con electrobisturí bipolar en una extensión de 20 mm, en ambos muñones óseos (proximal y distal). Luego se aplicaron ondas de choque extracorpóreas en una sola sesión. Se realizaron tinciones con hematoxilina-eosina. Se efectuó el análisis biomecánico con un método de carga a “3 puntos”. Se estudiaron la carga máxima aplicada y el módulo de elasticidad para cada grupo.
Resultados: El estudio histológico permitió registrar signos de consolidación –callo fracturario perióstico y endostal– considerablemente mayores en las tibias de los animales del grupo A (tratado con ondas de choque extracorpóreas) que en las del grupo B “control”.
Conclusión: En un modelo experimental original de seudoartrosis atrófica generada por electrocauterización en tibia de conejos, se registraron cambios significativos radiográficos e histológicos luego de la intervención del foco mediante ondas de choque extracorpóreas.
Palabras clave: Seudoartrosis; Ondas de choque extracorpóreas; Tibia; Conejo.
Nivel de Evidencia: II
Abstract
Atrophic pseudoarthrosis. Effect of extracorporeal shock waves application in an experimental model in tibia of rabbits
Introduction: The effects of extracorporeal shock wave therapy (ESWT) have been investigated in human osteoblasts, fracture foci, nonunion and periosteum cells. The best results of nonunion treatment with ESWT have been documented for hypertrophic type. The objective of this study was to investigate the effects of ESWT in an atrophic nonunion focus generated in a rabbit tibia model.
Methods: Three groups were included: A, fractures receiving ESWT; B (“control”), fractures not receiving ESWT, and C, no fractures (right leg). A total of 37 New Zealand white and skeletally mature rabbits (cuniculus NV) were treated. Periosteum was cauterized using bipolar electrocautery at 20 mm in both bone stumps (proximal and distal). Then ESWT was applied in one session. Staining with hematoxylin-eosin was used. A biomechanical analysis with a 3-point loading system was performed. Maximum load and elastic modulus were evaluated in each group.
Results: Histological study evidenced signs of union (periosteal and endosteal fracture callus) which were considerably larger in tibias of Group A (treated with ESWT) as compared to the control group (Group B).
Conclusion: In an experimental model of atrophic pseudarthrosis caused by electrocautery in tibias of rabbits, significant radiographic and histological changes were observed after focus intervention with the application of ESWT.
Key words: Pseudarthrosis; Extracorporeal shock waves; Tibia; Rabbit.
Level of Evidence: II
Introducción
Los modelos experimentales empleados habitualmente para generar seudoartrosis se han basado en: a) la inestabilidad focal por macromovimiento,1 b) la diastasis interfragmentaria2- 5 y c) la interposición focal.6 El modelo de seudoartrosis en roedores fundamentado en la cauterización parafocal7 remeda las características de una seudoartrosis “atrófica”. Los efectos de las ondas de choque extracorpóreas (OCEC) se han investigado en: osteoblastos humanos,8 focos fracturarios,9 seudoartrosis10 y células periósticas.11 Los mejores resultados del tratamiento de la seudoartrosis con OCEC se han documentado para seudoartrosis “hipertróficas”.11-13 El objetivo de este estudio fue investigar el efecto de la terapia con OCEC sobre un foco de seudoartrosis “atrófica” generado en tibia de conejo.
Materiales y Métodos
El Comité de Investigación del Hospital Universitario Austral aprobó la realización de este estudio. Se establecieron tres grupos dispuestos de la siguiente manera: a) Grupo A: fracturados sometidos a OCEC b) Grupo B (“control”): fracturados no sometidos a OCEC c) Grupo C: no fracturados (pierna derecha)
Preparación del animal
Se trataron 37 conejos (cuniculus NV) blancos y esqueléticamente maduros de Nueva Zelanda, todas hembras, con un peso promedio de 2600 g y 2 meses de vida. Todos los procedimientos se realizaron bajo anestesia general utilizando ketamina (22 mg/kg); la preanestesia se efectuó con midazolam (2 mg/kg) y atropina (0,04 mg/kg). Toda la medicación fue administrada por vía intramuscular.
Intervención sobre el foco
Se realizó una exposición quirúrgica longitudinal anterior de la pierna izquierda, y se practicó una osteotomía transversal mediodiafisaria de tibia mediante hoja de corte de 10 mm de ancho accionada por sierra oscilante (Stryker NR). A continuación, se procedió a la cauterización del periostio con electrobisturí bipolar en una extensión de 20 mm, en ambos muñones óseos (proximal y distal). Se realizó la osteosíntesis intramedular mediante clavija de extremo agudo y no roscado de 2,5 mm de diámetro implantada por vía retrógrada. El protocolo de profilaxis antibiótica incluyó ciprofloxacina (5 mg/kg) durante 48 h después de la cirugía. Se administró ketorolac (2 mg/kg) como analgésico. Los especímenes fueron mantenidos en condiciones que cumplen patrones de recomendación internacional para la experimentación animal in vivo (asistencia veterinaria, jaulas individuales, temperatura y humedad constantes, alimentación, bebida y limpieza diarias).
Evaluación radiográfica
A las 2, 4, y 10 semanas de posoperatorio, se tomaron radiografías con incidencias frontal y lateral (Figura 1) de la pierna estudiada, con inclusión de la rodilla y el tobillo utilizando un equipo GE Compax y chasis Kodak minR2000 con placa mamográfica de doble emulsión. Se documentaron: a) la alineación, b) la eventual aparición de signos de movilidad del foco, c) la morfología focal (y su eventual aspecto hipertrófico) y d) el comportamiento morfológico del periostio.
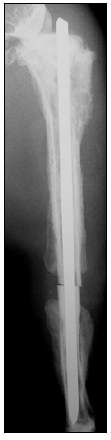
Figura 1. Radiografía de perfil de tibia. Seudoartrosis atrófica experimental.
Evaluación histológica
A la décima semana de la osteotomía, se sacrificó a los animales mediante una inyección de fenobarbital sódico y se enviaron tres muestras para el estudio histológico. Las piezas fueron fijadas en formaldehído al 10% V/V tamponado a pH 7,0 con buffer de fosfatos (Biopur Diagnostics, Argentina) y teñidas con hematoxilina-eosina. Las muestras fueron analizadas por un mismo observador, experto en Anatomía Patológica del sistema musculoesquelético, quien desconocía el origen y el tratamiento de las muestras analizadas.
Aplicación de la onda de choque
Los animales fueron distribuidos en grupos, en forma aleatorizada, utilizando sobres previamente cerrados y sellados. Considerando que la intervención fue ciega para el investigador, la modalidad de establecer la asignación a los grupos A o B fue el método de “bloques permutados”. Los animales del grupo A fueron sometidos a neuroleptoanestesia con midazolam durante la sesión. Las OCEC se aplicaron en una sola sesión con un generador de ondas de choque Healthec SRL Modelo HTL’ XXI, con sistema radioscópico de centrado del impacto. Se aplicaron 2000 impactos de OCEC a 10 kV de intensidad. La distribución topográfica fue aplicada, en forma simétrica, en ambos extremos (proximal y distal) del foco fracturario de la tibia intervenida y en los correspondientes límites de inserción del muñón perióstico (Figura 2). Cuatro especímenes fueron excluidos de las OCEC, porque presentaban signos radiográficos de consolidación antes del tratamiento propuesto.

Figura 2. Aplicación de ondas de choque extracorpóreas en una muestra.
Evaluación biomecánica
Se realizó el análisis biomecánico con un método de carga a “3 puntos”. Dieciocho muestras fueron sometidas al estudio biomecánico: siete del grupo A, tres del grupo B y ocho del grupo C. Las clavijas se removieron antes del estudio biomecánico. Las piezas se estudiaron en una “máquina universal de ensayos” Instrom NR, modelo TAG: 182. Fueron montadas entre dos soportes cilíndricos de 19 mm de diámetro con una separación de 75 mm entre sí, orientados en forma concéntrica al punzón de compresión. Se procedió a flexionar las muestras con un punzón cilíndrico de 19 mm de diámetro y una velocidad de desplazamiento de 5 mm/min (Figura 3). Se estudiaron la carga máxima aplicada y el módulo de elasticidad para cada uno de los grupos.
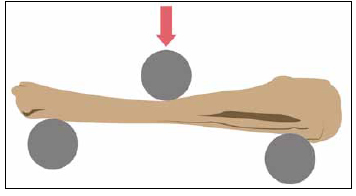
Figura 3. Prueba biomecánica con un método de carga a “3 puntos”.
Análisis estadístico
El análisis estadístico se ejecutó con el programa GraphPad versión 4.0. Se practicó un análisis de varianza ANOVA de una vía y se evaluó con un test t de Bonferroni, comparando los tres grupos entre sí, con p <0,05. Los datos se expresan como media ± desviación estándar.
Resultados
Histológicos
El estudio histológico permitió registrar signos de consolidación –callo fracturario perióstico y endostal– considerablemente mayores en las tibias de los animales del grupo A (tratado con OCEC) que en los del grupo B “control” (Figuras 4 y 5).

Figura 4. Signos de consolidación radiográfica completa (callo fracturario perióstico y endostal) en la muestra 3 del grupo A.

Figura 5. Hematoxilina-eosina. Signos de consolidación (callo fracturario perióstico y endostal) en la muestra 3 del grupo A.
Biomecánicos
Todos los especímenes mostraron una típica curva de desplazamiento-carga caracterizada por tres etapas: a) respuesta inicial “no linear”, b) curva ascendente y c) descenso abrupto de la curva (respuesta “deficiente” ante la solución de continuidad esquelética). Los resultados de carga máxima y módulo de elasticidad se esquematizan en las Tablas 1 y 2. La carga máxima para el grupo de las tibias sanas (grupo C) demostró ser más elevada en comparación con la de los grupos A (p <0,001; t: 7,988) y B (p <0,001; t: 6,599).
Tabla 1. Resultados comparativos entre los grupos para los módulos de elasticidad
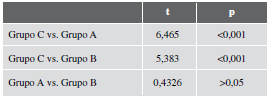
Tabla 2. Resultados comparativos entre los grupos para las diferentes cargas máximas a las que fueron sometidos
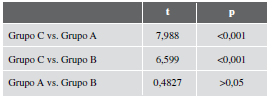
El balance entre los grupos A y B no evidenció resultados significativos (p >0,05; t: 0,4827) considerando el tamaño de la muestra utilizada. El módulo de elasticidad evaluado en el grupo C mostró cambios significativos comparativamente con los grupos A (p <0,001; t: 6,465) y B (p <0,001; t: 5,383). Estos no se observaron al comparar los grupos A y B (p >0,05; t: 0,4326).
Discusión
Se han descrito diversos procedimientos terapéuticos no invasivos para el tratamiento de la seudoartrosis14 (ultrasonido, ondas electromagnéticas, estimulación eléctrica e inmovilización mecánica). La terapia con OCEC es un procedimiento emergente a nivel mundial; es abundante la bibliografía que respalda su indicación en diversas entidades nosológicas del sistema musculoesquelético, tanto a nivel de tejido óseo como de partes blandas.9,15
Se han descrito modelos experimentales in vivo (en especies animales) que demuestran:
a) efectos favorables sobre la consolidación ósea (neovascularización, formación de nuevo hueso cortical y promoción de factores de crecimiento del tipo de las BMP)16 y
b) efectos desfavorables sobre la estabilidad mecánica del hueso involucrado y la necrosis de médula ósea.17
Algunos de los modelos experimentales de seudoartrosis atrófica más relevantes, son:
- Tibia de rata manteniendo la diastasis focal mediante fijador externo2
- Tibias de conejos sometidas a diastasis interfragmentaria18
- Fémur de rata sometiendo el foco a electrocauterización7
En este estudio, se ha elegido un modelo en tibia de conejo sobre la base de:
- la similitud del sector sural del conejo con la pierna humana (distribución topográfica de partes blandas y óseas)
- el tamaño del animal
- la dimensión de las piezas óseas
- la prevalencia de la seudoartrosis en la tibia del humano
- la mejor dispersión de las OCEC por presentar una menor cobertura de partes blandas.
Estudios clínicos retrospectivos han mostrado resultados satisfactorios con el tratamiento de ondas de choque en seudoartrosis hipertrófica, pero con peores resultados en el tratamiento de aquellas de tipo atrófica.13,14 Estudios histológicos y de inmunofluorescencia sobre la seudoartrosis atrófica señalan un aumento de la vascularización, de los terminales nerviosos a nivel focal y de la presencia de factores de crecimiento.3,4,19 Justamente la hipótesis sobre la cual se fundamenta el presente estudio consistió en dichas observaciones histológicas a la vez que en el demostrado efecto de las OCEC sobre el tejido óseo. En esta investigación, se han observado cambios significativos tanto radiográficos como histológicos, aunque con una escasa correlación con el estudio biomecánico de las muestras.
Pese a las numerosas publicaciones con el análisis histológico de las muestras, son escasas aquellas que desarrollan un modelo experimental con una evaluación biomecánica.
Conclusión
En un modelo experimental original de seudoartrosis atrófica generada por electrocauterización en tibia de conejos, se registraron cambios significativos radiográficos e histológicos luego de la intervención del foco mediante OCEC.
1. Hietaniemi K, Peltonen J, Paavolainen P. An experimental model for non-union in rats. Injury 1995;26(10):681-686. [ Links ]
2. Reed AA, Joyner CJ, Isefuku S, Brownlow HC, Simpson AH. Vascularity in a new model of atrophic nonunion. J Bone Joint Surg Br 2003;85(4):604-610. [ Links ]
3. Brownlow HC, Reed A, Simpson AH. The vascularity of atrophic non-unions. Injury 2002;33(2):145-150. [ Links ]
4. Brownlow HC, Reed A, Simpson AH. Growth factor expression during the development of atrophic non-union. Injury 2001;32(7):519-524. [ Links ]
5. Harrison LJ, Cunningham JL, Stromberg L, Goodship AE. Controlled induction of a pseudarthrosis: a study using a rodent model. J Orthop Trauma 2003;17(1):11-21. [ Links ]
6. Zucman J, Piketty D. Experimental study of the effect of bone marrow, periosteum and bone grafts in recent severe diaphysial fractures. Rev Chir Orthop Reparatrice Appar Mot 1970;56(1):3-21. [ Links ]
7. Ilarramendi A, Pascual Garrido C, De Carli P, Santini Araujo MG. Modelo experimental de seudoartrosis en roedores. Estudio biológico de su fisiopatología. Rev Asoc Argent Ortop Traumatol 2005;70(1):63-67. [ Links ]
8. Martini L, Giavaresi G, Fini M, Torricelli P, de Pretto M, Schaden W, et al. Effect of extracorporeal shock wave therapy on osteoblastlike cells. Clin Orthop Relat Res 2003;(413):269-280. [ Links ]
9. Wang CJ, Yang KD, Wang FS, Hsu CC, Chen HH. Shock wave treatment shows dose-dependent enhancement of bone mass and bone strength after fracture of the femur. Bone 2004;34(1):225-230. [ Links ]
10. Wang CJ, Chen HS, Chen CE, Yang KD. Treatment of nonunions of long bone fractures with shock waves. Clin Orthop Relat Res 2001;(387):95-101. [ Links ]
11. Tam KF, Cheung WH, Lee KM, Qin L, Leung KS. Delayed stimulatory effect of low-intensity shockwaves on human periosteal cells. Clin Orthop Relat Res 2005;438:260-265. [ Links ]
12. Haffner N, Antonic V, Smolen D, Slezak P, Schaden W, Mittermayr R, et al. Extracorporeal shockwave therapy (ESWT) ameliorates healing of tibial fracture non-union unresponsive to conventional therapy. Injury 2016;47(7):1506-1513. [ Links ]
13. Rompe JD, Rosendahl T, Schollner C, Theis C. High-energy extracorporeal shock wave treatment of nonunions. Clin Orthop Relat Res 2001;(387):102-111. [ Links ]
14. BMP-2 Evaluation in Surgery for Tibial Trauma (BESTT) Study Group, Govender S, Csimma C, Genant HK, Valentin-Opran A. Recombinant human bone morphogenetic protein-2 for treatment of open tibial fractures: a prospective, controlled, randomized study of four hundred and fifty patients. J Bone Joint Surg Am 2002;84(12):2123-2134. [ Links ]
15. Kuo SJ, Su IC, Wang CJ, Ko JY. Extracorporeal shockwave therapy (ESWT) in the treatment of atrophic non-unions of femoral shaft fractures. Int J Surg 2015;24(Pt B):131-134. [ Links ]
16. Wang FS, Yang KD, Chen RF, Wang CJ, Sheen-Chen SM. Extracorporeal shock wave promotes growth and differentiation of bone-marrow stromal cells towards osteoprogenitors associated with induction of TGF-beta1. J Bone Joint Surg Br 2002;84(3): 457-461. [ Links ]
17. Forriol F, Solchaga L, Moreno JL, Canadell J. The effect of shockwaves on mature and healing cortical bone. Int Orthop 1994; 18(5):325-329. [ Links ]
18. Brownlow HC, Simpson AH. Metabolic activity of a new atrophic nonunion model in rabbits. J Orthop Res 2000;18(3):438-442. [ Links ]
19. Santavirta S, Konttinen YT, Nordstrom D, Makela A, Sorsa T, Hukkanen M, et al. Immunologic studies of nonunited fractures. Acta Orthop Scand 1992;63(6):579-586. [ Links ]














