Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Geoacta
versión On-line ISSN 1852-7744
Geoacta v.33 Ciudad Autónoma de Buenos Aires ene./dic. 2008
ARTÍCULOS ORIGINALES
Movilidad de metales y otros elementos en el acuífero loéssico regional del suroeste bonaerense
A. Guillermo Bonorino1, Fabiana Limbozzi2, René Albouy3 y Claudio Lexow4
1CONICET-UNS San Juan 670 (8000) Bahía Blanca, bonorino@criba.edu.ar
2CONICET San Juan 670 (8000) Bahía Blanca, limbozzi@criba.edu.ar
3UNS San Juan 670 (8000) Bahía Blanca, albouy@criba.edu.ar
4CIC.PAID-UNS San Juan 670 (8000) Bahía Blanca, lexow@criba.edu.ar
RESUMEN
Se analizaron las concentraciones de elementos mayoritarios, menores y traza en el agua subterránea del acuífero freático regional de la vertiente occidental de las Sierras Australes, contrastándolas con la composición química del loess y del vidrio volcánico loéssico. Se calculó además el grado de movilidad relativa (MR) de cada elemento en el agua subterránea. A excepción de U y As, todos los elementos analizados exhiben baja movilidad. El amplio espectro de movilidad denota que la meteorización del loess es un proceso incongruente. Zr, Al, Th y Ti son los elementos con la movilidad más baja. Los elementos que forman oxohidroxoaniones, en particular U y As, tienen altos valores de MR. La movilidad de la secuencia de los elementos alcalinos y alcalinos térreos posee un patrón análogo al orden de la afinidad de sorción con los minerales de arcilla, teniendo el Cs y el Rb los MR más bajos y el Sr, Ca y Mg los MR más altos. Los metales de la transición muestran valores intermedios de MR, entre los alcalinos-alcalinos térreos y los elementos inmóviles. Las movilidades relativas del Fe, Co y Mn son las más bajas de este grupo. El Cr, Cd y Ni tienen valores moderados mientras que debido a las condiciones oxidantes del sistema acuífero, elementos como U, Mo, Zn, As y V exhiben gran movilidad. La formación de complejos con carbonatos influencia la geoquímica de la solución del U, del As y del Sn. La fuente principal de metales incorporados al flujo subterráneo sería el vidrio volcánico loéssico. Además de As se presentan otros elementos que alteran la calidad del agua subterránea con riesgo para la salud.
Palabras claves: Acuífero loéssico; Elementos traza; Movilidad; Metales
ABSTRACT
Major, minor and trace elements concentrations were analyzed from twelve groundwater samples collected from the western slopes of the Australes ranges, and correlated with loess chemical composition and loessic volcanic glass. Also, the relative mobility (RM) of each element was calculated. With the exception of U and As, all elements analyzed have low values of RM. The wide spectrum of mobility suggests that loess weathering is an incongruent process. Zr, Al, Th and Ti are the elements with lower mobility. OHA elements, in particular U and As, have high RM values. Sequence mobility of alkaline and earth alkaline elements has an analogous pattern of the affinity order of sorption with clay minerals, Cs and Rb having the lowest RM and Sr, Ca and Mg the highest RM. Transition metals have intermediate RM values, between alkaline-earths, alkaline and immobile elements. Relative mobility for Mn and Fe is the lowest of this group. Cr, Cd and Ni have moderate values while Zn and V have the highest ones. Due to the oxidizing conditions present in the aquifer system, elements such as U, Mo and V exhibit great mobility, whereas Mn and Co show little mobility. Carbonate complexes are formed, which influence the solution geochemistry of U, As and Sn. In addition to As there are several other toxic metals which degrade groundwater quality, thus endangering human health.
Keywords: Loessic aquifer; Trace elements; Mobility; Metals
INTRODUCCION
El acuífero regional de la vertiente occidental de las Sierras Australes, de constitución fundamentalmente loéssica, se extiende desde el piedemonte de estas serranías hasta el borde litoral de la Bahía Blanca, en el sur de la provincia de Buenos Aires, Argentina. El agua freática de este sistema es el sustento de la explotación agrícolo-ganadera y del abastecimiento de todas las poblaciones rurales de la región.
El loess posee minerales que durante su meteorización química, por la lixiviación del agua de lluvia infiltrada en la zona no saturada (ZNS), libera numerosos elementos, entre ellos metales, que luego llegan a la zona saturada (ZS), alcanzando tenores que afectan la calidad del agua para la bebida. El propósito de esta investigación es estudiar la movilidad geoquímica de ciertos elementos disueltos en el agua subterránea y sus implicancias ambientales, identificar su fuente principal y analizar los procesos que controlan su concentración.
CARACTERITICAS GEOLOGICAS E HIDROGEOLÓGICAS
El área de estudio abarca las cuencas de los arroyos Napostá Grande y Napostá Chico pertenecientes al escurrimiento superficial de la vertiente occidental de las Sierras Australes (Fig. 1). El acuífero libre y la zona no saturada de la región se alojan en la Formación La Norma (De Francesco, 1992) del Mioceno Superior-Pleistoceno Inferior que está integrada por depósitos loéssicos conocidos como sedimentos pampeanos, constituidos principalmente por limos arenosos y arenas limosas con arcilla subordinadas, cementados por carbonato de calcio, que alcanzan los 200 metros de potencia. Mineralógicamente, la formación está compuesta fundamentalmente por cuarzo, feldespatos alcalinos (plagioclasas intermedias a básicas), litoclastos de vulcanitas, vidrio volcánico, anfíboles (hornblenda) y micas (muscovita y biotita) (Rossi, 1996; Lexow, 2002). Otros minerales como la calcita, magnetita, titanita, ilmenita, turmalina, epidoto, sericita y circón se encuentran en menor cantidad. Los minerales de arcilla presentes son: la illita, montmorillonita, producto de neoformación por la alteración del vidrio volcánico, interestratificados de illita-montmorillonita y escaso caolín. El contenido de carbonato de calcio alcanza hasta un 10 % en la fracción arenosa el componente más abundante es la plagioclasa, en la limosa, el vidrio volcánico y en la arcillosa, la montmorillonita. El techo de la formación está coronado por niveles de tosca de hasta tres metros de espesor, de continuidad lateral variable y frecuentemente fisurados en superficie.

Figura 1. Área de estudio y ubicación de los sitios de muestreo
El material original de los suelos que dominan el ambiente periserrano de las Sierras Australes proviene de los sedimentos loéssicos que constituyen la cobertura regional. Se trata de suelos someros, de permeabilidad moderada, alcalinos y con medio a alto contenido en materia orgánica. Se clasifican, en general, como hapludoles líticos y petrocálcicos, de textura franco limosa a franco arcillo-limosa. En el resto del área de estudio predominan los suelos haplustoles típicos y líticos.
Hidroestratigráficamente, estos depósitos constituyen la Sección superior Epiparaniana (DYMAS, 1974) y generan un sistema acuífero del tipo multicapa. Su permeabilidad está dada principalmente por porosidad secundaria (macroporos y microfisuras) y los fenómenos de drenaje diferido son frecuentes.
Hidrodinámicamente, el sistema acuífero freático de la región presenta una zona preferencial de recarga, el pedemonte, una de circulación, la llanura y una área de descarga, el litoral marítimo (Bonorino et al., 1996; Carrica, 1998).
En la cuenca superior el agua de lluvia es del tipo bicarbonatada cálcico-magnésica (Bonorino, 1994). Sin embargo y dado el grado de aridez ambiental las sales inorgánicas, principalmente cloruros y sulfatos, son concentradas mayormente en la zona vadosa, luego de la evaporación de la fase acuosa, y posteriormente disueltas tanto por fluctuación del agua subterránea somera como por lixiviación a través del agua meteórica durante las estaciones húmedas (Barica, 1972). Los cloruros pueden también ser aportados al agua por hidrólisis de biotita (Stober y Bucher, 1999), sin embargo esta contribución, en tanto las biotitas son escasamente disponibles, es muy baja. La similitud en la distribución espacial de cloruros y sulfatos (R2 = 0.87) sugiere un origen común y muestra el incremento salino y la evolución general del agua subterránea en el acuífero. La salinidad y el contenido iónico aumentan según la línea de flujo, desde la zona de recarga hacia la zona costera donde el mar puede ejercer una influencia adicional, si bien los vientos marinos no son frecuentes en esta zona (Bonorino, 1994).
El agua de lluvia infiltrada reacciona con los minerales feldespáticos, con la consecuente liberación de Si, K, Na y Ca. La hidrólisis de la tosca agrega más Ca, el cual precipita en caso de alcanzarse la sobresaturación de la calcita. Por otra parte, el ataque a silicatos férricos y ferromagnésicos (biotita, hipersteno, augita y hornblenda) y a vidrios volcánicos presentes en los sedimentos adiciona al agua Si, F, y metales como Ca, Na, Ba, Sr, V, Zn, Cu, entre otros (Bonorino et al., 2001; Bonorino y Albouy, 2001). Los iones lixiviados desde la zona no saturada son incorporados al acuífero en toda su extensión. En su seno tienen lugar algunos procesos como la precipitación de calcita y el intercambio catiónico en arcillas que transforman el patrón hidroquímico del agua. Los tramos medio e inferior de las cuencas tienen un balance hídrico deficitario y por ello ocasionalmente los excedentes de agua algo más salinizados agregan más cloruros y sulfatos al acuífero. En la zona de descarga el agua alcanza una facies típica clorurada-sódica.
METODO DE TRABAJO
Se colectaron doce muestras de agua, correspondientes a sendos pozos cavados y perforados utilizando los sistemas de extracción de agua existentes, como molinos o electrobombas y almacenadas en botellas de polietileno. In situ se midió temperatura, pH y Eh del agua. Para las determinaciones de Al, Fe y Mn se tomaron muestras por separado, acidificándolas para evitar la precipitación de los mencionados iones.
Los análisis químicos fueron llevados a cabo por los laboratorios Activation Laboratories Ltd. (ACTLABS) y ACME Analytical Laboratories Ltd., ambos de Canadá. Los métodos aplicados en muestras de agua fueron ICP-MS para concentraciones de elementos mayoritarios y traza. En muestras de sedimentos se utilizaron LiBO2 fusión/ICP-ES para óxidos y LiBO2 fusión/ICP-MS y Agua Regia/ICP-MS para elementos traza. Los análisis verifican un error de balance de cargas menor al 5%. La especiación de los elementos estudiados se calculó mediante los códigos WATEQ4F (Plumer et al., 1976) y Visual MINTEQ, de la U.S.E.P.A. compilado por Gustafsson (2003).
RESULTADOS
El agua subterránea posee una temperatura comprendida entre los 16,5 y 19°C, un pH entre 7,5 y 8,2, y es de baja a media salinidad, con 421 a 1.704 mg.L -1 de sólidos totales disueltos (STD) (Tabla 1).
Tabla 1. Características físico-químicas del agua subterránea. Las concentraciones de STD, iones y elementos se expresan en mg.L-1; n.d.: no determinado.

Las concentraciones de STD, iones y elementos se expresan en mg.L-1; n.d.: no determinado
El sodio y el bicarbonato son los principales iones en solución determinando un patrón general de agua bicarbonatada-sódica, que pasa a bicarbonatada-clorurada-sódica y a clorurada-bicarbonatada-sódica en la dirección de circulación del flujo subterráneo.
La Tabla 2 presenta la concentración de los elementos minoritarios y traza disueltos en el agua subterránea. En valores promedio, solamente tres metales superan los 100 μg.L-1 (Sr, V y Fe). Por debajo de los 100 μg.L-1 y por encima de 1 μg.L-1 se encuentran la mayoría de los elementos analizados (As, Al, Ba y Mo entre otros). En tanto que los menos concentrados, van desde concentraciones promedio de 0,46 μg.L-1 (Sb) hasta tan bajas como 0,02 μg.L-1 para el Th y 0,008 μg.L-1 para el Cs.
Tabla 2. Concentración de elementos minoritarios y traza del agua subterránea. Las concentraciones se expresan en μg.L-1; n.d.: no determinado.
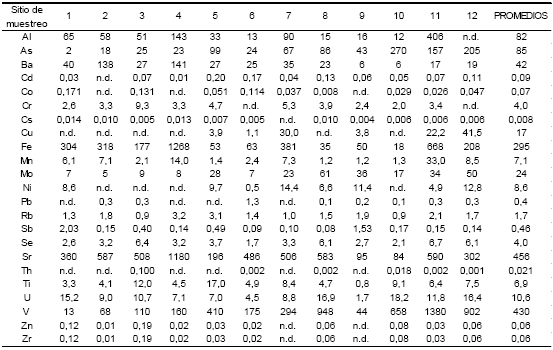
Las concentraciones se expresan en μg.L-1; n.d.: no determinado
El bicarbonato presenta una correlación media-alta con los cationes Cs, Cu, U, Se, Zn y Mn, Pb, Ti y As respectivamente (datos no presentados), lo cual pone de manifiesto que los elementos liberados al agua subterránea estarían condicionados por la intensidad del ataque ácido de los materiales loéssicos por el agua con CO2 en disolución.
Elementos menores y traza
En la figura 2 se presenta la relación entre la concentración promedio de cada elemento en el agua subterránea (Ca) y la del loess (Cl). La correlación que se observa especialmente entre los diferentes grupos de metales deja inferir la dependencia de la composición química del agua con respecto a la composición mineral de los sedimentos lixiviados y que el comportamiento químico de dichos elementos condiciona la separación de los metales entre el mineral y la solución.

Figura 2. Concentración promedio de elementos en el agua subterránea (Ca) versus la del loess (Cl).
El Al, Th, Ti, Zr y algo menos el Fe, en general decaen en el agua subterránea en consonancia con su fuerte tendencia a concentrarse en los minerales secundarios, óxidos y arcillas producidos durante la meteorización.
En el otro extremo los metales alcalinos y alcalino térreos, a excepción del Cs, se mueven hacia losíndices (Ca/Cl) más altos mostrando su preferencia a pasar a la solución durante el proceso de meteorización. Un comportamiento similar también se observa en los elementos del grupo que forman aniones oxo-hidroxo (AOH), a causa de su inclinación a formar complejos aniónicos solubles
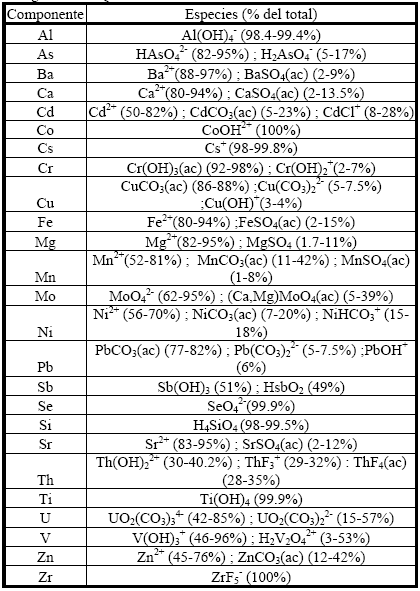
Respecto al As, U y V, los mismos muestran una distribución espacial aleatoria que puede relacionarse con la presencia irregular de niveles de vidrio volcánico. Las determinaciones químicas realizadas en los vidrios volcánicos loéssicos del acuífero y de niveles superiores (ZNS) de cenizas de la región indican que los mismos podrían ser la fuente de aporte más importante de elementos traza que se incorporan a la freática (Tabla 3). Así lo demuestran los altos índices de correlación obtenidos entre la composición química del agua y la del vidrio. La misma asociación fue encontrada por Arribére et al. (1997) en muestras de loess de las provincias de Santa Fe, San Luis y Córdoba. Nicolli et al. (1989) llegan a conclusiones similares en un estudio realizado en el centro-este de la provincia de Córdoba.
Tabla 3. Composición química del vidrio volcánico, cenizas y sedimento loéssico. Las concentraciones se expresan en ppm. Muestra 1: representativa de sedimentos pampeanos (Rossi y Bonorino, 1996), Muestra 2: nivel de ceniza en la Formación Chasicó (Fidalgo et al., 1979), Muestra 3: sedimento loéssico del acuífero freático del área de estudio. Las concentraciones se expresan en ppm

Los índices de saturación y especiación calculados con los programas WATEQ4F y MINTEQ respectivamente se muestran en las Tablas 4 y 5.
Tabla 4. Indices de saturación mineral en el agua subterránea.

Tabla 5. Especiación según MINTEQ.
DISCUSIÓN
Interacción agua-loess
El flujo de elementos químicos durante los procesos de meteorización depende estrechamente de la inestabilidad de los minerales primarios con respecto a la solución y a la formación de minerales secundarios. En sentido termodinámico, los sistemas de meteorización son abiertos y el agente de movilización es el agua que reacciona con los minerales. En general se considera que las condiciones necesarias para lograr el equilibrio en algunos sistemas químicos naturales es difícil de alcanzar. Sin embargo en el agua subterránea pueden establecerse condiciones más cercanas al equilibrio que en aguas superficiales debido a su lenta circulación, a su mayor área de contacto con el sedimento y a la escasez de procesos biológicos (Stumm y Morgan, 1970).
La secuencia de movilidad de los elementos durante la meteorización es controlada por los siguientes factores: a) naturaleza de los materiales parentales, b) naturaleza de las fases formadas recientemente, c) la solubilidad inherente a los elementos y d) la cinética de las reacciones. Igualmente son también importantes el tamaño del sistema, el estado de la meteorización y las condiciones ambientales del sistema.
El loess pampeano tiene una filiación piroclástica-volcánica intermedia a básica (Teruggi e Imbelloni, 1984). De acuerdo con las descripciones mineralógicas del loess de la región (Rossi, 1996; Lexow, 2002), los constituyentes más importantes son: la plagioclasa (andesina-oligoclasa), cuarzo, hornblenda y calcita (autígena) en la fracción arenosa. Estos minerales liberarán sílice, sodio, calcio y magnesio, según una secuencia que dependerá del grado de vulnerabilidad a la meteorización de cada mineral y de su estado de equilibrio con la fase acuosa (índice de saturación).
La mayor proporción de vidrio volcánico se encuentra en la fracción limo y, de acuerdo a su composición química puede asociarse al vulcanismo andesítico-dacítico. El vidrio es una sustancia amorfa y más inestable que el resto de los minerales presentes en el loess y puede ser afectado por los fenómenos de disolución, hidratación e hidrólisis. Estudios experimentales de disolución de basaltos entre 25-60°C (Gislason y Eugster, 1987) demostraron que el vidrio basáltico disuelve 1,5 a 2,5 veces más rápido que la plagioclasa y el olivino. Por lo tanto el vidrio aporta, por disolución, Na, Si y K, mientras que los cationes bivalentes son retenidos más fuertemente en su estructura (Mizutani y Mizutani, 1978). Distintos elementos que enriquecen comúnmente el vidrio, como los mencionados anteriormente As, V y otros también importantes como el Al, Fe, Ba, Sr, etc. son también liberados a la solución.
El análisis de los índices de saturación (Tabla 4) indican, para la mayoría de las muestras de agua, un estado de sobresaturación para el equilibrio con plagioclasas, albita, anortita, el cuarzo y la calcedonia, los cuales quedan fuera del proceso de disolución.
La disolución de vidrio volcánico y minerales primarios libera metales que pueden ser capturados por la formación de minerales secundarios tales como montmorillonita, illita y caolinita y óxidos de hierro, como la hematita y magnetita. Los índices de saturación para todas las muestras presentan valores positivos para montmorillonita e illita.
Se asume que el Al, Fe y Ti son casi inmóviles, aunque la presencia de aniones orgánicos incrementa la disolución de Al y Fe y pueden ser transportados, proceso que ocurre solo en los niveles superiores de la ZNS. También a pH muy alcalino hay suficiente OH- que se combina con el Al y Si formando hidróxidos muy solubles como la gibbsita y la halloysita (Appelo y Postma, 1999), que están en equilibrio y sobresaturados respectivamente. Los óxidos e hidróxidos de Fe, Ti y Th se encuentran muy sobresaturados.
Movilidad de los metales en el agua subterránea
La movilidad geoquímica relativa (MR) de un elemento (Aiuppa et al., 2000) se puede calcular a partir de la relación de su concentración (X) agua (a)/roca (l) normalizada al sodio, en razón de la alta movilidad química que presenta este metal durante la meteorización:
![]()
en la que a y l representan el agua y la roca respectivamente. La concentración de los elementos en el loess (Tabla 3) fue extraída del análisis químico realizado sobre una muestra de material acuífero (Rossi y Bonorino, 1996). En la Figura 3 se muestran las secuencias de movilidad relativa de tres muestras representativas de aguas subterráneas de baja (Punto 7), media (Punto 3) y alta salinidad. El gráfico se halla dividido en cuatro áreas correspondientes a: (1) elementos de escasa movilidad, (2) metales de transición, (3) metales alcalinos y alcalinos térreos, y (4) elementos que forman AOH.
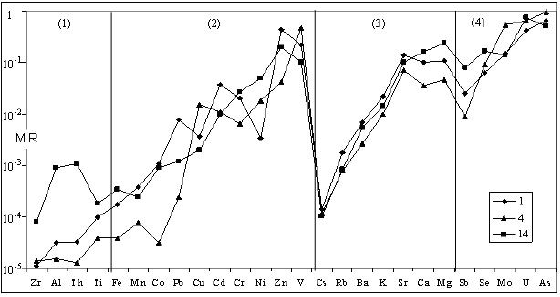
Figura 3. Movilidad relativa (MR) de los metales en el agua subterránea.
Todos los elementos analizados, a excepción del U y el As, tienen un MR < 1, lo cual indica que son fijados más eficazmente que el Na por los productos sólidos de la meteorización o retenidos en la estructura de los minerales primarios. El comportamiento geoquímico de los elementos analizados y su dependencia de las condiciones redox se discuten a continuación para cada grupo.
Elementos de escasa movilidad
Se trata del Zr, Th, Ti, Al y Fe, elementos casi inmóviles por ser preferentemente retenidos en el residuo sólido de la meteorización. El Zr puede mostrar un íntima asociación con la fase ferruginosa, adsorbido, formando parte de algún mineral como la goethita o incorporado a geles de Al y Ti. Los valores más bajos encontrados son de Th y Zr en la muestra de agua de mayor salinidad.
Elementos que forman aniones oxohidroxo (AOH)
Este grupo incluye al U, Sb, As, Mo y Se. Sus elevados valores de MR, especialmente en el U y el As, hasta por encima de 4 señalan su considerable aptitud para movilizarse en el sistema acuoso. Esta propiedad va asociada, al menos en los de mayor estado de oxidación (V y VI), a la de formar complejos aniónicos solubles.
De acuerdo a lo calculado por el programa MINTEQ (Tabla 5) la especie acuosa soluble de Se dominante en un ambiente oxidante es SeO4 2- . El Mo se encuentra presente en minerales ricos en hierro (óxidos y piroxenos) en estados de valencia reducidos (III o IV), pero durante la meteorización es lixiviado como molibdato (MoO4 2-), especie más abundante.
El Sb puede presentarse en aguas naturales coordinado por iones O2- o bien OH- (Pittwell, 1974). El estado de oxidación (III) es más estable que el (V) y puede presentarse en medios oxidantes como SbO2 - y como Sb(OH)3. El programa MINTEQ presenta para todas las muestras similares proporciones de ambas especies.
El As forma compuestos solubles tanto en soluciones oxidadas (V, arsenatos) como en reducidas (III, arsenitos). En ambientes oxidados como el del área de estudio la especie más importante es HAsO4 2- , fase de estado soluble (Garrels y Christ, 1965; Brookins, 1986).
El U(VI) es la forma termodinámicamente estable e interactúa fuertemente con fases sólidas. Barnett et al. (2000) han demostrado que el pH de la fase acuosa controla su adsorción. En el rango de pH 7,5 a 8,5 la misma decrece acentuadamente debido al incremento en la concentración de carbonato disuelto y el subsecuente aumento de la formación de complejos U(VI)-carbonato, especies neutras o aniónicas con interacciones despreciables con la fase sólida. Cálculos obtenidos con MINTEQ arrojan proporciones variables de las especies UO2 (CO3)2 2- (40 - 85%) y UO2 (CO3)3 4- (15 - 57%). Estos resultados se ajustan al diagrama de estabilidad para U presentado por Langmuir (1998).
Metales alcalinos y alcalino térreos
Dada su baja polaridad estos iones tienden a permanecer en solución como iones libres, ya que son más fuertemente atraídos por el agua que por otros ligandos inorgánicos. En la Figura 3 la secuencia de movilidad de los elementos alcalinos y alcalino térreos en las aguas subterráneas de baja a mediana salinidad es: Na > Ca > Mg ≥ Sr > K > Ba > Rb >> Cs. En las de mayor salinidad el orden es: Na > Sr > Mg > Ca > K > Ba > Rb >> Cs y sus valores de MR son notoriamente más bajos que en las otras.
La secuencia guarda un patrón similar al orden de afinidad de adsorción en los procesos de intercambio catiónico con arcillas según Freeze y Cherry (1979) y Stumm (1992): Cs > Rb > K > Na > Li, para los cationes monovalentes, y Ba > Sr > Ca > Mg, para los bivalentes. Dicha afinidad se incrementa con el radio iónico del elemento. En otras palabras, el ión con el mayor radio hidratado tiende a ser desplazado por el ión de menor radio hidratado. En este proceso, interviene además la naturaleza del intercambiador y la concentración de la solución. Por otra parte, el Ba puede ser adsorbido por óxidos e hidróxidos de metales.
Metales de transición
Los metales de transición, Fe, Zn, Mn, V, Ni, Cr, Co, Cu, Cd y Pb poseen una movilidad intermedia entre los metales alcalino-alcalino térreos y los considerados de escasa movilidad.
La presencia de metales pesados en agua implica un riesgo para la salud y el ambiente. Su toxicidad depende de las asociaciones químicas que presentan en suelos, así pueden encontrarse como metales adsorbibles e intercambiables, enlazados a fases carbonato, a fases reducibles (óxidos de Fe y Mn), a materia orgánica o como metales estructurales (Ma y Rao, 1997). En el área de estudio la movilidad y potencial biodisponibilidad en los suelos es Zn > Ni > Cd ≥ Cu. Los tres primeros se encuentran como iones bivalentes, en su mayor proporción (50 - 70%), o como carbonatos.
El Mn y Fe son movilizados en condiciones reductoras (Walton-Day et al., 2001). Puesto que el ambiente de estudio es oxidante los índices de movilidad de estos elementos, junto con el de Co, son los más bajos de este grupo. El Mn ocurre en suelos como Mn intercambiable, orgánico, formando óxidos o parte de minerales silicatados ferromagnesianos. Por tener radio iónico similar al Mg y al Fe, puede sustituirlos en sus óxidos y minerales. En suelos con materia orgánica y pH > 6,5 la disponibilidad puede disminuir por formación de complejos (Schulte y Kelling, 1999). MINTEQ señala una alta proporción de ión Mn2+ (50 - 80%), comportamiento coincidente con lo esperado a partir de los diagramas de estabilidad de los metales en estudio (Krauskopf, 1967). Con respecto al Fe, el mineral más estable en las condiciones de estudio es la hematita y la especie predominante es Fe2+ (80 - 95%), seguida por FeSO4(ac) (2 - 15%), con concentraciones de Fe del orden de aquellas que pueden deducirse de los diagramas de estabilidad (aproximadamente 10-6 M) (Krauskopf, 1967).
En los suelos, el Cr existe principalmente en dos estados de oxidación estables: trivalente y hexavalente. Exhibe un típico comportamiento de adsorción aniónico, esto es, su adsorción disminuye a medida que aumenta el pH y cuando existen en solución aniones que compiten por los sitios de adsorción (Stumm, 1992). En suelos con moderada o alta proporción de materia orgánica se presenta en formas poco móviles, mientras que en suelos minerales la fracción lábil es mayor. En solución MINTEQ indica una elevada proporción de la especie Cr(OH)3(ac). Respecto al Cu, su movilidad y retención en suelos está relacionada con la presencia de materia orgánica, óxidos de Fe y Mn y minerales de arcilla. Es principalmente retenido a través de mecanismos específicos de adsorción e intercambio (Balasoiu et al., 2001). Los tenores de Cu en solución han sido no detectables en muchas muestras y, si bien los diagramas de estabilidad muestran que se encontraría en solución como Cu2+ en ambientes oxidantes, los resultados reportados por MINTEQ indican que se halla en su mayor proporción en forma de carbonatos acuosos (85 - 90 %). Los niveles de Co en solución son afectados por el coprecipitado con óxidos de Fe y Mn (Sileo et al., 2001) y por fenómenos de adsorción en suelos. La única especie presente en solución, de acuerdo a MINTEQ, es CoOH2+. El Ni coprecipita, al igual que el Co con el Fe y el Mn, pero sus compuestos son más solubles.
En las disoluciones acuosas existen V2+(ac), V3+(ac), VO2+ y VO3 - pero también el vanadio forma numerosos complejos e iones que son complejos polinucleares. Los óxidos nativos son poco solubles en agua pero por hidrólisis generan diversas especies en solución denominadas genéricamente vanadatos. La especiación es compleja y altamente dependiente de la concentración de vanadio. Bajo las condiciones ambientales más comunes de Eh y pH, y a bajas concentraciones, el vanadato es monomérico (H2VO4 -). A mayores concentraciones pueden predominar formas diméricas y triméricas. Por medio de MINTEQ se reporta la presencia de dos especies mayoritarias, esto es, V(OH)3, con porcentajes variables entre 46 y 96%, y H2V2O4 2+ cuyos porcentajes son inferiores, entre 3 y 53%, coincidiendo los mayores tenores de la última especie con los valores más elevados de pH. Dada la falta de minerales concentradores de V y la resistencia a la meteorización de los minerales opacos que lo contienen (como por ejemplo magnetita) debería esperarse una escasa presencia de este ión en el agua subterránea. Sin embargo, su concentración es elevada por lo que puede inferirse que el vidrio volcánico podría ser la fuente principal de este elemento.
Consideraciones ambientales
Según los límites permisibles que fija la Organización Mundial de la Salud para el agua de consumo humano, algunas muestras de agua subterránea generarían un riesgo para la salud por su contenido en arsénico, hierro y aluminio (Tabla 6).
Tabla 6. Muestras y concentraciones de elementos nocivos para la salud que superan los límites establecidos por la Organización Mundial de la Salud (O.M.S.)
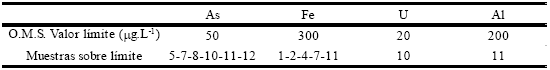
Los niveles de toxicidad se hallan no sólo en las muestras con mayor salinización, ubicadas en la zona de descarga, sino también en las de mediana y baja salinidad, en las zonas de circulación y recarga respectivamente. Se infiere entonces que el consumo de agua subterránea que conlleva riesgo para la salud puede ocurrir en toda la extensión de la cuenca.
Con respecto a la concentración de uranio en la muestra 10 cabe mencionar que si bien no supera el límite máximo admitido para el consumo humano de 0,02 mg.Kg-1 prácticamente lo alcanza. Además, algunas muestras superan las concentraciones máximas de As, Mo y V recomendadas por la Food and Agriculture Organization (FAO) para agua de irrigación, mientras que para la bebida del ganado el As y V sobrepasa también los límites máximos admisibles de toxicidad (Pais y Jones, 1997).
CONCLUSIONES
Las concentraciones de los diferentes metales disueltos en el agua subterránea guardan una alta dependencia con la composición química del loess que constituye las zonas no saturada y saturada de la región, con lo cual se descartan otras componentes superficiales (agua de lluvia, antropismo) o de flujo subterráneo (transmisión desde otro acuífero más profundo), que aporten metales.
La fuente principal de metales serían los vidrios volcánicos loéssicos, en donde la capacidad de meteorización es favorecida a causa de su entropía y la cinética de los procesos de liberación, en comparación con el resto de los minerales que componen el loess.
El amplio espectro de movilidad (10-5 < MR < 2) que presentan los diferentes elementos estudiados reafirma que la meteorización del loess no es un proceso congruente. Las condiciones oxidantes del sistema favorecen, principalmente, la movilidad del As, U, V y Zn y reducen la de otros elementos como el Co y el Mn.
La alta movilidad de algunos metales, como también del As, U, y Se, tiene una implicancia ambiental importante por la toxicidad y los niveles de riesgo para la salud que los mismos representan en el agua para la bebida. Otros como Fe y Al, a pesar de su escasa movilidad, con frecuencia superan las concentraciones máximas admisibles. Todos estos elementos son referentes de degradación natural y deben ser considerados en evaluaciones de la calidad del agua alojada en los acuíferos loéssicos de la llanura pampeana.
Agradecimientos: Este trabajo fue financiado por la Agencia Nacional de Promoción Científica y Tecnológica a través del PICT 07-12501/2002. Los autores agradecen las valiosas sugerencias realizadas por los evaluadores durante la revisión editorial.
REFERENCIAS
1. Aiuppa, A., Allard, P., D'Alessandro, W., Michel, A. Parello, F., Treuil, M. and Valenza, M., 2000. "Mobility and fluxes of major, minor and trace metals during basalt weathering and groundwater transport at Mt. Etna volcano (Sicily)" Geochimica et Cosmochimica Acta, 64(11), 1827-1841. [ Links ]
2. Appelo, C.A. and Postma, D., 1999. Geochemistry, groundwater and pollution. A. A.Balkema Pub., Rotterdam. [ Links ]
3. Arriberé, M., Cohen, M., Ferpozzi, A., Kestelman, V., Casa, A. y Riveiro Guevara, S., 1997. "Neutron Activation Analysis of Soils and Loess Deposits for the Investigation of the Origin of the Natural Arsenic Contamination in the Argentine Pampa" Radiochimica Acta, 78, 187-191. [ Links ]
4. Balasoiu, C.F., Zagury, F.J. and Deschenes, L., 2001. "Partitioning and speciation of chromium, copper, and arsenic in CCA-contaminated soils: influence of soil composition". The Science of the Total Environment, 280: 239-255. [ Links ]
5. Barica, J., 1972. Salinization of groundwater in arid zones. Water Research 6 (8), 925-933. [ Links ]
6. Barnett, M.O., Jardine, P.M, Brooks, S.C. and Selim, H.M., 2000. "Adsorption and transport of uranium (VI) in subsurface media". Soil Science Society American Journal, 64, 908-917. [ Links ]
7. Bonorino, A.G., 1994. "Geohidroquímica de la lluvia en la región suroeste bonaerense". RAGA 49(1-2), 93-98. [ Links ]
8. Bonorino, A.G. y Albouy, E.R., 2001. "La influencia del sistema carbonatado sobre el quimismo del agua subterránea (cuenca superior del arroyo Chasicó)". Geoacta, 26, 1-11. [ Links ]
9. Bonorino, A.G., Albouy, R. y Carrica, J., 2001. "Hidroquímica de un acuífero loéssico". Geoacta, 26, 33-45. [ Links ]
10. Bonorino, A.G., Panarello, H., Carrica. J.C. y Albouy, R., 1996. "Isótopos estables y dinámica del acuífero freático de la vertiente occidental de las Sierras Australes". XIII Congreso Geológico Argentino, Vol. IV, pp. 406-416. [ Links ]
11. Brookins, D.G., 1986. "Geochemical behavior of antimony, arsenic, cadmiun and thallium: Eh-pH diagrams for 25°C, 1 bar pressure". Chemical Geology, 54, 271-278. [ Links ]
12. Carrica, J.C., 1998. Hidrogeología de la cuenca del arroyo Napostá Grande provincia de Buenos Aires. Tesis Doctoral. Biblioteca Central , U.N.S., Bahía Blanca. 215 pp. [ Links ]
13. De Francesco, F.O., 1992. "Estratigrafía del cenozoico en el flanco occidental de la Sierra de Curamalal, Sierras Australes bonaerenses". Actas III Jornadas Geológicas Bonaerenses, pp. 3-12. [ Links ]
14. Fidalgo, F., Loza, J., Porro, N. y Tonni, E., 1979. Algunas características de la Formación Arroyo Chasicó y sus relaciones geológicas. VII Congreso Geológico Argentino. I, 213,225. Neuquén. [ Links ]
15. Freeze, R.A. and Cherry, J.A., 1979. Groundwater. Prentice-Hall, Inc. [ Links ]
16. DYMAS, 1974. "Contribución al mapa hidrogeológico de la provincia de Buenos Aires. Zonas de Bahía Blanca y Norpatagónica". CFI (inédito). [ Links ]
17. Garrels, R. and Christ, C., 1965. Solutions, Minerals and Equilibria. Harper & Row and J. Weatherhill, Inc. [ Links ]
18. Gislason, S.R. and Eugster, H.P., 1987. "Meteoric water-basalt interactions. II: Afield study in NE Iceland". Geochim. Cosmochim Acta, 51, 2841-2855. [ Links ]
19. Gustafsson, J.P, 2003. Visual MINTEQ, version 2.14, Department of Land and Water Resources Engineering, KTH (2003) Stockholm, Sweden. [ Links ]
20. Krauskopf, K., 1967. Introduction to Geochemistry. McGraw-Hill Book, Inc., New York, 721 pp. [ Links ]
21. Langmuir, D., 1998. Aqueous environmental geochemistry. Prentice Hall, N.J. [ Links ]
22. Lexow, C., 2002. Hidrodinámica de la zona no saturada aplicada al estudio del balance hidrológico y de contaminantes de los recursos hídricos subterráneos (Cuenca del arroyo Del Aguila). U.N.S. Tesis Doctoral, 174 pp. [ Links ]
23. Ma, L.Q. and Rao, G.N., 1997. "Chemical fractionation of Cadmium, Copper, Nickel and Zinc in contaminated soil". Journal of Environmental Quality, 26, 259-264. [ Links ]
24. Mizutani, T., Mizutani, A., 1978. Determination for some inorganic cations adsorbed on porous silica glass in a distilled water medium. Journal of Non-Crystaline Solids 30 (1), 23-27. [ Links ]
25. Nicolli, H., Suriano, J., Gómez Peral, M., Ferpozzi, L. y Baleani, O., 1989. "Groundwater contamination with arsenic and other elements in an area of the Pampa, province of Córdoba, Argentina". Environmental Geological Water Science, 14(1), 3-16. [ Links ]
26. Pais, I. and Jones, B.J., 1997. The Handbook of trace elements. St. Louis Press. Boca Raton, Florida. 219 pp. [ Links ]
27. Pittwell, L.R., 1974. "Metals coordinated by ligands normally found in natural waters". Journal of Hydrology, 21, 301-304. [ Links ]
28. Plumer, L.N., Jones, B.F. and Truesdale, A., 1976. WATEQ4F - A Fortran IV version of WATEQ, a Computer Program for Calculating Chemical Equilibrium of Natural Waters. U.S.G.S. Techniques of Water-Res. Invest., 76, 70 pp. [ Links ]
29. Rossi, S.P., 1996. Evolución hidrogeoquímica del agua subterránea en la cuenca superior del arroyo Chasicó, provincia de Buenos Aires. Tesis Doctoral, Universidad Nacional del Sur, Bahía Blanca. [ Links ]
30. Rossi, S.P. y Bonorino, A.G. 1996. "Hidroquímica del agua subterránea (sistema silicatado) de un acuífero loéssico. Cuenca del arroyo Chasicó, provincia de Buenos Aires". Actas XIII Cong. Geológico Argentino, Vol. IV, pp. 365-380. [ Links ]
31. Schulte, E.E. and Kelling, K.A., 1999. Soil and Applied Manganese (A2526). Publications in Understanding Plant Nutrients, University of Wisconsin-Extension, Madison, Wisconsin. [ Links ]
32. Sileo, E.E., Alvarez, M. and Rueda, E.H., 2001. "Structural studies on the manganese for iron substitution in the synthetic goethite-jacobsite system". International Journal of Inorganic Materials, 3, 271-279 [ Links ]
33. Stober, I., Bucher, K., 1999. Deep groundwater in the crystalline basement of the Black Forest region. Applied Geochemistry 14, 237-254. [ Links ]
34. Stumm, W., 1992. Chemistry of the solid-water interface. Processes at the mineral-water and particle-water interface in natural systems. J. Wiley & Sons, Inc. [ Links ]
35. Stumm, W. and Morgan, J. J., 1970. Aquatic Chemistry. An introduction emphasizing chemical equilibria in natural waters. WILEY- INTERSCIENCE, J. Wiley & Sons, Inc. [ Links ]
36. Teruggi, O., Imbelloni, P., 1984. "Respuesta a: En relación con perfiles de estabilidad mineral en suelos desarrollados sobre loess de la región pampeana septentrional, Argentina". Revista Ciencia del Suelo, 2(2), 218-222. [ Links ]
37. Walton-Day, K., Smith, K.S. and Rainville, J.F., 2001. Control of iron and trace-metal mobility in an alluvial aquifer affected by acidic rock drainage. Geological Society of America Annual Meeting. Paper No. 118-0. [ Links ]














