Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de radiología
versión On-line ISSN 1852-9992
Rev. argent. radiol. vol.72 no.4 Ciudad Autónoma de Buenos Aires oct./dic. 2008
OSTEO-ARTICULAR
Construcción de modelos computacionales para el análisis de esfuerzos mecánicos de piezas óseas utilizando imágenes de TC: aplicación a la articulación gleno-humeral
Adrián Cisilino1, Diego D'Amico1, Federico Buroni1, Pablo Commisso1, Mario Sammartino2 y Carlos Capiel3
1 División Soldadura y Fractomecánica, INTEMA. Facultad de Ingeniería, Universidad Nacional de Mar del Plata - CONICET. Av. Juan B. Justo 4302. (7600) Mar del Plata
2 Clínica de Fracturas y Ortopedia. Av. Independencia 1475. (7600) Mar del Plata.
3 Instituto Radiológico. Catamarca 1542. (7600) Mar del Plata.
Correspondencia: Ing. Adrián P. Cisilino: cisilino@fi.mdp.edu.ar
Recibido: mayo 2008; aceptado: septiembre 2008
Received: may 2008; accepted: september 2008
©SAR-FAARDIT 2008
Resumen
Se presenta en este trabajo una metodología para el procesamiento de imágenes de estudios de TC para la construcción de modelos computacionales de piezas óseas. Los modelos computacionales son utilizados para el análisis de esfuerzos utilizando el Método de los Elementos Finitos. Las constantes elásticas del tejido óseo son calculadas a partir de los datos de densidad de las TC. La metodología propuesta es aplicada en la construcción de un modelo para el análisis de la articulación gleno-humeral.
Palabras clave: Modelado computacional; Elementos finitos; Tomografía computada; Articulación gleno-humeral.
Abstract
Construction of computational models for the stress analysis of the bones using CT imaging: application in the gleno-humeral joint
A methodology for the construction of computational models from CT images is presented in this work. Computational models serve for the stress analysis of the bones using the Finite Element Method. The elastic constants of the bone tissue are calculated using the density data obtained in from the CTs. The proposed methodology is demonstrated in the construction of a model for the gleno-humeral joint.
Key words: Computational modeling; Finite elements; Computed tomography; Gleno-humeral Joint.
INTRODUCCIÓN
En las últimas décadas, las herramientas de cálculo numérico computacional, y en especial el Método de los Elementos Finitos (FEM por sus siglas en inglés) (1), se han popularizado en el campo de la biomecánica y la ortopedia. Estas herramientas, originalmente desarrolladas en el campo de la ingeniería, permiten crear los medios virtuales para el estudio del aparato músculo-esquelético y de esta manera determinar el comportamiento mecánico de sistemas hueso-implante sin necesidad de intervención y experimentación en el cuerpo humano. Al mismo tiempo, es posible desarrollar y trabajar con modelos individualizados que consideren las características particulares de cada paciente y que ayuden en la exploración y búsqueda de soluciones a problemas específicos antes de la intervención quirúrgica. La construcción de un modelo de Elementos Finitos necesita definir la geometría del problema (morfología ósea), junto con la información de sus propiedades mecánicas y cargas (fuerzas) aplicadas.
Por su parte, las imágenes médicas procedentes de los estudios de tomografía computada (TC) son herramientas usuales para el diagnóstico médico. El reformateo y procesamiento de las imágenes axiales de TC permite obtener reconstrucciones bidimensionales (2D) en los planos sagital, coronal y oblicuo o tridimensionales (3D) mediante la utilización de software específicos (Volume Rendering, Surface Rendering) (2).
Aunque muy potentes y eficaces, estas técnicas orientadas a la visualización y construcción de imágenes no proporcionan en forma directa la información necesaria para la construcción de modelos de Elementos Finitos. Como se explicará más adelante, la construcción de un modelo computacional requiere que la información sobre el problema esté dada en un formato compatible para su procesamiento por un algoritmo numérico.
La metodología propuesta para obtener la información del modelo de Elementos Finitos a partir de las imágenes de TC se describe a continuación, al tiempo que se lo ilustra para el caso de la articulación gleno-humeral.
MATERIAL Y MÉTODO
Este FEM (1) es usualmente reconocido como la invención más importante de la ingeniería computacional. Esta fue desarrollada como una herramienta potente y versátil de diseño ingenieril que sirve para el estudio del comportamiento de componentes y estructuras mecánicas complejas sujetas a estados arbitrarios de carga. En pocas palabras, el FEM consiste en dividir la estructura en pequeñas partes (elementos), cuyo comportamiento se describe en forma simplificada (Fig.1). Los elementos son entonces "reconectados" a través de puntos clave (nodos). El proceso resulta en un sistema de ecuaciones algebraicas simultáneas de cuya solución se obtiene la respuesta del problema (desplazamiento, deformaciones y esfuerzos). Los nodos y elementos en un modelo pueden ser varios cientos o miles, por lo que es mandatario el empleo de computadoras para la solución del problema.

Fig. 1. Discretización del extremo proximal de húmero para su análisis utilizando el Método de los Elementos Finitos.
El modelo de FEM requiere que la información sobre la geometría del problema le sea proporcionada a través de la posición de los nodos (matriz de coordenadas) y cómo estos se encuentran conectados para definir los elementos (matriz de conectividad). Luego se deben especificar para cada elemento las constantes elásticas. La metodología propuesta se ilustra en el diagrama de la figura 2 y se describe a continuación.
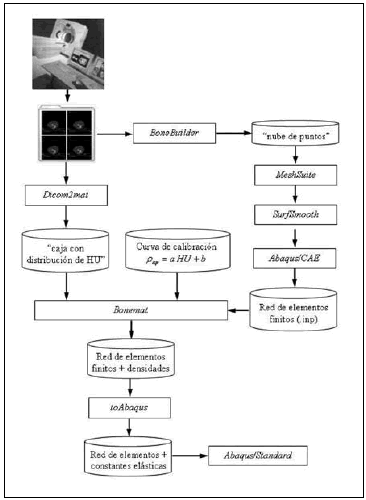
Fig. 2. Esquema con el proceso de construcción del modelo de elementos finitos a partir de TC.
Estudio tomográfico
Se realizó una tomografía computada del conjunto húmero-escápula en posición supina utilizando un tomógrafo computado helicoidal Philips Secura. Fueron obtenidas un total de 311 tomografías con un paso de 1 mm en la región de las epífisis del húmero y 2,5 mm en el resto del estudio.
Las imágenes tomográficas fueron procesadas con el software eFilm (3) para obtener imágenes de las secciones transversales de los huesos en blanco y negro, las que fueron exportadas en formato de mapa de bits (Fig. 3 a y b).
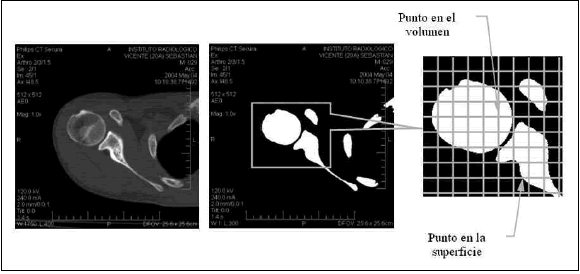
Fig. 3. Silueta de una sección del húmero y la escápula: (a) imagen tomográfica en escala de grises; (b) imagen de alto contraste en blanco y negro; (c) grilla para la obtención de puntos en la superficie y el volumen.
Construcción de la red de Elementos Finitos
Las imágenes con los cortes transversales fueron procesadas para obtener los puntos (nodos) en el dominio y la superficie del modelo. Con este propósito se desarrolló la rutina BoneBuilder en MatLab (4). Esta rutina coloca puntos sobre el contorno y el interior de las siluetas, utilizando una grilla regular que superpone sobre cada una de las imágenes (Fig. 3 c). Los puntos en el volumen son aquellos coincidentes con las intersecciones de las líneas horizontales y verticales de las grillas, mientras que los puntos sobre la superficie están dados por las intersecciones de las líneas de las grillas con el borde de la silueta. De esta forma, resultaron 33.822 puntos para el húmero y 24.872 puntos para la escápula. A modo de ejemplo, se ilustra una vista de la nube de puntos resultante para la escápula (Fig. 4).

Fig. 4. Nube de puntos para la escápula.
La reconstrucción de la superficie de los modelos del húmero y la escápula se realizó por medio del programa MeshSuite (5), que utiliza la técnica de Extended Delaunay Tessellation. De esta forma, la superficie exterior de los modelos queda definida por un conjunto de superficies triangulares (Fig. 5). Como puede observarse en esta figura, algunas regiones de los modelos presentan fuertes discontinuidades, las que son consecuencia de transiciones abruptas de su geometría. Para la solución de este defecto, se utilizó un algoritmo de relajación de las coordenadas de los modos (subrutina SurfSmooth), el que posibilita "suavizar" la superficie del modelo. Debido a que este proceso tiende a eliminar detalles geométricos del modelo, el número de veces que se aplica el algoritmo (sucesivas suavizaciones de la geometría) resulta del compromiso entre la mejora de la calidad de la superficie y la pérdida de precisión en la representación de la geometría. En este trabajo, los mejores resultados fueron obtenidos luego de aplicar dos veces el algoritmo. La geometría suavizada resultante se ilustra en la figura 6.

Fig. 5. Reconstrucción de la superficie de la escápula (geometría sin suavizar).

Fig. 6. Imagen de la escápula luego de la suavización de su superficie.
Finalmente, las geometrías resultantes fueron importadas como sólidos en el programa de modelado por elementos finitos Abaqus(6), el que fue utilizado para la discretización de su volumen utilizando elementos tetraédricos.
Asignación de constantes elásticas
Para modelar el tejido óseo como un sólido continuo se debe implementar un esquema de homogenización de sus propiedades mecánicas utilizando un parámetro que proporcione información sobre su microestructura. Típicamente, la densidad es utilizada con este propósito, para lo que se dispone de un importante número de trabajos en los que se proponen correlaciones entre la densidad aparente del tejidoóseo y sus constantes elásticas (7, 8, 9).
De esta forma, el siguiente paso consiste en la asignación a cada uno de los elementos del modelo de su valor de densidad aparente. En este sentido, es importante mencionar que la densidad reportada por el estudio tomográfico considera no solo la masa del tejidoóseo, sino que incluye además la masa de otros tejidos como médula, grasa y sangre. Esto implica hacer una corrección de la densidad tomada de las tomografías para obtener la densidad aparente del hueso. Esta se define como la masa de hueso mineralizado dividido por el volumen total (bulk volume) incluyendo los poros. Con este propósito se construye una curva de calibración utilizando la metodología propuesta por Taylor et al. (10). Esta consiste en asignar el valor de densidad aparente cero a la fase medular, mientras que la máxima densidad aparente (típicamente 2 gr/cm3) al tejido cortical más compacto. De esta forma y con el objeto de determinar los valores extremos de Unidades Hounsfield (UH), se analizaron 45 tomografías de la diáfisis del húmero, por ser ésta la zona donde se esperan encontrar los valores mínimos (cavidad medular) y máximos (cortical) de densidad. A partir de los resultados de este análisis, se asignó el valor de -137 UH para la densidad aparente r=0 gr/cm3 y 2030 UH para r=2 gr/cm3. Asumiendo una relación lineal entre estos dos puntos, la relación entre densidad aparente y UH quedó finalmente establecida por la siguiente curva de calibración:

Por su parte, se desarrolló la rutina de MatLab Dicom2mat para procesar las imágenes de las tomografías en formato DICOM. De este procesamiento resulta una "caja" con la distribución espacial de densidades (este último en formato estándar vtk). Esta "caja" con la distribución espacial de densidades (dadas por las curvas de nivel de UH), junto con la red de elementos finitos, se ilustra en la figura 7 para el problema en estudio.

Fig. 7. Ilustración con la "caja" con la distribución espacial de densidad (dada por las curvas de nivel de HU) junto con la discretización de elementos finitos.
La asignación de la densidad a cada elemento del modelo se realiza utilizando el programa BoneMat (11). Este programa asigna a cada elemento un valor de densidad, el que se calcula como el promedio de las UH sobre la porción de volumen que cada uno representa. BoneMat se vale con este propósito de la información de la distribución espacial de densidades, la información de la red de elementos finitos y la curva de calibración. En la figura 8 se ilustra el resultado obtenido sobre un corte longitudinal del húmero. En esta figura, cada elemento de la red de elementos finitos fue coloreado de acuerdo con la escala y según el valor de densidad aparente que le fuera asignado.

Fig. 8. Contornos con la distribución espacial de la densidad aparente en una sección longitudinal del húmero. Se aprecia la variación de densidad para los tejidos cortical y esponjoso.
Finalmente, se asigna a cada elemento del modelo los valores de sus propiedades elásticas en función de su densidad utilizando la rutina toAbaqus. El procedimiento desarrollado permite seleccionar para esta tarea entre dos hipótesis, según se considere un comportamiento isótropo (es decir uniforme en todas las direcciones) o transversalmente isótropo (simétrico respecto de un eje perpendicular al plano de isotropía) para el tejido óseo. Las correlaciones entre las propiedades elásticas y la densidad ósea para ambos casos fueron elaboradas a partir de la información disponible en los trabajos de Yang et al. (7), Wirtz et al. (8), Lotz et al. (9) y Dong y Guo (12). La figura 9 ilustra la dependencia del módulo elástico, E, con la densidad, r, de los tejidos trabecular y cortical para el comportamiento isótropo (el coeficiente de Poisson se tomó constante V=0,3 en ambos casos). Por razones de espacio se omite la presentación de los gráficos con las correlaciones para el comportamiento isótropo transversal. Una presentación detallada de las correlaciones las propiedades elásticas con la densidad están disponibles en los trabajos de Buroni y Commisso (13) y D'Amico (14).

Fig. 9. Gráficos de la correlación del valor de los módulos elásticos de los tejidos (a) trabecular y (b) cortical con la densidad para el caso de comportamiento isótropo.
EJEMPLO DE APLICACIÓN
A modo de ejemplo, se presenta en esta sección la aplicación de la metodología descripta al estudio de los esfuerzos sobre el húmero y escápula en el movimiento de abducción en el plano frontal.
Como se ilustra (Fig.10 a) el modelo considera la escápula fija al tórax y las fuerzas de los músculos deltoides y supraespinoso. Los músculos fueron introducidos en el modelo utilizando conectores axiales que representan las tres fibras principales (anterior, media y posterior) de cada uno de los músculos. Se consideraron, además, las fuerzas del peso propio del brazo y la de un peso adicional en la mano. Las zonas de inserción de los músculos fueron modeladas utilizando pequeños suplementos con propiedades del material similares a los del hueso cortical. Se logró de esta forma evitar la acción de fuerzas puntuales sobre el hueso. El cartílago en la zona de la articulación (el que evita el contacto hueso-hueso entre la cabeza del húmero y la escápula) fue modelado como un sólido hiperelástico con comportamiento Neo-Hookeano incompresible (15). Fueron impuestas condiciones de contorno de contacto con deslizamiento entre las superficies de los dos huesos y el cartílago. La figura 10 (b) presenta una vista con los resultados con la distribución de esfuerzos sobre el húmero y la escápula para 70º de abducción frontal.

Fig. 10. (a) Detalle del modelo de elementos finitos y (b) ejemplo con la distribución de la distribución de esfuerzos sobre el húmero y escápula a los 70º del movimiento de abducción en el plano frontal.
CONCLUSIONES
Se presentó en este trabajo una metodología para la construcción de modelos de elementos finitos para el análisis de esfuerzos mecánicos en piezas óseas utilizando imágenes de TC. La metodología propuesta incluye la reconstrucción de la geometría del hueso y la asignación de sus constantes elásticas en función de la densidad aparente. El proceso fue demostrado en la construcción de un modelo para el análisis de la articulación gleno-humeral.
La herramienta presentada es apta para la creación de modelos virtuales individualizados que consideren las características particulares de cada paciente y que ayuden en la exploración y búsqueda de soluciones a problemas específicos antes de la intervención quirúrgica.
Agradecimientos
Los autores desean manifestar su agradecimiento al Dr. Néstor Calvo (Centro Internacional de Métodos Computacionales en Ingeniería, Universidad Nacional del Litoral - CONICET), por facilitar el programa MeshSuite utilizado en este trabajo.
Este trabajo ha sido financiado por el proyecto PICT 12-14114 (2003)"Biomecánica de implantes para miembro superior" de la Agencia Nacional de Promoción Científica y Tecnológica de la República Argentina. Visite el sitio Web del proyecto www.intema.gov.ar/biomecanica para acceder a información adicional sobre este trabajo.
1. Zienkiewicz OC, Taylor RL. The finite Element Method. Volume 1, The Basis. 5th edition. UK: Butterworth- Heinemann; 2000. [ Links ]
2. Cody DD. AAPM/RSNAPhysis tutorial for residents: topics in CT- Image processing in CT. RadioGraphics 2000;22:1255-1268. [ Links ]
3. eFilm Workstation. Departament of Medical Imaging at the University Health Network and Mount Sinai Hospital in Toronto, Canada. http://www.efilm.ca. [ Links ]
4. MatLab 6.5, The Math Works Inc (2000). [ Links ]
5. Calvo N, Idelsohn SR, Oñate E. The Extended Delaunay Tessellation. Engineering Computations 2003;20/5-6. [ Links ]
6. Abaqus V6.4. Rhode Island, USA: Hibbitt, Karlsson& Sorensen Inc., http://www.abaqus.com; 2003. [ Links ]
7. Yang G, Kabel J, Van Rietbergen B, Odgaard A, Huiskes R, Cowin SC. The anisotropic Hooke's Law for cancellous bone and wood. Journal of Elasticity 1999;53:125-146. [ Links ]
8. Wirtz DC, Schiffers N, Pandorf T, Radermacher K, Weichert D, Forst R. Critical evaluation of known bone material properties to realize anisotropic FE-simulation of the proximal femur. Journal of Biomechanics 2000;33:1325-1330. [ Links ]
9. Lotz JC, Gerhart TN, Hayes WC. Mechanical properties of trabecular bone from the proximal femur: a quantitative CT study. Journal of Computed Assisted Tomography 1990;14(1):107-14. [ Links ]
10. Taylor WR, Roland E, Ploeg H, et al. Determination of orthotropic bone elastic constants using FEA and modal analisis. Journal of Biomechanics 2002;35:767-773. [ Links ]
11. BoneMat V2.1. Istituti Ortopedici Rizzoli, Bologna, Italia. http://www.biomedtown.org/biomed_town/B3C_Buildin g/products/bonemat/ [ Links ]
12. Dong XN, Guo E. The dependence of transversely isotropic elasticity of human femoral cortical bone on porosity. Journal of Biomechanics 2004;37/8:1281-1287. [ Links ]
13. Buroni FC, Commisso PE. Modelado numérico computacional de estructuras óseas". Proyecto Final de Ing. Mecánica, Facultad de Ingeniería, Universidad Nacional de Mar del Plata, Argentina. 2004. [ Links ]
14. D'Amico, D.S. (2005). Diseño de un Implante de Articulación Gleno-Humeral. Proyecto Final de Ing. Mecánica, Facultad de Ingeniería, Universidad Nacional de Mar del Plata, Argentina. 2005. [ Links ]
15. Büchler P, Ramaniraka NA, Rakotomanana LR, Iannotti JP, Farron A. Afinite element model of the shoulder: application to the comparison of normal and osteoarthritic joints. Clinical Biomechanics 2002;17:630-639. [ Links ]














