Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de radiología
versión On-line ISSN 1852-9992
Rev. argent. radiol. v.73 n.2 Ciudad Autónoma de Buenos Aires abr./jun. 2009
ABDOMEN - PUESTA AL DÍA
Diagnóstico diferencial de la patología del intestino delgado: un enfoque práctico.
Parte 2: Enfermedad focal
Luis H. Ros Mendoza1, Fernando J. Giménez Cepero2, María Sanchez Ballestín2, Manuel Arnal Monreal3, Pablo R. Ros4
1 Servicio de Radiodiagnóstico. Sector I. Hospital General Royo Villanova. Zaragoza. España. Avenida de San Gregorio, 30. Zaragoza 50015. España.
2 Servicio de Radiodiagnóstico. Sector I. Centro Médico de Especialidades Grande Covián. Zaragoza.
3 Servicio de Radiodiagnóstico. Sector I. Hospital Provincial Nuestra Señora de Gracia. Zaragoza.
4 Department of Radiology. Brigham and Women´s Hospital. Boston. Massachusetts.USA
Correspondencia: Dr. Luis H. Ros Mendoza: lhrosmendoza@gmail.com
Recibido: marzo 2009; aceptado: abril 2009
Received: march 2009; accepted: april 2009.
©SAR-FAARDIT 2009
Resumen
En este segundo artículo sobre la patología del intestino delgado se aborda la patología de carácter local o regional, entre la que se incluyen la enfermedad de Crohn y los tumores.
Consideramos como patología de carácter local o regional en el intestino delgado aquellas entidades focales o bien que afecten a menos de 5 asas intestinales.
Dividiremos la patología focal en inflamatoria y tumoral, poniendo especial énfasis en los hallazgos típicos de la enfermedad de Crohn y presentando estas entidades bajo un enfoque de correlación radiológico-patológica, que resulta útil para comprender los hallazgos semiológicos en las distintas técnicas de formación de imagen.
Palabras clave: Intestino delgado; Enfermedad focal; Enfermedad de Crohn; Tumores; Correlación patológico-radiológica.
Abstract
A pattern approach to the differential diagnosis of small bowel disease. Part two: focal disease
In this second article about small bowel disease we are taking into account focal or regional entities, including Crohn´s disease and tumours.
We are considering as local or regional disease those entities with focal or less than five bowel loops involvement.
So, we divide regional disease in inflammatory and neoplastic conditions, with special mention to radiologic findings in Crohn´s disease and tumours, presenting these entities under a radiologic-pathologic correlation approach, useful to understand the semiological findings of each imaging modality.
Key words: Small bowel; Focal disease; Crohn´s disease; Tumours; Pathologic-radiologic correlation.
INTRODUCCIÓN
El estudio de la patología del intestino delgado sigue sustentándose en la radiología debido a la dificultad de su abordaje mediante técnicas endoscópicas. Nuestro objetivo en este segundo artículo es describir los hallazgos en imagen de la patología focal del intestino delgado, entendiendo como tal aquella que sea localizada o bien afecte a menos de 5 asas intestinales (1). Dividiremos la patología en inflamatoria, con especial mención de los hallazgos de la enfermedad de Crohn (2), y tumoral, presentando correlación radiológico- patológica de la misma.
Las técnicas de estudio principales en el caso del intestino delgado siguen siendo el transito intestinal baritado, la enteroclisis y el estudio mediante tomografía computarizada (TC) (3-5). Técnicas más recientes como la TC-enteroclisis o el estudio mediante resonancia magnética (RM) se encuentran en expansión y muestran grandes opciones, sobre todo en pacientes con enfermedad de Crohn (6,7).
A pesar de que los datos más fiables para la diferenciación entre patología benigna y maligna los aportan los estudios baritados, evaluando los márgenes de la lesión, la presencia o ausencia de pliegues intestinales y el tipo de engrosamiento de la mucosa, los estudios mediante TC pueden ayudar a completar el diagnóstico diferencial (8,9).
Enfermedad de Crohn (EC)
Se define como un proceso inflamatorio, granulomatoso crónico, de etiología desconocida, que puede involucrar cualquier parte del tracto digestivo, fundamentalmente la región de íleon terminal y frecuentemente asociada a afectación del colon derecho. En torno al 55% de los pacientes existe afectación del íleon terminal y del colon; en el 30% de los casos sólo del intestino delgado, mientras que la afectación exclusiva del colon acaece en un 15% (10). La afectación es típicamente segmentaria, asimétrica y tiene un carácter recurrente.
La población diana de la EC suelen ser adultos jóvenes en los que se presenta normalmente de forma insidiosa, con diarreas, dolor, pérdida de peso, aun cuando a veces puede debutar como abdomen agudo simulando un cuadro de apendicitis. Pueden existir también manifestaciones extraintestinales asociadas: artritis periférica seronegativa, espondilitis anquilopoyética, sacroileítis y eritema nodoso.
Se ha propuesto clasificar en 4 subtipos a la enfermedad inflamatoria intestinal, según el grado de actividad inflamatoria (11) (Esquema 1), pudiendo coexistir en un mismo paciente y al mismo tiempo lesiones en distintos estadios. Además, el paciente puede volver a ser recalificado en otra categoría en función de los nuevos hallazgos.

Esquema 1: Clasificación según el grado de actividad de la enfermedad inflamatoria intestinal.
Subtipo activo inflamatorio
Los hallazgos más sutiles son las denominadas "úlceras aftoides", pequeñas sobreelevaciones de la mucosa en relación con la hipertrofia de los folículos linfoides de la submucosa con ulceración central. Están separadas por zonas de mucosa normal (Fig. 1). Éstas no son patognomónicas, ya que se encuentran en otros procesos, como infecciones por yersinia, salmonella, tuberculosis, ricketsia y en otros procesos inflamatorios tipo enfermedad de Behçet, de Reiter o de Betcherew (12), pero son muy sugestivas de EC en el contexto de afectación discontinua y asimétrica de la pared intestinal (13). También puede encontrarse una ligera distorsión de los pliegues intestinales (rectificación de ellos) o ligero edema (Fig. 2). Los estudios baritados deben ser realizados con una técnica exquisita, con sumo detalle y compresión cuidadosa de las asas.

Fig. 1. Enfermedad de Crohn, fase activa inflamatoria. a) En el estudio baritado, en íleon distal, se observan pequeñas imágenes puntiformes de acúmulo de bario rodeadas de edema, que corresponden a úlceras superficiales o aftoides. b) Correlación endoscópica.

Fig. 2. Enfermedad de Crohn, fase activa inflamatoria. a) Discreto enderezamiento, rectificación y engrosamiento de pliegues intestinales de asas yeyunales. b) La correlación de tomografía computarizada (TC) muestra la hiperemia y la estratificación tan propias de la situación inflamatoria activa de la pared intestinal.
En los casos severos ya existen ulceraciones profundas, longitudinales y transversales, que dejan entre sí islotes de mucosa muy edematosa, dando lugar al patrón en "empedrado" (Fig. 3). A nivel del íleon terminal el espasmo secundario a la inflamación justifica el llamado signo de "la cuerda" (Fig. 4). El signo del "asa orgullosa", llamado así por la separación de un asa del resto de estructuras intestinales, está justificado tanto por el espasmo como por la afectación de la grasa mesentérica, ya sea por la presencia de una masa inflamatoria o por cambios proliferativos fibroadiposos (Fig. 5).

Fig. 3. Enfermedad de Crohn, fase activa inflamatoria. a) Ulceraciones longitudinales y transversales que dejan entre sí islotes de mucosa edematosa, constituyendo el patrón en "empedrado" en el estudio baritado. b) Correlación microscópica: ulceración fisurante rodeada de infiltrado inflamatorio, lesión claramente delimitada y rodeada de mucosa normal.

Fig. 4. Enfermedad de Crohn, fase activa inflamatoria. a) En el tránsito baritado: signo de "la cuerda" a nivel del íleon terminal. b) La correlación en TC muestra engrosamiento mural, hiperemia y estratificación.

Fig. 5. Enfermedad de Crohn. a) Signo del "asa orgullosa" en el tránsito intestinal. b) Correlación tomodensitométrica: separación del asa intestinal del resto de asas en relación con la proliferación de la grasa mesentérica.
Cuando la actividad inflamatoria es moderada, los hallazgos en TC post contraste intravenoso son sutiles e inespecíficos. Puede demostrarse moderado edema submucoso, engrosamiento parietal y una ligera hiperemia mucosa.
Cuando el proceso inflamatorio es severo, el engrosamiento de la pared es mayor (pudiendo alcanzar más de 2 cm), así como los hallazgos sugestivos de hiperemia (signo de la diana, signo del peine) que describimos a continuación. Si bien la hiperemia a nivel de las asas intestinales no es patognomónica de la EC, se trata de un marcador de actividad (14).
El signo de la "diana" está en relación con la estratificación de la pared intestinal en tres capas diferenciadas por su atenuación (15). La zona interna de alto valor de atenuación corresponde a la mucosa hiperémica; la zona periférica, también de alto valor de atenuación, a la muscular-serosa, y una zona intermedia entre ambas, de menor valor de atenuación, corresponde a la submucosa edematosa. El signo "de la diana" se observa en los estudios post contraste endovenoso en la fase arterial tardía o venosa precoz (Fig. 6 y 7). También puede visualizarse sin contraste si el edema es severo (16-18). No hay que confundirlo, no obstante, con el "halo" producido por el depósito de grasa en algunos casos de EC crónica, colitis ulcerosa, enfermedad crónica por radiación y otras patologías (9) (Fig. 8).

Fig. 6. Enfermedad de Crohn, fase activa inflamatoria. Signo "de la diana". a) Estudio de TC donde se aprecia engrosamiento parietal estratificado, con hiperemia mucosa y de la muscular-serosa, así como edema submucoso de un asa ileal y del polo cecal. Se asocia prominencia de los vasa recta adyacentes (flechas). b) Hallazgos en el estudio baritado del mismo paciente, con rectificación de los pliegues de un asa ileal y espasmo.

Fig. 7. Enfermedad de Crohn, fase activa inflamatoria. Signo "de la diana" en resonancia magnética (RM). a) Corte de orientación axial potenciado en T1 con saturación grasa post gadolinio intravenoso: engrosamiento estratificado de la pared intestinal con realce mucoso y de la muscularserosa. b) Mismos hallazgos en un corte algo más caudal.

Fig. 8. Enfermedad de Crohn, "signo de la diana" y depósito de grasa parietal. a) Fase activa inflamatoria. Imagen de TC con contraste oral que demuestra el signo de la diana (flecha hueca), la prominencia de los vasa recta (flecha larga) y pequeñas adenopatías mesentéricas en relación con actividad inflamatoria. b) Cambios crónicos: imagen de TC post contraste endovenoso de otro paciente que presenta depósito de grasa en la submucosa de la pared ileal (flecha), en relación con proceso de larga evolución, sin asociar cambios inflamatorios.
Otro signo que indica hiperemia intestinal es la prominencia, tortuosidad y dilatación de los vasa recta que llegan al asa afectada, el denominado signo "del peine" (19, 20) (Fig. 9).

Fig. 9. Enfermedad de Crohn, fase activa inflamatoria. a) El signo del peine en resonancia magnética, secuencia potenciada en T1, imagen de orientación coronal. b) Secuencia potenciada en T2, corte coronal, muestra la prominencia y dilatación de los vasa recta.
Asimismo, podemos encontrar adenopatías mesentéricas de pequeño tamaño en relación con el proceso inflamatorio activo.
Subtipo fistulizante perforante
En este subtipo, además de los hallazgos indicadores de proceso inflamatorio activo, aparece estriación de la grasa mesentérica y se detecta la progresión de las ulceraciones profundas, produciendo trayectos sinusales, las denominadas ulceraciones en "espina de rosal", tal como se definen en los estudios baritados (Fig. 10).

Fig. 10. Enfermedad de Crohn, subtipo fistulizante-perforante. Este subtipo se caracteriza por la presencia de ulceraciones penetrantes en el contexto de un proceso inflamatorio activo de la pared. a) Estudio baritado que revela la existencia de ulceraciones penetrantes, con su aspecto serpiginoso y anfractuoso. b) Correlación microscópica: se aprecia una ulceración profunda, irregular, rodeada por el infiltrado inflamatorio.
A partir de las ulceraciones penetrantes pueden surgir trayectos fistulosos de todo tipo, muy característicos de este proceso, y a partir de las fístulas, es posible la formación de abscesos.
Subtipo fibroestenosante
No hay signos sugestivos de proceso inflamatorio activo, apreciándose zonas de estenosis segmentaria, generalmente no muy largas, con dilatación preestenótica. Consecuencia de la afectación asimétrica y discontinua de la pared intestinal se pueden encontrar rectificación y enderezamiento del borde mesentérico asociado a una serie de saculaciones en el borde antimesentérico, un tanto similares a las de la esclerodermia (aun cuando presentan un mecanismo patogénico diferente).
En las técnicas seccionales únicamente se aprecia un engrosamiento parietal uniforme, sin signos de edema ni de afectación inflamatoria activa, como la hiperemia o la estratificación de la pared (Fig.11).

Fig. 11. Enfermedad de Crohn. Subtipo fibroestenosante. a) Estenosis segmentarias cortas, con dilataciones preestenóticas en el estudio baritado. b) Engrosamiento parietal sin realce en el estudio TC (flechas).
Subtipo regenerativo
Tampoco existen signos de actividad inflamatoria. La mucosa es atrófica pero presenta pólipos hipertróficos de aspecto regenerativo. Puede existir alguna discreta zona de estenosis (Fig.12).

Fig. 12. Enfermedad de Crohn, fase reparativa-regenerativa. a) Presencia de pólipos regenerativos en el tránsito baritado. b) Correlación macroscópica con pieza de anatomía patológica.
En general, la presencia de estratificación en una pared intestinal engrosada se utiliza en los estudios TC post contraste endovenoso para excluir el diagnóstico de malignidad. Este patrón puede ser de "doble halo" o de "diana".
La extensión y la localización del proceso también deben ser evaluadas y aunque neoplasias y condiciones benignas se solapan ampliamente en cuanto a la longitud de los segmentos intestinales afectados, con pocas excepciones (principalmente el linfoma), segmentos largos de afectación indican condición benigna (21).
El grado de engrosamiento mural también ayuda a establecer el diagnóstico. Normalmente, las entidades benignas presentan un engrosamiento moderado (< 2 cm) y las condiciones malignas un engrosamiento más acusado (> 3 cm). No obstante, existe bastante solapamiento entre estas dos situaciones, pudiendo haber engrosamiento marcado en condiciones inflamatorias e isquémicas o tratarse de lesiones tumorales con engrosamiento moderado (9).
Otra característica útil es la existencia de estriación de la grasa mesentérica adyacente a un asa intestinal engrosada, que debe hacer sospechar un proceso inflamatorio. Su ausencia hace menos probable el diagnóstico de proceso inflamatorio. Además, si el grado de estriación de la grasa mesentérica es desproporcionadamente más severo que el grado de engrosamiento parietal, nos ayuda a diferenciar el tipo de proceso inflamatorio, sugiriendo diverticulitis, apendicitis o inflamación de apéndices epiploicos (22).
TUMORES DEL INTESTINO DELGADO
Son poco frecuentes. Representan sólo del 5 al 10% del total de los tumores del tracto digestivo, por tanto, el índice de sospecha clínica es bajo y el diagnóstico suele hacerse en fases tardías.
Se clasifican en:
Benignos: adenoma de glándulas de Brunner, lipoma, tumores neurogénicos, hamartoma mioepitelial, pólipo fibroide inflamatorio.
Tumores benignos con potencial maligno: pólipos adenomatosos, tumores de músculo liso (como el leiomioma y el leiomioblastoma).
Tumores malignos: adenocarcinoma, carcinoide, leiomiosarcoma, linfoma y metástasis.
Adenomas, leiomiomas y lipomas suponen los tres principales tumores benignos del intestino delgado. Por lo general, los tumores benignos ocurren menos frecuentemente en el duodeno y aumentan en frecuencia conforme se alcanza el íleon (23,24).
Las causas más frecuentes de una lesión pedunculada del íleon son el lipoma, el pólipo fibroide inflamatorio o un divertículo de Meckel invertido (25).
En la actualidad, el término tumores del estroma gastrointestinal (GIST) incluye el leiomioma y el leiomiosarcoma. Los tumores del estroma gastrointestinal pueden encontrarse en cualquier parte del tracto digestivo y también en mesenterio, omento o retroperitoneo. Los localizados en intestino delgado suelen tener origen en la muscular propia, por lo que su crecimiento es predominantemente exofítico, siendo mucho menos comunes las formas intramurales o intraluminales. Los originados en mesenterio o intestino delgado tienen tendencia al sangrado y a la necrosis. No obstante, sus características radiológicas no permiten una correcta diferenciación de otros tumores no epiteliales que asientan en intestino delgado (26).
Adenocarcinoma
Supone el 50% de los tumores malignos del intestino delgado, pero sólo un 1% de las tumoraciones gastrointestinales (27). Generalmente es único y de localización proximal en duodeno. Se presenta como una estenosis anular irregular excéntrica, con bordes prominentes. Aveces puede presentar forma polipoidea o ulcerada, y como frecuentemente se sitúa cerca de la ampolla de Vater, puede debutar con ictericia. Son muy raros en el yeyuno (28) (Fig. 13 y 14).
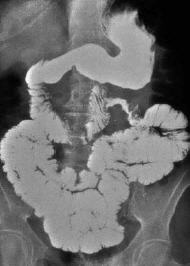
Fig.13. Adenocarcinoma. Tránsito digestivo convencional. Imagen estenosante con interrupción brusca del patrón mucoso normal de yeyuno proximal. Los márgenes de transición son abruptos.

Fig.14. Adenocarcinoma. a) Hallazgos incidentales en estudio ecográfico. Sección transversal de un segmento intestinal yeyunal que demuestra engrosamiento irregular parietal. b) Correlación en TC que demuestra el engrosamiento mural irregular del asa intestinal. c) y d) Tránsito digestivo.
Carcinoide
Es el tumor primario más frecuente del intestino delgado. Generalmente son de localización ileal, donde casi siempre son de naturaleza maligna. A veces, el tumor es múltiple y, en una etapa inicial, cuando no ha dado engrosamiento de pliegues ni retracción del mesenterio, se presenta como un defecto de repleción endoluminal redondeado y de contornos netos, cuyo tamaño no suele superar los 4 cm de diámetro. El tumor puede ser de pequeño tamaño, siendo, en este caso, las adenopatías regionales y la reacción desmoplásica en la raíz del mesenterio las únicas manifestaciones visibles de la enfermedad (29) (Fig. 15).

Fig.15. Tumor carcinoide. a) Defecto de repleción endoluminal ileal en estudio de enteroclisis, sin signos de retracción en asas intestinal adyacentes. b) Correlación macroscópica. Lesión ocupante de espacio, endoluminal, sin infiltración mural ni de estructuras mesentéricas.
Metástasis
Son la entidad tumoral que con mayor frecuencia se diagnostica en el intestino delgado. En ocasiones asientan en el borde mesentérico, pero son más frecuentes en el antimesentérico, porque es la zona donde terminan las ramificaciones vasculares (30). El tumor que con más frecuencia metastatiza en el intestino delgado es el melanoma (Fig. 16).

Fig. 16. Metástasis de melanoma. a) El estudio baritado intestinal muestra un gran efecto de masa y alteración del patrón mucoso del asa intestinal afectada, siendo la zona de transición abrupta. b) Estudio de TC con contraste intraluminal: gran masa hipodensa que rodea y estrecha la luz del asa intestinal. c) La correlación anatomopatológica macroscópica muestra varios implantes tumorales con pigmento melánico en ambos bordes, mesentérico y antimesentérico, aunque predominan los localizados en este último.
Leiomioma
Tumor benigno primario sintomático más frecuente del intestino delgado. Se manifiesta como una lesión intraluminal originada a partir de la musculatura lisa. A veces hay componente exoentérico y presenta una base de implantación amplia. Tiene forma redondeada. Aun a pesar de la tendencia a sangrar de este tipo de tumores, es muy difícil en el transcurso del examen baritado la demostración de una úlcera. Ello está en relación con que generalmente son pequeñas o de carácter lineal (Fig. 17).

Fig. 17. Leiomioma y leiomiosarcoma. a) Estudio digestivo convencional. Defecto de repleción endoluminal bien definido, con preservación del detalle mucoso, correspondiente a leiomioma. b) Correlación macroscópica de la pieza de anatomía patológica que muestra pequeñas zonas de ulceración y sangrado, no visibles en el estudio radiológico. c) Leiomiosarcoma. Lesión cavitaria visible en el estudio baritado. Este tipo de cavitación de gran tamaño se considera como muy representativo de este tipo de tumor.
Leiomiosarcoma
Es la vertiente maligna del leiomioma. El diagnóstico diferencial entre ambas entidades puede ser difícil, pero en el leiomiosarcoma son mucho más frecuentes las ulceraciones, a veces de gran tamaño, similares a la cavitación. Este es un criterio semiológico muy útil para el diagnóstico del mismo (27, 31, 32) (Fig. 17 c).
Pólipo fibroide inflamatorio
Es una tumoración benigna, que puede alcanzar gran tamaño, ocasionando invaginación intestinal. Se presenta en la sexta y séptima décadas y no tiene potencial maligno. En la histología muestra un componente fibroso con infiltrado inflamatorio de predominio eosinofílico, por lo que también se le denominó granuloma eosinofílico (Fig. 18).

Fig. 18. Pólipo fibroide inflamatorio. a) Imagen de intususcepción en estudio baritado intestinal, dependiente de tumoración endoluminal (cabeza de flecha). b) Correlación con pieza macroscópica que muestra ocupación de la luz intestinal por formación tumoral. c) Correlación microscópica que muestra la anatomía patológica de la lesión centrada por un tallo conectivo y el infiltrado inflamatorio a su alrededor.
Hamartoma mioepitelial
Está en íntima relación con los restos pancreáticos, el adenomioma o el adenoma de glándulas de Brunner. No tiene aspecto característico en las imágenes radiológicas, por lo que no se puede realizar a través de ellas el diagnóstico preciso de esta entidad.
Adenoma velloso
Se localiza típicamente en el duodeno. Se clasifican en tubulares, vellosos y túbulovellosos. En la superficie de los que tienen componente velloso quedan atrapadas estrías de bario que permiten el diagnóstico específico (Fig. 19).

Fig. 19. Adenoma velloso. Estudio baritado que muestra el tumor con su típica superficie "vellosa", a cuyo nivel quedan atrapados restos del contraste, en una localización duodenal.
Otras lesiones
La enteritis por radiación en su fase crónica (más de 12 meses) da lugar a segmentos de intestino fijos, poco distensibles y con estenosis. Estos cambios recuerdan a los encontrados en la enfermedad de Crohn o en la isquemia (24).
El sarcoma de Kaposi se presenta como masas submucosas múltiples que pueden tener ulceración (25). Otra de las entidades que entre sus manifestaciones puede tener la de una lesión focal es el linfoma. Las formas nodulares y las estenosantes plantearán el diagnóstico diferencial con el resto de entidades descritas (33).
Quiste de duplicación entérica ileocecal: lesión infrecuente que afecta fundamentalmente a intestino delgado, sobre todo íleon terminal, aunque también puede verse en ciego. De diagnóstico en época pediátrica, puede provocar intususcepción si su localización esta próxima a la válvula ileocecal. En TC aparece como una estructura quística redondeada o tubular, llena de líquido, con fino realce de pared (34).
Endometriosis del área ileocecal: Es muy rara. Puede afectar los 10 centímetros más distales del íleon, manifestándose como áreas excéntricas de estrechamiento. La historia clínica puede ayudar al diagnóstico (35).
1. Ros LH, Gutiérrez C, Guillén ME, Galbe R, Ros PR. Diagnóstico diferencial de la patología del intestino delgado: un enfoque práctico. Parte 1: Enfermedad difusa. Rev Arg Radiol 2008;72(2):157-164 [ Links ]
2. Ros LH, Crespo AM, Giménez FJ, Marcuello T, Galbe R. Diagnóstico por imagen en la enfermedad inflamatoria intestinal. Radiología 2006;48(4):205-215. [ Links ]
3. Ott DJ, Chen YM, Gelfand DW, Van Swearingen F, Munitz HA. Detailed per oral small bowel examination versus enteroclysis. Radiology 1985;155:29-34. [ Links ]
4. Maglinte DDT, Lappas JC, Kelvin FM, Rex D. Small bowel radiography: how, when and why? Radiology 1987;163:297-305. [ Links ]
5. Ros LH, Abril E, Galbe R. Estudio radiológico del intestino delgado. Radiología 2006;48(1):1-7. [ Links ]
6. Umschaden HW, Gasser J. MR enteroclisis. Radiol Clin North Am 2003;41(2):231-248. [ Links ]
7. Maglinte DDT, Sandrasegaran K, Lappas JC, Chiorean M. CT Enteroclysis. Radiology 2007;245(3):661-671. [ Links ]
8. Balthazar EJ. CT of the gastrointestinal tract: principles and interpretation. AJR Am J Roentgenol 1991;156:23-32. [ Links ]
9. Macari M, Balthazar EJ. CT of bowel wall thickening: significance and pitfalls of interpretation. AJR Am J Roentgenol 2001;176:1105-1116. [ Links ]
10. Moum B, Ekbom A. Epidemiology of inflammatory bowel disease- methodological considerations. Dig Liver Dis 2002;34:364-369. [ Links ]
11. Maglinte DDT, Gourtsoyiannis N, Rex D, Howard TJ, Kelvin FM. Classification of small bowel Crohn's subtypes based on multimodality imaging. Radiol Clin North Am 2003;41(2):285-303. [ Links ]
12. Ramos González L. Intestino delgado. En: Sánchez Álvarez-Pedrosa C, Casanova R, eds. Diagnóstico por imagen. Tratado de radiología clínica. Madrid: McGraw-Hill - Interamericana de España; 2000:481-527. [ Links ]
13. Caroline DF, Friedman AC. The radiology of inflammatory bowel disease. Med Clin North Am 1994;78:1353-1385. [ Links ]
14. Booya F, Fletcher JG, Huprich JE, et al. Active Crohn disease: CT findings and interobserver agreement for enteric phase CT enterography. Radiology 2006;241(3):787-795. [ Links ]
15. Ahualli J. The target sign: Small bowel. Radiology 2005;234:549-550. [ Links ]
16. Gore RM. CT of inflammatory bowel disease. Radiol Clin North Am 1989;27: 717-723. [ Links ]
17. Gore RM, Balthazar EJ, Ghahremani GG, Miller FH. CT features of ulcerative colitis and Crohn's disease. AJR Am J Roentgenol 1996;167:3-15. [ Links ]
18. Raptopoulos V, Schwartz RK, McNicholas MMJ, Mouson J, Pearlman J, Joffe N. Multiplanar helical CT enterography in patients with Crohn's disease. AJR Am J Roentgenol 1997;169:1545-1550. [ Links ]
19. Meyers MA, MacGuire PV. Spiral CT demonstration of hypervascularity in Crohn's disease: ''vascular jejunization'' of the ileum or the ''comb sign''. Abdom Imaging 1995;20:327-332. [ Links ]
20. Madureira AJ. The comb sign. Radiology 2004;230:783-784. [ Links ]
21. Hoeffel C, Crema MD, Belkacem A, et al. Multi-detector row CT: spectrum of diseases involving the ileocecal area. RadioGraphics 2006; 26:1373-1390. [ Links ]
22. Pereira JM, Sirlin CB, Pinto PS, Jeffrey RB, Stella DL, Casola G. Disproportionate fat stranding: a helpful CT sign in patients with acute abdominal pain. RadioGraphics 2004;24:703-715. [ Links ]
23. Rubesin SE, Furth EE. Differential diagnosis of small intestinal abnormalities with radiologic-pathologic explanation. In: Herlinger H, Maglinte DDT, Birnbaum BA, eds. Clinical imaging of the small intestine. 2nd edition. New York: Springer;1999:527-566. [ Links ]
24. Rubesin SE. Simplified approach to differential diagnosis of small bowel abnormalities. Radiol Clin N Am 2003;41:343-364. [ Links ]
25. Rubesin SE, Herlinger H. Small bowel: differential diagnosis. In: Gore RM, Levine MS, eds. Textbook of gastrointestinal radiology. Philadelphia: WB Saunders;2000:884-891. [ Links ]
26. Levy AD, Remotti HE, Thompson WM, Sobin LH, Miettinen M. Gastrointestinal stromal tumors: radiologic features with pathologic correlation. Radiographics 2003;23(2):283-304. [ Links ]
27. Trenkner SW, Halvorsen RA, Thompson WM. Neoplasms of the upper gastrointestinal tract. Radiol Clin North Am 1994;32:15-24. [ Links ]
28. Teplick SK, Glick SN, Keller MS. The duodenum. In: Putnam CE, Ravin CE, eds. Textbook of Diagnostic Imaging. Philadelphia: Saunders;1988:808-846. [ Links ]
29. Jeffree MA, Barter SJ, Hemingway AP, Nolan DJ. Primary carcinoid tumors of the ileum: the radiological appearances. Clin Radiol 1984;35:451-455. [ Links ]
30. Buckley JA, Fishman EK. CT evaluation of small bowel neoplasms: spectrum of disease. RadioGraphics 1998;18:379-392. [ Links ]
31. Starr GF, Dockerty MB. Leiomyomas and leiomyosarcomas of the small intestine. Cancer 1955;8:101-111. [ Links ]
32. Megibow AJ, Balthazar EJ, Hulnick DH, Naidich DP, Bosniak MA. CT evaluation of gastrointestinal leiomyomas and leiomyosarcomas. AJR Am J Roentgenol 1985;144:727-731. [ Links ]
33. Balthazar EJ, Noordhoorn M, Megibow AJ, Gordon RB. CT of small-bowel lymphoma in immunocompetent patients and patients with AIDS: comparison of findings. AJR Am J Roentgenol 1997;168:675-680. [ Links ]
34. Tong SC, Pitman M, Anupindi SA. Ileocecal enteric duplication cyst: radiologic-pathologic correlation. RadioGraphics 2002;22:1217-1222. [ Links ]
35. Carmato VJ, Levine MS, Herlinger H, Wickstrom M, Furth EE, Tureck RW. Ileal endometriosis: radiographic findings in five cases. Radiology 2000;214:509-512. [ Links ]














