Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de radiología
versión On-line ISSN 1852-9992
Rev. argent. radiol. vol.73 no.3 Ciudad Autónoma de Buenos Aires jul./set. 2009
VASCULAR
Anomalías congénitas de la arteria aorta. Evaluación mediante tomografía computada multicorte en neonatos y niños
Diego Haberman1, Enrique Gurfinkel1, Alejandro Beresñak1, Adriana Martínez1, Rosa Emsani1, Rubén Toledo2
1 Servicio de Diagnóstico por Imágenes.
2 Cirugía Cardiovascular Infantil. Fundación Favaloro.
Avenida Belgrano 1746. Ciudad de Buenos Aires. República Argentina.
Correspondencia: Dr. Diego Haberman: mail:diegohaberman@yahoo.com.ar
Recibido: abril 2009; aceptado: julio 2009
Received: april 2009; accepted: july 2009
©SAR-FAARDIT 2009
Resumen
Para la evaluación de los defectos congénitos de la arteria aorta, los métodos de imágenes utilizados tradicionalmente son la ecocardiografia y la radiología simple. La angiotomografía computada multicorte aparece como un método de relevancia en el diagnóstico de estas entidades, permitiendo evaluar en forma no invasiva, rápida y precisa las distintas anormalidades, otorgando de esta manera información sumamente útil a los cirujanos cardiovasculares para definir la estrategia quirúrgica. En el presente artículo revisamos las aplicaciones de la angiotomografia computada multicorte en la evaluación de las malformaciones congénitas de la arteria aorta más frecuentes en el periodo neonatal y en la primera infancia.
Palabras clave: Arteria aorta; Anomalías congénitas; Neonatos; Angiotomografia computada multicorte.
Abstract
Congenital abnormalities of aortic artery. Assessment in neonates and early childhodd with multislice tomography
In the evaluation of aortic artery congenital abnormalities, the echocardiography and the plain X ray are the traditionally used imaging methods. Multislice angiotomography appears as an important method in diagnosis of these different diseases allowing evaluate these entities in a non invasive, fast and accurate form, giving to cardiovascular surgeons very important information to delineate the surgical strategy. In this article, we review the applications of multislice angiotomography in the evaluation of most frequent congenital anomalies of aorta artery, performed in neonates and early childhood.
Key words: Aorta artery; Congenital anomalies; Neonates; Multislice angiotomography.
INTRODUCCION
La angiotomografía (angioTC) multicorte presenta muchas virtudes y es utilizada cada vez con mayor frecuencia por los cirujanos cardiovasculares infantiles como método de imagen de elección en el mapeo anatómico y patológico de las distintas anormalidades del arco aórtico. La capacidad multiplanar y especialmente las reconstrucciones tridimensionales son de fácil interpretación para los especialistas, siendo, por otra parte, sumamente rápidos los estudios, con bajo tiempo anestésico y poco volumen de contraste a administrar.
El objetivo del presente estudio fue realizar una revisión de los hallazgos en tomografía computada (TC) multicorte de las anomalías en el desarrollo del arco aórtico más frecuentemente encontradas en nuestra institución.
MATERIAL Y METODOS
Fueron evaluados en forma retrospectiva los estudios de angiotomografía realizados entre octubre de 2006 y noviembre de 2008 a 12 pacientes que presentaban anomalías congénitas de la arteria aorta. La totalidad de los pacientes incluidos en el presente estudio eran neonatos y niños pequeños con un rango de edad comprendido entre 6 días y 11 meses. Lospacientes contaban con ecocardiografía y/o radiografía de tórax frente previas, las que, en asociación con los síntomas, permitieron efectuar un diagnóstico presuntivo (Tabla 1).

Los estudios se efectuaron con un tomógrafo multicorte de 64 hileras de detectores (Toshiba, Aquilion) utilizando software de modulación de dosis de radiación (Sure Exposure) con dosis efectiva entre 0,6 a 1, 4 mSv. Se obtuvieron imágenes de 0,5 mm de espesor con 0,3mm de intervalo de reconstrucción. Factor pitch de 0,828. Rotación de tubo en 0,5seg.
Bajo anestesia y monitoreo cardiaco se inyectaron entre 1 y 1, 5 ml/ kg de contraste intravenoso no iónico (Iopamiron 370®, Schering) con bomba inyectora (Medrad, Stellant) a un flujo de 1,5 a 2,5 ml/seg.
Se efectuaron reconstrucciones tridimensionales en estación de trabajo (Vitrea, Vital Images).
Todos los pacientes se hallaban sintomáticos y fueron intervenidos quirúrgicamente, lo que permitió correlacionar lo observado por los diferentes métodos de imagen con los hallazgos intraoperatorios asumidos como diagnósticos definitivos de certeza.
En 11 casos, el diagnóstico presuntivo con el que arribaron a nuestro servicio fue similar al diagnóstico efectuado por angiotomografia. En un paciente, la angioTC mostró una patología no sospechada que luego fue confirmada en la cirugía.
Reseña embriológica Los vasos sanguíneos comienzan a desarrollarse a partir del mesodermo que cubre el saco vitelino a los 18 días de edad del embrión. El día 24, el sistema cardiovascular está compuesto por dos tubos cardiacos, vasos arteriales y venosos. Posteriormente, ambostubos cardiacos se fusionan para formar un corazón tubular, el que desarrolla cuatro dilataciones llamadas seno cavernoso, aurícula, ventrículo y bulbo cardiaco.
El corazón comienza un proceso de plegamiento y tabicación. Posteriormente, el bulbo cardiaco se divide en tres partes: una proximal, una intermedia, llamada tronco arterioso, y una distal, llamada saco aórtico. Las dos grandes arterias que nacen del corazón no se originan de vasos preexistentes sino del tronco arterioso, el cual primero se tabica y luego se divide para formar dos vasos independientes, la arteria aorta ascendente y el tronco de la arteria pulmonar.
Del saco aórtico nacen 6 pares de arcos aórticos que conectan a los esbozos aórticos ventral y dorsal. Algunos de ellos involucionan normalmente con el desarrollo, persistiendo a fines de la quinta semana solo los arcos tercero, cuarto y sexto, que darán origen luego a los grandes vasos (1).
RESULTADOS
En el presente estudio fueron incluidos doce pacientes sintomáticos que contaban, todos ellos, con una ecocardiografía previa. Un paciente con diagnóstico de coartación por ecocardiografía fue interpretado por angio tomografía como interrupción del arco aórtico tipo A, lo que fue confirmado en la cirugía. En los 11 pacientes restantes existió coincidencia entre la ecocardiografía y la angioTC. Ninguno de nuestros pacientes fue sometido a una RM.
Casos clínicos
Coartación
En nuestra casuística es la entidad más frecuente, con 5 pacientes estudiados con angioTC prequirúrgica (41,6%).
Es una anomalía congénita caracterizada por un estrechamiento focal de la luz aórtica. La estenosis suele hallarse en la aorta descendente proximal luego de la emergencia de la arteria subclavia izquierda. Teniendo en cuenta su relación con el ductus arterioso, se las clasifica en preductales, postductales o yuxtaductales (2, 3).
Se presentan habitualmente otras anomal ías cardiovasculares, entre ellas, válvula aórtica bicúspide, hipoplasia de la porción transversa del cayado, dilatación de aorta ascendente, ductus persistente, arteria subclavia derecha aberrante (4) (Fig.1).

Fig. 1. Paciente de sexo masculino de 6 días de vida. Reconstrucción 3D.Plano sagital. Coartación de típica localización en aorta descendente, distal a la emergencia de la arteria subclavia izquierda (flecha). Relativa hipoplasia de la porción transversa del cayado aórtico (cabezas de flecha).
Hay hipertensión de la extremidad superior que tiende a compensarse con desarrollo de colaterales intercostales, epigástricas y mediastinales (Fig. 2).

Fig. 2. Paciente de sexo femenino de 14 días de vida. Signos de insuficiencia cardiaca, discrepancia de pulsos y soplo sistólico dorsal. Plano sagital. Reconstrucción en máxima intensidad. Coartación severa (flecha) con continuidad a aorta descendente a través de un flujo filiforme y por circulación colateral intercostal (cabeza de flecha). A.M.I: Arteria mamaria interna. En cirugía se comprueba el diagnóstico. Se realiza resección de la coartación con anastomosis término-terminal y ligadura del ductus, el que se hallaba permeable (no visible en angioTC).
Los lactantes con coartación, en particular cuando existe un ductus arterioso persistente, se presentan con signos de insuficiencia cardiaca congestiva, (taquicardia y disnea). Se suele escuchar un soplo sistólico dorsal y se constatan pulsos y presiones diferenciales en los miembros inferiores.
El diagnóstico se sustenta en los hallazgos clínicos y en los métodos por imagen (ecocardiografía, angiografía, angiotomografia, resonancia magnética).
La tomografía computada nos ofrece información del sitio y extensión de la estenosis, aspecto de las colaterales, presencia de anomalías asociadas, siendo actualmente una modalidad sumamente útil en el seguimiento postratamiento quirúrgico o percutáneo (Fig. 3).
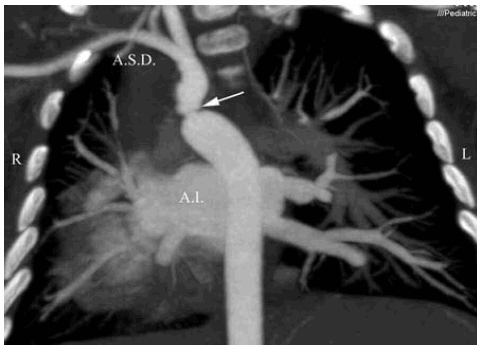
Fig. 3. a) Paciente de sexo femenino de 2 meses de vida. Plano coronal: Situs inversus totalis más coartación (flecha). A.S.D.: Arteria subclavia derecha. A.I.: Aurícula izquierda. Se realiza toracotomía derecha, sección de la coartación y anastomosis término-terminal.
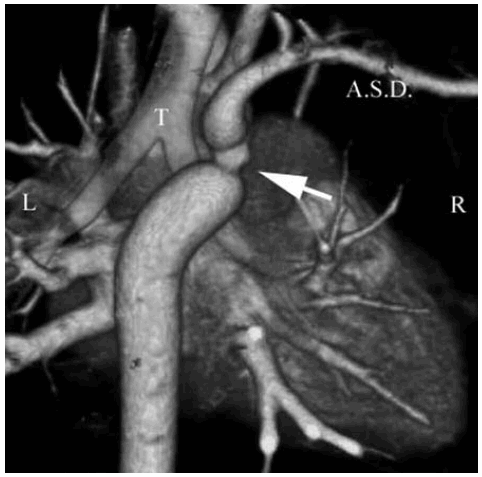
Fig. 3. b) Reconstrucción 3D. Vista posterior. Coartación (flecha). A.S.D.: Arteria subclavia derecha. T.: Tráquea.
Interrupción del arco aórtico
Se define por la pérdida de continuidad anatómica entre la aorta ascendente y la descendente y es considerada una forma extrema de coartación. El flujo hacia la aorta descendente está dado por el ductus, que permanece permeable y brinda continuidad entre el tronco de la arteria pulmonar y la aorta distal a la interrupción. A pesar de esta continuidad, la sangre que llega al abdomen y miembros inferiores está solo parcialmente oxigenada. En la mayoría de los casos se asocian otras anomalías cardiovasculares, como comunicación interventricular (CIV), obstrucción en el tracto de salida del ventrículo izquierdo, válvula aórtica bicúspide y ductus arterioso persistente.
Los pacientes evolucionan rápidamente luego del nacimiento con insuficiencia cardiaca congestiva severa, tendencia al shock y, en caso de no tratarse, suelen fallecer en el periodo neonatal a los pocos días del nacimiento (5).
Su incidencia es baja, alrededor de 3 casos por millón de nacidos vivos y representa el 1 % de todas las anomalías cardiovasculares. En nuestro trabajo fueron 3 de los 12 pacientes estudiados.
De acuerdo con el sitio donde se produce la interrupción, se las clasifica en tres tipos:
Tipo A: Distal a la arteria subclavia izquierda.
Tipo B: Entre la arteria carótida común izquierda y la arteria subclavia izquierda.
Tipo C: Entre el tronco arterial braquiocefálico y la arteria carótida común izquierda.
El tipo B es el más frecuente (53%), seguido del tipo A (43%) y del tipo C (4%) (6).
La angioTC muestra claramente la interrupción, su relación con los troncos supraaórticos, así como también la presencia del ductus que brinda continuidad entre la arteria pulmonar y la aorta descendente (Esquemas 1 y 2)(Fig. 4, 5, 6)

Esquema 1: Esquema ilustrativo de la interrupción del arco aórtico tipo A. VD: Ventrículo derecho. VI: Ventrículo izquierdo. AP: Arteria pulmonar. AAo Asc: Arteria aorta ascendente. AAo Desc: Arteria aorta descendente. Tr Bc: Tronco arterial braquiocefálico. ACPI: Arteria carótida primitiva izquierda. ASI: Arteria subclavia izquierda.

Esquema 2: Esquema ilustrativo de la interrupción del arco aórtico tipo B. VD: Ventrículo derecho. VI: Ventrículo izquierdo. AP: Arteria pulmonar. AAo Asc: Arteria aorta ascendente. AAo Desc: Arteria aorta descendente. Tr Bc: Tronco arterial braquiocefálico. ACPI: Arteria carótida primitiva izquierda. ASI: Arteria subclavia izquierda.

Fig. 4. a) Paciente de sexo femenino.Interrupción del arco aórtico tipo A. Plano Sagital. Reconstrucción en máxima intensidad. La aorta torácica se interrumpe en el sector posterior del cayado (flecha), en situación distal a la arteria subclavia izquierda (ASI). La aorta descendente recibe flujo de la arteria pulmonar (AP) a través de un ductus permeable (cabeza de flecha).
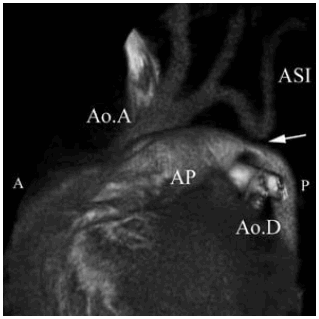
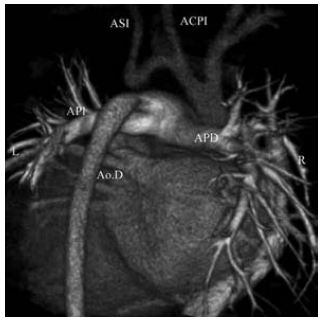
Fig. 4. b) Reconstrucción en 3D. Plano oblicuo anterior izquierdo. Ao.A.: Aorta ascendente. Ao.D.: Aorta descendente. AP: Arteria pulmonar. ASI: Arteria subclavia izquierda. Interrupción del arco aórtico (flecha). c) Reconstrucción 3 D. Vista oblicua posterior. APD: Arteria pulmonar derecha. API: Arteria pulmonar izquierda. ACPI: Arteria carótida primitiva izquierda. ASI: Arteria subclavia izquierda. Ao.D.: Aorta descendente. En la cirugía se liga el ductus, se reseca la zona interrumpida con posterior anastomosis que involucra el arco aórtico, la boca de la arteria subclavia y la aorta descendente.

Fig. 5. a) Paciente de sexo femenino de 5 días de vida. Distress respiratorio. Shock cardiogénico. Interrupción aórtica tipo B. Reconstrucción 3 D. Hay disociación entre la aorta ascendente y descendente, la cual tiene continuidad con el tronco de la arteria pulmonar. La interrupción es entre la arteria carótida y subclavia izquierda, la que emerge de la aorta descendente. Ao.A.: Aorta ascendente. A.C.P.I.: Arteria carótida primitiva izquierda. A.S.I.: Arteria subclavia izquierda.
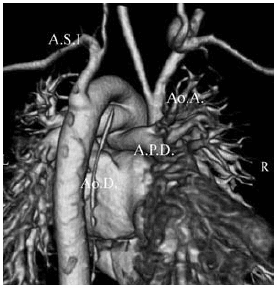
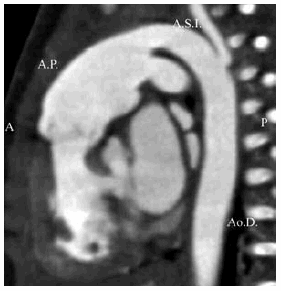
Fig. 5. b) Reconstrucción 3 D. Vista posterior. Ao.A.: Aorta ascendente. Ao.D.: Aorta descendente. A.P.D.: Arteria pulmonar derecha. A.S.I.: Arteria subclavia izquierda. c) Plano sagital. La arteria pulmonar (A.P.), dilatada, se continúa con la aorta descendente (Ao.D.), de la cual se origina la arteria subclavia izquierda. (A.S.I.).


Fig. 5. d y e) Plano coronal. La arteria aorta y la arteria pulmonar se originan una de las cavidades ventriculares correspondientes. V.I.: Ventrículo izquierdo. V.D.: Ventrículo derecho. A.P.: Arteria pulmonar. Ao.A.: Aorta ascendente.

Fig. 6. Fotografía quirúrgica. A.P.: Arteria pulmonar dilatada. Ao.A.: Aorta ascendente.
Tronco arterioso
El tronco arterioso (TA) se caracteriza por la presencia de una gran arteria única que se origina de la base del corazón con un anillo valvular único, la que da origen a las arterias coronarias, pulmonares y sistémicas. En la mayoría de los casos existe una comunicación interventricular y el tronco suele originarse justamente por encima de este defecto del septum. Resulta de una falla en el desarrollo embrionario precoz por falta de división del precursor arterial primario (tronco arterioso) en arterias aorta y pulmonar, eventualidad que debe suceder en el feto normal a las 8 semanas de gestación aproximadamente. Es una patología con baja incidencia, representa aproximadamente el 0,7 % de los defectos cardiovasculares congénitos. Puede asociarse con otras alteraciones, entre ellas, el arco aórtico a la derecha, la coartación e interrupción del arco aórtico (asociación presente en el 14 % de los TA), y también a anomalías extracardiacas, particularmente síndrome de Di George (anomalías faciales, paladar hendido, hipoplasia del timo e hipocalcemia) (7).
Existen dos sistemas de clasificación anatómica que toman en cuenta básicamente el origen de las arterias pulmonares: el de Collet-Edwards y de Van Praagh (8, 9).
Clasificación de Collet - Edwards
Tipo I. Existe un pequeño tronco que se separa y del cual se originan las ramas derecha e izquierda de la arteria pulmonar.
Tipo II. Ambas arterias nacen de la cara posterior del TA separadas por una corta distancia.
Tipo III. Cada arteria nace independiente de la cara lateral de TA, alejadas entre sí.
Tipo IV. Una rama nace del tronco, la otra de la aorta descendente o del ductus.
Van Praagh cuestiona la clasificación de Collet, especialmente el tipo IV, e introduce algunas modificaciones teniendo en cuenta la presencia o no de comunicación interventricular e interrupción del arco aórtico.
Utiliza el prefijo Apara indicar la presencia de CIV o B para el septum intacto. Por otra parte, en el tipo IV incluye al TA asociado a la interrupción del arco (10).
Hay un flujo pulmonar aumentado con mezcla de sangre sistémica y pulmonar.
La mayoría de los niños se presentan en etapas tempranas con cianosis debido a la mezcla de sangre oxigenada y desoxigenada y con signos de insuficiencia cardiaca congestiva. El pronóstico, si no se realiza una corrección quirúrgica, es malo, con una supervivencia del 25 % a los 6 meses (11) (Esquemas 3 y 4) (Fig. 7, 8).

Esquema 3: Esquema ilustrativo del tronco arterioso tipo III. VD: Ventrículo derecho. VI: Ventrículo izquierdo. CIV: Comunicación interventricular. TA: Tronco arterioso. APD: Arteria pulmonar derecha. API: Arteria pulmonar izquierda.
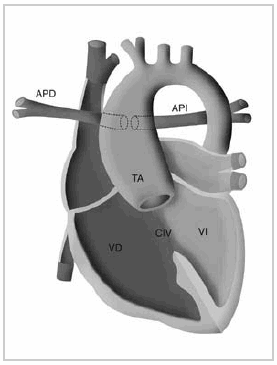
Esquema 4: Esquema ilustrativo del tronco arterioso tipo II. VD: Ventrículo derecho. VI: Ventrículo izquierdo. CIV: Comunicación interventricular. TA: Tronco arterioso. APD: Arteria pulmonar derecha. API: Arteria pulmonar izquierda.


Fig. 7. a) Paciente de sexo masculino de 3 semanas de vida. Disnea, taquicardia y cianosis. Tronco arterioso tipo III. Plano coronal. Extensa comunicación interventricular (C.I.V.) por encima de la cual se origina una gran arteria única que se denomina tronco arterioso (T.A.). V.I.: Ventrículo izquierdo. V.D.: Ventrículo derecho. A.D.: Aurícula derecha. b) Plano coronal. Imagen a 5 mm en sentido posterior a foto previa. Del tronco arterioso (T.A.) se origina un pequeño tronco común que va a formar el tronco arterial braquiocefálico (Tr.B.) y la arteria carótida primitiva izquierda (A.C.P.I.).


Fig. 7. c) La arteria pulmonar derecha se origina de la cara lateral del tronco arterioso (T.A.). d) Plano de corte a 5 mm en sentido posterior a la imagen previa. La arteria pulmonar izquierda (A.P.I.) nace alejada y a diferente altura de la arteria pulmonar derecha. Al mismo nivel, el tronco arterioso se continúa con la aorta descendente.

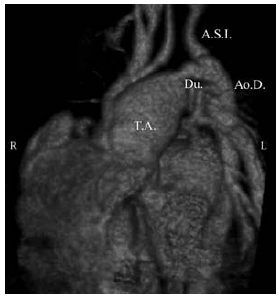


Fig. 8. Tronco arterioso tipo II. Reconstrucción 3D. Vista anterior. Del tronco arterioso (T.A.) emerge un pequeño tronco común (T.C.) que va a dar origen a la arteria carótida primitiva izquierda (A.C.P.I.) y al tronco arterial braquiocefálico (Tr.Br.). El tronco arterioso se continúa con la aorta descendente (Ao. D.) a través del ductus permeable (Du.). A.C.P.D.: Arteria carótida primitiva derecha. A.S.D.: Arteria subclavia derecha. A.S.I.: Arteria subclavia izquierda. b) Reconstrucción 3D. Vista oblicua anterior. T.A.: Tronco Arterioso. Du.: Ductus. Ao.D.: Aorta descendente. A.S.I.: Arteria subclavia izquierda. c) Reconstrucción 3D. Vista posterior. Las arterias pulmonares se originan cercanas entre sí desde la cara posterior del tronco arterioso. A.P.D.: Arteria pulmonar derecha. A.P.I.: Arteria pulmonar izquierda. Ao.D.: Aorta descendente. d) Fotografía quirúrgica. T.A.: Tronco arterioso. T.C.: Tronco común. V.C.S.: Vena cava superior.
Anillos vasculares
Corresponden a configuraciones anormales del arco aórtico que resultan de una regresión incompleta de uno de los seis arcos branquiales presentes durante el desarrollo embriológico. Las estructuras vasculares o el ligamento arterioso rodean y comprimen la traquea y el esófago provocando síntomas como estridor, dificultad respiratoria, atrapamiento aéreo y apnea; la compresión esofágica provoca vómitos, dificultad al tragar y disfagia. Predisponen a la aparición de neumonías por aspiración (12).
Pueden ser completos, formando un anillo continuo alrededor de la traquea y esófago, o bien incompletos, casos donde los síntomas suelen ser menores o incluso estar ausentes (13).
Existen diversas formas de anillos vasculares:
Síndrome de la arteria innominada anómala. El tronco arterial braquiocefálico se origina del cayado pero más hacia la izquierda que lo habitual, motivo por el cual cruza diagonalmente por delante de la tráquea y puede tener cierto grado de compresión de su cara anterior.
Arco aórtico doble. Puede existir como arco aórtico completo (funcional), en el que hay persistencia y permeabilidad de los arcos derecho e izquierdo o bien como arco doble, con atresia parcial de uno de ellos (habitualmente el izquierdo), donde la continuidad está dada por un cordón fibroso remanente que completa el anillo. Esta última variante es más frecuente.
Los troncos supraaórticos emergen cada uno por separado, sin un tronco arterial braquiocefálico, esto es, arteria subclavia y carótida derechas, arteria subclavia y carótida izquierdas, lo que se denomina signo de los cuatro vasos. Cuando el arco menor está atrésico, generalmente el cordón fibroso aparece distal a la emergencia de la arteria subclavia izquierda.
En estos casos, en ocasiones se puede interpretar en forma errónea como un arco aórtico a la derecha; sin embargo, se suele ver el signo de los cuatro vasos y, por otra parte, en el lado atrésico suele permanecer un pequeño segmento permeable previo al cordón fibroso manifestado como un divertículo posterior al esófago (Esquema 5)(Fig. 9).
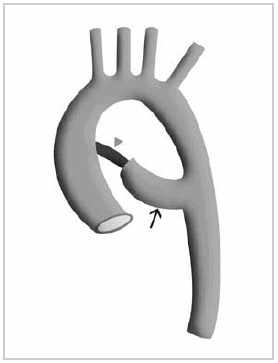
Esquema 5: Esquema ilustrativo del arco aórtico doble incompleto. Divertículo que corresponde al sector permeable del arco doble (flecha larga). Cordón fibroso que completa el arco (cabeza de flecha).

Fig. 9. a) Sexo masculino, 5 meses de edad. Dificultad respiratoria progresiva y estridor. Arco aórtico doble con atresia del componente izquierdo. Plano coronal. Divertículo del arco izquierdo atrésico (flecha). A.S.D.: Arteria subclavia derecha. A.S.I.: Arteria subclavia izquierda.

Fig. 9. b) Reconstrucción 3D. Vista oblicua superior. Las arterias emergentes del cayado aórtico emergen cada una en forma independiente (signo de los cuatro vasos). A.C.P.I.: Arteria carótida primitiva izquierda. A.C.P.D.: Arteria carótida primitiva derecha. A.S.I.: Arteria subclavia izquierda. A.S.D.: Arteria subclavia derecha. Divertículo del arco izquierdo atrésico (flecha).

Fig. 9. c) Plano axial. Compresión del bronquio fuente derecho con signos de atrapamiento aéreo de dicho pulmón.
Arco aórtico a la izquierda con arteria subclavia derecha aberrante. En la literatura no se lo considera un anillo verdadero; sin embargo, en algunas oportunidades, suele provocar síntomas considerables, de forma similar a los anillos verdaderos. En estos pacientes, la arteria subclavia derecha no se origina del tronco arterial braquiocefálico sino que emerge en forma individual como el último vaso del arco aórtico y sigue un trayecto retroesofágico para dirigirse luego hacia arriba y a la derecha (Fig. 10).

Fig. 10. a) Sexo femenino, 11 meses de edad. Disfagia y neumonías a repetición. Plano axial. Arteria subclavia derecha aberrante con trayecto retroesofágico. Consolidaciones del espacio aéreo en el lóbulo superior derecho con algunos sectores hipodensos con aspecto de neumonía aspirativa. A.S.D.: Arteria subclavia derecha. T.: Tráquea. Esófago dilatado (flecha).

Fig. 10. b) A.S.D.: Arteria subclavia derecha. Ao.D.: Aorta descendente.
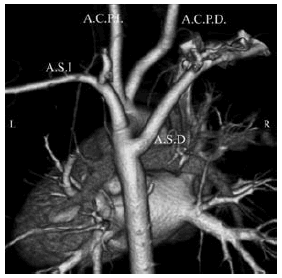
Fig. 10. c) Reconstrucción 3D. Vista posterior. A.S.D.: Arteria subclavia derecha. A.S.I.: Arteria subclavia izquierda. A.C.P.D.: Arteria carótida primitiva derecha. A.C.P.I.: Arteria carótida primitiva izquierda. En cirugía se realiza toracotomía postero-lateral derecha, sección de la arteria aberrante en la base y su reimplante en la arteria carótida homolateral.
Arco aórtico a la derecha con arteria subclavia izquierda aberrante.La arteria subclavia izquierda aberrante es el último tronco en salir. La presencia del ligamento arterioso completa un anillo verdadero. Suelen ser sintomáticos a temprana edad.
DISCUSION
Tradicionalmente, las anomalías congénitas del arco aórtico eran evaluadas mediante ecocardiografía o radiología convencional y, en algunas ocasiones, por angiografía convencional. En los últimos años la resonancia magnética (RM) y la angioTC, especialmente con tecnología multicorte, cobraron relevancia en el diagnóstico y mapeo prequirúrgico de las distintas anormalidades (14 - 16).
Cada una de estas modalidades presenta ventajas y desventajas que deben ser consideradas a la hora de elegir cuál utilizar.
Los pacientes neonatos e infantes pequeños presentan una frecuencia cardiaca de entre 100 a 160 latidos por minuto por lo cual es fundamental contar con equipamiento que tenga alta resolución temporal a fin de reducir los movimientos por latido cardiaco, disminuyendo también el tiempo de exposición a la radiación y el tiempo anestésico y también con alta resolución espacial debido al pequeño tamaño de los órganos a estudiar.
La tomografía computada multicorte cumple con estas especificaciones. En los equipos de 64 hileras de detectores la resolución espacial es de 0,35 mm y la resolución temporal de 0,4 segundos, permitiendo en un apnea de 3 a 5 segundos obtener una adquisición de todo el tórax de un neonato o niño pequeño. Es necesaria una sola adquisición volumétrica para luego realizar reconstrucciones multiplanares y tridimensionales.
Cabe mencionar que con angio TC es posible efectuar estudios "gatillados" o sincronizados, obteniéndose imágenes en distintas fases del electrocardiograma, lo que permite reconstruirlas en la fase de menor movimiento y reducir los artificios por latido.
Sin embargo, la adquisición gatillada insume mayor radiación, por lo que se utiliza en muy pocas ocasiones, cuando es absolutamente necesario definir la anatomía de la raíz aórtica (donde mayor movimiento suele haber).
La angio TC tiene como desventaja la utilización de radiación y eventuales reacciones adversas al yodo.
Con equipos de RM de campo alto y secuencias rápidas se logran imágenes de alta calidad y resolución espacial milimétrica. Se obtienen secuencias planares en distintas orientaciones, imágenes en hasta 20 fases durante el ciclo cardiaco que se visualizan como cine y secuencias angiográficas 3D (17).
Una de las ventajas de este método es que brinda información morfológica y funcional, con la posibilidad de medir flujos y gradientes de presión. Esto último puede ser utilizado como pronóstico de gravedad en situaciones como la coartación (18). Permite, además, visualizar la anatomía y la función de las válvulas cardiacas, lo que resulta de utilidad en las anomalías del arco aórtico que se asocian con malformaciones valvulares (coartación - válvula aórtica bicúspide).
Otra ventaja de la RM es que no utiliza radiación ionizante, lo que es de importancia en aquellos casos que requieren la repetición de estudios para control.
Como una desventaja se señala su tiempo de adquisición, el que a veces resulta un impedimento para la realización del estudio en pacientes con mal estado general y que no resisten una anestesia prolongada. Los estudios insumen entre 20 - 40 minutos, tiempo mayor que el de la angioTC.
La decisión de la modalidad a utilizar reside básicamente en la disponibilidad y experiencia de cada servicio de imágenes en particular.
A nuestro criterio, la TC presenta la ventaja de ser un estudio sumamente rápido y fácil de programar y que exige menor complejidad del proceso anestésico.
CONCLUSION
La angiotomografía computada aparece como un método complementario sumamente útil en el diagnóstico de las anomalías congénitas del arco aórtico en neonatos y pacientes en primera infancia. Es un procedimiento no invasivo y rápido, que insume bajo tiempo anestésico y poca carga de contraste intravenoso. En nuestra casuística permitió diagnosticar en forma eficaz y precisa todas las anomalías estudiadas, con excelente correlación con los hallazgos quirúrgicos reportados por los cirujanos.
Agradecimientos: Técnicos Radiólogos Gustavo Bisignano, Adrián Mancinelli, Héctor Juárez, Alejandro Steimberg.
1. Hib, José. Embriología médica. 7ª Ed. Santiago- Chile: McGraw-Hill / Interamericana de Chile; 1999. p. 124-141. [ Links ]
2. Becker C, Soppa C, Fink U, et al. Spiral CT angiography and 3D reconstruction in patients with aortic coarctation. Eur Radiol 1997;7(9):1473-1477. [ Links ]
3. Lee EY, Siegel MJ, Hildebolt CF, Gutierrez FR, Bhalla S, Fallah JH. MDCT Evaluation of thoracic aortic anomalies in pediatric patients and young adults: comparison of axial, multiplanar, and 3d images. AJR Am J Roentgenol 2004;182:777-784 [ Links ]
4. Sebastià C, Quiroga S, Boyé R, Perez-Lafuente M, Castellà E, Alvarez-Castells A. Aortic stenosis: spectrum of diseases depicted at multisection CT. RadioGraphics 2003;23;S79-91 [ Links ]
5. Collins-Nakai RL, Dick M, Parisi-Buckley L, Fyler DC, Castaneda AR. Interrupted aortic arch in infancy. J Pediatric 1976;88:958-962. [ Links ]
6. Celoria GC, Patton RB. Congenital absence of the aortic arch. Am Heart J 1959;58:407-413. [ Links ]
7. Konstantinov IE, Karamlou T, Blackstone EH, et al. Truncus arteriosus associated with interrupted aortic arch in 50 neonates: a Congenital Heart Surgeons Society Study. Ann Thorac Surg 2006;81;214-223. [ Links ]
8. Collet RW, Edwards JE. Persistent Truncus arteriosus: Aclassification according anatomic types. Surg Clin North Am 1949;29(4):1245-70. [ Links ]
9. Van Praagh, S; Van Praagh R. The anatomy of common aortopulmonary trunk (truncus arteriosus communis) and its embryologic implications. A study of 57 necropsy cases. Am J Cardiol 1965;16:406-25. [ Links ]
10. Van Praagh R. Truncus arteriosus: what is it really and how should it be classified. Eur J Cardiothorac Surgery 1987;1(2):65:70. [ Links ]
11. Caffey. Diagnóstico por imágenes en pediatría. Buenos Aires: Editorial Médica Panamericana; 1992. p. 424-425. [ Links ]
12. Lowe G, Donaldson J, Backer C. Vascular Rings: 10 years review of imaging. Radiographics 1991;11:637-646. [ Links ]
13. Berrocal T, Madrid C, Novo S, Gutiérrez J, Arjonilla A, Gómez-León N. Congenital anomalies of the tracheobronchial tree, lung and mediastinum: embryology, radiology and pathology. Radiographics 2004;24(1):e-17. [ Links ]
14. Haramati LB, Glickstein JS, Issenberg HJ, Haramati N, Crooke GA. MR Imaging and CT of vascular anomalies and connections in patients with congenital heart disease: significance in surgical planning. Radiographics 2002;22:337-349. [ Links ]
15. Kersting-Sommerhoff BA, Sechtem UP, Fisher MR, Higgins CB. MR imaging of congenital anomalies of the aortic arch. AJR Am J Roentgenol 1987;149:9-13, [ Links ].
16. Goo HW, Park IS, Ko JK, et al. CT of congenital heart disease: normal anatomy and typical pathologic conditions. RadioGraphics 2003;23:S147-S165 [ Links ]
17. Kellenberger CJ, Yoo SJ, Büchel ER. Cardiovascular MR imaging in neonates and infants with congenital heart disease. RadioGraphics 2007;27:5-18. [ Links ]
18. Nielsen JC, Powell AJ, Gauvreau K, Marcus EN, Prakash A, Geva T. Magnetic Resonance imaging predictors of coarctation severity. Circulation. 2005;111:622-628. [ Links ]














