Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de radiología
versión On-line ISSN 1852-9992
Rev. argent. radiol. vol.74 no.3 Ciudad Autónoma de Buenos Aires jul./set. 2010
NEURORRADIOLOGÍA - ARTÍCULO ORIGINAL
Aportes de la espectroscopía por resonancia magnética en las lesiones cerebrales
Alberto Surur1, José Facundo Cabral1, Alberto Marangoni1, Silvio Marchegiani1, Claudio Palacios2, Enrique Herreras3, Julio Suárez3
1 Servicio de Radiología.
2 Servicio de Neurología del Sanatorio Allende.
3 Servicio de Neurocirugía. Sanatorio Allende. Av. Hipólito Irigoyen 384. Córdoba - República Argentina.
Correspondencia: Dr. Alberto Surur: asurur@hotmail.com
Recibido: agosto 2009; aceptado: junio 2010
Received: august 2009; accepted: june 2010
©SAR-FAARDIT 2010
Resumen
Introducción: La Espectroscopía por Resonancia Magnética (ERM) es una técnica no invasiva que permite un análisis del metabolismo de las lesiones o del tejido normal, aumentando la especificidad del método. De esta manera, a la información morfológica aportada por las imágenes de resonancia magnética (RM) se le suma la información bioquímica que brinda la ERM. Si bien el "gold standard" para establecer el diagnóstico definitivo de una lesión cerebral sigue siendo la biopsia, la ERM es un método no invasivo y libre de complicaciones que posibilita determinar el tipo de lesión y evitar biopsias innecesarias en procesos no tumorales. El objetivo del presente trabajo es comprobar si la ERM monovóxel protón de hidrógeno (H+) de tiempo de eco (TE) largo es capaz de discriminar la naturaleza tumoral o no de las lesiones cerebrales y clasificarlas en grados de malignidad.
Material y método: Se trata de un estudio prospectivo en el que se incluyó a pacientes de ambos sexos y de distintas edades a los que se les realizó un estudio estándar de RM completado con ERM monovoxel.
Resultados: Se analizaron 47 lesiones y se caracterizaron adecuadamente 43 (92,9%), con una sensibilidad (S) del 96,8% (IC 89-100), una especificidad (E) del 89,6% (IC 76-100), un valor predictivo positivo (VPP) del 91,1% (IC 80-100) y un valor predictivo negativo (VPN) del 96,3% (IC 87-100). Muchas son las variables que influyen en la adquisición de un espectro factible de ser analizado, pudiendo surgir de éstas diferencias inter-observador. Sin embargo, se obtuvieron resultados similares a los de otras publicaciones.
Conclusión: La ERM sumada a la RM demostró ser un método confiable para determinar la naturaleza tumoral o no de una lesión cerebral, con valores estadísticos aceptables.
Palabras Clave: Resonancia magnética; Espectroscopia; Monovóxel; Tumores cerebrales.
Abstract
The contribution of the Magnetic Resonance Spectroscopy in the brain lesions Introduction
The Magnetic Resonance Spectroscopy (MRS) is a non-invasive technique which allows study of the metabolism of lesions or of normal tissue, increasing the method's specificity. In this way, the biochemical information provided by MRS is added to the morphologic information provided by the Magnetic Resonance Imaging (MRI). Even though the gold standards to determine the definite diagnosis of a brain lesion is still the biopsy, the MRS is a non-invasive method, free of complications which would help determine the type of lesion and avoid unnecessarybiopsies in non-tumor processes. The objective of this work is to determine if the monovoxel MRS hydrogen proton (H+) long Eco Time (TE) is capable to differentiating or not the nature of the tumor from the brain lesions and classify them into levels of malignity.
Material and Method: This is a retrospective study in which female and male patients of any ages were selected. A standard study of MRI was performed in them and it was completed with monovoxel ERM.
Results: 47 lesions were analyzed and 43 (92.9%) were adequately characterized, with a sensibility (S) of 96.8% (IC 89-100), specificity (E) of 89.6% (IC 76-100), positive predictive value (PPV) of 91.1% (IC 80-100) and a negative predictive value (NPV) of 96.3% (IC 87-100). There are many variables that can influence the acquisition of a spectrum capable of being analyzed and from them, inter-observer differences can emerge. However, our results were similar to those in other publications.
Conclusion: The MRS together with the MRI proved to be a reliable method to determine whether a brain lesion is a tumor or not, with acceptable statistic values.
Key Words: Magnetic Resonance Imaging; Spectroscopy; Monovoxel; Brain Tumors.
Introducción
El avance de la resonancia magnética (RM) en los últimos años ha posibilitado la realización de diagnósticos eficientes en gran número de patologías, entre ellas las neoplasias cerebrales (NC), con una exactitud que va ¡ del 30 al 90%, según el tipo de tumor (1, 2). Sin embargo, debido a la alta sensibilidad pero baja especificidad de este método, hay lesiones que plantean diagnósticos diferenciales con las NC, como es el caso de las displasias corticales, los abscesos, las encefalitis, los infartos en período subagudo y algunas formas pseudo tumorales de esclerosis múltiple (EM). Es ya desde hace algún tiempo que se ha incorporado a la espectroscopía por resonancia magnética (ERM) como método auxiliar de diagnóstico en forma complementaria a la RM a fin de aumentar la especificidad de este método.
La ERM es una técnica que básicamente realiza un análisis no invasivo del metabolismo del tejido a estudiar, determinando las concentraciones relativas de sus metabolitos y las interacciones producidas entre ellos. De esta manera, a la información morfológica que aporta la RM se suma la información bioquímica que brinda la ERM.
Si bien el "gold standard" para establecer el diagnóstico definitivo de una lesión cerebral sigue siendo la biopsia, la ERM ayudaría en determinados casos a evitar biopsias innecesarias (en procesos no tumorales o en tumores no accesibles) y, en otros, a dirigir la biopsia a la zona de mayor anaplasia.
El objetivo del presente trabajo es determinar si la ERM monovóxel protón de hidrógeno (H+) de TE largo es capaz de discriminar la naturaleza tumoral o no de las lesiones cerebrales. Para esto se calculará la sensibilidad (S), la especificidad (E), el valor predictivo positivo (VPP) y el valor predictivo negativo (VPN) de las lesiones estudiadas mediante ERM con su correlación anatomopatológica. Como objetivos secundarios se plantea la posibilidad de describir la existencia de patrones espectrales característicos para cada grupo de lesiones y en base a ellos realizar su clasificación.
Materiales y métodos
Para determinar la utilidad de la ERM en el diagnóstico de las lesiones cerebrales, se realizó un estudio prospectivo en el que se estudiaron pacientes de ambos sexos y de diferentes edades portadores de lesiones cerebrales. Se incluyó, además, a sujetos con cirugía previa de patología tumoral conocida en los que se deseaba investigar recidiva o respuesta al tratamiento y un grupo control normal. El período de tiempo que abarcó el estudio se extendió desde marzo de 2007 a septiembre de 2008 inclusive.
Para poder realizar las comparaciones, los pacientes fueron sometidos a un estudio estándar de RM en el que se practicaron secuencias ponderadas en T1, Spin Eco (SE) en planos sagital y axial (TR/TE/Nex- 540/15/2), con ponderación en T2, TSE en planos axial y coronal (4470/110/2), y Fluid Attenuation Inversion Recovery (FLAIR) en plano axial (11000/2800/140).
Se completó con ERM monovóxel (H+) con secuencias PRESS (Point Resolved SpectroscopicSequence) utilizando un vóxel de 20 x 20 x 20 cm3, en un resonador Phillips Intera
Fueron analizados los picos de los metabolitos, NAcetil Aspartato (NAA) a 2.0 ppm, Colina (Cho) a 3.2 ppm, Creatina (Cre) a 3.0 ppm, Lípidos (Líp) entre 0,9 y 1,3 ppm, Lactato (Lac) a 1.3 ppm y las relaciones entre sí.
Para el análisis de los espectros se tuvo en cuenta el pico máximo de cada metabolito en estudio y en base a ello se calcularon las relaciones entre sí, tomando la Cre como referencia.
Los hallazgos obtenidos tanto en RM como en la ERM monovóxel fueron analizados por dos radiólogos con experiencia que desconocían los resultados de la anatomía patológica (AP). Estos datos fueron cotejados con los resultados anatomopatológicos de las lesiones obtenidos mediante biopsia estereotáxica o cirugía. No se realizó biopsia a las lesiones con sospecha clínica e imagenológica de benignidad, las que se controlaron en forma evolutiva, ni al grupo control.
El análisis estadístico de los diferentes espectros se realizó mediante el programa Epidat 3.1® para determinar el grado de exactitud del diagnóstico obtenido y la capacidad del método para discriminar entre lesiones de naturaleza tumoral y no tumoral mediante las variables S, E, VPP, VPN.
Dependiendo de los resultados de AP, los casos se clasificaron en cinco grupos: lesiones no tumorales (LNT); tumores de bajo grado (TBG), grupo en el que se incluyó a las lesiones clasificadas por AP como grado I o II; tumores anaplásicos (TA), grado III de la clasificación anatomopatológica de los tumores cerebrales; por último, glioblastoma multiforme o metástasis (GBM-MTS). El quinto grupo correspondió al grupo control normal. El grupo de LNT se dividió en tres subgrupos por la gran variedad de lesiones heterogéneas que comprende, y por ello de difícil comparación, quedando conformado de la siguiente manera: lesiones con gliosis, lesiones quísticas o necróticas y lesiones desmielinizantes o inflamatorias.
En cuanto a los grupos, se calcularon las medias de los valores de cada metabolito con sus desviaciones estándares en base a su relación (razón) con la Cre y los resultados se reunieron en tablas que luego se graficaron.
Resultados
Se recolectó un total de 67 pacientes (36 mujeres y 31 hombres), pero solo se analizaron los espectros resultantes de 57 pacientes (de ellos, 47 presentaban lesiones y 10 pertenecían al grupo control normal), 33 mujeres (57,9%) y 24 hombres (42,1%), con edades comprendidas entre 12 y 81 años (media de 35 años). Diez pacientes (3 mujeres y 7 hombres) fueron excluidos, uno por ser portador de un tumor cerebral y no contar con los resultados anatomopatológicos para efectuar la comparación y los 9 restantes porque se obtuvieron espectros con demasiado artefacto y de mala calidad que no permitían su correcto análisis.
Se caracterizaron adecuadamente 43 de 47 lesiones cerebrales (92,9%), con tres hallazgos falsos positivos y un falso negativo, lo que arrojó los siguientes valores estadísticos: S del 96,8% (IC 89-100); E del 89,6% (IC 76-100); VPP del 91,1% (IC 80-100) y un VPN del 96,3% (IC 87-100) (Gráfico 1).
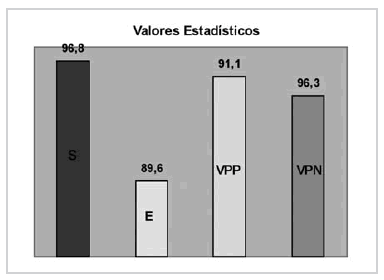
Gráfico 1. Valores estadísticos.
El grupo de LNT quedó conformado por un total de 18 pacientes: 8 en el subgrupo de lesiones con gliosis, 4 en el de lesiones quísticas-necróticas y 6 en el de lesiones desmielinizantes-inflamatorias (en su mayoría no se les realizó biopsia, solo control evolutivo, ya que su apariencia y su evolución eran benignas y no presentaban modificaciones, a excepción de una lesión necrosada y una leucoencefalopatía multifocal progresiva (LEMP), que fueron hallazgos falso positivos). En el grupo de TBG se incluyó a 15 pacientes (ganglioglioma (n=1); TNED (n=1); hamartoma (falsopositivo) (n=1); astrocitomas grado I (OMS) (n=2); astrocitomas grado II (n=5); oligodendrogliomas (n=4) y oligoastrocitoma (n=1)). El grupo TA estaba integrado por 6 pacientes (astrocitomas anaplásicos (n=3) y oligodendroglioma anaplásico (n=3)). Al grupo GBM-MTS lo formaban 8 pacientes (GBM (n=5) y MTS (n=3), de melanoma (falso negativo), pulmón y mama) y al grupo control normal 10 pacientes (ver Tablas y Gráficos 2 al 8).
Tabla 1: Grupo normal (valores correspondientes a la razón de la Cre con los diferentes metabolitos, media y desvío estándar).

Tabla 2: Lesiones no tumorales desmielinizantes/inflamatorias (valores correspondientes a la razón de la Cre con los diferentes metabolitos, media y desvío estándar).

Tabla 3: Lesiones no tumorales necróticas/quísticas (valores correspondientes a la razón de la Cre con los diferentes metabolitos, media y desvío estándar).

Tabla 4: Lesiones no tumorales con gliosis (valores correspondientes a la razón de la Cre con los diferentes metabolitos, media y desvío estándar).

Tabla 5: Lesiones de bajo grado de malignidad (I-II) (valores correspondientes a la razón de la Cre con los diferentes metabolitos, media y desvío estándar).

Tabla 6: Lesiones anaplásicas (III) (valores correspondientes a la razón de la Cre con los diferentes metabolitos, media y desvío estándar).

Tabla 7: Lesiones de alto grado (GBM-MTS) (valores correspondientes a la razón de la Cre con los diferentes metabolitos, media y desvío estándar).

Gráfico 2. Medias de los valores obtenidos para las lesiones no tumorales (Desm./Infl.). Aumento de la concentración relativa de Cho y leve descenso del NAA.
Gráfico 3. Medias de los valores obtenidos para las lesiones no tumorales (necróticas/quísticas). Se observa en el gráfico un descenso de la mayoría de los picos y aumento de Lac.
Gráfico 4. Medias de los valores obtenidos para las lesiones no tumorales (con gliosis).

Gráfico 5. Medias de los valores obtenidos para las lesiones de bajo grado de malignidad (I-II). Se observa suba de Cho y caída del NAA.
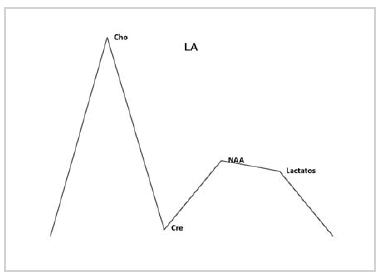
Gráfico 6. Medias de los valores obtenidos para las lesiones anaplásicas (III). Franco incremento de Cho, descenso del NAA y presencia de Lac.
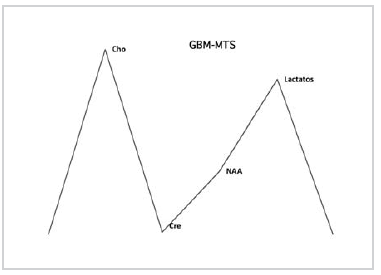
Gráfico 7. Medias de los valores obtenidos para las lesiones de alto grado (GBM-MTS). Marcada elevación de Lac y Cho.

Gráfico 8. Relación Cho/NAA en los diferentes grupos.
En los casos de gliosis se objetivó un leve incremento de la Cho, un descenso del NAA, observándose en un caso un leve ascenso del Lac.
En las lesiones con necrosis o quísticas se cuantificó una marcada disminución de todos los picos con un crecimiento significativo de Líp y Lac (Fig. 1).
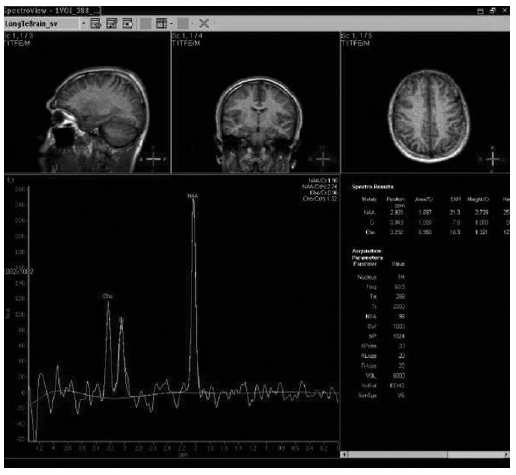
Fig. 1. Grupo normal: relación normal entre los picos de Cho, Cre y NAA.
En el grupo de las lesiones desmielinizantes o inflamatorias se visualizó, en la mayoría de los casos, un aumento leve del pico de la Cho, manteniéndose normal o levemente disminuido el pico del NAA y en aproximadamente la mitad de los casos se encontró un leve incremento de Líp y Lac (Fig. 2).

Fig. 2. Lesión inflamatoria temporal derecha: aumento del pico de Cho y leve disminución del pico NAA.
En el grupo de TBG, se encontró que la mayoría de las lesiones cursaban con una elevación de la Cho y una baja del NAA, en relación con neoproliferación e injuria celular, respectivamente, sin identificarse picos de Líp o Lac de manera significativa (Fig.3).

Fig. 3. Tumor de bajo grado: aumento franco del pico Cho y descenso significativo del pico NAA.
En cambio, en los TAse notó un ascenso significativo de Cho, un descenso también significativo de NAA y elevación de picos en la zona del espectro correspondiente a Líp y Lac (Fig.4); por último, en el grupo de GBM-MTS, no siempre se encontró incremento significativo de la Cho, probablemente debido a un mayor componente de necrosis, aunque sí se evidenció una marcada caída del NAA y un aumento significativo de los picos en la zona de Líp y Lac (Fig.5 a-b).
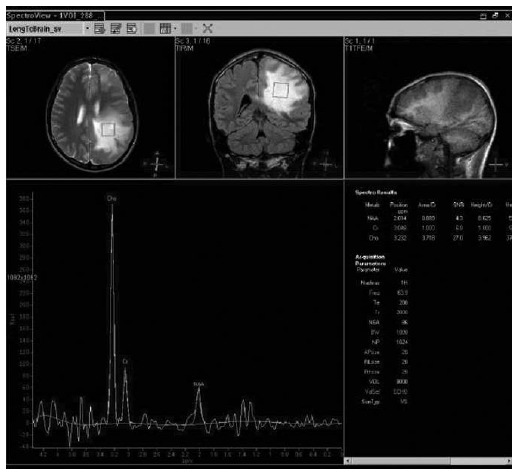
Fig. 4. Tumor anaplásico: similar hallazgo que en la Fig. 3, pero con aparición de picos de Lac.
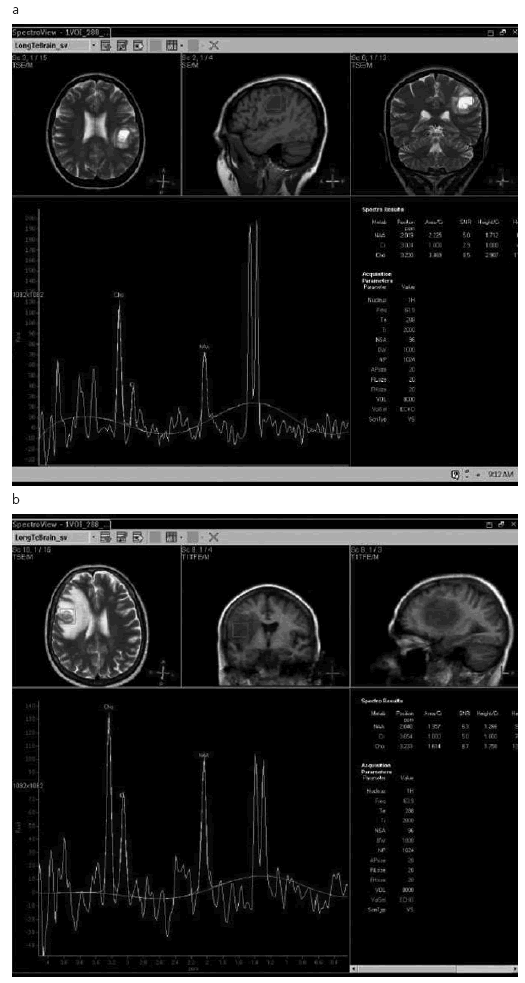
Fig. 5. a) Glioblastoma multiforme; b) metástasis. En a) y b) se observa elevación de Cho, descenso de NAA y franco aumento de los picos correspondientes a Lip y Lac.
Discusión
La obtención de un espectro que posteriormente será objeto de análisis se ve influido por numerosos factores, a saber: las características físicas y químicas de cada metabolito y de los compuestos en el que se encuentran; la selección del área a estudiar (quísticas, sólidas, homogéneas, heterogéneas) y la homogeneización de la misma (homogeneización del campo y la muestra, supresión de la señal del agua); la elección del tipo de técnica a emplear (monovóxel o multivóxel) y de la secuencia a utilizar (PRESS, DRESS, SPARS, STEAM), y la elección del tiempo de eco (corto o largo). De la correcta elección o aplicación de todos estos parámetros sumados a una adecuada colaboración del paciente depende la obtención de un espectro factible de ser analizado, de lo que pueden surgir las diferencias observadas por los distintos investigadores.
En material y métodos ya se mencionaron los diferentes parámetros utilizados en la obtención del espectro. Sin embargo, vale señalar que se analizaron principalmente los espectros obtenidos en TE largo debido a que:
• el espectro obtenido es más sencillo de analizar, cuantificar e interpretar, lo que hace que la técnica pueda ser más reproducible en la práctica diaria;
• a tiempos de eco muy largos, el pico resultante a 1,3 ppm se compone principalmente de lactatos, ya que los lípidos tienen un tiempo de eco corto por lo que quedarían saturados. Algunos autores sugieren, además, que la presencia de lípidos en tiempos de eco largo tiene un fuerte valor predictivo de malignidad, más que el observado en tiempos de eco corto (3).
• sabemos que al no realizarse espectroscopía en tiempo de eco corto se pierde valiosa información, como los valores de mio-inositol (MI); sin embargo, es preciso mencionar que el uso de ambos tiempos de eco duplica el tiempo de exploración, lo que puede ocasionar artefactos por movimientos, y que el objetivo principal de este trabajo es determinar si la lesión es o no tumoral y correlacionar los hallazgos de tiempo de eco largo con la anatomía patológica.
Con respecto a la elección de la técnica monovóxel, se realizó teniendo en cuenta diversos factores. Si bien la técnica multivóxel permite la valoración de las características metabólicas de múltiples vóxeles a la vez, presenta también algunos inconvenientes: cuanto mayor es el área a estudiar, también son mayores las dificultades técnicas para obtener un registro de calidad, tanto en la relación señal-ruido como en la homogeneidad del campo magnético y en la definición de los picos; en segundo lugar, el tiempo de adquisición es sensiblemente mayor y el procesamiento de los datos es más extenso. Otra limitación es que el método de localización que utilizan las secuencias multivóxel es menos preciso que el de las secuencias de vóxel único, produciéndose una pérdida y contaminación de la señal desde vóxeles vecinos (4).
Así, en el caso de lesiones cuya región a estudiar es focal u homogénea, consideramos más conveniente realizar estudios con secuencias monovóxel por su mayor calidad y rapidez en la obtención y posterior análisis del espectro. Por el contrario, cuando es preciso valorar diferentes regiones a un mismo tiempo o elárea a estudiar no está claramente definida o es muy extensa o heterogénea, son convenientes las secuencias multivóxel para la caracterización y extensión tumoral de la lesión (5).
Dado que se toma como referencia a la anatomía patológica para el diagnóstico de los tumores cerebrales y que los resultados de las ERM se correlacionarán con aquella, cualquier dificultad en establecer una adecuada correspondencia entre ambos métodos influirá negativamente en los resultados de la ERM. A este respecto, hay varios puntos a tener en cuenta:
a) los tumores cerebrales pueden ser muy heterogéneos y contener diferentes tipos de tejido: células tumorales viables, áreas de necrosis, áreas quísticas, tejido normal, tejido infiltrado. Cada compartimento aporta una información distinta, que terminará condicionando el diagnóstico según el posicionamiento del vóxel;
b) células de diferente grado tumoral pueden convivir en un mismo tumor; por lo tanto, un vóxel de determinado tamaño arrojará el espectro promedio de ese volumen, mientras que el diagnóstico de la AP considerará el mayor grado tumoral detectado en la muestra;
c) el diagnóstico histopatológico de una pequeña muestra de tumor obtenida por biopsia estereotáxica puede no ser representativa de toda la lesión; en este caso, no se trata de una limitación de la ERM, sino de la técnica empleada para realizar la biopsia y de la AP, que condicionará de manera negativa el diagnóstico efectuado por ERM, el que resultará diferente al de la AP y, por lo tanto, considerado como incorrecto.
d) por último, otra limitación de la AP son las discrepancias que pueden existir en el diagnóstico realizado por diferentes anátomo-patólogos con respecto a una misma muestra, lo que condicionará el resultado obtenido por la ERM.
Estas limitaciones justifican en parte las discrepancias existentes entre diferentes estudios al intentarse una clasificación o gradación de las lesiones tumorales. Sin embargo, la ERM ha demostrado ser útil en la distinción entre parénquima cerebral normal o lesiones no tumorales y los tumores cerebrales. Las principales características descritas en estos son: marcado descenso del NAA, leve baja de la Cre, marcado aumento de la Cho y presencia de Lac y de Líp en diferentes proporciones en algunos casos (6 - 11).
Numerosos trabajos publicados han descrito una correlación directa entre el aumento de la Cho y el grado tumoral en los tumores gliales. Aún cuando esto no haya podido ser constatado en todos los estudios, es un hecho constante el incremento de los niveles de la Cho en los astrocitomas anaplásicos (AA) en relación con los de bajo grado; sin embargo, algunos autores han encontrado niveles de Cho menores en los GBM que en los AA (como en nuestra serie). Esto puede ser debido a que los AA presentan una cantidad menor de necrosis en su composición con más áreas de tejido proliferativo (viable), a diferencia de los GBM, en los que predominan las áreas necróticas o el promedio del volumen de las áreas necróticas es mayor que el del tejido viable, por lo que el posicionamiento del vóxel en estos casos es crucial para obtener realmente el verdadero metabolismo de la lesión. Este punto explicaría también las diferencias observadas entre los distintos trabajos según el tamaño del vóxel, la estrategia de posicionamiento y las secuencias empleados, así como con los estudios realizados "in vitro", donde sólo se considera tejido viable (12).
Otro metabolito utilizado por muchos autores para la gradación de tumores es el Lac, siendo su presencia indicadora de alto grado tumoral, ya que se supone que el incremento de la actividad metabólica tumoral desplazaría el metabolismo celular hacia la vía anaerobia provocando acumulación de este metabolito. Los Líp se han relacionado con áreas de necrosis, por lo que se encontrarían presentes en los tumores de alto grado (GBM, MTS), en las necrosis no tumorales y en las patologías infecciosas (13).
Los hallazgos descritos por diferentes autores en otras lesiones cerebrales frecuentes, como las metástasis, incluyen reducción del NAA y de la Cre con elevación de la Cho, similar a lo observado en los astrocitomas. También, como los tumores gliales de alto grado, las metástasis pueden contener Líp y Lac. Se han desarrollado numerosos métodos de estudio y se han propuesto distintos signos para diferenciar estas lesiones de los tumores primarios, sin que hasta la fecha ninguna de las diferencias detectadas resulte significativa (14).
En la presente serie hubo tres falsos positivos: uno se trató de una LEMP en un paciente sin antecedentes de VIH en el momento del examen, lo que fue confirmado posteriormente. El espectro obtenido fue de buena calidad y mostró un aumento no muy marcado del pico de Cho, con una baja de los picos de NAA y Cre y presencia de dos picos pequeños en la zona de los Líp y Lac. Dado el leve efecto de masa que presentaba, el análisis de las imágenes planteó un diagnóstico diferencial entre una lesión neoproliferativa y una desmielinizante con aspecto pseudo tumoral. En la revisión de la literatura se encontró que en esta entidad existe moderada astrogliosis con astrocitos de aspecto atípico, símil neoplásicos, con núcleos grandes. En el caso en que la muestra biopsiada incluya los bordes, no existen problemas para su diagnóstico; sin embargo, ante una biopsia con atipía celular -como ocurre en la LEMP-, el patólogo puede interpretarla como un glioma oligodendroglial o astrocitario, dejando en evidencia las dificultades que presenta su caracterización también en anatomía patológica (15).
Otro caso fue el de una paciente con antecedente de un tumor de bajo grado al que se le implantó una semilla de braquiterapia y en la que se deseaba evaluar la respuesta al tratamiento. En el control efectuado se obtuvo el espectro de un tejido bastante heterogéneo, difícil de mesurar y algo artefactado, lo que pudo haber influido en la interpretación final; de todas maneras, presentó picos bajos de Cre, NAA, con aumento relativo de la Cho sobre los otros picos y un importante ascenso de los picos de Líp y Lac, lo que podía hacer pensar en una naturaleza tumoral enmascarada en un contexto inflamatorio/necrótico. La biopsia estereotáxica demostró necrosis y tejido inflamatorio reactivo y un control realizado cinco meses más tarde evidenció la desaparición casi total de la lesión, confirmándose de esta manera su naturaleza inflamatoria reactiva.
El último fue una lesión que fue interpretada como tumoral y que se trataba en realidad de un hamartoma, objetivándose un incremento en el pico de la Cho, un leve descenso de los picos del NAA y de la Cre y algunos picos pequeños de Líp y Lac. Los hamartomas corresponden a áreas de tejido displásico indiferenciado que tanto en las RM como en la ERM pueden tener un comportamiento similar a los TBG.
El falso negativo registrado en nuestro trabajo correspondió a una metástasis de melanoma en topografía meníngea, donde el escaso volumen y la localización de la lesión, en proximidad del hueso (dural), complicaron el desempeño de la ERM. El posicionamiento del vóxel se contaminó con señales provenientes del hueso y del parénquima cerebral normal, arrojando un espectro artefactado en una oportunidad y luego similar a una lesión benigna, a pesar de que los antecedentes del paciente y las características radiológicas de la lesión hacían sospechar una metástasis. Ante estas dificultades, que se plantearon en diversos trabajos con las lesiones de muy pequeño tamaño, los diferentes autores proponen como solución disminuir el tamaño del vóxel y ajustar su posicionamiento para evitar la contaminación de tejido no correspondiente a la lesión, lo que en la práctica diaria no es sencillo de obtener. En nuestro trabajo, por un tema de protocolo, se mantuvo en todos los casos el tamaño del vóxel, lo que pudo ser la causa del falso negativo (3, 6, 16, 17).
Respecto de los espectros eliminados del trabajo, ellos correspondían, en su mayoría, a espectros artefactados ya sea por movimientos del paciente o por encontrarse material ferromagnético posquirúrgico próximo a la zona de exploración, lo que hacía muy inhomogénea el área a explorar, o por mala calibración del equipo durante la adquisición, tal vez debido a inhomogeneidad de la zona a explorar. Esto generalmente ocurrió en regiones cerebrales próximas a la base del cráneo, correspondiendo todas ellas a limitaciones del método.
En resumen, en nuestro trabajo, al igual que en la mayoría de la bibliografía revisada, se obtuvo una adecuada caracterización de las lesiones tumorales y no tumorales con valores estadísticos muy aceptables y que hacen del método una excelente alternativa pre quirúrgica. Si bien el objetivo de este trabajo no fue realizar una clasificación de las lesiones tumorales cerebrales con RM y ERM, como lo han hecho muchas publicaciones, creemos -como la mayoría de los autores- que la distribución de los metabolitos dentro de cada grupo presenta un comportamiento similar, con algunas excepciones; por lo tanto, los gráficos obtenidos se correlacionan muy bien con los observados en la literatura mundial. Únicamente obtuvimos valores más bajos de Lac en el grupo de TA, con aumentos no tan marcados en comparación con otros autores, pudiendo deberse esto al TR/TE empleado.
Conclusión
La ERM monovóxel sumada a la RM demostró ser un método confiable para determinar la naturaleza tumoral o no tumoral de una lesión cerebral, con valores estadísticos muy aceptables. Si bien existen algunas excepciones, es posible clasificar a la mayoría de las lesiones cerebrales en diferentes grupos de acuerdo con el tipo de comportamiento espectral para una mejor categorización de las lesiones y con la posibilidad de diferenciar lesiones benignas de lesiones malignas y, entre estas últimas, las de bajo y alto grado.
1. Yu X, Liu Z, Tian Z, et al. Stereotactic biopsy for intracranial space-occupying lesions: clinical analysis of 550 cases. Stereotac Funct Neurosurg 2000;75(2-3):103-8. [ Links ]
2. Alesch F, Pappaterra J, Trattnig S, Koos WT. The role of stereotactic biopsy in radiosurgery. Acta Neurochirur Suppl 1995;63:20-4. [ Links ]
3. Majós C, Julià-Sapé M, Alonso J, et al. Brain tumor classification by proton MR Spectroscopy: comparison of diagnostic accuracy at short and long TE. AJNR Am J Neuroradiol 2004;25(10):1696-704. [ Links ]
4. Ricci PA, Pitt A, Keller PJ, Coons SW y Heiserman JE. Effect of voxel position on single-voxel MR Spectroscopy findings. AJNR Am J Neuroradiol 2000;21(2):367-74. [ Links ]
5. Tzika AA, Vajapeyam S, Barnes PD. Multivoxel Proton MR spectoscopy and hemodynamic MR Imaging of childhood brain tumors: preliminary observations. AJNR Am J Neuroradiol 1997;18(2):203-18. [ Links ]
6. Ott D, Hennig J, Ernst T. Human brain tumors: assessment wit in vivo proton MR spectroscopy. Radiology 1993;186(3):745-52. [ Links ]
7. Wilken B, Dechent P, Herms J, et al. Quantitative proton magnetic resonance spectroscopy of focal brain lesions. Pediatr Neurol 2000;23(1):22-31. [ Links ]
8. Negendank WG, Sauter R, Brown TR, et al. Proton magnetic resonance spectroscopy in patients with glial tumours: a multicenter study. J Neurosurg 1996;84(3):449-458. [ Links ]
9. Butzen J, Prost R, Chetty V, et al. Discrimination between neoplastic and nonneoplastic brain lesions by use of proton MR spectroscopy: the limits of accuracy with a logistic regression model. AJNR Am J Neuroradiol 2000;21(7):1213-19. [ Links ]
10. Usenius JP, Kauppinen RA, Vainio PA, et al. Quantitative metabolite patterns of human brain tumors: detection by MR spectroscopy in vivo and in vitro. J Comput Assist Tomogr 1994;18(5):705-13. [ Links ]
11. Vuori K, Kankaanranta L, Häkkinen AM, et al. Low-grade gliomas and focal cortical developmental malformations: differentiation with proton MR spectroscopy. Radiology 2004;230(3):703-8. [ Links ]
12. Majós C, Alonso J, Aguilera C, et al. Proton magnetic resonance spectroscopy of human brain tumors: assessment of differences between tumour types and its applicability in brain tumour categorization. Eur Radiol 2003;13(3):582-91. [ Links ]
13. Kugel H, Heindel W, Ernestus RI, Bunke J, du Mesnil R, Friedmann G. Human brain tumors: spectral patterns detected with localized H-1 MR spectroscopy. Radiology 1992;183(3):701-9. [ Links ]
14. Kim S, Chang K, Song I, et al. Brain abscess and brain tumor: discrimination with in vivo H-1 MR spectroscopy. Radiology 1997;204(1):239-45. [ Links ]
15. Gnocchi M, Salamano R, Mañana G, Lasalvia E, Riera R, Hernández O. Leucoencefalopatía multifocal progresiva en pacientes infectados por VIH. Rev Med Uruguay 2003;19(1):78-82. [ Links ]
16. Meyerand ME, Pipas JM, Mamourian A, Tosteson TD, Dunn JF. Classification of biopsy-confirmated brain tumors using single-voxel MR Spectroscopy. AJNR Am J Neuroradiol 1999; 20(1):117-23. [ Links ]
17. Shimizu H, Kumabe T, Tominaga T, et al. Noninvasive evaluation of malignancy of brain tumors with proton MR spectroscopy. AJNR Am J Neuroradiol 1996;17(4):737-47. [ Links ]














