Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de radiología
versión On-line ISSN 1852-9992
Rev. argent. radiol. vol.74 no.4 Ciudad Autónoma de Buenos Aires oct./dic. 2010
OBSTETRICIA - ARTÍCULO DE REVISIÓN - COLABORACIÓN INTERNACIONAL
RM fetal en las anomalías del SNC. Aspectos de interés para el obstetra
Manuel Recio Rodríguez*, Vicente Martínez de Vega Fernández, Pilar Martínez Ten**, Javier Pérez Pedregosa**, Daniel Martín Fernández-Mayoralas***, Mar Jiménez de la Peña
*Hospital Quirón Madrid. Diego de Velázquez. Pozuelo de Alarcón. 28223 Madrid. España. Email: machamama@telefonica.net
**Delta Ecografía. Centro de Diagnóstico por la Imagen en Obstetricia y Ginecología, Madrid.
*** Servicio de Neurología Infantil. Hospital Quirón Madrid.
Correspondencia: Manuel Recio Rodríguez machamama@telefonica.net
Recibido: julio 2010; aceptado: octubre 2010
Received: july 2010; accepted: october 2010
©SAR-FAARDIT 2010
Resumen
La resonancia magnética (RM) fetal es una técnica de imagen en auge, útil en la valoración del cerebro y columna fetal. Ayuda a estudiar el desarrollo cerebral fetal y se puede realizar un diagnóstico precoz de las anomalías congénitas. La imagen de RM muestra gran resolución de contraste y permite diferenciar mejor que la ecografía entre hallazgos normales y patológicos. Además, algunas malformaciones cerebrales o lesiones destructivas ocultas en la ecografía prenatal pueden ser detectadas por RM. Revisamos las indicaciones, utilidad, seguridad, aspectos técnicos de la RM fetal y la apariencia del desarrollo cerebral fetal, y evaluamos su contribución en el diagnóstico de las patologías de las diferentes regiones cerebrales y de la patología espinal fetal.
Abstract
Abnormalities in fetal CNS. Interesting issues to the obstetrician.
Fetal MR imaging (MRI) is an increasingly available technique used to evaluate the fetal brain and spine, because it provides a unique opportunity to evaluate fetal brain development and to make an early diagnosis of congenital abnormalities. MRI allows a better differentiation between normal and abnormal signal intensity of fetal tissues due to its higher contrast resolution compared to prenatal sonography (US). Therefore, structural abnormalities such as brain malformations and destructive lesions that could be sonographically occult on prenatal sonography can be detected at fetal MRI. We review indications, utility, safety, and technical aspects of fetal MR imaging and the appearance of normal fetal brain development evaluating its contribution in the diagnosis of fetal diseases of different brain regions and spinal disorders.
INTRODUCCIÓN
El objetivo fundamental del diagnóstico prenatal es conseguir información genética, anatómica, bioquímica y fisiológica sobre el feto para detectar posibles anomalías que puedan tener repercusiones tanto en el periodo fetal como después del nacimiento. De esta manera, se ofrece a la familia información, consejo genético y/o alternativas terapéuticas para la anomalía detectada.
Desde la primera descripción hecha por Smith FW et al (1) en 1983 sobre el uso de la resonancia magnética (RM) en el embarazo, editada en Lancet, se han publicado más de 3.000 artículos sobre RM fetal.
La RM es un método complementario a la ecografía (US), útil para la valoración fetal, que ayuda a establecer el pronóstico y el manejo perinatal, en tanto permite detectar anomalías ocultas hasta en un 50% de los casos, para determinadas indicaciones (2).
Nuestro objetivo es mostrar la seguridad, ventajas, limitaciones, indicaciones y aplicaciones clínicas de la RM fetal cerebral.
SEGURIDAD
Se han realizado muchos estudios de seguridad de RM en animales, pero no existe consenso en la extrapolación de los resultados a humanos (3). El Comité de Seguridad de la Sociedad de Imagen de Resonancia Magnética concluyó, hace 17 años, que la RM fetal estaría indicada cuando otro método de diagnóstico de imagen no ionizante no es adecuado, o bien cuando el examen de RM proporciona información importante sobre el embarazo. Sin embargo, por el potencial riesgo del desarrollo fetal y por las limitaciones de la RM, es conveniente esperar al segundo trimestre. A pesar de ello, el Colegio Americano de Radiología, valorando riesgo-beneficio, en el 2002 aprobó su uso en cualquier edad gestacional (4) .
El uso de contraste intravenoso no está aceptado porque los quelatos de gadolinio cruzan la placenta, luego pasan a la vejiga fetal y de ésta al líquido amniótico, el cual es tragado por el feto. Además, no se conoce la vida media en el feto (5). Recientemente algunos autores han referido el riesgo potencial de nefrotoxicidad del gadolinio (fibrosis sistémica nefrogénica) (6).
VENTAJAS Y LIMITACIONES
La ecografía es el método de elección en el cribado de rutina del feto y en el examen de la anatomía del sistema nervioso central (SNC). Sin embargo, incluso en manos expertas, existen alteraciones que pueden pasar desapercibidas, ya sea por problemas técnicos (artefactos de reverberación), condiciones maternas o fetales (obesidad de la madre, posición inadecuada del feto, oligoamnios) o por hallazgos muy sutiles.
La RM fetal tiene varias ventajas sobre el US perinatal:
-Mejora la resolución espacial (gracias al empleo de antenas receptoras con multicanales y estudios con imagen en paralelo).
-Permite visualizar directamente ambos lados del cerebro (en el US el margen anterior de los hemisferios cerebrales presenta sombra por reverberaciones de estructuras superiores, existiendo limitaciones también en el caso de oligoamnios, posición fetal inadecuada para el US o por la presencia de sombras acústicas por la osificación de la calota).
-Valora con más detalle el desarrollo cerebral, incluyendo la directa visualización de la formación cortical y patrón de sulcación, extremadamente difícil y a veces imposible por US.
Las principales limitaciones de la RM fetal son la presencia de:
- Artefactos por movimiento fetal que se reducen con las nuevas secuencias ultrarrápidas (obteniendo imágenes en menos de 1 segundo) y con un ayuno materno de al menos 4 h antes del estudio.
-Baja resolución espacial en los casos de corta edad gestacional, dado el pequeño tamaño del feto.
- Claustrofobia o incomodidad de la paciente durante el estudio (sobre todo en avanzadas edades gestacionales).
INDICACIONES
Como hemos mencionado, la ecografía es el método de elección para el cribado de rutina del feto y de la anatomía cerebral fetal. En nuestro centro realizamos la RM a partir del segundo trimestre para evitar la organogénesis, preferiblemente en edades gestacionales ?20 semanas, cuando el feto ya tiene suficiente tamaño para obtener una buena resolución espacial.
La RM siempre estaría indicada luego de la realización de un estudio por un ecografista experto. Salomon LJ et al (7) describen las principales indicaciones:
•Una historia de patología severa cerebral en un embarazo anterior con un estudio de US normal, en la que la RM se realiza para buscar muestras sutiles de recurrencia.
•Una alteración identificada en el estudio de US que parece aislada (típicamente ventriculomegalia o agenesia de cuerpo calloso), en la que la RM se realiza para buscar anomalías asociadas que puedan haber pasado por alto con US.
•Una alteración diagnosticada en el estudio de US, pero cuya exploración no se puede completar debido a problemas técnicos (por ejemplo, obesidad materna o posición fetal), en la que la RM se realiza para completar el estudio ecográfico.
•Riesgo elevado de anomalías del desarrollo cerebral, especialmente en los casos de infección fetal (citomegalovirus, varicela y toxoplasmosis) o en los de daño isquémico (muerte intrauterina de un gemelo monocorial o síndrome de transfusión gemelo-gemelo).
PROTOCOLO DE ESTUDIO
Es conveniente realizar los estudios en Resonancias de alto campo (1.5T) con antenas de gran resolución espacial para obtener una buena imagen diagnóstica (como una antena cardiaca de ocho canales), no siendo aceptada la utilización de campos magnéticos superiores. Se realiza el estudio en decúbito supino, salvo en edades gestacionales avanzadas donde la paciente se coloca en decúbito lateral izquierdo.
En la mayoría de los centros se realiza el estudio sin sedación, dado el uso de secuencias ultrarrápidas y se recomienda un ayuno de al menos 4 h para disminuir los artefactos por peristaltismo intestinal. Los centros que utilizan sedación suelen administrar 1mg de flunitrazepam 20 minutos antes (8).
Siempre es necesario el consentimiento firmado por la paciente, siendo conveniente, además, que la exploración sea realizada por personal entrenado. La información ecográfica previa ayuda a planificar mejor el estudio.
Se realizan tres planos ortogonales a la madre y, sobre éstos, se planifican los cortes sagitales, coronales y axiales del feto, utilizando siempre como referencia la última secuencia utilizada para la planificación de la siguiente debido a los movimientos fetales.
Las principales secuencias utilizadas son:
• Secuencias potenciadas en T2 como Single Shot Fast Spin Echo T2 (SSFSE T2) y secuencias balanceadas (FIESTA) son útiles en el estudio de la anatomía fetal. Las secuencias balanceadas o Steady State Free Precession son menos sensibles a los movimientos fetales y a los artefactos del líquido cefalorraquídeo (LCR), sobre todo en cortas edades gestacionales. En estas secuencias el LCR es hiperintenso.
• Secuencias potenciadas en T1 (gradiente doble eco o Fast Spoiled Gradient Echo T1). Nos permiten determinar la existencia de hemorragias, calcificaciones o lipomas y nos proporcionan información sobre la mielinización. En estas secuencias el LCR es hipointenso.
• Secuencias de difusión: Es una secuencia especialmente útil en la detección de lesiones isquémicas agudas así como en el diagnóstico diferencial entre el quiste aracnoideo y el epidermoide (Fig. 1) (9).
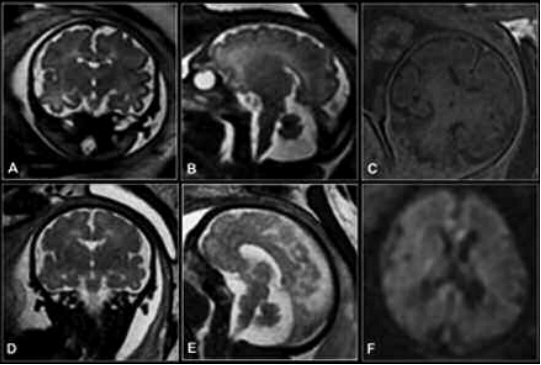
Fig. 1. (a) Coronal SSFSE T2; (b) Sagital SSFSE T2; (c) Coronal Gradiente T1 Doble Eco; (d) Coronal FIESTA; (e) Sagital FIESTA; (f) Axial Difusión.
Parámetros de interés de las secuencias utilizadas:
• Single Shot Fast Spin Echo T2 (SSFSE T2): TR = 1088ms, TE = mínimo (90 ms), matriz = 256 x 256, FOV = 34 cm, ancho de banda = 20,83 KHz. NEX = 0,5. Espesor de corte = 3 mm, distancia entre cortes = 0 mm.
• Secuencias balanceadas (FIESTA): TR = 3,9 ms, TE= mínimo (1,7 ms), matriz = 256 x 256, FOV = 35 cm, ancho de banda = 125 KHz. NEX = 2 espesor de corte = 5,1 mm, distancia entre cortes = 0 mm y ángulo = 45º.
• Secuencias potenciadas en T1 (3D gradiente doble eco ): TR = 8,5 ms, TE = mínimo (2,4ms), matriz = 336 x 256, FOV = 39 cm, ancho de banda = 62,5 KHz, NEX = 0,69, espesor de corte = 6 mm, distancia entre cortes = 0 mm y ángulo = 12º.
• Secuencias de difusión: TR= 2500 ms, TE = mínimo (69 ms), matriz = 128x128, FOV = 36 cm, ancho de banda = 62-250 KHz, NEX = 6, espesor de corte = 4 mm, distancia entre cortes = 0 mm y b = 1000 s/mm2.
ANÁLISIS E INTERPRETACIÓN
Biometría fetal
Para estimar el volumen cerebral se emplean el diámetro fronto-occipital, biparietal cerebral y el biparietal óseo, además del índice cráneo-cerebral y el índice cefálico (Fig. 2).
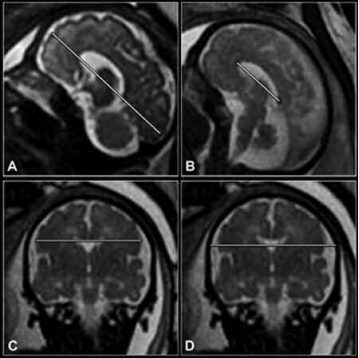
Fig. 2. (a) Sagital SSFSE T2, Diámetro Fronto-Occipital (FOD); (b) Sagital FIESTA, Longitud del Cuerpo Calloso (LCC); (c) Coronal FIESTA, Diámetro Biparietal Cerebral (DBPc); (d) Coronal FIESTA, Diámetro Biparietal Óseo (DBPb).
Enel estudio del cerebelo se utilizan el diámetro transverso cerebeloso, el diámetro anteroposterior, altura y superficie del vermis (Fig. 3) (10, 11), y en la valoración del tamaño ventricular se usa el diámetro anteroposterior del cuarto ventrículo, anchura del tercer ventrículo y el diámetro transversal de los ventrículos laterales en los atrios en el plano coronal (12).

Fig. 3. (a) Sagital SSFSE T2: Diámetro antero-posterior del vermis; (b) Sagital SSFSE T2: Altura del vermis; (c) Sagital SSFSE: Área del vermis; (d) Axial SSFSE T2: Diámetro Transverso cerebeloso (DTC).
En el estudio del cuerpo calloso utilizamos la longitud del cuerpo calloso en un plano sagital desde la rodilla al esplenio.
Análisis de los surcos corticales
El estudio de los surcos corticales es el segundo paso, siendo un importante marcador de la maduración fetal.
-A las 20 semanas sólo los surcos laterales (cisuras de Silvio) y la fisura interhemisférica serán visibles.
- A las 25 semanas serán visibles los surcos laterales, la fisura interhemisférica, las fisuras hipocámpicas y calcarinas, los surcos cingulares y los parietooccipitales internos (Fig. 4).

Fig. 4. (a) Sagital SSFSE T2, (b) Axial Fiesta; (c) Coronal Fiesta, en la semana 20 sólo la fisura interhemisférica (1) y las cisuras de Silvio (2) serían visibles. (d) Sagital SSFSE T2, (e) Axial Fiesta; (f) Coronal Fiesta, en la semana 25, sólo la fisura interhemisférica (1), cisuras de Silvio (2), surcos parietooccipitales (3), cisuras calcarinas (4), y fisuras hipocampales (5) serían visibles.
- A las 27 semanas se deben identificar los surcos laterales, la fisura interhemisférica, las fisuras hipocámpicas y calcarinas y los surcos cingulares, parieto-occipitales internos y centrales (surcos de Rolando) (10,13).
- A las 29 semanas los surcos temporales superiores, marginales, pre- y posterocentrales, intraparietales, colaterales y los surcos frontales superiores deben ser visibles, alcanzando los surcos centrales la mitad del hemisferio cerebral (10,13).
-A las 31 semanas el surco frontal inferior debe ser visible.
-A las 35 semanas el lóbulo temporal debe tener todos sus surcos, incluyendo los surcos temporales inferiores y los occípito-temporales. En esta edad gestacional el patrón es el definitivo (Fig. 5) (10,13,14).

Fig. 5. (a) Sagital SSFSE T2; (b) Axial SSFSE T2; (c) Coronal SSFSE T2. En la semana 29 los surcos marginal (6), pre (7), central (8) and postcentral (9), intraparietal, colateral (10) temporal superior (11) y frontal superior (12) y frontal inferior (13) serían visibles y el surco central alcanzaría la mitad de su profundidad en el hemisferio cerebral. (d) Sagital SSFSE T2; (e) Axial SSFSE T2; (f) Coronal SSFSE T2; en la semana 35 el lóbulo temporal debe tener todos sus surcos, incluyendo los surcos temporales inferiores (14) y surcos occípito-temporales (15). En esta edad gestacional el patrón es el definitivo. Fisura interhemisférica (1), cisuras de Silvio (2), surcos parieto-occipitales (3), cisuras calcarinas (4) y fisuras hipocampales (5).
Análisis de la mielinización
La mielinización es un buen indicador de la maduración cerebral fetal. El aumento en el colesterol y los glicolípidos, que acompañan la formación de mielina, dan lugar a un aumento del agua, llevando así a un acortamiento de las secuencias T1 y T2, visible como una hiperseñal en las imágenes ponderadas en T1 e hiposeñal en las imágenes ponderadas en T2.
Estos cambios de la señal se pueden ver en la sustancia blanca y a las 20 semanas en el tronco cerebral posterior. A las 27 semanas se observa una leve mielinización en el vermis y de los pedúnculos cerebelosos medios. Una señal moderada es también visible en los ganglios basales centrales (10,13) y, a las 33 semanas, ocurre la mielinización de los brazos posteriores de las cápsulas internas, extendiéndose progresivamente a los globos pálidos entre las 35 y 36 semanas (Fig. 6) (14). La mielinización de las coronas radiadas ocurreal final de la gestación.

Fig. 6 . (a) Axial Fiesta T2; (b) Axial Fiesta T2. Mielinización normal del tronco cerebral en feto de 25 semanas de gestación. La mielinización supratentorial no ha empezado. Mielinización del margen posterior de la protuberancia (cabeza de flecha). La señal de los pálidos y tálamos es similar a la sustancia blanca (flecha curva). (c) Axial SS FSE T2. La señal de los pálidos y tálamos es hipointensa en secuencias T2 en la semana 27 a 34 (flecha). (d) Coronal FSPGR T1. Mielinización de la cápsula interna, de los globos pálidos y tálamos aumenta en la semana 35 con hiperintensidad en T1 (flecha).
Análisis de la migración neuronal
El desarrollo cortical cerebral se divide en 3 etapas: proliferación celular, migración celular y, finalmente, organización celular.
La migración neuronal ocurre entre el tercer y cuarto mes de gestación y termina aproximadamente en la semana 24. La migración neuronal empieza en la zona germinal periventricular y termina en la superficie pial con 6 capas sucesivas. Las primeras neuronas ocupan las porciones más profundas de la cortical y las que migran posteriormente, en las capas más superficiales. Este proceso está regulado por las fibras radiales y mediadores (15).
La imagen en resonancia magnética viene determinada por las diferentes capas en secuencias ponderadas en T2:
- Entre la semana 16 y 18, se observan tres capas (matriz germinal interna, zona intermedia de neuronas en migración y capa cortical externa inmadura).
- A las 34 semanas se identifican 2 capas (sustancia blanca interna y cortical externa) (Fig. 7) (16).

Fig. 7. (a) Coronal SSFSE T2; (b) Coronal SSFSE T2; (c) Coronal FIESTA; (d) Coronal FIESTA. Tres capas: matriz germinal interna (flechas quebradas), capa intermedia de neuronas migratorias (flechas negras) y cortical inmadura externa (flechas curvas) en 20,4 semanas. Dos capas: sustancia blanca interna, (flecha blanca) y cortical externa (cabeza de flecha blanca) en 35 semanas.
APLICACIONES CLÍNICAS
Las malformaciones del sistema nervioso central corresponden a un tercio de las anomalías fetales y se encuentran en un 75% de los fetos muertos. Su incidencia se estima en 1 cada 100 nacidos vivos. Aproximadamente un 10% de las anomalías cerebrales es secundaria a alteraciones cromosómicas, 20% a factores hereditarios, 10% a efectos adversos intrauterinos (por ejemplo, infección) y un 60% no tienen causa identificable.
Vamos a dividir las patologías según las áreas de afectación cerebral:
Anomalías de línea media: Agenesia completa o parcial de cuerpo calloso (Fig. 8), holoprosencefalia alobar, semilobar o lobar (Fig. 9), displasia septo-óptica, lipoma del cuerpo calloso, quistes del cavum septum pellucidum, vergae o del velum interpositum o ausencia de cavum.

Fig. 8. EG: 29 s. Agenesia del cuerpo calloso. Gestación gemelar bicorial y biamniótica. (a) Coronal FIESTA; (b) Axial Single Shot Fast Spin Echo T2 (SSFSE T2); (c) Sagital SSFSE T2. Agenesia completa de cuerpo calloso del gemelo en cefálica dorso-izquierda que presenta elevación del tercer ventrículo comunicando con la fisura interhemisférica (flecha blanca), separación de astas frontales (cabeza de flecha) y colpocefalia (flecha curva). El otro gemelo no presenta alteraciones.

Fig. 9. (a) Sagital SSFSE T2; (b) Axial SSFSE T2; (c) Axial SSFSE T2. EG: 27,2 s Agenesia de la rodilla y de los 2/3 anteriores del cuerpo calloso (flecha blanca). Fusión anteroinferior de ambos lóbulos frontales (cabeza de flecha) y ausencia de astas frontales (flecha quebrada). Riñón derecho normal. Riñón izquierdo displásico multiquístico (flecha curva). (d) Coronal SSFSE T2; (e) Axial SSFSE T2; (f) Axial SSFSE T2. EG: 21,4 s. Holoprosencefalia semilobar con fusión de tálamos (flecha curva) y lóbulos frontales (cabeza de flecha). Formación de astas temporales y occipitales (flecha blanca). Hoz rudimentaria (flecha quebrada).
La evaluación del cuerpo calloso es una de las principales indicaciones de RM fetal, mientras que la agenesia completa se suele diagnosticar por ecografía. La RM es sobre todo útil en casos de agenesia parcial o anomalías asociadas. Debe realizarse cuando termina su formación, después de la semana 20, observándose aproximadamente en un 20% de las sospechas ecográficas de agenesia, un cuerpo calloso intacto en RM (17). En más del 63% existen anomalías asociadas como alteraciones corticales, heterotopias, malformación Dandy-Walker, anomalía de Chiari tipo II, esquisencefalias y encefaloceles (17,18).
Ventricular: La ventriculomegalia es el hallazgo más frecuente en US y supone la indicación más frecuente de RM fetal. Se clasifica en leve (10-12mm), moderada (12-15mm) y severa (> 15 mm). La RM fetal puede detectar anomalías ocultas en US hasta en un 40- 50%, como defectos del tubo neural (Fig.10), agenesia del cuerpo calloso, complejo Dandy-Walker, lisencefalia, polimicrogiria, holoprosencefalia, heterotopia subependimaria, hemorragia subependimaria o intraventricular, leucomalacia periventricular o porencefalia (2).

Fig.10. Hidrocefalia y meningocele occipital. (a) Sagital SSFSE T2; (b) Axial SSFSE T2; (c) Sagital FIESTA; (d) Axial FIESTA. EG: 21 s. Meningocele occipital (flecha blanca) con hipoplasia cerebelosa. Hidrocefalia con defecto del septum pellucidum (cabeza de flecha). Útero arcuato (flecha curva) con miomas uterinos (flecha quebrada).
Área periventricular: La RM permite detectar heterotopias subependimarias, pequeñas hemorragias de la matriz germinal así como nódulos subependimarios de esclerosis tuberosa (Fig.11). La ausencia de visualización de nódulos subependimarios no excluye el diagnóstico de esclerosis tuberosa (19,20,21).
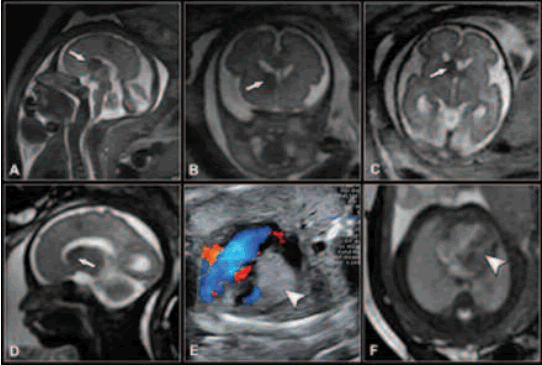
Fig. 11. EG: 30 s. Esclerosis tuberosa con rabdomioma cardíaco. (a) y (d) Sagital SSFSE T2; (b) Coronal SSFSE T2; (c) Axial SSFSE T2. Nódulo subependimario derecho adyacente al foramen de Monro (flecha). (e) Eco-Doppler: plano de 4 cámaras con gran rabdomioma en el ventrículo izquierdo (cabeza de flecha); (f) Axial FIESTA. Rabdomioma cardíaco del ventrículo izquierdo (cabeza de flecha). Evolución: parto a las 36 semanas.
Parénquima cerebral: La RM es capaz de detectar pequeñas hemorragias cerebrales o lesiones isquémicas estableciendo el carácter agudo o no de las mismas con la secuencia de difusión (Fig.12) (22,23).

Fig. 12. EG: 27 s. Infarto subagudo venoso con hemorragia intraventricular y hemorragia de la matriz germinal . (a) y (b) Sagital y axial Eco de gradiente T1; (c) Sagital SSFSE T2; (d) Axial SSFSE T2; (e) Coronal SSF SE T2; (f) Axial Imagen de difusión. Infarto subagudo hemorrágico (flecha), hemorragia en matriz germinal (cabeza de flecha) y hemorragia intraventricular (asterisco). Parto a término con secuelas motoras.
En la patología infecciosa ayuda a detectar lesiones parenquimatosas que pueden pasar desapercibidas en el estudio ecográfico, especialmente la infección por citomegalovirus (24,25).
Superficie cortical: El desarrollo cortical cerebral se divide en tres procesos: proliferación celular (2º a 4º mes), migración neuronal (3º/4º mes a semana 24) y organización cortical (semana 22 hasta los 2 años de vida) (15). Las malformaciones se clasifican en:
Trastornos proliferativos: Proliferación disminuida (microlisencefalia), aumentada (hemimegalencefalia) y proliferación anormal (displasia cortical).
Trastornos de migración: disminuida (lisencefalia clásica) (Fig.13), aumentada (distrofia muscular congénita), migración ectópica (heterotopias).

Fig. 13. Lisencefalia tipo 1 y agenesia de calloso. Mujer con primer embarazo normal (sexo femenino). (a) Sagital FIESTA; (b) Axial FIESTA. Segundo embarazo. EG: 23 s. Hidrocefalia severa con ausencia de visualización de la cisura de Silvio, surcos parieto-occipitales y cisuras calcarinas. Agenesia de cuerpo calloso (flecha). Sexo varón. (c) Coronal SSFSE T2; (d) Axial SSFSE T2. Tercer embarazo EG: 21,1 y sexo varón. Los hallazgos son similares a los del segundo embarazo (lisencefalia y agenesia de calloso).
Trastornos de organización cortical: polimicrogiria (patrón I y II), síndromes polimicrogíricos (frontal bilateral, perisilviano bilateral, fronto-parietal bilateral, parieto-occipital parasagital bilateral y bilateral difuso) y esquisencefalia (tipo 1 de labio cerrado y tipo II de labio abierto) (Fig.14) (26).

Fig. 14. Esquisencefalia de labio abierto EG: 25 s (a) Coronal SSFSE T2; (b) Coronal SSFSE T2; (c) Axial SSFSE T2; (d) Sagital SSFSE T2. Hendidura insular derecha (flecha blanca) con comunicación pial-ependimaria sugestivo de esquisencefalia de labio abierto (tipo II). Septo fino que parece corresponder a pared ventricular (flecha negra). (e) Coronal FIR; (f) Reconstrucción axial 3D FSPGR. Se realiza RM a los 6 años al padecer crisis desde los 5 años controladas con ácido valproico y una monoparesia espástica braquial izquierda leve. Vemos como la esquisencefalia de labio abierto ha evolucionado a esquisencefalia de labio cerrado con polimicrogiria en la hendidura (cabeza de flecha blanca). La opercularización ocurre entre la semana 22 y la 38. Se acompaña de heterotopias subependimarias en localización inferior y posterior (cabeza de flecha negra).
Se debe realizar el estudio en gestación avanzada, ya que hasta la semana 35 no se han formado todos los surcos corticales.
Espacios pericerebrales: Cuando el espacio extra-axial está aumentado es normalmente visible con US, sin embargo, algunas lesiones como hematomas subdurales requieren completar el estudio con RM (27).
Fosa posterior: La mayoría de las anomalías detectadas en el embarazo que afectan a la fosa posterior tienen peor pronóstico. La RM permite visualizar esta estructura mejor que la ecografía, sobre todo en presentaciones no cefálicas donde no se puede complementar el estudio con sonda endovaginal. Se estudian por RM la malformación Dandy-Walker (Fig.15), hipoplasia y/o mala rotación del vermis (Fig.16), quiste de la bolsa de Blake, mega cisterna magna, quiste aracnoideo, displasia cerebelosa, hipoplasia cerebelosa, hemorragia cerebelosa, síndrome de Walker-Warburg, malformación de Chiari y otras menos frecuentes como el síndrome de Pascual Castroviejo 2 (síndrome de PHACE) (28,29).

Fig. 15. EG: 22 s. Complejo Dandy-Walker clásico. (a) y (b) Ecografía; planos axiales (c) Sagital SSFSE T2; (d) Sagital FIESTA; (e) Axial SSFSE T2; (f) Axial FIESTA. Dandy-Walker con agenesia parcial cerebelosa y del vermis (flecha) e hidrocefalia (cabeza de flecha).

Fig. 16. EG: 25 s. Hipoplasia y malrotación de vermis (a) Coronal FIESTA; (b) Sagital FIESTAfeto1; (c) Axial SSFSE T2, feto1; (d) Sagital FIESTA, feto2; (e) Sagital FIESTA, feto 3; (f) Coronal FIESTA, feto 3 . Gestación múltiple en mujer de 42 años con FIV OVODON y transferencia de 3 embriones. Dos varones monocoriales diamnióticos (feto 1 en cefálica y feto 3 de nalgas) con hipoplasia y malrotación de vermis (flecha blanca) y amplia comunicación del cuarto ventrículo con la cisterna magna (cabeza de flecha). El gemelo en transversa (sexo femenino) tiene vermis normal (flecha negra).
Hay que hacer mención especial a dos indicaciones de RM fetal:
Complicaciones de embarazo gemelar monocoriónico: La muerte intrauterina de un gemelo monocorial incrementa el riesgo de supervivencia del otro gemelo por hipoperfusión aguda cerebral secundaria a fenómenos tromboembólicos (30).
El síndrome de transfusión feto-feto (STFF) se caracteriza por un flujo anómalo desde que el donante desarrolla oligoamnios hasta que el receptor presenta polihidramnios. La morbilidad es muy alta y ambos gemelos tienen riesgo de isquemia cerebral. Aproximadamente el 50% de los gemelos supervivientes presenta alteraciones (31).
Infecciones congénitas: La afectación cerebral más común es por citomegalovirus (CMV) seguido de toxoplasma. Existe también afectación por otros virus: varicela-zoster, parvovirus B19, rubeola y virus de coriomeningitis linfocitaria. Producen alteración difusa o focal de la sustancia blanca y, con el tiempo, atrofia cortical y dilatación ventricular. Las hemorragias están asociadas a CMV y parvovirus B19. Pueden ir acompañadas de malformaciones corticales como lisencefalia, polimicrogiria y retraso en la maduración cortical (24,25,32).
La RM permite valorar, además, anomalías espinales y medulares: Chiari II con mielomeningocele, teratoma sacrococcígeo, síndrome de regresión caudal, mielosquisis, meningocele y lipomeningocele, médula anclada o diastematomielia.
La indicación más frecuente es el mielomeningocele asociado a Chiari II (Fig. 17 ), siendo útil la RM sobre todo en los casos que existen limitaciones para la ecografía (obesidad de la madre, posición inadecuada del feto, oligoamnios) . La RM es útil en tanto aporta información adicional de anomalías asociadas: agenesia o hipoplasia del cuerpo calloso, heterotopias nodulares periventriculares, displasia cerebelosa, hidrocefalia, siringohidromielia y diastomatomielia (33,34).
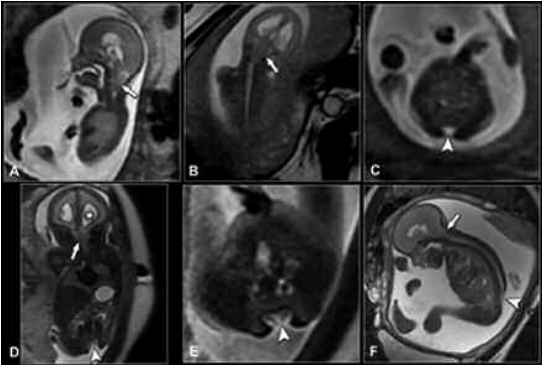
Fig. 17. EG 20 s: Chiari II con mielomeningocele . (a ) Sagital SSFSE; (b) Coronal SSFSE; (c) Axial SSFSE T2. Ventriculomegalia. Malformación Chiari II (flecha). Mielomeningocele (punta de flecha). EG: 26,5 s Chiari II con mielosquisis. (d) Coronal SSFSE; (e) Axial SSFSE; (f) Sagital FIESTA. Malformación Chiari II (flecha). Mielosquisis (punta de flecha). Ventriculomegalia (asterisco).
El teratoma sacrococcígeo es el tumor más común del neonato con una incidencia de 1 cada 35.000 - 40.000 nacidos vivos (35). La degeneración maligna es la primera causa de muerte postnatal y es rara intraútero. La alta mortalidad se relaciona con el tamaño del tumor y distocia del parto, prematuridad secundaria a polihidramnios y placentomegalia (debido a fallo cardíaco asociado a shunt arterio-venoso) (36,37, 38). La RM valora mejor que la ecografía la extensión del teratoma y se utiliza la clasificación de la Academia Americana de Cirugía Pediatría: tipo I (componente externo y mínimo componente presacro), tipo II (componente externo e importante componente presacro), tipo III (mínimo componente externo y predominante componente intrapélvico) y tipo IV (está completamente localizado en pelvis y abdomen) (Fig. 18) (39,40).
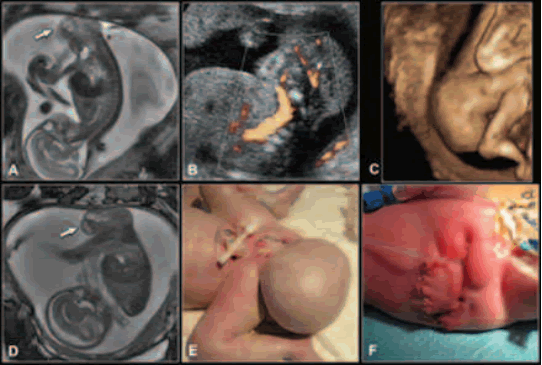
Fig. 18. EG: 20 s. Teratoma sacrococcígeo tipo I (flecha). (a) Sagital SSFSE T2; (b) Eco doppler; (c) Ecografía tridimensional, reconstrucción en superficie; (d) Sagital Fiesta. Lesión predominantemente exofítica cubierta por piel. Presenta mínimo componente presacro. Cirugía a las 48 h. (e) Fotografía del teratoma prequirúrgico; (f) Fotografía postquirúrgica.
Por último, otras de las aplicaciones clínicas de la RM es el estudio de las malformaciones craneofaciales en las que se valora: hendiduras labiales, palatinas (Fig. 19), hipotelorismo, hipertelorismo, anoftalmia, microftalmia, agenesia o hipoplasia de huesos nasales (síndrome de Down o displasia frontonasal) (Fig. 20) o anomalías de línea media (hipoplasia de maxilar, cíclope, prosboscis, etmocefalia o cebocefalia) (41,42,43).

Fig. 19. EG: 29,4 s. (a), (b) y (c) Coronal SSFSE T2; (d) Axial SSFSE T2; (e) y (f) Sagital SSFSE T2. Hendidura labial y palatina tipo II (flecha). Microftalmia con ausencia de cristalino e hipoplasia de órbita derecha (punta de flecha).

Fig. 20. Displasia frontonasal y heterotopías subependimarias EG 19,5 s (a) Sagital SSFSE T2. Improntas en la pared del atrio ventricular izquierdo por heterotopias subependimarias (flecha). Control a la semana 29 (b) Sagital SSFSE T2. Hallazgos similares a RM previa. Control postnatal (c) y (d) 3D SPGR con reconstrucciones VR. Se confirma la existencia de heterotopia periatrial izquierda y se identifican numerosas heterotopias periventriculares. (e) Ecografía 3D prenatal, reconstrucción tridimensional en superficie; (f) fotografía postnatal.
CONCLUSIONES
La RM surge como una útil herramienta complementaria de la ecografía que permite evaluar la maduración normal del cerebro fetal a partir del segundo trimestre. Además, posee una capacidad diagnóstica de mayor precisión que la ecografía para las anomalías del desarrollo cerebral u otras patologías destructivas. La RM ayuda a establecer el pronóstico y el manejo perinatal, ya que puede detectar anomalías ocultas hasta en un 50% de los casos para determinadas indicaciones.
1. Smith FW, Adam AH, Phillips WD. NMR imaging in pregnancy.Lancet1983; 1:61-2. [ Links ]
2. Levine D, Barnes PD, Madsen JR, Abbott J, Mehta T, Edelman RR. Central nervous system abnormalities assessed with prenatal magnetic resonance imaging. Obstet Gynecol 1999;94:1011-9. [ Links ]
3. Heinrichs WL, Fong P, Flannery M, et al. Midgestational exposure of pregnant BALB/c mice to magnetic resonance imaging conditions. Magn Reson Imaging 1988; 6: 305-13. [ Links ]
4. Kanal E, Borgstede JP, Barkovich AJ, et al. American College of Radiology whitepaper on MR safety. AJR Am J Roentgenol 2002; 178:1335-47. [ Links ]
5. Salomon LJ, Siauve N, Balvay D, et al. Placental perfusion MR imaging with contrast agents in a mouse model. Radiology 2005; 235: 73-80. [ Links ]
6. Grobner T, Prischl FC. Gadolinium and nephrogenic systemic fibrosis. Kidney Int 2007; 72(3): 260-4. [ Links ]
7. Salomon LJ, Garel C. Magnetic resonance imaging examination of the fetal brain. Ultrasound Obstet Gynecol 2007; 30: 1019-32. [ Links ]
8. Girard N, Raybaud C, Gambarelli D, Figarella-Branger D. Fetal brain MR imaging. Magn Reson Imaging Clin N Am 2001; 9: 19-56, vii. [ Links ]
9. Glenn OA, Barkovich AJ. Magnetic Resonance Imaging of the Fetal Brain and Spine: An Increasingly Important Tool in Prenatal Diagnosis, Part 1. AJNR Am J Neuroradiol 2006; 27: 1604-11. [ Links ]
10. Garel C. The role of MRI in the evaluation of the fetal brain with an emphasis on biometry, gyration and parenchyma. Pediatr Radiol 2004; 34(9): 694-9. [ Links ]
11. Viñals F, Muñoz M, Naveas R, Shalper J, Giuliano A. The fetal cerebellar vermis: anatomy and biometric assessment using volume contrast imaging in the C-plane (VCI-C). Ultrasound Obstet Gynecol 2005; 26: 622-7. [ Links ]
12. Garel C, Alberti C. Coronal measurement of the fetal lateral ventricles: comparison between ultrasonography and magnetic resonance imaging. Ultrasound Obstet Gynecol 2006; 27:23-7. [ Links ]
13. Garel C, Chantrel E, Elmaleh M, Brisse H, Sebag G. Fetal MRI: normal gestational landmarks for cerebral biometry, gyration and myelination. Childs Nerv Syst 2003; 19: 422-5. [ Links ]
14. Fogliarini C, Chaumoitre K, Chapon F, et al. Assessment of cortical maturation with prenatal MRI. Part I: Normal cortical maturation. Eur Radiol 2005; 15: 1671-85. [ Links ]
15. Abdel Razek AA, Kandell AY, Elsorogy LG., Elmongy A, Basett AA. Disorders of cortical formation: MR imaging features. AJNR Am J Neuroradiol 2009; 30: 4-11. [ Links ]
16. Chung HW, Chen CY, Zimmerman RA, Lee KW, Lee CC, Chin SC. T2-Weighted Fast MR Imaging with True FISP Versus HASTE: Comparative Efficacy in the Evaluation of Normal Fetal Brain Maturation. AJR Am J Roentgenol 2000; 175: 1375-80. [ Links ]
17. Glenn OA, Goldstein R, Li KC, et al. Fetal MRI in the evaluation of fetuses referred for sonographically suspected abnormalities of the corpus callosum. J Ultrasound Med 2005; 24: 791-804. [ Links ]
18. D'Ercole C, Girard N, Cravello L, et al. Prenatal diagnosis of fetal corpus callosum agenesis by ultrasonography and magnetic resonance imaging. Prenat Diagn 1998; 18: 247-53. [ Links ]
19. Canapicchi R, Cioni G, Strigini FA, Abbruzzese A, Bartalena L, Lencioni G. Prenatal diagnosis of periventricular hemorrhage by fetal brain magnetic resonance imaging. Childs Nerv Syst 1998; 14: 689-92. [ Links ]
20. Fukui K, Morioka T, Nishio S, et al . Fetal germinal matrix and intraventricular haemorrhage diagnosed by MRI. Neuroradiology 2001; 43: 68-72. [ Links ]
21. Sonigo P, Elmaleh A, Fermont L, Delezoide AL, Mirlesse V, Brunelle F. Prenatal MRI diagnosis of fetal cerebral tuberous sclerosis. Pediatr Radiol 1996; 26: 1-4. [ Links ]
22. Reiss I, Gortner L, Moller J, Gehl HB, Baschat AA, Gembruch U. Fetal intracerebral hemorrhage in the second trimester: diagnosis by sonography and magnetic resonance imaging. Ultrasound Obstet Gynecol 1996; 7: 49-51. [ Links ]
23. Garel C, Delezoide AL, Elmaleh-Berges M, et al. Contribution of fetal MR imaging in the evaluation of cerebral ischemic lesions. AJNR Am J Neuroradiol 2004; 25: 1563-8. [ Links ]
24. Benoist G, Salomon LJ, Mohlo M, Suarez B, Jacqucmard F, Ville Y. Cytomegalovirus-related fetal brain lesions: comparison between targeted ultrasound examination and magnetic resonance imaging. Ultrasound Obstet Gynecol 2008; 32: 900-5. [ Links ]
25. Doneda C, Parazzini C, Righini A, et al. Early cerebral lesions in cytomegalovirus infection: prenatal MR imaging. Radiology 2010; 255(2):613-21. [ Links ]
26. Denis D, Maugey-Laulom B, Carles D, Pedespan JM, Brun M, Chateil JF. Prenatal diagnosis of schizencephaly by fetal magnetic resonance imaging. Fetal Diagn Ther 2001; 16: 354-9. [ Links ]
27. Garel C. MRI of the Fetal Brain. Springer: Berlin, 2004; 267. [ Links ] 28. Malinger G, Lev D, Tally Lerman-Sagie T. The fetal cerebellum. Pitfalls in diagnosis and management. Prenat Diagn 2009; 29: 372-80. [ Links ]
29. Frieden IJ, Reese V, Cohen D. PHACE'S syndrome: The association of posterior fossa, brain malformation, hemangiomas, arterial anomalies, coartation of the aorta and cardiac defects, and eye abnormalities. Arch Dermatol 1996;132:307-11. [ Links ]
30. Glenn OA, Barkovich AJ. Magnetic Resonance Imaging of the Fetal Brain and Spine: An Increasingly Important Tool in Prenatal Diagnosis, Part 2. Am J Neuroradiol 2006; 27: 1604-11. [ Links ]
31. Haverkamp F, Lex C, Hanisch C, Fahnenstich H, Klaus Zerres.Neurodevelopmental risks in twin-twin transfusion syndrome: preliminary findings. Eur J Paediatr Neurol 2001; 5: 21-7. [ Links ]
32. Hollier LM, Grissom H. Human herpes viruses in pregnancy: cytomegalovirus, Epstein-Barr virus, and varicella zoster virus. Clin Perinatol 2005; 32: 671-96. [ Links ]
33. Gilbert JN, Jones KL, Rorke LB, et al. Central nervous system anomalies associated with meningomyelocele, hydrocephalus and the Arnold-Chiari malformation: reappraisal of theories regarding the pathogenesis of posterior neural tube closure defects. Neurosurgery 1986, 18: 559-64. [ Links ]
34. Wolpert S, Anderson M, Scott R, et al. Chiari II malformation: MR imaging evaluation. AJR Am J Roentgenol 1987; 149:1033-42. [ Links ]
35. Brace V, Grant SR, Brackley KJ, Kilby MD, Whittle MJ. Prenatal diagnosis and outcome in sacrococcygeal teratoma: areview of cases between 1992 and 1998. Prenat Diagn 2000; 20:51-5. [ Links ]
36. Bond SJ, Harrison MR, Schmidt KG, et al. Death due to highoutput cardiac failure in fetal sacrococcygeal teratoma. J Pediatr Surg 1990; 25: 1287-91. [ Links ]
37. Langer JC, Harrison MR, Schmidt KG, et al. Fetal hydrops and death from sacrococcygeal teratoma: rationale for fetal surgery. Am J Obstet Gynecol 1989; 160: 1145-50. [ Links ]
38. Flake AW. Fetal sacrococcygeal teratoma. Semin Pediatr Surg 1993; 2:113-20. [ Links ]
39. Altman PR, Randolph JG, Lilly JR. Sacrococcygeal teratoma: American Academy of Pediatrics Surgical Section Survey- 1973. J Pediatr Surg 1974; 9:389-98. [ Links ]
40. Danzer E, Hubbar AM, Hedrick HL, et al. Diagnosis and Characterization of Fetal Sacrococcygeal Teratoma with Prenatal MRI. AJR Am J Roentgenol 2006; 187:350-6. [ Links ]
41. Ghi T, Tani G; Savelli L, Colleoni GG, Pilu G, Bovicelli L. Prenatal imaging of facial clefts by magnetic resonance imaging with emphasis on the posterior palate. Prenatal Diagn 2003; 23(12): 970-5. [ Links ]
42. Sonek JD, Mckenna D, Webb D, Croom C, Nicolaides K. Nasal bone length throughout gestation normal ranges based on 3537 fetal ultrasound measurements. Ultrasound Obstet Gynecol 2003; 21(2): 152-5. [ Links ]
43. McGahan JP, Nyberg DA, Mack LA. Sonography of facial features of alobar and semilobar holoprosencephaly. Am J Roentgenol 1990; 154 (1): 143-8. [ Links ]














