Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista argentina de radiología
versão On-line ISSN 1852-9992
Rev. argent. radiol. vol.75 no.3 Ciudad Autónoma de Buenos Aires jul./set. 2011
CARDIOVASCULAR
Medición del espesor miointimal carotídeo como predictor de riesgo de accidente isquémico transitorio
Stella Maris Batallés, María Natalia Heredia, Luciana Della Rosa, Mauricio Capomasi, Roberto Villavicencio, Stella Maris Pezzotto*
Instituto Cardiovascular de Rosario- Oroño 450 - 2000, Rosario, Argentina.
* Carrera del Investigador. Consejo de Investigaciones. Universidad Nacional de Rosario.
Correspondencia: Dra. Stella M. Batallés - batalless@icronline.com
Recibido: noviembre 2010; aceptado: junio 2011
Received: november 2010; accepted: june 2011
©SAR-FAARDIT
Resumen
Objetivos. Determinar si el riesgo de accidente isquémico transitorio (AIT) es mayor en pacientes con valores anormales de espesor miointimal carotídeo (EMIC).
Materiales y Métodos. Evaluación de 168 pacientes con y sin AIT estudiados con ecografías de vasos de cuello, midiendo EMIC. Diseño de casos y controles apareados por distintas variables. Análisis estadístico: variables continuas (media ± DS), comparadas mediante prueba "t de Student" para muestras relacionadas. Variables categóricas (porcentajes) comparadas mediante pruebas de McNemar. Para evaluar EMIC como predictor de AIT, se ajustaron dos modelos de regresión logística condicional, considerando EMIC como variable continua y como variable binaria EMIC normal (<1 mm) vs. patológico (>1 mm). Se construyó una curva ROC para evaluar la capacidad discriminativa de EMIC, calculando la sensibilidad y especificidad para diferentes puntos de corte.
Resultados. Valor de EMIC: casos 1,03 ± 0,31 mm (IC 95%: 0,97-1,10); controles 0,77 ± 0,27mm (IC 95%: 0,710,83); p<0,001. El riesgo de AIT fue casi 9 veces mayor en pacientes con EMIC patológico (OR=8,8; p<0,001). Con un 95% de confianza pudo afirmarse que por cada 0,05 mm de incremento en el EMIC, el riesgo de AIT aumentó entre 16 y 44%. Área bajo la curva ROC: 0,75 (IC 95%: 0,67-0,82).
Conclusiones. Los valores anormales de EMIC están significativamente asociados a una mayor probabilidad de presentar AIT. En nuestra experiencia, el estudio de las paredes carotídeas con ecografía permitiría predecir enfermedad preclínica cerebrovascular.
Palabras clave. Accidente isquémico transitorio, Ecografía; Espesor miointimal carotídeo.
Abstract
Carotid Intima - Media Thickness measurement as a risk predictor of transient ischemic attack Objectives.
To determine if the risk of transient ischemic attack (TIA) is higher in patients with abnormal values of carotid intima-media thickness (CIMT). Materials and Methods. We evaluated 168 patients with and without TIA by ultrasound of the neck vessels, measuring CIMT. Case and controls were matched according to different variables. Statistical analysis: continuous variables (mean ± SD) were compared using the Student's t test for related samples. Categorical variables (percentages) were compared using the McNemar tests. In order to assess CIMT as a predictor of TIA, two models of conditional logistic regression were adjusted, considering CIMT both as a continuous variable and as a binary variable: normal CIMT (<1 mm) vs. pathologic (>1 mm). A ROC curve was performed to determine the discriminative capacity of CIMT, estimating the sensitivity and specificity for different cutoff values.
Results. CIMT value: cases 1.03±0.31 mm (95% CI: 0.971.10); controls 0.77±0.27 mm (95% CI: 0.71-0.83); p<0.001. The risk of TIA was about 9 fold higher in patients with abnormal CIMT (OR=8.8; p<0.001). With 95 % confidence interval we were able to affirm that for each 0.05 mm increase in CIMT, the risk of TIA increased between 16 and 44%. Area under ROC curve: 0.75 (95% CI: 0.67-0.82).
Conclusions. Abnormal values of CIMT are significantly associated with a higher probability of suffering a TIA. According to our experience, the carotid wall US examination would allow to predict cerebrovascular preclinical disease.
Key words. Carotid intima-media thickness; Transient ischemic attack; Ultrasound.
INTRODUCCIÓN
La arterioesclerosis es una afección crónica, difusa y sistémica, que provoca complicaciones focales en diferentes territorios vasculares y trastornos que pueden conducir a enfermedad arterial coronaria, periférica y cerebrovascular. La hipótesis de que la interacción e interfase dentro de la pared arterial y la circulación es el sitio primario del mecanismo subyacente de los eventos cardiovasculares asienta en el hecho de que todos los estados de la arterioesclerosis pueden producirse en territorios distantes, localizaciones múltiples y de manera simultánea (1, 2).
De acuerdo a las investigaciones de Furchgott y Zawadzki 3, el endotelio fue considerado durante mucho tiempo como una capa inerte de células que revestían el interior de los vasos sanguíneos. Sin embargo, la evidencia actual ha demostrado que es una estructura que censa y responde a una gran cantidad de estímulos internos y externos, a través de complejos de receptores de membrana y mecanismos de traducción de señales, llevando a la síntesis y liberación de sustancias vasoactivas, tromboregulatorias y regulatorias del crecimiento vascular. Se sabe que desempeña una función clave en la regulación del tono vascular, trombogenicidad, proliferación de células musculares y adhesión, y agregación plaquetaria(4). Por ello, la disfunción endotelial es una de las fases iniciales en el desarrollo de la arterioesclerosis y está directamente asociada a un aumento de patología cardíaca, cerebrovascular y arteriopatía periférica (5). La presencia de factores de riesgo como la hipertensión arterial, la diabetes, el tabaquismo, la dislipemia, el sedentarismo (entre los principales) contribuyen a que el endotelio sea disfuncional, favoreciendo entonces la liberación de sustancias vasoconstrictoras, proagregantes plaquetarias, factores proinflamatorios, arterioesclerosis por mayor oxidación de LDL, factores procoagulantes y antiagregantes plaquetarios (6).
Por su parte, el accidente isquémico transitorio (AIT) -definido como un breve episodio de disfunción neuro-lógica causado por una isquemia focal cerebral o retinal, cuyos síntomas clínicos duran típicamente menos de 1 hora, sin evidencia de infarto (7)- ocurre en 200.000 a 500.000 pacientes por año en Estados Unidos (8). Después de ocurrido un AIT, existe un riesgo de recurrencia del 8% en el primer mes, del 5% anual y también un riesgo del 5% anual de infarto agudo de miocardio. El riesgo de sufrir un ictus después de un AIT varía entre un 24 y 29% en los 5 años siguientes, siendo del 4 al 8% en el primer mes y del 12 al 13% en el primer año (9).
La evaluación de la íntimamedia carotídea por ultrasonido de alta definición es una herramienta útil para el diagnóstico precoz de la ateroesclerosis subclínica, de la enfermedad vascular cerebral y de la enfermedad arterial coronaria (10). Constituye un marcador que proporciona una medición reproducible, no invasiva y segura para estimar la extensión, la progresión de la enfermedad y la respuesta al tratamiento (10, 11-13).
El propósito de nuestro trabajo fue determinar si el riesgo de AIT es mayor en pacientes con valores anormales de espesor miointimal carotídeo (EMIC) utilizando la ecografía carotídea de alta resolución.
MATERIALES Y MÉTODOS
Se trató de un estudio de investigación epidemiológica de casos y controles apareados. Se incluyeron en el análisis todos los pacientes con diagnóstico clínico de AIT, de acuerdo a la definición de Albers y col. (7), internados en nuestra institución durante el período febrero 2009- mayo 2010 (n=84). Por otra parte, se seleccionaron 84 pacientes sin AIT internados durante el mismo período, los cuales fueron cotejados con los otros casos de acuerdo a las siguientes variables: edad (±5 años), sexo, hipertensión arterial (HTA), diabetes (DBT) tipo I y tipo II, dislipidemia y tabaquismo.
A todos los casos y controles se les realizó ecografía de carótidas con medición de espesor íntimamedia. Los estudios se realizaron con un ecógrafo Philips HD11 con programa automático de medición de EMIC. Con el paciente en decúbito dorsal y en la misma posición en que se realiza un estudio carotídeo convencional, se obtuvo el EMIC de doce mediciones:
. Pared anatómicamente anterior y posterior de los principales segmentos de las arterias carótidas extracraneales a derecha e izquierda. Luego, determinación del valor promedio de cada segmento en ambos lados:
- El EMIC a nivel de la arteria carótida común se midió a 1 cm por debajo de la bifurcación carotídea.
- El EMIC de la bifurcación se midió desde el origen de la misma hasta la división de los flujos en interno y externo (bulbo carotídeo).
- El EMIC de la arteria carótida interna se midió a partir de la separación de los flujos, en el centímetro proximal de la carótida.
Las mediciones se efectuaron desde la interfase lumeníntima hasta la interfase media-adventicia, en una extensión de 1 cm de largo, con sistema automático.
Para las variables de confusión consideradas, se definió HTA a valores de presión sistólica > 130 mmHg, de presión diastólica > 85 mmHg y dislipidemia como valores de triglicéridos plasmáticos > 1,7 mmol/l o colesterol HDL <1 mmol/l en hombres y <1,29 mmol/l en mujeres. Para la DBT, debieron cumplirse alguno de estos 3 (confirmados en más de una oportunidad): 1. Glicemia (en cualquier momento) > 200 mg/dl, asociada a síntomas clásicos (poliuria, polidipsia, baja de peso); 2. Dos o más glicemias > 126 mg/dl; 3. Respuesta a la sobrecarga de la glucosa alterada con una glicemia a los 120 minutos post sobrecarga > 200 mg/dl.
Análisis estadístico
Las variables continuas se presentaron como media ± desvío estándar y se compararon entre los grupos de análisis por medio de la prueba "t de student" para muestras relacionadas y la prueba de los rangos señalados de Wilcoxon. Las variables categóricas se presentaron como frecuencias absolutas y relativas. Se aplicó la prueba de McNemar para contrastar la hipótesis de que la probabilidad de EMIC patológico es igual en los casos y controles. Se consideraron significativas las pruebas cuyo valor de p<0,05.
Para identificar si EMIC podía ser considerado factor de riesgo de AIT, se ajustaron dos modelos de regresión logística condicional: uno de ellos considerando EMIC como variable continua y otro considerándolo como variable binaria (EMIC normal -<1mm-o patológico ->1mm -) (Figs. 1 y 2). Se calcularon Odds Ratio (OR) con sus intervalos de confianza del 95%.
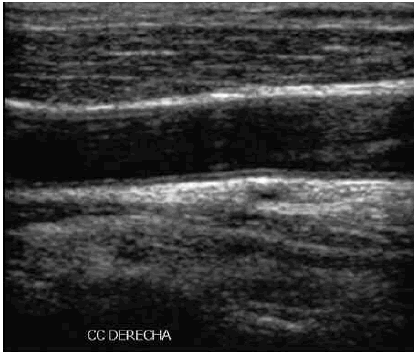
Fig. 1: EMIC menor a 1 mm, obtenido a nivel de la carótida común derecha. Modo B, corte longitudinal.

Fig. 2: EMIC medido en forma automática a nivel de la carótida común. Se observa ROI de medición de 10 mm de ancho que demuestra engrosamiento de la interfase miointimal, cuyo valor es de 1,18 mm.
Utilizando los valores de los coeficientes obtenidos mediante la regresión logística, se estimó para cada individuo la probabilidad de que presente la enfermedad. Proponiendo distintos puntos de corte para la misma y considerando enfermos a los individuos cuya probabilidad de estarlo superaba dicho punto de corte, se comparó el estado asignado por el modelo con el real, calculando la sensibilidad y especificidad correspondiente a cada punto de corte, y se construyó la curva ROC (Receiver Operating Characteristic). La sensibilidad y especificidad para cada punto de corte de la probabilidad estimada por el modelo logístico se calculó según fórmulas estándar.
Finalmente, un aspecto importante para evaluar la validez del modelo de regresión logística es su poder de discriminación (grado en que el modelo logístico distingue entre individuos en los que ocurre el evento y en los que no). Como medida de discriminación se usa el área bajo la curva ROC, la cual puede ser considerada como medida de valor predictivo.
Todos los análisis estadísticos se realizaron con el programa estadístico STATA versión 8.
RESULTADOS
En la Tabla 1 se muestran los resultados del apareamiento realizado entre los casos y los controles de acuerdo a las posibles variables de confusión analizadas.
Tabla 1: Características de los casos y controles apareados por las variables de confusión consideradas.
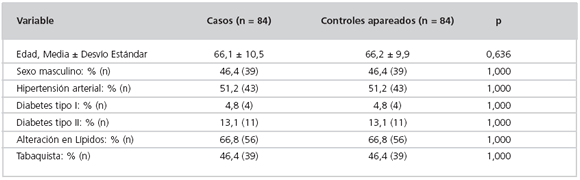
En la Tabla 2 se describe la distribución de frecuencia de EMIC normal vs. patológico en los casos y controles. En 29 parejas (caso - control), el EMIC fue normal tanto en el caso como en el control; en 16 parejas fue patológico tanto en el caso como en el control; en 35 parejas fue anormal en el caso y normal en el control; y en 4 parejas el EMIC fue normal en el caso y patológico en el control. La proporción de pares en los que el EMIC fue anormal en el caso y normal en el control (41,7%) fue significativamente mayor (Prueba de McNemar: p < 0,001) que la proporción de pares en que el EMIC fue normal en el caso y patológico en el control (4,8%). Este resultado indica que la probabilidad de EMIC patológico es significativamente mayor en los casos que en controles.
Tabla 2: Valores de EMIC normales y patológicos en los 84 pares caso-control.
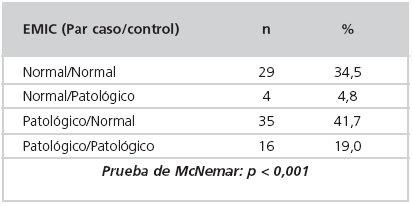
En la Tabla 3 se observan los valores medios de EMIC en los casos y controles, con sus respectivos intervalos de confianza del 95% (IC 95%). El valor medio del EMIC para los casos fue significativamente superior que el correspondiente a los controles (Prueba tpara muestras relacionadas: p<0,001). En el Gráfico 1 (gráfico de cajas) se observa la diferente distribución de los valores de EMIC en los casos y controles (Prueba de los rangos señalados de Wilcoxon: p<0,01).
Tabla 3: Valores medios de EMIC (mm) con sus IC 95%.

Gráfico 1: Gráfico de cajas indicando mediana, percentil 25 y 75 y valor mínimo y máximo de EMIC en casos y controles.
Aplicando el modelo de regresión logística condicional, se observó que el EMIC está significativamente asociado con el riesgo de AIT (OR=8,8; p<0,001 - IC 95%: 3,11- 4,62), ya que el riesgo es casi nueve veces mayor en pacientes con EMIC patológico (>1mm).
Además, por cada 0,05 mm de incremento en EMIC se observó un 29% de aumento en el riesgo de AIT (OR=1,29; IC 95%= 1,16-1,44; p<0,001). Con un 95% de confianza podemos afirmar que, por cada 0,05 mm de incremento en el EMIC, el riesgo de AIT aumenta entre un 16 y un 44%. En base a este resultado y con el propósito de valorar la utilidad del EMIC como predictor de ocurrencia de AIT se calculó el área bajo la curva (Gráfico 2. Curva ROC), que fue de 0,746 (IC 95%= 0,671-0,821) con una buena capacidad discriminativa (p<0,001). Para valores de EMIC superiores a 0,75 mm, la especificidad fue de 63% y la sensibilidad de 75%; mientras que, para valores superiores a 1,05 mm, la especificidad fue de 76% y la sensibilidad del 61%.

Gráfico 2: Curva ROC: capacidad de EMIC de predecir AIT.
DISCUSIÓN
Como demuestran numerosos estudios y revisiones (14-23), el engrosamiento miointimal carotídeo y de las arterias periféricas es un potente predictor e indicador de enfermedad cerebro y cardiovascular subclínica.
La disfunción endotelial comienza cuando el endotelio indemne morfológica y funcionalmente se expone a una variedad de factores de riesgo que pueden provocarle injuria. Si el factor de riesgo persiste, se lesiona la pared vascular y se pone en marcha el desarrollo de placas ateromatosas que generan placas vulnerables con riesgo de ruptura y producción de eventos cardiovasculares o cerebrovasculares (10, 11, 24).
El análisis de las carótidas con ecografía, obteniendo la medición del EMIC, permite inferir de manera sencilla y no invasiva el estado del sistema vascular del paciente y asumir lo difuso de la presentación de la enfermedad aterosclerótica(25, 26).
El modo B ultrasonográfico se ha impuesto como la modalidad de imagen de elección para evaluar el EMIC y la placa de ateroma cuando está presente. Además de la medición de la interfase miointimal, permite la caracterización de la placa al visualizar su ecogenicidad, la cual está influenciada por la composición de la misma: una placa hipoecoica heterogénea está asociada a la presencia de lípidos, mientras que una placa hiperecoica homogénea es principalmente fibrosa. Esta diferenciación puede ayudar a predecir el comportamiento de la placa (27), ya que las más blandas -más ecolúcidas o que menos reflejan las ondas ultrasonoras- son las que tienen una mayor probabilidad de desprenderse y producir fenómenos embólicos. En nuestro estudio, la variable independiente de interés fue el valor obtenido de EMIC y no hubo análisis de las placas ateromatosas dado que, de estar presentes, constituyeron un criterio de exclusión para nuestro análisis. Consideramos que su sola presencia determinaba la pérdida de oportunidad de detectar tempranamente los cambios endoteliales precoces.
El engrosamiento del EMIC y la ocurrencia de AIT se han asociado positivamente en estudios epidemiológicos y observacionales con los factores de riesgo cerebro y cardiovasculares clásicos, como edad, sexo, HTA, dislipidemia, tabaquismo y DBT. También existe asociación entre el EIM carotídeo y la sumatoria de factores de riesgo, como se observó en el puntaje de riesgo de Framingham (5,28-32). En nuestro análisis, estas variables, que han demostrado estar asociadas al engrosamiento del EMIC, fueron consideradas para realizar el apareamiento de los casos con los controles, tal como se muestra en la Tabla 1. De esta manera, se controló que estos factores no se comportaran como variables de confusión al estudiar la asociación entre EMIC patológico y riesgo de AIT.
No se investigó asociación de factores de riesgo (HTA, DBT, dislipidemia, etc.) con AIT ni con engrosamiento de EMIC.
Un aspecto controversial en la evaluación del EMIC es la variedad de protocolos utilizados para su determinación, ya que dificulta la interpretación y comparación de los resultados (5). Los distintos protocolos reportados incluyen a la arteria carótida común, bifurcación o bulbo carotídeo y a la arteria carótida interna. Algunos autores prefieren medir el aumento difuso del espesor miointimal excluyendo las áreas con placas ateromatosas y otros prefieren incluir el espesor de la placa como parte del complejo miointimal. Algunos miden sólo la pared posterior de la arteria carótida común o de los tres segmentos carotídeos, o la pared anterior y posterior de los tres segmentos, para luego promediarlas (5, 33). Algunos trabajos (los más antiguos) reportan la medición del EMIC sólo en la carótida derecha (34-36). Al igual que la mayoría de los autores, en el presente análisis medimos el EMIC en ambas carótidas, en las paredes anterior y posterior de los tres segmentos (12 mediciones).
Los valores normales del EIM dependen de la edad y el sexo. El punto de corte para caracterizar el valor de EIM como normal suele ser arbitrario y en general se ubica por encima del percentil 75 de la población estudiada (5).
El rango de valores normales del EMIC en adultos, tanto el de la carótida común como el combinado de todos los segmentos carotídeos, oscila entre 0,4 y 1 mm, con una progresión anual de 0,01 a 0,02 mm (5, 37). Al igual que lo considerado por Salonen y col. (38), consideramos anormal un valor de EMIC superior a 1 mm de espesor. Sin embargo, Bots y col. (39) reportaron mayor riesgo de eventos cerebrovasculares en adultos con valores de espesor miointimal en carótida común mayor de 0,82 mm.
Concordando con nuestra hipótesis de trabajo observamos que, aplicando el modelo de regresión logística condicional, el riesgo de presentar AIT es casi nueve veces mayor en pacientes con EMIC >1 mm (p<0,001 - IC 95%: 3,11-24,62). De considerar el punto de corte de 0,82 mm para EMIC reportado por Bots y col. (39) en nuestra serie de pacientes, el riesgo de presentar AIT sería aún mayor.
En nuestra experiencia, por cada 0,05 mm de incremento en EMIC se observó un 29% de aumento en el riesgo de AIT (OR=1,29; IC 95%= 1,16-1,44; p<0,001) de manera que podemos afirmar con un 95% de confianza que por cada 0,05 mm de incremento en el EMIC el riesgo de AIT aumenta entre un 16 y un 44%.
Es necesario aclarar que, a pesar de que el intervalo de confianza obtenido al estimar el riesgo de AIT comparando pacientes con valores de EMIC patológico en relación a aquellos con valores normales fue amplio y que esto podría deberse al escaso número de pacientes incluidos en el análisis, el resultado obtenido resultó estadísticamente significativo.
La curva ROC obtenida nos mostró, para cada posible valor de corte de EMIC, la tasa de casos verdaderos positivos en las ordenadas (Sensibilidad) y la tasa de falsos positivos en las abscisas (1-Especificidad). Además, indicó que la medición de EMIC es una prueba que nos permite discriminar los casos de EMIC patológico de aquellos normales. El área bajo la curva evidenció una exactitud diagnóstica de EMIC para predecir AIT del 75% (considerando 100% como la exactitud diagnóstica máxima).
CONCLUSIONES
La medición del EMIC es una prueba con muy buena exactitud diagnóstica para detectar AIT.
Los valores anormales de EMIC están significativamente asociados con mayor riesgo de presentar AIT. Los incrementos del 0,05 mm del EMIC aumentan el riesgo de AIT entre un 16 y un 44%.
En nuestra experiencia, el estudio carotídeo con ecografía de alta resolución permitiría predecir enfermedad preclínica cerebrovascular.
1. Lerman A, Zeiher AM. Contemporay reviews in cardiovascular medicine. Endothelial function. Cardiac events. Circulation 2005; 111:363-8. [ Links ]
2. Bonetti PO, Lerman LO, Lerman A. Endothelial dysfunction: a marker of atherosclerotic risk. Arterioescler Thromb Vasc Biol 2003; 23:168-75. [ Links ]
3. Furchgott RF, Zawadzki JV. The obligatory role of endothelial cell in the relaxation of arterial smooth muscle by acetylcholine. Nature 1980; 299:373-6. [ Links ]
4. Gokce N, Keaney Jr. JF, Hunter LM, et al. Predictive value of noninvasively determined endotelial dysfunction for long-term cardiovascular events in patients with peripheral vascular disease. J Am Coll Cardiol 2003; 41:1769-75. [ Links ]
5. Sanada H, Higashi Y, Goto C, Chayama K, Yoshizumi M, Sueda T. Vascular function in patients with lower extremity peripheral arterial disease: a comparison of functions in upper and lower extremities. Atherosclerosis 2005; 178:179-85. [ Links ]
6. Esper RJ, Nordaby RA, Vilariño JO, Paragano A, Cacharrón JL, Machado RA. Endothelial dysfunction: a comprehensive appraisal. Cardiovasc Diabetol 2006; 5:1-18. [ Links ]
7. Albers GW, Caplan LR, Coull BM, et al. Transient ischemic attack: proposal for a new definition. N Engl J Med 2002; 347(21):1712-6. [ Links ]
8. Johnston SC, Gress DR, Browner WS, Sidney S. Short-term prognosis after emergency department diagnosis of TIA. JAMA 2000; 284(22):2901-6. [ Links ]
9. Ruiz- Giménez N, González Ruano P, Suárez C. Abordaje del accidente cerebrovascular. Inf Ter Sist Nac Salud 2002; 26:93-106. [ Links ]
10. Chain S, Luciardi H, Feldman G, Valberdi A. El espesor íntima-media carotídeo, un marcador de ateroesclerosis subclínica y riesgo cardiovascular. Importancia de su valoración y dificultades en su interpretación. Rev Fed Arg Cardiol 2005; 34:392-402. [ Links ]
11. Barth JD. An update on carotid ultrasound measurement of intima-media thickness. Am J Cardiol 2002; 89(4A):32B-38B. [ Links ]
12. Barth JD. Which tools are in your cardiac workshop? Carotid ultrasound, endothelial function, and magnetic resonance imaging. Am J Cardiol 2001; 87(4A):8A-14A. [ Links ]
13. Bots ML, Evans G, Riley W, Grobbee DE. Carotid intima-media thickness measurements in intervention studies design options, progression rates, and sample size considerations: a point of view. Stroke 2003; 34:2985-94. [ Links ]
14. De Groot E, Kees Hovingh G, Wiegman A, et al. Measurement of arterial wall thickness as a surrogate marker for atherosclerosis. Circulation 2004; 109 (23 Suppl 1):III33-8. [ Links ]
15. Lorenz M, Markus H, Bots ML, Rosvall M, Sitzer M. Prediction of clinical cardiovascular events with carotid intima-media thickness. A systematic review and meta-analysis Circulation 2007; 115:459-67. [ Links ]
16. Cao JJ, Arnold A, Manolio TA, Polak JF, et al. Association of carotid artery intima-media thickness, plaques and C-Reactive protein with future cardiovascular disease and all-cause mortality. The Cardiovascular Health Study. Circulation 2007; 116:32-8. [ Links ]
17. Chambless LE, Folsom AR, Clegg LX, et al. Carotid wall thickness is predictive of incident clinical stroke: the Atherosclerosis Risk in Communities (ARIC) Study. Am J Epidemiol 2000; 151:478-87. [ Links ]
18. Iglesias del Sol A, Bots ML, Grobbee DE, Hofman A, Witteman JC. Carotid intima-media thickness at different sites: relation to incident myocardial infarction; the Rotterdam Study. Eur Heart J 2002; 23:934-40. [ Links ]
19. Hollander M, Hak AE, Koudstaal PJ, et al. Comparison between measures of atherosclerosis and risk of stroke: the Rotterdam Study. Stroke 2003; 34:2367-72. [ Links ]
20. Kitamura A, Iso H, Imano H, et al. Carotid intima-media thickness and plaque characteristics as a risk factor for stroke in Japanese elderly men. Stroke 2004; 35:2788-94. [ Links ]
21. Rosvall M, Janzon L, Berglund G, Engstrom G, Hedblad B. Incident coronary events and case fatality in relation to common carotid intima-media thickness. J Intern Med 2005; 257:430-7. [ Links ]
22. Rosvall M, Janzon L, Berglund G, Engstrom G, Hedblad B. Incidence of stroke is related to carotid IMT even in the absence of plaque. Atherosclerosis 2005; 179:325-31. [ Links ]
23. Lorenz MW, von Kegler S, Steinmetz H, Markus HS, Sitzer M. Carotid intima-media thickening indicates a higher vascular risk across a wide age range: prospective data from the Carotid Atherosclerosis Progression Study (CAPS). Stroke 2006; 37:87-92. [ Links ]
24. Virmani R, Kolodgie FD, Burke AP, Farb A, Schwartz SM. Lessons from sudden coronary death: a Comprehensive morphological classification scheme for atherosclerotic lesions. Arterioscler Thromb Vasc Biol 2000; 20:1262-75. [ Links ]
25. Touboul P, Hennerici M, Meairs S, et al. Mannheim Carotid Intima-Media Thickness Consensus (2004 - 2006). Cerebrovasc Dis 2007; 23:75-80. [ Links ]
26. Helft G, Worthley SG, Fuster V, et al. Progression and regression of Atherosclerotic lesions: monitoring with serial noninvasive Magnetic Resonance Imaging. Circulation 2002; 105:993-8. [ Links ]
27. Krebs C. Principios y bases físicas de los ultrasonidos. En: Krebs C, Giyanani V, Eisenberg D, eds. Doppler Color. Madrid: Marbán; 2004:11-9. [ Links ]
28. Kuller L, Fisher L, McClelland R, et al. Differences in prevalence of and risk factors for subclinical vascular disease among black and white participants in the Cardiovascular Health Study. Arterioscler Thromb Vasc Biol 1998; 2:283-93. [ Links ]
29. Gariepy J, Salomon J, Denarié N, et al. Sex and topographic differences in association between large-artery wall thickness and coronary risk profile in a French working cohort. The AXA Study. Arterioscler Thromb Vasc Biol 1998; 18:584-90. [ Links ]
30. Schmidt-Trucksäss A, Grathwohl D, Schmid A, et al. Structural, functional, and hemodynamic changes of the common carotid artery with age in male subjects. Arterioscler Thromb Vasc Biol 1999; 19:1091-7. [ Links ]
31. Stensland-Bugge E, Bonaa KH, Joakimsen O, Niostald I. Sex differences in the relationship of risk factors to subclinical carotid atherosclerosis measured 15 years later. The Tromso Study. Stroke 2000; 31:574-81. [ Links ]
32. Grundy SM, Balady GJ, Criqui MH, et al. Primary prevention of coronary heart disease: guidance from Framingham. A statement for healthcare professionals from The American Heart Association's Task Force on Risk Reduction. Circulation 1998; 97:1876-87. [ Links ]
33. Simon A, Gariepy J, Chironi G, Megnien JL, Levenson J. Intima-media thickness: a new tool for diagnosis and treatment of cardiovascular risk. J Hypertens 2002; 20:159-69. [ Links ]
34. Hulthe J, Wikstrand J, Emanuelsson H, Wiklund O, de Feyter PJ, Wendelhag I. Atherosclerotic changes in the carotid artery bulb as measured by B-mode ultrasound are associated with the extent of coronary atherosclerosis. Stroke 1997; 28:1189-94. [ Links ]
35. Pignoli P, Tremoli E, Poli A, Oreste P, Paoletti R. Intimal plus medial thickness of the arterial wall. A direct measurement with ultrasound imaging. Circulation 1986; 74:1399-406. [ Links ]
36. Salonen R, Salonen JT. Determinants of carotid intima-media thickness: a population-based ultrasonography study in eastern Finnish men. J Intern Med 1991; 229:225-31. [ Links ]
37. Kanters SDJM, Algra A, van Leeuwen MS, Banga JD. Reproducibility of in vivo carotid intima-media thickness measurements. Stroke 1997; 28:665-71. [ Links ]
38. Salonen JT, Salonen R. Ultrasound B-mode imaging in observational studies of atherosclerotic progression. Circulation 1993; 87 (3 Suppl): II56-65 [ Links ]
39. Bots ML, Hoes A, Koudstaal PJ, et al. Common carotid intima-media thickness and risk of stroke and myocardial infarction. The Rotterdam Study. Circulation 1997; 96:1432-7. [ Links ]
El autor y los colaboradores del trabajo declaran no tener ningún conflicto de intereses.














