Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista argentina de radiología
versão On-line ISSN 1852-9992
Rev. argent. radiol. vol.75 no.3 Ciudad Autónoma de Buenos Aires jul./set. 2011
ABDOMEN
Pseudoquiste pancreático gigante
Javier Pereda Rodríguez1, Javier González Llórente2
1 Residente de Segundo año de Radiodiagnóstico del Complejo Hospitalario de Segovia. Complejo Asistencial de Segovia. Ctra. de Ávila, s/n. C.P. 40002. Segovia, Castilla y León, España.
2 Especialista en Radiodiagnóstico. Adjunto del Complejo Asistencial de Segovia. Complejo Asistencial de Segovia. Ctra. de Ávila, s/n. C.P. 40002. Segovia, Castilla y León, España.
Correspondencia: Dr. Javier Pereda Rodríguez -javierpereda2008egmail.com
Complejo Asistencial de Segovia. Ctra. de Ávila, s/n. C.P. 40002. Segovia. Castilla y León. España.
Recibido: agosto 2010; aceptado: febrero 2011
Received: august 2010; accepted: february 2011
©SAR-FAARDIT
Resumen
Presentamos el caso de un hombre de 54 años de edad que acude a Urgencias con historia previa de dolor abdominal de cuatro semanas de evolución, pérdida de peso de 3 Kg y la presencia de una masa epigástrica palpable.
En la radiografía convencional de abdomen se observó la presencia de una masa ocupante de espacio a nivel del epigastrio. El estudio ecográfico mostró una gran masa quística en la región epigástrica, que comprimía el estómago y desplazaba el colon transverso en sentido caudal, sugestiva de pseudoquiste pancreático. Éste fue demostrado en el estudio tomográfico.
Se realizó una revisión bibliográfica de los hallazgos de imagen específicos y su diagnóstico diferencial. El conocimiento de esta entidad, así como de sus características ecográficas y topográficas, permite el diagnóstico y tratamiento precoz, evitando procederes invasivos.
Palabras clave. Ecografía; Páncreas; Pseudoquiste; Tomografía Computarizada.
Abstract
Giant Pancreatic Pseudocyst
We report the case of a 54-year-old male who presented at the Emergency Department with a four-week history of abdominal pain, weight loss of 3 kg and a palpable epigastric mass. On a plain abdominal X-ray, a space-occupying lesion was observed in the epigastrium. An abdominal ultrasound examination showed a large cystic mass in thee epigastric region, compressing the stomach and displacing the transverse colon caudally, suggestive of a large pancreatic pseudocyst. A Giant Pancreatic Pseudocyst was confirmed by a contrast-enhanced Computed Tomography (CT). A review of the literature about specific imaging findings and differential diagnosis was made. An understanding of this entity and of its characteristic findings on ultrasound and CT allows an early diagnosis and treatment, thus avoiding invasive procedures.
Key words. Computed Tomography; Pancreas; Pseudocyst; Ultrasound.
INTRODUCCIÓN
El pseudoquiste pancreático es una entidad cuyo diagnóstico estuvo limitado durante décadas a pacientes con alta sospecha clínica y lesiones con dimensiones suficientemente grandes, como para ser palpadas y reconocidas mediante signos radiológicos indirectos secundarios al desplazamiento de órganos y vísceras adyacentes.
El vertiginoso desarrollo de las técnicas de imagen avanzadas como son la ultrasonografía, la tomografía computarizada, la resonancia magnética y la colangiopancreatografía, entre otras, han permitido un aumento en la frecuencia diagnóstica del pseudoquiste pancreático (en ocasiones subclínico), así como un mayor conocimiento de su historia natural y un mejor manejo terapéutico. Por ello, en la actualidad el dominio de los signos radiológicos juega un papel primordial en su diagnóstico y tratamiento.
PRESENTACIÓN DEL CASO
Paciente masculino de 54 años de edad con antecedentes de consumo habitual de alcohol e hipertensión arterial esencial en tratamiento con inhibidores de la enzima convertidora de angiotensina, que acude al Servicio de Urgencias por molestias abdominales de más de un mes de evolución y pérdida de peso de aproximadamente 3 kg durante ese período. No se recogen antecedentes familiares de interés.
Al examen físico se palpaba una masa epigástrica de gran tamaño, no dolorosa, de consistencia dura, difícil de movilizar, no pulsátil, que se extendía a hipocondrio izquierdo. El resto de la exploración y la analítica complementaria no aportaban datos valorables.
Descripción de los hallazgos radiográficos:
Como primer estudio de imagen, se realizó radiografía convencional de abdomen (Fig. 1) donde se observó una masa supramesocólica (asterisco) en región epigástrica e hipocondrio izquierdo que lateralizaba el estómago y desplazaba el colon transverso caudalmente (flechas) sin borrar los músculos psoas y sin calcificaciones en su interior.
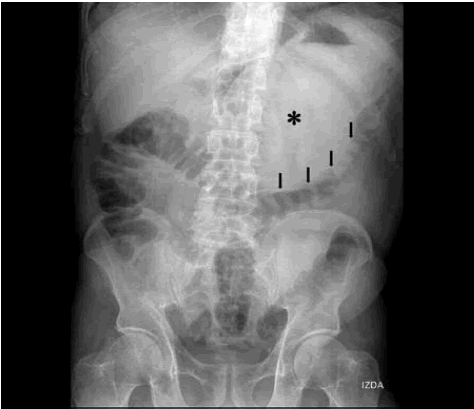
Fig. 1: Radiografía directa de abdomen: imagen radio opaca redondeada, con densidad agua, en el sector izquierdo del abdomen superior (asterisco), con compresión y desplazamiento de la columna aérea del colon transverso (flechas).
Ante esos hallazgos, se decidió realizar ecografía abdominal (US) (Fig. 2) y se confirmó la existencia de una imagen redondeada de aproximadamente 12 cm de diámetro en región epigástrica e hipocondrio izquierdo, de paredes finas, hipoecogénica, con refuerzo posterior y compatible con colección quística (asterisco). Dicha imagen comprimía el estómago, estando en contacto con su pared, sin que sugiriese dependencia a este último o al riñón izquierdo. No se identificaron ecos en el interior de la imagen compatibles con tabiques, vasos u otras estructuras.

Fig. 2: Ecografía de abdomen superior. Corte transversal a nivel epigástrico: imagen hipoecogénica, con aspecto quístico y ecos en su interior, de 11,7 cm de diámetro, sin tabiques y con pared relativamente fina (asterisco).
Se indicó TC abdominal con contraste intravenoso (Fig. 3), la cual corroboró la presencia de la lesión de característica quística (asterisco) anteriormente descrita, con densidad aproximada de 9 UH y que parecía estar en comunicación con una pequeña imagen quística en el cuerpo-cola del páncreas, sin dilatación del conducto pancreático ni de la vía biliar intra o extra hepática, así como también se verificó ausencia de signos inflamatorios en la región pancreática. Se evidenció estrecho contacto entre la pared quística y la gástrica, y la reconstrucción en el plano coronal demostró un eje mayor de la colección de aproximadamente 16 cm que desplazaba estructuras vecinas (Fig. 4).

Fig. 3: TC axial en abdomen superior. Imagen quística con pared bien definida, con contenido líquido, en el sector anterior del epigastrio (asterisco) y pequeña imagen líquida conectando con la cara anterior del páncreas en el cuerpo.

Fig. 4: TC en reconstrucción coronal. La imagen es ovoidea, aparece bilobulada y tiene un diámetro de 15,7 cm.
Finalmente, se realizó punción simple de la colección con toma de muestra del líquido, que resultó negativa para células malignas y marcadores tumorales. Luego, se procedió a la evacuación de la colección, a través de una cistogastrostomía con colocación de catéter pigtail, con guía ecográfica (Fig. 5). A las seis semanas, se realizó un control con TC, donde se objetivó ausencia de colección con pigtail in situ (Figs. 6 y 7). El diagnóstico final fue pseudoquiste pancreático.

Fig. 5: US. Guía ecográfica para el tratamiento por gastrocistostomía. Aguja de punción (flecha).

Fig. 6: TC. Reconstrucción multiplanar en plano sagital: catéter pigtail de la gastrocistostomía.

Fig. 7: TC. Corte axial a nivel del páncreas: se demuestra el drenaje total del pseudoquiste.
DISCUSIÓN
El pseudoquiste pancreático se define como una colección de más de 4 semanas de evolución, limitada por una pared fina de tejido reactivo granulomatoso o conectivo, sin revestimiento epitelial (a diferencia de los quistes verdaderos) y cuyo aspirado demuestra líquido estéril, hipocelular y rico en enzimas pancreáticas, secundario a la extravasación de estas últimas (1-10). Se presentan como complicación en el 15% de las pancreatitis agudas, relacionándose también con pancreatitis crónicas e ingesta crónica de alcohol (75 %) (1, 26 7 8 10). Según Greenberger los pseudoquistes suelen deberse a procesos inflamatorios pancreáticos en el 90% de los casos y a traumas pancreáticos en el 10%. Pueden ser únicos o múltiples y tener un tamaño variable, llegando a presentar grandes dimensiones, independientemente de su tiempo de evolución (1, 2 6 8).
Se localizan dentro o fuera del páncreas y su pared puede relacionarse con estructuras adyacentes, como el estómago, el colon transverso o la pared abdominal.
Clínicamente se presentan en pacientes con consumo crónico de alcohol, cuadros previos de pancreatitis, dolor abdominal, pérdida de peso, y al examen físico puede palparse una masa epigástrica (1, 6). Se han descrito complicaciones en el 30 a 50% de las pseudoquistes y las más frecuentes son: ictericia, infección secundaria del quiste, fistulización a estructuras adyacentes y hemorragias (1, 2 8). El dolor persistente y la elevación de la amilasa sérica sugieren el diagnóstico (8).
Éste y las pruebas de imagen (US, TC) serán la base del diagnóstico clínico inicial (1, 8) El juicio clínico se confirmará con el estudio del contenido del pseudoquiste, que demostrará niveles de amilasa elevados, muy sugestivos de comunicación entre la colección y los conductos pancreáticos No obstante, una cifra elevada de amilasa en el líquido no es suficientemente específica como para establecer el diagnóstico, por lo que nos apoyaremos en el estudio citológico negativo para células malignas, así como también en la negatividad de los marcadores tumorales (1, 3, 10, 11).
Lewandrowski concluyó que la punción de una lesión quística pancreática y el análisis de su contenido pueden proporcionar una orientación etiológica preoperatoria. Mediante el análisis de la viscosidad, determinación de CEA, CA 125 y la citología en el líquido, consiguió distinguir lesiones quísticas malignas y potencialmente malignas de los pseudoquistes y cistoadenomas serosos.
En cuanto al diagnóstico diferencial, existen varias entidades a descartar. Las duplicaciones intestinales son anomalías congénitas que, desde el punto de vista radiológico, se presentan como una masa quística tubular o esférica, localizada en el mismo sentido de la luz intestinal normal y con una mucosa ecogénica en su interior, paralela a la pared del quiste.
Radiológicamente, los abscesos se presentan como colecciones de tamaño variable, con paredes gruesas, que pueden contener gas y/o ecos internos, habitualmente acompañados de clínica infecciosa. También los quistes hidatídicos se muestran como quistes complejos.
Los divertículos gástricos o duodenales aparecen como estructuras quísticas que están en comunicación con la pared gástrica o duodenal que les da origen y que frecuentemente se acompañan de nivel hidroaéreo.
Los quistes mesentéricos muestran una imagen quística en el mesenterio u omentum, uni o multilocular con ecos internos y, en ocasiones, con calcificaciones en su pared. Etiológicamente, los más frecuentes son los linfangiomas de paredes finas y adheridos al intestino.
El hecho de que el 90% de las lesiones quísticas del páncreas sean atribuidas a pseudoquistes es un punto polémico, aun reconociendo que son los más frecuentes (10). Desde el punto de vista clínico-radiológico, Howell (2) recomienda la consideración de varios aspectos que nos harían dudar del diagnóstico de pseudoquiste, sin poder descartar etiología maligna de la colección pancreática. Los más relevantes son:
a) Ausencia de clínica compatible con pancreatitis, ya sea aguda, crónica o traumatismo pancreático.
b) Ausencia de cambios inflamatorios en el estudio tomográfico de la región pancreática.
c) Presencia de tabiques intracavitarios. Sahani (12) calculó el valor predictivo positivo para benignidad y malignidad en lesiones quísticas pancreáticas sobre la base del tamaño del quiste y la ausencia o presencia de septos. Para ello, determinó retrospectivamente la frecuencia de malignidad en pequeñas lesiones quísti-cas menores a 3 cm y concluyó que la mayoría de los pequeños quistes eran benignos. El 42% fueron quistes uniloculares y, de estos últimos, todos fueron benignos (excepto uno). En el 20% de los casos, la presencia de septos fue asociada a lesiones borderline o malignidad in situ.
A pesar de que estamos ante una masa con un eje máximo de aproximadamente 16 cm y que en la literatura los pseudoquistes pancreáticos tienen dimensiones máximas medias que rondan los 8-9 cm, éste debe ser siempre un diagnóstico diferencial a considerar, ya que se trata de una masa quística simple. Gouyon et al.(13) estudiaron retrospectivamente los casos complicados de pancreatitis crónica con pseudoquistes entre enero de 1983 y diciembre 1993, y encontraron que el 90% de los pseudoquistes presentaba un diámetro máximo menor a 8 cm. Cheruvu (14), por su parte, describió que el tamaño medio de los pseudoquistes en pacientes con pancreatitis aguda era de 9 cm, mientras que en las pancreatitis crónicas era de 7 cm.
Sobre este punto, Sandberg y Dervenis (15) hacen referencia a un estudio realizado sobre material recogido desde 1985 hasta 2001 en el Hospital Universitario de Galveston, Texas. Éste demostró que el diámetro medio de pseudoquistes en 103 pacientes con pancreatitis crónica fue de 9 ±1 cm. No obstante, según la literatura revisada por estos autores, existen reportes de pseudoquistes que han alcanzado excepcionalmente los 35 cm.
Respecto al algoritmo diagnóstico del pseudoquis-te pancreático, muchos autores recomiendan una exploración ecográfica inicial que se completaría con el estudio tomográfico y la CPRE. La resonancia magnética y la arteriografía pueden también estar indicadas (hasta el 10% de las pancreatitis desarrollan un pseudoaneurisma, siendo la arteria esplénica la másfrecuentemente afectada) (1, 6 8). En un estudio retrospectivo, que incluyó 58 pacientes con masas quísticas pancreáticas histológicamente demostradas, Visser y sus coautores (4) determinaron la exactitud de la TC y RM en la caracterización de dichas masas. A su vez, concluyeron que ambas técnicas son, de manera similar, razonablemente precisas en la caracterización de las masas quísticas del páncreas, principalmente al clasificarlas como benignas o malignas.
El hallazgo radiológico más característico del pseudoquiste pancreático es la presencia de una masa quística redondeada u ovoidea de tamaño variable (frecuentemente entre 2 y 9 cm) (6), única en más del 90% de los casos (5), con un volumen líquido que puede superar los 5000 ml e infiltrar los planos grasos peripancreáticos (6). Generalmente, son de aspecto simple (aunque en el 6% pueden verse multiloculados, incluso en ausencia de complicaciones) (6, 7, 8, 10,13). Kim y sus colaboradores (16) plantean la probabilidad de realce de la pared de los pseudoquistes tras la administración de contraste intravenoso, a pesar de su escaso grosor. Al respecto, Kalb (17) recuerda que el tejido blando presente en el pseudoquiste está compuesto por elementos no vascularizados y que el realce que puede observarse corresponde a tejido de granulación y fibrosis. Además, este autor insiste en que la lesión no es un pseudoquiste pancreático cuando dentro de una lesión quística vemos elementos vascularizados.
Ecográficamente podemos demostrar la morfología de la imagen quística anecogénica, de pared lisa y refuerzo acústico posterior. Durante su formación, el pseudoquiste puede tener ecos internos de aspecto complejo que desaparecen rápidamente al madurar. El detritus dentro de los pseudoquistes se evidencia por ecos dispersos de baja intensidad, secundarios a la degradación de células inflamatorias (6, 8). Raramente se pueden observar calcificaciones en las paredes de pseudoquistes muy evolucionados (7, 9). Habashi y Draganov (18) enfatizan que, durante las primeras fases del desarrollo de los pseudoquistes, estos pueden presentarse como lesiones complejas con diversos grados de ecos internos. Si bien desaparecen al tiempo en la mayoría de los casos, inicialmente pueden conducir a errores diagnósticos. Por lo general, esta apariencia es el resultado de la presencia de restos necróticos y es más común en pseudoquistes secundarios a pancreatitis aguda necrotizante que a pancreatitis crónica. Los pseudoquistes también pueden tener un aspecto complejo cuando se produce una hemorragia o infección en su interior.
El estudio tomográfico se centra en la confirmación de la imagen redondeada de paredes finas en relación con el páncreas, de densidad cercana al agua y que puede acompañarse de signos inflamatorios pancreáticos con afectación de la grasa adyacente.
Un 15% de los pseudoquistes se ubica en la cabeza del páncreas, mientras que el 85% restante se distribuye por el cuerpo y la cola (1, 5 6). En el 70% de los casos, la CPRE puede identificar la comunicación entre el pseudoquiste y los conductos pancreáticos(6).
Desde el punto de vista terapéutico, las alternativas van desde el manejo conservador hasta la extirpación o drenaje quirúrgico, percutáneo o endoscópico.
Yeo (19) en una serie de 75 pacientes con pseudoquistes, documentados mediante tomografía computarizada, concluyó que una gran proporción de pacientes con pseudoquistes se puede tratar de forma conservadora bajo seguimiento. A su vez, para pseudoquistes asintomáticos o que no disminuyan de tamaño con terapia conservadora, Palanivelu (20) recomienda drenaje laparoscópico interno en pseudoquistes maduros de diámetro > 6 cm o con una duración > a 6 semanas.
En una serie de 36 casos tratados inicialmente de forma conservadora, Cheruvu (14) describe que, del total pacientes, 14 (39%) fueron seguidos mensualmente con técnicas de imagen y se logró su curación.
De los 22 restantes, 12 requirieron drenaje percutáneo radiológico, 1 drenaje por cistogastrostomía endoscópica y sólo 9 cirugía abierta. Del total de pacientes, sólo 5 presentaron un episodio recurrente. Es por ello que, desde el punto de vista de la imagen, la valoración morfológica de la lesión y su evolución temporal son aspectos importantes que pueden condicionar el manejo terapéutico.
El principal imitador de un pseudoquiste es el cistoadenoma mucinoso y puede haber un solapamiento significativo entre las características de imagen de las dos entidades. En este caso, Kalb (17) plantea que el seguimiento con estudios de imagen seriados es útil, ya que el pseudoquiste pancreático a menudo se desarrolla en intervalos cortos, mientras que el cistoadenoma mucinoso suele mantenerse sin cambios significativos durante largos intervalos. Además, la pancreatitis aguda o crónica no está frecuentemente asociada al cistoadenoma mucinoso.
Las vías de drenaje a utilizar pueden ser: retro o transperitoneales, transgástricas, transhepáticas o transduodenales (6, 10). La probabilidad de recurrencia del pseudoquiste por drenaje interno hacia el estómago es mínima, por lo que se considera la ruta de elección en los casos que se asocian a obstrucción del conducto pancreático (8).
CONCLUSIÓN
Los pseudoquistes pancreáticos forman parte de una amplia gama de lesiones quísticas del páncreas. Estos pseudoquistes en ocasiones presentan grandes dimensiones que nos pueden inducir a cometer errores diagnósticos. Por ello, el conocimiento de sus características radiológicas y diagnóstico diferencial nos facilitará su reconocimiento, evaluación y seguimiento óptimo. A su vez, los antecedentes clínicos del paciente juegan un papel primordial, a tal punto que si un paciente no tiene antecedentes de pancreatitis, traumatismo pancreático o cirugía previa de páncreas y los resultados de los estudios de imagen no son concluyentes, el control evolutivo con imagen o su drenaje pueden ser recomendados.
1. Greenberger NJ, Toskes PT. Acute and chronic pancreatitis. En: Braunwald E, Hauser SL, Fausi AS, Longo DL., Kasper DL., Jameson JL., eds. Harrison's Principles of Internal Medicine. United States of America: McGraw-Hill; 2001: 1792-1804. [ Links ]
2. Howell DA. Diagnosis and management of pseudocysts of pancreas. UpToDate, version 16.3: october 1, 2008. Available at: http://www.uptodate.com. Accessed May 12, 2010. [ Links ]
3. Steer ML. Cystic lesions of pancreas. UpToDate, version 16.3: october 1, 2008. Available at: http://www.uptodate.com. Accessed May 12, 2010. [ Links ]
4. Visser BC, Yeh BM, Qayyum A, Way LW, Mcculloch CE, Coakley FV. Characterization of Cystic Pancreatic Masses. AJR Am J Roentgenol 2007; 189(3): 648-56. [ Links ]
5. Schmidt G. Páncreas. En: Schmidt G. Ecografía. De la imagen al diagnóstico. Madrid: Médica Panamericana; 2008: 293-311. [ Links ]
6. Federle MP. Pancreatic Pseudocyst. En: Federle MP, Jeffrey RB, Desser TS., eds. Diagnostic Imaging Abdomen. Utah: Amirsys; 2005: II3 24-8. [ Links ]
7. Abbitt PL. Páncreas. En: Abbitt PL. Ecografía, patrones de diagnóstico diferencial. Madrid: Marbán; 1997: 119-30. [ Links ]
8. Atri M, Finnegan PW. El Páncreas. En: Rumack CM, Wilson SR, Charboneau JW, eds. Diagnóstico por Ecografía. Madrid: Elsevier; 2006: 229-40. [ Links ]
9. Brant WE. Páncreas. En: Webb WR, Brant WE, Major NM, eds.. Fundamentos de TAC Body. Madrid: Marbán; 2007: 247-63. [ Links ]
10. Morgan DE, Stanley RJ. Páncreas. En: Lee JK, Sagel SS, Stanley RJ, Heiken JP, eds. Body TC con correlación RM. Madrid: Marbán; 2007: 1007-100. [ Links ]
11. Lewandrowski KB, Southern JF, Pins MR, Compton CC, Warshaw AL. Cyst Fluid Analysis in the Differential Diagnosis of Pancreatic Cysts A Comparison of Pseudocysts, Serous Cystadenomas, Mucinous Cystic Neoplasms, and Mucinous Cystadenocarcinoma. Ann Surg 1993; 217(1): 41-7. [ Links ]
12. Sahani DV, Saokar A, Hahn PF, Brugge WR, Del Castillo CF. Pancreatic Cysts 3 cm or Smaller: How Aggressive Should Pseudoquiste pancreático gigante Treatment Be? Radiology 2006; 238(3): 912-9. [ Links ]
13. Gouyon B, Lévy P, Ruszniewski, P, et al. Predictive factors in the outcome of pseudocysts complicating alcoholic chronic pancreatitis. Gut 1997; 41(6): 821- 5. [ Links ]
14. Cheruvu C, Clarke MG, Prentice M, Eyre-Brook IA. Conservative treatment as an option in the management of pancreatic pseudocyst. Ann R Coll Surg Engl 2003; 85: 313-6. [ Links ]
15. Sandberg A, Dervenis C. Pancreatic Pseudocysts in the 21st Century. Part I: Classification, Pathophysiology, Anatomic Considerations and Treatment. JOP. J Pancreas (Online) January 2004; 5(1): 8-24. Accessed May 22, 2010. [ Links ]
16. Kim YH, Saini S, Sahan D, Hahn PF, Mueller PR, Auh YH. Imaging Diagnosis of Cystic Pancreatic Lesions: Pseudocyst versus Nonpseudocyst. RadioGraphics 2005; 25: 671-85. [ Links ]
17. Kalb B, Sarmiento JM, Kooby DA, Adsay NV, Martin DR. MR Imaging of Cystic Lesions of the Pancreas. RadioGraphics 2009; 29: 1749-65. [ Links ]
18. Habashi S, Draganov PV. Pancreatic pseudocyst. World J Gastroenterol 2009; 15(1): 38-47. [ Links ]
19. Yeo CJ, Bastidas JA, Lynch-Nyhan A, Fishman EK, Zinner MJ, Cameron JL. The natural history of pancreatic pseu- docysts documented by computed tomography. Surg Gynecol Obstet 1990; 170(5): 411-7. [ Links ]
20. Palanivelu C. Laparoscopic Pancreatic Surgery. En: Palanivelu C. Art of Laparoscopic Surgery-Textbook and Atlas. First Edition. New Delhi: JAYPEE; 2007: 851-69. [ Links ]
El autor y los colaboradores del trabajo declaran no tener ningún conflicto de intereses.














