Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de radiología
versión On-line ISSN 1852-9992
Rev. argent. radiol. vol.76 no.1 Ciudad Autónoma de Buenos Aires mar. 2012
OBSTETRICIA

RM fetal: patología torácica y abdómino-pélvica
Manuel Recio Rodríguez (1), Pilar Martínez Ten (2), Javier Pérez Pedregosa (2), Carmina Bermejo López (3), Inés Tamarit Degenhardt (4), Ignacio Pastor Abascal (1).
(1) Hospital Universitario Quirón-Madrid, España. C/Diego de Velázquez 1, Pozuelo de Alarcón (28223)-Madrid, España.
(2) Delta Ecografía. Centro de Diagnóstico por la Imagen en Obstetricia y Ginecología, Madrid.
(3) Gabinete Médico Velázquez. Madrid.
(4) Servicio de Ginecología y Obstetricia. Hospital La Moraleja. Madrid.
Correspondencia: Dr. Recio Rodríguez-machamama@telefonica.net
Recibido: agosto 2011; aceptado: diciembre 2011
Received: august 2011; accepted: december 2011
©SAR
Resumen
Aunque la ecografía (US) es el método de elección en la evaluación del feto, la resonancia magnética (RM) es una técnica complementaria a la US en el diagnóstico de las anomalías fetales. Entre las ventajas de la RM se destacan un excelente contraste tisular, un campo de visión grande y una relativa operador-independencia. La mayoría de los trabajos previos de RM fetal han estudiado el sistema nervioso central (SNC). Sin embargo, la RM es útil en la evaluación de las anomalías torácicas y abdominales. En este artículo se muestran los diferentes aspectos por RM de las anomalías fetales torácicas y abdominales y se discuten las indicaciones y ventajas de la RM fetal.
Palabras clave. Anomalías fetales; Ecografía fetal; Estudios comparativos; Resonancia magnética (RM); RM embarazo; RM fetal.
Abstract
Fetal MRI: thoracic, abdominal ana pelvic pathology.
Ultrasonography (US) is the method of chotee in fetal examinaüon. However, magnetic resonance (MR) imaging is a complementan/ technique that contributes to the aecurate diagnosis of fetal anomalies. The benefits of MR include excellent tissue contrast, large field of view and relative operator independence. Most previous reports on fetal MR have focused on central nervous system (CNS). However, MR is a useful tool for the examination of fetal thoracic and abdominal anomalies. This article illustrates the different features of fetal thoracic and abdominal anomalies on MR, and further discusses the indications and benefits of fetal MR.
Keywords. Comparative studies; Fetal anomalies; Fetal MR; Fetal US; Magnetic resonance (MR) imaging; Pregnancy MR; Rapid imaging.
INTRODUCCIÓN
La ecografía (US) es el método de estudio rutinario para el cribado de las anomalías fetales, pero, incluso en manos experimentadas, tiene limitaciones técnicas. Si bien la mayoría de las ecografías son diagnósticas, estas limitaciones pueden requerir en patologías complejas un método por imagen alternativo para confirmar o completar los hallazgos ecográficos, ayudar al manejo del embarazo y planificar tanto las intervenciones intrauterinas como el parto o los cuidados posnatales.
Gracias al desarrollo de las secuencias ultrarrápidas en los años 90, la resonancia magnética (RM) se está convirtiendo en un método de estudio no invasivo, complementario a la US, para detectar anomalías fetales, que ayuda a establecer el pronóstico y el manejo perinatal. Sin embargo, la mayoría de los trabajos publicados se centran en la patología cerebral y sólo un número menor describen las aplicaciones de la RM fetal en la patología torácica, gastrointestinal o genitourinaria. En este artículo se revisa la patología fetal torácica (con especial mención de la hernia diafragmática congénita, donde la RM juega el papel más importante) y se describen las principales indicaciones de la RM en la patología abdominal, así como también las ventajas y desventajas de la RM frente a la ecografía.
PROTOCOLO DE ESTUDIO
Los estudios se deben realizar en resonadores de alto campo (1.5T) con bobinas multicanales de gran resolución espacial. Se realizan tres planos ortogonales a la madre y, sobre estos, se planifican los cortes sagitales, coronales y axiales del feto, usando siempre como referencia la última secuencia utilizada para la planificación de la siguiente (por los movimientos fetales). Las principales secuencias utilizadas son (Fig. 1):
• Secuencias potenciadas en T2 -como Single Shot Fast Spin Echo T2 (SSFSE T2)- y secuencias balanceadas Steady-State Free Precession -como la secuencia FIESTA-, que presentan gran contraste tisular, mostrando el líquido amniótico hiperintenso. Ambas secuencias permiten el estudio de la vía aérea, del pulmón, de la vía urinaria y del tracto digestivo -desde el esófago hasta las asas intestinales de íleon proximal-. Todas estas estructuras presentan un comportamiento de señal hiperintenso en secuencias T2. La secuencia FIESTA nos permite, además, realizar estudios vasculares sin contraste intravenoso, mostrando los vasos fetales hiperintensos (los vasos aparecen hipointensos en secuencias SSFSE T2 y T1).
• Secuencias potenciadas en T1 (3D gradiente doble eco, 2D FSPGR y 3D LAVA): tienen menor contraste tisular que las secuencias SS FSE T2 o FIESTA. Se utilizan en el estudio del hígado, de las asas de íleon distal y del colon, los cuales son visualizados como estructuras hiperintensas. Las secuencias 3D ofrecen la posibilidad de hacer reconstrucciones volumétricas de todo el marco cólico. Al igual que en la patología cerebral, estas secuencias son útiles para determinar la presencia de sangrado subagudo, calcificaciones o lipomas (1).
• Secuencias de difusión: sus aplicaciones están en desarrollo y actualmente se utilizan en el estudio de la madurez del parénquima pulmonar (2) y en el estudio de patologías renales, como la trombosis de la vena renal o el Síndrome de Transfusión Feto-Fetal (STFF) (3).

Fig. 1: (a) Sagital SS FSE T2. (b) Coronal FIESTA. (c) SS FSE T2 (URO-RM). (d) Secuencia de difusión. (e) Sagital 3D eco de gradiente T1. (f) Reconstrucción volumétrica (VR) del colon con secuencia 3D LAVA.
PATOLOGÍA TORÁCICA
Los pulmones fetales son estructuras llenas de líquido, hiperintensas en T2, fácilmente diferenciables del resto de las estructuras. La RM no sustituye a la US como primera línea de cribado, pero es útil en los casos de oligoamnios, obesidad de la madre o posición fetal inadecuada. En el trabajo de Levine y cols. (4), se estudiaron por US 74 fetos diagnosticados con anomalías torácicas. La RM aportó información adicional en un 38% y modificó el manejo en el 8%.
Hernia diafragmática congénita
La hernia diafragmática congénita (HDC) es la principal indicación de RM fetal en patología torácica. Su incidencia es de 1/2.500 - 1/5.000 de los recién nacidos vivos (5), siendo el 85% izquierda (hernia de Bochdalek), el 13% derecha y el 2% bilateral (6). Aproximadamente el 40% de los pacientes con HDC tienen otras malformaciones congénitas (sobre todo, cardíacas y del sistema nervioso central -SNC-), anomalías cromosómicas (trisomía 21, 18 y 13) y síndromes genéticos (síndrome de Fryns, síndrome de Lange o síndrome de Marfan) (7). Las anomalías asociadas se consideran un factor independiente de supervivencia (ésta es menor al 15%) (8).
El grado de hipoplasia pulmonar y la herniación hepática son los principales factores pronósticos. Para calcular el volumen pulmonar se utiliza en ecografía la razón LHR (área de pulmón contralateral/ circunferencia cefálica) y se mide en el segundo trimestre. Si la razón LHR es > 1,6 , la supervivencia es > 83%; si la razón LHR es > 1 y < 1,6, la supervivencia es del 66%; y con valores > 0,8 y < 1, la supervivencia es del 16% (9). El estudio volumétrico pulmonar 3D por US para el cálculo del volumen pulmonar no es superior al LHR (10).
La RM permite medir el volumen pulmonar del pulmón ipsilateral a la hernia y el contralateral, obteniendo el volumen pulmonar total observado (VPO).
Rypens y cols. (11) realizaron, en siete hospitales de Francia y Bruselas, un estudio multicéntrico prospectivo con RM en 336 fetos que tenían sospecha de patología del SNC, para establecer la correlación entre el volumen pulmonar total y la edad gestacional. El volumen pulmonar predictivo o esperado (VPE) es calculado por la ecuación: VPE = 0.0033 x g 2.86 (siendo g la edad gestacional en semanas).
Coakley y cols. (12) en su estudio retrospectivo con 46 fetos de mujeres norteamericanas establecen una estrecha relación entre el volumen pulmonar total calculado por RM y el volumen hepático medido por la RM, el peso fetal estimado por la ecografía, la circunferencia cefálica medida por la ecografía y la edad gestacional. El VPE es calculado por la ecuación: VPE = (0,47 x volumen hepático en ml) + (0,76 x diámetro biparietal en mm) - (0,39 x longitud del fémur en mm) -18,9.
Asimismo, Cannie y cols. (13) llevaron a cabo un estudio en 200 fetos sin anomalías en el Hospital Universitario de Gasthuisberg (Bélgica). Correlacionaron el volumen pulmonar total con el volumen corporal fetal (VCF), siendo superior a la correlación con el resto de variables biométricas. El VPE es calculado por la ecuación: VPE = (2.0 x 10 -9 x VCF 3) - (1,19 x 10 -5 x VCF 2) + (0,0508 x VCF) - 1,79.
La relación VPO/VPE x 100 establece el volumen pulmonar relativo (VPR) y se considera hipoplasia a los valores inferiores al 80% (14). Todos los fetos con valores < 14,3% presentan 100% de mortalidad, aquellos con valores > 32,8 tienen 100% de supervivencia y los que tienen valores > 44% no necesitan oxigenación membranal extracorpórea (ECMO) (15) (Figs. 2, 3 y 4).

Fig. 2: (a), (b) y (c) Sagital SS FSE T2. (d) Axial SS FSE. (e) VR de pulmón derecho (5,311 cm3) y (f) VR de pulmón izquierdo (1,425 cm3). Hernia diafragmática izquierda con herniación de asas intestinales (flecha blanca), estómago (cabeza flecha blanca) y lóbulo hepático izquierdo (flecha curva). Pulmón derecho (flecha quebrada). Corazón (cabeza de flecha negra). Hipoplasia del pulmón izquierdo (flecha negra) y desplazamiento cardio-mediastínico contralateral.Volumen pulmonar esperado total: 18,2 c.c.; volumen pulmonar observado total: 6,73 c.c.; volumen pulmonar relativo: 36,9%. EG: 20 s.

Fig 3: (a) Coronal FIESTA y (b) Coronal gradiente doble eco T1. (c) y (d) Sagital SS FSE T2. Hernia diafragmática derecha con herniación de asas intestinales (flecha negra) y lóbulo hepático derecho (flecha blanca). Pulmón derecho hipoplásico (cabeza de flecha). Desplazamiento cardio-mediastínico contralateral. EG: 22,5 s. Volumen pulmonar derecho: 0,884 cc.; volumen pulmonar izquierdo: 5,905 cc.; volumen pulmonar total observado: 6,79 cc.; volumen pulmonar total esperado: 20,32 cc.; volumen pulmonar relativo: 33%.

Fig. 4: (a) Sagital SS FSE T2, (b) Sagital gradiente doble eco T1 y (c) Coronal SSFSE T2. Hernia diafragmática izquierda con herniación parcial del estómago (flecha negra), de asas intestinales (flecha quebrada), ángulo esplénico del colon (flecha curva) y bazo (cabeza de flecha blanca). Pulmón izquierdo (flecha blanca). Desplazamiento cardio-mediastínico contralateral. EG: 21 s. Volumen pulmonar derecho: 6,077 c.c.; volumen pulmonar izquierdo: 3,063 c.c.; volumen pulmonar total observado: 9,14 c.c.; volumen pulmonar total esperado: 19,2 c.c.; volumen pulmonar relativo: 48,05%.
La RM también permite valorar la madurez pulmonar mediante intensidad pulmonar: se ha correlacionado la madurez pulmonar con la hiperseñal que presenta el pulmón en secuencias T2, valorando el ratio de señal entre pulmón/ líquido cefalorraquídeo (16), pulmón/ líquido gástrico o pulmón/ hígado (17). La intensidad de señal aumenta con la gestación (18).
El grupo de Moore y cols. (19) han estudiado los pulmones fetales con secuencias de difusión y han demostrado que el ADC aumenta con la edad gestacional (a partir de la semana 18), probablemente reflejando el aumento de las secreciones alveolares y de la vascularización pulmonar (20,21).
La espectroscopía tiene un teórico potencial en la evaluación de la madurez pulmonar. El surfactante está compuesto en un 90% por fosfolípidos (básicamente por la fosfatidilcolina -lecitina- en un 70%) y en un 10% por proteínas. La cantidad de colina, el ratio colina creatina, lecitina y lactato se podrían correlacionar con la cantidad de surfactante del pulmón (22,23). Por desgracia, esta técnica tiene varias limitaciones (especialmente los artefactos de movimiento).
Los fetos con herniación hepática tienen una supervivencia del 50%. La posición supradiafragmática hepática es difícil de visualizar por ecografía, mientras que la RM permite identificar, sobre todo en los planos sagital y coronal, el defecto del diafragma (solución de continuidad de la banda hipointensa en secuencias T2) y la posición anómala del hígado (que presenta una señal hiperintensa en secuencias T1 e hipointensa en secuencias T2). Las estructuras que se hernian con mayor frecuencia en hernias diafragmáticas izquierdas son la grasa omental, el intestino delgado, el lóbulo hepático izquierdo y el estómago. Es poco común que se hernien el riñón o el páncreas. En hernias diafragmáticas derechas, el órgano que se hernia con más asiduidad es el hígado con herniación del lóbulo hepático derecho.
El tratamiento con balón de oclusión endotraqueal (FETO) está indicado en los casos de herniación hepática (LHR <1, en la semana 26-29 y en ausencia de alteraciones cromosómicas o de anomalías asociadas). Es una terapia mínimamente invasiva, en la cual se infla un balón endotraqueal durante 3 ó 6 semanas. La retención de fluidos en el pulmón acelera la maduración pulmonar y disminuye el riesgo de hipertensión pulmonar. Debe ser realizado antes de la semana 29, para luego ser retirado por fetoscopia -tras la punción del balón en la semana 34-, ex-útero-intraparto (EXIT) o de forma neonatal (traqueoscopia o punción percutánea). El tratamiento con FETO realizado antes de las 29 semanas produce una importante expansión del pulmón por una marcada producción de fluidos. Cuando el balón es retirado, existe casi un 50% de pérdida de VPR, pero es un 40% superior al VPR previo del feto. El tratamiento con FETO realizado luego de la semana 29 no incrementa el VPR después de retirar el balón (24). En el trabajo de Jani y cols. (25) las principales complicaciones fueron: ruptura prematura de membranas (47%), corioamnionitis o parto prematuro. El tratamiento con FETO aumentó la supervivencia en HDC izquierdas de 24,1% a 49,1% y la supervivencia en HDC derechas de 0% a 35,3%. El 97% de los fetos tratados con FETO nació vivo y, de ellos, el 50% soportó la cirugía y salió vivo del hospital.
Malformación adenomatoidea quística (MAQ) o malformación congénita de la vía aérea pulmonar
Es la masa pulmonar fetal más comúnmente diagnosticada en el periodo neonatal. Consiste en un hamartoma pulmonar con proliferación de bronquiolos terminales y ausencia de alveolos normales. Son masas sólidas o quísticas, con vascularización por la arteria pulmonar y drenaje a venas pulmonares. La mayoría de las MAQ son unilaterales y afectan a un lóbulo entero, aunque existen lesiones híbridas asociadas a secuestros pulmonares con vascularización sistémica (26 27). Stocker y cols. (28) las clasificaron en: tipo I (uno o más quistes > 2 cm), tipo II (múltiples quistes 2-0,5 cm) y tipo III (gran lesión microquística < 0,5 cm). Las MAQ son normalmente detectadas por ecografía en la semana 20 (29) y aparecen como masas pulmonares ecogénicas quísticas o sólidas. Ocasionalmente, pueden diagnosticarse por ecografía, como HDC o viceversa (30).
Las MAQ aisladas tienen buen pronóstico, con una supervivencia del 97% independientemente del tipo histológico, si se excluyen a las MAQ con anomalías asociadas, que suponen un 3-12% (la mayoría corresponde a las lesiones tipo II de Strocker). Más del 50% se resuelve de forma espontánea en el embarazo (29). Típicamente las MAQ con un volumen menor al 57% del volumen pulmonar total tienen una resolución completa, mientras que aquellas con un volumen mayor al 84% muestran una resolución incompleta.
El factor pronóstico más importante es la presencia o ausencia de hidrops (31). La MAQ puede comprimir el corazón y la vena cava inferior y, secundariamente, reducir la contractilidad cardíaca y disminuir el retorno venoso (32). Si no se la trata con hidrops, más del 90% de los fetos morirán antes de nacer(33). Para estimar el desarrollo de hidrops, se calcula por ecografía la razón CVR (volumen de la MAQ/ circunferencia cefálica). El volumen de la MAQ se calcula con las medidas ecográficas de las tres dimensiones de la masa. Éste se divide por la circunferencia cefálica, la cual se evalúa por ecografía (diámetro óseo fronto-occipital + diámetro óseo biparietal) x 1,57. Si la CVR es > 1,6, el feto desarrollará hidrops en un 75% de los casos; si la CVR es < 1,6, se producirá hidrops en menos del 3% (35).
Los hallazgos en RM varían según el tipo de MAQ: en el tipo I, aparece como una lesión unilocular hiperintensa en secuencias T2; en el tipo II, se presenta como una lesión multilocular hiperintensa en secuencias T2; y en el tipo III, como una masa sólida hiperintensa en secuencias T2, adyacente al pulmón normal, que es más hipointenso. Además, permite calcular el volumen de la lesión y del parénquima pulmonar y, así, cuantificar y monitorizar el crecimiento o resolución de las lesiones (31) (Figs. 5 y 6).

Fig 5: (a) Coronal SS FSE T2, (b) Sagital SS FSE T2, (c) Axial SS FSE T2, (d) reconstrucción VR de la MAQ, (e) reconstrucción VR del pulmón derecho, (f) reconstrucción VR del pulmón izquierdo. MAQ tipo II en LII (flecha curva), LSI (cabeza de flecha) y pulmón derecho (flecha blanca). EG: 22,5 s. Volumen pulmonar derecho: 9,307c.c; volumen pulmonar izquierdo: 4,244 cc.; volumen pulmonar total: 13,55 cc. Volumen MAQ: 13,942 cc. Índice CVR: 0,75 (< 1,6 buen pronóstico). El corazón desde las 32 semanas ocupó su lugar en hemitórax izquierdo y con control ecográfico que constató la reducción de la zona pulmonar afectada por MAQ. Parto eutócico a término con un peso de 3200 g; no precisó ayuda respiratoria. Rx de tórax posparto normal.

Fig.6: (a) Sagital SS FSE T2, (b) Coronal SS FSE T2, (c) Axial SS FSE T2 y (d) Coronal EG doble eco T1. MAQ tipo II en segmento posterior de LID (flecha blanca). EG: 28 s. Hígado (cabeza de flecha) y ángulo hepático del colon (flecha quebrada) normales.
Requieren cirugía posnatal, pasado el mes de vida, por el peligro de infección y bajo riesgo de malignización -tasa anual del 3%-: en niños pequeños, a blastoma pleuropulmonar, rabdomiosarcoma o myxosarcoma; en niños mayores o adultos, a carcinoma bronquioalveolar (36).
Secuestro broncopulmonar
Es la segunda lesión pulmonar más común en el diagnóstico prenatal. El tejido broncopulmonar no conecta con el árbol bronquial o las arterias pulmonares y está irrigado normalmente por vascularización sistémica de la aorta torácica o abdominal. Su localización más frecuente es en el lóbulo inferior izquierdo (> 2/3) (37), siendo en un 90% supradiafragmático (Fig. 7) y en menos del 10% infradiafragmático (38) (Fig. 8).

Fig 7: (a) Coronal SS FSE T2. (b) Axial SSFSE T2. (c) Coronal FIESTA. (d) y (e) Ecografías. (1) Secuestro pulmonar que presenta un componente sólido hiperintenso en T2, similar a MAQ tipo III. (2) Vaso anómalo sistémico de la aorta torácica distal. (3) Aorta torácica distal. (4) Parénquima pulmonar izquierdo colapsado. (5) Pulmón derecho. EG: 28 s. Evolución: cesárea 38 SG; apgar 8/10; 3100 g Confirmación posnatal.

Fig. 8: (a) y (b) Sagital SS FSE T2. (c) Coronal SS FSE T2. (d) Axial SS FSE T2. Secuestro infradiafragmático (flecha) y arteria sistémica de aorta abdominal (cabeza de flecha). EG: 31,5 s.
El secuestro tipo extralobar es el que se encuentra en el feto y presenta revestimiento pleural propio y drenaje venoso sistémico a ácigos o a vena cava inferior (25% a venas pulmonares) (39). El secuestro intralobar no tiene pleura propia y drena a venas pulmonares (40). Estos son raramente diagnosticados prenatalmente y suelen estar asociados a las MAQ tipo II (lesiones híbridas) (41). Tienen un excelente pronóstico, cuando es un hecho aislado, y más del 50% desaparecen intraútero (29). Las lesiones de gran tamaño pueden comprimir al esófago y a las venas torácicas, causando hidrops (es indicación de intervención fetal y parto precoz) (42). El tratamiento prenatal se realiza en casos de hidrotórax a tensión con shunt tóraco-amniótico.
En la RM, el secuestro pulmonar aparece como una lesión sólida hiperintensa en secuencias T2, muy similar a las MAQ tipo III. La identificación del aporte vascular sistémico facilita el diagnóstico, sobre todo con las secuencias balanceadas. La RM detecta lesiones de tamaño pequeño y anomalías asociadas.
En el periodo posnatal, la mayoría es asintomática y puede presentar distress respiratorio o cianosis. El tratamiento posnatal consiste en la embolización del aporte vascular y/o resección quirúrgica, debido al riesgo de infección, hemorragia y cuestionable malignidad (sobre todo en lesiones híbridas) (42).
Quiste broncogénico
El quiste broncogénico es la lesión quística solitaria más comúnmente encontrada en el tórax fetal. En su mayoría son únicos y tienen una localización mediastínica en la región carinal y, con menor frecuencia, en la hiliar (43). En la RM aparece como un quiste de bordes bien definidos, hiperintenso en T2 comparado con el tejido pulmonar adyacente (Fig. 9). Además, la RM puede detectar obstrucción bronquial por efecto de masa de algunos quistes con hiperintensidad en secuencias T2 del lóbulo obstruido (44). El papel de la RM queda limitado a los casos que presenten obstrucción bronquial. Estos se beneficiarían con EXIT con ECMO con resección de la lesión obstructiva, seguida de reconstrucción de la vía aérea.

Fig. 9: (a) Sagital FSE T2. (b) Sagital FIESTA. (c) Axial SS FSE T2. (d) Coronal FIESTA. (e) Ecografía axial y (f) ecografía sagital. Quiste broncogénico en pulmón izquierdo (flecha blanca). EG: 22 s. Gemelos bicoriales y biamnióticos.
Obstrucciones bronquiales por tapón mucoso
Las obstrucciones bronquiales por tapón mucoso de un bronquio principal o lobar producen una imagen similar a la MAQ tipo III o a un secuestro con masa intratorácica, hiperintensa en T2, que puede desplazar el mediastino (Fig. 10). Se puede resolver de forma espontánea intraútero o por broncoaspiración posnatal (45).

Fig 10: (a) y (b) Coronal SS FSE T2. (c) y (d) Sagital SS FSE T2. Afectación del LII (flecha blanca), LSI sano (cabeza de flecha) y pulmón derecho sano (flecha quebrada) con Rx normal al nacer, que correspondía a atelectasia transitoria por tapón mucoso. EG: 20,5 s.
Otras indicaciones menos frecuentes
Onfalocele
Entre las patologías torácicas estudiadas con menor frecuencia por RM se incluyen: obstrucción congénita de la vía aérea (por factores extrínsecos o malformaciones atrésicas o estenóticas traqueales y bronquiales), enfisema lobar congénito, derrame pleural, derrame pericárdico, tumores pericárdicos (teratoma), tumores mediastínicos (teratoma, linfangioma) y tumores cardíacos (rabdomiomas).
PATOLOGÍA ABDOMINAL
El número de trabajos publicados sobre la utilidad de la RM en patología abdominal es muy inferior a los publicados sobre RM torácica. Si bien la mayoría de las ecografías son diagnósticas, existen limitaciones ecográficas que requieren una imagen alternativa.
Defectos de la pared anterior del abdomen
Los defectos de la pared anterior del abdomen presentan una incidencia de 1/ 2.000 recién nacidos vivos (4). Los más frecuentes son la gastrosquisis y el onfalocele y los menos habituales, la pentalogía de Cantrell (defecto de la pared abdominal en línea media, hernia diafragmática anterior, defecto del pericardio diafragmático, defecto esternal inferior y anomalías cardiacas) y la extrofia vesical y cloacal.
Es un defecto de la pared abdominal en línea media con herniación de contenido abdominal, recubierto de peritoneo y amnios, con inserción del cordón umbilical en el ápex del onfalocele. El hígado, estómago y asas de intestino delgado se hernian más frecuentemente y son fácilmente identificados por RM. El onfalocele se asocia a otras malformaciones en un 40 a 70% de los casos y la incidencia de anomalías cromosómicas es del 10 al 40%, incluidas las trisomías 13, 14,15, 18 y 21 (47).
La presencia de hígado en los órganos herniados ha sido considerada como el elemento que diferencia un onfalocele grande de uno pequeño. Los grandes tienen una alta mortalidad, ya que requieren varios procedimientos quirúrgicos para obtener el cierre del defecto y presentan como mayor limitación una cavidad torácica pequeña, asociada a hipoplasia pulmonar y necesidad prolongada de ventilación mecánica (Fig. 11). La RM diagnostica fácilmente la presencia del hígado en la herniación y puede establecer el grado de hipoplasia pulmonar. Por su parte, los onfaloceles pequeños (Fig. 12) muestran una mayor asociación con cromosomopatías (48).
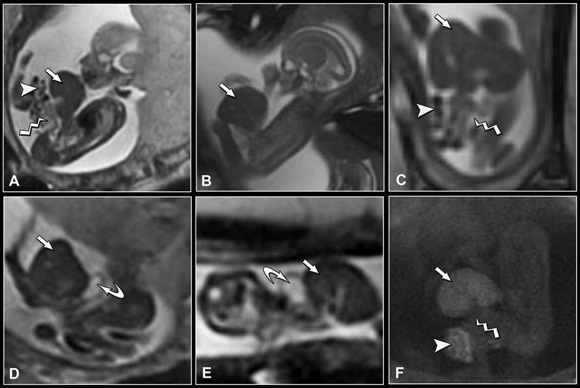
Fig. 11: (a) y (b) Sagital SS FSE T2. (c) Coronal SS FSE T2. (d) Corte oblicuo SS FSE T2. (e) Axial SS FSE T2. (f) Eco de gradiente T1. Onfalocele: herniación de hígado (flecha blanca), estómago (flecha curva), asas intestinales sin meconio (flecha quebrada) y asas intestinales con meconio (cabeza de flecha). EG: 20 s.

Fig. 12: (a) Ecografía 3D. (b) Ecografía 2D (c) Sagital SS FSE T2. (d) Sagital Eco de gradiente T1. Onfalocele (flecha blanca). Asas intestinales con meconio (cabeza flecha blanca). EG: 28 s. Evolución: parto normal y corrección quirúrgica posterior.
Gastrosquisis
Es un defecto paraumbilical de la pared abdominal anterior, típicamente derecho (49). Las asas del intestino delgado se prolapsan con frecuencia y flotan en el líquido amniótico sin recubrimiento membranal. El colon puede ser extracorporal en la gastrosquisis, pero no el recto o el sigma. Con menor frecuencia existe prolapso hepático. Su incidencia es mayor en madres que toman sustancias vasoactivas (cocaína, nicotina, descongestivos o aspirinas) y en madres menores de 25 años. Generalmente no se asocian a otras malformaciones, aunque pueden afectar en un 10-15% al tracto intestinal (atresias, estenosis, intestino corto) debido, probablemente, a fenómenos isquémicos determinados por la obstrucción de las asas (50). Se asocia a oligoamnios y restricción del crecimiento intrauterino (RCI). Si se acompaña de polihidramnios, hay que descartar obstrucción o atresia intestinal. La RM facilita la visualización en los casos de oligoamnios u obesidad materna, así como las complicaciones intestinales asociadas.
En el 4-5% se asocia a malformaciones cardíacas (51). La incidencia de anomalías cromosómicas en gastrosquisis es inferior al 3% (52).
ANOMALÍAS GASTROINTESTINALES
La base del estudio del tracto gastrointestinal en el feto es la presencia de un medio de contraste natural: el líquido amniótico deglutido que pasa al intestino y el meconio. La deglución del líquido amniótico comienza en la semana 9-10 de gestación (53); sin embargo, salvo en el estómago, hasta la semana 25 de gestación no existe una cantidad suficiente en el intestino que sirva de contraste. En el feto a término, el volumen de líquido amniótico deglutido es de unos 750 ml/día. El meconio se empieza acumular en el recto a las 18 ó 20 semanas, con relleno retrógrado del colon y asas de íleon distal.
La mayoría de las anomalías es diagnosticada por ecografía y no necesita de un método diagnóstico complementario.
Las principales indicaciones de la RM en el estudio gastrointestinal son: identificar el nivel de las obstrucciones intestinales (atresias intestinales, íleos meconiales y vólvulos intestinales) y descartar tanto isquemia intestinal (engrosamiento de pared, peritonitis meconial) como malrotaciones intestinales.
Atresia esofágica
La más frecuente es la tipo A con atresia proximal y fístula traqueo-esofágica distal. El diagnóstico se establece por polihidramnios, estómago pequeño, bolsón proximal esofágico y RCI en el 2º o 3º trimestre (54) (Fig. 13). La fístula traqueo-esofágica no puede ser detectada por RM. Se asocia a trisomía 18 y, si no presenta fístula, es más común en trisomía 21.

Fig 13: (a) y (b) Coronal SS FSE T2. (c) y (d) Sagital SS FSE T2. Arteria umbilical única (flecha blanca). Atresia de esófago con estómago de pequeño tamaño (cabeza de flecha) y pequeño bolsón esofágico (flecha quebrada). Tráquea (flecha curva). EG: 31,5 s.
Atresia o estenosis duodenal
Es diagnosticada por el signo de la doble burbuja del estómago y duodeno (hipointensa en secuencias T1 e hiperintensa en secuencias T2) (55), que incluye estenosis duodenal, páncreas anular, bandas de Ladd y vólvulo. La atresia duodenal se asocia a otras anomalías y a trisomía 21 (56).
Atresia o estenosis de intestino delgado
Existe una dilatación de las asas intestinales proximales a la obstrucción. La RM proporciona información adicional, ya que, si la atresia o estenosis es yeyunal, las asas dilatadas son hipointensas en secuencias T1 e hiperintensas en secuencias T2 (con signo de triple burbuja y polihidramnios, si afecta al yeyuno proximal) y en la atresia o estenosis ileal aparecen asas dilatadas con forma de "ristra de salchichas" con meconio, hiperintensas en secuencias T1 e iso-hipointensas en secuencias T2 (57). Las atresias distales tienen más riesgo de perforación y peritonitis meconial.
Peritonitis meconial
Es una peritonitis química secundaria a la perforación de un asa intestinal, que se diagnostica con la US por la presencia de calcificaciones peritoneales, ascitis y pseodoquistes (54). La RM no identifica las calcificaciones, pero permite reconocer con facilidad las asas dilatadas, la ascitis, el polihidramnios y las masas quísticas (pseudoquistes meconiales). Los pseudoquistes pueden tener septos en su interior y una señal variable T1 y alta en T2 (58), hiperintenso en T1 e intermedio en T2 (59) o hiperintenso en T1 y muy baja en T2 (60).
Síndrome del megavejiga- microcolon-hipoperistaltismo
La ecografía y la RM diagnostican fácilmente el aumento de tamaño vesical (es el hallazgo más característico). La RM lo identifica, a partir de la semana 25 de gestación, por la escasa cantidad de meconio generalmente presente en el recto. Al final de la gestación, se acumula más meconio y se puede visualizar el microcolon (55).
Atresias de intestino grueso
Afectan fundamentalmente al recto. La atresia de colon transverso produce la dilatación del colon proximal, escaso meconio distal y dilatación de asas de delgado con ausencia de peristaltismo. La atresia cecal produce dilatación del ciego y del íleon terminal con abundante meconio (61).
Malrotaciones del colon
Se pueden diagnosticar a partir de la semana 25 de gestación por RM. Ésta muestra la posición anómala del colon, utilizando secuencias ponderadas en T1, debido al contenido meconial (55).
Enfermedad de Hirschsprung
Se observa dilatación rectal con señal invertida hipointensa en secuencias T1 e intermedia en secuencias T2 (62).
Atresia anal
Las formas pequeñas y aisladas pueden ser indetectables por RM. Las asas en forma de U o V en pelvis sugieren el diagnóstico. Frecuentemente, se asocian a la fístula del tracto urinario que produce enterolitos (los cuales se identifican mejor con ecografía) (63) o forman parte del síndrome de VACTERL (anomalías vertebrales, atresia anal, anomalías cardíacas, fístula traqueo-esofágica, anomalías renales y malformaciones en los miembros).
ANOMALÍAS GENITOURINARIAS
La orina fetal es la principal fuente de producción de líquido amniótico. A partir de la décima semana de gestación, los riñones fetales producen orina y, durante la segunda mitad del embarazo, producen el 90% del líquido amniótico.
La RM está solamente indicada cuando los resultados de la ecografía no son concluyentes, especialmente en los casos de oligoamnnios o anhidramnios. Las secuencias T2 2D y 3D con tiempo de repetición (TR) largo permiten obtener imágenes urográficas del sistema excretor sin el uso de contraste intravenoso (éste se encuentra contraindicado).
La secuencia de difusión sería útil en los casos de sospecha de infarto renal por trombosis venosa con disminución del coeficiente de difusión aparente (ADC) y en los síndromes de transfusión feto-fetal, donde el valor de ADC del riñón del donante es superior al del receptor y se correlaciona con la severidad del síndrome. La difusión facilita el diagnóstico de agenesia renal (uni o bilateral) porque es una técnica muy sensible en la detección del parénquima renal (64,65).
Agenesia renal bilateral
La RM permite el diagnóstico de agenesia renal bilateral, ya que el severo oligoamnios o anhidramnios dificulta la valoración por US. Se acompaña de cardiomiopatías congénitas y síndrome de Potter por el oligoamnios (facies característica, contracturas articulares e hipoplasia pulmonar) (69).
Agenesia renal unilateral
La agenesia renal unilateral (Fig. 14) generalmente es un hecho aislado con esperanza de vida normal, aunque en ocasiones puede asociarse al síndrome de VACTERL. Cuando un riñón no está localizado en la fosa renal, la RM ayuda a identificar la situación del riñón ectópico.

Fig. 14: (a) y (b) Sagital FIESTA. (c) Coronal FIESTA. (d) y (e) Imágenes urográficas SS FSE T2. (f) Coronal Eco de gradiente T1. Agenesia renal izquierda. Riñón derecho hipertrófico (flecha blanca). Vejiga (cabeza de flecha blanca). Asas de intestino delgado (flecha quebrada) y ángulo esplénico del colon (flecha curva) en celda renal izquierda. EG: 32 s.
Enfermedad renal poliquística autosómica
La enfermedad renal poliquística autosómica recesiva presenta riñones grandes con alta intensidad uniforme en secuencias T2 y pérdida de diferenciación córtico-medular; no se identifica el sistema pielocalicial (70).
Riñones displásicos multiquísticos
Los riñones displásicos multiquísticos (Fig. 15) están aumentados de tamaño y tienen múltiples quistes de diferentes tamaños en situación periférica y central con escaso parénquima renal entre ellos (71). Estos quistes presentan hiperseñal en secuencias T2 y están separados del sistema pielocalicial.
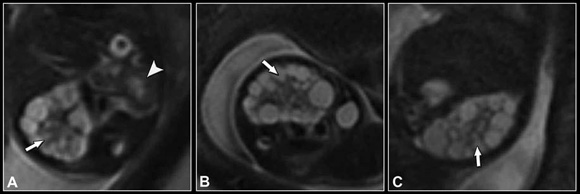
Fig. 15: (a) Coronal SS FSE T2. (b) Axial SS FSE T2. (c) Sagital SS FSE T2. Riñón derecho multiquístico (flecha). Riñón izquierdo normal (cabeza de flecha). EG: 20 s.
Hidronefrosis
La hidronefrosis es claramente visualizada en T2. En el plano coronal, se pueden realizar imágenes urográficas, visualizando todo el trayecto ureteral (66).
Estenosis de la unión pieloureteral
La estenosis de la unión pieloureteral es la causa más frecuente de hidronefrosis detectada prenatalmente (67) y, cuando progresa, puede producir un riñón displásico con múltiples quistes corticales y medulares.
Duplicidad del sistema pielocalicial
La duplicidad del sistema pielocalicial es la malformación más frecuente (68). La RM puede ayudar a establecer el diagnóstico de duplicidad completa o incompleta, así como la desembocadura ectópica de un ureterocele asociado al uréter superior.
Extrofia vesical
La extrofia vesical es una malformación rara con pared anterior vesical ausente y pared posterior expuesta externamente. La RM identifica una masa sólida extruida en situación infraumbilical, con riñones y LA normales (72).
Malformación cloacal
La malformación cloacal es una causa infrecuente de uropatía obstructiva secundaria al fallo en la división de la cloaca primitiva, con comunicación entre el tracto gastrointestinal, urinario y los genitales, con un solo orificio perineal. Es más frecuente en el sexo femenino, con hidronefrosis bilateral, lesión quística en pelvis y dificultad para visualizar la vejiga por su tamaño pequeño (Fig. 16). Se acompaña de calcificación del meconio en el tracto urinario y colon, los cuales se identifican mejor por ecografía (72,74). Existe una variante menor: el seno urogenital, donde permanece una comunicación entre la vagina y el tracto urinario (esto existe normalmente durante el desarrollo embriológico). Dicha comunicación ocurre en cualquier punto, desde el meato uretral hasta la vejiga, pero generalmente se da en la uretra media o distal. Las dos estructuras se unen y desembocan en el periné como un único canal común (75).

Fig. 16: Gestación gemelar bicorial biamniótica. Malformación cloacal. (a) Ecografía de la semana 15: dilatación recto-sigmoidea (flecha blanca) y fecalito (cabeza de flecha blanca) en uno de los gemelos, sin ascitis. (b) Ecografía de la semana 20: se observa una estructura quística con septo incompleto (flecha quebrada), anterior al rectosigma y posterior a la vejiga (flecha negra), presentando genitales ambiguos. Se realiza RM a la semana 26,5. (c) Sagital SS FSE T2 y (d) Sagital SS FSE T2 (URO-RM). Ascitis (cabeza de flecha negra) del gemelo en situación longitudinal y presentación podálica dorso izquierda. Estructura quística (flecha quebrada) anterior al recto-sigma. (e) y (f) Coronal FIESTA. Ascitis (cabeza de flecha negra) y estructura quística con septo incompleto (flecha quebrada) que presenta contenido en su interior (flecha curva), sugiriendo detritus por fístula con el recto-sigma (flecha blanca). No se logra identificar vejiga. G SS FSE T2 (URO-RM). Hidronefrosis grado III /IV derecha (1) y grado II/IV izquierda (2), sugiriendo ascitis urinaria. Control posnatal con Rx: relleno retrógrado de contraste a través de un orificio único perineal (3). Se rellenan la vejiga (4), vagina y útero septado parcial (5) con hidrometrocolpos y gas en su interior por fístula con el rectosigma. No se logra rellenar el rectosigma con el contraste (6).
Síndrome de Prune Belly o de Eagle-Barret
El síndrome de Prune Belly o de Eagle-Barret es una malformación congénita rara con severa hidronefrosis, deficiencia de la musculatura abdominal y criptorquidia. La RM identifica la hidronefrosis, la dilatación ureteral bilateral y la dilatación de toda la uretra, a diferencia de las valvas posteriores que dilatan la uretra proximal. Los genitales están ausentes y se acompaña de oligoamnios (76).
MASAS ABDOMINALES
La mayoría de las masas abdominales son lesiones quísticas benignas:
Quiste de duplicación intestinal: es un quiste unilocular, con doble pared mucosa y muscular. Es más frecuente en el íleon distal.
Quiste del mesenterio: se considera una malformación linfática. Puede ser unilocular o más frecuente multilocular con múltiples septos (Fig. 17). En ocasiones se extiende al retroperitoneo y a las extremidades inferiores.

Fig. 17: Linfangioma quístico. (a) y (b) Axiales SS FSE T2. (c) Sagital SS FSE T2. (d) Coronal FIESTA. Linfangioma quístico multiseptado en el mesenterio, omento mayor y región ileocecal, hiperintenso en T2 (flecha blanca). La lesión es independiente del riñón derecho (cabeza de flecha), desplaza las asas de intestino delgado al hemiabdomen izquierdo (flecha curva) e impronta la cúpula vesical (flecha quebrada). (e) 3D LAVA. El linfangioma presenta hipointensidad en T1 (flecha blanca) sin evidencia de sangrado e impronta la cúpula vesical (flecha quebrada). (f) 3D LAVA Reconstrucción MIP coronal. El colon transverso está desplazado en dirección craneal (flecha negra). EG: 33,3 s.
Quiste del ovario: es la masa abdominal femenina más frecuente en el tercer trimestre. Los ligamentos del ovario son laxos y puede estar en cualquier localización. Es posible que sea simple o complicado, con torsión y sangrado
Quiste del uraco: es un quiste unilocular en la línea media entre la vejiga y la inserción del cordón.
Quiste del colédoco: es un quiste unilocular en el cuadrante superior derecho. Pueden verse ductos biliares que entran en el quiste.
TUMORES
La RM permite la detección, localización y caracterización de las lesiones quísticas benignas, diferenciándolas de las asas intestinales (77,78).
La experiencia en RM en el diagnóstico de las masas hepáticas congénitas es muy limitada. La mayoría son masas grandes y sólidas (hemangioendotelioma, hepatoblastoma o metástasis de neuroblastoma), siendo menos frecuentes las lesiones quísticas (hamartoma mesenquimal) (79).
El nefroma mesoblástico es la masa renal sólida más común. Es un tumor benigno con pronóstico excelente que se acompaña, en un 70% de los casos, de polihidramnios(80). La RM delimita mejor su órgano-dependencia y se presenta como una masa sólida de señal uniforme, levemente hiperintensa en secuencias T2.
El neuroblastoma es el tumor maligno más frecuente en el periodo neonatal (81). La mayoría se origina en la médula adrenal y puede presentarse como masas suprarrenales sólidas, quísticas o sólido-quísticas (82). Las metástasis hepáticas son frecuentes (82). Se debe establecer el diagnóstico diferencial con la hemorragia suprarrenal (la RM identifica hemorragia en los diferentes estadios) (83), el secuestro pulmonar infradiafragmático (la RM puede mostrar el aporte sistémico vascular) (84) y los teratomas retroperitoneales (85) (Fig. 18).

Fig 18: Teratoma retroperitoneal. (a) y (b) Axial SS FSE T2. (c) y (d) Coronal SS FSE T2. (e) Sagital Fiesta. (f) Sagital Eco de gradiente T1. Masa en localización suprarrenal derecha quística con polos sólidos (flecha blanca), que cruza la línea media (cabeza de flecha) anterior a la aorta. La masa desplaza, en dirección inferior, el riñón derecho con horizontalización del mismo (flecha curva). EG: 35,5 s.
ESTUDIOS DE PATOLOGÍA VASCULAR
El uso de contraste intravenoso (gadolinio) no está aceptado. Los quelatos de gadolinio pasan la barrera placentaria (86) y existe riesgo potencial de nefrotoxicidad del gadolinio (fibrosis sistémica nefrogénica) (87).
Las secuencias balanceadas (FIESTA) permiten realizar estudios vasculares torácicos y abdominales sin contraste (88), sobre todo en los casos de secuestros intra o extralobares, anomalías del desarrollo de la vena cava inferior (Fig. 19) o de malformaciones vasculares como los shunt porto-sistémicos hepáticos (Fig. 20).

Fig. 19: (a) Coronal FIESTA.(b),(c), (d), (e) y (f) Axiales FIESTA. (1) Vena cava inferior supradiafragmática; (2) vena hepática media; (3) vena hepática izquierda; (4) aurícula derecha; (5) aorta torácica descendente; (6) vena ácigos; (7) aorta abdominal; (8) vena hemiácigos; (9) vena hepática derecha; (10) vena lumbar ascendente izquierda. Agenesia de vena cava inferior secundaria a trombosis, con circulación colateral por venas paravertebrales, venas lumbares ascendentes ácigos y hemiácigos. Pseudoquistes hemorrágicos suprarrenales bilaterales. Riñones con cortical engrosada (flechas blancas), sobre todo en riñón izquierdo. (g) Sagital SS FSE T2. Pseudoquiste hemorrágico suprarrenal izquierdo e hiperseñal en polo superior renal que sugiere infarto renal (flecha quebrada). (h) Imagen de difusión. Hiperseñal del riñón izquierdo que sugiere infarto probablemente venoso (cabeza de flecha blanca). EG: 36 s.

Fig. 20: Shunt porto-sistémico con aneurisma o lago venoso en feto de 30 semanas. (a), (b), (c), (d) y (e) RM. Axial FIESTA; (f) Sagital FIESTA. Cordón umbilical (flecha curva). Ausencia de conducto venoso, desembocando la vena umbilical (flecha negra) en la porta (cabeza de flecha) a la altura del hilio hepático. Lago o aneurisma venoso (flecha blanca) en el segmento VIII. Vena de drenaje anterior (1). Vena de drenaje posterior (2). Vaso que recoge la sangre de (1) y (2) y drena a vena cava inferior (3). Vena cava inferior (flecha quebrada). Vena hepática izquierda (cabeza de flecha negra).
CONCLUSIONES
La RM juega un papel importante como método complementario a la ecografía, dada su capacidad multiplanar y diferenciación tisular. Su indicación más importante es el estudio de la hernia diafragmática, donde la RM aporta información diagnóstica, establece un pronóstico y ayuda a planificar el parto y cirugía posterior. En la patología gastrointestinal es útil en el estudio de las obstrucciones, perforaciones y malrotaciones intestinales. En el estudio génito-urinario, la RM no presenta las limitaciones de la ecografía (oligoamnios u obesidad materna) y se utiliza en los estudios de agenesia renal, patología obstructiva y enfermedad quística renal. Además, permite caracterizar las lesiones quísticas congénitas. Las secuencias balanceadas proporcionan estudios angio-RM sin contraste intravenoso, útiles en la patología vascular congénita de grandes vasos y en secuestros pulmonares.
Agradecimientos
A Sergio García Fauró, Técnico en Radiodiágnóstico.
El autor y los colaboradores del trabajo declaran no tener ningún conflicto de intereses.
1. Shinmoto H, Kashima K, Yuasa Y, et al. MR imaging of non-CNS fetal abnormalities: a pictorial essay. RadioGraphics 2000; 20:1227-43. [ Links ]
2. Cannie M, Jani J, De Keyzer F, Roebben I, Dymarkowski S, Deprest J. Diffusion-weighted MRI in lungs of normal fetuses and those with congenital diaphragmatic hernia. Ultrasound Obstet Gynecol 2009; 34:678-86. [ Links ]
3. Chaumoitre K, Colavolpe N, Shojai R, Sarran A, D' Ercole C, Panuel M. Diffusion-weighted magnetic resonance imaging with apparent diffusion coefficient (ADC) determinatíon in normal and pathological fetal kidneys. Ultrasound Obstet Gynecol 2007; 29:22-31. [ Links ]
4. Levine D, Barnewolt CE, Mehta TS, Trop I, Estroff J, Wong G. Fetal thoracic abnormalities: MR imaging. Radiology 2003; 228:379-88. [ Links ]
5. Butler N, Claireaux AE Congenital diaphragmatic hernia as a cause of perinatal mortality Lancet 1962; 1:659-63. [ Links ]
6. Torfs CP, Curry CJ, Bateson TE, Honoré LH. A population-based study of congenital diaphragmatic hernia. Teratology 1992; 46:555-65. [ Links ]
7. Witters I, Legius E, Moerman R et al. Associated malformations and chromosomal anomalies in 42 cases of prenatally diagnosed diaphragmatic hernia. Am J Med Genet 2001; 103:278-82. [ Links ]
8. Skari H, Bjornland K, Haugen G, Egeland T, Emblem R. Congenital diaphragmatic hernia: a meta-analysis of martality factors. J Pediatr Surg 2000; 35:1187-97. [ Links ]
9. Jani J, Peralta CEA, Van Schoubroeck D, Deprest J, Nicolaides KH. Relation between lung-to-head ratio and lung volume in normal fetuses and fetuses with diaphragmatic hernia. Ultrasound Obstet Gynecol 2006; 27:545-50. [ Links ]
10. Jani J, Cannie M, Peralta CEA, Deprest J, Nicolaides KH, Dymarkowski S. Lung volumes in fetuses with congenital diaphragmatic hernia: comparison of 3D US and MR Imaging assessments. Radiology 2007; 244:575-82. [ Links ]
11. Rypens F, Metens T, Rocourt N, et al. Fetal lung volume: estimation at MR imaging-initial results. Radiology 2001; 219:236-41. [ Links ]
12. Coakley FV, Lopoo JB, Lu Y, et al. Normal and hypoplastic fetal lungs: volumetric assessment with prenatal single-shot rapid acquisition with relaxation enhancement MR imaging. Radiology 2000; 216:107-11. [ Links ]
13. Cannie M, Jani J, Van Kerkhove F, et al. Fetal body volume at MR imaging to quantify total fetal lung volume normal ranges. Radiology 2008; 247:197-203. [ Links ]
14. Paek BW, Coakley FV, Lu Y, et al. Congenital diaphragmatic hernia: prenatal evaluation with MR lung volumetry-preliminary experience. Radiology 2001; 220:63-7. [ Links ]
15. Kilian AK, Schaible T, Hofmann V, et al. Congenital diaphragmatic hernia: predictive valué of MRI relative lung-to-head ratio compared with MRI fetal lung volume and sonographic lung-to-head ratio. AJR Am J Roentgenol 2009; 192:153-8. [ Links ]
16. Osada H, Kaku K, Masuda K, Iitsuka Y, Seki K, Sekiya S. Quantitative and qualitative evaluations of fetal lung with MR imaging. Radiology 2004; 231:887-92. [ Links ]
17. Balassy C, Kasprian G, Brugger PC, et al. MRI investigation of normal fetal lung maturation using signal intensities on different imaging sequences. Eur Radiol 2007; 17:835-42. [ Links ]
18. Sedin G, Bogner P, Berényi E, Repa I, Nyúl Z, Sulyok E. Lung water and protón magnetic resonance relaxation in preterm and term rabbit pups: their relation to tissue hyaluronan. Pediatr Res 2000; 48:554-9. [ Links ]
19. Moore RJ, Strachan B, Tyler DJ, Baker PN, Gowland PA. In vivo diffusion measurements as an indication of fetal lung maturation using echo planar imaging at 0.5T. Magn Reson Med 2001; 45:247-53. [ Links ]
20. Manganaro L, Perrone A, Sassi S, et al. Diffusion-weighted MR imaging and apparent diffusion coefficient of the normal fetal lung: preliminary experience. Prenat Diagn 2008; 28:745-8. [ Links ]
21. Cannie M, Jani J, De Keyzer F, Roebben I, Dymarkowski S, Deprest J. Diffusion-weighted MRI in lungs of normal fetuses and those with congenital diaphragmatic hernia. Ultrasound Obstet Gynecol. 2009; 34:678-86. [ Links ]
22. Fenton BW, Lin CS, Seydel F, Macedonia C. Lecithin can be detected by volume-selected protón MR spectroscopy using a 1.5 T whole body scanner: a potentially non-invasive method for the prenatal assessment of fetal lung maturity Prenat Diagn 1998; 18:1263-6. [ Links ]
23. Fenton BW, Lin CS, Ascher S, Macedonia C. Magnetic resonance spectroscopy to detect lecithin in amniotic fluid and fetal lung. Obstet Gynecol 2000; 95:457-60. [ Links ]
24. Cannie MM, Jani JC, De Keyzer F, Allegaert K, Dymarkowski S, Deprest J. Evidence and patterns in lung response after fetal tracheal occlusion: clinical controlled study. Radiology 2009; 252:526-33. [ Links ]
25. Jani JC, Benachi A, Nicolaides KH, et al. Prenatal prediction of neonatal morbidity in survivors with congenital diaphragmatic hernia: a multicenter study. Ultrasound Obstet Gynecol 2009; 33:64-9. [ Links ]
26. Achiran R, Hegesh J, Yagel S. Fetal lung lesions: a spectrum of disease. New classification based on pathogenesis, two-dimensional and color Doppler ultrasound. Ultrasound Obstet Gynecol 2004; 24:107-14. [ Links ]
27. Achiran R, Zalel Y, Lipitz S, et al. Fetal lung dysplasia: clinical outcome based on a new classification system. Ultrasound Obstet Gynecol 24:127-33. [ Links ]
28. Stocker JT, Madewell JE, Drake RM. Congenital cystic adenomatoid malformation of the lung. Classification and morphologic spectrum. Hum Pathol 1977; 8:155-71. [ Links ]
29. Cavoretto P, Molina F, Poggi S, Davenport M, Nicolaides KH. Prenatal diagnosis and outcome of echogenic fetal lung lesions. Ultrasound Obstet Gynecol 2008; 32:769-83. [ Links ]
30. Quinn TM, Hubbard AM, Adzick NS. Prenatal magnetic resonance imaging enhances fetal diagnosis. J Pediatr Surg 1998, 33:553-8. [ Links ]
31. Liu YP, Chen CP, Shih SL, Chen YF, Yang ES, Chen SC. Fetal cystic lung lesions: evaluation with magnetic resonance imaging. Pediatr Pulmonol 2010; 45:592-600. [ Links ]
32. Rosado-de-Christenson ML, Stocker JT Congenital cystic adenomatoid malformation. RadioGraphics 1991; 11:865-86. [ Links ]
33. Grethel EJ, Wagner AJ, Clifton MS, et al. Fetal intervention for mass lesions and hydrops improves outcome: al5-year experience. J Pediatr Surg 2007; 42:117-23. [ Links ]
35. Vu L, Tsao KJ, Lee H, et al. Characteristics of congenital cystic adenomatoid malformations associated with nonimmune hydrops and outcome. J Pediatr Surg 2007; 42:1351-6. [ Links ]
36. Laberge JM, Puligandla R Flageóle H. Asymptomatic congenital lung malformations. Semin Pediatr Surg 2005; 14:16-33. [ Links ]
37. Savic B, Birtel FJ, Tholen W, Funke HD, Knoche R. Lung sequestration: report of seven cases and review of 540 published cases. Thorax 1979; 34:96-101. [ Links ]
38. Laje P, Martinez-Ferro M, Grisoni E, Dudgeon D. Intraabdominal pulmonary sequestration. A case series and review of the literature. J Pediatr Surg 2006; 41:1309-12. [ Links ]
39. Laurin S, Hägerstrand I. Intralobar bronchopulmonary sequestration in the newborn: a congenital malformation. Pediatr Radiol 1999; 29:174-8. [ Links ]
40. Winters WD, Effmann EL. Congenital masses of the lung: prenatal and postnatal imaging evaluation. J Thorac Imaging 2001; 16:196-206. [ Links ]
41. Zeidan S, Hery G, Lacroix F, et al. Intralobar sequestration associated with cystic adenomatoid malformation: diagnostic and thoracoscopic pitfalls. Surg Endose 2009; 23:1750-3 [ Links ]
42. Azizkhan RG, Crombleholme TM. Congenital cystic lung disease: contemporary antenatal and postnatal management. Pediatr Surg Int 2008; 24:643-57. [ Links ]
43. Takeda S, Miyoshi S, Minami M, Ohta M, Masaoka A, Matsuda H. Clinical spectrum of mediastinal cysts. Chest 2003; 124:125-32. [ Links ]
44. Levine D, Jennings R, Barnewolt C, Mehta T, Wilson J, Wong G. Progressive fetal bronchial obstruction caused by abronchogenic cyst diagnosed using prenatal MR imaging. AJR Am J Roentgenol 2001; 176:49-52. [ Links ]
45. Meizner I, Rosenak D. The vanishing fetal intrathoracic mass: consider an obstructing mucous plug. Utrasound Obstet Gynecol 1995; 5:275-7. [ Links ]
46. Nyberg DA, Mack LA. Abdominal wall defects. En: Nyberg DA, Mahony BS, Pretorius DH, eds. Diagnostic ultrasound of fetal anomalies. St. Louis: Mosby; 1990: 395. [ Links ]
47. Ledbetter DJ. Gastroschisis and omphalocele. Surg Clin North Am 2006; 86:249-60, vii. [ Links ]
48. Nyberg DA, Fitzsimmons J, Mack LA, et al. Chromosomal abnormalities in fetuses with omphalocele. Significance of omphalocele contents. J Ultrasound Med 1989; 8: 299-308. [ Links ]
49. De Vries PA. The pathogenesis of gastroschisis and omphalocele. J Pediatr Surg 1980; 15:245-51. [ Links ]
50. Louw JH, Barnard CN. Congenital intestinal atresia. Observations on its origin. Lancet 1955; 269:1065-7. [ Links ]
51. Kunz LH, Gilbert WM, Towner DR. Increased incidence of cardiac anomalies in pregnancies complicated by gastroschisis. Am J Obstet Gynecol 2005; 193:1248-52. [ Links ]
52. Eggink BH, Richardson CJ, Malloy MH, Ángel CA. Outcome of gastroschisis: a 20-year case review of infants with gastroschisis born in Galveston, Texas. J Pediatr Surg 2006; 41:1103-8. [ Links ]
53. Dumont RC, Rudolph CD. Development of gastrointestinal motility in the infant and child. Gastroenterol Clin North Am 1994; 23:655-71. [ Links ]
54. Nyberg DA, Neilsen IR. Abdomen and gastrointestinal tract. En: Nyberg NA, McGahan JP, Pretorius DH, Pilu G, eds. Diagnostic imaging of fetal anomalies. Philadelphia: Lippincott Williams & Wilkins; 2003:551-602. [ Links ]
55. Brugger PC. MRI of the fetal abdomen. En: Prayer D, ed. Fetal MRI. Verlag Berlin Heidelberg: Springer; 2011: 377-98. [ Links ]
56. Tongsong T, Wanapirak C, Sirichotiyakul S, Sirivatanapa P Prenatal sonographic markers of trisomy 21. J Med Assoc Thai 2001; 84:274-80. [ Links ]
57. Carcopino X, Chaumoitre K, Shojai R, Panuel M, Boubli L, DErcole C. Use of fetal magnetic resonance imaging in differentiating ileal atresia from meconium ileus. Ultrasound Obstet Gynecol 2006; 28:976-7. [ Links ]
58. Simonovsky V, Lisy J. Meconium pseudocyst secondary to ileal atresia complicated by volvulus: antenatal MR demonstration. Pediatr Radiol 2007; 37:305-9. [ Links ]
59. Garel C, Dreux S, Philippe-Chomette P, Vuillard E, Oury JE, Muller F. Contribution of fetal magnetic resonance imaging and amniotic fluid digestive enzyme assays to the evaluation of gastrointestinal tract abnormalities. Ultrasound Obstet Gynecol 2006; 28:282-91. [ Links ]
60. Carcopino X, Chaumoitre K, Shojai R, et al. Foetal magnetic resonance imaging and echogenic bowel. Prenat Diagn 2007; 27:272-8. [ Links ]
61. Hill BJ, Joe BN, Qayyum A, Yeh BM, Goldstein R, Coakley FV. Supplemental valué of MRI in fetal abdominal disease detected on prenatal sonography: preliminary experience. AJR Am J Roentgenol 2005; 184:993-8. [ Links ]
62. Ohgiya Y, Gokan T, Hamamizu K, Moritani T, Kushihashi T, Munechika H. Fast MRI in obstetric diagnoses. J Comput Assist Tomogr 2001; 25:190-20. [ Links ]
63. Sepulveda W, Romero R, Qureshi F, Greb AE, Cotton DB. Prenatal diagnosis of enterolithiasis: a sign of fetal large bowel obstruction. J Ultrasound Med 1994; 13:581-5. [ Links ]
64. Chaumoitre K, Colavolpe N, Shojai R, Sarran A, D'Ercole C, Panuel M. Diffusion-weighted magnetic resonance imaging with apparent diffusion coefficient (ADC) determination in normal and pathological fetal kidneys. Ultrasound Obstet Gynecol 2007; 29: 22-31. [ Links ]
65. Witzani L, Brugger PC, Hórmann M, Kasprian G, Csapone-Balassy C, Prayer D. Normal renal development investigated with fetal MRI. Eur J Radiol 2006; 57:294-302. [ Links ]
66. Fradin JM, Regan F, Rodriquez R, Moore R. Hydronephrosis in pregnancy: simultaneous depiction of fetal and maternal hydronephrosis by magnetic resonance urography Urology 1999; 53:825-7. [ Links ]
67. Guys JM, Borella F, Monfort G. Ureteropelvic junction obstructions: prenatal diagnosis and neonatal surgery in 47 cases. J Pediatr Surg 1988; 23:156-8. [ Links ]
68. Jeffrey RB, Laing FC, Wing VW, Hoddick W. Sonography of the fetal dúplex kidney Radiology 1984; 153:123-4. [ Links ]
69. Potter EL. Bilateral absence of ureters and kidneys: a report of 50 cases. Obstet Gynecol 1965; 25:3-12. [ Links ]
70. Mine K, Suzuki S, Watanabe S, et al. Prenatal diagnosis of autosomal recessive polycystic kidney disease. A case report. Nihon Ika Daigaku Zasshi 1999; 66:188-90. [ Links ]
71. Ohgiya Y, Gokan T, Hamamizu K, Moritani T, Kushihashi T, Munechika H. Fast MRI in obstetric diagnoses. J Comput Assist Tomogr 2001; 25:190-200. [ Links ]
72. Lee EH, Shim JY New sonographic finding for the prenatal diagnosis of bladder exstrophy: a case report. Ultrasound Obstet Gynecol 2003; 21:498-500. [ Links ]
73. Warne S, Chitty LS, Wilcox DT. Prenatal diagnosis of cloacal anomalies. BJU Int 2002; 89:78-81. [ Links ]
74. Gupta P, Kumar S, Sharma R, Gadodia A. Case report: Antenatal MRI diagnosis of cloacal dysgenesis syndrome. Indian J Radiol Imaging 2010; 20:143-6. [ Links ]
75. Campbell- Walsh. Urología. Tomo 4. Buenos Aires: Editorial Médica Panamericana; 2009: 3846-51. [ Links ]
76. Caire JT, Ramus RM, Magee KP, Fullington BK, Ewalt Dh, Twickler DM. MRI of fetal genitourinary anomalies. AJR Am J Roentgenol 2003; 181:1381-5. [ Links ]
77. Breysem L, Bosmans H, Dymarkowski S, et al. The valué of fast MR imaging as an adjunct to ultrasound in prenatal diagnosis. Eur Radiol 2003; 13:1538-48. [ Links ]
78. Shinmoto H, Kuribayashi S. MRI of fetal abdominal abnormalities. Abdom Imaging 2003; 28:877-86. [ Links ]
79. Brunelle F, Chaumont P Hepatic tumors in children: ultrasonic differentiation of malignant from benign lesions. Radiology 1984; 150:695-9. [ Links ]
80. Leclair MD, El-Ghoneimi A, Audry G, Ravasse P, Moscovici J, Heloury Y. French Pediatric Urology Study Group. The outcome of prenatally diagnosed renal tumors. J Urol 2005; 173:186-9. [ Links ]
81. Kesrouani A, Duchatel F, Seilanian M, Muray JM. Prenatal diagnosis of adrenal neuroblastoma by ultrasound: a report of two cases and review of the literature. Ultrasound Obstet Gynecol 1999; 13:446-9. [ Links ]
82. Toma P, Lucigrai G, Marzoli A, Lituania M. Prenatal diagnosis of metastatic adrenal neuroblastoma with sonography and MR imaging. AJR Am J Roentgenol 1994; 162:1183-4. [ Links ]
83. Trop I, Levine D. Hemorrhage during pregnancy: sonography and MR imaging. AJR Am J Roentgenol 2001; 176:607-15. [ Links ]
84. Plattner V, Haustein B, Llanas B, Allos N, Vergnes P, Héloury Y. Extralobar pulmonary sequestration with prenatal diagnosis. A report of 5 cases and review of the literature. Eur J Pediatr Surg 1995; 5:235-7. [ Links ]
85. Woodward PJ, Sohaey R, Kennedy A, Koeller KK. From the archives of the AFIP: a comprehensive review of fetal tumors with pathologic correlation. RadioGraphics 2005; 25:215-42. [ Links ]
86. Webb JA, Thomsen HS, Morcos SK. The use of iodinated and gadolinium contrast media during pregnancy and lactation. Eur Radiol 2005; 15:1234-40. [ Links ]
87. Grobner T, Prischl FC. Gadolinium and nephrogenic systemic fibrosis. Kidney Int 2007; 72:260-4. [ Links ]
88. Prayer D, Brugger PC. Investigation of normal organ development with fetal MRI. Eur Radiol 2007; 17: 2458-71. [ Links ]














