Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de radiología
versión On-line ISSN 1852-9992
Rev. argent. radiol. vol.76 no.1 Ciudad Autónoma de Buenos Aires mar. 2012
NEURORRADIOLOGÍA
Aporte de la Resonancia Magnética en el diagnóstico del Síndrome de Embolia Grasa Cerebral. Reporte de cuatros casos
Alberto Surur (1), Cayetano Galletti (2), Juan José Martín (3), Alberto Marangoni (1), Bartolomé Allende (4)
(1) Servicio de Radiología,
(2) Servicio de Terapia Intensiva,
(3) Servicio de Neurología,
(4) Servicio de Traumatología, Sanatorio Allende
Correspondencia: Dr. Alberto Surur - asurur@hotmail.com
Recibido : abril 2011; aceptado: septiembre 2011
Received: april 2011; accepted: september 2011
©SAR
Resumen
El síndrome de embolia grasa (SEG) es una entidad poco frecuente de difícil diagnóstico clínico y una causa importante de morbimortalidad en pacientes con politraumatismos. Es la manifestación clínica de la presencia de glóbulos grasos en la circulación sistémica y se caracteriza, fundamentalmente, por el desarrollo de insuficiencia respiratoria, síntomas neurológicos y exantema petequial. Se asocia principalmente con complicación de fracturas de huesos largos, aunque puede ser causada por otros tipos de patologías. El diagnóstico se ha basado clásicamente en los hallazgos clínicos. Por este motivo, presentamos cuatro casos donde la Resonancia Magnética (RM) de encéfalo tuvo un rol fundamental en el diagnóstico.
Palabras clave. Embolia grasa cerebral;Resonancia Magnética; Síndrome de embolia grasa; Trauma.
Abstract
Contribution of Magnetíc Resonance Imaging to the diagnosis of Cerebral Fat Embolism Syndrome. Report of four cases.
Fat Embolism Syndrome (FES) is an uncommon entity characterized by a difficult clinical diagnosis and high morbi-mortality in polytrauma patients. It is the clinical manifestation of the presence of fatty cells in the systemic circulation and it is mainly characterized by the development of respiratory failure, neurologic symptoms and petechial rash. Although it has been largely associated with long-bone fractures, it may be caused by other types of pathologies. Clinical findings have been classically used for the diagnosis. Therefore, we report on four cases where brain Magnetic Resonance Imaging (MRI) had a key role in the diagnosis.
Keywords. Cerebral fat embolism; Fat embolism syndrome; Magnetic Resonance Imaging; Trauma.
INTRODUCCIÓN
La embolia grasa (EG) fue descrita por primera vez por Zenker en 1861. Corresponde a la presencia de glóbulos grasos en la circulación pulmonar y periférica, mientras que el síndrome de embolia grasa (SEG) es la manifestación clínica de la embolia, caracterizada por insuficiencia respiratoria, trombocitopenia, síntomas neurológicos y petequias a nivel de la piel (1,2,3). Se sostiene que la EG se presenta en un 90% de las fracturas desplazadas de huesos largos y en procedimientos en los cuales existe manipulación ósea intramedular, mientras que el SEG o SEG cerebral (SEGC) tiene una incidencia que oscila entre el 0,5 y 3,5% de los casos (según diferentes autores) (2,4). Las manifestaciones neurológicas pueden ser sutiles y se producen después del desarrollo de la insuficiencia respiratoria, por lo que los síntomas más comunes, confusión y alteración del estado de conciencia (transitorio y reversible en la mayoría de los casos), pueden ser atribuidos a la hipoxemia, si no se tiene un alto índice de sospecha. También se han descrito hallazgos más evidentes, como convulsiones y signos neurológicos focales menos benignos. Tanto en un caso como en el otro, los métodos de diagnóstico por imágenes cerebrales pueden ser de gran ayuda en el diagnóstico, tratamiento y pronóstico del paciente.
Se presentan cuatro pacientes con SEGC, con lesiones cerebrales visibles en la RM, con el objetivo de describir y discutir los hallazgos encontrados en las imágenes de Tomografía Computada (TC) y Resonancia Magnética (RM).
MATERIALES Y MÉTODOS
Se incluyeron cuatro pacientes, asistidos en nuestra institución desde 2007 al 2010, con diagnóstico de fractura inestable de huesos largos y diagnóstico presuntivo de SEG.
Para el diagnóstico clínico presuntivo de SEG se utilizaron los criterios de Gurd (Cuadro 1) (1).
Cuadro 1: Criterios de Gurd.

A todos los pacientes se les realizó TC de encéfalo sin y con contraste iodado, con cortes de 5 mm en fosa posterior y 10 mm en región supratentorial, y RM, empleando secuencias Fast Spin Eco (FSE) T2, Fluid Attenuation Inversion Recovery (FLAIR), Gradiente de Eco (GRE) T2, Difusión (DWI), Spin Eco (SE) e Inversion Recovery (IR) T1 sin y con Gadolinio, con cortes de 5 mm, en los tres planos del espacio.
PRESENTACIÓN DE CASOS
Paciente de sexo masculino, de 24 años de edad, que ingresó a nuestro hospital con diagnóstico de fractura inestable tibio-peronea, secundaria a un accidente de tránsito. Al ingreso, el examen neurológico fue normal con una escala de Glasgow de 15. A las 48 horas, presentó desorientación témporo-espacial y depresión del estado de la conciencia hasta llegar al coma. Se le realizó una TC de cráneo con contraste, que no evidenció alteraciones, y se intervino quirúrgicamente con la finalidad de estabilizar la fractura. En los días sucesivos el paciente continúo en coma y agregó trombocitopenia y petequias hemorrágicas en la pared abdominal.
Se le realizó una ecocardiografía transesofágica, donde se descartó la existencia de un foramen oval permeable, y una RM de encéfalo, en la cual se evidenciaron, en la fosa posterior, lesiones hiperintensas en secuencias ponderadas en T2, ubicadas en la sustancia blanca de la protuberancia, en el pedúnculo cerebeloso medio y en el cerebelo, y asociadas a microhemorragias. A nivel supratentorial, las lesiones se localizaron preferentemente en la sustancia blanca profunda peri-ventricular y centros semiovales (Fig. 1).

Fig. 1: (a) y (b) RM GRE T2 en plano axial. Fosa posterior que muestra múltiples focos puntiformes hipointensos, sugestivos de microhemorragias (flechas). (c) RM FSE T2 en plano axial, que pone en evidencia lesiones hiperintensas confluentes a nivel de la sustancia blanca de ambas coronas radiadas (flechas).
Paciente de sexo femenino, de 26 años de edad, que ingresó por fractura inestable de pelvis y diafisaria femoral derecha, secundaria a accidente de tránsito, con hipotensión severa. Durante su traslado, había requerido el uso de drogas inotrópicas (Noradrenalina) y, como antecedente patológico, presentaba una comunicación interventricular (CIV). El examen neurológico inmediato reveló orientación en tiempo y espacio, con escala de Glasgow de 13.
Al ingreso, la TC de cráneo fue normal, pero a las 24 horas presentó un deterioro del estado de conciencia que progresó al coma. Se le realizó una RM de encéfalo, donde se evidenciaron múltiples lesiones hiperintensas en T2. En la fosa posterior, éstas predominaban en la sustancia blanca protuberancial y el pedúnculo cerebeloso medio; a nivel supratentorial, se ubicaban en los núcleos grises, cápsula interna y sustancia blanca periventricular, con afectación del cuerpo calloso y unión córtico-subcortical. Se encontró microhemorragia aislada en topografía subcortical frontal derecha (Fig. 2).

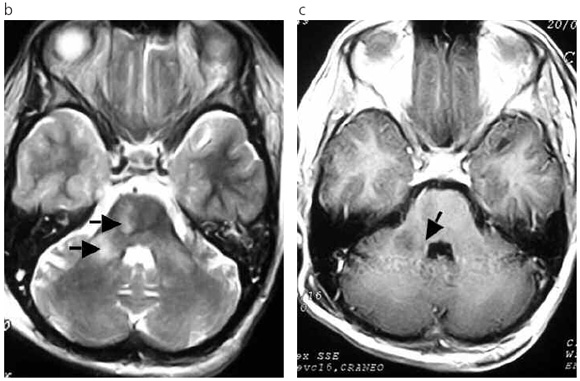
Fig 2: (a) Petequias hemorrágicas a nivel de la piel de la mama izquierda. (b) y (c) Secuencias FSE T2 y IR T1 con Gadolinio y DWI en el plano axial, que objetivan la presencia de lesiones a nivel de la sustancia blanca protuberancial y pedúnculos cerebelosos medios que se comportan hipointensas en T1, hiperintensas en T2 y no realzan con Gadolinio (flechas). Similares lesiones se observaron a nivel del cerebro (imágenes no incluidas).
Se estabilizaron quirúrgicamente las fracturas y pasó a UTI. En los días siguientes, la paciente continuó en coma y presentó distress respiratorio, petequias hemorrágicas en la piel de tronco y trombocitopenia. La ecocardiografía mostró CIV sin shunt de derecha a izquierda.
Paciente de sexo masculino, de 19 años de edad, que presentó fracturas diafisarias tibio-peronea y cubital derecha, secundarias a politraumatismo por accidente de tránsito. Ingresó orientado en tiempo y espacio (OTE), excitado, con escala de Glasgow de 13. La TC de cráneo, al ingreso, fue normal. Al día siguiente, la excitación continuó y se le realizó una RM donde se evidenciaron pocas microhemorragias (¿lesión axonal?) en el lóbulo frontal derecho. Se estabilizaron quirúrgicamente las fracturas, pero posteriormente, en sala de cuidados intensivos, el paciente presentó desorientación, deterioro del sensorio, hipoxemia con taquipnea, plaquetopenia y petequias en la piel del tórax y el abdomen. Se le realizó una nueva RM de encéfalo a las 72 h del ingreso, en la cual se observaron: lesiones en la fosa posterior, a nivel de la protuberancia, corteza y sustancia blanca cerebelosa; múltiples lesiones supra-tentoriales, ubicadas en la sustancia blanca periventricular y corona radiada bilateral y unas pocas, en la corteza cerebral y núcleos grises (Fig. 3). Se le realizó una eco Doppler transesofágica que no demostró comunicación interauricular (CIA) ni CIV.
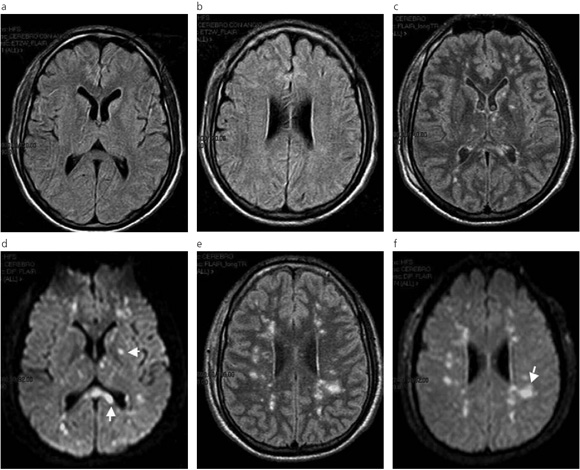
Fig. 3: (a) y (b) RM secuencia FLAIR, al ingreso del paciente en nuestra institución. No se observan lesiones. Estudio con artefactos de movimiento (paciente excitado con mínima sedación). (c), (d), (e), (f) Secuencias FLAIR y DWI. Muestran la distribución de las lesiones de diferentes tamaños, aspecto confluente y poco compromiso cortical (flechas) que predominan en la sustancia blanca profunda.
Caso 4
Paciente de sexo masculino con fractura de fémur, sin trauma craneal, con escala de Glasgow de 15 y OTE. A las 24 h del trauma, desarrolló un cuadro de desorientación progresiva, sopor y evolución al coma. Ingresó a nuestra institución 36 h después del trauma, con petequias en el tronco, sin distress respiratorio y sin plaquetopenia. Se le efectuó una RM de encéfalo, donde se constataron múltiples lesiones hiperintensas en secuencias ponderadas en T2, que no realzaron con Gadolinio y que estaban ubicadas en la sustancia blanca profunda supratentorial con algunas microhemorragias a nivel subcortical.
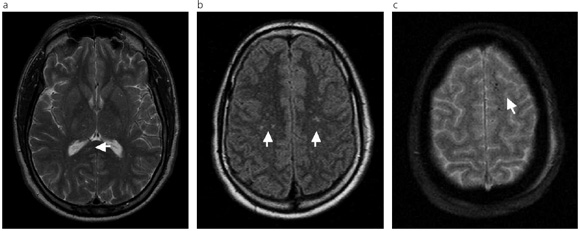
Fig. 4: (a) y (b) RM secuencias FSE T2 y FLAIR que muestran la distribución de pequeñas lesiones predominando en la sustancia blanca profunda (con afectación del esplenio del cuerpo calloso y sustancia blanca periventricular), sin evidenciarse compromiso cortical (flechas). (c) Presencia de microhemorragias subcorticales en la secuencia GRE T2.
DISCUSIÓN
El objetivo de este reporte es ilustrar acerca de los hallazgos en neuroimagen de esta patología poco frecuente en la práctica diaria (en los últimos tres años, recolectamos tan solo cuatro casos).
Cabe destacar que, en la mayoría de los casos, la TC suele ser negativa para el diagnóstico SEGC, pero nos permite descartar lesiones de origen traumático. Por eso, consideramos a la RM como el método de referencia para estudiar y demostrar la totalidad de las lesiones en el parénquima cerebral (5,6). Las secuencias FLAIR, DWI y GRE T2 son las de mayor utilidad, dada su alta sensibilidad. El FLAIR porque permite evaluar las lesiones periventriculares y yuxtacorticales gracias a la saturación del LCR y, además, porque demostró la misma cantidad de lesiones que la secuencia de DWI, pero con un mejor detalle anatómico. La secuencia de DWI es útil para diferenciar la isquemia del edema vasogénico, ya que ambas brillan en el FLAIR, y el GRE T2 permitió demostrar la presencia de microhemorragias. Con Gadolinio no tuvimos realces patológicos, sabiendo que está descrito el realce de las lesiones por rotura de la Barrera Hemato-Encefálica (BHE). Sin embargo, debemos mencionar que la RM fue realizada dentro de las 72 h de comenzados los síntomas y no se obtuvieron imágenes más tardías (4).
La etiología traumática fue la principal causa, aunque también están descritas etiologías no traumáticas, como quemaduras, osteomielitis, pancreatitis, diabetes mellitus, liposucción, hígado graso, nutrición parenteral o terapia prolongada corticoesteroidea (3,5).
En tres de los casos no se evidenció la existencia de un shunt de derecha a izquierda responsable del paso de los émbolos grasos a la circulación sistémica. En cuanto al mecanismo fisiopatológico del SEG, se describe que la EG puede alcanzar la circulación sistémica, ya sea por la persistencia de un shunt arterio-venoso o por un foramen oval permeable, o bien por los émbolos grasos atrapados en los capilares pulmonares (cuyo diámetro es inferior a las 7 µm) que pueden deformarse y atravesar el capilar pulmonar intacto, pasando de esta manera a la circulación sistémica con eventual embolización cerebral (2,4,7,8).
El mecanismo fisiopatológico de las lesiones de la EG es consecuencia de efectos físicos y químicos. Los físicos están determinados por la obstrucción que los émbolos grasos provocan a nivel de las arteriolas y los capilares, ya que esto origina cambios de origen isquémico, necrosis y hemorragia perivascular, con infartos que van desde los pocos milímetros hasta los cuatro centímetros. En lo que respecta a los cambios químicos, estos son secundarios a los efectos tóxicos de la liberación de ácidos grasos libres que desencadenan, a nivel local, una respuesta inflamatoria con liberación de mediadores químicos (prostaglandinas, leucotrienos y tromboxanos), tanto a nivel de las plaquetas como de las células lesionadas por la hipoxia, alterando la permeabilidad capilar, con rotura de la BHE y aparición del edema vasogénico. La teoría bioquímica de la lesión endotelial es la causa de las múltiples hemorragias petequiales, ya que los ácidos grasos libres poseen efecto citotóxico sobre las células endoteliales (3,4,9,10,11).
Con respecto a la evaluación de las lesiones encefálicas a través de las imágenes, la TC tiene un aporte muy limitado en esta patología y en un alto porcentaje de los casos es normal (7,1,2). Sin embargo, ciertos autores describen en algunos pacientes la presencia de edema cerebral y puntos hiperdensos secundarios a microhemorragias (2,4,5,13). También, se ha descrito en la TC el "signo de la arteria cerebral hipodensa", producido por un trombo "macroscópico" de grasa en la luz vascular (14). La utilidad de la TC está dada por su rapidez y sirve para descartar una patología traumática. En la actualidad, el método de elección es la RM por su mayor sensibilidad, aunque su realización es mucho más compleja que la TC en los pacientes traumatizados. Estos muchas veces requieren ventilación mecánica externa o, en caso de excitación, necesitan estabilización de parámetros clínicos previos o sedación a fin de evitar artefactos de movimiento (lo que obliga a emplear secuencias rápidas con disminución de la sensibilidad del método).
En estudios microscópicos, los émbolos grasos fueron localizados con mayor frecuencia a nivel de la sustancia gris, aunque predominaron las lesiones en la sustancia blanca (tal vez, por su mayor susceptibilidad a la isquemia y al menor desarrollo de circulación colateral) (2,3). Nuestros casos presentaron más lesiones profundas que corticales en RM. En la fosa posterior, las mismas predominaron en la sustancia blanca con afectación de pedúnculos cerebelosos medios, cerebelo y tronco cerebral. Mientras tanto, a nivel supratentorial, las lesiones fueron más frecuentes en la sustancia blanca profunda (centros semiovales, coronas radiadas), seguidas por lesiones en núcleos grises, corteza cerebral y cuerpo calloso, afectando múltiples territorios vasculares (lo que se conoce como patrón de "campo estrellado" -star-field pattern-) (712). En nuestros casos, tuvimos lesiones inflamatorias (edema vasogénico) y lesiones isquémicas (edema citotóxico). De acuerdo a los resultados en DWI, fueron en su mayoría de tipo "no confluentes", pero también se observaron algunas lesiones "confluentes" y pocas de ellas presentaron en la secuencia GRE T2 o T2* componente hemorrágico. Estos hallazgos evocan o sugieren que el SEGC representa una combinación de oclusión vascular, neurotoxicidad y aumento de la permeabilidad de la BHE(6,12,13,15).
La secuela de SEGC es la desmielinización de la sustancia blanca. En dos pacientes (casos 1 y 2), los controles posteriores mostraron una extensa desmielinización con cambios involutivos significativos de la masa encefálica.
Desde el punto de vista clínico, no existe un patrón patognomónico del SEG, por lo que se siguen utilizando los criterios de Gurd (1). En relación a la presentación clínica de esta entidad, existen tres formas de presentación: subclínica, no fulminante y fulminante. La manifestación subclínica respiratoria es secundaria al distress respiratorio, siendo el signo cardinal la hipoxemia. Como síntomas neurológicos, se presentan cefaleas, desorientación, somnolencia, estupor, agitación, hemiparesia, hemiplejía, crisis convulsivas y coma. Al examen hematológico, presentan plaquetopenia, glóbulos grasos en la sangre y petequias hemorrágicas. En la forma fulminante, los síntomas aparecen en las primeras 12 horas posteriores a la injuria, existiendo mayor compromiso neurológico (coma) y una embolización sistémica masiva, que lleva al colapso cardiovascular y respiratorio con una alta tasa de mortalidad. Las restantes formas de presentación más frecuentes siguen un curso más lento, con aparición de síntomas entre las 24 y 72 horas después de ocurrido el trauma y con un cuadro clínico variado que va desde la hipoxia leve y transitoria con un cuadro confusional hasta el distress respiratorio y coma (2,4). En nuestros casos, todos los pacientes se encontraban despiertos al ingresar al hospital, OTE y con una escala de Glasgow alta (entre 13 y 15 puntos). En cuanto a su evolución, todos presentaron la forma no fulminante. Como secuela neurológica, tuvieron una leve ataxia y déficit motor en los miembros inferiores, con excepción del 2º caso, en el cual la paciente no revirtió su estado neurológico y permaneció en un estado vegetativo persistente hasta su fallecimiento meses después.
Dado el antecedente traumático, estas lesiones en RM plantean diagnóstico diferencial con la lesión axonal difusa (12) y para un correcto diagnóstico debemos basarnos en dos pilares fundamentales: la clínica y la evaluación correcta de las imágenes. En relación al cuadro clínico, hay que tener presente que en la lesión axonal generalmente el paciente presenta un rápido deterioro de la conciencia con coma inmediato posterior al trauma (depende de la intensidad del trauma y del grado de injuria axonal), mientras que en la EG el deterioro del estado de conciencia aparece horas o días después del trauma y, además, no se acompaña de distress respiratorio, ni de plaquetopenia, ni de petequias hemorrágicas en el tronco. En las imágenes de RM, las lesiones axonales afectan, en particular, a la interfase sustancia gris-blanca, localizándose clásicamente en la sustancia blanca lobar subcortical (fibras en "U"), el cuerpo calloso y el margen dorsolateral del tronco, y respetan la corteza cerebral (a no ser que la lesión sea grande y, entonces, quede involucrada). Además, predominan las microhemorragias y se asocian frecuentemente a otras lesiones traumáticas primarias (por ejemplo, contusiones) (15). En cambio, en la EG cerebral, el paciente presenta generalmente un período de lucidez posterior al trauma y la RM muestra lesiones en la sustancia blanca profunda, en la fosa posterior y en la corteza cerebral, con márgenes mal definidos y una distribución anárquica. Las lesiones hemorrágicas son escasas.
CONCLUSIÓN
El SEGC es una patología muy poco frecuente. La RM juega un rol relevante en la confirmación de este síndrome, por lo que es importante conocer las características de las imágenes de las lesiones encefálicas y su distribución, para no confundirlas con otras patologías y poder realizar un diagnóstico correcto que ayude en la toma de decisiones, la evolución y el pronóstico del paciente con SEGC.
El autor y los colaboradores del trabajo declaran no tener ningún conflicto de intereses.
1. Gurd AR, Wilson RI. The fat embolism syndrome. J Bone Joint Surg Br 1974; 56:408-16. [ Links ]
2. Navarro T. Síndrome de embolia grasa cerebral. Cuadernos de Neurología, 1999; 23. Disponible en (Available at): http://escuela.med.puc.cl/publ/cuadernos/1999/Indice_99.html. Accedido (accessed): septiembre 25, 2011. [ Links ]
3. Lucena J, Salguero M, Rico A, et al. Embolia grasa como complicación de politraumatismo por precipitación autolítica. Cuad Med Forense 2005, 40:131-7. [ Links ]
4. Simon A, Ulmer J, Strottmann J. Contrast-Enhanced MR imaging of cerebral fat embolism: case report and review of the literature. AJNR Am J Neuroradiol 2003; 24:97-101. [ Links ]
5. Vummidi D, Kasthuri R, Bury R. Case of the month. A catastrophic complication. Br J Radiol 2006; 79:449-51. [ Links ]
6. Butteriss D, Mahad D, Soh C, Walls T, Weir D, Birchall D. Case report. Reversible cytotoxic cerebral edema in cerebral fat embolism AJNR Am J Neuroradiol 2006, 27:620-3. [ Links ]
7. Rughani A, Florman J, Seder D. Clinical and Radiographic Improvement Following Cerebral Fat Emboli. Nueurocrit Care 2011; 15:190-3. [ Links ]
8. Leiva Salinas C, Poyatos Ruipérez C, González Masegosa A, et al. Difusión por resonancia magnética en el diagnóstico precoz de la embolia grasa cerebral. Neurología 2008; 23:188-91. [ Links ]
9. Kim H, Lee JH, Lee CH, et al. Experimental cerebral fat embolism: embolic effects of triolein and oleic acid depicted by MR imaging and electron microscopy. AJNR Am J Neuroradiol 2002; 23:1516-23. [ Links ]
10. Hulman G. The pathogenesis of fat embolism. J Pathol 1995; 176:3-9. [ Links ]
11. Kim HJ, Lee CH, Kim HG, et al. Reversible MR changes in the cat brain alter cerebral fat embolism induced by triolein emulsion. AJNR 2004; 25: 958-63. [ Links ]
12. Parizel P, Demey H, Veeckmans G, et al. Early diagnosis of cerebral fat embolism syndrome by diffusion-weighted MRI (starfield pattern). Stroke 2001; 32:2942-4. [ Links ]
13. Kirkland L. Fat Embolism. E-medicine [revista electrónica]. Disponible en (Available at): http://emedicine.medscape.com. Accedido (accessed): agosto 4, 2009. [ Links ]
14. Lee TC, Bartlett ES, Fox AJ, Symons SP The hypodense artery sign. AJNR Am J Neuroradiol 2005 26:2027-9. [ Links ]
15. Gentry L. Traumatismo craneales. En: Atlas S, ed. RM de Cabeza y Columna. Madrid: Marbán; 2004: 1059-98. [ Links ]














