Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista argentina de radiología
On-line version ISSN 1852-9992
Rev. argent. radiol. vol.76 no.3 Ciudad Autónoma de Buenos Aires Jul./Sept. 2012
ABDOMEN
Enterotomografía en la enfermedad de Crohn
María Alejandra Lalanne, Mariana Kucharczyk, Analía Soledad Varela, Josefina Etchevers, Jorge Alberto Ocantos, Alberto Seehaus
Hospital Italiano de Buenos Aires. Juan D. Perón 4190 (C1181ACH)- Buenos Aires, Argentina.
Correspondencia: Dra. María Alejandra Lalanne - alejandralalanne@hotmail.com
Recibido: diciembre 2011; aceptado: junio 2012
Received: december 2011; accepted: june 2012
Resumen
Objetivos de aprendizaje. Definir el aporte de la enterotomografía (ETC) para el diagnóstico, control y pronóstico de la enfermedad de Crohn (EC) y detallar su forma de adquisición. Compararlo con otros métodos de diagnóstico utilizados para el estudio del intestino delgado y establecer sus ventajas y desventajas.
Revisión del tema. La EC es una enfermedad inflamatoria intestinal crónica, que afecta a todo el tubo digestivo de forma discontinua y transmural. Son objetivos a determinar el compromiso del intestino delgado, el diagnóstico de la etapa aguda de la enfermedad y su respuesta al tratamiento. El curso de la enfermedad, sus complicaciones (sangrado, obstrucción, estrangulamiento, abscesos y fístulas) y la severidad de los síntomas presentan una evolución variable. El diagnóstico inicial se basa en la combinación de la clínica, los hallazgos endoscópicos, bioquímicos y radiológicos.
Hallazgos en imágenes. Los hallazgos característicos de la enfermedad estudiada con ETC son: aumento del realce mural e imágenes ganglionares con realce luego del contraste E.V. (ambos signos de actividad), incremento del espesor parietal y signo del halo (anillo hipodenso por depósito graso en la submucosa), proliferación de la grasa mesentérica, prominencia de los vasos rectos, áreas de estenosis, fístulas y abscesos.
Conclusión. La ETC es un método accesible y fácil de emplear. Permite determinar la extensión y fase de progresión de la enfermedad, el compromiso extraintestinal y las eventuales complicaciones. La combinación de un tiempo corto de examen, una única respiración sostenida, la accesibilidad y disponibilidad del método le otorgan un rol importante en el diagnóstico y seguimiento de estos pacientes.
Palabras clave. Tomografía; Colonoscopía virtual; Ultrasonido; Doppler; Enfermedad de Crohn; Enfermedad inflamatoria intestinal.
Abstract
CT enterography in Crohn's disease.
Learning Objectives. To define the contribution of CT enterography (CTE) to the diagnosis, follow-up and prognosis of Crohn's disease, and to detail image acquisition. To compare CT enterography with other diagnostic methods used for the study of the small bowel, defining advantages and disadvantages.
Topic Review. Crohn's disease is a chronic inflammatory bowel disease that affects the entire gastrointestinal tract with a discontinuous and transmural compromise. The objectives are to determine small bowel involvement, diagnosis of active disease and its response to treatment. The course of disease, its complications (bleeding, obstruction, strangulation, abscesses and fistulas) and the severity of symptoms are variable. Initial diagnosis is based on a combination of clinical, endoscopic, biochemical and radiological findings.
Image Findings. The characteristic features in CTE are increased mural enhancement and enhanced lymph nodes after the administration of IV contrast (both signs of activity), wall thickening and halo sign (low attenuation ring in bowel due to deposit of submucosal fat), proliferation of mesenteric fat, prominence of the vasa recta, areas of stenosis, fistulas and abscesses.
Conclusion. CTE is readily available and easy to perform, being possible to determine the extent and stage of disease progression, extraintestinal involvement and potential complications. The combination of a short examination time, a single breath hold, accessibility and availability has made CTE an important tool in the diagnosis and follow-up of patients with Crohn's disease.
Keywords. Tomography; Virtual colonoscopy; Ultrasound; Doppler; Crohn's disease; Inflamatory bowel disease.
REVISIÓN DE TEMA
La enfermedad de Crohn (EC) es una enfermedad inflamatoria intestinal (EII) frecuente, que afecta a más de medio millón de pacientes en Norteamérica. En nuestro país, el número de casos se encuentra en aumento. Analizando la incidencia, las estadísticas sugieren que en los países más desarrollados, las personas de etnia caucásica y clase social alta sufren esta patología en mayor medida. Mientras en Estados Unidos se registran entre 7 y 13 casos cada 100 mil habitantes, en América Latina, con cifras menores, se presentan 0,5 casos cada 100 mil personas (1).
La prevalencia estimada de EII en Europa y Estados Unidos es aproximadamente de 100 a 300 por 100.000 para colitis ulcerosa (CU) y de 50 al 100 por 100.000 para EC. No hay registros nacionales de patología inflamatoria intestinal.
El servicio de Gastroenterología del Hospital Italiano de Buenos Aires (2) realizó en el 2009 un estudio retrospectivo y descriptivo de corte a partir de datos de sospecha clínica, confirmados por estudios complementarios, que fueron recopilados a través de la historia clínica electrónica. La prevalencia estimada de EII en la Argentina es menor a la anteriormente reportada en EE.UU. y norte de Europa y similar a la del sur de Europa y Puerto Rico. Sin embargo, recordemos que la muestra evaluada no es representativa del total, ya que se circunscribe a un pequeño porcentaje de los habitantes del país (Tabla 1).
Tabla 1: Prevalencia de pacientes con plan de salud de EII del Hospital Italiano de Buenos Aires (2).

La distribución etaria de la enfermedad tiene una presentación bimodal: el primer grupo tiene de 15 a 30 años, mientras que el segundo se presenta, tardíamente, entre los 60 y 80 años de edad.
La EC compromete únicamente al intestino delgado en un 30% de los casos y los síntomas clásicos incluyen dolor abdominal, diarrea y pérdida de peso.
Es una enfermedad de evolución crónica, con variaciones en su curso y severidad de los síntomas. Las complicaciones de esta entidad pueden implicar sangrado, obstrucción, estrangulamiento, abscesos y fístulas.
El diagnóstico inicial se basa en la combinación de la clínica, los hallazgos endoscópicos, bioquímicos y radiológicos (2).
Históricamente, la EC ha sido difícil de diagnosticar debido, en parte, a que sus síntomas son similares a los de otros trastornos intestinales, como la CU y el síndrome del intestino irritable. Sin embargo, el principal problema es la dificultad de estudiar el intestino delgado con los métodos tradicionales (3).
HALLAZGOS PATOLÓGICOS
Si bien la EC puede afectar a cualquier segmento del tracto digestivo o a una combinación de ellos, desde la boca hasta el ano, la más frecuente es la afectación del íleon terminal y el colon derecho. Cuando se afecta sólo el colon, el patrón -a diferencia de la CUes segmentario y frecuentemente respeta el recto (Tabla 2). No obstante, la enfermedad perianal es un dato prominente de la EC.
Tabla 2: Principales diferencias entre las enfermedades inflamatorias intestinales.

Los cambios histológicos consisten en una inflamación de las criptas, formando microabscesos de neutrófilos, con las consiguientes ulceraciones; pero, a diferencia de la CU, la inflamación es más profunda e invade la lámina propia por agregados linfoides y macrófagos, que producen una inflamación transmural inespecífica. En un 50% de los casos, estas modificaciones conducen a la formación de granulomas no caseificantes en cualquier capa de la pared, en el mesenterio o en los ganglios linfáticos (muy característicos de la enfermedad). La inflamación puede extenderse por todo el espesor de la pared, provocando fístulas. Es frecuente el depósito de colágeno, el cual puede contribuir a las estenosis.
El tamaño del intestino delgado en pacientes con EC es significativamente más corto que el del resto de la población. Además, estos pacientes tienen aumentada la permeabilidad intestinal y la presencia de anticuerpos.
Es característico de la enfermedad la existencia de granulomas no caseificantes. La mitad de ellos se encuentra adyacente a los vasos linfáticos, mientras que la secreción mucosa se ubica en los sitios de ulceración y son la consecuencia de las criptas ileales.
Las úlceras lineales en la EC generalmente presentan una orientación longitudinal predominante a lo largo del lado mesentérico. Los pequeños vasos que irrigan dicha región podrían generar isquemia, dando origen a las úlceras (4).
La forma de presentación clínica determina la evolución de la enfermedad y sus complicaciones. En la EC y CU, las características clínicas y demográficas son las que más se asocian al curso de la enfermedad. Éstas son la edad de diagnóstico, la localización y el hábito tabáquico. El diagnóstico a edad temprana se vincula a un curso más severo de ambas enfermedades. En la EC, la enfermedad proximal del intestino delgado y la localización en el tracto gastrointestinal superior están asociadas a recurrencia y cirugía. La enfermedad de intestino delgado con riesgo quirúrgico y la enfermedad colónica, particularmente la rectal, se encuentran asociadas a un incremento del riesgo de lesiones perianales. En la CU, la extensión de la colitis se asocia con un aumento del riesgo de cáncer colorrectal y colectomía(5).
La enfermedad inflamatoria intestinal es de origen multifactorial y presenta determinantes genéticos muy variados. En el 2001, Hugot y Omura (5), por separado, publicaron el descubrimiento del gen NOD2 dentro del locus IBD1 del cromosoma 16, como marcador de susceptibilidad para EC. A éste, posteriormente se le encontró un papel patogénico.
Más recientemente se han postulado, al menos, cuatro nuevos genes que también generarían susceptibilidad para EC: DLG5, SCL, MDR1, TLR (6). Varios factores de riesgo ambientales, como la dieta, el tabaquismo o el antecedente de apendicetomía, son los que contribuyen a su patogénesis (7).
En el año 2005 se introdujo el sistema de clasificación "The Montreal revision of the Vienna" (6). Con su uso, se demostró en un ensayo clínico, basado en un estudio de cohortes, que podía haber un cambio significativo en el tiempo de la enfermedad según su localización. El uso de inmunomoduladores, como tratamiento temprano y/o moduladores biológicos, justificó la disminución del riesgo de progresión de la enfermedad. Por lo tanto, resulta importante identificar tempranamente al grupo de pacientes en riesgo para realizar un diagnóstico precoz y una terapéutica oportuna.
En estos últimos años se comenzó a enfatizar en la determinación de la importancia de los factores predictivos, evaluándose -como elementos relevantes del curso de la enfermedad- los hallazgos endoscópicos y los biomarcadores. La progresión de la enfermedad se puede dividir en tres estadios, según su traducción en las imágenes: temprano, intermedio y avanzado.
HALLAZGOS EN IMÁGENES
Las técnicas convencionales para el diagnóstico de la EC en el intestino delgado han sido la endoscopia y el tránsito de bario, pero actualmente existen nuevos métodos para su evaluación. A continuación analizamos sus ventajas y desventajas.
Tránsito de intestino delgado
El tránsito se efectúa con contraste simple de bario. Se puede realizar con 400 a 600 ml de suspensión de sulfato de bario y radioscopia intermitente durante, aproximadamente, 20 ó 30 minutos hasta visualizar el íleon terminal.
A pesar de que el tránsito de intestino delgado puede diagnosticar efectivamente la enfermedad transmural, puede ser impreciso para determinar enfermedades leves, como aftas, úlceras u otro tipo de anormalidades mucosas (Fig. 1).
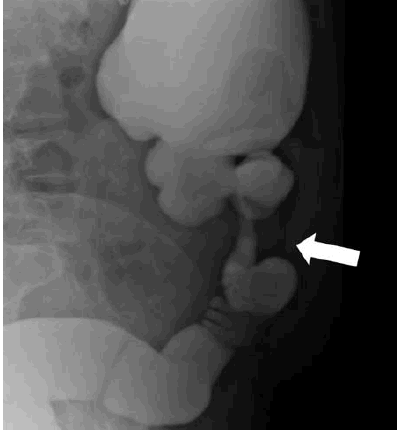
Fig. 1: Estudio contrastado donde se observa estrechamiento con dilatación preestenótica de la luz de las asas de colon, dando el clásico signo de la cuerda (flecha).
Cápsula endoscópica
Éste es un procedimiento no invasivo para evaluar el intestino delgado. La prueba se realiza con una cápsula, consistente en un dispositivo del tamaño de una pastilla grande. El endoscopio se compone de una fuente de luz potente, una pequeña cámara y un transmisor. Una vez ingerida la cápsula, ésta viaja a través del tracto digestivo, y se registran varias imágenes que se transmiten a una grabadora (3).
Con la cápsula endoscópica se pueden observar varios metros a lo largo del intestino delgado, permitiendo determinar alteraciones que están más allá del alcance de los procedimientos endoscópicos tradicionales. Además, la claridad de sus imágenes posibilita a los médicos detectar cambios no observados en otros métodos de diagnóstico.
En un estudio retrospectivo, se analizaron 733 exámenes consecutivos en 4 grandes centros de referencia (8). En 8,46% de los pacientes hubo limitaciones técnicas con recolección incompleta de los datos, dificultades por la corta duración de la batería de las cápsulas y fallas en la descarga de la información, que ocurrieron en la fase temprana del uso de la cápsula en un 8,6% de los exámenes. Las complicaciones clínicas prevenibles, como la dificultad para tragar la cápsula o la evaluación incompleta del intestino delgado, ocurrieron en el 16,4% de las evaluaciones, mientras que la retención de la cápsula con necesidad de cirugía o endoscopia se presentó en el 1,9% de los casos.
La cápsula endoscópica puede ser utilizada para el estudio de la EC en pacientes en los que existe una franca sospecha de esta enfermedad y hay una ausencia de alteraciones en la colonoscopia y el tránsito intestinal (a fin de evitar el atascamiento de la misma) (9).
Colonoscopía
Es un examen directo que evalúa el colon, incluyendo a veces la porción final del intestino delgado. Durante los procedimientos endoscópicos, el cirujano puede tomar biopsias y obtener el diagnóstico histopatológico. Su desventaja es que se presenta como un método invasivo e incapaz de diagnosticar lesiones extraluminales.
Entero-resonancia
La entero-resonancia (ERM) presenta varias ventajas con respecto a la enterotomografía (ETC) por ser un método que no incluye radiación ionizante y que utiliza como contraste el gadolinio (el cual, a diferencia del yodo, no genera reacciones alérgicas importantes). La mayor limitación de la ERM es su alto costo, la claustrofobia que genera, la mayor duración del estudio (dificultad de sostener la apnea) y su menor disponibilidad; mientras que la ETC es más accesible, barata y rápida (20 s) (2).
La ERM permite determinar las complicaciones extraluminales, su distribución y la actividad de la enfermedad, así como también la evaluación de sectores del intestino delgado proximal inaccesibles por colonoscopia (Fig. 2).
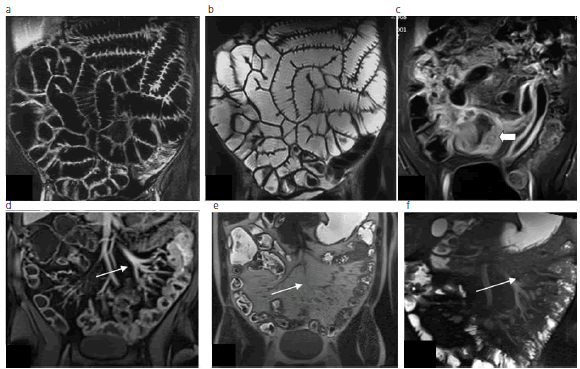
Fig. 2: (a) y (b) Se observan cortes coronales de ERM en secuencias T1 con contraste endovenoso (contraste oral negro) y secuencias T2 (contraste oral blanco), obtenidas con correcta distensión. (c), (d), (e) y (f) Las imágenes muestran un ejemplo de hallazgos patológicos por ERM. En (c) se observa engrosamiento de la pared de las asas de intestino delgado y compromiso de la grasa mesentérica, mientras que en (d), (e) y (f) se evidencia un engrosamiento mural circunferencial focal del colon y la presencia de adenopatías con ingurgitación vascular en el borde mesentérico (flechas).
Debido a su resolución espacial limitada, es dificultoso observar los cambios tempranos de la EC, como la nodularidad de la mucosa, el eritema y las ulceraciones aftosas superficiales. La distensión subóptima de las asas dificulta la evaluación del espesor parietal. Sin embargo, la ERM con enteroclisis permite una correcta distensión de las asas, pudiendo identificar, así, los signos tempranos de la enfermedad.
Los cambios típicos de la EC incluyen afectación ileal, proliferación del tejido adiposo, aumento del espesor parietal, úlceras lineales y aftoides, fistulización, lesiones salteadas y patrón en empedrado. Los hallazgos de la ERM asociados a la actividad de este proceso patológico comprenden engrosamiento mural mayor de 4 mm, edema intramural y mesentérico, hiperemia de la mucosa, realce mural, úlceras transmurales y formación de fístulas, ingurgitación vascular y nódulos linfáticos inflamatorios mesentéricos. El realce de estos últimos es el hallazgo más característico (10).
Las indicaciones de la RM incluyen recaídas, sospecha de enfermedad obstructiva, complicación extraluminal, fallo del tratamiento y planificación de resección quirúrgica. Tiene mayor sensibilidad en la detección de fístulas y permitiría identificar el tejido fibroso, debido a cambios inflamatorios crónicos de la patología aguda.
Nicholas Gourtsoyiannis et al. (11), por sus hallazgos, sugieren estudiar con ERM a los pacientes con enfermedad activa que presenten una falta de correlación entre las imágenes, la clínica y el laboratorio. De todos modos, estos datos deben ser interpretados cautelosamente, ya que se ha utilizado un grupo de estudio limitado. Los autores observaron que los pacientes con laboratorio normal presentaban en las imágenes de ERM cambios representativos de la enfermedad activa. Los parámetros que se utilizaron fueron: cambios en la intensidad de señal en las imágenes posgadolinio en T1, características de intensidad de señal y medida del espesor parietal en T2 pesado, y cambios perientéricos. Los hallazgos específicos indicadores de EC activa fueron la presencia de úlceras profundas, el aumento del espesor de la pared y los nódulos linfoides mesentéricos con realce.
Eco-Doppler
El estudio mediante ecografía Doppler de la EII y, en particular, de la EC tiene especial interés en la determinación de la actividad de la enfermedad, así como también en la respuesta al tratamiento, ya que esta técnica permite valorar la arteria mesentérica superior y la pared del intestino (12).
La EC se asocia a hipervascularización de la pared intestinal durante la enfermedad activa, lo cual se traduce en un aumento del flujo local y regional. De esta manera, la evaluación mediante Doppler color demuestra un aumento del flujo sanguíneo y de la velocidad media, asociado a una disminución del índice de resistencia (IR) en la arteria mesentérica superior (ésta se vincula a la actividad de la enfermedad). Algunos estudios han evaluado la diferencia de flujo, índice de pulsatilidad e IR antes y después de la ingesta, encontrando una diferencia significativa (13). Las mediciones de la arteria mesentérica superior pueden estar influenciadas por la edad, la presencia de arterioesclerosis y la longitud del segmento intestinal afectado. El conocimiento de la anatomía normal intestinal y los hallazgos patológicos, como veremos a continuación, deben ser evaluados junto con los datos obtenidos con el Doppler.
La exploración ecográfica se inicia con un transductor cónvex de 3 MHz. Éste logra una mayor profundidad y una visualización general, permitiéndonos ubicar rápidamente el área sospechosa de actividad; luego, mediante transductores lineales de mayor frecuencia (5 MHz), se obtiene una mejor caracterización de la imagen y se pueden distinguir las capas del intestino.
En el intestino delgado normal (Fig. 3) se identifican 5 capas que, de adentro hacia fuera, corresponden a: interface mucosa (hiperecogénica), mucosa profunda y muscularis mucosae (hipoecogénica), submucosa (hipercogénica), muscular propia (hipoecogénica) e interfase serosa (hiperecogénica). Una vez distinguido el segmento o los segmentos afectados, medido el espesor parietal e identificada la presencia de complicaciones (fístulas, colecciones, etc.) en el modo B, se inicia la evaluación Doppler del asa con el máximo engrosamiento parietal y con un seteo especial que nos permite evaluar el flujo lento. El sitio principal de asiento de la patología es la submucosa, la cual se ve hipoecogénica debido al edema, con pérdida de la estratificación y aumento del espesor de la pared del segmento intestinal afectado.
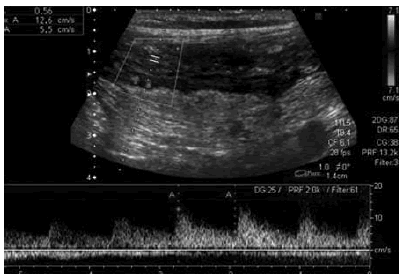
Fig. 3: Corte longitudinal de ecografía transabdominal (utilizando transductor de 10-5 MHz). Engrosamiento mural del asa con pérdida de estratificación y Doppler positivo.
Fraquelli et al. (14) demostraron en un metaanálisis que si se establecen como límite normal 3 mm de espesor parietal, la sensibilidad es del 88% y la especificidad del 93% para el diagnóstico presuntivo de EC a partir del engrosamiento mural; mientras que, elevando la línea de corte a 4 mm, los valores son del 75% y 97%, respectivamente. Así, se concluye que en el diagnóstico primario se debe utilizar una línea de corte de 4 mm por ser más representativa de la enfermedad activa.
El aumento del espesor parietal se asocia con la necesidad de procedimientos quirúrgicos y la recurrencia de la enfermedad, pero dicho hallazgo no es específico de la EC. El diagnóstico de certeza se realiza con la endoscopia y el estudio histológico. El cambio mencionado produce una reducción de la luz del asa afectada, generando áreas de estenosis y dilataciones del asa previa (15).
Enteroclisis
Este método, considerado el mejor en la evaluación por imágenes de la enfermedad de intestino delgado, fue superado por la técnica de la enteroclisis TC. Pese a no presentar una diferencia relevante en la caracterización de la mucosa y anormalidades de la pared, la enteroclisis TC aporta información importante en cuanto a la extensión extraintestinal (en particular, fístulas y abscesos). En un estudio comparativo se evaluó el hallazgo de lesiones salteadas (17 con enteroclisis TC vs. 3 con enteroclisis convencional) y el agrupamiento de asas (13 vs. 3, respectivamente) y se concluyó que la ETC presentaba una mayor precisión diagnóstica (16).
Reconocer precozmente estas dos complicaciones es importante para un tratamiento temprano. Los pacientes que desarrollan abscesos y agrupamiento de asas estranguladas enlazadas, así como también lesiones dispersas, necesitan tratamiento quirúrgico (Fig. 4).

Fig. 4: (a) Imágenes de enteroclisis donde se observa un patrón en empedrado por convergencia de úlceras lineales y fisuras transversales (flecha). (b) y (c) El cambio de calibre lleno simple nos muestra (b) el área de estenosis y (c) con doble contraste el patrón nodular de la mucosa.
En manos experimentadas, la enteroclisis es considerada un método superior al tránsito convencional (16), en tanto produce una mejor delimitación de las asas de delgado. No sólo ocasiona mejor distensión de las asas individualmente, sino que, además, el doble contraste permite detectar y separar correctamente al íleon distal.
La enteroclisis TC combina las ventajas y beneficios de ambas técnicas (enteroclisis y TC).
Enterotomografía computada
En varias instituciones, la ETC es la modalidad preferida de imágenes para la valoración de la extensión y severidad de la enfermedad de intestino delgado en pacientes con EII. Estudios recientes han demostrado la significativa correlación de la enfermedad activa con la elevación de proteína C reactiva y los hallazgos de ETC del realce mural, del espesor de la pared o de la densidad de la grasa mesentérica (Fig. 5) (19).
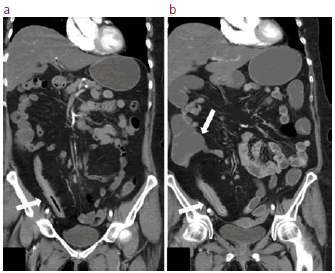
Fig. 5: Enfermedad activa en un paciente a través de los años. (a) Corte coronal de ETC que revela enfermedad activa de EC en íleon, con engrosamiento de la pared y realce en el borde mesentérico, adenomegalias y proliferación fibroadiposa, en el año 2009 durante un episodio agudo de dolor abdominal. (b) Dos años más tarde, se observa persistencia del engrosamiento mural, adenomegalias y aumento del diámetro del ciego.
DETALLES DEL PROCEDIMIENTO DE LA ETC
El paciente debe ingerir 1500 ml de contraste negativo: 500 ml se le administran 45 minutos antes de la adquisición, otros 500 ml en los 30 minutos previos y los últimos 500 ml, 15 minutos antes del examen. Al iniciar el estudio, se inyectan 150 ml de contraste no iónico IV, a un flujo de 3 ml/s, y la imagen se adquiere a los 40 segundos poscontraste. Se debe utilizar un tomógrafo multidetector y cortes de 2 mm con un espesor de 1 mm, 200 mA y 120 kVp. (17) Hay que realizar reconstrucciones en los 3 planos, siendo el más relevante el coronal (cada 3 mm de distancia).
En nuestra institución, los estudios se llevan a cabo en tomógrafos multislice de 64 y 16 pistas. Exceptuando algún inconveniente de disponibilidad, la mayoría se realiza en el primer equipo, con un promedio de 7 estudios por semana.
Como material de contraste oral negativo, se utiliza polietilenglicol y manitol. En caso de utilizar el primero, se deben administrar 750 ml, a ingerir en 40 minutos (un vaso cada 10 minutos), y los 750 ml restantes se toman en menos de 30 minutos (un vaso cada 5 minutos). Cuando se utiliza un contraste negativo como el manitol, se debe ingerir la jarra de 1500 ml entre los 30 y 40 minutos.
Se ubica al paciente en decúbito ventral para facilitar la distensión y redistribución de las asas, y se aplica Buscapina® por vía intramuscular para disminuir los espasmos del tubo digestivo. El contraste yodado se administra por vía endovenosa a un flujo de 3 ml/s con un volumen aproximado de 120 ml y se adquieren tres fases con contraste en tiempo arterial (a los 40 s) y una fase portal (a los 70 s de la administración del contraste). En caso de presentar una lesión no caracterizada en el parénquima hepático o alguna vinculada al sistema excretor (o en relación al mismo), se realiza una fase tardía: en el primer caso, a los 3 minutos y, en el segundo, después de los 10 minutos. Esto último permite evitar fases innecesarias que impliquen una mayor irradiación para el paciente.
DIAGNÓSTICO
El marcador imagenológico más sensible de la EC es, en primera instancia, la hiperdensidad mural seguida por el engrosamiento mural. Otros autores postulan que la combinación del engrosamiento mural (Fig. 6) y el aumento de la atenuación de la grasa perientérica (Fig. 7) son los signos más específicos de la EC activa (17).

Fig. 6: Diferencia en un mismo paciente del engrosamiento mural (a) en la fase activa y (b) dos años más tarde.

Fig. 7: Paciente con EC, dolor abdominal y diarrea, en el cual se observa el engrosamiento y realce de la pared en la topografía de la fosa ilíaca izquierda. (a) 2009 y (b) 2011: se muestran signos de actividad, como realce mural (flecha gruesa), ganglios que realzan con contraste y signo del peine (flecha fina). Estos son indicadores de EC activa.
La atenuación yeyunal es significativamente mayor que la ileal, cuando se examina la distensión del intestino delgado en la fase entérica de la ETC. Evaluar la atenuación del intestino delgado en pacientes con enfermedad activa es fundamental, ya que la hiperdensidad segmentaria mural en TC y RM es un indicativo de actividad inflamatoria (18).
Asimismo, para no sobrediagnosticar EC, resulta importante saber que los segmentos de asas colapsadas tienen mayor atenuación que las asas distendidas y que en el yeyuno tienen mayor densidad que el íleon.
El íleon terminal presenta una atenuación mayor en pacientes con EC activa que los que no la presentan. Voderholzher (17) encontró que la inflamación del íleon terminal en la EC mediante ETC tiene una sensibilidad del 67%, mientras que, con la cápsula endoscópica, tiene un 80%. En otro estudio reciente en el que se compararon la fase portal de la ETC, la cápsula endoscópica, el tránsito de intestino delgado y la ileoscopia para EC activa se reportó un sensibilidad de 82, 83, 65 y 74% respectivamente, demostrando que la ETC es más específica que la cápsula endoscópica (18).
Un engrosamiento mural mayor de 3 mm con un límite de corte relativo para la atenuación de 50% puede distinguir al íleon terminal normal del que presenta la EC activa (18).
HALLAZGOS TÍPICOS DE ETC EN EC
Los hallazgos tomográficos son: realce de la mucosa, vascularización mucosa, engrosamiento mural, alteración grasa, líquido libre adyacente al asa afectada, proliferación grasa, aire extraluminal, linfadenopatía y fístulas interasas (Figs. 8-17).

Fig. 8: (a) Esquema de corte transversal normal, con las capas del tubo digestivo a la izquierda y a la derecha un esquema que representa la reducción de la luz con estratificación a expensas del edema de la submucosa. (b) Corte transversal de ecografía transabdominal donde se observa un aumento del espesor parietal a expensas de la submucosa, con pérdida de la estratificación debido a un edema. (b), (c) y (d) Cortes axiales de TC con contraste donde se muestra el engrosamiento mural del asa, presentando la típica imagen en tiro al blanco. Signos: engrosamiento mural, reconocido por el espesor parietal mayor de 3 mm (la densidad de la pared intestinal debería ser igual a la densidad de los músculos intrapélvicos), pérdida de la estratificación (flechas blancas) y realce mucoso en el que se reconoce aumento de la captación de contraste de la capa interna (flecha hueca).
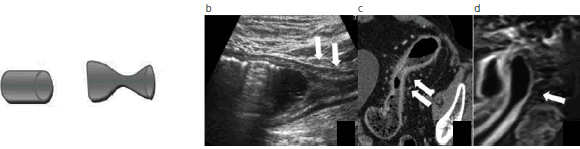
Fig. 9: Esquema representativo del calibre normal y estenosado. Cambios de calibre debido al edema de la submucosa, con zonas de dilatación alternadas con las áreas de estenosis. En las imágenes se señala con flechas las áreas de estenosis en (a) una ecografía transabdominal, (b) ETC y (c) ERM.
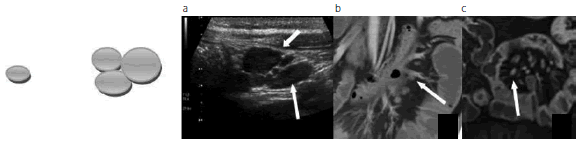
Fig. 10: Esquema representativo de ganglios de tamaño normal y de tamaño aumentado. (a) Ecografía. (b) y (c) ETC. Adenomegalias y conglomerados ganglionares (flechas) en relación con las asas correspondientes al drenaje linfático mesentérico.

Fig. 11: Esquema representativo de reemplazo de la estratificación mural. Signo del halo. (a) Por infiltración acuosa "halo acuoso", indicador del proceso inflamatorio agudo - subagudo. (b) Por infiltración grasa de la submucosa "halo adiposo", secuela del proceso inflamatorio crónico.
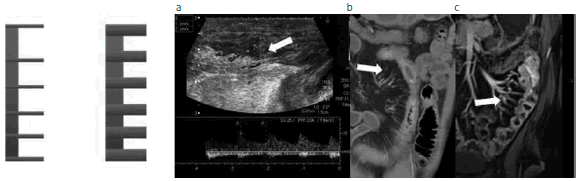
Fig. 12: Esquema representativo de los vasos rectos y los vasos aumentados de tamaño. Ingurgitación de la vasa recta de las asas digestivas. (a) Eco-Doppler, (b) ETC y (c) ERM, en los cuales se observa la hipervascularización a dicho nivel en la zona activa. En la ecografía Doppler se evidencia la enfermedad activa: aumento del espesor parietal con edema de la submucosa y pérdida de la estratificación parietal (flecha), hiperflujo parietal de baja resistencia, aumento de la ecogenicidad del tejido adiposo adyacente, signo del peine, aumento de calibre y mayor visualización de los vasos rectos en el borde mesentérico del asa (hallazgo compatible con enfermedad activa).
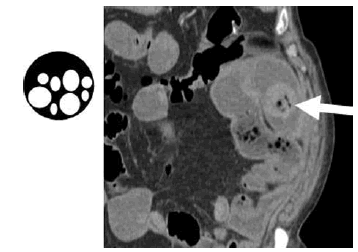
Fig. 13: Material sólido, heterogéneo y con burbujas en el intestino delgado (normalmente visible en colon). Su hallazgo en el intestino delgado es signo indirecto de enlentecimiento del tránsito intestinal (obstrucción). Signo de las heces.

Fig. 14: Esquema representativo y ejemplo. Líquido extraluminal interasas.
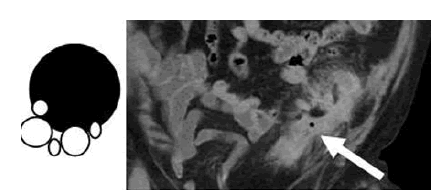
Fig. 15. Esquema representativo y ejemplo. El gas extraluminal se reconoce debido a su muy baja densidad por fuera de las asas de intestino delgado.


Fig. 16: (a) Esquema representativo de hiperdensidad e (b) hipodensidad. (a) Alteración grasa y aumento de la densidad de la grasa mensentérica. (b) Proliferación fibroadiposa y aumento del tejido adiposo del mesenterio que separa los vasos.

Fig. 17: Cortes axial y coronal de ETC donde se identifica una colección líquida de bordes definidos, en el contexto de un paciente con signos tomográficos y síntomas clínicos de reactivación de la enfermedad, compatibles con un absceso en la fosa ilíaca derecha.
Otro beneficio de la ETC es la habilidad para detectar complicaciones penetrantes de la EC y manifestaciones extraintestinales de la EII. La presencia de fístulas, abscesos o flemones puede determinar directamente una conducta o alertar para la planificación del tratamiento (Figs. 18 y 19). El hallazgo de manifestaciones extraintestinales (como nefrolitiasis, colelitiasis, sacroileitis, necrosis avascular, trombosis de venas profundas o colangitis esclerosante primaria) determina el cuidado del paciente, pese a no encontrar afectación luminal del intestino delgado, y explica la sintomatología no relacionada con la misma (17,19,20).

Fig. 18: (a) Corte axial de ETC donde se identifica solución de continuidad de la pared anterior del abdomen, la cual toma contacto con un asa a ese nivel (hallazgo compatible con fístula enterocutánea). (b) Corte coronal: prominencia de los vasos rectos y alteración de la grasa mesentérica adyacente. Se identifica disrupción de la mucosa con tractos lineales con contenido líquido, compatibles con trayectos fistulosos en el borde mesentérico de las asas descritas (compatible con fístula interasa) (flecha).
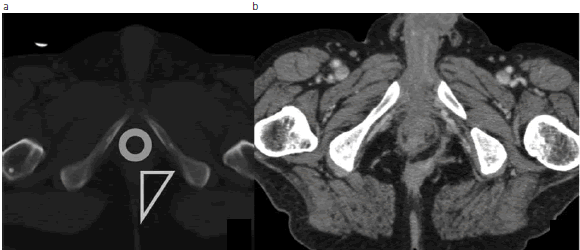
Fig. 19: (a) Cortes axiales de ETC a nivel perineal en los que se representa, mediante un círculo, el esfínter anal externo y, con un triángulo, la fosa isquioanal izquierda. (b) Se observa una colección con pequeños trayectos fistulosos asociados, ocupando la fosa isquiorrectal e isquioanal (EC fistulizante).
Se demostró una concordancia del 80% de los síntomas clínicos con respecto a las imágenes de la ETC, en cuanto a la progresión o regresión de la enfermedad, en un estudio retrospectivo en el cual se evaluaron 20 pacientes (21). En éste, se comparó la ETC con la cápsula endoscópica, ileoscopia y tránsito de intestino delgado en los mismos pacientes, sabiendo que tenían sospecha de EC. Los resultados que se encontraron fueron los siguientes: la ETC, la cápsula endoscópica y la ileoscopia tienen mayor capacidad de reconocer hallazgos de EC que el tránsito intestinal. La cápsula endoscópica tiene mejor capacidad diagnóstica para enfermedad proximal y lesión mucosa temprana (8), mientras que la ETC es el mejor método para detectar patología transmural y extraluminal (17). Tanto la cápsula como la ETC pueden detectar EC no obstructiva, cuando el tránsito o la ileoscopia son negativos o no concluyentes (22).
CONCLUSIÓN
La ETC es un método accesible y fácil de emplear. Permite determinar la extensión y fase de progresión de la enfermedad inflamatoria intestinal, las afectaciones extraintestinales y las eventuales complicaciones. La combinación de un tiempo corto de examen, una única respiración sostenida, la accesibilidad y disponibilidad del método le otorgan un rol importante en el diagnóstico y seguimiento de estos pacientes.
Sin embargo, no debemos olvidar que cada método aporta diferentes detalles de la enfermedad, por lo que son estudios complementarios entre sí. La confirmación por diferentes métodos aumenta la certeza del diagnóstico, cuando los hallazgos no son categóricos.
Agradecimientos
Al Dr. Juan Andrés De Paula, jefe del Servicio de Gastroenterología del Hospital Italiano de Buenos Aires.
1. Hara AK, Alam S, Heigh RI, Gurudu SR, Hentz JG, Leighton JA. Using CT enterography to monitor Crohn´s disease activity: a preliminary study. Am J Roentgenol AJR 2008; 190: 1512-6. [ Links ]
2. Sobrero MJ, Varela E, González ML, et al. M1155 Prevalence of inflammatory bowel disease in a University Hospital Health Maintenance Organization. Gastroenterology 2009; 136: a361-2. [ Links ]
3. Mayo Clinic staff. Crohn´s disease. Definition. Disponible en (Available at): http://www.mayoclinic.com/health/crohnsdisease/ DS00104. Accedido (Accessed): junio 29, 2011. [ Links ]
4. Skuca J. Advanced Imaging of the Abdomen. London: Springler; 2006137-6. [ Links ]
5. Lakatos PL, Kiss LS. Is the disease course predictable in inflammatory bowel diseases? World J Gastroenterol 2010; 16:2591-9. [ Links ]
6. Hugot JP, Chamaillard M, Zouali H, et al. Association of NOD2 leucine-rich repeat variants with susceptibility to Crohn's disease. Nature 2001; 411:599-603. [ Links ]
7. Kaplan GG, Jackson T, Sands BE, Frisch M, Andersson RE, Korzenik J. The risk of developing Crohn's disease after an appendectomy: a meta-analysis Crohn's disease and appendectomy. Am J Gastroenterol 2008; 103:2925-31. [ Links ]
8. Rondonotti E, Herrerias JM, Pennazio M, Caunedo A, Mascarenhas-Saraiva M, de Franchis R. Complications, limitations, and failures of capsule endoscopy: a review of 733 cases. Gastrointest Endosc 2005; 62:712-6. [ Links ]
9. Ferretti SE, Bonini C. Cápsula endoscópica en el estudio de la hemorragia digestiva. Anuario Fundación Dr. J. R. Villavicencio 2005; 13:23-6. [ Links ]
10. Tolan DJ, Greenhalgh R, Zealley IA, Halligan S, Taylor SA. MR enterographic manifestations of small bowel Crohn disease. RadioGraphics 2010; 30:367-84. [ Links ]
11. Gourtsoyiannis N, Papanikolaou N, Grammatikakis J, Papamastorakis G, Prassopoulos P, Roussomoustakaki M. Assessment of Crohn's disease activity in the small bowel with MR and conventional enteroclysis: preliminary results. Eur Radiol 2004; 14:1017-24. [ Links ]
12. Giovagnorio F, Diacinti D, Vernia P. Doppler sonography of the superior mesenteric artery in Crohn´s disease. AJR Am J Roentgenol 1998; 170:123-6. [ Links ]
13. Maconi G, Radice E, Bianchi Porro G. Crohn´s Disease. En: Baert AL, Knauth M, Sartor K, eds. Ultrasound of the Gastrointestinal Tract. Germany: Springer; 2007. [ Links ]
14. Fraquelli M, Colli DA, Casazza G, et al. Rol of US in detection of Crohn disease: meta-analisis. Radiology 2005; 236:95-101. [ Links ]
15. Gasche C, Moser G, Turetschek K, Schober E, Moeschl P, Oberhuber G. Transabdominal bowel sonography for the detection of intestinal complications in Crohn's disease. Gut 1999; 44:112-7. [ Links ]
16. Sailer J, Peloschek P, Schober E, et al. Diagnostic value of CT enteroclysis compared with conventional enteroclysis in patients with Crohn's disease. AJR Am J Roentgenol 2005; 185:1575-81. [ Links ]
17. Booya F, Fletcher JG, Huprich J, et al. Active Crohn disease: CT findings and interobserver agreement for enteric phase CT enterography. Radiology 2006; 241:787-95. [ Links ]
18. Baker ME, Walter J, Obuchowski NA, et al. Mural attenuation in normal small bowel and active inflammatory Crohn´s disease on CT enterography: location, absolute attenuation, relative attenuation, and the effect of wall thickness. AJR Am J Roentgenol 2009; 192:417-23. [ Links ]
19. Lee SS, Kim AY, Yang SK, et al. Crohn disease of the small bowel: comparison of CT enterography, MR enterography, and small-bowel follow-through as diagnostic techniques. Radiology 2009; 251:751-61. [ Links ]
20. Higgins PDR, Caoili E, Zimmermann M, et al. Computed tomographic enterography adds information to clinical management in small bowel Crohn´s disease. Inflamm Bowel Dis 2007; 13:262-8. [ Links ]
21. Bruining DH, Siddiki HA, Fletcher JG, Tremaine WJ, Sandborn WJ, Loftus EV Jr. Prevalence of penetraiting disease and extraintestinal manifestations of Crohn´s disease detected with CT enterography. Inflamm Bowel Dis 2008; 14:1701-6. [ Links ]
22. Hara AK, Leighton JA, Height RI, et al. Crohn disease of the small bowel: preliminary comparison among CT enterography, capsule endoscopy, small-bowel follow-trough, and ileoscopy. Radiology 2006; 238:128-34. [ Links ]














