Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de radiología
versión On-line ISSN 1852-9992
Rev. argent. radiol. vol.76 no.4 Ciudad Autónoma de Buenos Aires dic. 2012
VASCULAR
Malformaciones vasculares: claves diagnósticas para el radiólogo
Ricardo García Mónaco (1,2), Tamara Kreindel (1,2), Ana Giachetti (2, 3)
(1) Servicio de Diagnóstico por Imágenes,
(2) Clínica de Anomalías Vasculares,
(3) Sección Dermatología Infantil, Departamento de Pediatría Hospital Italiano de Buenos Aires, CABA, Argentina.
Correspondencia: Dr. Ricardo García Mónaco -ricardo.garciamonaco@hospitalitaliano.org.ar
Recibido: abril 2012; aceptado: junio 2012
Received: april 2012; accepted: june 2012
Resumen
Las malformaciones vasculares son enfermedades raras ocasionadas por errores en el desarrollo embriológico de los vasos sanguíneos. Estas lesiones, junto con los tumores vasculares, constituyen las anomalías vasculares. En el caso de las malformaciones vasculares, éstas se denominan de acuerdo al vaso que conforma la lesión y se clasifican según las características del flujo en malformaciones de bajo o alto flujo. Si bien la mayor parte son diagnosticadas según criterios clínicos, algunas lesiones requieren de estudios complementarios tanto para el establecimiento de un correcto diagnóstico como para la evaluación de su extensión. La ecografía Doppler suele ser el estudio inicial para conocer las características hemodinámicas y contribuir al diagnóstico diferencial entre un tumor y una malformación vascular. La resonancia magnética (RM) es el mejor método para evaluar la extensión de las lesiones y su relación con estructuras adyacentes. El diagnóstico preciso del tipo de malformación vascular es importante por su pronóstico y tratamiento diferentes. La Radiología Intervencionista constituye uno de los pilares fundamentales en el manejo terapéutico. Es altamente recomendable un abordaje multidisciplinario dada la complejidad de estas lesiones, particularmente en la elección de las opciones terapéuticas y en el seguimiento clínico de los pacientes.
Palabras clave. Angioma; Embolización; Malformación vascular; Resonancia magnética.
Abstract
Vascular malformations: diagnostic clues for the radiologist.
Vascular malformations are rare conditions resulting from the abnormal development of blood vessels. These lesions, together with vascular tumors, represent the vascular anomalies. Vascular malformations are named according to which type of vessel is affected and are classified into high- or low-flow malformations on the basis of flow characteristics. Most vascular malformations are diagnosed according to clinical criteria. However, some require imaging studies to confirm the diagnosis or assess its extension. Doppler ultrasound is the usual initial study for hemodynamic assessment and for its contribution to differential diagnosis between vascular tumors and malformations. Magnetic resonance imaging (MRI) is the best technique for evaluating the extent of the lesions and their relationship with adjacent structures. An accurate diagnosis of the type of vascular malformation is of importance because of the different prognosis and treatment. Interventional radiology is one of the cornerstones in the therapeutic management. A multidisciplinary approach is highly recommended given the complexity of these lesions, particularly for selecting therapeutic options and for the patient clinical follow-up.
Keywords. Angioma; Embolization; Vascular malformations; Magnetic resonance.
INTRODUCCIÓN
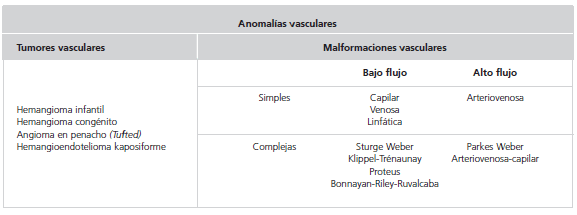
Las malformaciones vasculares (MV) constituyen un grupo de enfermedades poco frecuentes que afectan al 0,5% de la población. Forman parte del grupo nosológico denominado anomalías vasculares (1) y su diagnóstico correcto se ve dificultado por las confusiones generadas en la práctica médica por el uso de una terminología inadecuada. A pesar de que hace 30 años Mulliken y Glowacki aclararon esta problemática, suelen ser llamadas erróneamente angiomas. En 1982 estos autores propusieron una clasificación basada en criterios biológicos y de comportamiento clínico, que dividía las anomalías vasculares en tumores y malformaciones (2). Esta clasificación fue adoptada en 1996 por la International Society for the Study of Vascular Anomalies (ISSVA) y es la que se utiliza actualmente en la práctica médica(3) (Tabla 1).
Tabla 1: Clasificación de las anomalías vasculares según la International Society for the Study of Vascular Anomalies (ISSVA)(3).
El diagnóstico, la evolución, el pronóstico y la terapéutica son diferentes en estos dos grupos de enfermedades. Los tumores vasculares son consecuencia de una exagerada proliferación celular y, por lo general, no están presentes en el momento del nacimiento. Entre estos, el más frecuente es el hemangioma infantil, que aparece en las primeras semanas de vida y tiene una fase de crecimiento seguida de una fase de involución. Si bien existen otros tipos de tumores vasculares, su análisis excede el objetivo de esta comunicación (4).
Por su parte, las malformaciones vasculares son producto de una disembriogénesis y, a diferencia de los tumores vasculares, presentan un recambio endotelial normal (5). Están siempre presentes en el momento del nacimiento, crecen proporcionalmente con el paciente y nunca involucionan. Sin embargo, pueden no ser aparentes durante los primeros años de vida y detectarse a edades más tardías, especialmente durante la pubertad o el embarazo.
Las MV se denominan según el tipo de vaso predominante que las conforma (arterial, capilar, venosa, linfática, etc.) y, a su vez, se las puede agrupar de acuerdo a la velocidad de su flujo vascular (alto o bajo) (6).
El diagnóstico de estas patologías generalmente es clínico. Una correcta anamnesis y un examen físico adecuado que incluya observación, auscultación, palpación, eventuales modificaciones ante la maniobra del Valsalva y pesquisa de malformaciones asociadas son habitualmente suficientes para arribar al diagnóstico.
Los métodos imagenológicos son de importancia para confirmar el diagnóstico presuntivo, conocer la extensión y localización anatómica exacta, y colaborar con la decisión terapéutica y la evaluación de la respuesta al tratamiento. La Radiología Intervencionista cobra un importante rol en la terapéutica de las MV a través de la embolización y la esclerosis de las lesiones.
El objetivo de esta comunicación es comentar los elementos radiológicos, clínicos y terapéuticos de los diferentes tipos de MV que un médico radiólogo debe conocer para una práctica clínica adecuada.
MÉTODOS DE DIAGNÓSTICO POR IMÁGENES EN MALFORMACIONES VASCULARES
Los métodos más utilizados en la evaluación de las MV son la ecografía (con y sin Doppler color) y la resonancia magnética (RM). También la tomografía computada multidetector (TCMD), la radiografía simple (Rx) y la angiografía o flebografía por cateterismo tienen indicaciones en situaciones particulares.
La ecografía es el primer método a realizar ante la sospecha de una anomalía vascular. Esta técnica accesible y no irradiante permite distinguir el diagnóstico diferencial entre una lesión tumoral (sólida) o malformativa (sin masa tisular), y dentro de esta última si es de alto o bajo flujo. Hay que tener en cuenta que la ecografía sólo es de gran valor si es realizada por un médico entrenado en este tipo de patologías. Como desventajas de este método se mencionan su dificultad para evaluar la extensión de las lesiones en profundidad y la inaccesibilidad del ultrasonido a ciertos órganos profundos y estructuras óseas.
La RM es el mejor método de diagnóstico para evaluar las MV, ya que permite analizar las partes blandas y los elementos vasculares. A su vez, tiene una alta resolución anatómica y es de gran ayuda para establecer el diagnóstico definitivo de estas lesiones, además de resultar excelente para ubicarlas topográficamente y evaluar el compromiso de las estructuras adyacentes. Generalmente se realizan adquisiciones con y sin la inyección de gadolinio endovenoso y, de ser necesario, secuencias 3D en tiempo arterial y venoso de manera tal de poder realizar reconstrucciones a fin de obtener una angiografía por resonancia (ARM) (7). La desventaja de la RM es que en la mayoría de los niños menores de 5 años deben ser realizadas bajo anestesia general.
La TCMD con contraste yodado endovenoso, combinada con técnicas de reconstrucción MIP (Máxima Intensidad de Proyección), 2D y 3D angiográfica, brinda una excelente definición anatómica, reemplazando en muchos casos a la angiografía por cateterismo o a la flebografía convencional con fines diagnósticos o de mapeo preterapéutico. Además, es el método de elección para evaluar un eventual compromiso óseo de las malformaciones vasculares. Este estudio requiere radiaciones ionizantes, por lo que debe ser utilizado de forma criteriosa, sobre todo en la población pediátrica.
La Rx tiene cierta utilidad, ya sea para demostrar la presencia de flebolitos (típicos de las MV venosas) o para detectar cambios óseos secundarios a cualquier tipo de MV aislada o combinada, especialmente en la evaluación comparativa del crecimiento de las extremidades en el caso de malformaciones complejas.
La angiografía y/o flebografía por cateterismo prácticamente no tienen indicación como método diagnóstico en el momento actual, pero sí son de gran valor durante el acto terapéutico endovascular que suele realizarse en una misma sesión.
CARACTERÍSTICAS DE LOS DIFERENTES TIPOS DE MALFORMACIONES VASCULARES
1. Malformaciones vasculares de bajo flujo
Malformaciones vasculares venosas (MVV)
Las MVV son lesiones formadas por venas anómalas dismórficas, de aspecto sinusoidal o esponjoso, que mantienen diferentes grados de comunicación con las venas adyacentes. Ocasionalmente, las MVV están asociadas a venas displásicas o varicosas.
Existen tres subtipos de malformaciones venosas: esponjoso, cavitario y displásico (Fig. 1). El esponjoso es la forma más común y corresponde a una masa compuesta por múltiples canales venosos anómalos sinusoidales, que contienen sangre con flujo muy enlentecido y pobre conexión con las venas de drenaje habituales. Por su parte, el tipo cavitario está conformado por una masa vascular con cavidades sinusoidales de importante tamaño, mientras que el tipo displásico tiene la particularidad de estar formado por múltiples venas varicosas. Ocasionalmente estas lesiones venosas malformativas pueden combinarse (en particular, las de tipo cavitario y displásico) (8).
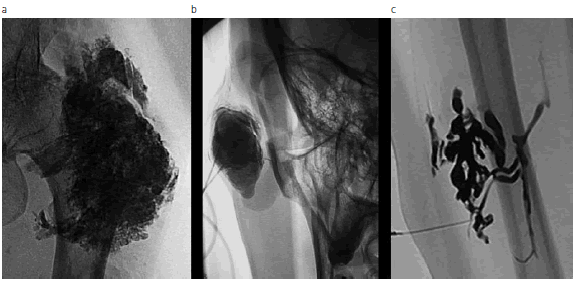
Fig. 1: Venografía por punción percutánea directa en tres pacientes con diferentes tipos de malformaciones venosas: (a) malformación venosa esponjosa en pelvis, (b) malformación venosa cavitaria en cara, (c) malformación venosa displásica en muslo.
La presentación clínica de las MVV es variable y depende de su profundidad y extensión. Desde el punto de vista semiológico, son tumoraciones azuladas, blandas, depresibles, de temperatura similar a la del resto de la piel, que aumentan de tamaño con la maniobra de Valsalva o con otras maniobras de hipertensión venosa (9). Pueden aparecer en cualquier localización, siendo las más frecuentes las extremidades, la cabeza y el cuello. Aunque generalmente suelen ser asintomáticas, en su evolución pueden producir complicaciones, como inflamación, dolor, compresión o invasión de estructuras adyacentes, hemorragias, coagulopatía localizada y/o deformidades cosméticas. En algunos casos, cuando comprometen la cavidad oral, son causa de trastornos funcionales del lenguaje o de la dentición, particularmente en los niños en desarrollo.
Las trombosis espontáneas en las MVV son muy frecuentes, producen dolor inflamatorio, en algunas ocasiones impotencia funcional y dejan como secuela lesiones induradas a la palpación y visibles en imágenes por la formación de calcificaciones llamadas flebolitos.
En el examen por ecografía Doppler (Fig. 2) las malformaciones vasculares venosas se presentan como una lesión compuesta por múltiples cavidades de contenido hipoecogénico o heterogéneo, generalmente compresible. En los casos de trombosis, el contenido de la lesión se presenta hiperecogénico y la compresión se vuelve dificultosa. La presencia de flebolitos confirma el diagnóstico de MVV. Estos se manifiestan como imágenes ecogénicas con sombra acústica posterior. El examen con Doppler muestra un contenido que presenta un flujo lento, con espectro venoso monofásico, en ocasiones imperceptible, pero que se hace evidente con las maniobras de compresión-descompresión o Valsalva. Es frecuente identificar venas vecinas dilatadas y tortuosas. El hallazgo de estructuras vasculares con flujo de alta resistencia corresponde a arterias normales dentro de la lesión (10).
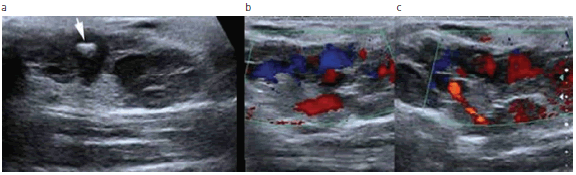
Fig. 2: Ecografía de partes blandas en un niño de 4 años. (a) Malformación venosa en antebrazo compresible hipoecogénica con flebolito (flecha) en su interior; (b) y (c) Doppler color muestra la vascularización de bajo flujo.
La radiografía simple puede ser normal o demostrar flebolitos. Estos aparecen como calcificaciones redondeadas dentro de la lesión malformativa.
La resonancia magnética (Fig. 3) es el método de elección en aquellos casos de diagnóstico dudoso o cuando se decide adoptar una conducta terapéutica, ya que confirma el diagnóstico y determina la exacta localización, extensión y el compromiso de las estructuras vecinas. El protocolo de estudio debe hacerse sin contraste con secuencias eco de espín ponderadas en T1 y secuencias con supresión de la señal de la grasa ponderadas en T2, y con contraste endovenoso con gadolinio en ponderación T1 con supresión de la señal de la grasa a fin de evaluar su vascularización (7).
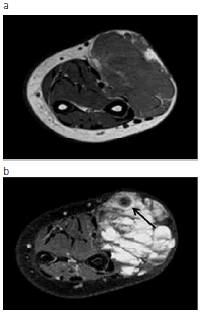
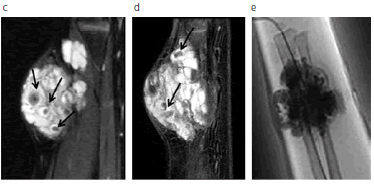
Fig. 3: RM de partes blandas (mismo paciente que la figura 2). (a) Secuencia en ponderación T1 plano axial; (b) y (c) secuencia con supresión grasa en ponderación T2 planos axial y coronal, respectivamente; (d) secuencia con supresión grasa en ponderación T1 con contraste coronal; (e) venografía directa por punción. Se observa la malformación venosa con múltiples septos, típicamente hipointensa en ponderación T1, hiperintensa en las demás secuencias y con flebolitos en su interior (flecha). Luego de la administración de gadolinio se aprecia realce intravascular típico. Obsérvese la correlación de la RM con la venografía directa.
La MVV se evidencia en la RM como una lesión focal o difusa, compuesta por cavidades separadas por finos tabiques, cuyo contenido se muestra hipo o isointenso en secuencias ponderadas en T1, pudiendo ser heterogéneo en los casos de hemorragia o trombosis. En secuencias ponderadas en T2, las MVV son hiperintensas y brindan una clara delimitación de la MVV con respecto a las estructuras adyacentes. Los flebolitos se detectan como imágenes redondeadas con ausencia de señal y la inyección de contraste endovenoso muestra realce lento y en tiempos tardíos. A diferencia de lo que ocurre en las malformaciones vasculares arteriales, en las MVV no se observan imágenes serpiginosas de vacío de flujo.
La angiografía por cateterismo no está indicada y suele ser normal o demostrar sinusoides, visibles en los tiempos venosos tardíos, que permanecen contrastados durante varios minutos. La venografía por punción percutánea de la MVV permite observar con claridad las conexiones intersinusoidales y sus eventuales comunicaciones con venas adyacentes normales o displásicas, pero sólo está indicada durante un acto terapéutico (Fig. 1).
El manejo de la mayoría de las MVV es conservador, pudiendo utilizarse bandas o medias compresivas en los casos de compromiso de las extremidades (1,7).
Las indicaciones para el tratamiento de estas lesiones son: presencia de dolor, compromiso articular, trastornos funcionales o cuando por su localización afectan la cosmética del paciente. En el pasado el tratamiento era la cirugía, pero sus resultados incompletos y muchas veces mutiladores para una enfermedad benigna han determinado su reemplazo por técnicas de Radiología Intervencionista. Éstas ofrecen excelentes resultados de forma poco invasiva.
La esclerosis percutánea realizada bajo estricto control radioscópico y funcional se considera actualmente el tratamiento de elección (11). Esta técnica consiste en inyectar etanol o algún derivado del mismo en los espacios sinusoidales malformados. Esto provoca una destrucción del endotelio y una trombosis de la malformación, cuya eventual reabsorción espontánea conduce habitualmente a la disminución del volumen y a una mejoría y/o desaparición de los síntomas (Fig. 4). En ocasiones y de acuerdo a la localización, se puede utilizar bleomicina como agente esclerosante para evitar algunos efectos adversos del tratamiento con etanol.
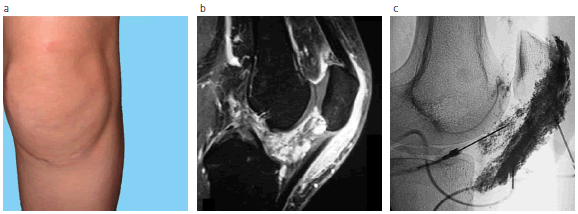
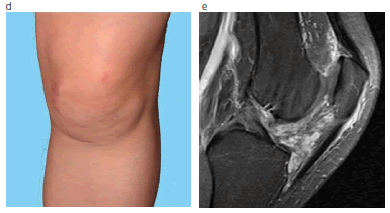
Fig. 4: Malformación venosa en una paciente adulta tratada con esclerosis percutánea. (a) Masa dolorosa en rodilla; (b) la RM muestra la malformación en las partes blandas de la región prerrotuliana e intraarticular; (c) inyección de etanol contrastado con lipiodol dentro de la malformación; (d) y (e) excelente resultado clínico y por RM a los 3 meses del tratamiento percutáneo. Compárese con (a) y (b).
Malformaciones vasculares linfáticas (MVL)
Las malformaciones linfáticas son consecuencia de una disembriogénesis del tejido vascular linfático. Se dividen según su aspecto macroscópico en macro y microquísticas, y pueden presentarse en forma aislada o combinarse con otras malformaciones vasculares (generalmente venosas o capilares). Históricamente se las ha denominado "higroma quístico" o "linfangiomas", pero son términos confusos que deben abandonarse.
Clínicamente, las MVL macroquísticas son grandes masas multilobuladas cubiertas por piel normal o levemente azulada, que pueden aumentar de tamaño por episodios traumáticos o infecciosos. Al examen físico son blandas, no compresibles y no cambian de tamaño con las maniobras de Valsalva o la compresión venosa (como lo hacen las MVV). Suelen localizarse en el cuello, la axila o ser maxilofaciales. Si bien en general son asintomáticas, en algunas ocasiones pueden sangrar o infectarse, provocando dolor y aumento del volumen de la lesión. Además, según su localización y tamaño, pueden causar otras complicaciones, como obstrucción de la vía aérea o dificultades en la alimentación o el habla.
Las lesiones microquísticas están compuestas por pequeñas vesículas de contenido linfático y zonas hiperqueratósicas que asientan en cualquier superficie mucosa o cutánea. Los síntomas más frecuentes son la linforrea, la tumefacción y el dolor asociado a fenómenos inflamatorios o sobreinfecciones. Cuando se localizan sobre mucosas, clínicamente se observan como placas o pequeñas vesículas.
En la ecografía (Fig. 5) las MVL macroquísticas aparecen como lesiones quísticas multiloculadas con contenido anecogénico y paredes finas. En algunos casos pueden observarse niveles líquido-líquido como consecuencia del sangrado dentro de las lesiones. El contenido de las MVL no muestra flujo al Doppler color. En el caso de las lesiones microquísticas, éstas se encuentran pobremente definidas y se muestran hiperecogénicas y con aspecto sólido debido a la alta densidad de tejido tisular otorgada por las paredes de los microquistes. El examen Doppler puede mostrar elementos vasculares arteriales o venosos dentro de los septos, pero nunca en el contenido de los mismos(4). La ecografía también es de utilidad para el diagnóstico prenatal, ya que algunas formas macroquísticas pueden ser bien visibles en la ecografía fetal.
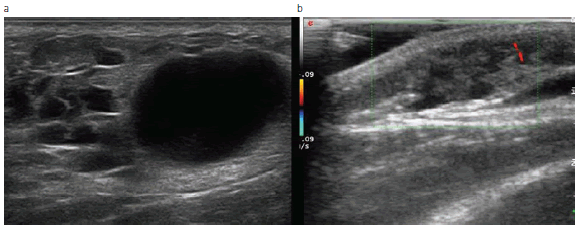
Fig. 5: Ecografía de una malformación linfática de las partes blandas en dos pacientes diferentes. (a) Malformación linfática macroquística y (b) malformación linfática microquística.
En la resonancia magnética (Fig. 6) las MVL macroquísticas se observan como una masa ocupante compuesta por estructuras saculares de paredes finas y con contenido líquido hiperintenso en secuencias ponderadas en T2 e hipointenso en secuencias ponderadas en T1. Éste no presenta refuerzo luego de la inyección de gadolinio, salvo a nivel de los septos (7). Es frecuente la presencia de niveles líquido-líquido con contenido hiperintenso en secuencias ponderadas en T1 como consecuencia del sangrado intralesional. En lo que respecta a las lesiones microquísticas, éstas se caracterizan también por ser hiperintensas en ponderación T2 y frecuentemente están asociadas a linfedema en la grasa subcutánea. Debido al predominio del componente tisular (paredes de los microquistes), este tipo de lesiones presenta un aspecto más sólido. Luego de la inyección de contraste endovenoso, se produce un refuerzo de los septos, pero no del contenido (7).
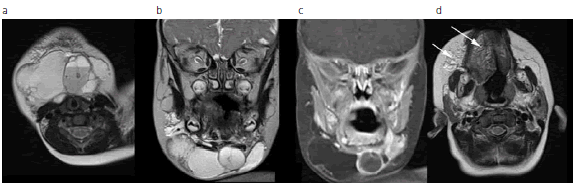
Fig. 6: Malformación linfática facial en un niño de 2 años. (a) Secuencia ponderada en T2 plano axial muestra MVL macroquística multiloculada con niveles líquidos correspondientes al contenido linfático y hemático; (b) secuencia ponderada en T2 plano coronal muestra los macroquistes con su contenido líquido; (c) secuencia ponderada en T1 con supresión grasa luego de la inyección de gadolinio muestra realce de los septos, pero no del contenido linfático, que se observa hipointenso. (d) Secuencia ponderada en T2 plano axial en otro plano muestra un componente microquístico (flechas) de la MVL que afecta la lengua y el tejido adiposo.
El tratamiento clásico de la MVL, particularmente en la forma macroquística, es la cirugía. Sin embargo, dado que requiere grandes resecciones y presenta frecuentes recidivas, actualmente el tratamiento quirúrgico tiende a ser reemplazado por técnicas de Radiología Intervencionista (12). La embolización esclerosante consiste en inyectar, bajo estricto control radioscópico, un material esclerosante en los espacios quísticos malformados para producir la destrucción del endotelio vascular de la MVL (de forma similar a lo expresado anteriormente en el tratamiento de las MVV). Los agentes esclerosantes que han sido utilizados por diferentes autores son numerosos: doxiciclina, OK 42, ethilbloc, alcohol y sus derivados, bleomicina, etc. Lo más importante a considerar es que la inyección del esclerosante, cualquiera sea, debe ser restringida exclusivamente a la MVL y por ello es fundamental la observación y el monitoreo en tiempo real en una institución con el equipamiento e instrumental adecuado y no en un consultorio ambulatorio.
Las MVL microquísticas son más difíciles de tratar (tanto por cirugía como por esclerosis percutánea), ya que son difusas y tienden a comprometer diferentes estructuras tisulares, limitando las posibilidades de una resección quirúrgica no mutilante o una esclerosis adecuada. Las MVL, como ya se ha comentado, pueden complicarse con una infección, produciendo dolor y aumento de volumen de la lesión. Este cuadro responde rápidamente al tratamiento antibiótico adecuado, el cual debe instituirse en forma urgente. De acuerdo a la localización, particularmente en el sector orbitario o en la cavidad oral, pueden aparecer trastornos maxilofaciales que deben ser prevenidos y corregidos con tratamientos de ortodoncia concomitantes para evitar una secuela funcional. El diagnóstico prenatal es importante, ya que en caso de una MVL cérvico-facial de gran tamaño se recomienda evitar el parto vaginal y programar una cesárea en un medio que cuente con un equipo de médicos expertos en el manejo de esta patología y que pueda intervenir rápidamente ante una eventual complicación respiratoria. Después del nacimiento, es fundamental asegurar la permeabilidad de la vía aérea recurriendo, en caso de ser necesario, a una punción aspiración del contenido líquido de la MVL. Con el paciente controlado, se programará el tratamiento definitivo para una etapa ulterior durante la infancia.
Malformaciones vasculares capilares (MVC)
Las MVC incluyen telangiectasias y las denominadas "manchas en vino de oporto", que frecuentemente se combinan con elementos venulares. A estas últimas, históricamente se las ha llamado "angiomas planos" por su descripción dermatológica, pero este término ha sido abandonado en la actualidad. Las MVC están compuestas por capilares ectáticos ubicados en la dermis, que aumentan de tamaño con la edad, haciendo que las lesiones se vean más oscuras y gruesas. Pueden ocupar grandes o muy pequeñas superficies de piel, ser únicas o múltiples y aparecer en cualquier localización anatómica (siendo la más frecuente la zona de la cabeza y el cuello) (1). Las MVC pueden ser combinadas con malformaciones arteriolares o venosas, adquiriendo el nombre de malformaciones arteriolo-capilares o capilaro-venosas, respectivamente (serán abordadas al final del capítulo al tratar las MV combinadas). Se ha descrito la asociación de una MVC localizada en la línea media lumbar o de la nuca con un lipoma o hemangioma y un disrafismo espinal oculto (13).
Las MVC no requieren tratamiento, salvo que ocasionen un trastorno estético que altere la calidad de vida del paciente. En estos casos el tratamiento de elección es el láser de luz pulsada, el cual debe hacerse bajo anestesia general cuando se realiza en niños.
No es necesario estudiar las MVC con exámenes de imágenes, excepto en aquellas localizaciones que puedan sugerir la existencia de otras anomalías asociadas como parte de síndromes que describiremos más adelante.
La ecografía y la resonancia magnética sólo demuestran un engrosamiento inespecífico de la dermis ocasionalmente extendido al tejido celular subcutáneo (14) y no tienen indicación en la práctica clínica habitual.
2. Malformaciones vasculares de alto flujo
Malformación arteriovenosa (MAV)
Son lesiones de flujo rápido compuestas por comunicaciones arteriovenosas (shunts AV) sin lecho capilar interpuesto. Habitualmente, las comunicaciones AV tienen un nido malformativo interpuesto, aunque en ocasiones pueden ser directas (fístulas AV).
Si bien el estigma malformativo está presente desde el nacimiento, solamente en el 60% de los casos son evidentes al nacer. Efectivamente las M AV suelen ser asintomáticas durante las primeras décadas de la vida, excepto en los raros casos que producen sobrecarga cardíaca en la infancia o que por su localización comprometen órganos profundos dando sintomatología funcional. Las MAV que comprometen las partes blandas, aun las asintomáticas, presentan evolución hemodinámica y, como tal, empeoran con el paso de los años.
Clínicamente suelen presentarse como una mácula rosada con o sin hipertrofia de las partes blandas. El examen físico muestra hipertermia localizada, pulsatilidad, frémito y soplo a la auscultación. Ocasionalmente pueden detectarse vasos tortuosos aumentados de tamaño y pulsátiles. Las MAV suelen aumentar de tamaño armónicamente con el crecimiento del paciente, pero pueden tener un rápido desarrollo precipitado por factores hormonales (pubertad, embarazo, hormonoterapia), traumatismo, infección o cirugía. En casos avanzados, la hipertensión venosa, consecuencia del rápido tránsito arteriovenoso, puede conducir a una isquemia tisular, acompañada de dolor, trastornos tróficos y úlceras (frecuentemente complicadas con severas hemorragias) (1).
La ecografía no tiene indicación en el estudio de las MAV, ya que demuestra los mismos signos que pueden detectarse en un buen examen semiológico. Efectivamente, el examen ecográfico de una MAV muestra una lesión poco definida, sin masa tisular visible, constituida por múltiples estructuras arteriales y venas dilatadas. El examen Doppler permite observar en las arterias aferentes un flujo de alta velocidad (superior a 1,5 m/s) con bajo índice de resistencia y en las venas eferentes un espectro con patrón de flujo "arterializado". Sólo está indicada en los raros casos en los que el diagnóstico diferencial con un hemangioma infantil no sea simple desde el punto de vista clínico. En estos pacientes se debe tener en cuenta que los hemangiomas, si bien pueden presentar algunas fístulas arteriovenosas, se identifican como masas tumorales con amplio contenido tisular y el espectro venoso no suele ser "arterializado" (10).
La resonancia magnética permite la evaluación de la extensión de la MAV. Se identifican como estructuras serpiginosas, correspondientes a arterias aferentes y venas de drenaje, con escaso componente tisular y ausencia de lagos venosos. Las imágenes de vacío de flujo en secuencias ponderadas en T1 y T2 son características de este tipo de lesiones. La inyección de gadolinio es de utilidad, ya que demuestra el realce de estructuras arteriales y venosas, permitiendo además realizar reconstrucciones angiográficas (ARM) (Fig. 7). La opacificación temprana de venas en una fase arterial confirma la existencia de shunts A V .
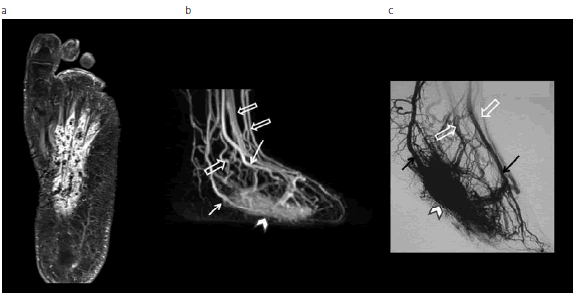
Fig. 7: Malformación arteriovenosa en la planta del pie. (a) RM en secuencia ponderada en T1 muestra hiperintensidad del nido malformativo con el típico aspecto serpiginoso con vacío de flujo en arterias y venas, ocasionado por las comunicaciones AV. (b) ARM muestra las arterias (flechas) y venas (flechas huecas) aumentadas de tamaño y el nido malformativo (cabeza de flecha) en la planta del pie. (c) Correlación con la angiografía por cateterismo.
La ARM permite una evaluación global de la MAV, pero no tiene la adecuada resolución para conocer los detalles específicos de la angioarquitectura malformativa, necesarios para establecer una estrategia y técnica terapéutica (7,8,10). Además, requiere ser complementada por una angio-TCMD o una angiografía por cateterismo.
La TCMD es un método de gran utilidad para evaluar las MAV en 3 dimensiones y determinar la relación con las estructuras adyacentes (incluyendo el eventual compromiso óseo). Requiere administración de contraste yodado endovenoso y adquisición en tiempo arterial para realizar las técnicas de angio-TCMD que demuestran los shunts AV y su angioarquitectura de mejor manera que la RM (Fig. 8).
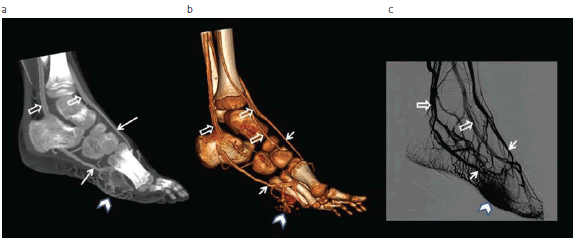
Fig. 8: Malformación arteriovenosa en la planta del pie en un niño de 4 años. (a) y (b) Angio-TCMD en 2D y 3D muestra el nido malformativo (cabeza de flecha) con las arterias aferentes (flechas) y las venas de drenaje (flechas huecas). (c) Correlación con la angiografía por cateterismo preembolización.
La angiografía por cateterismo selectivo tiene valor como estudio diagnóstico para conocer detalles de la angioarquitectura (distinguir el nido malformativo, las arterias y venas comprometidas, evaluar aneurismas asociados, estenosis venosas, angiopatía por hiperflujo, etc.) y puede contribuir a la estrategia y táctica terapéuticas. Es por ello que, en muchas ocasiones, debe realizarse a pesar de los estudios deangiografía no invasiva por RM y TCMD (particularmente cuando persisten dudas sobre detalles importantes en vistas al tratamiento).
Al igual que en otros tipos de MV, el tratamiento está indicado cuando la MAV es sintomática o afecta la funcionalidad de un órgano. En casos asintomáticos, el tratamiento debe instituirse sólo si puede asegurarse su completa y definitiva erradicación. El tratamiento debe ser planificado correctamente para evitar estímulos isquémicos que puedan empeorar la situación clínica y anatómica de la MAV en el futuro. De tal manera, es imperativo evitar la ligadura quirúrgica de las arterias aferentes, la embolización arterial proximal con coils (agentes embólicos compuestos por espirales mecánicos) o la introducción de stents-grafts. El tratamiento, en cambio, debe estar dirigido a la erradicación completa del nido de la MAV, ya sea por embolización (Fig. 9) o cirugía (en forma aislada o combinadas), cada vez que sea posible (15).

Fig. 9: Malformación arteriovenosa del pabellón auricular en un paciente adulto. (a) Angio TCMD; (b) angiografía selectiva de la arteria auricular posterior. Obsérvese el nido malformativo (cabeza de flecha), arteria aferente (flecha) y venas de drenaje (flechas huecas); (c) control angiográfico posembolización del nido con cianocrilato muestra exclusión completa de la MAV (asterisco); (d) control alejado con angio-TCMD confirma el resultado exitoso de la embolización (asterisco).
La embolización transarterial o por punción directa del nido de la MAV debe realizarse con un agente embólico permanente (cianocrilato, onyx o alcohol absoluto). No deben utilizarse agentes embólicos transitorios (como espongostan, microesferas o micropartículas), ya que la recanalización, la recidiva anatómica y el empeoramiento clínico son la regla con estos materiales. Por lo tanto, la embolización debe ser evaluada en la estrategia terapéutica global del paciente, con un objetivo determinado y relacionado con la sintomatología y angioarquitectura de la MAV y no como un simple acto de oclusión mecánica de un territorio vascular.
La embolización puede ser curativa por sí misma o combinada con cirugía, y en pacientes con MAV incurables puede utilizarse como tratamiento paliativo de control sintomático. Efectivamente, la embolización permite, en la mayoría de los pacientes con MAV incurables, controlar los síntomas hemorrágicos, el dolor, las alteraciones tróficas, etc.
El manejo clínico-terapéutico de los pacientes con MAV es complejo y requiere habitualmente un equipo interdisciplinario.
3. Malformaciones vasculares combinadas sindrómicas
Las MV pueden ser sindrómicas y asociarse a anomalías subyacentes o sistémicas. En estos síndromes pueden distinguirse diferentes tipos de MV combinadas, pudiendo también ser de alto o bajo flujo.
Síndrome de Sturge Weber
Es un síndrome cutáneo no hereditario, causado por una mutación somática, que consiste en la asociación de una malformación capilar facial unilateral con una MV leptomeníngea ipsilateral. En algunos casos puede asociarse también con una MVL facial y una MV coroidea con buftalmos y glaucoma (14).
El diagnóstico es clínico y existen diferentes expresiones fenotípicas, desde formas frustras a formas completas. La evaluación temprana con RM permite determinar la existencia y extensión del compromiso cerebral y ocular. Los niños afectados por este síndrome pueden, en ocasiones, presentar convulsiones, retraso madurativo o trastornos motores por isquemia venosa del sistema nervioso central. El examen oftalmológico para descartar glaucoma es imperativo en el momento del diagnóstico.
La resonancia magnética debe realizarse en el territorio cerebral con y sin inyección de gadolinio endovenoso. La misma puede ser normal o presentar realce leptomeníngeo, luego de la inyección de gadolinio. Las secuencias SWI (susceptibility weighted imaging) han demostrado gran sensibilidad para el diagnóstico de las hemorragias repetitivas crónicas en diferentes grados de evolución (16). En casos con compromiso neurológico importante es posible detectar cambios isquémicos, como atrofia cerebral, aumento de los espacios subaracnoideos y calcificaciones de la sustancia blanca córtico-subcortical (17).
La TCMD de cerebro con y sin contraste yodado endovenoso también puede demostrar, en casos de compromiso neurológico, los signos mencionados anteriormente. En general, tiene menor resolución anatómica que la RM, excepto para las calcificaciones intracerebrales, que son mejor identificadas con este método (Fig. 10).
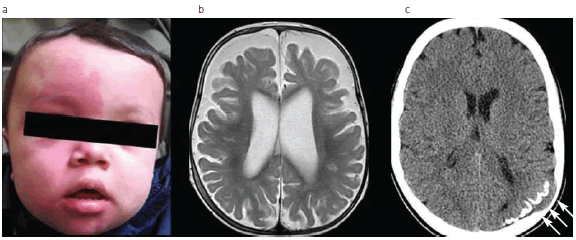
Fig. 10: Síndrome de Sturge Weber. (a) Facies con la típica malformación capilaro-venular en la hemicara derecha; (b) RM en secuencia ponderada en T2 muestra atrofia cerebral, manifestada por ensanchamiento de los ventrículos laterales y surcos de la convexidad; (c) TC sin contraste de otro paciente muestra calcificaciones en topografía típica (flechas).
Síndrome de Klippel-Trénaunay
Es una MV compleja de bajo flujo, manifestada por los componentes capilar, venoso y linfático en una extremidad y está asociada frecuentemente a la hipertrofia de la extremidad afectada (18). Esta patología asienta predominantemente a nivel de los miembros inferiores y menos frecuentemente a nivel de los miembros superiores y tronco. Las lesiones pueden extenderse hacia la pelvis y retroperitoneo.
Entre las malformaciones venosas se observa la persistencia de venas embrionarias (como la denominada vena marginal lateral o vena de Servelle) que se originan en la cara lateral del pie y discurren a lo largo de la extremidad, drenando en las venas hipogástricas y en la vena ciática. Es frecuente la presencia de venas varicosas y venas perforantes incompetentes secundarias a la hipertensión venosa (ocasionada por las anomalías del sistema venoso profundo). Las anomalías venosas profundas más frecuentes son la agenesia y/o hipoplasia venosa, la avalvulia u otros defectos valvulares (19).
Coexisten también las MVL microquísticas con linfedema y las MVC claramente visibles al examen semiológico. La hipertrofia de la extremidad compromete huesos y tejidos de partes blandas y provoca que el miembro afectado crezca tanto en longitud como en su circunferencia (Fig. 11). En general, en el momento del nacimiento el paciente presenta una extensa MVC y luego, durante los primeros meses de vida, se evidencian los demás componentes del síndrome. La expresión clínica es sumamente variable: desde ligeros cambios cosméticos asintomáticos a severas lesiones invalidantes. No hay ninguna indicación terapéutica en casos asintomáticos con alteraciones cosméticas menores.
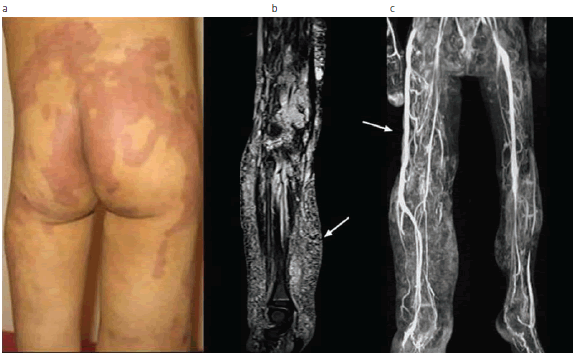
Fig. 11: Síndrome de Klippel-Trénaunay en un niño. (a) Malformaciones capilares en el dorso y ambos miembros e hipertrofia del miembro inferior derecho. (b) RM en secuencia con supresión de grasa muestra engrosamiento del tejido celular subcutáneo con múltiples malformaciones linfáticas microquísticas (flecha). (c) ARM demuestra la hipertrofia del miembro derecho, la existencia de venas anómalas, venas perforantes insuficientes y la vena de Servelle o marginal lateral (flecha).
La ecografía Doppler permite evaluar la permeabilidad del sistema venoso profundo y la incompetencia de las venas perforantes y, a su vez, detecta complicaciones como la trombosis venosa.
La radiografía simple resulta determinante para comparar las extremidades y consignar la hipertrofia ósea, mientras que la resonancia magnética es el mejor método para evaluar la extensión de la enfermedad, precisar la hipertrofia ósea y de partes blandas, y caracterizar anatómicamente la MV y sus diferentes componentes. La ARM permite identificar las anomalías venosas descritas y la vena marginal lateral de Servelle. En lo que respecta a la flexografía, ésta puede utilizarse para una evaluación intrínseca precisa de las anomalías venosas con el fin de analizar hemodinámicamente el flujo venoso del miembro afectado.
El tratamiento habitualmente es conservador con apoyo de bandas elásticas compresivas. Sólo ante la aparición de complicaciones o de una importante sintomatología del componente vascular venoso se indica un tratamiento endovascular. En algunos casos puntuales puede recurrirse a la cirugía de reducción de tamaño de la lesión o debulking.
Síndrome de Proteus
Es una rara enfermedad esporádica que afecta el hueso, tejido conectivo y tejido adiposo subcutáneo. Los síntomas aparecen durante el primer mes de vida. Se caracteriza por una combinación de malformaciones vasculares veno-linfáticas, hemihipertrofia, gigantismo de manos y pies, exostosis, macrocefalia, hamartomas viscerales y subcutáneos, lipomatosis intraabdominal y nevos epidérmicos (7,18). En las radiografías se observan las hiperostosis y distorsión de la arquitectura ósea normal. Las alteraciones del tejido adiposo incluyen hipertrofia o atrofia adiposa localizada y las anomalías vasculares comprenden a las MVC, MVL, várices y malformaciones complejas (similares a las halladas en el síndrome de Klippel-Trénaunay, pero de menor extensión). El nevo cerebriforme de la planta del pie es una lesión específica del síndrome de Proteus, pudiendo también encontrarse visceromegalias (especialmente espleno y nefromegalia) (18).
Síndrome Bonnayan-Riley-Ruvalcaba
Es una rara enfermedad autosómica dominante, de penetrancia variable, asociada a la mutación del gen homólogo de la fosfatasa tensina (PTEN) en el cromosoma 10 q. Se caracteriza por macrocefalia, retardo del desarrollo, papiledema, máculas pigmentadas en el pene, poliposis gastrointestinal, lipomas viscerales, tiroiditis y malformaciones capilares y combinadas. En el 10% de los casos pueden verse malformaciones vasculares de bajo flujo y malformaciones capilares, venosas y linfáticas.
Síndrome de Parkes Weber
Es una rara enfermedad compleja, que se caracteriza por la combinación de una MVC con MAV e hipertrofia de la extremidad (18). Existe una importante hipertensión venosa, pero, a diferencia del síndrome de Klippel-Trénaunay, está ocasionada por las fístulas AV y no por problemas venosos intrínsecos. Puede afectar miembros superiores o inferiores, aunque es más común la afectación de estos últimos. Al igual que otras MAV, los síntomas se manifiestan generalmente en la pubertad, pero otros factores, como los traumatismos y/o las cirugías del miembro afectado, pueden desencadenar su aparición. Los shunts AV son reconocidos semiológicamente y/o con imágenes (ecografía Doppler, TCMD, RM, etc.) como ya se explicitó al abordar las MAV esporádicas. El tratamiento es similar a cualquier otro tipo de MAV.
Hemorragia hereditaria telangiectásica (Enfermedad de Rendu Osler Weber)
Es una enfermedad autosómica dominante, con una prevalencia estimada en 1/5000 habitantes, que se manifiesta frecuentemente con telangiectasias mucocutáneas y/o MAV en sistema nervioso central o a nivel pulmonar (20). En ocasiones, otros órganos (cerebro, tubo digestivo, hígado, etc.) pueden afectarse con otras M V.
Al examen físico suelen observarse telangiectasias en pabellones auriculares, labios, lengua y/o extremidades digitales. La sintomatología más frecuente la constituyen los episodios de epistaxis reiteradas, ocasionalmente los sangrados digestivos y, sobre todo, los antecedentes familiares de síntomas semejantes.
Las MAV pulmonares afectan al 50% de los pacientes con esta enfermedad, pudiendo ser asintomáticas u ocasionar disnea o accidentes neurológicos por embolias paradojales. El diagnóstico es simple y rápido en pacientes con antecedentes familiares y, si es necesario, puede realizarse un examen sanguíneo que demuestre la mutación genética. La ecografía cardíaca con contraste aéreo endovenoso es el método corriente para el screening de shunts AV. La TCMD y la angio-TCMD son los métodos de elección para caracterizar las MAV pulmonares (en caso de un ecocardiograma positivo) y también para detectar aneurismas viscerales (Fig. 12). Si bien no hay consenso absoluto, es conveniente incluir en el algoritmo diagnóstico una RM cerebral para descartar shunts AV o secuelas de isquemia cerebral secundarias a embolias paradojales.
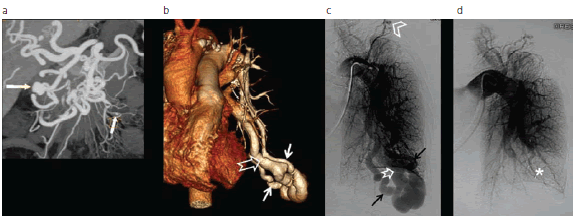
Fig. 12: Hemorragia hereditaria telangiectásica en un paciente adulto. (a) Angio-TCMD con reconstrucción 2D muestra oclusión ostial del tronco celíaco con hiperflujo en las arterias pancreático-duodenales y aneurismas (flechas) en la arteria pancreático-duodenal antero-inferior y en una rama yeyunal. (b) Angio-TCMD con reconstrucción 3D muestra una fístula arteriovenosa (FAV) pulmonar gigante con dos aferencias arteriales (flechas) y una gruesa vena de drenaje (flecha hueca). (c) Correlación con la angiografía por cateterismo donde se observa otra pequeña FAV (cabeza de flecha) con dos aferencias arteriales (flechas) y una gruesa vena de drenaje (flecha hueca). (d) Control angiográfico posembolización que muestra la exclusión de la FAV gigante (asterisco).
Las MAV pulmonares requieren tratamiento inmediato (aun en casos asintomáticos) por el riesgo de embolia paradojal. El tratamiento de elección es la embolización selectiva de la MAV por abordaje transfemoral percutáneo.
Ante la sospecha de la hemorragia hereditaria telangiectásica, es importante realizar un screening en el resto de la familia para determinar si son portadores de la enfermedad a través de la anamnesis y un examen físico o eventualmente con un examen sanguíneo genético.
CONCLUSIÓN
Las MV conforman un grupo heterogéneo que presenta diferentes aspectos clínicos, pronósticos y terapéuticos. El diagnóstico diferencial con los tumores vasculares y entre los diferentes tipos de MV es fundamental para establecer el pronóstico y correcto tratamiento (Fig. 13).
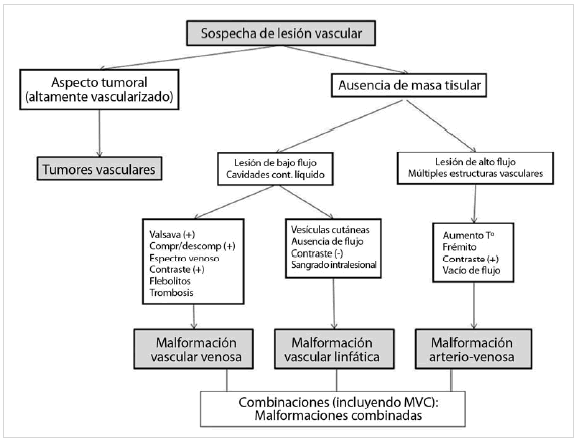
Fig. 13: Algoritmo diagnóstico ante la sospecha de una anomalía vascular.
Los exámenes por imágenes y la Radiología Intervencionista juegan un importante rol en el diagnóstico y tratamiento de estas patologías. El médico radiólogo debe tener en cuenta los aspectos clínicos y estar familiarizado con los hallazgos radiológicos, a fin de establecer el diagnóstico adecuado utilizando una correcta nomenclatura.
Agradecimientos
Al Dr. Oscar Peralta por su colaboración en la preparación editorial de las ilustraciones de este artículo de revisión.
1. Garzon MC, Huang JT, Enjolras O, Frieden IJ. Vascular malformations: Part I. J Am Acad Dermatol 2007; 56:353-70; quiz 371-4. [ Links ]
2. Mulliken JB, Glowacki J. Classification of pediatric vascular lesions. Plast Reconstr Surg 1982; 70:120-1. [ Links ]
3. Mulliken JB, Fishman SJ, Burrows PE. Vascular anomalies. Curr Probl Surg 2000; 37:517-84. [ Links ]
4. Wassef M, Vanwijck R, Clapuyt L, Boon L, Magalon G. Vascular tumours and malformations, classification, pathology and imaging. Ann Chir Plast Esthet 2006; 51:263-81. [ Links ]
5. Boon LM, Ballieux F, Vikkula M. Pathogenesis of vascular anomalies. Clin Plast Surg 2011; 38:7-19. [ Links ]
6. Enjolras O, Soupre V, Picard A. Classification of superficial vascular anomalies. Presse Med 2010; 39:457-64. [ Links ]
7. Dubois J, Alison M. Vascular anomalies: what a radiologist needs to know. Pediatr Radiol 2010; 40:895-905. [ Links ]
8. Arnold R, Chaudry G. Diagnostic imaging of vascular anomalies. Clin Plast Surg 2011; 38:21-9. [ Links ]
9. Casanova D, Boon LM, Vikkula M. Venous malformations: clinical characteristics and differential diagnosis. Ann Chir Plast Esthet 2006; 51:373-87. [ Links ]
10. Ernemann U, Kramer U, Miller S, et al. Current concepts in the classification, diagnosis and treatment of vascular anomalies. Eur J Radiol 2010; 75:2-11. [ Links ]
11. Greene AK, Alomari AI. Management of venous malformations. Clin Plast Surg 2011; 38:83-93. [ Links ]
12. Greene AK, Perlyn CA, Alomari AI. Management of lymphatic malformations. Clin Plast Surg 2011; 38:75-82. [ Links ]
13. Enjolras O, Boukobza M, Jdid R. Cervical occult spinal dysraphism: MRI findings and the value of a vascular birth-mark. Pediatr Dermatol 1995; 12:256-9. [ Links ]
14. Garzon MC, Huang JT, Enjolras O, Frieden IJ. Vascular malformations. Part II: associated syndromes. J Am Acad Dermatol 2007; 56:541-64. [ Links ]
15. Greene AK, Orbach DB. Management of arteriovenous malformations. Clin Plast Surg 2011; 38:95-106. [ Links ]
16. Tong KA, Ashwal S, Obenaus A, Nickerson JP, Kido D, Haacke EM. Susceptibility-weighted MR imaging: a review of clinical applications in children. AJNR Am J Neuroradiol 2008; 29:9-17 [ Links ]
17. Adams ME, Aylett SE, Squier W, Chong W. A spectrum of unusual neuroimaging findings in patients with suspected Sturge-Weber syndrome. AJNR Am J Neuroradiol 2009; 30:276-81. [ Links ]
18. Lobo-Mueller E, Amaral JG, Babyn PS, Wang Q, John P. Complex combined vascular malformations and vascular malformation syndromes affecting the extremities in children. Semin Musculoskelet Radiol 2009; 13:255-76. [ Links ]
19. Kulungowski AM, Fishman SJ. Management of combined vascular malformations. Clin Plast Surg 2011; 38:107-20. [ Links ]
20. Faughnan ME, Palda VA, Garcia-Tsao G, et al. International guidelines for the diagnosis and management of hereditary hemorrhagic telangiectasia. J Med Genet 2011; 48:73-87. [ Links ]














