Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de radiología
versión On-line ISSN 1852-9992
Rev. argent. radiol. vol.77 no.1 Ciudad Autónoma de Buenos Aires mar. 2013
GENITOURINARIO
Carcinoma de células renales: estadificación prequirúrgica por tomografía computada y su analogía con la anatomía patológica
María Cinthya Ortega Hrescak (1), Aníbal J. Ezquer (2), Fernando F. Cenice (2), Gustavo A. Socolsky (1), Raúl E. López (2), Adolfo J. López Galíndez (1)
(1) ALTA GAMA, San Miguel de Tucumán, Tucumán, Argentina.
(2) Instituto Urológico Privado Prof. Dr. Ronald Parada Parejas, San Miguel de Tucumán, Tucumán, Argentina.
Correspondencia: Dra. María Cinthya Ortega Hrescak - cinthya_ortega@hotmail.com
Recibido: julio 2012; aceptado: octubre 2012
Received: july 2012; accepted: october 2012
doi: 10.7811/rarv77n1a02
Resumen
Objetivo. Evaluar la correlación entre la estadificación preoperatoria de los carcinomas de células renales usando tomografía computada y los resultados anatomopatológicos de la pieza operatoria.
Materiales y Métodos. Se llevó a cabo un estudio retrospectivo entre los años 2005 y 2011, tomando un total de 40 pacientes con diagnóstico presuntivo de carcinoma de células renales (CCR) del Servicio de Urología, que habían sido sometidos a nefrectomía total o parcial. Se compararon diferentes parámetros del estudio imagenológico (tomografía computada) y anatomopatológico de cada paciente y se evaluó qué reciprocidad existía entre la estadificación pre y posoperatoria según el TNM.
Resultados. Los datos obtenidos mediante el estudio anatomopatológico de la pieza operatoria mostraron 28 lesiones limitadas al riñón (estadios T1 y T2), 3 lesiones con extensión perirrenal y a la vena renal (estadio T3a), 7 lesiones con compromiso de la vena cava (estadio T3b) y 2 lesiones con extensión más allá de la fascia de Gerota (estadio T4). Se encontró una fuerza de concordancia casi perfecta entre la estadificación tomográfica y anatomopatológica (kappa = 0,87) con respecto al criterio T del TNM. Sólo 2 T1b (por estudio anatomopatológico) fueron sobrediagnosticados como T2 (según tomografía computada) y 2 T3b (según estudio anatomopatológico) se subdiagnosticaron como T3a (según tomografía computada).
Conclusión. La tomografía computada proporciona una buena delimitación y caracterización del carcinoma de células renales. El nivel de concordancia con el patrón de referencia más fiable (anatomía patológica) resultó casi perfecto (k = 0,87) para la estadificación del estadio T.
Palabras clave. Carcinoma; Células renales; Correlación; Tomografía computada; Estudio anatomopatológico.
Abstract
Renal cell carcinoma: preoperative staging by computed tomography and its analogy to pathology.
Objective. To evaluate the correlation between the preoperative staging of renal cell carcinoma by computed tomography (CT) and histopathologic results of the surgical specimen.
Materials and Methods. A retrospective study has been carried out in a total of 40 patients from our urology department with suspected diagnosis of renal cell carcinoma (RCC) who had undergone total or partial nephrectomy between 2005 and 2011. We compared different parameters of imaging (CT) and pathological studies of each patient and assessed the reciprocal relationship between pre-and postoperative staging according to TNM.
Results. Data obtained by pathological examination of the resected specimen showed 28 lesions limited to the kidney (stages T1 and T2), 3 lesions with perirenal extension and renal vein (stage T3a), 7 lesions with involvement of the vena cava (stage T3b) and 2 lesions with extension beyond Gerota's fascia (stage T4). We found an almost perfect strength of agreement between tomographic and pathologic staging (kappa = 0.87), with respect to T of the TNM criteria. Only two T1b (by pathological study) were overdiagnosed as T2 (by computed tomography) and two T3b (by pathological study) were underdiagnosed as T3a (by CT).
Conclusion. Computed tomography provides a good delineation and characterization of renal cell carcinoma. The level of agreement with the most reliable reference standard (pathological study) was almost perfect (k = 0.87) for the staging of T stage.
Keywords. Carcinoma; Renal cell; Mapping; Computed tomography; Pathological study.
INTRODUCCIÓN
La patología neoplásica renal es muy diversa y tiene una incidencia del 3% en la población adulta (1). En países como Estados Unidos se diagnostican más de 58.000 casos de tumores renales sólidos al año (2,3).
Entre los tumores benignos, se destacan el adenoma papilar, el adenoma metanéfrico y el oncocitoma. Para los tumores malignos del parénquima renal, Heidelberg propuso una clasificación en la que se combinan parámetros morfológicos, citogenéticos y estudios moleculares (4). El carcinoma de células renales (CCR) es el tumor maligno más frecuente del riñón: representa el 90% de los tumores renales en adultos y el 2% de los tumores malignos (5).
Un tercio de todos los casos diagnosticados son descubiertos incidentalmente mediante estudios imagenológicos en pacientes con síntomas abdominales no relacionados con su patología renal (6). Muchos de estos tumores son lesiones pequeñas y asintomáticas (7).
Estos hechos, junto con los datos que indican una supervivencia similar a 5 años después del tratamiento de los tumores pequeños con nefrectomía radical o parcial, han generado un mayor interés en las cirugías ahorradoras de nefronas para los pacientes con un riñón contralateral normal (8,9).
La creciente popularidad de las técnicas basadas en la nefrectomía parcial ha implicado una mayor demanda en la obtención de imágenes preoperatorias. La correcta selección de los pacientes, junto con el planeamiento de una técnica quirúrgica adecuada, requiere un conocimiento detallado de la vasculatura renal, así como de las relaciones del tumor con el parénquima renal y órganos adyacentes.
La tomografía computada (TC) y/o resonancia magnética (RM) pueden hacer una caracterización preoperatoria y, en algunos casos, hasta permiten distinguir el subtipo histológico (por ejemplo, angiomiolipomas) (10,11). Varios autores sostienen que, con respecto a los tumores, los criterios más importantes a evaluar son: naturaleza, tamaño, localización, contornos, número, patrón de realce, necrosis, presencia y sitio de hemorragia, grasa tumoral, valoración del compromiso de la vena cava inferior y de la vena renal, valoración de ganglios linfáticos, fascia de Gerota, grasa perirrenal y cápsula renal (4,12).
En 1969 Robson reportó una sobrevida a 5 años de: 66% para el estadio 1, 64% para el estadio 2, 42% para el estadio 3 y 11% para el estadio 4 (7) . Sin embargo, estudios recientes informaron una mejor sobrevida para pacientes con tumores confinados al riñón. De acuerdo a la clasificación por estadios del TNM de carcinoma renal, la supervivencia a 10 años en el estadio 1 es mayor del 90%, en el estadio 2 es del 80%, en el estadio 3 es del 40-60% y en el estadio 4 es del 10% (13).
En el año 2010, Mohamed et al. realizaron la estadificación preoperatoria del CCR utilizando la TC helicoidal trifásica y concluyeron que, de acuerdo con el TNM, la correlación entre la estadificación preoperatoria y la estadificación patológica posoperatoria fue perfecta para el parámetro T, mientras que para el parámetro N resultó deficiente. De esta forma, se vio que la estadificación T del CCR se puede predecir a través de los hallazgos puestos en evidencia por la TC helicoidal trifásica (14).
Está claro que el progreso tecnológico y el uso en expansión de la TC han logrado diagnosticar en forma incidental un mayor número de carcinomas renales en pacientes asintomáticos.
Teniendo en cuenta que el estadio del tumor es el factor de influencia más importante en el pronóstico y la supervivencia de los pacientes, y que tiene un impacto importante en la planificación del tratamiento, este estudio tuvo como objetivo evaluar la exactitud de la TC para la estadificación preoperatoria del CCR, comparándola con el patrón de referencia histopatológica.
OBJETIVO
Evaluar la correlación entre la estadificación preoperatoria de los CCR usando tomografía computada y los resultados anatomopatológicos de la pieza operatoria.
MATERIALES Y MÉTODOS
Se llevó a cabo un estudio retrospectivo entre los años 2005 y 2011, tomando un total de 40 pacientes de nuestro Servicio de Urología que habían sido sometidos a nefrectomía total o parcial por diagnóstico presuntivo de carcinoma renal.
Criterios de inclusión: pacientes de ambos sexos con estudio tomográfico preoperatorio e informe de anatomía patológica de la pieza operatoria disponibles (ambos pertenecientes a los mismos servicios de diagnóstico).
Criterios de exclusión: pacientes con diagnóstico de tumoración renal que no poseían estudio tomográfico preoperatorio ni informe de anatomía patológica
Procedimiento: se realizó una búsqueda en nuestra base de datos de todos los pacientes sometidos a nefrectomía total o parcial (ya sea por vía convencional o laparoscópica) por diagnóstico presuntivo de tumor renal y que en sus exámenes patológicos de la pieza operatoria se demostraba la existencia de CCR. Posteriormente, se compararon diferentes parámetros entre el estudio imagenológico y patológico de cada paciente y se evaluó qué reciprocidad existía entre la estadificación pre y posoperatoria.
Para el estudio imagenológico se utilizó un tomógrafo secuencial marca Elscint Mx Twin. Los parámetros tomográficos fueron 220 mA y 120 Kv, y se administraron manualmente, en forma directa mediante bolo endovenoso, 50 cc de contraste yodado sin diluir.
Todos los pacientes se estudiaron inicialmente con técnica estándar (sin contraste EV) y posteriormente con refuerzo EV, con cortes de 5 mm de espesor cada 5 mm de incremento de la mesa. Se analizó el realce del riñón en la fase cortical a los 30 - 40 segundos de comenzada la inyección del contraste y en la fase nefrográfica a los 90 -120 segundos. Además, se adicionaron cortes tardíos para evaluar la fase excretora a los 5 minutos de la inyección del contraste endovenoso. De esta manera, se evaluó a la totalidad de los pacientes sin y con contraste en las 3 fases (cortical, nefrográfica y excretora).
Las variables consideradas fueron seleccionadas de acuerdo a los parámetros más importantes para una estadificación (según la bibliografía consultada). Los valores para cada una de ellas fueron: “comprometido” o “no comprometido”
1. Cápsula renal
2. Grasa perirrenal
3. Fascia de Gerota
4. Órganos vecinos
5. Invasión vascular
De acuerdo con el grado de compromiso, se realizó la estadificación del parámetro T para cada paciente, según el sistema de estadificación TNM de 2009 (Tabla 1).
Tabla 1: Sistema de estadificación TNM (2009).

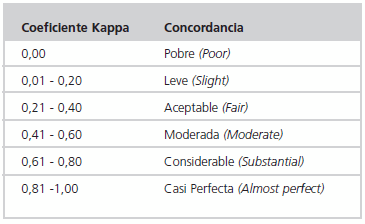
Análisis de los datos: el grado de concordancia entre ambos métodos se llevó a cabo mediante el uso de la prueba estadística del coeficiente Kappa (k), el cual refleja la fuerza de concordancia entre dos observadores. Dicho coeficiente puede tomar valores entre -1 y +1. Mientras más cercano es a +1, mayor es el grado de concordancia interobservador. Por el contrario, mientras más cercano es a -1, mayor es el grado de discordancia interobservador. Un valor de k = 0 refleja que la concordancia observada es precisamente la que se espera como causa sólo del azar (15). La Tabla 2 corresponde a la escala utilizada con frecuencia para expresar cualitativamente la fuerza de la concordancia, según Landis y Koch (16).
Tabla 2: Concordancia del coeficiente Kappa.
RESULTADOS
Evaluación mediante anatomía patológica
Sobre un total de 40 pacientes incluidos en este trabajo, los datos obtenidos mediante el estudio anatomopatológico de la pieza operatoria mostraron 28 lesiones limitadas al riñón (estadios T1 y T2), 3 lesiones con extensión perirrenal y a la vena renal (estadio T3a), 7 lesiones con compromiso de la vena cava (estadio T3b) y 2 lesiones con extensión más allá de la fascia de Gerota (estadio T4).
El examen histopatológico reveló los siguientes tipos de tumores renales: carcinoma de células claras (Fig. 1) en 37 casos, de tipo papilar (Fig. 2) en 2 casos y cromófobo (Fig. 3) en un solo caso.
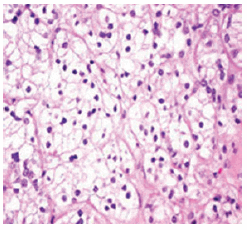
Fig. 1: CCR variante células claras (tinción con hematoxilina-eosina 40 x).

Fig. 2: CCR variante papilar (tinción con hematoxilina- eosina 40 x).
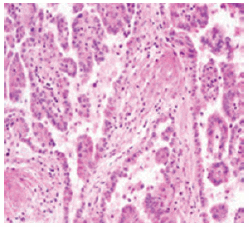
Fig. 3: CCR variante cromófobo (tinción con hematoxilina-eosina 20 x).
De acuerdo al sistema de graduación nuclear de Fuhrman (17), 10 lesiones pertenecían al grado I, 8 correspondían al grado II, 12 eran grado III y las 10 restantes eran grado IV.
Evaluación mediante TC
Del total de pacientes incluidos en el trabajo de acuerdo a su estadificación tomográfica, 4 tumores correspondían al estadio T1a (Fig. 4), 13 al estadio T1b, 11 al estadio T2, 5 al estadio T3a (Fig. 5a), 5 al estadio T3b (Fig. 5b) y finalmente 2 lesiones pertenecían al estadio T4 (Fig. 6). Además, de acuerdo a los hallazgos en la TC, 22 lesiones se ubicaban en el polo superior, 7 en la zona media y 11 en el polo inferior.

Fig. 4: TC abdominal con contraste endovenoso de diferentes pacientes que muestran un tumor (flecha) confinado al interior de la cápsula renal a nivel del (a) riñón derecho y (b) riñón izquierdo.

Fig. 5: TC abdominal con contraste endovenoso de diferentes pacientes que muestran: (a) tumor en riñón izquierdo con extensión a la vena renal ipsilateral (flecha) sin compromiso de la fascia de Gerota; (b) tumor en riñón derecho con extensión a la vena renal ipsilateral y vena cava, en la que se visualiza trombosis (flecha) sin compromiso de la fascia de Gerota.
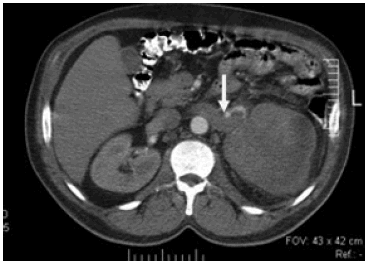
Fig. 6: TC abdominal con contraste endovenoso que muestra un tumor, a nivel del riñón izquierdo, que compromete la fascia de Gerota y se extiende al pedículo renal (flecha).
De los 40 tumores renales evaluados, 23 afectaban el riñón derecho y 17 el riñón izquierdo.
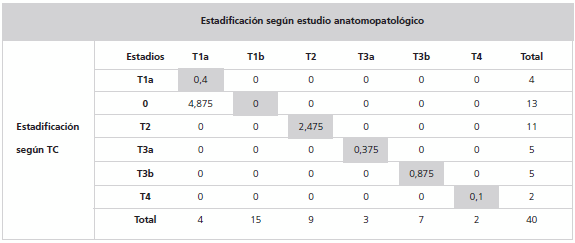
En la Tabla 3 se comparan los resultados obtenidos para la estadificación de acuerdo a la tomografía y el estudio anatomopatológico. Vemos que, tomando como patrón de referencia los valores de la anatomopatología, la TC no mostró concordancia en 4 casos. Dos casos fueron estadificados según TC como T2, correspondiendo a un estadio T1b según el estudio anatomopatológico, y los otros dos casos fueron estadificados como T3a según la TC, correspondiendo a un estadio T3b según el estudio anatomopatológico.
Tabla 3: Comparación entre la estadificación según TC y estudio anatomopatológico.

El grado de concordancia entre ambos métodos se llevó a cabo mediante el uso de la prueba estadística del coeficiente Kappa. Primero, fue necesario definir para cada celda de la diagonal principal (celdas concordantes, marcadas en color gris en la Tabla 3) el número de observaciones atribuibles al azar (Tabla 4).
Tabla 4: Valores teóricos para cada celda de la diagonal principal.
Luego, a partir de esto y a través de las siguientes fórmulas matemáticas, se llegó al valor de k:


De acuerdo con lo expuesto en la Tabla 2, podemos decir que existe una concordancia casi perfecta (k = 0,87) entre la estadificación prequirúrgica realizada por TC y la estadificación posquirúrgica efectuada a través de la anatomía patológica de la pieza operatoria (Figs. 7 y 8).

Fig. 7: Pieza quirúrgica del mismo paciente de la Fig. 4a, al cual se le practicó nefrectomía total derecha.

Fig. 8: Pieza quirúrgica del mismo paciente de la Fig. 4b, al cual se le practicó nefrectomía parcial izquierda.
DISCUSIÓN
El estudio imagenológico del CCR juega un papel fundamental en el diagnóstico, estadificación y seguimiento (18). Se ha determinado que la presentación del CCR se da principalmente entre la sexta y séptima décadas de vida, aumentando con la edad un 3% la tasa de incidencia anual (19). En el presente trabajo, la edad media de los pacientes fue de 54 años, encontrándose 3 subtipos histológicos de CCR (células claras, papilar y cromófobo).
De acuerdo con los resultados obtenidos, hemos encontrado una concordancia casi perfecta entre la estadificación tomográfica y anatomopatológica (k = 0,87) con respecto al criterio T del TNM, salvo 2 T1b (por estudio anatomopatológico) sobrediagnosticados como T2 (según TC) y 2 T3b (según estudio anatomopatológico) subdiagnosticados como T3a (según TC). En este sentido, cabe destacar la utilización de un equipo TC helicoidal para el desarrollo del presente trabajo, con las limitaciones que ello implica, ya que los resultados pueden verse afectados de manera significativa (algo inusual mediante el uso de la TC multicorte) (Fig. 9).
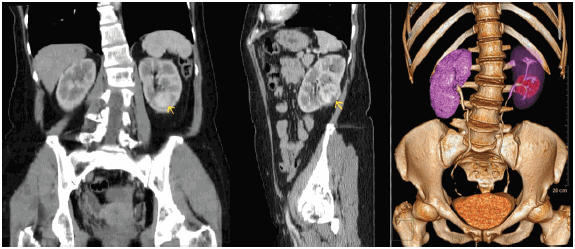
Fig. 9: TC abdominal con contraste endovenoso que muestra un tumor a nivel del riñón izquierdo. (a) MPR coronal; (b) MPR sagital, (c) reconstrucción volumétrica 3D.
Mohamed et al. (14) han obtenido un valor de k de 0,941 para el criterio T, utilizando TC helicoidal trifásica; mientras, para el estadio N el coeficiente k tuvo un valor de 0,33. De esta forma, quedó en evidencia la menor utilidad de la TC para evaluar el compromiso ganglionar. En el caso de nuestro trabajo no se evaluó el parámetro N debido a que durante el acto quirúrgico no se realizaron linfadenectomías.
Por su parte, Catalano et al. informaron que la exactitud de la TC helicoidal con múltiples cortes (TC multicorte) fue del 95% en la evaluación de la infiltración de la grasa perirrenal (20). No obstante, a pesar de que en los estudios por imágenes podían evidenciarse patrones subjetivos de diseminación periférica, estos hallazgos no fueron corroborados a través del estudio anatomopatológico. Los resultados patológicos de estos casos revelaron signos de inflamación en la grasa perirrenal. Aparentemente, la predicción de la infiltración de la grasa perirrenal sería un parámetro difícil de evaluar, incluso con la TC multicorte.
Entre nuestros resultados hubo 5 casos en estadio T3b con compromiso de la vena cava, que fueron claramente visualizados mediante TC y, posteriormente, confirmados mediante el estudio anatomopatológico de la pieza operatoria. Esto concuerda con Kallmann et al. (21), dado que ellos afirmaron que los trombos pueden ser visualizados en la fase corticomedular. Por ello, hay autores que señalan que el uso de la TC con multicorte y la RM son métodos adecuados para evaluar la extensión del trombo tumoral (22).
Por otro lado, Huang et al. (23), utilizaron la RM tridimensional (RM-3D) para realizar una estadificación preoperatoria de tumores renales y encontraron que este método tiene una sensibilidad del 100% y una especificidad del 88%. Siguiendo la misma metodología de trabajo con la RM, Spero et al. (24) calcularon un índice de concordancia k de 0,73 para la estadificación T de los tumores malignos.
CONCLUSIÓN
En la actualidad existe un creciente y permanente avance tecnológico en el campo de la Imagenología. La mejora del equipamiento y los softwares empleados ha favorecido a múltiples especialidades médicas (en particular, a la Urología), permitiendo la optimización de los diagnósticos de forma sorprendente. De acuerdo con los resultados obtenidos en nuestro trabajo, podemos decir que la TC proporciona una buena delimitación y caracterización del CCR, en tanto el nivel de concordancia con el patrón de referencia más fiable (estudio anatomopatológico) resultó casi perfecto (k = 0,87) para la estadificación del estadio T.
Recientemente, en nuestro medio se ha incorporado, facilitando aún más los diagnósticos, la tomografía multicorte, que permite la adquisición de cortes milimétricos en menor tiempo de barrido, con el posterior procesamiento de las imágenes para la obtención de reconstrucciones multiplanares (MPR).
Por todo ello, en un futuro próximo, el panorama mostrará cambios favorables en lo que al diagnóstico precoz de tumores renales se refiere, quedando abierto el camino para la realización de nuevas investigaciones sobre una población de estudio de mayor tamaño.
Los autores del trabajo declaran no tener ningún conflicto de intereses.
1. Linehan WM, Rini Bi, Yang JC. Cancer of the kidney. En: De Vita VT Jr, Hellman S, Rosenberg SA, eds. Cancer: Principles and Practice of Oncology. Philadelphia: Lippincott Williams & Wilkins; 2008:1331-54. [ Links ]
2. Cancer Facts and Figures 2010 (database online). Atlanta, Ga: American Cancer Society; 2010. Updated: 2010. Disponible en (Available at): http://www.cancer.org/acs/groups/content/@nho/documents/document/acspc-024113.pdf. Accedido (Accessed): julio 11, 2012. [ Links ]
3. Uzzo RG, Novick AC. Nephron sparing surgery for renal tumors: indications, techniques and outcomes. J Urol 2001; 166:6-18. [ Links ]
4. Oyen R, Van Poppel H, Roskams T. Primary malignant renal parenchyma epithelial neoplasms. En: Gourtsoyiannis NC, Ros PR, eds. Radiologic-Pathologic Correlations from Head to Toe. Heraklion Crete: Springer; 2005:595-617. [ Links ]
5. Jemal A, Murray T, Ward E, et al. Cancer statistics, 2005. CA Cancer J Clin 2005; 55:10-30. [ Links ]
6. Polascik TJ, Pound CR, Meng MV, Partin AW, Marshall FF. Partial nephrectomy: technique, complications and pathological findings. J Urol 1995; 154:1312-8. [ Links ]
7. Smith SJ, Bosniak MA, Megibow AJ, Hulnick DH, Horii SC, Raghavendra BN. Renal cell carcinoma: earlier discovery and increased detection. Radiology 1989; 170:699-703. [ Links ]
8. Butler BP, Novick AC, Miller DP, Campbell SA, Licht MR. Management of small unilateral renal cell carcinomas: radical versus nephron-sparing surgery. Urology 1995; 45:34-41. [ Links ]
9. Lerner SE, Hawkins CA, Blute ML, et al. Disease outcome in patients with low stage renal cell carcinoma treated with nephron sparing or radical surgery. J Urol 1996; 155:1868-73. [ Links ]
10. Russo P. Renal cell carcinoma: presentation, staging, and surgical treatment. Semin Oncol 2000; 27:160-76. [ Links ]
11. Macari M, Bosniak MA. Delayed CT to evaluate renal masses incidentally discovered at contrast-enhanced CT: demonstration of vascularity with deenhancement. Radiology 1999; 213:674-80. [ Links ]
12. Zagoria RJ, Bechtold RE, Dyer RB. Staging or renal adenocarcinoma: role of various imaging procedures. AJR Am J Roentgenol 1995; 164:363-70. [ Links ]
13. Balsa Barro JA, Gonzalez-Spinola San Gil MJ, Pascual Santos J, et al. Diagnóstico Tratamiento Médico Urología. España: Marbán; 2012. [ Links ]
14. Mohamed Nageeb Allam, Hazim Ibrahim Tantawey, Mohamed Mustafa Saad, Abdellatif Mohamed Zayed. Preoperative staging of renal cell carcinoma using triphasic helical computed tomography. The Egyptian Journal of Radiology and Nuclear Medicine 2010; 41:421-8. [ Links ]
15. López de Ullibarri I, Pita S. Medidas de concordancia: el índice kappa. Cad Aten Primaria 1999; 6:169-71. [ Links ]
16. Landis JR, Koch GG. The measurement of observer agreement for categorical data. Biometrics 1977; 33:159-74. [ Links ]
17. Fuhrman SA, Lasky LC, Limas C. Prognostic significance of morphologic parameters in renal cell carcinoma. Am J Surg Pathol 1982; 6:655-63. [ Links ]
18. Ng CS, Wood CG, Silverman PM, Tannir NM, Tamboli P, Sandler CM. Renal cell carcinoma: diagnosis, staging, and surveillance. AJR Am J Roentgenol 2008; 191:1220-32. [ Links ]
19. Chow WH, Devesa SS, Warren JL, Fraumeni JF Jr. Rising incidence of renal cell cancer in the United States. JAMA 1999; 281:1628-31. [ Links ]
20. Catalano C, Fraioli F, Laghi A, et al. High-resolution multidetector CT in the preoperative evaluation of patients with renal cell carcinoma. AJR Am J Roentgenol 2003; 180:1271-7. [ Links ]
21. Kallman DA, King BF, Hattery RR, et al. Renal vein and inferior vena cava tumor thrombus in renal cell carcinoma: CT, US, MRI and venacavography. J Comput Assist Tomogr 1992; 16:240-7. [ Links ]
22. Hallscheidt PJ, Fink C, Haferkamp A, et al. Preoperative staging of renal cell carcinoma with inferior vena cava thrombus using multidetector CT and MRI: prospective study with histopathological correlation. J Comput Assist Tomogr 2005; 29:64-8. [ Links ]
23. Huang GJ, Israel G, Berman A, Taneja SS. Preoperative renal tumor evaluation by three-dimensional magnetic resonance imaging: staging and detection of multifocality. Urology 2004; 64:453-7. [ Links ]
24. Spero M, Brkljacic B, Kolaric B, Marotti M. Preoperative staging of renal cell carcinoma using magnetic resonance imaging: comparison with pathological staging. Clin Imaging 2010; 34:441-7. [ Links ]













