Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista argentina de radiología
On-line version ISSN 1852-9992
Rev. argent. radiol. vol.77 no.1 Ciudad Autónoma de Buenos Aires Mar. 2013
ABDOMEN
Cuatro años de experiencia en el uso de tomografía computada multidetector en el trasplante de páncreas: aprendiendo junto a los cirujanos
Hugo José Paladini, Ángela Patricia Neira Sepúlveda, María Bernardita González, Diego Ramisch, Gabriel Eduardo Gondolesi, Diego Mariano Haberman
Fundación Favaloro. Av. Belgrano 1746 /1782, (C1093AAS), Buenos Aires, Argentina.
Correspondencia: Dr. Hugo José Paladini - vforvendetta2002@gmail.com
Recibido: septiembre 2012; aceptado: diciembre 2012
Receibed: september 2012; accepted: december 2012
doi: 10.7811/rarv77n1a06
Resumen
Objetivo. Conocer la anatomía normal posquirúrgica del paciente con trasplante de páncreas en tomografía computada multidetector (TCMD) y describir las complicaciones más frecuentes.
Revisión de tema. El trasplante pancreático ha aumentado en los últimos años como estrategia terapéutica en pacientes diabéticos, siendo en la actualidad el único tratamiento eventualmente curativo. Según cifras del Instituto Nacional Central Único Coordinador de Ablación e Implante (INCUCAI), en el 2001 se realizaron 9 trasplantes renopancreáticos/pancreáticos, mientras que en el 2011 se practicaron 74. Esto nos obliga como radiólogos a conocer la anatomía normal posquirúrgica y a aprender a identificar las complicaciones más frecuentes.
Los métodos imagenológicos utilizados son la ecografía/Doppler, la tomografía computada multidetector (TCMD), la angiografía convencional y la resonancia magnética (RM). En pacientes con buena función renal y ecografía no concluyente, para categorizar las complicaciones, la evaluación por tomografía computada multidetector es el paso siguiente.
En nuestro hospital se realizaron 25 trasplantes pancreáticos en el período 2008-2012. Durante el posoperatorio, en 19 de ellos se sospecharon, por clínica o ecografía, complicaciones (a 15 de los cuales se les realizó tomografía computada).
Conociendo la técnica quirúrgica, describimos la anatomía normal y desarrollamos las complicaciones posquirúrgicas más frecuentes: vasculares (trombosis, fístula arteriovenosa, pseudoaneurisma) y no vasculares (pancreatitis, fístulas pancreáticas, colecciones, neumoperitoneo, íleo).
Conclusión. La tomografía computada multidetector es un método de gran utilidad al momento de evaluar pacientes con trasplante pancreático. Un conocimiento cabal de la particular anatomía posquirúrgica y sus posibles complicaciones es crucial para el radiólogo, con el fin de orientar el seguimiento y tratamiento de estos pacientes.
Palabras clave. Trasplante de páncreas; Tomografía computada; Anatomía normal posquirúrgica; Complicaciones.
Abstract
Four years of experience in the use of multidetector computer tomography in pancreas transplantation: a lesson learned together with surgeons.
Purpose. To gain knowledge of normal postoperative findings on Multidetector Computed Tomography (MDCT) in patients with pancreas transplant and describe the most frequent complications.
Topic review. Pancreatic transplantation is currently the only definitive treatment for diabetic patients. In recent years, its use has increased as therapeutic strategy. According to the INCUCAI, in 2001 9 transplants were performed, increasing to 74 in 2011. This increase creates a need for radiologists to gain knowledge of the normal postoperative anatomy and learn to identify the most frequent postoperative complications.
The imaging methods used are Doppler / ultrasound, MDCT, conventional angiography and MRI. In patients with good renal function in whom ultrasound is not diagnostic for characterization of complications, the next step is MDCT.
At our hospital, 25 pancreatic transplants were performed in 2008-2012. Postoperative complications were suspected clinically or by ultrasound in 19 of them. Fifteen of them were evaluated by CT for further characterization
Imaging findings or procedure details. As we learn the surgical techniques that were performed, normal images are described, allowing a correct interpretation of MDCT findings in these patients. The most common post operative complications were:
- Vascular: thrombosis, arteriovenous fistula, pseudoaneurysm
- Non vascular: pancreatitis, pancreatic fistulas, collections, pneumoperitoneum, ileus.
Conclusion: MDCT is a useful method for assessing patients with pancreas transplantation. A clear understanding of the unique anatomy and possible postoperative complications is crucial for the radiologist to guide the monitoring and treatment of this patient.
Keywords. Pancreatic Transplantation; Computed tomography; Postsurgical normal anatomy; Complications.
OBJETIVO
Conocer la anatomía normal posquirúrgica del paciente con trasplante de páncreas en la tomografía computada multidetector (TCMD) y describir las complicaciones más frecuentes.
REVISIÓN DE TEMA
Actualmente el trasplante pancreático es el único tratamiento definitivo para el paciente diabético. Permite controlar los niveles de glucemia sin la necesidad de administrar insulina, mejorando la calidad de vida del paciente y estabilizando (e incluso revirtiendo) las complicaciones propias de la enfermedad (1,2).
La disminución de las complicaciones postrasplante, debido a las mejoras a nivel técnico-quirúrgico e inmunosupresión, ha provocado que aumenten los trasplantes como estrategia terapéutica (3-5). Según cifras del INCUCAI, en el 2001 se realizaron 9 trasplantes renopancreáticos/pancreáticos, mientras que en el 2011 ascendieron a un total de 74 (6). Este incremento en el número de trasplantes obliga al radiólogo a conocer la anatomía normal posquirúrgica y las complicaciones más frecuentes, ya que la identificación temprana de las mismas es esencial para evaluar los resultados del trasplante a corto o largo plazo (7-9).
Los métodos por imágenes para el estudio de los pacientes son la ecografía/Doppler, la TCMD, la angiografía convencional y la resonancia magnética (RM) (10). Si la ecografía no ha podido ser definitiva al momento de evaluar posibles complicaciones, el estudio por TCMD es el paso siguiente. La sospecha diagnóstica y la función renal del paciente definen la necesidad y beneficio de la utilización del contraste endovenoso.
HALLAZGOS EN IMÁGENES
En nuestro hospital se realizaron 25 trasplantes renopancreáticos en el período 2008-2012. Durante el posoperatorio, se sospecharon clínicamente complicaciones en 19 pacientes. En un inicio, todos fueron evaluados por ecografía, pero en 15 (9 hombres y 6 mujeres) se avanzó en el diagnóstico a través de la TCMD. En estos últimos el rango etario fue de 26 a 66 años (media: 44 años). Todos presentaban como enfermedad de base diabetes tipo 1 asociada a insuficiencia renal crónica, salvo en 2 casos en los que la diabetes era tipo 2.
Los protocolos tomográficos se realizaron con contraste endovenoso en 11 de los casos y en los 4 restantes se evitó su administración, debido a que presentaban una función renal alterada.
En 11 (74%) de ellos se detectaron complicaciones por TCMD, las cuales condujeron a la reintervención quirúrgica y/o tratamiento médico. En 2 (13%) no hubo hallazgos patológicos en la TCMD y durante el resto de la internación presentaron buena evolución clínica, por lo que recibieron el alta hospitalaria. Los otros 2 (13%) pacientes (pertenecientes al grupo que no había recibido contraste endovenoso durante el estudio tomográfico), si bien no presentaron hallazgos patológicos en la TCMD, tuvieron como complicación una necrosis tubular aguda posquirúrgica (que fue diagnosticada por la clínica y el laboratorio). Ambos recibieron el tratamiento indicado por nefrología.
TÉCNICA QUIRÚRGICA Y ANATOMÍA POSQUIRÚRGICA POR TCMD
La glándula trasplantada se coloca intraperitonealmente a nivel de la fosa ilíaca derecha, a través de varias técnicas quirúrgicas con las cuales el radiólogo debe estar familiarizado. La mayoría de las variantes dependen del tipo de drenaje exocrino del órgano trasplantado y las anastomosis vasculares que se realizan.
En general, el trasplante pancreático se lleva a cabo simultáneamente con el renal, debido a que aumenta la sobrevivida del paciente (11-13). El riñón, en nuestra institución, suele implantarse en la fosa ilíaca izquierda en situación extraperitoneal (Fig. 1).
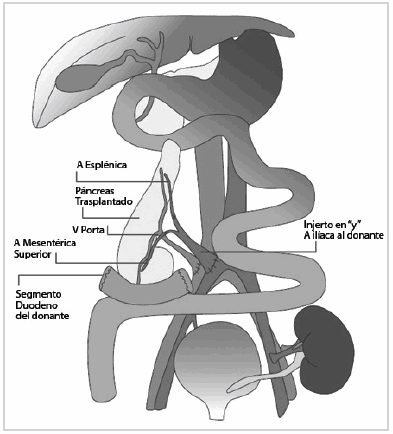
Fig. 1: Esquema de la anatomía posquirúrgica del trasplante renopancreático.
Drenaje exocrino pancreático
En nuestra institución la técnica empleada en todos los trasplantes pancreáticos fue el drenaje exocrino hacia el intestino. El drenaje entérico de las secreciones exocrinas se consigue realizando la anastomosis látero-lateral del duodeno del donante con íleon nativo (Fig. 2) (9,14).

Fig. 2: Drenaje exocrino entérico. TCMD con contraste oral. (a) Reconstrucción en el plano coronal, (b) oblicuo. Se identifican asas del intestino delgado (I) del receptor, que se anastomosan látero-lateralmente al duodeno (D) del donante con contraste oral en su interior. Cabeza del páncreas (CP) y riñón trasplantado (RTx).
La variante de la técnica descrita se realiza con drenaje exocrino vesical y, en ella, se abocan los conductos de excreción pancreáticos a la vejiga y no al intestino. Se ha asociado frecuentemente a cistitis, uretritis y a estenosis ureteral, dada la irritación que generan las secreciones pancreáticas (15,16). Por este motivo, en la actualidad, no se realiza en nuestro hospital ni en la mayoría de las series de trasplantes publicadas por otras instituciones del exterior. De hecho, es de elección en menos del 10% de los casos (17-19).
Anastomosis vasculares
La vena porta del páncreas trasplantado es anastomosada a la vena ilíaca externa derecha del receptor (drenaje portal sistémico). Como variante, podría ser anastomosada a la vena mesentérica superior del receptor (drenaje portal entérico). Esta última sería más fisiológica, pero aún no ha demostrado ser superior (algo que se ve reflejado en la poca utilización que tiene en las grandes series publicadas -menos del 20%-, como la revisión de Gruessner et al.) (4).
En nuestra institución, en el 100% de los casos se utilizó drenaje portal sistémico.
En cuanto al sistema arterial, las ramas con que se reseca el órgano a trasplantar son la arteria esplénica y la arteria mesentérica, las cuales son anastomosadas a la arteria ilíaca interna y externa del receptor, respectivamente. Como variante anterior al trasplante, en banco se prepara el órgano, utilizando la arteria ilíaca común del donante y se crea un injerto en “Y” para unir las ramas del órgano trasplantado a la arteria ilíaca del receptor (Fig. 1) (9,20).
COMPLICACIONES VASCULARES
La trombosis del injerto tiene una incidencia del 2% al 19% (en nuestra muestra fue del 12%). Es la complicación vascular más seria y puede llevar a la necrosis del injerto, requiriendo en muchos de los casos la reintervención quirúrgica (10,21). Suele ser venosa y se presenta típicamente en los primeros días de evolución del trasplante (generalmente entre las primeras 24 a 48 h) (22).
Si se detecta en el período agudo, las causas predisponentes pueden ser las alteraciones en la microcirculación, los estados de hipercoagulabilidad y los defectos técnicos en el procedimiento quirúrgico (17,21,23). Si la trombosis aparece en forma tardía, suele ser expresión de rechazo (10,24).
En la tomografía computada (TC) es necesaria la administración de contraste endovenoso, luego de haber evaluado la función renal del paciente. Se realizan fases arterial y venosa para poder detectar defectos de relleno venoso o arterial (Fig. 3).

Fig. 3: Trombosis. TC con contraste endovenoso, fase portal, cortes (a) axial y (b) coronal. Se identifican imágenes de defecto de relleno, compatibles con trombosis vascular a nivel de la vena esplénica (VE) (flechas). El páncreas (P) presenta realce homogéneo. Luego del diagnóstico, se inició tratamiento anticoagulante para la preservación del injerto.
Si se constata la trombosis arterial, se identifica, además del defecto de relleno vascular, un pobre realce del parénquima del injerto, que indica necrosis del mismo (17,25).
Pueden encontrarse trombosis sin significado clínico, identificadas en pequeñas ramas laterales, que corresponderían a pequeños vasos ligados durante la ablación. Generalmente no tienen impacto negativo en el paciente, pero se recomienda su seguimiento para excluir la propagación del trombo (10).
Pseudotrombosis ilíaca
Esta falsa imagen de trombosis se presenta por un retardo en la opacificación de la vena ilíaca que se encuentra en relación con el injerto pancreático, comparado con el tiempo de opacificación del injerto renal, que es más precoz (Fig. 4) (26).

Fig. 4: (a) y (b) Pseudotrombosis. TCMD con contraste EV en tiempo arterial, cortes axiales sucesivos. Se evidencia realce precoz de la vena ilíaca izquierda debido a la mayor velocidad del flujo de los vasos renales con respecto al trasplante pancreático. La vena ilíaca derecha aún no tiene contraste por el flujo venoso lento del injerto pancreático. Vena ilíaca derecha (VID); vena ilíaca izquierda (VII); arteria ilíaca derecha (AID); arteria ilíaca izquierda (AII); riñón trasplantado (RTx); vena renal del riñón trasplantado (VR RTx). Conociendo que éste no era un hallazgo patológico verdadero, se evitó el inicio del tratamiento anticoagulante en el posquirúrgico temprano.
Pseudoaneurismas y fístulas arteriovenosas
Son complicaciones vasculares infrecuentes (menos del 4% de nuestros casos), que se pueden observar en los sitios de anastomosis vasculares, sitios de realización previa de biopsias o como consecuencia de infecciones. Generalmente, son asintomáticas y se objetivan en los estudios realizados por otras razones.
La TC es una buena alternativa diagnóstica, cuando con la ecografía Doppler no se puede definir la naturaleza de la lesión. En el caso de la TC con contraste, se puede evidenciar una imagen ovalada o redondeada con realce similar al pool vascular (Fig. 5) (17) .

Fig. 5: Fístula arteriovenosa. (a) TCMD con reconstrucción volume rendering. (b) Reconstrucción MIP (Maximum Intensity Projection) en el plano coronal. (c) Reconstrucción MIP en el plano axial. Se observa realce temprano y tortuosidad de las venas del injerto (cabeza de flecha) y de la vena ilíaca del receptor (flecha) debido a la presencia de una fístula arteriovenosa formada a los 7 días de realizado el trasplante. Se decidió no embolizarla por el normal funcionamiento del injerto y su tamaño.
La mayoría de las veces son pequeñas y de resolución espontánea, pero si persisten o aumentan de tamaño, deberá plantearse su embolización debido al riesgo de rotura (27).
COMPLICACIONES NO VASCULARES
Oclusión intestinal
Las dos causas más importantes de obstrucción intestinal son las adherencias y las hernias internas (14). Su diferenciación es de gran importancia debido a que estas últimas presentan una tasa de estrangulación mucho más alta (28).
El defecto mesentérico postrasplante está limitado: posteriormente por la aorta y las arterias ilíacas, superiormente por el mesenterio del intestino delgado, anteriormente por el páncreas con la anastomosis e inferiormente por la anastomosis vascular. El yeyuno puede ser atrapado posteriormente en relación con el páncreas (14).
En la TCMD se evidencian asas de yeyuno íleon proximal distendidas, con cambio de calibre de las asas cercano a la anastomosis intestinal y asas de íleon colapsadas distales a la anastomosis (Fig. 6).

Fig. 6: Oclusión intestinal. TCMD sin contraste, cortes coronales. Se identifica dilatación de las asas del intestino delgado (flechas) proximal a la anastomosis látero-lateral del duodeno trasplantado con el íleon. En la fosa ilíaca derecha se identifican asas de íleon distal a la anastomosis colapsadas (cabeza de flechas). Se realizó laparotomía para la liberación del asa. La evolución fue satisfactoria.
Fístula pancreática
Su incidencia ha disminuido en los últimos años y actualmente menos del 1% de los injertos se pierden por esta causa (29). En nuestra muestra, sólo hubo dos casos que evolucionaron adecuadamente sin la pérdida del injerto, gracias a la intervención temprana del equipo de trasplante. Generalmente, se asocian a problemas en la técnica quirúrgica, rechazo agudo, pancreatitis, duodenitis por reperfusión o infección. Se las reconoce como colecciones peripancreáticas, las cuales muestran altos niveles de amilasa si se realiza punción, y suelen requerir cirugía de urgencia (Fig. 7) (30).

Fig. 7: Fístula pancreática. TCMD con contraste EV en la que se identifica, en corte coronal, una colección de bordes definidos (C) en la proximidad de la cabeza del páncreas trasplantado (P). En el contexto de un dolor abdominal y fiebre, se decidió realizar una laparotomía exploradora, en la cual se extrajo material líquido rico en enzimas pancreáticas, confirmando el diagnóstico de fístula. Se realizó colocación de drenaje y nutrición parenteral asociada a octreotide para disminuir la secreción pancreática y favorecer el cierre de la fístula.
Infecciones
No sólo resultan frecuentes, sino que además son graves, ya que reducen de forma significativa la supervivencia del injerto y del paciente. Las infecciones intraabdominales precoces pueden causar peritonitis (infección difusa) o abscesos (localizada), y es común que se asocien a otras complicaciones.
La infección puede producir pancreatitis del injerto, fuga pancreática por afectación del segmento duodenal del donante o perforación intestinal (causando neumoperitoneo) (Fig. 8).

Fig. 8: Neumoperitoneo. TCMD con contraste, corte axial abdominal (a) alto y (b) bajo. Se identifica neumoperitoneo (N) en paciente con dolor abdominal agudo, trasplantado de riñón (RTx) y páncreas (P).
Rechazo
El rechazo es una causa común que genera la pérdida del órgano trasplantado. Puede ser hiperagudo, agudo o crónico. En el caso del rechazo agudo, su incidencia actual es del 15% (mientras que hace 9 años oscilaba entre el 60% y 80%) (4,24,31).
En lo que respecta a su expresión tomográfica, puede evidenciarse heterogeneidad del parénquima y alteración del tamaño y forma. Sin embargo, estos hallazgos no son específicos, ya que también pueden encontrarse en la pancreatitis y sus complicaciones (17,27).
La mejor forma de confirmar el rechazo es mediante la biopsia guiada por imágenes (17) .
Pancreatitis del injerto
Es una complicación frecuente. En nuestra serie se observó en el 12% de los casos (una cifra similar a la publicada por otras instituciones) (17). Sus causas pueden ser múltiples y entre ellas se encuentran la pancreatitis posreperfusión, el rechazo agudo y las infecciones.
Se puede identificar un aumento focal o difuso del tamaño del páncreas, una disminución y/o heterogeneidad de la densidad del parénquima y un borramiento de los bordes de la glándula.
Los cambios peripancreáticos incluyen densidades lineales en la grasa, borramiento de los planos grasos y líquido periférico a la glándula. La inyección de contraste endovenoso produce realce heterogéneo del parénquima y la necrosis se expresa como áreas con ausencia de realce (algo visible en el 4% de los trasplantes) (30).
Es importante destacar que son relativamente frecuentes los cuadros de pancreatitis edematosa en el período temprano postrasplante (primeras 36 horas), debido a una injuria de reperfusión. En la mayoría de los casos son cuadros autolimitados (25).
Colecciones
El hallazgo de una colección periinjerto abre un amplio abanico de diagnósticos diferenciales (entre ellos, pseudoquiste, hematoma, linfocele o absceso).
Los hallazgos tomográficos suelen ser inespecíficos, por lo que su correlato con la clínica y el laboratorio será fundamental para un correcto diagnóstico. Si esto aún resulta insuficiente, se puede optar por la realización de una punción-aspiración percutánea guiada por tomografía o ecografía (10,17).
El pseudoquiste es una de las complicaciones vinculadas a la pancreatitis del injerto. Puede aparecer en relación con los tejidos regionales o en el espesor del injerto, y puede sobreinfectarse (17).
El hematoma suele ser el resultado de una falla en la anastomosis arterial o en los vasos mesentéricos superiores ligados. Clínicamente puede ser asintomático o presentarse con signos asociados a la disminución del hematocrito. En la TC sin contraste se evidencia con colecciones líquidas de elevada atenuación (Fig. 9). Si el sangrado es activo, en las fases venosa o arterial se puede detectar contraste extravasado, requiriendo una reintervención de urgencia (10).

Fig. 9: Hematoma. (a) Corte axial. Paciente anticoagulado por trombosis presenta, adyacente al páncreas (P), una colección de contenido heterogéneo con áreas hiperdensas, compatible con hematoma (H). (b) Corte coronal, en el cual se pueden observar las diferencias imagenológicas descritas en el texto entre una verdadera colección (C) y el duodeno (D).
Los abscesos pueden formarse de novo o provenir de la infección de un pseudoquiste o fístula duodenal. En las imágenes tomográficas se identifican acúmulos loculados de líquido, que pueden contener burbujas aéreas en su interior y/o cambios inflamatorios en el tejido graso que lo rodea (Fig. 10).

Fig. 10: Absceso. Paciente febril con leucocitosis. (a) Se realizó TCMD con contraste endovenoso, corte coronal, que evidenció colección loculada (C) con paredes (flecha) que realzaron luego de la administración de contraste endovenoso. Páncreas (P). (b) Se interpretó como un absceso y se decidió colocar un catéter de drenaje multipropósito guiado por TC.
El desconocimiento de la anatomía posquirúrgica de estos pacientes puede llevar a errores de interpretación y a una confusión del segmento del duodeno trasplantado con una colección. Esto podría significar una reintervención quirúrgica innecesaria. Las claves para evitar este error son constatar la presencia de contraste oral en su interior y los pliegues mucosos (de ser una colección verdadera la pared será lisa), pero el dato más importante es la topografía en la que se encuentra la imagen (Fig. 9).
CONCLUSIÓN
La TCMD es un método de gran utilidad a la hora de evaluar pacientes con trasplante renopancreático. Un conocimiento cabal de la particular anatomía posquirúrgica y de las posibles complicaciones es crucial para poder orientar el seguimiento y tratamiento de estos pacientes.
Agradecimientos
A la indispensable colaboración de: P. Barros Schelotto, G. Pfaffen, M. Mela, A. Marrero, V. Carrozza, A. Martínez, C. Legarreta, M. Castignola, G. Bisignano, H. Juárez, L. Peredo, G. Saire, J. Bernasconi, F. Maldonado; y a Magdalena Paladini, por el diseño y edición de la Figura 1.
Los autores del trabajo declaran no tener ningún conflicto de intereses.
1. Gruessner AC, Sutherland DE. Pancreas transplant outcomes for United States (US) and non-US cases as reported to the United Network for Organ Sharing (UNOS) and the International Transplant Registry (IPTR) as of June 2004. Clin Transplant 2005; 19:433-55. [ Links ]
2. Robertson RP, Davis C, Larsen J, Stratta R, Sutherland DE. Pancreas and islet transplantation for patients with diabetes. Diabetes Care 2000; 23:112-6. [ Links ]
3. Sutherland DE, Gruessner RW, Dunn DL, et al. Lessons learned from more than 1,000 pancreas transplants at a single institution. Ann Surg 2000; 233; 4:463-501. [ Links ]
4. Gruessner AC. 2011 update on pancreas transplantation: comprehensive trend analysis of 25,000 cases followed up over the course of twenty-four years at the Interantional Pancreas Transplant Registry (IPTR). Rev Diabet Stud 2011; 8:6-16. [ Links ]
5. Ming CS, Chen ZH. Progress in pancreas transplantation and combined pancreas-kidney transplantation. Hepatobiliary Pancreat Dis Int 2007; 6:17-23. [ Links ]
6. INCUCAI. Memorias 2010. Procuración y trasplante de órganos, tejidos y células en Argentina. Disponible en (Available at): http://www.incucai.gov.ar/docs/otros_documentos/memoria10_incucai.pdf. Accedido (Accessed): diciembre, 2012. [ Links ]
7. Moulton JS, Munda R, Weiss MA, Lubbers DJ. Pancreatic transplant: CT with clinical and pathologic correlation. Radiology 1989; 172:21-6. [ Links ]
8. Dachman AH, Newmark GM, Thistlethwaite JR Jr, Oto A, Bruce DS, Newell KA. Imaging of pancreatic transplantation using portal venous and enteric exocrine drainage. AJR Am J Roentgenol 1998; 171:157-63. [ Links ]
9. Freund MC, Steurer W Gassner EM, et al. Spectrum of imaging findings after pancreas transplantation with enteric exocrine drainage: Part 1, posttransplantation anatomy. AJR Am J Roentgenol 2004; 182:911-7. [ Links ]
10. Hampson FA, Freeman SJ, Ertner J, et al. Pancreatic transplantation: surgical technique, normal radiological appearances and complications. Insights Imaginig 2010; 1:339-47. [ Links ]
11. Ojo AO, Meier-Kriesche HU, Hanson JA, et al. The impact of simultaneous pancreas-kidney transplantation on long-term patient survival. Transplantation 2001; 71:82-90. [ Links ]
12. Leichtman AB, Cohen D, Keith D, et al. Kidney and pancreas transplantation in the Unites States, 1997-2006: the HRSA Breakthrough Collaboratives and the 58 DSA Challenge. Am J Transplant 2008; 8:946-57. [ Links ]
13. Smets YF, Westendrop RG, Van Der Pijil JW, et al. Effect of simultaneous pancreas-kidney transplantation on mortality of patients with type-1 diabetes mellitus and end-stage renal failure. Lancet 1999; 353:1915-9. [ Links ]
14. Lall CG, Sandrasegaran K, Maglinte DT, Fridell JA. Bowel complications seen on CT after pancreas transplantation with enteric drainage. AJR Am J Roentgenol 2006; 187:1288-95. [ Links ]
15. Sandrasegaran K, Lall C, Berry WA, Hameed T, Maglinte DD. Enteric drainage pancreatic transplantation. Abdom Imaginig 2006; 31:588-95. [ Links ]
16. Dumas MD, Bude RO, Sonda PL 3rd, Cohan RH, Merion RM. Urethral disruption with urinary extravasation: a delayed complication of pancreatic transplantation. Radiology 1996; 201:761-5. [ Links ]
17. Dillman JR, Elsayes KM, Bude RO, Platt JF, Francis IR. Imaging of pancreas transplants: postoperative findings with clinical correlation. J Comput Assist Tomogr 2009; 33:609-17. [ Links ]
18. Jiménez-Romero C, Manrique A, Meneu JC, et al. Comparative study of bladder versus enteric drainage in pancreas transplantation. Transplant Proc 2009; 41:2466-8. [ Links ]
19. Young CJ. Are there still roles for exocrine bladder drainage and portal venous drainage for pancreatic allografts? Curr Opin Organ Transplant 2009; 14:90-4. [ Links ]
20. Krishnamurthi V, Philosophe B, Bartlett ST. Pancreas transplantation: contemporary surgical techniques. Urol Clin North Am 2001; 28:833-8. [ Links ]
21. Eubank W, Schmidel U, Levy A. Venous thrombosis and occlusion after pancreas transplantation: evaluation with breath-hold gadolinium-enhanced three-dimensional MR imaging. AJR Am J Roentgenol 2000; 175:381-5. [ Links ]
22. Jiménez CM, García Roca R, Fernández-Cruz L. Trasplante de páncreas: aspectos quirúrgicos. Actualizaciones en Trasplante 2009; 1:393-9. [ Links ]
23. Foshager MC, Hedlund LJ, Troppmann C, Benedetti E, Gruessner RW. Venous thrombosis of pancreatic transplants: diagnosis by duplex sonography. AJR Am J Roentgenol 1997; 169:1269-7. [ Links ]
24. Krebs TL, Dally B, Wong-You-Cheong JJ, Carroll K, Bartlett ST. Acute pancreatic transplant rejection: evaluation with dynamic contrast-enhanced MR imaging compared with histopathologic analysis. Radiology 1999; 210:437-42. [ Links ]
25. Freund MC, Steurer W Gassner EM, et al. Spectrum of imaging findings after pancreas transplantation with enteric exocrine drainage: Part 2, posttransplantation complications. AJR Am J Roentgenol 2004; 182:919-25. [ Links ]
26. Gupta R, Rottenberg G, Taylor J. Pseudothrombosis of the iliac vein in patients following combined kidney and pancreas transplantation. Br J Radiol 2002; 75:692-4. [ Links ]
27. Heller MT, Hattoum A. Kidney-pancreas transplantation. Assessment of key imaging findings in the acute setting. Emerg Radiol 2012; 19:527-33. [ Links ]
28. Sandrasegaran K, Maglinte DD. Imaging of small bowel-related complications following major abdominal surgery. Eur J Radiol 2005; 53:374-86. [ Links ]
29. Mompo E, Brulles R. Diabetes y trasplante de páncreas. Nutr Hosp 2008; 23:64-70. [ Links ]
30. Franca M, Certo M, Martins L, et al. Imaging of pancreas transplantation and its complications. Insights Imaging 2010; 5:329-38. [ Links ]
31. Stratta RJ, Taylor RS, Bynon JS. Patterns of rejection after combined pancreas-kidney transplantation. Transplant Proc 1994; 26:524-5. [ Links ]













