Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista argentina de radiología
On-line version ISSN 1852-9992
Rev. argent. radiol. vol.77 no.2 Ciudad Autónoma de Buenos Aires June 2013
http://dx.doi.org/10.7811/rarv77n2a02
TORAX - Puesta al día
Nódulos pulmonares subsólidos en tomografía computada multicorte. Características y diagnósticos diferenciales con el adenocarcinoma de pulmón.
Ramiro Orta, Lisandro Paganini, Kevin M. Davies, Mercedes L. Dalurzo, Marina Ulla, Ricardo García Mónaco
Hospital Italiano de Buenos Aires, Buenos Aires, Argentina.
Correspondencia: Dr. Ramiro Orta ramiro.orta@hospitalitaliano.org.ar
Recibido: noviembre 2012; aceptado: abril 2013
Received: november 2012; accepted: april 2013
doi: 10.7811/rarv77n2a02
Resumen
En el último tiempo se ha incrementado la detección de nódulos pulmonares, debido al uso de la tomografía computada multicorte (TCMC) y a la implementación de métodos de cribado de cáncer de pulmón mediante el uso de la tomografía computada (TC) de baja dosis. Esto ha despertado especial interés en los nódulos de tipo subsólido por su probabilidad de tener una etiología maligna, en particular el adenocarcinoma (ADC).
Con el análisis minucioso de las imágenes adquiridas en la tomografía computada multicorte se pueden identificar las características morfológicas de cada nódulo y realizar una correlación en forma aproximada con su probable anatomía patológica. La evaluación, junto con el contexto clínico-epidemiológico del paciente, hace posible un diagnóstico presuntivo y un pronóstico aproximado, permitiendo determinar las conductas terapéuticas o los planes de seguimiento.
Palabras clave. Nódulo pulmonar subsólido; Adenocarcinoma de pulmón; Tomografía computada multicorte.
Abstract
Subsolid pulmonary nodules at multislice computed tomography. Characteristics and differential diagnosis with lung adenocarcinoma.
In recent years, detection of pulmonary nodules has increased as a result of the use of multislice computed tomography (MSCT) and the implementation of lung cancer screening programs with low-dose computed tomography (CT). This has raised special interest in the subsolid type of nodules because of their probable malignant etiology, especially adenocarcinoma (ADC).
With a thorough analysis of multislice computed tomography images, it is possible to identify certain morphological characteristics of each nodule and to make an approximate correlation with its probable histology considering the clinical and epidemiological context of the patient. This allows for a presumptive diagnosis and an approximate prognosis, on which we can base decisions on therapeutic management and follow-up procedures.
Keywords. Subsolid pulmonary nodules; Lung adenocarcinoma; Multislice computed tomography.
OBJETIVO
Enfatizar la utilidad de la tomografía computada multicorte (TCMC) para la caracterización de los nódulos pulmonares subsólidos (NPSS) y su diagnóstico diferencial con el adenocarcinoma (ADC) de pulmón y otras etiologías benignas, como los focos de fibrosis y focos inflamatorios o infecciosos.
INTRODUCCIÓN
El ADC es el tipo histológico más frecuente de cáncer de pulmón, representando aproximadamente el 45% de los tumores pulmonares primarios. Recientemente se ha confirmado que el cribado de cáncer de pulmón mediante el uso de la tomografía computada (TC) de baja dosis ha disminuido considerablemente la mortalidad por esta enfermedad, con respecto al cribado mediante los rayos X (Rx) de tórax, en pacientes de alto riesgo, fumadores y ex-fumadores de entre 55 y 74 años (1). Una consecuencia inmediata de esta confirmación es el aumento en el volumen de pacientes estudiados con TC. Además, la amplia difusión del uso de la TCMC ha incrementado la detección de los nódulos pulmonares (2).
La presencia de nódulos pulmonares en los estudios de TC realizados en programas de detección temprana del cáncer de pulmón (cribado) varía entre un 10% y un 23%, según las distintas series (3).
Definiciones
El nódulo pulmonar se define como un área de aumento de atenuación, redondeada u oval, que no supera los tres centímetros de diámetro. Dependiendo de la densidad tomográfica, estos nódulos pueden clasificarse en sólidos o subsólidos (4).
El nódulo sólido representa un área de aumento de atenuación, debido a un colapso del espacio aéreo, que impide ver las estructuras subyacentes del parén-quima pulmonar normal (Fig. 1). En cambio, los nódulos subsólidos incluyen, a su vez, aquellas opacidades en vidrio esmerilado puro (VEP) y los nódulos mixtos (4). El nódulo en VEP (Fig. 2) es un área de aumento de atenuación focal que no oculta ni impide ver los vasos subyacentes (4), mientras que los nódulos mixtos presentan, además del componente en vidrio esmerilado, una porción sólida variable (4) (Fig. 3).

Fig. 1: Nódulo pulmonar sólido (flechas). TCMC, cortes axial (a) y sagital (b), en el segmento posterior del lóbulo superior derecho. El mismo mide 10 mm, presenta bordes bien definidos, sin bronco-gama aéreo en su interior.
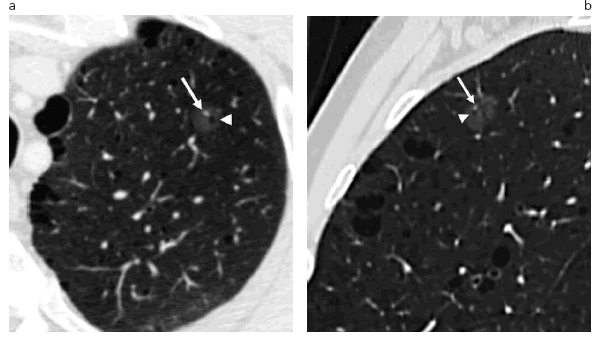
Fig. 2: Nódulo subsólido en vidrio esmerilado puro. TCMC, cortes axial (a) y sagital (b), en el segmento ápico-posterior del lóbulo superior izquierdo. A través del nódulo puede observarse una estructura vascular (flecha) y otra bronquial (punta de flecha). Presencia de bullas subpleurales.
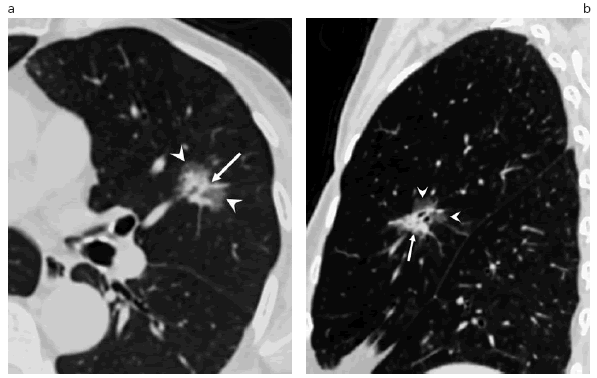
Fig. 3: Nódulo mixto. TCMC, cortes axial (a) y sagital (b), a nivel del pulmón izquierdo. Porción sólida central de bordes espiculados (flecha) y un componente en vidrio esmerilado periférico (puntas de flecha).
En el presente trabajo se hace especial hincapié en los NPSS (tanto VEP como mixtos). Si bien este tipo de nódulos puede ser de etiología benigna (focos de fibrosis, inflamación o hemorragia), no es infrecuente que corresponda a un adenocarcinoma de pulmón (2).
Clasificación anatomopatológica
En 1995 Noguchi y cols. publicaron un trabajo basado en el estudio de 236 ADC periféricos menores de 2 cm y establecieron 6 tipos (A-F) en relación con el patrón de crecimiento tumoral (5,6).
. Tipo A. Carcinoma bronquioloalveolar (CBA) localizado sin colapso pulmonar ni fibrosis (mínimo engrosamiento septal): 7%.
. Tipo B. CBA localizado con focos de colapso pulmonar (debido a la degeneración celular tumoral): 7%.
. Tipo C. CBA localizado con focos de proliferación fibroblástica activa (es el más frecuente y suele originar retracciones pleurales): 60%
. Tipo D. Adenocarcinoma pobremente diferenciado: 18%.
. Tipo E. Adenocarcinoma tubular (se originan en células glandulares bronquiales): 4%.
. Tipo F. Adenocarcinoma papilar con crecimiento compresivo y destructivo: 4%.
En 1999 y nuevamente en el 2004, la clasificación de la Organización Mundial de la Salud (OMS) determinó que, para definir un CBA, éste debe tener un patrón de crecimiento de tipo puramente lepídico (es decir, tener un crecimiento exclusivo que revista espacios alveolares preexistentes). No debe existir invasión estromal, vascular o pleural, por lo que los tipos A y B de Noguchi se consideran estrictamente como un CBA y el tipo C (que tiene cualidades del CBA, pero con un componente invasivo) pasa a ser denominado subtipo mixto (4,7).
En la clasificación se menciona como lesión pre-maligna a la hiperplasia adenomatosa atípica (HAA). Ésta se define como una proliferación de células epiteliales atípicas, que involucra al revestimiento alveolar y los bronquiolos respiratorios menores de 5 mm. En la TCMC puede verse como una opacidad focal, redonda u oval, de bordes bien definidos, con patrón en VEP, sin espículas o retracciones pleurales persistentes en el tiempo. La HAA ocurre con más frecuencia en pacientes que padecen o padecieron con anterioridad un adenocarcinoma de pulmón (2,4,8).
En febrero del 2011 se publicó con un enfoque interdisciplinario una nueva clasificación del ADC, surgida del trabajo conjunto entre la International Association for the Study of Lung Cancer, la American Thoracic Society y la European Respiratory Society.
Tanto la clasificación del 2004 como la del 2011 se resumen en la Tabla 1(9). Como vemos, dentro de los subtipos de ADC, se encuentra el carcinoma bronquioloal-veolar/ adenocarcinoma in situ (CBA/AIS), el cual presenta características epidemiológicas, clínico-patológicas y radiológicas propias. Éste es más frecuente en mujeres jóvenes y es el que menor asociación tiene con el cigarrillo. Su localización es periférica y se caracteriza por un crecimiento exclusivo que reviste espacios alveolares preexistentes. Además, tiene un crecimiento lento y en la mayoría de los casos es asintomático. Hasta en un 27% puede presentarse en forma multifocal (4,10).
La nueva clasificación se destaca por remarcar el carácter no invasivo del CBA, llamándolo adenocarci-noma in situ y caracterizándolo como una lesión preinvasiva.
Dentro del patrón de crecimiento lepídico, encontramos los tipos A y B de Noguchi, ambos englobados por la OMS en el 2004 bajo el término CBA. Éste, en la actualidad, con la nueva clasificación abarca a las lesiones preinvasivas, como la HAA y el adenocarcinoma in situ. El tipo C de Noguchi presenta un componente invasivo de proporción variable, por lo que se lo consideró en el 2004 como un subtipo mixto y actualmente representa en cierta forma al adenocarcinoma mínimamente invasivo de la clasificación interdisciplinaria (4). Además, debemos agregar que estos subtipos, tanto el ADC in situ como los mínimamente invasivos, sólo pueden aplicarse a tumores menores de 3 cm (estudiados en su totalidad). La importancia de estas categorías se debe a que el ADC in situ y el mínimamente invasivo tienen una elevada sobrevida (cercana al 100%) en comparación con el ADC invasivo (11).
Características en TCMC
Con respecto a las características tomográficas, los tipos varían entre ellos. Mientras el A y B de Noguchi suelen tener más componente en vidrio esmerilado y ser de bordes redondeados, el tipo C combina un aspecto en vidrio esmerilado con un componente sólido (cuyas relaciones porcentuales son variables y de las cuales se desprende un factor pronóstico importante) (2). Este último, además, presenta con más frecuencia bordes lobulados e irregulares, engrosamientos pleurales y espiculaciones. La presencia de broncograma aéreo y/o burbujas dentro del nódulo es común sobre todo en el tipo C de Noguchi y poco habitual en los no-lepídicos.
Tabla 1: Clasificación del 2004 y 2011 de los adenocarcinomas de pulmón.
| OMS 2004 INTERDISCIPLINARIA 2011 | |||
| Lesiones preinvasivas | HAA | Lesiones preinvasivas | HAA Adenocarcinoma in situ (ex CBA) |
| Carcinoma bronquioloalveolar | CBA no mucinoso, mucinoso o mixto | Adenocarcinoma mínimamente invasivo | Adenocarcinoma con patrón de crecimiento predominantemente de tipo lepídico, con pequeño foco de invasión inferior a los 5 mm. |
| Adenocarcinomas invasivos (sin CBA) | Adenocarcinoma mixto | Adenocarcinoma invasivo | Adenocarcinoma con patrón de crecimiento predominantemente de tipo lepídico con foco de invasión que supera los 5 mm. |
| Adenocarcinoma acinar | Adenocarcinoma predominantemente acinar | ||
| Adenocarcinoma papilar | Adenocarcinoma predominantemente papilar | ||
| Adenocarcinoma predominantemente micropapilar | |||
| Adenocarcinoma sólido con producción de mucina | Adenocarcinoma predominantemente sólido con producción de mucina | ||
Con respecto a los nódulos no-lepídicos, los tipos D, E y F de Noguchi, que actualmente representan al ade-nocarcinoma invasivo, tienen un crecimiento expansivo que comprime y destruye al parénquima pulmonar adyacente. Son claramente invasivos, crecen más rápido y tienen peor pronóstico que los lepídicos. Las metástasis ganglionares (como las recurrencias) se observan con más frecuencia. Además, suele haber engrosamientos pleurales y espiculaciones. Debido a su comportamiento invasivo, es común que presenten un aspecto consolidativo y sólido, donde por lo general no se identifica broncograma aéreo ni burbujas (4,12).
Correlación de TCMC con los hallazgos histológicos
A través de varios estudios se ha establecido una buena correlación entre la anatomía patológica, la imagen en TCMC y el pronóstico de la enfermedad (Tabla 2) (4). Si bien la TCMC no puede confirmar el origen benigno o maligno, sí puede hacer una aproximación teniendo en cuenta algunas de las características de los nódulos.
El tamaño, los bordes y la presencia de componente sólido han sido los factores más determinantes al momento de definir la benignidad o una naturaleza maligna. Para los nódulos VEP, un tamaño superior a los 8 mm y la presencia de bordes lobulados son factores independientes de malignidad, mientras que un nódulo VEP que mide 4 mm o menos es considerado benigno.
En los nódulos mixtos el mayor riesgo de malignidad se asocia a la presencia de bordes lobulados (aunque no se pudo establecer un punto de corte con respecto al tamaño de la lesión, ya que pequeñas lesiones resultaron malignas) (4,13). En estos casos, el mayor tamaño del componente sólido se asocia a un peor pronóstico, mientras que en los que predomina el componente en vidrio esmerilado (más del 50%) se han demostrado estadios tempranos de la enfermedad y mejor pronóstico (2,14).
Un nódulo pulmonar subsólido tiene más probabilidades de ser maligno que uno sólido (en particular el tipo mixto, que es el que más riesgos presenta) (13,15). Con respecto a los nódulos VEP, estos son malignos hasta en un 20-40%, mientras que el resto se debe a procesos benignos, como focos de fibrosis o focos inflamatorios, hemorrágicos o infecciosos (2).
El comportamiento en el tiempo es un factor muy importante para predecir el origen del nódulo. La mayoría de los procesos benignos resuelven en forma espontánea o, luego de un tratamiento adecuado, en semanas o meses, a la vez que mejoran clínicamente. Los nódulos malignos pueden permanecer sin cambios por mucho tiempo (dos o tres años) hasta presentar algún incremento en su tamaño o densidad, y durante ese período suelen ser completamente asintomáticos (2).
Para intentar predecir el posible comportamiento de los NPSS con respecto a su persistencia o regresión en el tiempo, se han evaluado aspectos morfológicos de los nódulos y características clínicas de los pacientes. Un nódulo se define como transitorio cuando, después de un seguimiento de tres meses, se constata una reducción en el tamaño de al menos el 20% (con respecto a la TC inicial). Si ha transcurrido ese período de tiempo y el nódulo tiene el mismo tamaño o ha aumentado, se lo denomina persistente(15).
Tabla 2: Correlación entre la anatomía patológica, la TCMC y la sobrevida a los 5 años.
| Histología (Noguchi 1995) | Clasificación interdisciplinaria 2011 | TCMC | Sobrevida a los 5 años |
| Tipo A | HAA ADC in situ | Vidrio esmerilado puro Bordes redondeados | 100% |
| Tipo B | Vidrio esmerilado heterogéneo Bordes redondeados | Cercano al 100% | |
| Tipo C | ADC mínimamente invasivo | Mixto (VEP y componente sólido) Bordes lobulados e irregulares Engrosamiento pleural Espiculaciones Broncograma aéreo/burbujas | Superior al 75% |
| Tipo D, E y F | ADC invasivo | Sólido o predominantemente sólido Bordes redondeados Engrosamiento pleural Espiculaciones NO broncograma aéreo/burbujas Metástasis ganglionares y recurrencias frecuentes | Inferior al 50% |
En el caso de los nódulos transitorios, estos se han encontrado con más frecuencia en mujeres y adultos-jóvenes, con antecedentes de tabaquismo de jerarquía (un paquete diario por 30 años), y en aquellos con eosinofilia en sangre periférica (12). Con respecto a las características morfológicas, en este mismo estudio se vio que las lesiones múltiples de contornos no espiculados y bordes mal definidos orientaron hacia un comportamiento transitorio, mientras que todos los nódulos con márgenes espiculados, broncograma aéreo, burbujas o retracciones pleurales fueron persistentes (15).
Conceptos técnicos sobre la evaluación del NPSS
En la evaluación inicial y el seguimiento de un NPSS es útil determinar, primero, la forma en que va a ser estudiado el nódulo para luego poder realizar estudios comparativos fidedignos. Existen dos características esenciales a tener en cuenta en el momento de realizar la evaluación inicial y el posterior seguimiento: una es el tamaño y la otra, la densidad tomográfica.
La medición de los diámetros es un método poco exacto, ya que frecuentemente existen diferencias entre observadores y, además, las pequeñas variaciones de longitud no reflejan realmente el incremento del volumen de la lesión estudiada. Como método complementario para poder calcular si un nódulo ha aumentado de tamaño, se recomienda el uso de la volumetría pulmonar (Fig. 4). Esta técnica nos permite medir (de manera automática a través de un software específico) el tiempo de duplicación del nódulo y, de esa manera, podemos conocer su comportamiento biológico.
Fig. 4: Mujer de 67 años de edad. (a) TCMC: nódulo en vidrio esmerilado, de 11,5 mm de diámetro mayor y un volumen de 0,57 ml, de aspecto heterogéneo y con bordes irregulares, en el segmento ápico-posterior del lóbulo superior izquierdo (flecha). (b) El seguimiento con TCMC demostró que, a los dos años, el nódulo (flecha) presentaba un leve incremento de su diámetro mayor (13 mm), pero un volumen que duplicaba al inicial (1,26 ml) (c). Además, tenía un aumento de la densidad tomográfica asociado a un aspecto más compacto con respecto al anterior. Se realizó el estudio PET/TC y no se encontró incremento de la actividad metabólica. Debido al aumento del volumen-tamaño y de la densidad del nódulo durante un período de dos años, se decidió realizar una lobectomía superior izquierda con diagnóstico de ADC invasor predominantemente acinar.
Tal como mencionamos anteriormente, pequeñas modificaciones en la medida del nódulo traducen cambios significativos en el volumen. Si a esto le sumamos que muchos de los ADC de pulmón son de crecimiento lento, para cuando existe un claro incremento en el tamaño es probable que ya el volumen del nódulo se haya duplicado más de una vez y el pronóstico sea menos favorable (16).
La otra característica a evaluar en el seguimiento es la densidad tomográfica de los NPSS, ya que estos pueden permanecer sin cambios o incrementar la densidad (en forma difusa o focal) y adquirir mayor componente sólido (lo cual se asocia a una mayor invasión estromal y a un peor pronóstico).
Para medir el tamaño de un NPSS suele utilizarse la ventana apropiada para el pulmón, mientras que para medir la porción sólida en un nódulo mixto suele tomarse el diámetro de mayor longitud en el eje axial, evaluando la imagen con ventana adecuada para el mediastino (12).
Rol de la tomografía por emisión de positrones con fluorodesoxiglucosa (FDG)
El rol de la tomografía por emisión de positrones (PET/TC) para la caracterización de los NPSS no está NPSS en TCMC. Características y diagnósticos diferenciales con el ADC de pulmón completamente definido. En las lesiones pequeñas inferiores al centímetro de diámetro y con aspecto en vidrio esmerilado puro, como el caso de la HAA y el adenocarcinoma in situ, el análisis por PET/TC es de limitada utilidad. Al ser lesiones no invasivas y de bajo metabolismo, el estudio arroja resultados negativos en la gran mayoría de los casos (falsos negativos cercanos al 100%). Tampoco sería útil en estos casos para evaluar la enfermedad a distancia, ya que el riesgo de diseminación es casi nulo (12).
Distinto es el caso de sospecha de un adenocarcinoma invasivo o mínimamente invasivo. Como su nombre lo indica, estos nódulos tienen un componente invasor que aumenta las probabilidades de demostrar la hipercaptación de la lesión. Además, en estos casos, la conducta generalmente es quirúrgica, por lo que una mejor caracterización, junto con la estadifica-ción preoperatoria, justifica el empleo del estudio PET/TC, sobre todo teniendo en cuenta el mayor riesgo de metástasis en este grupo.
Para las lesiones sólidas superiores al centímetro de diámetro, la PET/TC tiene una sensibilidad y especificidad del 96% y 88%, respectivamente (4).
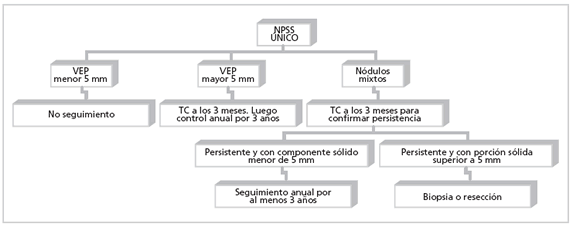
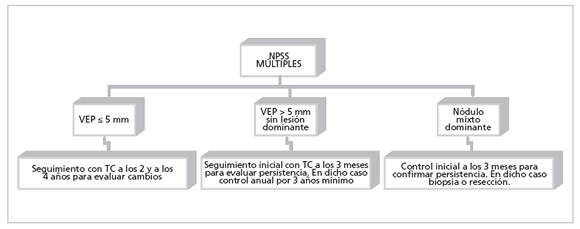
Algoritmo para el manejo de los NPSS, según la Sociedad Fleischner
La Sociedad Fleischner publicó en el año 2005 un trabajo orientado al manejo de los nódulos pulmonares sólidos hallados incidentalmente en TC. Recientemente, publicó un nuevo artículo para la orientación en el manejo de los nódulos pulmonares subsólidos (11).
Este último trabajo incluye consejos para el manejo de los NPSS únicos (algoritmo 1) y múltiples (algoritmo 2). Además, resalta que, a pesar de las pautas generales para cada tipo de nódulo, siempre debe evaluarse cada caso en forma particular, junto con sus antecedentes clínico-epidemiológicos (11).
CASOS CLÍNICOS
Foco de hiperplasia adenomatosa atípica
Mujer de 31 años de edad (Fig. 5) con antecedentes de resección de adenocarcinoma en el pulmón izquierdo que se realizó una TC de control periódico.
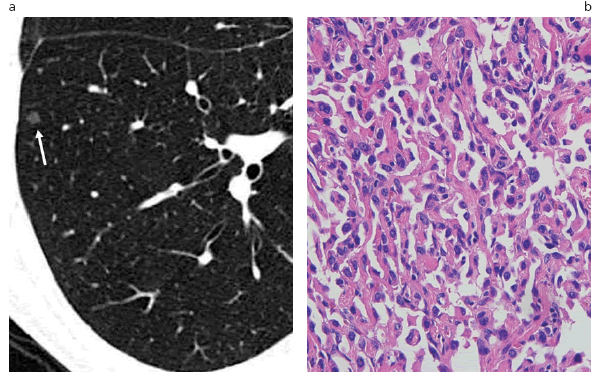
Fig. 5: (a) TC a nivel del lóbulo inferior derecho donde se observa un pequeño NPSS de aspecto en vidrio esmerilado puro y 4 mm de diámetro (flecha). (b) La anatomía patológica (hematoxilina-eosina, 200x) muestra septos levemente engrosados con tejido fibroso y epitelio de revestimiento alveolar con aumento del tamaño nuclear sin atipia. El diagnóstico resultó un foco de hiperplasia adenomatosa atípica (HAA). La imagen de la TC es característica de este tipo de lesión (una opacidad nodular en vidrio esmerilado puro, menor de 5 mm de diámetro). Concuerda con el mayor riesgo de HAA por tener el antecedente de un ADC previo. Lo que lo termina diferenciando del ADC in situ es el tamaño inferior a los 5 mm de diámetro, ya que el patrón de crecimiento es el mismo (lepídico).
Adenocarcinoma in situ
Varón tabaquista de larga data, de 72 años de edad, se realizó una TC de cribado (Fig. 6). El diagnóstico fue un ADC in situ y hubo una completa correlación entre la imagen de la TCMC (la cual mostró un nódulo de aspecto en vidrio esmerilado puro y bordes lobulados) y la anatomía patológica (que describió una lesión no invasiva con patrón de crecimiento de tipo lepídico).
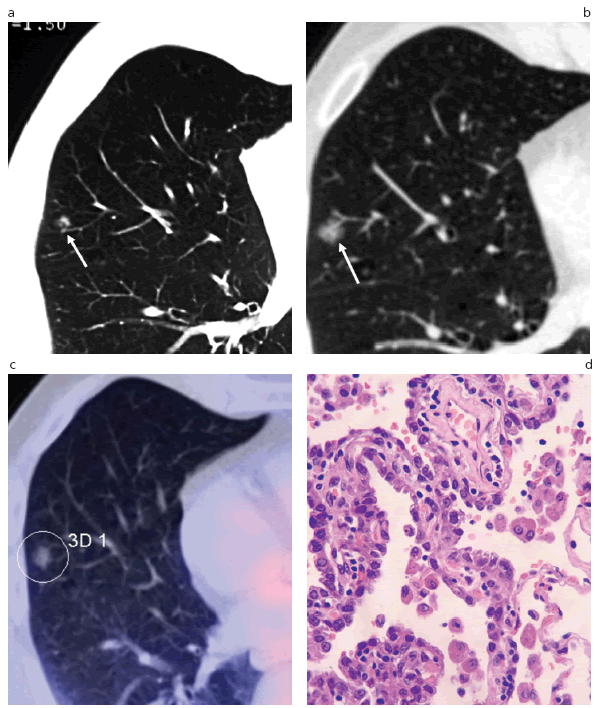
Fig. 6: (a) TC de cribado donde se observa un NPSS mal definido (flecha), localizado en el segmento lateral del lóbulo medio del pulmón derecho. Luego, (b) en la TC de seguimiento, se analiza el mismo nódulo (flecha) de contornos lobulados y aspecto en vidrio esmerilado puro, observándose una estructura vascular subyacente y un aumento de tamaño y densidad con respecto al estudio realizado dos años antes. (c) La lesión no evidencia hipercaptación de la FDG en el estudio de PET/TC, lo que indica una baja actividad metabólica. (d) La anatomía patológica (hematoxilinaeosina, 400x) muestra un crecimiento del tumor, revistiendo espacios alveolares irregulares y septos engrosados en áreas con leve infiltrado mononuclear. El margen del tumor evidencia alveolos con revestimiento tumoral que se continúan con revestimiento de aspecto normal aplanado.
Adenocarcinoma mínimamente invasivo
Hallazgo incidental en la TC realizada a una mujer de 68 años de edad por un cuadro de dolor abdominal (Fig. 7).

Fig. 7: (a) TCMC: se visualiza un NPSS en el lóbulo inferior izquierdo, de aspecto en vidrio esmerilado (flecha) con mínimo componente sólido en su interior (punta de flecha). La lesión mide 15 mm de diámetro y presenta contornos mal definidos. En el examen PET/TC la lesión no evidenció un incremento de la actividad metabólica. El diagnóstico fue un ADC mínimamente invasivo. (b) El preparado de anatomía patológica (hematoxilina-eosina, 40x) muestra la zona central del tumor con áreas de fibrosis, colapso alveolar y mayor atipia celular, en relación con el componente invasor, representado en la TCMC por las porciones sólidas más densas.
Adenocarcinoma invasivo predominantemente papilar
Mujer tabaquista de 35 años y asintomática se realizó una TCMC de tórax (Fig. 8).
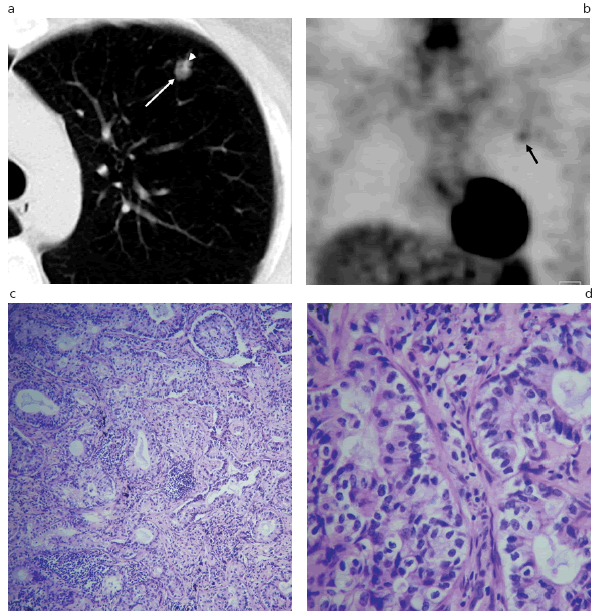
Fig. 8: (a) TCMC de tórax donde se observa un NPSS en el segmento anterior del LSI. Mide 9 mm de diámetro, tiene bordes lobulados y aspecto en vidrio esmerilado (flecha) con un componente sólido de mayor densidad de ubicación excéntrica (cabeza de flecha). (b) En la imagen de PET/TC se observa la hipercaptación de la lesión (flecha). Los preparados de anatomía patológica (c) (hematoxilina-eosina, 40x) y (d) (hematoxilinaeosina, 100x) muestran estructuras glandulares tumorales irregulares y papilas de tamaño variable, revestidas por células con núcleos hipercromáticos y citoplasma claro. El diagnóstico final fue un ADC invasivo, predominantemente papilar.
Diagnósticos diferenciales
La presencia de un nódulo pulmonar con aspecto en vidrio esmerilado, sea puro o con algún componente sólido, nos obliga a plantear el diagnóstico diferencial con distintas entidades. Como hemos mencionado, hasta un 40% de estos nódulos puede representar alguna forma de adenocarcinoma (14), mientras que otros tienen su origen en procesos benignos y rara vez son la manifestación de secundarismo pulmonar (4).
La fibrosis intersticial focal es una de las principales entidades benignas que se manifiestan como una opacidad nodular en vidrio esmerilado persistente en el tiempo, con escasos o nulos cambios. Esto plantea un difícil diagnóstico diferencial con un tumor de origen maligno. Puede tener o no un componente sólido, y el diámetro mayor no suele superar los 2 cm. La falta de espiculaciones e indentaciones pleurales sugiere una naturaleza benigna (2).
Con origen infeccioso encontramos la aspergilosis pulmonar. Ésta, en pacientes inmunodeprimidos, se manifiesta de forma invasiva como una lesión nodular de densidad de partes blandas, que se rodea de una opacidad en vidrio esmerilado, llamada "signo del halo" (Fig. 9). Éste, si bien no es un signo específico de la aspergilosis, se encuentra presente al inicio de la enfermedad en más del 90% de los casos y traduce hemorragia alveolar debida a infarto (2).
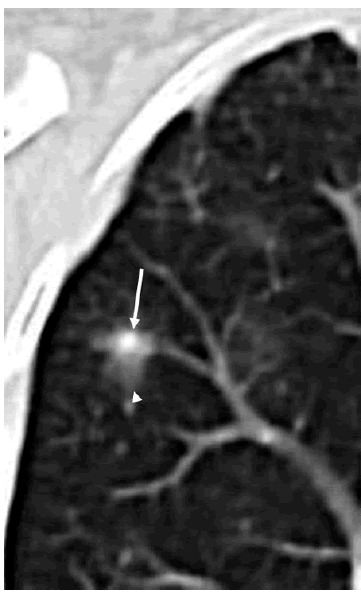
Fig. 9: Aspergilosis pulmonar invasiva. Corte coronal de TCMC a nivel del lóbulo superior derecho. Paciente febril neutropénico presenta un foco de aumento de la atenuación, de aspecto sólido central (flecha), rodeado de un halo periférico en vidrio esmerilado (punta de flecha), configurando el denominado "signo del halo".
La neumonía eosinófila es una enfermedad de origen idiopático que cursa con fiebre, tos y disnea, de meses de evolución. Puede presentarse en forma primaria o estar asociada a entidades como la sarcoidosis, las infecciones parasitarias, la vasculitis u otras. En la TC se manifiesta como opacidades en vidrio esmerilado que representan un infiltrado inflamatorio intraalveolar predominantemente eosinófilo. En ocasiones, la lesión tiene un componente sólido central en relación con un pequeño absceso (2,17).
La neumonía en organización con o sin bronquio-litis obliterante (BOOP, por sus siglas en inglés) puede ser primaria (denominada COP, por sus siglas en inglés: cryptogenic organizing pneumonia) o secundaria a infecciones, enfermedades autoinmunes o fármacos. Los hallazgos en TC incluyen la presencia de opacidades en vidrio esmerilado o consolidativas bilaterales, de distribución periférica y peribronquial. En algunos casos existen nódulos centrales de aspecto en vidrio esmerilado, rodeados de un tejido de mayor atenuación, que se denomina "signo del halo invertido" (reverse halo sign). Si bien éste es sugestivo de la enfermedad, también podemos encontrarlo en otras patologías, como las micosis(2,17).
CONCLUSIÓN
Los nódulos pulmonares subsólidos pueden corresponder a un adenocarcinoma de pulmón, pero tienen buen pronóstico en lesiones no invasivas o mínimamente invasivas. Su correcta caracterización mediante la TCMC, junto con el contexto clínico-epidemiológico del paciente, nos permite plantear un diagnóstico presuntivo con un papel relevante en la determinación de las conductas terapéuticas o los planes de seguimiento en cada caso particular.
1. National Lung Screening Trial Research Team, Aberle DR, Berg CD, et al. The National Lung Screening Trial: overview and study sesign. Radiology 2011; 258:243-53. [ Links ]
2. Park CM, Goo JM, Lee HJ, Lee CH, Chun EJ, Im JG. Nodular groundglass opacity at thin-section CT: histologic correla-tion and evaluation of change at follow-up. Radiographics 2007; 27:391-408. [ Links ]
3. Chimondeguy DJ. Relato oficial. Sociedad Argentina de Cirugía. Tema: Cáncer De Pulmón. 2010: 1-137. Accesible en (Available at): http://www.sact.org.ar/docs/relato_chimondeguy_2010.pdf. Accedido (Accessed): abril, 2013. [ Links ]
4. Godoy MC, Naidich DP. Subsolid pulmonary nodules and the spectrum of peripheral adenocarcinomas of the lung: recommended interim guidelines for assessment and management. Radiology 2009; 253:606-22. [ Links ]
5. Seehaus A, Fattal Jaef V. Nódulo pulmonar solitario. En: Criales JL, Stoopen M, García Mónaco R, eds. Avances en Diagnóstico por Imágenes: Tórax. Buenos Aires: Journal; 2009:121-40. [ Links ]
6. Noguchi M, Morikawa A, Kawasaki M, et al. Small adenocarcinoma of the lung. Histologic characteristics and prognosis. Cancer 1995; 75:2844-52. [ Links ]
7. Terasaki H, Kato S, Matsuno Y, et al. Lung adenocarcinoma, mixed subtype: histopathologic basis for high-resolution computed tomography findings. J Thorac Imaging 2011; 26:74-81. [ Links ]
8. Park CM, Goo JM, Lee HJ, et al. CT findings of atypical adenomatous hyperplasia in the lung. Korean J Radiol 2006; 7:80-6. [ Links ]
9. Travis WD, Brambilla E, Noguchi M, et al. International association for the study of lung cancer/American Thoracic Society/European Respiratory Society International Multidisciplinary Classification of Lung Adenocarcinoma. J Thorac Oncol 2011; 6:244-85. [ Links ]
10. Adler B, Padley S, Miller RR, Müller NL. High-resolution CT of bronchioloalveolar carcinoma. AJR Am J Roentgenol 1992; 159:275-7. [ Links ]
11. Naidich DP, Bankier AA, MacMahon H, et al. Recommendations for the management of subsolid pulmo-nary nodules detected at CT: a statement from the Fleischner Society. Radiology 2013; 266:304-17. [ Links ]
12. Nakazono T, Sakao Y, Yamaguchi K, Imai S, Kumazoe H, Kudo S. Subtypes of peripheral adenocarcinoma of the lung: differentiation by thin-section CT. Eur Radiol 2005; 15:1563-8. [ Links ]
13. Lee HJ, Goo JM, Lee CH, et al . Predictive CT findings of malignancy in ground-glass nodules on thin-section chest CT: the effects on radiologist performance. Eur Radiol 2009; 19:552-60. [ Links ]
14. Aoki T, Tomoda Y, Watanabe H, et al. Peripheral lung adenocarcinoma: correlation of thin-section CT findings with histologic prognostic factors and survival. Radiology 2001; 220:803-9. [ Links ]
15. Lee SM, Park CM, Goo JM, et al. Transient part-solid nodules detected at screening thin-section CT for lung cancer: comparison with persistent part-solid nodules. Radiology 2010; 255:242-51. [ Links ]
16. Hasegawa M, Sone S, Takashima S, et al. Growth rate of small lung cancers detected on mass CT screening. Br J Radiol 2000; 73:1252-9. [ Links ]
17. Webb WR, Brant WE, Major NM. Fundamentals of body CT. Madrid: Marbán; 2007. [ Links ]
Los autores del trabajo declaran no tener ningún conflicto de intereses.














