Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de radiología
versión On-line ISSN 1852-9992
Rev. argent. radiol. vol.79 no.1 Ciudad Autónoma de Buenos Aires mar. 2015
ACTUALIZACIÓN EN RADIOLOGÍA
Infecciones del sistema nervioso: nuevas herramientas diagnósticas
N. Sgarbi
Departamento Clínico de Radiología, Hospital de Clínicas, Montevideo, Uruguay
Correo electrónico: nsgarbi@gmail.com
Recibido el 13 de agosto de 2014; aceptado el 11 de noviembre de 2014
Disponible en Internet el 7 de febrero de 2015
Resumen
Las infecciones del sistema nervioso constituyen un problema emergente de salud. Su pronóstico es desfavorable si el tratamiento no es el adecuado, por lo que, para comenzar rápidamente con una apropiada estrategia terapéutica, es necesario establecer el diagnóstico de forma precisa. Sin embargo, esto representa un verdadero desafío.
El rendimiento relativo de los métodos de diagnóstico por imágenes es bien conocido: mientras la tomografía computada (TC) permite una valoración inicial general de la estructura, la resonancia magnética (RM) es el procedimiento de elección, a pesar de su baja especificidad. No obstante, en los últimos años esto se ha visto sustancialmente modificado por la introducción en la práctica diaria de nuevas modalidades de resonancia que permiten un análisis estructural y funcional más preciso, brindando, además, información fundamental para el diagnóstico.
Así, gracias a las técnicas de difusión, perfusión y espectroscopia (entre otras), se puede realizar un análisis más profundo que, junto con la clínica y los estudios de laboratorio, mejora significativamente la sensibilidad y especificidad del método en este complejo grupo de pacientes.
Revisamos las formas de presentación de las patologías infecciosas más frecuentes del sistema nervioso, destacando los aportes de las técnicas funcionales o de las secuencias convencionales modificadas.
PALABRAS CLAVE: Absceso cerebral; Encefalitis; Difusión; Perfusión; Espectroscopia
Central nervous system infections: new diagnostic tools
Abstract
Central nervous system infections are an emerging health problem with poor prognosis if treatment is not adequate. Thus, establishing a correct diagnosis is necessary to quickly start the appropriate treatment. This is a real challenge for the radiologist, as it frequently requires a multidisciplinary approach.
The relatively low performance of diagnostic imaging is well known. While computed tomography (CT) is limited only to an initial structural assessment, with magnetic resonance imaging (MRI) being the method of choice, although it has a low specificity. However, this has been substantially modified in recent years with the introduction into daily practice of new magnetic resonance sequences that allow precise structural and functional analysis, and provide essential additional information for final diagnosis.
Now, due to the techniques of diffusion, perfusion, and spectroscopy, among others, a more detailed analysis can be made in conjunction with clinical and laboratory studies that significantly improve the sensitivity and specificity of MRI in this complex patient group.
The patterns of the most common infectious diseases of the nervous system are reviewed here, highlighting the contributions of functional sequences in these complex patients. © 2014 Sociedad Argentina de Radiología. Published by Elsevier España, S.L.U. All rights reserved.
KEYWORDS: Brain abscess; Encephalitis; Diffusion; MRI perfusion; Spectroscopy
Introducción
Las infecciones del sistema nervioso (ISN) representan un verdadero problema sanitario emergente, dado el aumento sostenido de la cantidad de casos en los últimos años. Si bien este incremento está determinado por el elevado número de enfermos con infección por el virus de la inmunodeficiencia humana (VIH), existen otros dos factores importantes: por un lado, los significativos fenómenos migratorios a nivel mundial y, por otro, el aumento de agentes infecciosos resistentes a las terapias habituales.
El factor que más impacto ha demostrado en el pronóstico vital del paciente con ISN es la identificación del agente causal. Esto permite instaurar de forma rápida una estrategia terapéutica específica.
Entre las herramientas, sin dudas la resonancia magnética (RM) ha modificado el paradigma de estudio de las enfermedades neurológicas desde que fue implementada. Sin embargo, a pesar de ser un método con elevada sensibilidad para el diagnóstico definitivo, tiene algunas limitaciones al momento de establecer el agente involucrado. En este sentido, las técnicas de difusión, perfusión y espectroscopia de la RM han demostrado efectividad en la detección de múltiples afecciones neurológicas, particularmente de las infecciosas. Su inclusión en los estudios de rutina del sistema nervioso (SN) cambió sustancialmente el rendimiento global del método, convirtiéndose en herramientas fundamentales.
El objetivo de esta revisión es destacar el rol de las nuevas técnicas de RM en la evaluación del paciente con ISN, con sus alcances y limitaciones, e ilustrarlo con casos desarrollados en nuestro centro.
Importancia del tema: epidemiología
El SN puede estar comprometido por múltiples agentes (como bacterias, virus, hongos y parásitos) y cada uno evidencia sus particularidades clínicas e imagenológicas.
Los patógenos potencialmente involucrados varían en función del compartimento o sector comprometido, la ubicación geográfica y el estado de inmunidad, vacunación y edad del paciente, entre otros factores1.
En 2004, la Organización Mundial de la Salud (OMS) reportó cerca de 350.000 muertes relacionadas a meningoencefalitis (ME), con una incidencia aproximada de 700.000 casos a nivel mundial2.
A pesar de los múltiples avances diagnósticos en la mayoría de los pacientes, todavía se desconoce el agente responsable del proceso3. En el caso de las encefalitis esporádicas, el virus del herpes simple (VHS) es el más común1,3; mientras que en los abscesos cerebrales (AC) los más frecuentes son las especies del Streptococcus y Staphylococcus, responsables de aproximadamente un 35 y 20% del total de casos, respectivamente4. El compromiso cerebral es muy importante en la mayoría de las parasitosis, siendo los cestodos (y, dentro de ellos, el agente de la cisticercosis) el más asiduo5.
En nuestro medio (Uruguay), es difícil conocer las cifras precisas de incidencia e importancia. Si bien se la considera una enfermedad poco usual, las infecciones más frecuentes hasta el 2002, según el Ministerio de Salud Pública, fueron las ME, con una tasa cada 100.000 habitantes de 3,27 a 5 en todo el país y una mortalidad aproximada del 10-30%, dependiendo del agente involucrado y la edad del paciente.
En cuanto a los AC, su mortalidad ha disminuido a nivel mundial de un 40 a un 10%, con un aumento de la recuperación total del 33 al 70%4.
En Uruguay son excepcionales las infecciones parasitarias, más aún en el paciente inmunocompetente, a diferencia de lo que sucede en los países vecinos donde la neurocisticercosis es relativamente habitual.
En aquellos pacientes inmunocomprometidos, sobre todo con infección por VIH, los parásitos son los agentes más frecuentes, siendo la toxoplasmosis la infección más común en esta población, seguida por la del virus JC1,5.
Patología: base de los hallazgos en imágenes
Los factores o condiciones predisponentes se encuentran en más del 80% de los pacientes con AC, sobre todo los focos contiguos o alejados que son el origen de la diseminación4. La radiología y la patología son indisociables a la hora de comprender los fenómenos que se producen en las infecciones del SN. De ellas, surgen numerosas clasificaciones, algunas basadas en el agente de origen y otras en la topografía de la infección (intra vs. extraaxiales). Sin embargo, una de las más importantes las categoriza según el tipo de compromiso, dividiéndolos en focal, multifocal o difuso. Cada uno de estos grupos está relacionado con agentes y procesos específicos.
La forma de respuesta del SN es muy restringida, a pesar de la interacción de múltiples poblaciones celulares6. Se observa una inflamación limitada con alteraciones de la barrera hematoencefálica (BHE) y compromiso del líquido cefalorraquídeo (LCR). Así, aparece un edema, predominantemente vasogénico, aunque con grados variables de citotoxicidad y de necrosis en diferentes formas, focos de hemorragia y cambios de permeabilidad de la BHE6. Todas estas variaciones tienen su traducción en las imágenes y constituyen la base de una adecuada interpretación.
Las infecciones y sus alteraciones (y, por ende, los hallazgos) dependen de diferentes factores. Entre los más importantes, se puede mencionar: el agente involucrado, el estado inmunológico del paciente y la vía de llegada del proceso infeccioso.
Los agentes pueden diferenciarse en patógenos propiamente dichos (entre ellos, las bacterias y la mayor parte de los virus) y en oportunistas, que son aquellos que requieren de un estado de inmunosupresión para producir daño (p. ej. los hongos).
Las vías de infección son diversas. La más frecuente es la hematógena, aunque puede verse extensión directa desde focos de vecindad, como sucede en el trauma, o incluso fenómenos de diseminación retrógrada perineural.
No debemos olvidar la enorme variedad de procesos patológicos asociados, no producidos directamente por el agente infeccioso, pero que son desencadenados por este: por ejemplo, alteraciones vasculares (como vasculitis o trombosis venosa), trastornos en la circulación y reabsorción del LCR, y fenómenos desmielinizantes directos o autoinmunes.
Resonancia magnética: protocolo de estudio y técnicas avanzadas
La RM constituye el método de elección en el estudio del paciente con ISN, pero es fundamental evaluar las imágenes junto con la edad del paciente, su contexto socioeconómico y estado de inmunidad, así como también con la mayor cantidad de información clínica disponible7. La técnica permite establecer una infección, descartar los diagnósticos diferenciales, analizar el mecanismo y orientar sobre el agente etiológico, al mismo tiempo que es útil en el seguimiento y control del tratamiento. No obstante, es esencial contar, además, con un estudio del LCR y saber si existe la sospecha o no de la presencia de un foco infeccioso extraneurológico, ya que todo esto contribuye a un diagnóstico precoz. Este, más el inicio de una terapia específica, vale recordar, son los factores más importantes y con mayor impacto en la mortalidad por estas enfermedades.
Todo protocolo de estudio debe contar con secuencias básicas en los 3 planos: secuencias ponderadas en T1 y T2, secuencias con supresión del LCR (FLAIR) y secuencias ponderadas en T1 luego de la administración del medio de contraste paramagnético a base de gadolinio.
A su vez, en los últimos años se ha corroborado la utilidad de las técnicas funcionales. Estas aportan información sobre el proceso de base y las alteraciones fisiopatológicas (previamente revisadas), por lo que el protocolo debe incluir secuencias de difusión (DWI) y un mapa de coeficiente de difusión aparente (ADC), ambos imprescindibles en el estudio de esta patología. La utilización de la perfusión (PWI) y espectroscopia, así como de otras modalidades, también resulta relevante.
Secuencia FLAIR poscontraste
La secuencia FLAIR ponderada en T2 se utiliza con un pulso de inversión que anula la señal del LCR. Esto aumenta su sensibilidad para detectar lesiones y zonas de edema. Constituye una parte fundamental del protocolo de estudio básico para las patologías del encéfalo cuando se analiza una posible infección, sobre todo por su capacidad de reconocer el edema que acompaña a la mayoría de los procesos infecciosos parenquimatosos virales y bacterianos.
En los últimos años, se ha destacado la importancia de utilizar esta secuencia con pulsos de saturación grasa y luego de administrar el medio de contraste: mientras la primera aumenta el contraste entre la sustancia gris y blanca, con una mejora consiguiente de la resolución; la poscontraste tiene una mayor sensibilidad en la detección de alteraciones meníngeas, tanto de colecciones líquidas (sobre todo empiemas subdurales) como del compromiso leptomeníngeo observado en las meningitis de distinta etiología 8 -10 (fig. 1).


Figura 1 Paciente con meningitis tuberculosa confirmada. Se muestra la utilidad y los hallazgos de la secuencia FLAIR luego de administrar el contraste. (a, b y c) En los cortes axiales se identifica el intenso realce y la ocupación de la cisterna de Silvio del lado derecho por el depósito de material granulomatoso (característico de esta patología). (d, e y f) Mismo paciente: en los cortes sagital y axial de la secuencia SE ponderada en T1 con contraste se observan los hallazgos ya identificados claramente en la secuencia anterior.
Algunos autores sugieren que la sensibilidad de las secuencias FLAIR posgadolinio y las ponderadas en T1 es idéntica en el diagnóstico de la patología infecciosa leptomeníngea, pero que la FLAIR tiene mayor especificidad10. Incluso, otras comunicaciones, como la de Splendiani et al.11, demuestran la utilidad de la RM con secuencias FLAIR poscontraste en el diagnóstico precoz de casos con meningitis infecciosa. No obstante, a pesar de estos estudios y de que nuestra experiencia sea muy similar en un número significativo de pacientes, es necesario destacar que las secuencias convencionales ponderadas en T1 con contraste no son sustituibles en esta población.
Secuencias de susceptibilidad magnética (SWI/SWAN)
Las secuencias de susceptibilidad magnética permiten detectar con elevada sensibilidad la presencia de productos de degradación de la hemoglobina. La más usada es la secuencia eco de gradiente (GRE T2*), aunque las nuevas secuencias ponderadas de susceptibilidad, como la SWI/SWAN (dependiendo de la marca comercial), tienen una mayor capacidad para hallar este artificio.
Se ha descrito el aspecto de múltiples capas de la pared de los abscesos cerebrales bacterianos inespecíficos, dado por la existencia de un artificio de susceptibilidad intenso en el sector de la pared correspondiente a la cápsula, que coincide con el sector de mayor realce12,13.
El patrón ordenado o en ‘‘doble anillo’’ de los productos de fagocitosis que determinan la presencia de este artificio es muy útil en el diagnóstico diferencial de las lesiones con patrón de realce anular, sobre todo con lesiones tumorales de alto grado con necrosis, como el glioblastoma multiforme14 (fig. 2).

Figura 2 Absceso cerebral bacteriano inespecífico, confirmado luego del drenaje quirúrgico. Los cortes seleccionados de la RM en el plano axial demuestran la utilidad de (a) la secuencia de susceptibilidad magnética, (b) la SE ponderada en T1 con contraste, (c) la difusión y (d) el mapa de ADC. En la susceptibilidad magnética se identifica el aspecto típico de la cápsula bacteriana con un patrón en diana o de doble pared, debido al depósito ordenado de productos de degradación de la hemoglobina. La lesión presenta el típico realce en anillo fino, regular, completo y sin nódulos, con un centro necrótico con un intenso fenómeno de restricción en la difusión.
Además, en algunas infecciones (p. ej. las encefalitis herpéticas) pueden observarse focos de microhemorragias, en especial a nivel cortical, lo cual es fácilmente evidenciable con estas secuencias15,16 (fig. 3).

Figura 3 Encefalitis herpética (VHS 1) en un paciente de sexo masculino y 2 años de edad, con diagnóstico confirmado por el estudio del líquido cefalorraquídeo. Se observan secuencias (a) FLAIR, (b) de difusión, (c) FSE ponderada en T2, (d) GRE T2*, (e) SE ponderada en T1 y (f) con medio de contraste. Los hallazgos son característicos de esta entidad: intenso fenómeno de restricción cortical en la difusión con un patrón gírico, similar a la distribución del edema que produce esta entidad y al patrón de realce. (d) En la secuencia eco de gradiente se identifica el componente hemorrágico cortical profundo.
La existencia de hemorragia en algunas lesiones se ha considerado por mucho tiempo rara, dificultando el diagnóstico. Sin embargo, la utilización de estas secuencias ha demostrado que su frecuencia es mucho mayor, como sucede en los casos de toxoplasmosis en el paciente con VIH.
La presencia de productos de degradación de la hemoglobina en los AC por toxoplasmosis es común y no debe invalidar el diagnóstico de sospecha ni retrasar la puesta en marcha de un tratamiento específico17.
Difusión (DWI)
La técnica de difusión permite un análisis de los movimientos de las moléculas de agua en el tejido cerebral y provee información única en el estudio de las infecciones18.
Se ha establecido la presencia de un intenso fenómeno de restricción en el centro de los AC bacterianos inespecíficos, que ha sido relacionada con la viscosidad del pus y su escasa celularidad18,19(fig. 2).
La presencia de restricción en una lesión con realce en anillo permite establecer el diagnóstico de AC bacteriano (con niveles de especificidad cercanos al 100%) y lo diferencia, sobre todo, de lesiones tumorales con necrosis o contenido quístico18,20,21 (fig. 4). Incluso, este hallazgo se ha señalado como patognomónico del AC, a pesar de que puede encontrarse en otro tipo de lesiones, como algunas metástasis con contenido de alta viscosidad o glioblastomas con hemorragia22.


Figura 4 Abscesos cerebrales bacterianos inespecíficos. Pacientes con AC (a y d) bacteriano cerebeloso, (b y e) encefálico subcortical y (e y f) múltiples de distribución bilateral superficial y profunda. Se ilustra el comportamiento característico de estas lesiones con el realce anular clásico en (a, b y c) las secuencias ponderadas en T1 con contraste y (d, e y f) el intenso fenómeno de restricción en el centro necrótico en la difusión, típico de estas lesiones.
En las etapas precoces del proceso infeccioso bacteriano, cerebritis y fase de encapsulación primaria, la restricción no es tan marcada, por lo que existen dificultades al momento de realizar el diagnóstico diferencial15,18.
En la práctica, la distinción entre los tipos de AC únicamente con secuencias convencionales es muy compleja. Si utilizamos la DWI, sumado a un análisis minucioso de la morfología de las lesiones, el contexto clínico y el estado de inmunidad del paciente, se puede arribar al diagnóstico de forma más precisa.
Por su parte, los abscesos fúngicos o de tuberculosis no se presentan con un fenómeno de restricción tan homogéneo como los AC bacterianos, con zonas de restricción y áreas de difusión facilitada, por lo que es una herramienta fundamental en el análisis diagnóstico23.
Los AC fúngicos muestran una restricción en la pared con valores similares a los bacterianos, pero también en las proyecciones que habitualmente se presentan hacia el centro, con baja señal en DWI23,24.
El fenómeno de restricción relacionado con la presencia de pus se mantiene independientemente del compartimento en el que se encuentre. Por lo tanto, este se observa en las colecciones supuradas del espacio extra o subdural (empiemas) o dentro del sistema ventricular, como en las ventriculitis25,26 (fig. 5).

Figura 5 Infecciones bacterianas con compromiso de distintos compartimentos. Se ilustra la utilidad de la difusión para el análisis del compromiso bacteriano de distintos compartimentos afectados. En (a) la secuencia SE en ponderación T1 con contraste y (d) la difusión se evidencia un AC abierto y evacuado parcialmente al ventrículo lateral con volcado de pus (lo que explica la restricción en su interior). (b y e) Se observa un empiema extradural frontal anterior derecho, originado por un proceso infeccioso nasosinusal, con (b) el realce clásico en la secuencia ponderada en T1 con contraste y (e) el fenómeno de restricción en la difusión. Por último, se presenta un empiema subdural con el mismo comportamiento que ya mencionamos: (c) secuencia SE en ponderación T1 con contraste y (f) difusión.
Finalmente un punto muy interesante es la utilización de la DWI en el seguimiento de pacientes con AC tratados con antibióticos sin drenaje quirúrgico. Esta herramienta resulta una de las más importantes para evaluar el éxito del tratamiento elegido, ya que presenta un descenso de la señal central, si la terapia antiobiótica tiene el efecto esperado; y la desaparición total, si el drenaje quirúrgico es completo27 (fig. 6).


Figura 6 Absceso cerebral bacteriano tratado con antibióticos: seguimiento. Paciente tratado con triple plan de antibióticos (ATB) debido a la ausencia de focalidad neurológica y el tamaño del absceso. En el estudio diagnóstico se observa el aspecto típico de la lesión: (a) edema en FLAIR, (b) realce anular en la secuencia ponderada en T1 con contraste e (c) intensa restricción en la difusión. En la RM de control a los 15 días se observa (d) la disminución del tamaño de la lesión y del edema, (e) la persistencia de un sector de realce y (f) sobre todo la ausencia total de restricción, que confirma la excelente respuesta al tratamiento instaurado.
En las infecciones virales la DWI también juega un rol fundamental16,18. La encefalitis herpética por el VHS tipo 1 es la más frecuente de este grupo y tiene elevada mortalidad1,18. Lo clásico es observar restricción gírica cortical desde las etapas iniciales de esta enfermedad (a las 48 horas del comienzo de los síntomas), lo cual permite establecer el diagnóstico18,28,29 (fig. 3).
En todas las infecciones virales, es común encontrar una elevada señal de DWI, con grados variables de restricción, en distintas topografías según el agente causal. Esto permite establecer la sospecha diagnóstica con adecuados niveles de sensibilidad18,30 (fig. 7). Inclusive, se ha descrito una elevada sensibilidad de la DWI para detectar zonas de actividad viral en los estadios precoces de la encefalitis en relación con el comienzo de la clínica. Esta se muestra con sectores de restricción cortical no identificados en otras secuencias (disociación clínico radiológica) (fig. 8).

Figura 7 Encefalitis por arbovirus: RM multimodal. En las secuencias (a) ponderadas en T2 y (b) FLAIR se identifica un edema en el hemisferio izquierdo que coincide con un intenso fenómeno de restricción de distribución gírica y (c) cortical en la difusión (común en las infecciones virales). (d) En la secuencia ponderada en T1 con contraste se observa un patrón de realce cortical, mientras que en (e) la perfusión se observa cómo la zona patológica presenta, a pesar del realce, una disminución del volumen sanguíneo cerebral regional, delimitando la zona afectada como hipoperfundida. (f) En la espectroscopia se evidencia el patrón metabólico de tipo pseudotumoral, con un descenso del N-acetil-aspartato y la creatina, un aumento de los niveles de colina y un pequeño pico de lactatos (flecha).

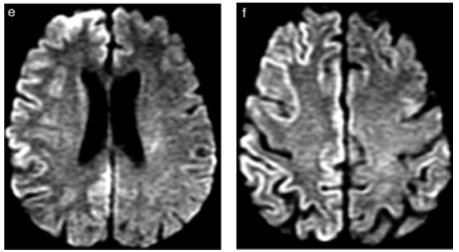
Figura 8 Encefalitis confirmada por estudio del líquido cefalorraquídeo. Se ilustra la utilidad particular de la difusión en el diagnóstico precoz de cuadros infecciosos virales. (a, b y c) Secuencia FLAIR que se interpreta como normal a los 3 días del inicio de los síntomas. (d, e y f) Secuencia de difusión del mismo estudio que muestra zonas extensas de restricción cortical a nivel del hemisferio derecho, con compromiso insular asociado, sin zonas de edema significativo ni efecto de masa.
Por último, debemos destacar el rol de esta secuencia en el diagnóstico de la leucoencefalopatía multifocal progresiva (LMP) en pacientes con VIH/sida. En los casos con inmunosupresión severa es fundamental establecer un diagnóstico basado en el estudio por proteína C reactiva (PCR) del LCR y los hallazgos imagenológicos, en vistas a modificar el pronóstico inmediato31.
La LMP es una afección desmielinizante subaguda, producida por la reactivación del virus JC. Debido a su naturaleza progresiva y mal pronóstico, el tratamiento y la evaluación de la respuesta son primordiales31,32. Recientemente, múltiples estudios han utilizado la secuencia DWI para detectar las zonas de actividad en pacientes con LMP y monitorizar su respuesta al tratamiento18,33. En estos casos, las lesiones en la DWI se caracterizan por una señal baja en el centro y una señal elevada en la periferia, lo cual indica actividad. Esta es el área pasible de respuesta a la terapia con antirretrovirales34 (fig. 9).
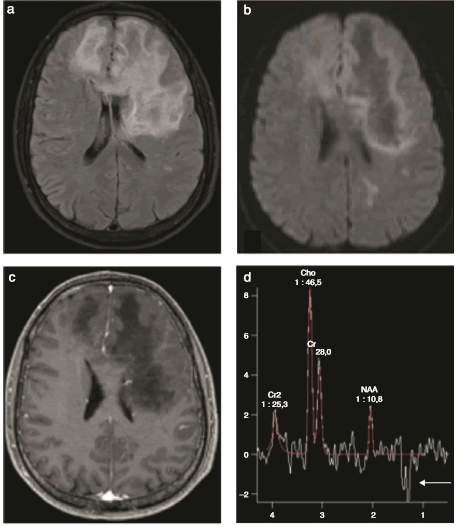
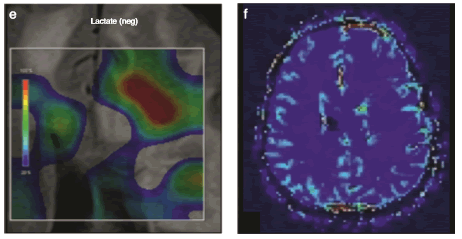
Figura 9 RM multimodal en un paciente HIV+ con leucoencefalopatía multifocal progresiva. Se observa una extensa área patológica frontal anterior del lado izquierdo, con efecto de masa y edema en (a) la secuencia FLAIR, y (b) el patrón clásico en la difusión con el halo de alta señal y el centro hipointenso. (c) No se evidencia realce en las secuencias con contraste. (d) En la espectroscopia se manifiesta un patrón pseudotumoral dado por el descenso del N-acetil-aspartato y un aumento de la colina, con una presencia muy significativa de lactatos (flecha) que se ilustra en (e) el mapa metabólico como un doble pico invertido en 1.3 y que en (f) la perfusión muestra un bajo volumen sanguíneo cerebral. Se confirma por el estudio del líquido cefalorraquídeo la presencia del virus JC, causante de esta patología.
Por otra parte, también se ha indicado el rol del mapa ADC en la diferenciación entre pacientes con rápida respuesta y aquellos no respondedores, con mala evolución y posibilidad de sufrir un síndrome de reconstitución inflamatoria (IRIS)35.
Perfusión
Las técnicas de PWI permiten un análisis funcional y hemodinámico de la circulación cerebral, que incluye el estado del lecho capilar, la indemnidad o no de la BHE y la presencia o ausencia de neovascularización36. A través de una inyección dinámica del medio de contraste, se pueden elaborar diferentes mapas funcionales (p. ej. del flujo sanguíneo cerebral [FSC] o del volumen sanguíneo cerebral [VSC]).
Si bien su rol en la evaluación de accidentes cerebrovasculares o tumores del sistema nervioso ha sido bien establecido, es una herramienta de particular interés en el paciente con infección37. Debido a la constitución de la cápsula de los AC, rica en colágeno y poco vascularizada, es fácil distinguir estas lesiones de los tumores que pueden presentarse de forma similar en las secuencias convencionales38,39. Así, en la PWI se muestran valores bajos del VSC, sin alteraciones de la permeabilidad en la zona de máximo realce (o sea, en la cápsula de la lesión)39(fig. 10). En el caso de los valores de VSC encontrados en el centro necrótico de los tumores y los AC, estos no tienen diferencias significativas, por lo que es necesario un correcto análisis de los distintos sectores de la lesión40.


Figura 10 Abscesos cerebrales bacterianos: comportamiento en la perfusión. La RM en las secuencias seleccionadas, en los 2 pacientes con AC bacterianos confirmados luego de su evacuación quirúrgica, presenta (a y d) el clásico fenómeno de restricción en la difusión y (b y e) un mapa de ADC con (c y f) valores bajos de volumen sanguíneo cerebral en la perfusión.
La PWI constituye una herramienta eficaz en la diferenciación entre los AC y los tumores necróticos, que -como mencionamos anteriormente- en alguna circunstancia pueden presentar restricción en el centro. Chan et al. han demostrado que los valores de VSC relativo (rVSC) en la pared de diferentes tumores quísticos o necróticos son superiores a los de la sustancia blanca normal, en comparación con los de la pared de los AC41.
La técnica de perfusión puede ser utilizada en todas las ISN, ya que por norma general se trata siempre de lesiones con bajo VSC, es decir, hipoperfundidas (figs. 7 y 9).
Distintos autores han constatado que en pacientes con VIH/sida es de gran utilidad para diferenciar casos de toxoplasmosis y linfoma cerebral primario, en tanto este último tiene valores elevados de rVSC, en comparación con el descenso observado en las lesiones infecciosas42 (fig. 11).


Figura 11 RM multimodal de un paciente HIV+ con toxoplasmosis cerebral. Se observa una voluminosa lesión gangliobasal derecha con necrosis, edema y efecto de masa en las secuencias (a) ponderadas en T1 y (c) FLAIR. Se manifiestan sectores de hemorragia centrales en (b) la secuencia ponderada en T2 y (d) un intenso realce heterogéneo. (e) No presenta restricción con la difusión en su centro, distinguiéndose así de los AC bacterianos y del linfoma, con proyecciones hacia su interior en forma de septos con alta señal (frecuente en agentes atípicos). (f) En la perfusión se observa, característicamente, el volumen sanguíneo cerebral disminuido (zona hipoperfundida).
Espectroscopia
La espectroscopia es una técnica que permite realizar un análisis no invasivo del comportamiento metabólico de los tejidos normales y patológicos. A pesar de que su interpretación puede resultar compleja, tiene un buen rendimiento diagnóstico en una amplia gama de patologías del SN43. Sus mayores aportes han sido en las tumorales, aunque en las infecciosas su utilidad también resulta innegable44.
En el caso de las lesiones con realce en anillo, provee datos muy importantes para diferenciar las infecciosas de otras entidades e, incluso, aporta información sobre el agente probablemente involucrado44 -46.
La presencia de succinato, acetato, alanina, leucina y valina en algunos casos es considerada como específica del AC piogénico, aun en ausencia de restricción en la DWI44,47. Algunos índices, como la relación acetato/succinato, incluso permiten distinguir entre lesiones bacterianas y parasitarias48 (fig. 12).
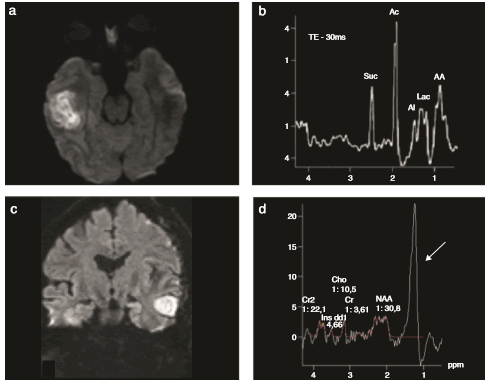
Figura 12 Espectroscopia en abscesos cerebrales bacterianos: trazados metabólicos. Se muestran dos casos de AC: (a y b) uno temporal derecho luego de una otitis media, con mala evolución, y (c y d) otro temporal izquierdo luego de la cirugía de un tumor de alto grado. En el 1.er caso se muestra el trazado típico de estas lesiones con metabolitos: aminoácidos (AA), acetato (Ac), succinato (Suc) y lactatos (flecha). El 2.º caso, de importante dificultad diagnóstica, muestra (c) el fenómeno de restricción en la difusión y (d) el patrón más frecuente con niveles muy elevados de lípidos/lactatos en el sector central de la lesión.
Si encontramos aminoácidos, se puede diferenciar un AC de una lesión tumoral con adecuados niveles de sensibilidad y especificidad48.
En el caso de las encefalitis virales la evidencia no es clara sobre el rendimiento global del método.
En pacientes con VHS aguda, en fases iniciales se observa un descenso de los niveles del N-acetil-aspartato (NAA) y un ascenso de la colina (Cho) con reducción de la relación NAA/Cr (creatina) y picos variables de lactato, habitualmente elevados49. No obstante, este patrón es poco específico y, dado que se puede ver en múltiples agentes virales, es posible interpretarlo como tumoral (patrón pseudotumoral), comprometiendo la especificidad del método (figs. 7, 9 y 13).

Figura 13 Espectroscopia en un paciente con encefalitis por arbovirus demostrada y extensa zona patológica frontal izquierda, (b) con edema y sin una traducción muy significativa en la difusión, y (f) zonas de realce heterogéneo. (d y e) Los trazados metabólicos muestran un patrón pseudotumoral con niveles muy elevados de lactatos (flecha). (a) La secuencia FLAIR y (c) la SE ponderada en T1 sin medio de contraste complementan el estudio.
Algunos autores han señalado la utilidad de la espectroscopia en el estudio de las lesiones infecciosas en los casos de VIH/sida, pero su interpretación es compleja y tiene algunas dificultades 50 (fig. 14). En el paciente VIH, la tuberculosis del SN es una de las patologías emergentes y, de las formas de compromiso de esta afección, la meningitis es la más frecuente, mientras que el tuberculoma constituye un verdadero desafío diagnóstico.

Figura 14 Perfusión y espectroscopia en pacientes HIV+ con toxoplasmosis cerebral. (a) Lesión focal frontal del lado derecho con un patrón de realce anular y en diana, con un nódulo excéntrico en la secuencia ponderada en T1 con contraste. En las secuencias funcionales se muestran los hallazgos característicos: (b) volumen sanguíneo cerebral disminuido y (c) un trazado metabólico de espectroscopia con concentración normal de N-acetil-aspartato y creatina, aumento de los niveles de colina y un pico muy significativo de lactatos (flecha). Este patrón es claramente diferente al del linfoma, la lesión tumoral del sistema nervioso más frecuente en este grupo de pacientes.
El tuberculoma es una lesión con centro caseificante, lo que le da la típica baja señal en ponderación T251. No presenta restricción en la difusión y tiene bajo VSC, como ya vimos que sucede en agentes específicos50,51. Los trazados metabólicos muestran habitualmente un pico muy significativo de lípidos/lactatos. Si bien este hallazgo resulta inespecífico, analizado junto con la información disponible permite sospechar el diagnóstico final51 (fig. 15).

Figura 15 RM multimodal en un paciente VIH+ con tuberculoma cerebral diagnosticado por el estudio patológico de la pieza de resección quirúrgica. Se presenta (a) en la secuencia FLAIR una lesión focal parietal izquierda y superficial con edema asociado, (b) baja señal en la secuencia ponderada en T2 (típico de estas lesiones) y (c) realce anular en la secuencia ponderada en T1 con contraste. (d) En la difusión no hay restricción central. (d) La perfusión y (f) la espectroscopia tienen las características habituales de las lesiones infecciosas, con un pico elevado de lípidos/lactatos (flecha).
Como concepto fundamental, hay que recordar que la interpretación de los trazados metabólicos debe realizarse con el conjunto de imágenes y secuencias obtenidas, para determinar un adecuado diagnóstico y sus posibles diferenciales.
Recomendaciones y conceptos finales
Las infecciones del SN constituyen un verdadero problema de salud, con elevados niveles de mortalidad, si el diagnóstico es tardío.
La interpretación de las imágenes es un desafío, pero entre los pilares diagnósticos la RM se destaca como método de elección debido a que ha demostrado tener un impacto positivo en este grupo de pacientes: no sólo permite establecer un diagnóstico aproximado, descartar diferenciales y analizar el agente involucrado con mayor probabilidad y el mecanismo etiopatogénico, sino que, además, posibilita un seguimiento estricto de la estrategia terapéutica elegida.
Para lograr el mejor rendimiento del método, las imágenes deben interpretarse junto con la clínica, el perfil evolutivo y el estado de inmunidad del paciente, así como también con la información epidemiológica relevante (noción de contacto con agentes, viajes recientes, etc.) y los estudios de laboratorio, sobre todo el análisis sanguíneo y el del LCR.
Establecer un diagnóstico precoz disminuye la mortalidad, al permitir la instauración de un tratamiento específico de forma rápida. Para ello, es imperioso realizar un estudio de RM adecuado. Este debe contar con secuencias convencionales, FLAIR, ponderadas en T2 y T1, y con medio de contraste, siendo indispensable la utilización de nuevas modalidades de imagen, fundamentalmente la difusión y perfusión. Así, se consigue establecer un diagnóstico final con niveles de sensibilidad y especificidad cercanos al 100%.
Conflicto de intereses
El autor declara como posible conflicto de interés ser miembro del Comité de Consultores Internacionales de la Revista Argentina de Radiología.
1. Riddell J 4th, Shuman EK. Epidemiology of central nervous system infection. Neuroimag Clin N Am. 2012;22: 543-56. [ Links ]
2. Mathers C, Boerma T, Ma Fat D. The global burden of disease: 2004 update. Switzerland: World Health Organization; 2008. [ Links ]
3. Solomon T, French N. Neurological infections: something for everyone. Lancet Neurol. 2013;12: 20-2. [ Links ]
4. Brouwer MC, Coutinho JM, van de Beek D. Clinical characteristics and outcome of brain abscess: systematic review and meta-analysis. Neurology. 2014;82: 806-13. [ Links ]
5. Finsterer J, Auer H. Parasitoses of the human central nervous system. J Helminthol. 2013;87: 257-70. [ Links ]
6. McKeever PE. Pathologic basis of central nervous system infections. Neuroimag Clin N Am. 2012;22: 773-90. [ Links ]
7. Marchbank ND, Howlett DC, Sallomi DF, Hughes DV. Magnetic resonance imaging is preferred in diagnosing suspected cerebral infections. BMJ. 2000;320: 187-8. [ Links ]
8. Kremer S, Abu Eid M, Bierry G, Bogorin A, Koob M, Dietemann JL, et al. Accuracy of delayed post-contrast FLAIR MR imaging for the diagnosis of leptomeningeal infectious or tumoral diseases. J Neuroradiol. 2006;33: 285-91. [ Links ]
9. Kamran S, Bener AB, Alper D, Bakshi R. Role of fluid-attenuated inversion recovery in the diagnosis of meningitis: comparison with contrast-enhanced magnetic resonance imaging. J Comput Assist Tomogr. 2004;28: 68 -72. [ Links ]
10. Parmar H, Sitoh YY, Anand P, Chua V, Hui F. Contrast-enhanced flair imaging in the evaluation of infectious leptomeningeal diseases. Eur J Radiol. 2006;58: 89-95. [ Links ]
11. Splendiani A, Puglielli E, De Amicis R, Necozione S, Masciocchi C, Gallucci M. Contrast-enhanced FLAIR in the early diagnosis of infectious meningitis. Neuroradiology. 2005;47: 591-8. [ Links ]
12. Chang HC, Chuang TC, Chung HW, Lin HS, Lai PH, Weng MJ, et al. Multilayer appearance on contrast-enhanced susceptibility-weigthed images on patients with brain abscesses: possible origins and effects of postprocessing. J Magn Reson Imaging. 2012;36: 1353-61. [ Links ]
13. Lai PH, Chang HC, Chuang TC, Chung HW, Li JY, Weng MJ, et al. Susceptibility-weighted imaging in patients with pyogenic brain abscesses at 1.5T: characteristics of the abscess capsule. AJNR Am J Neuroradiol. 2012;33: 910-4. [ Links ]
14. Toh CH, Wei KC, Chang CN, Hsu PW, Wong HF, Ng SH, et al. Differentiation of pyogenic brain abscesses from necrotic glioblastomas with use of susceptibility-weighted imaging. AJNR Am J Neuroradiol. 2012;33: 1534-8. [ Links ]
15. Rath TJ, Hughes M, Arabi M, Shah GV. Imaging of cerebritis, encephalitis and brain abscess. Neuroimag Clin N Am. 2012;22: 585-607. [ Links ]
16. Saini J, Gupta RK, Jain KK. Intracranial infections: key neuroimaging findings. SeminRoentgenol. 2014;49: 86-98. [ Links ]
17. Bhagavati S, Choi J. Frequent hemorrhagic lesions in cerebral toxoplasmosis in AIDS patients. J Neuroimaging. 2009;19: 169-73. [ Links ]
18. Gasparetto EL, Cabral RF, da Cruz LC, DominguesF R.C. Jr. Diffusion imaging in brain infections. Neuroimag Clin N Am. 2011;21: 89 -113. [ Links ]
19. Mishra AM, Gupta RK, Saksena S, Prasad KN, Pandey CM, Rathore D, et al. Biological correlates of diffusivity in brain abscess. Magn Reson Med. 2005;54: 878-85. [ Links ]
20. Desprechins B, Stadnik T, Koerts G, Shabana W, Breucq C, Osteaux M. Use of diffusion-weighted MR imaging in differential diagnosis between intracerebral necrotic tumors and cerebral abscesses. AJNR Am J Neuroradiol. 1999;20: 1252-7. [ Links ]
21. Mishra AM, Gupta RK, Jaggi RS, Reddy JS, Jha DK, Husain N, et al. Rol of diffusion-weighted imaging and in vivo proton magnetic resonance spectroscopy in the differential diagnosis of ring-enhancing intracranial cystic mass lesions. J Comput Assist Tomogr. 2004;28: 540-7. [ Links ]
22. Hartmann M, Jansen O, Heiland S, Sommer C, Münkel K, Sartor K. Restricted diffusion within ring enhancement is not pathognomonic for brain abscess. AJNR Am J Neuroradiol. 2001;22: 1738-42. [ Links ]
23. Luthra G, Parihar A, Nath K, Jaiswal S, Prasad KN, Husain N, et al. Comparative evaluation of fungal, tubercular and pyogenic brain abscesses with conventional and diffusion MR imaging and proton MR spectroscopy. AJNR Am J Neuroradiol. 2007;28: 1332-8. [ Links ]
24. Mathur M, Johnson CE, Sze G. Fungal infections of the central nervous system. Neuroimag Clin N Am. 2012;22: 609-32. [ Links ]
25. Mohan S, Jain KK, Arabi M, Shah GV. Imaging of meningitis and ventriculitis. Neuroimag Clin N Am. 2012;22: 557-83. [ Links ]
26. Pezzullo JA, Tung GA, Mudigonda S, Rogg JM. Diffusion-weighted MR imaging of pyogenic ventriculitis. AJR Am J Roentgenol. 2003;180: 71-5. [ Links ]
27. Cartes-Zumelzu FW, Stavrou I, Castillo M, Eisenhuber E, Knosp E, Thurnher MM. Diffusion-weighted imaging in the assessment of brain abscesses therapy. AJNR Am J Neuroradiol. 2004;25: 1310-7. [ Links ]
28. Kuker W, Nagele T, Schmidt F, Heckl S, Herrlinger U. Diffusion-weighted MRI in herpes simplex encephalitis: a report of three cases. Neuroradiology. 2004;46: 122-5. [ Links ]
29. Tien RD, Felsberg GJ, Osumi AK. Herpes virus infections of the CNS: MR findings. AJR Am J Roentgenol. 1993;161: 167-76. [ Links ]
30. Handique SK. Viral infections of the central nervous system. Neuroimag Clin N Am. 2011;21: 777-94. [ Links ]
31. Sahraian MA, Radue EW, Eshaghi A, Besliu S, Minagar A. Progressive multifocal leukoencephalopathy: a review of the neuroimaging features and differential diagnosis. Eur J Neurol. 2012;19: 1060-9. [ Links ]
32. Barata Tavares J, Geraldo AF, Neto L, Reimão S, Campos JG. Diffusion-weighted MR imaging characterization of progressive multifocal leucoencephalopathy (PML) lesions. Acta Med Port. 2012;25Suppl1: 34-7. [ Links ]
33. Mader I, Herrlinger U, Klose U, Schmidt F, Küker W. Progressive multifocal leukoencephalopathy: analysis of lesion development with diffusion-weighted MRI. Neuroradiology. 2003;45: 717-21. [ Links ]
34. Shah R, Bag AK, Chapman PR, Curé JK. Imaging manifestations of progressive multifocal leukoencephalopathy. Clin Radiol. 2010;65: 431-9. [ Links ]
35. Buckle C, Castillo M. Use of diffusion-weighted imaging to evaluate the initial response of progressive multifocal leukoencephalopathy to highly active antiretroviral therapy: early experience. AJNR Am J Neuroradiol. 2010;31: 1031-5. [ Links ]
36. Cha S. Perfusion MR imaging: basic principles and clinical applications. Magn Reson Imaging Clin N Am. 2003;11: 403-13. [ Links ]
37. Aksoy FG, Lev MH. Dynamic contrast-enhanced brain perfusion imaging: technique and clinical applications. Semin Ultrasound CT MR. 2000;21: 462 -77. [ Links ]
38. Nguyen JB, Black BR, Leimkuehler MM, Halder V, Nguyen JV, Ahktar N. Intracranial pyogenic abscess: imaging diagnosis utilizing recent advances in computed tomography and magnetic resonance imaging. Crit Rev Comput Tomogr. 2004;45: 181-224. [ Links ]
39. Grand S, Lefournier V, Krainik A, Bessou P, Tropres I, Chabardes S, et al. Imagerie de perfusion: principes et applications cliniques. J Radiol. 2007;88: 444-71. [ Links ]
40. Chiang IC, HsieH TJ, Chiu ML, Liu GC, Kuo YT, Lin WC. Distinction between pyogenic brain abscess and necrotic brain tumor using 3-tesla MR spectroscopy, diffusion and perfusion imaging. Br J Radiol. 2009;82: 813-20. [ Links ]
41. Chan JH, Tsui EY, Chau LF, Chow KY, Chan MS, Yuen MK, et al. Discrimination of an infected brain tumor from a cerebral abscess by combined MR perfusion and diffusion imaging. Comput Med Imag Graph. 2002;26: 19 -23. [ Links ]
42. Ernst TM, Chang L, Witt MD, Aronow HA, Cornford ME, Walot I, et al. Cerebral toxoplasmosis and lymphoma in AIDS: perfusion MR imaging experience in 13 patients. Radiology. 1998;208: 663 -9. [ Links ]
43. Tran T, Ross B, Lin A. Magnetic resonance spectroscopy in neurological diagnosis. Neurol Clin. 2009;27: 21-60. [ Links ]
44. Oz G, Alger JR, Barker PB, Bartha R, Bizzi A, Boesch C, et al. Clinical proton MR spectroscopy in central nervous system disorders. Radiology. 2014;270: 658 -79. [ Links ]
45. Gupta RK. Magnetic resonance spectroscopy in intracranial infection. En: Gillard JH, Waldman AD, Barker PB, editores. ClinicalMR neuroimaging. 2nd ed. London, England: Cambridge University Press; 2010. p. 426 -54.
46. Chang KH, Song IC, Kim SH, Han MH, Kim HD, Seong SO, et al. In vivo single-voxel proton MR spectroscopy in intracranial cystic masses. AJNR Am J Neuroradiol. 1998;19: 401-5. [ Links ]
47. Pal D, Bhattacharyya A, Husain M, et al. In vivo proton MR spectroscopy evaluation of pyogenic brain abscesses: a report of 194 cases. Am J Neuroradiol AJNR. 2010;31: 360-6. [ Links ]
48. Gupta RK, Jobanputra KJ, Yadav A. MR spectroscopy in brain infections. Neuroimag Clin N Am. 2013;23: 475-98. [ Links ]
49. Gupta RK, Lufkin RB. Viral infections. En: Gupta RK, Lufkin RB, editores. MR imaging and spectroscopy of central nervous system infection. New York: Kluver Academic/Plenum Publishers; 2001. p. 147 -75. [ Links ]
50. Simone IL, Federico F, Tortorella C, et al. Localised 1H-MR spectroscopy for metabolic characterisation of diffuse and focal brain lesions in patients infected with HIV. J NeurolNeurosurg Psychiatry. 1998;64: 516 -23. [ Links ]
51. Gupta RK, Kumar S. Central nervous system tuberculosis. Neuroimag Clin N Am. 2011;21:795 -814. [ Links ]














