Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de radiología
versión On-line ISSN 1852-9992
Rev. argent. radiol. vol.80 no.4 Ciudad Autónoma de Buenos Aires dic. 2016
CARTAS CIENTÍFICAS
Leucoencefalitis hemorrágica aguda - Enfermedad de Weston Hurst
Acute haemorrhagic leucoencephalitis - Weston Hurst disease
Estimada Editora:
La encefalomielitis diseminada aguda (EMDA) se define como el primer evento clínico de una encefalopatía polisintomática y monofásica, de inicio agudo o subagudo. Se observa con lesiones hiperintensas multifocales que afectan predominantemente la sustancia blanca del sistema nervioso central (SNC) en las secuencias ponderadas en T2 y en recuperación de inversión atenuada de fluido (FLAIR) de la resonancia magnética (RM)1. Su incidencia se estima en 0,6-0,8 casos cada 100.000 pacientes/año, siendo mayor en pacientes pediátricos. En estos la mortalidad global no supera el 5% y evoluciona con una resolución completa hasta en el 90%2. Suele producirse por una reacción autoinmune posvacunal, posexantémica o posinfecciosa contra la proteína básica de la mielina.
La leucoencefalitis hemorrágica aguda (LHA) o enfermedad de Weston Hurst es una variante infrecuente con desenlace fatal debido al severo edema y herniación cerebral3. Comunicamos el caso de una niña de 3 años de edad, hasta ese momento sana, que presentó un cuadro clínico de un mes de evolución, consistente en dislalia progresiva, ataxia con aumento de la base de sustentación y episodios de retrodesviación de la mirada con vómitos sin náusea previa. En la consulta, se constató una tendencia al sopor alternado con irritabilidad, hemiparesia faciobraquio-crural izquierda, faringitis en curso con fiebre de 38 °C y un episodio de convulsión atónica que cedió con diazepam endorrectal.
Los resultados del electroencefalograma (EEG), la radiografía de tórax, el hemograma y el ionograma solicitados fueron normales y las serologías para el virus de la inmuno-deficiencia humana (VIH) y Toxoplasmas gondii, negativas. La punción del líquido cefalorraquídeo (LCR) mostró un aspecto de cristal de roca, con un leve aumento de proteínas, 20 leucocitos por mm3 (88% mononucleares y 12% polimorfonucleares), bandas oligoclonales negativas y reacción en cadena de la polimerasa (PCR) negativa para los virus herpes simple, Epstein-Barr, citomegalovirus y varicela zóster. La PCR para enterovirus fue positiva.
Se llevó a cabo una RM de encéfalo con gadolinio que evidenció múltiples lesiones en la sustancia blanca supra e infratentorial, con predilección subcortical en ambos hemisferios cerebrales, hipointensas en ponderación T1 e hiperintensas en ponderación T2 y FLAIR (fig. 1), con refuerzo anular tras la inyección endovenosa de gadolinio (fig. 2). Además, reveló un leve efecto de masa con escaso edema vasogénico perilesional.
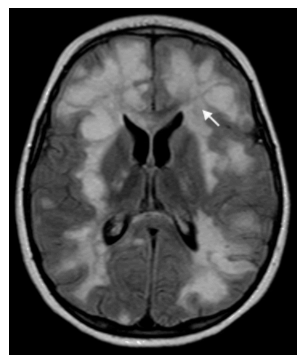
Figura 1 RM en plano axial ponderada en FLAIR, a los dos meses de evolución, muestra lesiones hiperintensas a nivel de sustancia blanca (flecha blanca).

Figura 2 Imágenes ponderadas en T1 con gadolinio a los dos meses de evolución: a nivel del cerebro (a) evidencian lesiones en la sustancia blanca con refuerzo anular (asteriscos) y a nivel de la médula espinal (b) muestran una lesión con realce pseudonodular en niveles D3 y D4 (flecha blanca).
En este contexto, se sospechó como principal diagnóstico una EMDA y se dio inicio al tratamiento con pulsos de corticoides. Sin embargo, en las semanas siguientes el cuadro clínico se agravó con un estado epiléptico sin respuesta al tratamiento. El EEG fue compatible con encefalopatía difusa severa, mientras que el LCR se mostró xantocrómico con sedimento eritrocitario escaso y aumento de proteínas.
Una nueva RM de encéfalo y médula espinal permitió objetivar un aumento del tamaño de las lesiones, con difusión facilitada en secuencias ponderadas en difusión y mapa de coeficiente de difusión aparente (ADC), que evocaba un comportamiento de tipo quístico-necrótico (fig. 3). También se observó un marcado refuerzo anular con inyección de contraste y alteración difusa de la señal de la sustancia blanca, secundario a desmielinización y a edema vasogénico. Las secuencias de eco de gradiente (GRE) en ponderación T2 mostraron múltiples imágenes puntiformes hipointensas localizadas en los márgenes de las lesiones, que se interpretaron como depósitos de hemosiderina (fig. 4). En la médula espinal se evidenció una lesión focal hiperintensa en ponderación T2 e hipointensa en ponderación T1 con realce homogéneo pseudonodular a la altura de D3 y D4. La biopsia guiada por estereotaxia de una lesión cerebral confirmó LHA.

Figura 3 Imágenes ponderadas en (a) difusión y (b) mapa de ADC muestran lesiones con difusión facilitada (flechas negras).

Figura 4 RM en eco de gradiente con artefactos por focos de hemorragia (asteriscos) a nivel (a) supratentorial e (b) infratentorial.
Se escaló el tratamiento con corticoides e inmunoglobulinas, y plasmaféresis, pero luego del tercer ciclo debió suspenderse por una infección del catéter. La evolución de la enfermedad fue tórpida y la paciente falleció en un corto plazo.
La disfunción cerebral aguda puede deberse a procesos infecciosos, inflamatorios vasculares, metabólicos o tóxicos, así como a una isquemia, enfermedades desmielinizantes o neoplasias. La evaluación clínica, los análisis de sangre, la punción lumbar y la tomografía computada (TC), junto con la RM de cerebro, constituyen la secuencia de diagnóstico de primera línea en la emergencia4.
La LHA fue descrita en 1941 por el patólogo Weston Hurst, y es considerada una variante aguda, de rápido progreso y con frecuencia mortal, de la EMDA. Se da en menos del 2% de estos pacientes, siendo más común en niños5. Ambas patologías forman parte del espectro de enfermedades autoinmunes posinfecciosas6. En la mayoría de los casos, tanto la EMDA como la LHA, ocurre dentro de las 2-4 semanas posteriores a una infección viral de las vías aéreas superiores y menos frecuentemente después de una vacunación o enfermedad exantémica. De todos modos, el antecedente de una infección no es específico ni sensible para su diagnóstico7.
La enfermedad suele presentar un inicio brusco, con un cuadro encefalopático agudo con fiebre, trastornos del nivel de alerta, crisis convulsivas generalizadas o signos de déficit neurológico focal6. En cuanto a las imágenes, generalmente se inicia el estudio con una TC, dado que permite descartar patologías más prevalentes, como hemorragias, lesiones expansivas o infecciosas (p. ej. encefalitis herpética)8, aunque la RM cerebral es el método diagnóstico de elección.
En nuestro caso, las lesiones observadas tuvieron una presentación típica9,10. No obstante, creemos relevante su divulgación debido a que la paciente no presentó la evolución rápidamente progresiva con resolución fatal descrita en la literatura, sino una prolongada con agravamiento progresivo.
Confidencialidad de los datos
Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
L.M. Pessini Ferreira*, J. Gagliardino y A. Surur
Servicio de Diagnóstico por Imágenes, Sanatorio Allende, Córdoba, Argentina
* Autor para correspondencia.
Correo electrónico: lucaspssn@gmail.com (L.M. Pessini Ferreira).
1. Borlot F da Paz JA, Casella EB, Marques-Dias MJ. Acute hemorrhagic encephalomyelitis in childhood: Case report and literature review. J Pediatr Neurosci. 2011;6:48-51. [ Links ]
2. Reig Sáenz R, Zazo Santidrián C, Martín Medina P, Feliú Rey E, Díaz Barranco M, Plumed Martín L. Clinical outcome of the hyperacute form of acute disseminated encephalomyelitis. An Pediatr (Barc). 2013;78:234-40. [ Links ]
3. Lee HY, Chang KH, Kim JH, Na DG, Kwon BJ, Lee KW, et al., Serial MR. imaging findings of acute hemorrhagic leukoencephalitis: a case report. AJNR Am J Neuroradiol. 2005;26:1996-9.
4. Gupte G, Stonehouse M, Wassmer E, Coad NA, Whitehouse WP. Acute disseminated encephalomyelitis: a review of 18 cases in childhood. J Paediatr Child Health. 2003;39:336-42. [ Links ]
5. Marin SE, Callen DJ. The magnetic resonance imaging appearance of monophasic acute disseminated encephalomyelitis: an update post application of the 2007 consensus criteria. Neuroimaging Clin N Am. 2013;23:245-66. [ Links ]
6. O';Mahony J, Shroff M, Banwell B. Mimics and rare presentations of pediatric demyelination. Neuroimaging Clin N Am. 2013;23:321-36. [ Links ]
7. Leake JA, Billman GF, Nespeca MP, Duthie SE, Dory CE, Meltzer HS, et al. Pediatric acute hemorrhagic leukoencephalitis: report of a surviving patient and review. Clin Infect Dis. 2002;34:699-703.
8. Rothstein TL, Shaw CM. Computed tomography in acute hemorrhagic leukoencephalitis. Ann Neurol. 1984;15:312. [ Links ]
9. Kao HW, Alexandru D, Kim R, Yanni D, Hasso AN. Valué of susceptibility-weighted imaging in acute hemorrhagic leukoencephalitis. J Clin Neurosci. 2012;19:1740-1. [ Links ]
10. Kuperan S, Ostrow P, Landi MK, Bakshi R. Acute hemorrhagic leukoencephalitis vs. ADEM: FLAIRMRI and neuropathology findings. Neurology. 2003;60:721-2. [ Links ]














