Introducción
El cáncer de próstata (CP) es la neoplasia maligna más común entre los hombres en todo el mundo y la segunda causa de muerte por cáncer entre los hombres en los Estados Unidos, de acuerdo con Globocan.1
El CP localizado es tratado, con intenciones curativas, por medio de una prostatectomía radical (PR) con buenos resultados. No obstante, un tercio de estos pacientes presentan, en su seguimiento, una recaída del CP (RCP) que se constata por la elevación del antígeno prostático específico (PSA por su sigla en inglés).2 Cuando la RCP ocurre, es decisivo evidenciar dónde se produjo, para instaurar el tratamiento adecuado. Actualmente, la precisión diagnóstica de los estudios convencionales por imágenes [(ecografía (ECO), resonancia magnética (RM), tomografía computarizada (TC) y centellograma óseo (CO)] en la evaluación de la RCP es limitada.3,4,5 En los últimos años, la tomografía por emisión de positrones/tomografía computada (PET/TC) con colina (PETC) ha surgido como una herramienta diagnóstica eficaz en la detección de la localización del sitio de la RCP y se ha utilizado para estadificar a estos pacientes. El PSA es el predictor más potente para evaluar el rendimiento de la PETC.6 Sin embargo, se ha encontrado que el nivel PSA sólo al momento de solicitar la PETC, especialmente para niveles ≤ 2 ng/ml, es una variable insuficiente para la selección de los pacientes con RCP, con una sensibilidad menor al 20%.6 Diferentes series han sugerido que el tiempo de duplicación del PSA (PSADT) y la velocidad de PSA (PSAV) podrían servir como marcadores adicionales en la selección de los pacientes con una RCP.7
El objetivo de este estudio fue evaluar la relación de las cinéticas del PSA en el rendimiento de la PETC en la detección de la RCP.
Materiales y métodos
Se realizó un trabajo observacional, retrospectivo y de corte transversal. La población accesible de estudio fueron los pacientes con una RCP luego de una PR que fueron evaluados mediante una PET/TC F-18 colina en nuestra institución desde junio de 2017 hasta junio de 2018. Se obtuvo una muestra de 48 pacientes. Todos los pacientes cumplieron los requerimientos del comité de ética en consonancia con el código ético de la Organización Mundial de la Salud (OMS) y se tuvo el consentimiento informado de todos los sujetos estudiados.
Recaída bioquímica
Se definió RCP después de la PR a dos aumentos consecutivos de PSA 0,2 ≥ ng / ml.8
Cinética del PSA
Se definió a la cinética del PSA como las variaciones del PSA a lo largo del tiempo, expresada como PSADT y PSAV.
Los niveles de PSA se determinaron a partir de muestras de sangre obtenidas durante el período de ayuno a los 3 meses de la PR y luego cada 6 meses. El primer nivel de PSA disponible en la población examinada se consideró el valor de referencia. PSADT y PSAV podrían calcularse:9,10,11
PSADT se calculó utilizando la siguiente fórmula:
PSADT = [log 2 x t] / =[log (PSA retardo) - log (PSA temprano)].
PSAV se calculó utilizando la siguiente formula:
PSAV= (PSA2-PSA1/tiempo) + (PSA3-PSA2/tiempo) / 2.
Se definió PSAG como el último PSA realizado que desencadeno la toma de decisión de realizar el PETC.
Los niveles de PSA se determinaron utilizando un método de ECLIA, quimioluminiscencia con una sensibilidad para PSA valores < 0.01 ng/ml.
Los valores de corte de PSADT (12 meses) Y PSAV (0,75 ng/-ml/año) se escogieron analizando los valores de corte establecidos en otras publicaciones.7 No obstante, de estos valores se buscó el punto de corte que mejor performance tuvo en el grupo de PETC positiva en nuestra muestra de pacientes.
Fueron excluidos del estudio aquellos pacientes que carecían de la información clínica correspondiente o aquellos pacientes que hubieran realizado radioterapia pelviana post PR o bloqueo hormonal previo a la PETC.
PET/TC con 18F-colina
Las PETC se obtuvieron usando un PET/TC Philips Gemini GXL16 (Philips Medical Systems, OH, EUA) con una adquisición temprana (pelvis) y tardía (todo el cuerpo). Las imágenes se reconstruyeron utilizando un algoritmo iterativo estándar. Se realizó una TC de bajo amperaje para la corrección de atenuación de las imágenes de PET (80 mA, 140 kV, campo de visión de aproximadamente 420 - 500 mm, grosor de corte de TC de 3,75 mm). Se inyectaron 4 MBq / kg (0,10 mCi) de 18F-Colina. Antes de la adquisición de las imágenes tempranas y tardías, se les pidió a los pacientes que vaciaran su vejiga.
La adquisición temprana de la pelvis (8 min en modo dinámico, cada cuadro que dura 30 s en una matriz de 128 128) se inició después de la inyección en bolo del radiotrazador. Después de la adquisición temprana, se les pidió a los pacientes que permanecieran en una habitación dedicada durante aproximadamente 40 minutos. En todos los pacientes, se administró solución salina al 0,9% por vía intravenosa para reducir el agrupamiento del radiotrazador en los riñones. La adquisición tardía se inició aproximadamente 50 minutos después de la inyección del radiotrazador. Primero, se realizó una TC de bajo amperaje para corregir la atenuación de las imágenes de PET. Inmediatamente después de la TC de dosis baja, se adquirieron imágenes de PET de todo el cuerpo en una matriz de 256 256 (posiciones de cinco a siete camas, posición de 3 min / lecho) desde la parte superior de los muslos hasta el vértice.
Las imágenes PETC fueron revisadas por dos médicos de medicina nuclear (RL y FF) de forma anónima e independiente. En los casos en que hubo dudas diagnósticas los pacientes fueron reevaluados de forma conjunta y se llegó a un consenso.
PETC positivas
La captación se consideró patológica cuando se detectó visualmente un área de captación del trazador focal superior al fondo. Los valores de captación máximos estandarizados (SUVmax> 2,5) también se determinaron y se tuvieron en cuenta, pero no se utilizó ningún valor de corte absoluto para el diagnóstico. (►Fig. 1) Los resultados de la PETC fueron considerados verdaderos positivos cuando cumplieron alguno de los 4 criterios: confirmación histopatológica, confirmación por resonancia magnética de alto campo, desaparición o reducción de la captación de la 18F-Colina en el área considerada patológica o del número de áreas durante el seguimiento o el tratamiento local o sistémico, disminución > 50% del PSA luego del tratamiento local o sistémico.
Análisis estadístico
Las variables cuantitativas se describen con media y sus respectivos intervalos de confianza del 95%, además se presentaron los cuartiles. Las variables cualitativas se describen con frecuencias absolutas y sus respectivas frecuencias relativas.
La relación entre variables cualitativas se evaluó mediante el test χ2 o el test exacto de Fisher, según correspondiera. La comparación de medias se realizó mediante la prueba T de muestras independientes. Ante el no cumplimiento de los supuestos de normalidad, se utilizó la prueba del Wilcoxon para comparar medianas.
Se realizaron las curvas ROC entre las cinéticas del PSA y la tasa de detección de recaída usando PETC (negativo o positivo). Se realizó el cálculo de sensibilidad y especificidad; y partir de estas se obtuvieron los valores de las razones de verosimilitud (LR por su sigla en inglés) con valores de LR + = > 10 y valores LR- = < 0,1.
El software utilizado para los análisis estadísticos fue el IBM SPSS v 23.0. Se trabajó con un nivel de significancia α = 0,05.
Resultados
Se incluyeron en el estudio 48 pacientes. La edad media fue de 68,3 ± 4,9 años (►Tabla 1). La tasa de detección de la PETC fue del 52% (n = 25). Del total de pacientes, 7 tuvieron confirmación histopatológica por biopsia del lecho quirúrgico y 18 presentaron confirmación por imágenes o disminuyeron las áreas de captación en la PETC de seguimiento o tuvieron reducción del PSA > 50% con tratamiento local o sistémico.
Tabla 1 Características de los pacientes
| Total | PETC positiva | PETC negativa | Valor p |
|---|---|---|---|
| N | 25 | 23 | - |
| Edad, media ± DE | 69.3 ± 4.3 | 67.3 ± 5.4 | > 0.05 |
| PSA diagnóstico, mediana (RI) | 5.9 (4.97) | 4.6 (2.15) | - |
| Gleason* post-PR | |||
| ≤ 6 | 1 | 11 | - |
| 7 | 9 | 9 | - |
| ≥ 8 | 15 | 3 | - |
| Estadio patológico post-PR | |||
| T2 a-c | 11 | 20 | - |
| T3 a | 9 | 3 | - |
| T3 b | 5 | 0 | - |
| PSA post-PR, mediana (RI) | 0.08 (0.82) | 0.01 (0.017) | - |
| PSA último, mediana (RI) | 19 (12.9) | 1.7 (1.4) | <0.001 ** |
| PSAV, mediana (RI) | 4.1 (2.9) | 0.3 (0.3) | <0.001 ** |
| PSADT, mediana RI | 5.5 (3.2) | 16.3 (5) | <0.001 ** |
| TC estadificación RCP | 0 | 0 | - |
| CO estadificación RCP | 0 | 0 | - |
| PETC metástasis ganglionar positiva | 5 | 0 | - |
| PETC metástasis óseas axial positiva | 9 | 0 | - |
| PETC metástasis óseas no axial positiva | 4 | 0 | - |
| PETC lecho quirúrgico positivo + + | 7 | 0 | - |
N: número de pacientes. *ISUP 2014. 56,25% (n = 27) de los pacientes habáan realizado la prostatectomía antes de la implementación de esta nueva clasificación, lo que explica el alto porcentaje de Gleason 6. DE: desvío estándar, RI: rango intercuartil. * Valor P obtenido de prueba T de muestras independientes. ** Valor P obtenido de prueba de Wilcoxon de muestras independientes. En negrita, valores P significativos. ++ todos los pacientes tuvieron confirmación histopatológica del lecho quirúrgico por biopsia.
El PSAG presentó una mediana para el grupo PETC negativo de 1,7 ng/ml [el rango intercuartilo fue de 1,4 ng/ml con un cuartil 1 (Q1) de 1 y un cuartil 3 (Q3) de 2,4 ng/ml]. Para el grupo PETC positivo se observó una mediana de 19 ng/ml [el rango intercuartilo fue de 12,9 ng/ml con un Q1 de 14,3 ng/ml y un Q3 de 27,2 ng/ml]. La comparación de medianas entre los grupos mostró que existen diferencias estadísticamente significativas (W = 2,81, p = < 0.001) (►Tabla 1).
El PSADT presentó una mediana para el grupo PETC negativo de 16,3 meses, [el rango intercuartilo fue de 5 meses con un Q1 de 14,5 meses y un Q3 de 19,5 meses]. Para el grupo PETC positivo se observó una mediana de 5,5 meses [el rango intercuartilo fue de 3,15 meses con un Q1 de 4,35 meses y un Q3 de 7,5 meses]. La comparación de medianas entre los grupos mostró que existen diferencias estadísticamente significativas (W = 329,5, p = < 0.001) (►Tabla 1).
Al categorizar a los pacientes según su PSADT con un punto de corte 12 meses, el 96% de los pacientes que tuvieron un PSADT < 12 meses, presentaron PETC positiva, siendo esta proporción estadísticamente significativa (χ2 =36,3, G.L = 1, p = < 0.001) (►Gráfico 1A y 1B).

Gráfico 1A PSADT 6 meses. Al categorizar la PSADT con un punto de corte de ≥ 6 meses, se observó en los pacientes con un valor 6 meses que 23 PETC fueron negativas y 10 fueron positivas, mientras que de los 15 pacientes con un valor < 6 meses, todas las PETC fueron positivas.

Gráfico 1B PSADT 12 meses. Para un nuevo punto de corte de 12 meses, se observó que de las 22 PETC con un valor ≥ 12 meses, 21 PETC fueron negativas y 1 fue positiva, mientras que, de los 26 pacientes con valores < 12 meses, 24 PETC fueron positivas y 2 fueron negativas. De los resultados expuestos se determinó que el punto de corte de 12 meses fue el mejor clasificador del resultado de la PETC.
La PSAV presentó una mediana para el grupo PETC negativo de 0,03 ng/ml/año [el rango intercuartilo fue de 0,03 ng/ml/año con un Q1 de 0,02 ng/ml/año y un Q3 de 0,05 ng/ml/año]. Para el grupo PETC positivo se observó una mediana de 4,1 ng/ml/año [el rango intercuartilo fue de 2,9 ng/ml/año con un Q1 de 3 ng/ml/año y un Q3 de 5,9 ng/-ml/año]. La comparación de medianas entre los grupos mostró que existen diferencias estadísticamente significativas (W = 285, p = < 0.001) (►Tabla 1).
Al categorizar a los pacientes según su PSAV con un punto de corte 0,75 ng/ml/año, el 92% de los pacientes que tuvieron un PSAV > 0,75 ng/ml/año, presentaron PETC positiva, siendo esta proporción estadísticamente significativa (χ2 =36,8, G. L= 1, p <0,001) (►Gráfico 2A y 2B).

Gráfico 2A PSAV 1ng/ml/año. Al categorizar la PSAV con un punto de corte de 1 ng/mL/año, se observó que para los pacientes con un valor < 1 ng/ml/año, 22 PETC fueron negativas y 2 fueron positivas, mientras que en los pacientes con valores ≥ 1 ng/ml/año, 23 PETC fueron positivas y 1 fue negativa.

Gráfico 2B PSAV 0,75 ng/ml/año. Para un nuevo punto de corte de 0,75 ng/mL/año, se observó que los pacientes con un valor < 1 ng/ml/año todos tuvieron una PETC negativas, mientras que en los pacientes con valores ≥ 1 ng/ml/año, 25 PETC fueron positivas y 1 fue negativa. De los resultados expuestos se determinó que el punto de corte de 0,75 ng/mL/año es un mejor clasificador del resultado de la PETC.
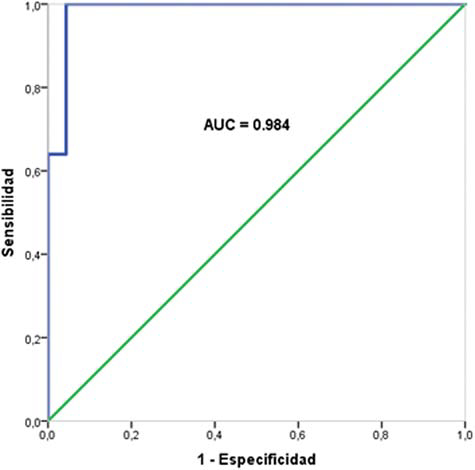
Para obtener los puntos de corte de las cinéticas del PSA en nuestra muestra de pacientes se realizaron las curvas ROC para PSAV (►Gráfico 3) y para PSADT (►Gráfico 4). Se observó para PSAV que el área bajo la curva fue igual a 0,984 y que el punto de corte con mayor capacidad de discriminación fue de 0,785 ng/ml/año (sensibilidad = 1; especificidad = 0,96). Con los valores obtenidos de la sensibilidad y especificidad del PSAV se calcularon las LR, siendo LR + = 25 y LR- = 0.
Para el PSADT, se observó que el área bajo la curva fue igual a 0,992 y que el punto de corte con mayor capacidad de discriminación fue de 11 meses (sensibilidad = 1; especificidad = 0,96). Con los valores obtenidos de la sensibilidad y especificidad del PSAV se calcularon las razones de verosimilitud, siendo LR + = 11,1 y LR- = 0. Por esto, aunque se utilizaron los puntos de corte del PSAV y el PSADT evaluados en otras series. Cuando se evaluó el mejor punto de corte en nuestra cohorte, evidenciamos que este fue de 0,78 ng/-ml/año para el PSAV y de 11 meses para el PSADT.
Discusión
La PETC ha sido extensamente utilizada para evaluar a los pacientes con una RCP luego de una PR. El PSAG se ha utilizado como el predictor más fuerte para solicitar la PETC. No obstante, este es un marcador inespecífico, especialmente cuando los valores de PSA son <1 ng/ml.12 Diferentes series mostraron una tasa de detección de la PETC variable, independientemente del sitio de recurrencia, para valores de PSA >2 ng/ml.13,14,15. Así, de Jong y col.14 no encontró PETC positiva en pacientes con un PSA < 4 ng/ml después de la PR. Schillaci y col.16 mostraron una tasa de detección del 87% con valores de PSA >4 ng/ml, mientras que Panebianco y col.17 y Giovacchini y col.18 concluyeron que valores de PSA >3 ng/ml estaban asociados con una tasa de detección del 82% y del 73%, respectivamente. A su vez, Castellucci y col.19 reportaron una baja tasa de detección (28%) con un PSA <1,5 ng/ml. Oyama y col.20 reportaron una sensibilidad del 4% en pacientes con un PSA <3 ng/ml. En nuestra serie de casos evidenciamos una tasa de detección del 52%. Además, evidenciamos que la probabilidad de tener una PETC negativa con un PSA 1,7 ng/ml fue estadísticamente significativa al compararla con un PSA 19 ng/ml.
Debido a lo inespecífico que es el PSAG, se han estudiado otros indicadores que permitan aumentar la probabilidad pre-test de la PETC positiva. Un estudio inicial demostró que los pacientes con una PETC positiva tuvieron un menor tiempo duplicación de PSA y una mayor velocidad del PSA que los pacientes con una PETC negativa.21 Diferentes estudios han evidenciado significancia estadística al evaluar la cinética del PSA en la detección la RCP después de una PR con PETC con un PSA >2 ng/ml como punto de corte.19,20,21,22,23,24 Marzola y col.25 evidenciaron que la tasa de PETC positiva era proporcional al ascenso del PSA, principalmente en los pacientes que presentaban una cinética de PSA elevada. A similares conclusiones arribaron otros autores.16,23,26 Giovacchini y col.24 notaron, al evaluar con una PETC a pacientes con RCP, que el bajo tiempo de PSADT se asociaba independientemente con el riesgo de tener una PETC positiva, al evidenciar que el 81% de los pacientes con una PETC positiva tenían un PSADT < 3 meses. Estos mismos autores, en otra publicación, constataron que la frecuencia de PETC positiva aumentaba con el aumento del PSAV al evidenciar que sólo el 21% de los pacientes con una PETC positiva tenían un PSAV <1 ng/ml/año.22 Castellucci y col.19 encontraron que el PSADT fue un predictor positivo de PETC positiva, utilizando un PSADT de 7 meses, con una sensibilidad del 94%. Al evaluar la cinética del PSA con valores de corte de PSA <2 ng/ml. Chiaravalloti y col.27 constataron que el PSADT (< 6 meses) y el PSAV (>1 ng/ml/año) eran estadísticamente significativos en la detección de RCP con una PETC, no así el valor de PSAG. A similares resultados arribaron Castellucci y col.19, al evaluar la RCP temprana con valores de PSA <1,5 ng/ml.
Al estudiar el desempeño de la PETC en la RCP con valores de PSA <1 ng/ml, Gómez de la Fuente y col.28 no encontraron significancia estadística respecto al PSADT y PSAV en la detección de RCP con una PETC en ningún grupo de pacientes. No obstante, Mamede y col.29 evaluaron la performance de la PETC en pacientes con RCP temprana con valores de PSA <0,5 ng/ml y constató que la PETC fue positiva en el 38% de los pacientes con un PSADT <6,23 meses; contra el 3% en los pacientes con un PSADT >6,23 meses, siendo este hallazgo estadísticamente significativo en el análisis multivariado.
Recientemente, Treglia y col.7 demostraron, en un meta-análisis, que existe una correlación significativa entre la cinética del PSA y la tasa de detección de la PETC en los pacientes con una RCP. Además, evidenciaron que el PSADT <6 meses y el PSAV >1 ng/ml/año son fuertes predictores de PETC positiva en estos pacientes. Estos hallazgos fueron vistos también por otros autores (►Tabla 2).
Tabla 2 Tasa de detección según los valores de corte de PSADT y PSAV
| Autor | PSADT (meses) valor de corte | TD % | S % | E % | PSAV (ng/ml/año) valor de corte | TD % | S % | E % |
|---|---|---|---|---|---|---|---|---|
| Castellucci21 2009 | >6,4 6,2 ≤ 4,<2 | 20, 40, 48, 60 | ND | ND | <1,1 ≤ 2,2 ≤ 5 >5 | 12, 34, 42, 70 | ND | ND |
| Giovacchini24 2010 | <3, 3-6, >6 | 81, 61, 27 | ND | ND | ND | ND | ND | ND |
| Schillaci16 2012 | <6, >6 | 84, 50 | ND | ND | >2, <2 | 86, 37 | ND | ND |
| Giovacchini22 2012 | ND | ND | ND | ND | <1, 1-2, >2 | 21, 56, 76 | ND | ND |
| Rybalov30 2013 | 0-3, 3-6, 6-9, 9-12, 12-24, >24 | 79, 69, 70, 61, 68, 60 | ND | ND | <1, 1-2, 2-4, 4-6, 6-10, > | 40, 71, 84, 86, 78, 88 | ND | ND |
E, Especificidad; ND, No disponible; S, Sensibilidad; TD, Tasa de detección.
En nuestra serie de casos, se observó que el PSAV presentó una mediana para el grupo PETC negativo de 0,03 ng/ml/año y para el grupo PETC positivo de 4,1 ng/ml/año, siendo esta estadísticamente significativa. Así también, se constató que con un punto de corte de PSAV >0,75 ng/ml/año, el 92% de los pacientes presentaban una PETC positiva. Al evaluar el PSADT, se mostró un PSADT de 16,3 meses para el grupo PETC negativo y un PSADT de 3,15 meses para el grupo PETC positivo, siendo estadísticamente significativa. También se constató que con un punto de corte <12 meses, el 96% de los pacientes tuvieron una PETC positiva.
A través de las curvas ROC de nuestra serie de pacientes se evidenció que los puntos de corte de las cinéticas del PSA con mayor capacidad de discriminación fueron de 0,78 ng/ml/año para PSAV y de 11 meses para PSADT, similares a los establecidos por otros autores.7 Para dichos puntos de corte, los cálculos de LR para PSAV y PSADT mostraron un LR+ > 10 y un LR- <0,1. Visto de otro modo, es 25 veces más verosímil que un paciente con una PETC positiva tenga un PSAV > 0,785 ng/ml/año, en comparación con un paciente con una PETC negativa y 11 veces más verosímil que un paciente con una PETC positiva tenga un PSADT < 11 meses, en comparación con un paciente con PETC negativa. Estos hallazgos podrían evidenciar la utilidad de las cinéticas del PSA como marcadores predictivos de positividad de la PETC.
Ninguno de los factores de riesgo conocidos parece influenciar en la tasa de detección de la PETC tanto como la cinética del PSA. No obstante, al evaluar el score de Gleason en nuestra serie, los pacientes con una puntuación ≥ 7 tuvieron una mayor frecuencia de la PETC positiva que los pacientes con un score de Gleason menor. Esto mismo constató Cimitan9, quien vio que la PETC fue positiva en el 49% de los pacientes con un score de Gleason 6 y en el 79% de los pacientes con un score de Gleason ≥ 8. Este investigador, al realizar un estudio multivariado, evidenció que el score de Gleason era un factor predictivo independiente de PETC positiva.
Las posibles limitantes de nuestro trabajo son: el bajo número de pacientes incluidos, que no todos los pacientes con una PETC positiva tuvieron confirmación histopatológica, que este no es un trabajo multicéntrico y también que el diseño no fue prospectivo ni aleatorizado.