Introducción
Los gliomas difusos representan un grupo heterogéneo de tumores del sistema nervioso central (SNC) con morfología astrocítica y oligodendroglial que, acorde a la clasificación de la Organización Mundial de la Salud (OMS), incluye los grados II y III, así como el glioblastoma (grado IV), siendo ese último el de peor pronóstico y mayor grado de agresividad.1 Los gliomas de menor grado (grado II y III) poseen características clínicas y moleculares propias que permiten distinguirlos en subtipos molecularmente definidos. Históricamente, su clasificación se basó de manera exclusiva en características histológicas, aunque limitadas por la alta variabilidad inter e intraobservador. La reciente actualización agrega por primera vez marcadores moleculares y genéticos con la finalidad de elaborar una entidad integral.1,2
Las características moleculares de los gliomas poseen mayor relación con el desenlace clínico del paciente que el que reflejan las características histológicas.3,4 Los gliomas grado II y III, sean astrocitomas u oligodendrogliomas, comparten mutaciones genéticas en relación al gen IDH (isocitrato deshidrogenasa), tanto el IDH1 como el IDH2.1 El estado mutacional del IDH y la codeleción de los cromosomas 1p y 19q son parámetros definitorios en su clasificación, estableciéndose tres subgrupos moleculares: 1) gliomas IDH-mutado y 1p/19q codelecionado (características moleculares reconocidas típicamente en los oligodendrogliomas), 2) gliomas IDH-mutado y 1p/19q no codelecionado, 3) gliomas IDH no mutado.2,3,4 Otros marcadores moleculares implicados en la génesis tumoral como las mutaciones del gen TP53 y la inactivación del ATRX (α thalassemia/intelectual disability syndrome X-linked) se encuentran fuertemente asociados al astrocitoma y son casi siempre mutuamente excluyentes con la presencia de la codeleción 1p/19q.3,4 Esa clasificación molecular es particularmente útil en predecir el pronóstico, ya que la presencia de la codeleción 1p/19q se asocia a mejor respuesta terapéutica y mayor sobrevida.3,4,5,6
En los últimos años, varios investigadores han estudiado la asociación entre las características morfológicas de los tumores por imágenes y su perfil de expresión genética que permiten predecir en cierto grado el subgrupo molecular. En particular, Patel y col.5, en el año 2017, describieron el signo del mismatch T2-FLAIR como la completa o casi completa hiperintensidad de señal en secuencia potenciada en T2 y señal hipointensa en secuencia FLAIR a excepción de un halo hiperintenso. Ese signo es uno de los más prometedores por su alto valor predictivo positivo (VPP), y considerado un biomarcador radiológico altamente especifico y con 100% de VPP en predecir la ausencia de la codeleción 1p/19q en gliomas IDH-mutados.7
La hipótesis del trabajo es que algunas características imagenológicas en RM, en especial el signo del mismatch T2-FLAIR, podrían ser una excelente herramienta diagnóstica en predecir el estado del 1p/19q entre los gliomas IDH-mutados (grado II y III), pudiendo ser fácilmente identificable en resonancia magnética (RM) convencional, sin la necesidad de técnicas avanzadas. Por lo tanto, nuestro objetivo es evaluar sobre una cohorte de pacientes con gliomas IDH-mutado (grado II y III) molecularmente definidos, el rendimiento del signo mismatch T2-FLAIR y otras características morfológicas de los tumores en predecir el estado del 1p/19q, y su reproducibilidad interobservador.
Métodos
Este trabajo fue aprobado por el comité de ética médica institucional.
Diseño del estudio y selección de pacientes
Es un estudio retrospectivo, descriptivo y analítico sobre una cohorte de pacientes con gliomas IDH-mutados (grado II y III) que fueron diagnosticados durante el periodo 2014-2019. Los pacientes fueron seleccionados a partir de la base de datos de la institución.
Criterios de inclusión: pacientes adultos (mayores de 18 años), con diagnóstico histológico de glioma de grado II o III, presencia de mutación IDH, clasificación molecular definida respecto al estado 1p/19q, localización supratentorial e imágenes de RM prequirúrgicas.
Criterios de exclusión: pacientes con RM incompleta, sin las secuencias relevantes para la evaluación de los parámetros a estudiar.
Se recolectaron datos demográficos de los pacientes al igual que el diagnóstico histopatológico y grado.
Neuropatología
Los casos incluidos en el trabajo surgen de los informes de anatomía patológica recabados en la historia clínica electrónica. Los tejidos fueron evaluados por el laboratorio de patología y biología molecular de la institución. Se realizó una revisión de los diagnósticos histológicos y del estado de ATRX evaluado por inmunohistoquímica y por medio de la técnica de reacción en cadena de la polimerasa con análisis del polimorfismo de los fragmentos de restricción (PCR-RFLP) se determinaron las mutaciones en el codón 132 del gen IDH1 y, en algunos casos, la mutación del codón 172 del gen IDH2 por secuenciación directa. La detección de las deleciones cromosómicas del 1p y 19q, se determinó por análisis cuantitativo de microsatélites por reacción en cadena de la polimerasa en tiempo real (Real Time PCR). Asimismo, se estudiaron otras mutaciones como P53, receptor del factor de crecimiento epidérmico (EGFR), 10q y p16, como parte del protocolo en la caracterización de las alteraciones genéticas vinculadas a la gliomagénesis.
Evaluación de las imágenes
Los estudios de RM se adquirieron en cuatro equipos. Dos de ellos 3T: General Electric Discovery 750 3T (GE Healthcare, Milwaukee, Wisconsin), y dos 1.5T: Achieva (Philips Medical Systems, Países Bajos) y General Electric Signa HXT (GE Healthcare, Milwaukee, Wisconsin).
Para la evaluación de los parámetros a estudiar, se utilizaron secuencias ponderadas en T2, FLAIR y SWAN/ GRE adquiridas en plano axial. Algunos pacientes contaban con secuencias volumétricas FLAIR CUBE y T2 CUBE.
Las imágenes fueron evaluadas en la plataforma Carestream Vue PACS versión 11 (Carestream, Estados Unidos) por dos neuroradiólogos con siete (evaluador A: M.C) y tres (evaluador B: E.O) años de experiencia, de forma independiente y enmascarada al diagnóstico histológico y molecular. Se determinó la presencia o ausencia del signo del mismatch T2-FLAIR, localización tumoral, bordes (netos/difusos), señal en secuencia ponderada en T2 (homogénea/heterogénea), grado de infiltración cortical (mayor a 50%/menor al 50%) y la presencia o ausencia de inhomogeneidad de señal en T2*.
El signo del mismatch T2-FLAIR fue determinado subjetivamente como la completa o casi completa hiperintensidad de señal en secuencias ponderadas en T2 y marcada hipointensidad en FLAIR del área hiperintensa en secuencias ponderadas en T2, a excepción de un halo hiperintenso, visible en más del 50% del área tumoral (►Fig. 1). Para dicha valoración, se utilizaron como referencia estudios publicados respecto a la descripción del signo.7,8
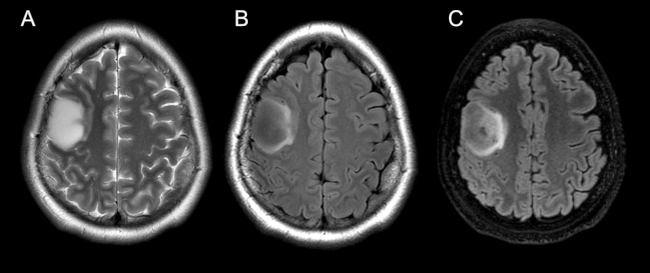
Fig. 1 Cortes axiales en secuencia ponderada en T2-PROPELLER (A), FLAIR (B) y reconstrucción en plano axial de secuencia FLAIR CUBE (C) en un paciente con diagnóstico de astrocitoma IDH-mutado, 1p/19q no codelecionado. Se observa a nivel frontal derecho una lesión ocupante de espacio intra-axial, de bordes netos y señal homogénea que presenta el signo del mismatch T2-FLAIR. El signo del mismatch consiste en la completa o casi completa hiperintensidad de señal en secuencias ponderadas en T2 (A) e hipointensidad en secuencia FLAIR a excepción de un halo hiperintenso, tal como es evidente en las imágenes (B y C).
La localización se estableció en base al compromiso tumoral de las siguientes áreas: frontal, fronto-insular, fronto-temporo-insular, fronto-parietal, fronto-cuerpo calloso, temporal, temporo-insular, temporo-hipocampal, parietal, parieto-temporal, parieto-temporo-occipital, fronto-parieto-temporo-occipital, fronto-parieto-temporal, fronto-cuerpo calloso-insular.
En la valoración de los bordes, se clasificaron como netos aquellos tumores en los cuales la interfaz entre el tumor y el parénquima normal pudiera ser delimitada perfectamente. En caso contrario fueron asignados como difusos.
La señal tumoral fue valorada en secuencias ponderadas en T2, siendo heterogéneos aquellos tumores que mostraron dos o más intensidades de señal intralesionales. De lo contrario, aquellos tumores que demostraron una única intensidad de señal fueron clasificados como homogéneos.
La ►Figura 2 ejemplifica las características por imágenes en relación a la valoración de los bordes y la señal en un paciente 1p/19q no codelecionado (A, B) y codelecionado (C, D).
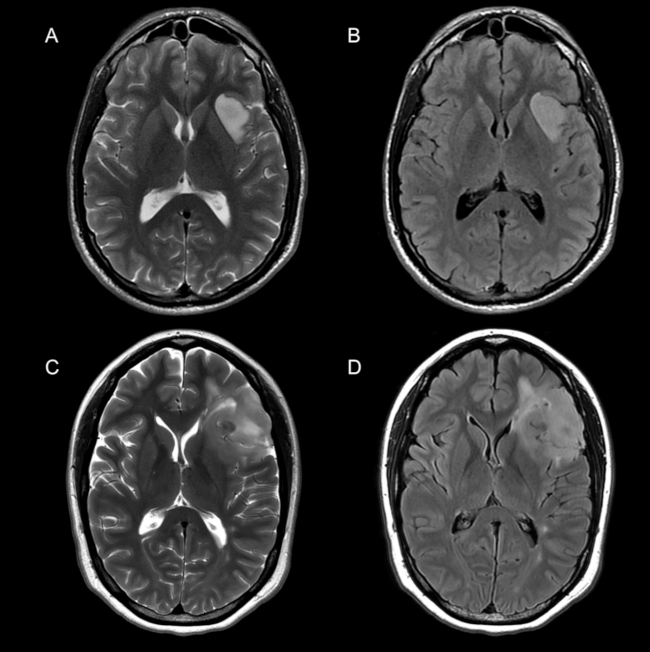
Fig. 2 Cortes axiales en secuencia potenciada enT2 (A, C) y FLAIR (B, D) en dos pacientes diferentes con diagnóstico de Astrocitoma IDH-mutado, 1p/ 19q no codelecionado (A, B) y oligodendroglioma IDH-mutado, 1p/19q codelecionado (C, D). (A, B) Se reconoce una lesión neoproliferativa insular izquierda de bordes netos y señal homogénea, sin signo del mismatch T2-FLAIR. (C, D) Se identifica una lesión neoproliferativa frontal izquierdo de bordes difusos y señal heterogénea, siendo claramente evidente la presencia de dos o más intensidades de señal intralesionales valorado en secuencia ponderada en T2 (C).
El grado de infiltración cortical fue considerado como la relación entre el perímetro total del tumor y la corteza con alteración de señal en secuencias ponderadas en T2 en comparación a la corteza homóloga contralateral, determinando de forma subjetiva un compromiso mayor o menor al 50% (►Fig. 3).
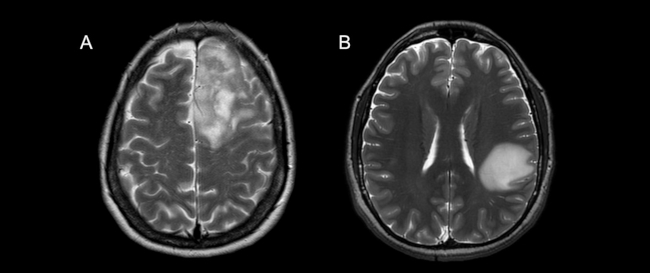
Fig. 3 Cortes axiales en secuencia ponderada en T2 en dos pacientes diferentes con diagnóstico de oligodendroglioma IDH-mutado, 1p/ 19q codelecionado (A) y astrocitoma IDH-mutado, 1p/19q no codelecionado (B). La imagen A evidencia una lesión neoproliferativa a nivel frontal izquierdo de bordes difusos y señal heterogénea con infiltración cortical mayor al 50%. En la imagen B se identifica una lesión neoproliferativa de bordes netos y señal homogénea con infiltración cortical menor al 50%.
En la valoración de la inhomogeneidad de señal en secuencias ponderadas en T2*, se determinó el sangrado o la calcificación únicamente en los casos que contaban con la secuencia SWAN e imágenes de fase que puedan diferenciar las variables con seguridad. En caso contrario, se describió como imagen indefinida, o ausente si no presentaba inhomogeneidades intratumorales.
En los casos en los que hubo discordancia entre los dos evaluadores respecto del signo del mismatch T2-FLAIR, los bordes y la señal, un tercer neuroradiólogo (P.Y) de 20 años de experiencia evaluó las imágenes y definió las variables discordantes.
Análisis estadístico
La concordancia interobservador se calculó con el coeficiente kappa y se interpretó según lo establecido por Landis y Koch9 (pobre 0,0, leve de 0,01 a 0,2, aceptable entre 0,21 y 0,40, moderada entre 0,4 y 0,60, considerable entre 0,61 y 0,80, casi perfecta entre 0,81 y 1,0).
Con el fin de evaluar la asociación y capacidad de predicción de cada una de las características con el diagnóstico molecular de codeleción, se realizó en primera instancia un análisis univariado para determinar si las diferencias en las frecuencias o proporciones entre cada uno de los grupos se debían al azar. Para ello, se utilizan las pruebas de Chi2 y t de Student, tomando como significativo un valor de p de 0,05.
Posteriormente, se realizó una regresión logística multivariable donde la variable dependiente fue la presencia o ausencia de codeleción 1p/19q y las variables independientes fueron el signo de mismatch, los bordes, la señal y la infiltración cortical, reportando Odds Ratio con intervalos de confianza del 95% para cada una de las variables independientes al igual que el respectivo valor de p.
Se construyeron tablas de contingencia para calcular los estadígrafos de diagnóstico para la variable con mayor capacidad de discriminación entre los dos grupos e igualmente calculamos el área bajo la curva ROC mediante un análisis ROC no paramétrico para un clasificador único.
Para el análisis estadístico, se utilizó el software Stata (Version 15.0, StataCorp, College Station, Texas).
Resultados
De nuestra cohorte de 53 gliomas IDH-mutados, 51% fueron mujeres (n = 27) y 49% fueron hombres (n = 26). La edad media de los pacientes fue de 38,6 +/- 12,4 años (rango 18-67 años). La prueba t de Student en nuestra muestra poblacional demostró una diferencia en la edad media entre los pacientes codelecionados y no codelecionados (41,6 13,53 versus 36,33 11,28) respectivamente, mostrando que los pacientes codelecionados son mayores 5,27 3,4 años (95% CI, -1,57 a 12,114 años) t (51) =1,545, p < ,0642. De los 53 gliomas estudiados, 94,3% (n = 50) presentaron la mutación IDH1 y 5,7% (n = 3) la mutación IDH2. El 56,6% (n = 30) fueron no codelecionados, y el 43,4% restante (n = 23) fueron codelecionados. El diagnóstico histológico fue de astrocitoma difuso grado II en el 47,17% (n = 25), astrocitoma anaplásico grado III en el 3,77% (n = 2) y oligodendroglioma en el 43,4% (n = 23). En tres casos (5,67%) hubo diagnóstico histológico previo a la clasificación molecular de oligodendroglioma (n = 2) y oligodendroglioma anaplásico (n = 1), sin embargo, en el estudio molecular diferido fueron reclasificados en el subtipo no codelecionados.
Concordancia interobservador
Los dos evaluadores demostraron una concordancia interobservador casi perfecta respecto al signo del mismatch κ =,907 (95% CI, 0,781 a 1,0), p < ,0001.
El evaluador A marcó la presencia de mismatch en 16 pacientes, mientras que el evaluador B en 15 pacientes. El tercer neuroradiólogo de mayor experiencia evaluó tres casos donde hubo discordancia, y determinó la positividad del signo en dos de ellos y ausencia en uno, dando un total de 16 casos (30,18%) con mismatch positivo.
La concordancia fue moderada respecto a la localización κ = 0,545 (95% CI, 0,52 a 0,65), p < ,0001, bordes κ = 0,620 (95% CI, 0,423 a , 816), p < ,0001 y señal κ = 0,585 (95% CI, 0,361 a , 809).
La concordancia fue discreta para la susceptibilidad magnética κ = 0,331 (95% CI, 0,263 a. 474), p < ,0006 y para la infiltración cortical κ = 0,205 (95% CI, -0,056 a . 466), p < ,0591.
Análisis univariado
Se realizó un análisis univariado para evaluar la probabilidad de que las diferencias en los parámetros morfológicos estudiados por RM y el estado molecular del 1p/19q sean debido al azar. En la ►Tabla 1 se representan las principales características de los dos grupos estudiados.
Tabla 1 Principales características de los dos grupos estudiados (codelecionado y no codelecionado) en el análisis univariado
| Variables | Codeleción 1p/19q | No codeleción 1p/19q | P valor |
|---|---|---|---|
| (n = 23) | (n = 30) | ||
| Sexo | |||
| Hombres | 38.4% | 61.5% | p = .477 |
| Mujeres | 48.1% | 51.8% | |
| Edad - años | 41.6 ± 13.53 | 36.33 ± 11.28 | p < .0642 |
| Mismatch | |||
| Positivo | 6.25% | 93.75% | p= <.0001 |
| Negativo | 59.46% | 40.54% | |
| Bordes | |||
| Difusos | 52.78% | 47.22% | p = .045 |
| Netos | 23.53% | 76.47% | |
| Infiltración cortical | |||
| <50% | 46.67% | 53.33% | p = .769 |
| >50% | 42.11% | 57.89% | |
| Señal | |||
| Homogénea | 30.77% | 69.23% | p = 0.349 |
| Heterogénea | 47.50% | 52.50% | |
| Susceptibilidad | |||
| Ausente | 40% | 60% | |
| Indefinida | 50% | 50% | |
| Calcio | 0% | 0% | |
| Sangre | 100% | 0% | |
El análisis demostró diferencia estadísticamente significativa únicamente en dos de los parámetros estudiados. Uno de ellos fue el signo del mismatch, el cual fue positivo en nuestra cohorte en 16/53 (30,18%). Quince de ellos (93,75%) fueron no codelecionados y uno solo (6,25%) fue codelecionado (Fischer exact test p = < ,0001). El segundo parámetro fue la característica de los bordes, siendo netos en 13 pacientes no codelecionados (76,47%) y en 4 codelecionados (23,53%) C2(1, N = 53) = 4,0214, p = ,045.
El resultado de la neuropatología del único paciente codelecionado con presencia del signo del mismatch (falso positivo) de nuestra cohorte, presentó adicionalmente a la codeleción 1p/19q, mutación del gen p53, deleción del gen 10q, y el estudio por inmunohistoquimica del ATRX evidenció su inactivación (►Fig. 4). Esos hallazgos sugieren el diagnóstico de un probable glioma mixto.
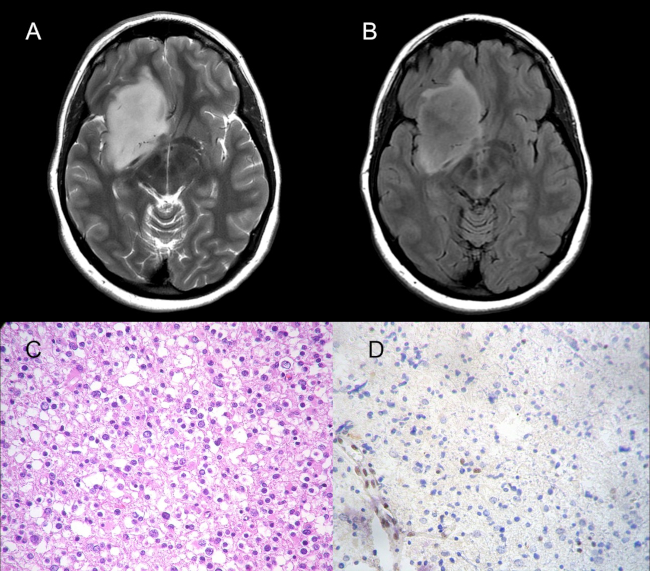
Fig. 4 Cortes axiales en secuencia T2-PROPELLER (A) y T2-FLAIR (B). Paciente falso positivo (presencia de codeleción y signo del mismatch). Se reconoce una lesión ocupante de espacio de localización fronto-insular derecha que presenta el signo del mismatch T2-FLAIR, en un paciente con diagnóstico de oligodendroglioma IDH-mutado, 1p/19q codelecionado. El estudio histológico (C) con H&E (40X) evidencia proliferación glial con células que exhiben marcado pleomorfismo nuclear, algunas con halos claros perinucleares. En la marcación con técnica de inmunohistoquímica de ATRX (D) 40X se observa pérdida de la expresión de la proteína ATRX en núcleos de células neoplásicas y retención en las células endoteliales. Las características moleculares del tumor sugieren un probable glioma mixto.
Las demás variables de RM estudiadas (infiltración cortical, señal e inhomogeneidad de señal en T2*) no mostraron diferencias estadísticamente significativas entre los dos grupos evaluados.
En la ►Tabla 2 se muestra las medidas de resumen diagnóstico para el signo de mismatch. La sensibilidad, especificidad, valor predictivo positivo y negativo del signo del mismatch para predecir la ausencia de la codeleción fue de 50%, 95,7%, 93,8% y 59,5% respectivamente.
Tabla 2 Medidas de resumen diagnóstico para el signo de mismatch T2-FLAIR
| Medidas de resumen diagnóstico | 95% Intervalo de Confianza | ||
|---|---|---|---|
| Sensibilidad | 50% | 31.3% | 68.7% |
| Especificidad | 95.7% | 78.1% | 99.9% |
| ROC area | 0.728 | 0.628 | 0.829 |
| Likelihood ratio (+) | 11.5 | 1.64 | 80.8 |
| Likelihood ratio (-) | 0.523 | 0.362 | 0.755 |
| Odds ratio | 22 | 3.26 | |
| Valor predictivo positivo | 93.8% | 69.8% | 99.8% |
| Valor predictivo negativo | 59.5% | 42.1% | 75.2% |
Análisis multivariado
Las variables que fueron estadísticamente significativas en el análisis univariado fueron estudiadas en el modelo de regresión logística multivariado (►Tabla 3) utilizando el estado de la codeleción como variable dependiente.
Tabla 3 Resultados del modelo de regresión logística multivariado
| Características en RM | Odds Ratio | Error estándar | z | p valor | [95% Conf. Interval] | |
| Mismatch | 30.47247 | 40.36308 | 2.58 | 0.010 | 2.272099 | 408.6845 |
| Bordes | 1.233625 | 1.217772 | 0.21 | 0.832 | .1782049 | 8.539776 |
| Señal | .6291439 | .6884606 | -0.42 | 0.672 | .0736709 | 5.372844 |
| Infiltración cortical | 3.873235 | 3.730763 | 1.41 | 0.160 | .5863845 | 25.58381 |
El análisis demostró que el signo del mismatch fue el parámetro con una mayor capacidad de discriminación del estado de codeleción 1p/19q b = 3,416824 p = 0,010, OR = 30,4 (95% CI: 2,27, 408,68).
Discusión
En este estudio retrospectivo, analizamos características por RM de gliomas IDH-mutado (grado II y III) en base a parámetros cualitativos a fin de valorar el rendimiento del signo mismatch T2-FLAIR y otras características morfológicas de los tumores en predecir el estado del 1p/19q.
El 30,18% de los 53 gliomas de nuestra cohorte presentó el signo del mismatch T2-FLAIR con una concordancia interobservador casi perfecta. De aquellos gliomas que mostraron el signo, solo uno (6,25%) presentó la codeleción 1p/19q, siendo los restantes no codelecionados. Ese signo, entre todos los parámetros morfológicos evaluados, fue el que obtuvo mayor capacidad en predecir el estado de codeleción 1p/19q.
En la primera publicación por Patel y col.2, el signo fue identificado en el 12% de los pacientes, tanto de la base de datos de entrenamiento (n = 125) como la de validación (n = 82), demostrando una alta especificidad y un valor predictivo positivo de 100% para determinar el subtipo molecular relacionado al astrocitoma: IDH-mutado, 1p/19q no codelecionado.7 Sucesivos estudios han reafirmado un VPP de 100% para predecir el subtipo molecular no codelecionado de los gliomas IDH mutados, sin reportar falsos positivos entre sus muestras.8,9,10
En nuestro estudio, documentamos un único paciente con diagnóstico histológico de oligodendroglioma y presencia de la codeleción 1p/19q que presentaba el signo del mismatch (►Fig. 4). Por consiguiente, y a diferencia de las publicaciones anteriormente mencionadas que han reportado un VPP de 100%, obtuvimos un VPP de 93,8% para predecir la ausencia de codeleción. En el conocimiento de los autores, este trabajo representa una de las pocas publicaciones a nivel mundial en demostrar falsos positivos relacionados al signo del mismatch. El primer reporte fue publicado por Juratli y col,11 quienes evaluaron el signo en 133 pacientes sobre una cohorte de gliomas grado II y III IDH mutados y no mutados, detectando mismatch T2-FLAIR en 28% y 29,5% de gliomas IDH-mutados, 1p/ 19q codelecionados grado II y grado III respectivamente. Lee y col.,12 reportaron también valores predictivos inferiores al 100% en un estudio donde obtuvieron 10 falsos positivos. Asimismo, Johnson y col.13 han publicado un reporte de casos donde identificaron el signo en pacientes que no cumplían de forma conjunta la mutación del IDH y la ausencia de la codeleción 1p/ 19q. En su reporte, exponen un paciente con diagnóstico de oligodendroglioma molecularmente definido que presenta el signo del mismatch.
Tal como se comentó previamente, el único falso positivo de nuestro estudio (presencia de signo del mismatch T2-FLAIR y de la codeleción 1p/19q) demostró ciertas particularidades en los resultados del análisis de la biología molecular. El estudio para la detección de mutaciones del gen p53 demostró una duplicación en los codones 241 S y 242 C del exón 7. Por otro lado, se detectó también la deleción del gen 10q. El estudio por inmunohistoquimica del ATRX evidenció su inactivación. Es de nuestro interés destacar esos hallazgos, ya que esas alteraciones genéticas como las mutaciones en el gen p53 no son características habituales de los oligodendrogliomas, más bien son alteraciones genéticas típicamente vinculadas a los astrocitomas. Como se comentó previamente y se expone en la bibliografía, la mutación del p53, al igual que la inactivación del ATRX, son mutuamente excluyentes con la codeleción 1p/19q. Esa incongruencia sugiere el diagnóstico de un glioma mixto, diagnóstico desaconsejado en la última clasificación dado que, con el estudio molecular, la mayoría son finalmente compatibles con oligodendrogliomas al estar codelecionados o astrocitomas en caso contrario.1
Concretamente, encontramos que el signo del mismatch es un biomarcador radiológico con alta especificidad para predecir el estado 1p/19q, y es de gran utilidad en los casos en los que no hay disponibilidad del estudio molecular. Sin embargo, se debe tener en cuenta que existen falsos positivos, como fue documentado en nuestro estudio, así como en bibliografía previa, y que el signo presenta baja sensibilidad.
Por otro lado, conforme a los trabajos previos, la concordancia entre los observadores para el signo fue excelente, probablemente debido a la llamativa diferencia de contraste entre la alta señal en secuencias ponderadas en T2 y la baja señal en FLAIR, convirtiendo al signo en un método de valoración visual simple.7,8,12
Un objetivo secundario de nuestro trabajo fue evaluar las características morfológicas y su asociación con el subtipo molecular. El análisis de los tumores se realizó a partir de secuencias de RM convencional, sin la utilización de técnicas avanzadas, lo que permite que nuestros resultados sean fácilmente extrapolables a estudios realizados en centros no necesariamente de alta complejidad.
Johnson y col.,14 estudiaron las características por RM de oligodendrogliomas genéticamente definidos y encontraron diferencias estadísticamente significativas en relación a la distribución anatómica de los distintos subgrupos moleculares, siendo la región frontal y parietal más frecuente en los tumores codelecionados y la localización insular y temporal más frecuente en los no codelecionados. En nuestro estudio, si bien la concordancia interobservador fue moderada en relación a la localización tumoral, debemos comentar que, debido al amplio número de variables otorgadas al momento de planear el estudio, no hemos podido concluir con datos estadísticamente significativos sobre la asociación entre localización y subgrupo molecular.
El estudio anteriormente mencionado reportó además una mayor asociación entre la codeleción y dos características evaluadas: la presencia de bordes no circunscriptos y la heterogeneidad de señal. La evaluación de esos parámetros en nuestra cohorte obtuvo moderada concordancia interobservador, y los casos discordantes (10 respecto a los bordes y 9 a la señal) fueron evaluados por un tercer neuroradiólogo de mayor experiencia. Si bien en el análisis univariado presentó diferencias respecto a los bordes, ese parámetro no fue estadísticamente significativo en el análisis multivariado. La señal intralesional evaluada en secuencia ponderada en T2, por otra parte, no evidenció diferencias significativas en ninguno de los dos análisis estadísticos. En consonancia con estudios previos, el análisis del grado de infiltración cortical estuvo limitado por la mala concordancia interobservador.15 Respecto a la presencia de calcificaciones o inhomogeneidad de señal potenciada en T2*, no hemos encontrado diferencias estadísticamente significativas entre los dos grupos. La bibliografía respecto a las calcificaciones es ambigua, algunos trabajos encontraron ese hallazgo como característica propia de los gliomas codelecionados, mientras que los resultados de otros autores son similares a los publicados en nuestro trabajo.10,14,15
En nuestra muestra poblacional obtuvimos una diferencia en la edad media entre los dos subgrupos. Los pacientes codelecionados presentaron una edad media de 41,6 ± 13,53, mientras que los no codelecionados de 36,33 ± 11,28. Esa diferencia es consistente con lo publicado en la bibliografía.3 Sin embargo, en nuestra muestra obtuvimos un valor de p no significativo (p < 0,0642) y un intervalo de confianza que contiene el uno, lo cual podría explicarse por el tamaño muestral. Posiblemente un estudio con mayor número de pacientes permita demostrar que pacientes mayores tienden a presentar más frecuentemente gliomas del tipo codelecionado.
La incorporación de las bases genéticas y moleculares, que fueron en un primer momento utilizadas meramente con fines descriptivos, cumplen a día de hoy un rol central en la clasificación de los tumores. La distinción entre los dos subtipos, el codelecionado y el no codelecionado, es clínicamente importante dadas sus implicancias pronósticas y terapéuticas. La presencia de la codeleción 1p/19q se asocia a una mejor respuesta a la quimio y radioterapia, y a una mayor sobrevida en comparación con los gliomas difusos no codelecionados.3,4,5,6 Aquellos pacientes con la codeleción presentan una sobrevida media de 8 años, mientras que los no codelecionados de 6,3 años.3 De ese modo, los biomarcadores radiológicos permitirían una aproximación temprana y no invasiva al diagnóstico molecular, siendo de gran utilidad para el planeamiento terapéutico y el asesoramiento del paciente. Además, podrían sustituir el estudio por biología molecular en los casos que no pueden ser estudiados por el alto costo y la baja disponibilidad.
En nuestro trabajo incluimos únicamente pacientes que hayan sido estudiados para la codeleción 1p/19q y excluimos aquellos con estudio molecular incompleto. De esa forma, nuestra cohorte fue conformada por gliomas molecularmente definidos acorde a la clasificación actual de los tumores del SNC. Nuestro estudio excluyó a pacientes con gliomas del tipo pediátrico dado que se encuentran involucradas otras mutaciones genéticas.
Debemos reconocer, como sesgo de selección, que muchos de los gliomas operados en la institución previo a la clasificación actual no fueron estudiados para la codeleción. Debemos señalar también como limitante que, en el planeamiento del estudio, la definición de cada una de las variables fue discutida teóricamente, no habiéndose realizado un entrenamiento práctico ni habiéndose guardado un set de datos imagenológicos con los cuales hacer un entrenamiento previo, como ha sido la metodología de estudio en otros trabajos publicados. Por otro lado, debemos destacar que algunos protocolos de RM contaban con secuencias volumétricas T2 CUBE y FLAIR CUBE, otros únicamente secuencias axiales ponderadas en T2-PROPPELLER y T2-FLAIR, mientras que otros contaban con ambas secuencias. Se debe mencionar también que la evaluación de las características estudiadas está también sujeta a variabilidad intraobservador, la cual no fue analizada de forma estadística en este trabajo.
También es importante mencionar que el tamaño de nuestra muestra es pequeño y que el análisis multivariado para el signo de mismatch reportó un Odds Ratio con un límite superior muy elevado en el IC95% (de 408,6) lo que también indica un probable sesgo en la muestra, por lo que creemos que son necesarios estudios futuros con un mayor número de pacientes en población latinoamericana con diseños más robustos.
Conclusión
El signo del mismatch T2-FLAIR es el único biomarcador radiológico que muestra asociación estadísticamente significativa en predecir el diagnóstico molecular de los gliomas IDH-mutados. Ese marcador posee una alta especificidad y un valor predictivo positivo para predecir el diagnóstico de astrocitomas IDH-mutados, no codelecionados, y su interpretación es sumamente útil en los casos donde no se cuente con biología molecular por su alto costo y baja disponibilidad. Sin embargo, se debe tener en cuenta la existencia de falsos positivos respecto al signo, como ha sido demostrado en nuestro estudio y en trabajos recientemente publicados, lo que disminuye su valor predictivo.














