Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista del Museo Argentino de Ciencias Naturales
On-line version ISSN 1853-0400
Rev. Mus. Argent. Cienc. Nat. vol.12 no.2 Ciudad Autónoma de Buenos Aires Dec. 2010
ECOLOGÍA
Algunos aspectos biológicos de Bryconamericus iheringii (Ostariophysi: Characidae) en dos arroyos de la alta cuenca del río Samborombón, Argentina
Ricardo A. Ferriz1, Cristina A. Bentos1, Guillermo R. López1-2 & Eduardo M. Fernández1
1 Museo Argentino de Ciencias Naturales "Bernardino Rivadavia" Av. A. Gallardo 470, C1405DJR Buenos Aires, Argentina. E-mail: maradentro@fibertel.com.ar, rferriz@macn.gov.ar, cbentos@macn.gov.ar.
2 Facultad de Veterinaria (UBA), Área de Medicina, Producción y Tecnología de Fauna Acuática y Terrestre. glopezfcvuba@yahoo.com.ar
Resumen: En este estudio se analizó los siguientes aspectos de la estructura poblacional de Bryconamericus iheringii: abundancia, factor de condición, relación machos-hembras, relación largo/peso y período reproductivo. Las muestras fueron tomadas en los arroyos Manantiales y El Portugués entre los meses los meses de mayo de 2004 y abril de 2005 con redes de arrastre. Los mayores valores de biomasa correspondieron a los meses de mayo, julio y marzo para el arroyo Manantiales, mientras que para El Portugués correspondieron a los meses de mayo, septiembre y marzo. En el arroyo Manantiales, tanto para machos como para hembras, el grupo de individuos < 25 mm de Lst dominaron en primavera, los comprendidos entre los 26-40 mm de Lst predominaron en los meses más cálidos, mientras que los comprendidos entre 41-60 mm de Lst abundan a finales del verano, otoño e invierno. En el arroyo el Portugués, individuos machos < 25 mm de Lst, estuvieron presentes en el verano, en el resto del año dominaron las tallas comprendidas entre 26-40 mm de Lst en los meses más cálidos y las tallas entre 41-60 mm de Lst lo hiceron en los meses más fríos. La relación entre sexos difirió significativamente de la razón 1:1, con predominio de hembras en casi todos los meses. Los valores más altos del factor K correspondieron al final de la primavera y al verano para ambos arroyos. Esta especie presenta crecimiento levemente alométrico, las diferencias en este factor entre machos y hembras se debería a la mayor talla de las hembras. El mayor número de hembras en maduración y maduras se observó en los meses de agosto, septiembre y noviembre en ambos arroyos y en post desove febrero-mayo en el arroyo Manantiales y marzo-mayo para El Portugués, lo que indicaría que el periodo de desove estaría comprendido entre los meses de agosto y noviembre.
Palabras clave: Peces; Abundancia; Reproducción; Bryconamericus iheringii; Buenos Aires.
Abstract: Some aspects of biology of Bryconamericus Iheringii (Ostariophysi: Characidae) in two streams in the high basin of the Samborombón river, Argentina. This study analyzed the following aspects of the Bryconamericus iheringii population structure: abundance patterns, condition factor, male-female sex ratio, relation between weight and length, and reproductive period. Samples were made monthly from May 2004 to April 2005 using small trawling nets, in the Manantiales and El Portugués streams. The highest values of biomass for the Manantiales stream corresponded to May, July and March, the highest values of biomass for El Portugués stream were for May, September and March. In the Manantiales stream, both for males and females, the set of individuals < 25 mm Lst dominated during the spring. Individuals included among the 26-40 mm Lst predominated in the warmer months, while those between 41-60 mm Lst abounded at the end of the summer, autumn and winter. In the Portuguese stream, individuals males < 25 mm Lst, were present in the summer, the rest of the year was dominated by sizes between 26-40 mm Lst during the warmer months. Sizes between 41-60 mm Lst dominated in colder months. The relationship between the sexes differed significantly from the 1:1 reason with predominance of females in almost every month. Higher values of K factor were recorded at the end of the spring and summer for both streams. This species has a slightly allometric growth and differences between males and females in this factor may be due to the greater size of females. The largest number of females in maturation and mature was observed in the months of August, September and November in both streams and during the post-spawning period in February-May in the Manantiales stream and in March-May in the Portuguese stream. This would indicate that the spawning period would be between the months of August and November.
Key words: Fishes; Abundance; Reproduction; Bryconamericus iheringii; Buenos Aires.
INTRODUCCIÓN
El orden Characiformes es uno de los grupos más diversos de peces neotropicales, presentando una gran variedad de formas, comportamientos y adaptaciones al medio (Lowe-McConnell, 1987), siendo la familia Characidae la que posee mayor número de especies, el género Bryconamericus es uno de los 88 descriptos como incertae sedis por (Lima et al., 2003). Liotta (2006) indica que en aguas de la República Argentina se hallán unas 13 especies de este género.
Bryconamericus iheringii (Boulenger, 1887) es un pequeño pez carnívoro que se alimenta secundariamente con algas crisófitas y clorofitas, de aguas quietas y vegetadas, siendo un importante recurso para los peces ictiófagos (Ringuelet, 1975; Destefanis & Freyre, 1972; Escalante, 1987; Grosman et al., 1996; López Cazorla et al., 2003; Menni, 2004). Posee una amplia distribución en Argentina que incluye las cuencas de los ríos Paraná, Uruguay y Río de La Plata (Almirón et al., 2008), el límite meridional de esta especie corresponde a los arroyos tributarios del río Sauce Grande en el sur de la provincia de Buenos Aires (Casciotta et al., 1999).
La mayor parte de la diversidad, de los peces Neotropicales, puede ser atribuida a especies de pequeño a mediano porte, como fue constatado por Vazzoler (1996) para el alto río Paraná, en lagunas relacionadas con el Paraná medio (Cordiviola de Yuan et al., 1984), para tributarios del río Uruguay (López et al., 1984), formada por especies de esta categoría de tamaño. Las especies de pequeño porte están principalmente distribuidas en riachos, donde llegan a componer, como mínimo, 50% del ensamble (Castro, 1999; Menni, 2004).
La distribución y la composición específica son de los factores de mayor importancia en el estudio de las poblaciones de peces, siendo la abundancia de los peces una particularidad de cada uno de los sistemas, lo cual es un reflejo de la capacidad de cada río de soportar una comunidad acuática determinada (Meffe & Berra, 1988; Matthews, 1998).
El objetivo del presente trabajo consiste en analizar las variaciones poblacionales y período reproductivo de Bryconamericus iheringii durante un ciclo anual.
MATERIALES Y MÉTODOS
El presente trabajo se llevó a cabo en los arroyos Manantiales o Campos (S 35° 02' 34'' - O 58° 19' 37'') y El Portugués (S 35° 04' 16'' - O 58° 26' 09''), ambos pertenecientes a la alta cuenca del río Samborombón, partido de San Vicente, provincia de Buenos Aires (Fig. 1).
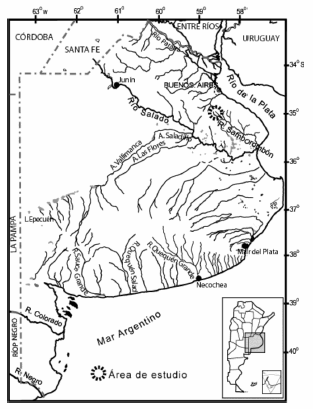
Fig. 1. Ubicación del área de estudio en la alta cuenca de Río Samborombón, provincia de Buenos Aires, República Argentina.
Se establecieron dos estaciones de muestreo, una en el arroyo Manantiales, a 1,5 km de su desembocadura en el arroyo San Vicente, y otra en el arroyo El Portugués, a 6 km de sus nacientes. En ambas se realizaron muestreos mensuales desde mayo de 2004 hasta abril de 2005. Mensualmente, en cada lugar de muestreo se determinó la profundidad y el ancho del cauce. Se tomó la temperatura del agua y del aire, se determinó el pH con un peachímetro Luftman P300, la conductividad del agua mediante instrumental Horiba U 10 y la transparencia mediante disco de Secchi (Tabla 1). Para las capturas se utilizó una red de arrastre de malla fina de 5 mm de distancia entre nudos, 10 metros de largo y 1,8 metros de altura. Para la determinación de numerosidad en cada una de las capturas se estandarizó el esfuerzo de pesca a 50 m de arrastre. De cada ejemplar se tomó el largo estándar (Lst) y el peso total (Pt). Se determinó el factor de condición (K) a través de la fórmula de Fulton (Tesch, 1968) K= Pt / Lst3 105.
TABLA 1. Características físico-químicas de los arroyos Manantiales y El Portugués, durante el período de muestreo, la media de cada variable figura entre paréntesis.

Se determinó la relación largo estándar/peso para machos y hembras de ambos ambientes estudiados, relacionadas por la fórmula: P = aLb , donde P es peso en gramos; L es el Lst en mm; para la estimación de los coeficientes a y b se utilizaron las ecuaciones de Rounsefell & Everhart (1962).
Los valores registrados para las variables ambientales se relacionaron con los obtenidos para la abundancia, peso y factor de condición en cada uno de los arroyos mediante la prueba de Mann-Whitney y el test de Mantel.
Se examinó macroscópicamente el estado de desarrollo sexual de las gónadas de machos y hembras para determinar el período reproductivo, siguiendo los estadios descriptos por Lampert et al. (2004): I: inmaduros; II: en maduración; III: maduros; IV: desovantes y V: post desove. Se establecieron, arbitrariamente, cuatro clases de talla (Lst) de intervalos de 5 mm cada uno: <25 mm; 26-40 mm; 41-60 mm y > 60 mm.
Los ejemplares analizados se depositaron en la colección del MACN-Ict.
RESULTADOS
En total se capturaron 1871 ejemplares, 1619 en Manantiales y 252 en El Portugués de una talla comprendida entre los 18 y 67 mm de Lst. El mayor índice de abundancia en ambos arroyos se obtuvo en el mes de mayo, los índices de abundancia más bajos correspondieron al mes de agosto en el arroyo Manantiales y al mes de diciembre en el arroyo El Portugués (Fig. 2).
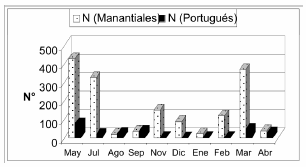
Fig. 2. Número de ejemplares de Bryconamericus iheringii capturados mensualmente, desde mayo de 2004 hasta abril de 2005, en los arroyos Manantiales y El Portugués.
En los histogramas resultantes de un año de muestreo (Fig. 3), se advierte que en el arroyo Manantiales, tanto para machos como hembras, el grupo de individuos < 25 mm de Lst dominan en el mes de noviembre, los comprendidos entre los 26-40 mm de Lst predominan en los meses de diciembre enero y abril (en ambos sexos), mientras que los comprendidos entre 41-60 mm de Lst abundan a finales del verano, otoño e invierno (en ambos sexos). En el arroyo el Portugués, individuos machos < 25 mm de Lst, sólo están presentes en los meses de enero y febrero, las tallas comprendidas entre 26-40 mm de Lst dominan en ambos sexos en los meses de enero y febrero. En el resto de los meses estudiados, y para ambos sexos, dominan los individuos incluidos en las tallas 41-60 mm de Lst.
Fig. 3. Representación porcentual de las clases de tallas de machos y hembras de Bryconamericus iheringii, en los arroyos Manantiales y El Portugués.
Considerando el total de los individuos, en cada uno de los meses estudiados, la diferencia entre sexos difirió significativamente de la razón 1:1 en cada una de las localidades estudiadas (p: 0,002 alfa: 0,050 en Manantiales; p: 0,050 alfa: 0,5 en El Portugués). Con predominio de hembras en casi todos los meses a excepción de lo observado en enero en el arroyo El Portugués (1:1) y en febrero donde dominan los machos sobre las hembras (0,54:1). En el arroyo Manantiales los machos dominan levemente en septiembre (0,79:1) y en enero se observa la razón 1:1 (Fig. 4).

Fig. 4. Composición por sexo de Bryconamericus iheringii, en los arroyos Manantiales y El Portugués.
El factor de condición K, medio, fue de 2,11 en El Portugués y 2,08 en Manantiales. El valor máximo de K correspondió al mes de diciembre para ambos arroyos, K = 2,96 en Manantiales y K = 2,56 en El Portugués (Fig. 5). En Manantiales el K mínimo correspondió al mes de mayo, K =1,70, y en El Portugués al mes de abril, K = 1,86 (Fig. 5).

Fig. 5. Factor de condición K, promedio mensual, de Bryconamericus iheringii en los arroyos Manantiales y El Portugués.
En la Fig. 6 se consignan los resultados de la ecuación Lst/peso para ambos sexos de las dos localidades estudiadas. El exponente b resultó mayor para las hembras en ambos ambientes el valor más bajo fue para los machos del arroyo Manantiales. Los valores del coeficiente de determinación (R2) arrojaron en los dos ambientes valores altamente significativos superiores a 0,9 en todos los casos.
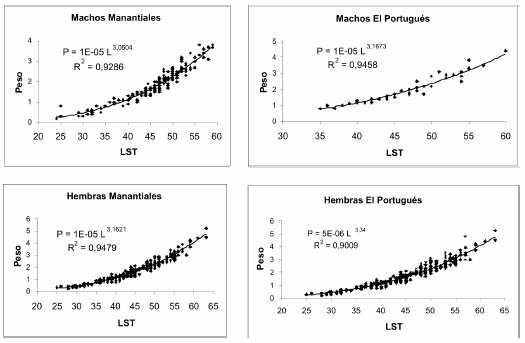
Fig. 6. Relación largo-peso para machos y hembras de Bryconamericus iheringii en los arroyos Manantiales y El Portugués.
La variación mensual de las frecuencias relativas de los estadios de maduración gonadal (Fig. 7) muestra la presencia de un mayor número de hembras en maduración y maduras en los meses de julio, agosto, septiembre y noviembre en ambos arroyos, y en post desove, febrero-mayo en el arroyo Manantiales y marzo-mayo en el arroyo El Portugués, lo que indicaría que el periodo de desove estaría comprendido entre los meses de agosto y noviembre. Ejemplares machos maduros se observan durante casi todo el año en ambos ambientes, los inmaduros y en maduración dominan desde los meses de enero a abril en el arroyo El Portugués, mientras que en el arroyo Manantiales los inmaduros y machos dominan desde noviembre a mayo.

Fig. 7. Frecuencia de ocurrencia de los estados de maduración sexual de machos y hembras de Bryconamericus iheringii en los arroyos Manantiales y El Portugués.
El análisis factorial no mostró correlaciones significativas entre abundancia y factores ambientales en ninguno de los dos arroyos. La prueba de Mann-Whitney indicó diferencias significativas entre las muestras de abundancia de ambos arroyos a un nivel de significación alfa = 0,05; p = 0,009 < 0,05. El test de Mantel indicó la ausencia de correlación significativa entre las matrices de abundancia/factores ambientales de ambos arroyos, r = 0,230, p = 0,231 > alfa = 0,05
DISCUSIÓN
B. iheringii es una especie permanente de ambos arroyos. En Manantiales es la más capturada con un 49,81% de abundancia relativa, mientras que en el arroyo El Portugués sólo representa el 4,70% de la abundancia relativa (Fernández et al., 2008).
Si bien la abundancia en ambos arroyos fue mayor en el mes de mayo, en el arroyo El Portugués la variación de la abundancia a lo largo del año es significativamente menos pronunciada que la registrada en el arroyo Manantiales, como puede observarse en la figura 2. El valor de abundancia relativa en el arroyo Manantiales es notablemente superior a los registrados en otros cursos de agua de la pampasia, como el arroyo El Pescado donde representa el 4,3% de las capturas totales, en una estación de aguas libres (Almirón et al., 2000) y mucho menor al encontrado en el arroyo Las Tunas - Sierras de la Ventana - donde representó el 97% de las capturas (Menni et al., 1988), en ambientes lagunares del área en estudio se encontraron valores de 8% para la laguna de Chascomús (Alaimo & Freyre, 1969) y de 9,2% en la laguna Sauce Grande (Padín et al., 1991). En el río Ceballos-Saldán (Córdoba) representa el 8,93% de la abundancia total (Juncos et al., 2006).
En el arroyo Manantiales las aguas presentan baja turbidez, con remansos con vegetación flotante, caracterizada por el predominio de falsa verdolaga, Ludwigia peploide, amapola de agua, Hydrocleys nymphoides y helechito de agua, Azolla filiculoide. En las aguas bajas próximas a la orilla predominan los céspedes de bacopa, Bacopa monnieri. Según Menni (2004) este es el tipo de ambiente típico de B. iheringgii, lo cual explicaría la diferencia en la numerosidad de ambos ambientes, puesto que El Portugués presenta aguas color marrón y poco transparentes (por la gran cantidad de ácidos húmicos en dilución), siendo una zona que presenta un mayor impacto de la actividad ganadera. El aumento de la hidrofitia está asociada a una mayor disponibilidad de microhábitats con el debido incremento de la complejidad estructural, lo cual produce una disminución de la eficiencia de los depredadores (Petry et al., 2003; Menni, 2004; Montaña et al., 2008).
El factor de condición es considerado un buen índice que indica el grado de bienestar de un pez, reflejando la condición nutricional reciente, evidenciando las interacciones entre factores bióticos y abióticos sobre las condiciones fisiológicas de los peces (Anderson & Neumann, 1996; Vazzoler, 1996) que permite establecer relaciones con los períodos reproductivos de las especies. Si bien se observaron variaciones mensuales considerables de este índice para B. iheringii, en ambos ambientes, los valores fueron relativamente altos, lo que indicaría una buena oferta alimentaria (Román-Valencia et. al., 2008). Los valores más altos del factor K correspondieron al final de la primavera y al verano lo que coincide con una mayor disponibilidad trófica que se observa en estos meses, esta es una estrategia que refleja la distribución de la energía para la reproducción elaborando reservas para la vitelogénesis (Bechara et al., 1996).
Se aprecia una constante alométrica (b) superior a tres lo que indica, para ambos sexos, un crecimiento alométrico. Se evidencia un incremento ligeramente mayor en el peso especialmente en las hembras de ambos arroyos. A excepción de los machos del arroyo Manantiales que muestran un crecimiento levemente isométrico (b: 3,05). Según Safran (1992) valores altos para el factor alométrico indican una tendencia a la forma más esférica en el cuerpo, por lo cual los machos resultan más delgados. Además las hembras alcanzan un mayor tamaño que los machos.
El análisis de los rangos de tallas a lo largo del año fueron significativamente distintos para ambos arroyos (p: 0,003 alfa: 0,05). En el arroyo Manantiales, se observa un aumento de machos y hembras de tallas menores de 25 mm de Lst. en los meses de noviembre, los cuales son el producto de los desoves de invierno y primavera. En el arroyo El Portugués, en cambio no se registraron capturas de ejemplares hembras menores de 25 mm de Lst., los machos de esta talla fueron abundantes en enero y febrero. Las tallas mayores de 41 mm de Lst fueron las dominantes en todos los meses excepto en los meses de verano. La importante presencia de juveniles principalmente en el arroyo Manantiales indicaría, como lo señala Braga et al. (2007), que B. iheringii iniciaría su ciclo de vida en los tramos inferiores de los arroyos para luego moverse hacia las cabeceras y ocupar diversos hábitat.
Sendra & Freyre (1978) registraron desplazamientos migratorios en la laguna Chascomús, donde los momentos de máxima concentración de ejemplares corresponden a la época de desove (otoño-primavera). En ambos arroyos los meses de mayo, julio y marzo fueron los de mayor concentración, siendo los meses en donde se capturaron las tallas mayores. Posiblemente, esto indique la existencia de desplazamientos dentro de estos arroyos por parte de los adultos en busca de alimento o de mejores condiciones ambientales. En los carácidos, en general, se evidencia el predominio de hembras (Fialho et al., 1998) en casi todo el año. En este estudio sólo se observaron dominancias de machos durante los meses más cálidos del año, en cambio en los meses más fríos las hembras fueron las que predominaron en los muestreos, y es justamente el período de reproducción de esta especie.
En ambientes de estacionalidad moderada la mayoría de los caracoideos muestran una considerable variación en sus períodos reproductivos (Menni & Almirón, 1994) no correlacionado con período de lluvias, en cambio en ambientes tropicales se observa una marcada estacionalidad en la reproducción de los peces (Lowee Mc Connell, 1987, Vazzoler & Menezes, 1992) influenciada mayormente por el nivel del agua, la temperatura y el fotoperíodo. En el sur de Brasil B. iheringii presenta un período reproductivo que abarca los meses de primavera y verano (Lampert et al., 2004). En la laguna Chascomús posee dos períodos reproductivos, uno a mediados de otoño y otro a fines de primavera (Sendra & Freyre, 1978). En ambientes artificiales dependientes del río de La Plata lo hace en primavera y verano (Almirón, 1989). En cambio, en estos dos ambientes lóticos el período reproductivo estuvo comprendido entre mediados de invierno y primavera. B. hieringii es un estratega oportunista. Si bien no se encontraron correlaciones entre su abundancia y los factores ambientales, sí se encontró una correlación significativa entre la temperatura del agua y los individuos de ambos sexos en maduración (alfa: 0,05). Asimismo se observa un aumento notable de hembras maduras con el aumento del fotoperíodo y de la temperatura del agua, proceso que fue registrado para peces de regiones templadas (De Vlaming, 1972).
En el presente trabajo se detectó una importante población de B. iheringii, en especial en las nacientes del arroyo Manantiales. Bistoni et al. (1999) consideran a este carácido como una especie sensitiva en ríos del centro del país. El análisis de los resultados obtenidos indica que el área en estudio cumple una importante función en la biología trófica y reproductiva de esta y otras especies, por lo que resulta necesario evaluar la conservación de estas nacientes, actualmente fuertemente sometidas a la explotación ganadera y a la pesca furtiva.
BIBLIOGRAFÍA
1. Alaimo, S. & L.R. Freyre. 1969. Resultados sobre la estimación de numerosidad de peces en la laguna de Chascomús, (Provincia de Buenos Aires). Physis, 29(78): 97-212. [ Links ]
2. Almirón, A.E. 1989. Estudios Ictiológicos en ambientes leníticos de los alrededores de La Plata . Tesis doctoral 552, Univ. Nac. De La Plata. 247 pp. [ Links ]
3. Almirón, A.E., M.L. Garcia, R.C. Menni., L.C. Protogino & L.A. Solari. 2000. Fish ecology of a seasonal lowland in temperate South America. Mar. Freshwater Res., 51:265-274. [ Links ]
4. Almirón, A.E., J. Casciotta, L. Ciotek & P. Georgia. 2008. Guía de los Peces del Parque Nacional Pre-Delta. Administración de Parques Nacionales. 215 pp. [ Links ]
5. Anderson, R.O. & R.M. Neumann. 1996. Length, weight, and associated structural indices. En: B.R. Murphy & D.W. Willis (Ed.): Fisheries Techniques. 2nd. ed. American Fisheries Society, Bethesda, Marylan, USA. 447-482 p. [ Links ]
6. Bechara, J.A., S. Sánchez, J.P. Roux, J.C. Terraes & C.F. Quintana. 1999. Variaciones del factor de condición relativo de la ictiofauna del río Paraná aguas abajo de la represa de Yaciretá, Argentina. Rev. de Ictiología, 7: 75-89. [ Links ]
7. Bistoni, M.A., A.C. Hued, M.M. Videla & L. Sagretti. 1999. Efectos de la calidad del agua sobre las comunidades ícticas de la región central de Argentina. Rev. Chilena Hist. Nat. 72: 325-335. [ Links ]
8. Braga, M.R., J.R.S. Vitule & J.M.R. Aranha. 2007. Estrutura poblacional de Mimagoniates microlepis (Steindachner, 1876) (Characidae, Glandulocaudinae) em um riacho de Floresta Atlântica, Paraná (Brasil). Acta Biol. Par. 36(1-2): 67-81. [ Links ]
9. Casciotta, J.R., A.E. Almirón, A.L. Cione & M.M. Azpelicueta. 1999. Brazilian freshwater assemblages from southern pampean area, Argentina. Biogeographica, 75: 67-78. [ Links ]
10. Castro, R.M.C. 1999. Evoluçâo da ictiofauna de ríachos sulamericanos: padrôes gerais e possíveis processos causais. En: E.P.R. Caramaschi, R. Mazzoni & P.R. Peres-Neto (Eds.): Ecología de peixes de riachos. Série Oecologia Brasiliensis. 139-155pp. [ Links ]
11. Cordiviola de Yuan, E., E. Oldani, O. Oliveros & C. Pignalberi de Hassan. 1984. Aspectos limnológicos de ambientes próximos a la ciudad de Santa Fe (Paraná Medio): poblaciones de peces ligados a la vegetación. Neotropica, Buenos Aires, Argentina, 30(84): 127-139. [ Links ]
12. Destefanis, S. & L. Freyre. 1972. Relaciones tróficas de los peces de la laguna de Chascomús con un intento de referenciación ecológica y tratamiento bioestadístico de espectro trófico. Acta Zool. Lilloana, 29: 17-33. [ Links ]
13. De Vlaming, V. 1982.Environmental control of teleost reproductive cycles: a brief review. J. Fish Biol., 4:131-140. [ Links ]
14. Escalante, A.H. 1987. Alimentación de Bryconamericus iheringi y Jenynsia lineata lineata (Osteichthyes) en Sierra de la Ventana (Argentina). An. Mus. Hist. Nat. Valparaíso, Chile, 18: 101-108. [ Links ]
15. Fernández, M.E., R.A. Ferriz, C. A. Bentos & G.R. López. 2008. Ichthyofauna of two streams in the high basin of the Samborombón River, in the province of Buenos Aires, Argentine Republic. Rev. Mus. Argentino Cienc. Nat., n.s., 10(1):147-154. [ Links ]
16. Fialho, C.B., L.C. Schifino & J.R. Verani. 1998. Biologia reprodutiva de Oligosarcus jenynsii (Günther) (Characiformes, Characidae) da Lagoa das Custó-dias, Tramandaí, Rio Grande Do Sul, Brasil. Revta. bras. Zool., 15(3): 775-782. [ Links ]
17. Grosman, F., J.R. Gonzalez & E.J. Usonoff. 1996. Trophic niches in on Argentine ponds as a way ossess fuctional relationships between fishes and other communities. Water SA, 22(4): 345-350. [ Links ]
18. Juncos, R., M.A. Bistoni & I. Zito Freyer. 2006. Composición y estructura de la ictiofauna del Río Cevallos-Saldán (Córdoba, Argentina). Iheringia, Sér. Zool., 96(3): 363-371. [ Links ]
19. Lampert, V.R., M.A. Azevedo & C.B. Fialho. 2004. Reproductive biology of Bryconamericus iheringii (Ostariophysis: Characidae) from rio Vacacaí, RS, Brazil. Neotrop. Ichtyol., 2(4): 209-215. [ Links ]
20. Lima, F.C.T, L.R. Malabarba, P.A. Buckup, J.F. Pezzi da Silva, R.P. Vari, A. Harold, R. Benine, O.T. Oyakawa, C.S. Pavanelli, N.A. Menezes, C.A.S. Lucena, M.C.S.L. Malabarba, Z.M.M.S. Lucena, R.E. Reis, F. Langeani, L. Cassati, V.A. Bertaco, C. Moreira & P.H.F Lucinda. 2003. Genera incertae sedis in Characidae. P: 106-169. En: R.E. Reis, S.O. Kullander & C.J. Ferraris (organizers): Check list of the freshwater fishes of South and Central America. EDIPUCRS, Porto Alegre, Brasil. 729 p. [ Links ]
21. Liotta, J. 2006. Distribución geográfica de los peces de aguas continentales de la República Argentina. ProBiota, Serie Documentos N° 3: 701 pp. [ Links ]
22. López, H.L., J.R. Casciotta, A.M. Miquelarena & R.C. Menni. 1984. Nuevas localidades para peces de agua dulce de la Argentina. IV. Adiciones a la ictiofauna del Río Uruguay y algunos afluentes. Stud. Neotrop. Fauna & Environ. 19(2): 73-87. [ Links ]
23. López Cazorla, A. W. Durán & L. Tejera. 2003. Alimentación de la ictiofauna del Río Sauce Grande, Provincia de Buenos Aires, Argentina. Biol. Acuát. 2:73-79. [ Links ]
24. Lowe-McConnell, R.H. 1987. Ecological studies in tropical fish communities. Cambridge Univ. Press, Cambridge. 382 p. [ Links ]
25. Matthews, W.J. 1998. Patterns in Freshwater Fishes Ecology. Chapman and Hall. 752 pp. [ Links ]
26. Meffe, G.K. & T.M. Berra. 1988. Temporal characteristics of fish assemblage structure in on Ohio stream. Copeia, (3): 684-690. [ Links ]
27. Menni, R.C. 2004. Peces y ambientes en la Argentina continental. Monogr. Mus. Argentino Cienc. Nat. 5:1-316. [ Links ]
28. Menni, R.C. & A.E. Almirón. 1994. Reproductive seasonality in fishes of madmode ponds in temperate South America. Neotropica. 40(103-104): 75-85. [ Links ]
29. Menni, R.C., H.L. López & R.H. Aramburu. 1988. Ictiofauna de Sierra de la Ventana y Chasicó (Provincia de Buenos Aires, Argentina). Zoogeografía y parámetros ambientales. A. Mus. Hist. Nat. Valparaiso, 19: 75-84. [ Links ]
30. Montaña, C.G., C.A. Layman & D.C. Taphorn. 2008. Comparison of fish assemblages in two littoral habitats in a Neotropical morichal stream in Venezuela. Neotrop. Icthyol., 6(4): 577-582. [ Links ]
31. Padín, O.H., R. Iriart & N.O. Oldani. 1991. Evaluación del número y biomasa de peces de la laguna Sauce Grande (Monte Hermoso, Bs. As.). Biología Acuática, 15(2): 196-197. [ Links ]
32. Petry, P., P. Baley & T. Markle. 2003. Relationships between fish assemblages, macrophytes and environmental gradients in the Amazon River floodplain. J.Fish Biol., 63: 547-579. [ Links ]
33. Ringuelet, R.A. 1975. Zoogeografía y ecología de los peces de aguas continentales de la Argentina y consideraciones sobre las áreas ictiológicas de América del Sur. Ecosur, 2(3): 1-122. [ Links ]
34. Román-Valencia, C., J.A. Vanegas-Ríos & R.I. Ruiz-C. 2008. Una nueva especie del género Bryconamericus (Ostariophysi: Characidae) del río Magdalena, con una clave para las especies de Colombia. Revista de Biología Tropical, 56:1749-1763. [ Links ]
35. Rounsefell, G. & W. Everhart. 1962. Fisheries science, methods and applications. J. Whitey & Sons. New York, 356-358 pp. [ Links ]
36. Safran, P. 1992. Theoretical analysis of the weigth-length relationship in fish juveniles. Mar. Biol., 112: 454-551. [ Links ]
37. Sendra, E.D. & L. Freyre. 1978. Dinámica poblacional de Bryconamericus iheringi (Pisces, Tetragonopteridae) de la laguna de Chascomús. Limnobios, 1(8): 299-321. [ Links ]
38. Tesch, F.W. 1968. Age and growth. p. 93-123. En: W.E. Rickers (Ed): Methods for assesment of fish production in fresh waters. Blackwell Scientific, Oxford. [ Links ]
39. Vazzoler, A.E.A. 1996. Biologia da reproducao de peixes Teleóstesos: teoría e prática. Editora da Universidade Estadual de Maringa, Maringa, Brasil. 169pp. [ Links ]
40. Vazzoler, A.E.A. & N.A. Menezes. 1992. Síntese de conhecimiento sobre o comportamento reproductivo dos Characiformes da América do Sul (Teleostei, Ostariophysi). Rev. Bras. Biol., 52(4): 627-640. [ Links ]
Recibido: 23-IX-2009
Aceptado: 12-VIII-2010














