Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista del Museo Argentino de Ciencias Naturales
versión On-line ISSN 1853-0400
Rev. Mus. Argent. Cienc. Nat. vol.12 no.2 Ciudad Autónoma de Buenos Aires dic. 2010
ZOOLOGIA
Remoción química como nueva alternativa a la remoción mecánica para el estudio del polen transportado en las escopas de abejas silvestres
Marta Caccavari1 & Gabriela Cilla1, 2
1Museo Argentino de Ciencias Naturales "Bernardino Rivadavia", Av. Ángel Gallardo 470, C1405DJR Buenos Aires, Argentina.
2 Facultad de Agronomía de la Universidad de Buenos Aires, Av. San Martín 4453, C1417DSQ Buenos Aires, Argentina. E-mail: gcilla@agro.uba.ar
*Esta nueva técnica fue desarrollada y puesta en práctica por las autoras antes del fallecimiento de Marta Caccavari en noviembre de 2009.
Resumen: El reconocimiento taxonómico y la cuantificación de los distintos tipos polínicos colectados por las abejas ofrecen el método más directo para estudiar la dieta. Para determinar la importancia de cada taxón vegetal y minimizar la contaminación, es necesario separar el polen depositado en las estructuras de colecta, de los granos recolectados en forma pasiva en otras partes del cuerpo. La técnica que se aplica hasta el momento se basa en la remoción mecánica de las cargas polínicas con agujas de disección y sucesivos lavados con etanol. Escopas de patas metatoráxicas sometidas a este procedimiento al ser observadas bajo lupa presentaban aún granos de polen en cantidades variables. Como una alternativa a esta técnica proponemos la remoción química, mediante la utilización de HOK. La pata se extrae y es tratada por separado para impedir la contaminación. Las propiedades defloculantes del HOK permiten separar exitosamente el polen adherido a la escopa, la cual puede ser devuelta al ejemplar al no ser afectada por el procedimiento. Suspender todo el contenido de polen en un volumen de medio de montaje conocido y luego tomar una submuestra, permite determinar el número total de granos de polen de cada taxón. En este trabajo se presenta la nueva técnica y se compara su efectividad con la técnica utilizada hasta el momento.
Palabras clave: Polen; Abejas silvestres; Estructuras recolectoras; Remoción mecánica; Remoción química.
Abstract: Removal new alternative to chemical and mechanical removal for the study of pollen carried on the wild bee scopae. Taxonomic recognition and quantification of the different pollen types collected by bees offer the most direct method to study the diet. To determine the importance of each plant taxon, it is necessary to separate the pollen deposited only in the collecting structures in order to minimize contamination of grains collected passively in other parts of the body. The technique currently applied is based on the mechanical removal of the pollen loads with dissecting needles and repeated washings with ethanol. Metathoracic scopae that underwent this procedure showed traces of pollen in varying amounts when observed under the microscope. As an alternative to this technique chemical removal using HOK is proposed. The leg is removed and treated separatedly to avoid contamination. The deflocculant properties of HOK successfully allowed to separate the pollen adhered to the scopae, which can be then returned to the individual, unaffected by the procedure. Suspend the pollen in a know quantity of mounting fluid permit take the subsamples and determine the total number of pollen grains of each taxon. In this paper, the new technique is presented and its effectiveness is compared to the technique currenty used.
Key words: Pollen; Wild bees; Collecting structures; Diet; Mechanical removal; Chemical removal.
INTRODUCCIÓN
El polen representa la principal fuente de proteínas para las abejas, con excepción de un grupo pequeño de Meliponini del género Trigona, que utilizan carroña transformándose en necrófagas obligadas. El polen recolectado y transportado para alimentar los estadios larvales es también incorporado en la dieta de abejas adultas durante la producción de huevos (Michener, 2007; Roig Alsina, 2008). La presencia de pelos ramificados en diferentes partes del cuerpo y de un aparato recolector, caracterizan a las hembras de abejas silvestres, con excepción de las especies cleptoparásitas y de las Hylaeinae y Euryglossinae que transportan el polen en el buche. Las estructuras recolectoras se denominan escopas, cuando consisten en áreas densas de pelos, o corbículas, cuando la tibia posterior es glabra y está rodeada de pelos curvados. El polen empaquetado en estas estructuras es usualmente mezclado con néctar. Por otro lado, ayudan además en su acumulación las cargas electrostáticas de la superficie del cuerpo y de los granos de polen, así como el pollenkitt propio de los tipos polínicos entomófilos, que pueden actuar como aglutinante (Erdtman, 1966; Charloner, 1968).
Las abejas generalistas, polilécticas, colectan polen de plantas de diversos géneros y familias. Las especies o géneros de abejas que se especializan en un taxón vegetal en particular se las denomina oligolécticas. Del análisis de las cargas polínicas transportadas se desprende el espectro de plantas visitadas para la colecta activa de polen, que puede ir desde la más amplia polilectia hasta la más estricta oligolectia (Michener, 2007; Müller & Kuhlmann, 2008). El reconocimiento taxonómico y la cuantificación de los distintos tipos polínicos recolectados ofrece el método más directo para estudiar la dieta (Cane & Sipes, 2006).
Los métodos utilizados hasta el momento para separar el polen de las estructuras de recolección se basan en la remoción mecánica de las cargas con agujas de disección (Dafni et al., 2005; Sipes & Tepedino, 2005; Müller & Kuhlmann, 2008) y sucesivos lavados con etanol absoluto, previa puesta en cámara húmeda de los ejemplares provenientes de colecciones entomológicas. La extracción se lleva a cabo manipulando el ejemplar completo lo que puede provocar la contaminación de la muestra con polen proveniente de otras partes del cuerpo, al igual que el ascenso del etanol por capilaridad durante los sucesivos lavados.
El HOK es utilizado en una serie de técnicas para la separación y extracción química del contenido de polen del tracto digestivo de insectos, sírfidos en particular (Larson, 1993), de las anteras de ejemplares de herbario o material fresco para palinotecas de referencia (O'Rourke & Buchmann, 1991) y de perfiles sedimentarios (Faegri & Iversen, 1975). Este procedimiento aplicado al polen no daña la exina, capa más externa del grano de polen donde se encuentran los caracteres con valor taxonómico (Von Post, 1933). Por otra parte, los caracteres con valor taxonómico son claramente reconocibles sin necesidad de la aplicación del método acetolítico de Erdtman (1969). A pesar de las ventajas que presenta el HOK debido a sus propiedades defloculantes (Faegri & Iversen, 1975), no fue utilizado hasta el momento para la obtención del polen colectado por las abejas.
En este trabajo se presenta la remoción química como una nueva alternativa para la separación del polen transportado en las estructuras de recolección. Se compara su efectividad con la técnica tradicional, remoción mecánica, sobre las escopas de un mismo ejemplar de abeja silvestre y se discuten las ventajas de la nueva técnica.
MATERIALES Y MÉTODOS
El compuesto básico de esta técnica es el HOK 10%. Para su desarrollo se trabajó con ejemplares de abejas silvestres de la especie Melissodes tintinnans Holmberg capturados en la localidad de General Villegas, provincia de Buenos Aires. Las escopas se ubican, en este caso, en la tibia y basitarsos posteriores de la pata metatoráxica (Fig. 1). Se seleccionaron y disecaron escopas con abundante polen. Como medio de suspensión y de montaje se utilizó agua-glicerina coloreada: 70 cm3 de agua destilada, 230 cm3de glicerina, 2 g de cristales de fenol, y cristales de fucsina básica 50 mg. Para su preparación se adicionaron los cristales de fenol al agua destilada y se agitó hasta disolver con varilla de vidrio en baño de 50°C. Se adicionó la glicerina a la solución acuosa de fenol y se disolvieron cristales de fucsina hasta alcanzar la coloración deseada agitando con varilla de vidrio. Se utilizó además lupa Leica Wild M3Z, centrífuga Rolco 380T, micropipetas de precisión y microscopio óptico Leitz Laborlux 12.

Figs. 1-4. Vista de la cara externa de las estructuras recolectoras (tibia y basitarso en pata metatoráxica) de Melissodes tintinnans. 1, polen acumulado en la escopa izquierda y en el abdomen luego de una visita floral. 2, partes afectadas luego de sucesivos lavados con etanol de la escopa izquierda. 3, escopa izquierda tratada con la técnica de remoción mecánica. 4, escopa derecha del mismo ejemplar tratada con la técnica de remoción química.
TÉCNICA PARA LA REMOCIÓN QUÍMICA
Separación del polen de las escopas
1. Colocar la estructura portadora de la carga escopal en un Eppendorf de 100 μl.
2. Incorporar por goteo HOK 10% hasta cubrir la pata.
3. Llevar a baño María a 40 °C por 10 minutos, agitando suavemente en su transcurso con varilla de vidrio de 3 mm de diámetro.
4. Retirar del baño María. Extraer la pata mientras se agrega agua destilada (incorporando pequeños chorros sobre la pieza para barrer los restos de polen) hasta cubrir ¾ partes del Eppendorf.
5. Centrifugar a 2000 RPM por 10 minutos y decantar con ayuda de una pipeta Pasteur.
En el caso de no poder realizarse el conteo de inmediato, luego de este centrifugado agregar al residuo 2 o 3 gotas de ácido acético glacial. Cuando se vaya a continuar, extraer con pipeta el líquido agregado y continuar el procedimiento para la obtención del recuento.
Conteo
1. Agregar una alícuota de agua-glicerina coloreada (60 μl) con micropipeta de precisión.
2. Homogenizar y extraer con la micropipeta el total del volumen contenido en el tubo, tomar nota de los μl resultantes (60 μl de agua-glicerina + residuo de polen) y volver todo el contenido al tubo.
3. Homogenizar el contenido total, procediendo a extraerlo con la micropipeta y volcarlo en el Eppendorf 2 o 3 veces. A continuación proceder a la extracción para el conteo.
4. Extraer con micropipeta de precisión, 1/3 del volumen total obtenido (20 μl de agua-glicerina + 1/3 del residuo de polen).
5. Realizar un preparado con la alícuota extraída usando un cubreobjetos de 24x24 mm.
6. Realizar un recuento total del polen contenido en el preparado y multiplicarlo por 3, obteniendo así el número total de granos de polen que portara la estructura de transporte.
Reconocimiento taxonómico
En muchos casos alcanzará con el procesamiento anterior realizado con HOK y glicerina coloreada para el reconocimiento del polen.
Si se desea o requiere un reconocimiento taxonómico más preciso, los 2/3 restantes podrán ser tratados con el método acetolítico. Para ello incorporar:
1. Dos o tres gotas de ácido acético glacial para neutralizar el HOK que aún contenga la muestra, agitar con varilla de vidrio y volcar el contenido del Eppendorf a tubos de vidrio tipo Pyrex aforados de fondo cónico de 10 cm3, y agregar nuevamente ácido acético hasta aproximadamente 1/3 del tubo; centrifugar por 10 minutos y decantar el líquido.
2. Incorporar la mezcla acetolítica (Erdtman, 1969) (9 partes de anhídrido acético y 1 parte de ácido sulfúrico) y llevarla a baño maría a punto de ebullición bajo campana, durante 5-7 minutos agitando con varilla de vidrio.
Cálculo del volumen de polen
Calcular el volumen de polen transportado en una estructura de recolección restando al volumen resultante del paso 2 del conteo (Vt) los 60 μl de agua-glicerina adicionados al residuo de polen (Vp):
Vp = Vt - 60 μl de agua-glicerina
Para calcular el volumen de polen de un taxón en particular (Vi) calcular el volumen promedio de un grano de polen para el taxón (vi) según Buchmann & O'Rourke (1991) aproximando la forma del grano a una figura geométrica. Multiplicar el volumen promedio del grano de polen del taxón (vi) por el número total de granos de ese taxón en particular (ni) obtenido en el paso 5 de conteo.
Vi = vi x ni
Luego el volumen total de polen transportado en una estructura recolectora puede también calcularse sumando los volúmenes de cada taxón en particular que componen la muestra.
Vp = Σ Vi
COMPARACIÓN DE TÉCNICAS PARA LA REMOCIÓN DE CARGAS ESCOPALES
Para observar y comparar la efectividad de los métodos se trataron en forma diferencial las escopas de un mismo ejemplar de abeja silvestre de la especie M. tintinnans (N=5). Una de las escopas se disecó y se sometió a remoción química del polen según el protocolo de la nueva técnica descripta anteriormente. La otra escopa se sometió a remoción mecánica. Luego se la disecó y se la sometió a remoción química de posibles remanentes de polen. Este procedimiento se repitió en cinco ejemplares de la misma especie.
Para la remoción mecánica se colocó sobre un portaobjetos al ejemplar, previa puesta en cámara húmeda por 24 hs, y bajo lupa se removió el polen de la escopa remanente con una aguja de disección realizando sucesivos lavados con etanol absoluto. Se adicionó una gota de colorante (fucsina en solución alcohólica) al residuo de polen y un trozo pequeño de gelatina-glicerinada (Wodehouse, 1935; Erdtman, 1969). Se llevó a una placa caliente hasta que la gelatina-glicerina fundió, cuidando de no deteriorar el material por sobrecalentamiento. Se homogeneizó con la aguja de disección evitando la formación de burbujas. Se colocó y selló el cubreobjetos con parafina.
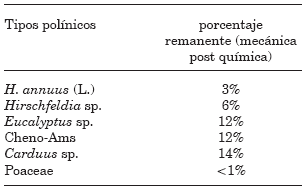
Las escopas sometidas a la remoción mecánica, mostraron bajo lupa, la presencia de restos de polen adheridos a su superficie y a los pelos escopales lo cual indicaría una subestimación del polen total y sesgo en la cuantificación (Figs. 2 y 3) (Tablas 1 y 2). Durante el procedimiento la aguja desprendió pelos de las escopas dificultando la desagregación del polen. Se observó además que el etanol ascendió por capilaridad, embebiendo otros sectores del cuerpo (Fig. 2). Tanto las escopas como otras partes del cuerpo de los ejemplares fueron afectados por el procedimiento. Por otra parte, las escopas tratadas con HOK quedaron completamente limpias y sanas (Fig. 4). De los seis tipos polínicos resultantes de la remoción mecánica, sólo cinco de ellos se encontraron representados en las cargas polínicas extraídas por remoción química (Tabla 1). En la Tabla 1 se detallan los porcentajes de diferencia entre el número total de granos de polen cuantificados para cada uno de los taxones representados en las cargas obtenidas por remoción química respecto del total para los mismos taxones representados luego de la remoción mecánica. Para todos los tipos polínicos representados en las cargas obtenidas por remoción química el número total de granos fue mayor al obtenido por remoción mecánica (Tabla 1, expresado en porcentaje de diferencia). Las cargas removidas con la técnica tradicional mostraron un 12%, 13% y 15% menos de granos de polen de Eucalyptus sp., Chenopodiaceae-Amaranthaceae (Cheno-Ams) y Carduus sp., respecto de las cargas extraídas con HOK para el total de cinco ejemplares. Las escopas sometidas a remoción química luego de la extracción del polen en forma mecánica mostraron remanentes de polen para los taxones representados luego de la primera remoción (Tabla 2).
TABLA 1. Tipos polínicos representados en las cargas extraídas por remoción química y remoción mecáncia (presente =sí, ausente =no). Diferencia del total de granos de polen representado en las cargas extraídas en forma química respecto del total extraído por remoción mecánica, expresada en porcentaje para cada taxón. Cheno-Ams= Chenopodiaceae-Amaranthaceae.
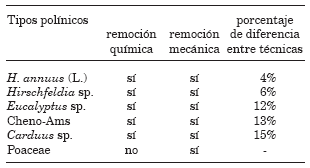
TABLA 2. Porcentaje de polen remanente respecto del total de granos de polen para los tipos polínicos representados en una misma escopa extraídos por remoción química luego de una primera extracción por remoción mecánica. Total de granos de polen = suma del número de granos obtenidos por remoción mecánica y remanente por remoción química. Cheno-Ams=Chenopodiaceae-Amaranthaceae
El polen extraído con agujas de disección y montado en gelatina-glicerina, no permitió una clara observación al microscopio óptico de los caracteres con valor taxonómico presentes en la exina. Los caracteres de valor diagnóstico fueron observados con mayor detalle o claridad en los granos tratados con KOH, que en los no tratados (Fig. 5). Los granos mostraron una distribución más homogénea facilitando su reconocimiento y conteo (Fig. 6). Esta nueva técnica, permitió además el recuento absoluto de los granos de polen y el cálculo del volumen de polen colectado.
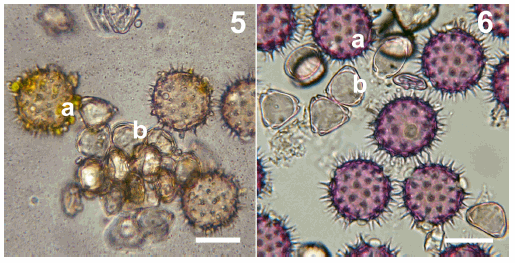
Figs. 5-6. Observación al microscopio óptico de granos de polen de Helianthus annuus (a) y Eucalyptus sp. (b) transportados en las escopas de Melissodes tintinnans. 5, polen removido de la escopa izquierda en forma mecánica. 6, polen removido de la escopa derecha con HOK. Escala, 20 μm.
DISCUSIÓN
En la evaluación de las preferencias alimentarias de una especie de abeja son fundamentales la extracción cuidadosa del material polinífero de las estructuras recolectoras, la homogeneización adecuada durante la preparación de la muestra a observar y el cálculo preciso del volumen de polen (O'Rourke & Buchmann, 1991). En la remoción mecánica es fundamental el especial cuidado en la extracción del material polinífero debido a la posible contaminación con polen proveniente de sectores del cuerpo distintos a los de recolección activa. Durante las visitas a plantas hospedadoras para su recolección o a plantas no hospedadoras en busca de néctar el polen puede acumularse en las partes pilosas de todo el cuerpo de la abeja (Fig. 1). Manipular el ejemplar completo durante la remoción de las cargas aumenta la probabilidad de contaminar las muestras con aquellos taxones que solo son fuente de néctar o con polen extraño que llega a la planta hospedadora transportado por otros visitantes florares (Dafni et al., 2005; Sipes & Tepedino, 2005). Esto dependerá del comportamiento de la especie de abeja en estudio, en particular de la selección de los taxones vegetales como fuentes de recursos nectaríferos y/o poliníferos. El polen de Poaceae, representado sólo en las cargas removidas en forma mecánica, probablemente fue contactado por partes del cuerpo de la abeja que no participaron de la recolección activa de polen. Estudios previos sobre las preferencias polínicas de abejas de la especie M. tintinnans (Cilla et al., 2007), no mostraron a Poaceae entre los taxones visitados para la colecta de polen. La extracción de las estructuras recolectoras permite que la técnica sea limpia y efectiva y minimiza la posibilidad de considerar como componentes de la dieta taxones no seleccionados en forma activa.
La apreciación incorrecta del espectro de plantas visitadas para la colecta activa de polen puede también darse por remoción incompleta de las cargas polínicas. Con la técnica utilizada hasta el momento no se logra la remoción total de las cargas escopales. Algunos tipos polínicos no se verán representados o se encontrarán en proporciones menores a las reales, como pudo observarse para Eucalyptus sp., Cheno-Ams y Carduus sp. luego de la remoción diferencial de las cargas (Tablas 1 y 2). El etanol, al igual que la hidratación previa en cámara húmeda del ejemplar, no son suficientes para disolver las sustancias que actúan como aglutinantes: pollenkit (propias del grano de polen), néctar y/o secreciones de las abejas. Dada la efectividad del HOK para la remoción del polen, no es necesario pretratar a los ejemplares de colección en cámara húmeda. Las propiedades defloculantes del HOK (Faegri & Iversen, 1975) permiten disolver las sustancias que actúan como aglutinantes y separar exitosamente el polen adherido a las estructuras de transporte. El procedimiento no afecta a las escopas; pelos y superficies cuticulares de tibias y basitarsos quedan completamente limpios y sanos. Esto permite que las partes disecadas y tratadas con la nueva técnica sean devueltas al ejemplar en buenas condiciones (Fig. 4).
Otra de las ventajas que presenta la remoción química es mantener intacta la exina. Luego de la utilización de HOK los caracteres con valor taxonómico son claramente reconocibles sin necesidad de la aplicación del método acetolítico de Erdtman (1969). Con la remoción mecánica las sustancias propias o adicionadas a los granos de polen no son removidas en forma efectiva de su superficie. Esto sumado al montaje en gelatina-glicerina, técnica utilizada ampliamente (Wodehouse, 1935), no permite un análisis detallado de la exina (Louveaux et al., 1978). La gelatina-glicerina requiere de su fusión sobre una placa caliente cuidando de que el material no se estropee por sobrecalentamiento. La homogenización del material con la aguja de disección lleva a la frecuente formación de burbujas que entorpecen la observación junto con los pelos que se desprenden de las escopas por el arrastre mecánico del polen. Como una alternativa al montaje en gelatina-glicerina, el residuo de polen se monta en medio líquido. La posibilidad de un montaje en glicerina-agua permite la homogenización adecuada de la muestra de forma más sencilla facilitando el reconocimiento y conteo de granos. La tinción de los granos depende de los tipos morfológicos que puedan encontrarse en la muestra más que del medio de montaje. Un color demasiado oscuro puede ocultar detalles morfológicos y demasiado claro puede no resaltarlos lo suficiente (Beattie, 1971).
Por último resuspender el residuo de polen en un volumen conocido, permite el cálculo exacto del volumen contenido en cada una de las muestras analizadas. Utilizar un medio de suspensión/medio de montaje de baja viscosidad impide que una alícuota quede en la pipeta al extraer las submuestras, error en el que se podría incurrir al utilizar un método volumétrico (Moore et al., 1991). Por lo general, las preferencias alimentarias de las abejas silvestres son estudiadas recurriendo a métodos palinológicos cualitativos (O'Rourke & Buchmann, 1991). Si bien se considera el volumen de cada tipo polínico para ponderar su contribución en la dieta en relación a su tamaño, el volumen de polen de cada taxón se calcula multiplicando el número de granos de ese taxón (Buchmann & O'Rourke 1991, Silveira, 1991) contados a lo largo de un número de transectas (Von Der Ohe et al., 2004) y no sobre la totalidad de la muestra. Expresar cada tipo polínico en relación a la suma de todos los taxones presentes hace depender la abundancia de cada taxón en particular de las fluctuaciones de los otros sesgando la interpretación de los datos (Moore et al., 1991). Partir de un volumen conocido de polen nos permite realizar el conteo de granos sobre una submuestra homogénea sin necesidad de recurrir al conteo de la carga en su totalidad o al agregado de un marcador foráneo para contar con los valores absolutos para cada taxón presente. Si calculamos el volumen promedio del grano de un tipo polínico en particular al multiplicarlo por el número de granos de polen de ese taxón presente en la submuestra obtenemos el volumen de ese taxón contenido en la submuestras (ver Cálculo del volumen de polen). La suma de los volúmenes de todos los taxones contenidos en la submuestras nos permite conocer el volumen total de polen transportado en una escopa. De esta forma es posible analizar la fluctuación de un tipo polínico en la dieta de una especie de abeja (analizando una muestra representativa de ejemplares de la misma) independizándonos de las alteraciones de la abundancia de los otros taxones vegetales a lo largo de las distintas muestras. Conocer el volumen de polen colectado permite evaluar la dieta en términos de los requerimientos de las distintas especies de abejas silvestres, aspecto importante para el estudio de la biología y la conservación de muchos grupos de abejas nativas.
AGRADECIMIENTOS
A Arturo Roig Alsina y a Beatriz Galatti por sus sugerencias y la lectura crítica del manuscrito.
BIBLIOGRAFÍA
1. Beattie, A.J. 1972. A technique for the study of insect-borne pollen. The Pan-Pacific Entomologist, 47 (1): 82. [ Links ]
2. Buchmann, S.L. & M.K. O'Rourke. 1991. Importance of pollen grain volumes for calculating bee diets. Grana 30: 591-595. [ Links ]
3. Cane, J. & S. Sipes. 2006. Characterizing floral specialization among bees: analytical methods and a revised lexicon for oligolecty. En: Waser M. & Ollerton J. (Eds.): Plan-Pollinator Interactions: From Specialization to Generalization, pp. 99-122. The University of Chicago Press. [ Links ]
4. Cilla, G., M. Caccavari & A. Roig Alsina. (2007) Estudios preliminares del polen transportado en las escopas de abejas silvestres de la especie Melissodes Latreille (Hymenoptera: Eucerini). Bol. Soc. Argent. Bot. 42, 229. [ Links ]
5. Charloner, W.G. 1968. Electrostatic forces in insect pollination and their significance in exine ornament. En: Blackmore, S. & Ferguson, L.K. (Eds): Pollen and spores: form and function, 12: 103-108. Linnean Society Symposium Series, Academic Press, London. [ Links ]
6. Dafni, A., P.G. Kevan & B.C. Husband. 2005. Charper 6 Plant - pollinator interface. In: Practical Pollination Biology, pp. 329-400. Cambridge, Ontario, Canada. [ Links ]
7. Erdtman, G. 1969. Handbook of Palynology - An Introduction to the Study of Pollen Grains and Spores. Munksgaard, Copenhagen, 486 pp. [ Links ]
8. Faegri, K. & J. Iversen .1975 . Textbook of pollen analysis. Munksgaard, Copenhagen , 3rd ed., 295 pp. [ Links ]
9. Larson, G. 1993. Charper 7 Animals. En: Kearns C.A. & D.W. Inouye (Eds.): Techniques for pollination biologists. University Press of Colorado, Niwot, CO., pp. 263-392. [ Links ]
10. Louveaux, J., A. Maurizio & G. Vorwohl. 1978. Methods of Melissopalynology International Commission for Bee Botany of IUBS. Bee World, 59 (4): 139-157. [ Links ]
11. Michener, C.D. 2007. The Bees of the World, 2nd ed. Johns Hopkins University Press, New York, 953 pp. [ Links ]
12. Moore P.D., J.A. Webb & M.E. Collinson. 1991. Pollen Analysis. 2nd ed. Blackwell Scientific Publications, Oxford, 216 pp. [ Links ]
13. Müller, A. & M. Kuhlmann. 2008. Pollen hosts of western palaearctic bees of the genus Colletes (Hymenoptera: Colletidae) the Asteraceae paradox. Biol. J. Linn. Soc., 95: 719-733. [ Links ]
14. O'Rourke, M.K. & S.L. Buchmann. 1991. Standardized analytical techniques for bee-collected pollen. Environmental Entomology, 20: 507-513. [ Links ]
15. Roig Alsina, A. 2008. Apiformes. En: Claps L.E., Debandi G. & Roig Juñent, S. (Eds.) Biodiversidad de Artrópodos Argentinos, 2: 373-406. Sociedad Entomológica Argentina ediciones. [ Links ]
16. Silveira da, F.A. 1991. Influence of pollen grain volume on the estimation of the relative importance of its source to bees. Apidologie 22: 495-502. [ Links ]
17. Sipes, S.D. & V. Tepedino. 2005. Pollen-host specificity and evolutionary patterns of host switching in a clade of specialist bees (Apoidea: Diadasia). Biol. J. Linn. Soc., 86: 487-505. [ Links ]
18. Von Der Ohe W., L. Persano Oddo, M.L. Piana, M. Mortolot & P. Martin. (2004) Harmonized method of melissopalynology. Apidologie 35 (2004), 18-25. [ Links ]
19. Von Post, L. 1933. On improvements of the pollen analysis technique. Geol. Förem. Förhandl, vol 55. [ Links ]
20. Wodehouse, R.P. 1935. Pollen Grains. New York-London, 574 pp. [ Links ]
Recibido: 22-VII-2010
Aceptado: 20-XII-2010














