Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista del Museo Argentino de Ciencias Naturales
versión On-line ISSN 1853-0400
Rev. Mus. Argent. Cienc. Nat. vol.14 no.2 Ciudad Autónoma de Buenos Aires dic. 2012
ECOLOGÍA
Alimentación de Pseudocorynopoma doriai (Pisces: Characidae) en el arroyo El Portugués, provincia de Buenos Aires, Argentina
Ricardo A. Ferriz1, Eduardo M. Fernandez1, Guillermo R. López1, 2 & Cristina A. Bentos1
1Museo Argentino de Ciencias Naturales "Bernardino Rivadavia" Av. Angel Gallardo 470, 1405 Buenos Aires, Argentina.
2Facultad de Veterinaria (UBA), Area de Medicina, Producción y Tecnología de Fauna Acuática y Terrestre. edumarfernandez@gmail.com; rferriz@macn.gov.ar; cbentos@macn.gov.ar; glopezfcvuba@yahoo.com.ar
Resumen: Se describe la dieta de la mojarra de velo, Pseudoeorynopoma doriai, en el arroyo El Portugués (58° 26' 30" S - 35° 04' 24" W), perteneciente a la alta cuenca del río Samborombón, provincia de Buenos Aires. Para tal fin, se realizaron muestreos mensuales desde mayo de 2004 hasta abril de 2005. Para el análisis de los contenidos estomacales se utilizaron métodos de frecuencia, porcentaje volumétrico, porcentaje numérico e índice de importancia relativa (IRI). Los resultados obtenidos indican una dieta sin diferencias significativas a lo largo del año, constituida básicamente por insectos acuáticos, insectos alóctonos y arañas. El análisis demuestra que si bien no se encontraron grandes diferencias en la dieta de esta especie según la talla, los individuos menores de 42 mm de longitud estándar consumieron una mayor cantidad de insectos de origen terrestre. Los resultados permiten caracterizar a Pseudoeorynopoma doriai como una especie insectívora generalista para este arroyo de la Pampasia.
Palabras clave: Peces; Pseudoeorynopoma doriai; Alimentación; Argentina.
Abstract: Feeding of Pseudocorynopoma doriai (Pisces: Characidae) in "El Portugués" stream, Buenos Aires province, Argentina. We describe the diet of dragonfin tetra, Pseudoeorynopoma doriai, in the El Portugués stream (58° 26' 30" S - 35° 04' 24" W) belonging to the high Samborombón river basin, Buenos Aires province. To achieve this aim, samples were taken monthly from May 2004 until April 2005. The methods used for the analysis of stomach contents were, frequency, volumetric percentage, numerical percentage and index of relative importance (IRI). The results obtained indicate a diet with no significant differences throughout the year, consisting mainly of aquatic insects, allochthonous insects and spiders. The analysis shows that while there were no significant differences in diet at differents range length of this species, individuals less than 42 mm standard length, consumed a greater number of insects of terrestrial origin. The results allow to characterize Pseudoeorynopoma doriai as a generalist insectivorous species for this stream of Pampasia.
Key words: Fish; Pseudoeorynopoma doriai; food; Argentina.
INTRODUCCIÓN
El orden Characiformes es uno de los más diversos de peces neotropicales, presentando una gran variedad de formas, comportamientos y adaptaciones al medio (Lowe-McConnell, 1987), siendo la familia Characidae la que posee mayor número de especies. Los representantes de la subfamilia Glandulocaudinae, alrededor de 50 especies, se distribuyen desde el sur de Costa Rica hasta Ecuador en cursos de agua que drenan al Pacífico; y desde Trinidad y norte de Venezuela hasta el norte de la provincia de Buenos Aires, Argentina, de pendiente atlántica (Weitzman, 2003).
Pseudocorynopoma doriai Perugia, 1891 es el glandulocaudino que presenta la distribución más austral. Se la encuentra desde el sur de Brasil hasta el norte de la Pampasia, en la cuenca del río Salado, y en la cuenca parano-platense. (Ringuelet et al., 1967; Almirón et al., 1992; López et al., 2001). Los miembros de la subfamilia Glandulocaudinae presentan especies con inseminación. Este grupo se caracteriza por el marcado dimorfismo sexual y por la presencia en los machos de una glándula caudal con células activas que secretan feromonas durante el cortejo, lo que facilita la inseminación (Nelson, 1964).
Sobre aspectos básicos de la biología de P. doriai pueden citarse trabajos sobre distribución (Weitzman, 2003; Menni, 2004), aspectos poblacionales (Ferriz et al., 2010), alimentación (Graciolli et al., 2003), hábitat (Almirón et al., 2000), reproducción (Nelson, 1964; Menni & Almirón, 1994; Azevedo, 2004; Ferriz et al., 2007), conservación (Zayas & Cordiviola, 2007).
P. doriai, al igual que otros glandulocaudi-nos, es una especie conocida por los acuaristas desde hace unos 90 años, debido a su fácil crianza y su particular cortejo. Son exportados desde Argentina, Brasil, Paraguay, Trinidad y Venezuela (Gómez et al., 1993/94). Este pez presenta un cuerpo fuertemente comprimido, boca relativamente grande orientada hacia arriba típica de un consumidor de superficie, ojos laterales y aleta caudal grande.
En las últimas décadas, diversos estudios sobre los hábitos tróficos de peces neotropica-les han demostrado la importancia del aporte de los ambientes boscosos y arbustivos, cercanos a ríos y arroyos, a las tramas tróficas de los Glandulocaudinae y otros carácidos (Lowe-McConnell, 1987; Escalante, 1987; Gracioli et al., 2003; Menni, 2004; Pouilly et al., 2006). En general, la omnivoría es la estrategia alimentaria dominante en los arroyos neotropicales, siendo los alimentos dominantes restos vegetales, frutas e insectos aportados por la vegetación arbórea y arbustiva de la costa.
Factores ecológicos, como el grado de cobertura vegetal en los márgenes de los ríos y la velocidad del agua producen un fuerte efecto en las presas disponibles para las poblaciones de peces. La identificación y cuantificación de algunos de estos factores ecológicos es una herramienta que permite determinar los mecanismos de la adaptación local para un determinado tipo de alimento (Kolm & Arnqvist, 2011), el cual es un importante generador de diversidad en los peces.
El Portugués, es un típico arroyo de la llanura pampeana, con una estacionalidad menos marcada comparada con el ciclo de inundación periódica de los ríos tropicales, siendo la disposición permanente del agua y la temperatura moderada los factores más importantes que regulan la permanencia de las especies de peces. En este arroyo, P. doriai es una especie permanente, que representa el 6,13 % de la captura anual (Fernández et al., 2008).
Históricamente, las investigaciones en agua dulce se han centrado en los grandes ríos, debidas principalmente a su importancia económica y sus recursos pesqueros. Sin embargo, el número de estudios sobre pequeños cursos de agua ha aumentado recientemente, debido a su singular biota y a ser sumamente vulnerables a la degradación como consecuencia de las actividades antropogénicas (Menni, 2004). Por otra parte, la correcta planificación estratégica de gestión necesita de un conocimiento cabal de la dinámica de sus comunidades, incluyendo las interacciones abióticas y bióticas que promueven la coexistencia de las especies.
El objetivo del presente trabajo consiste en caracterizar la biología alimentaria de P. doriai en un curso de agua de la Pampasia, correspondiente al extremo sur de la distribución de esta especie, a través de la variación mensual de la dieta y del análisis de la variación de la misma a lo largo de su desarrollo.
MATERIALES Y MÉTODOS
Los peces fueron capturados mensualmente desde mayo de 2004 hasta abril de 2005. Las colectas se llevaron a cabo en el arroyo El Portugués (58° 26' 30" S - 35° 04' 24" W), perteneciente a la alta cuenca del río Samborombón, partido de San Vicente, provincia de Buenos Aires (Fig. 1).
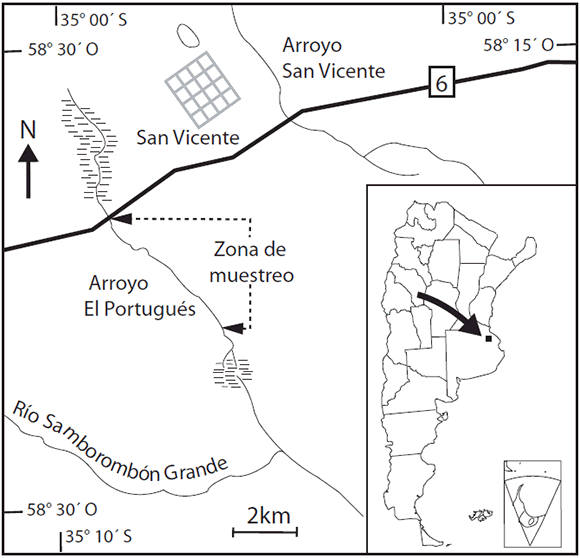
Fig. 1. Estación de muestreo (círculo negro) en el arroyo El Portugués, Partido de San Vicente, provincia de Buenos Aires, Argentina.
El Portugués es un curso de agua de primer orden tributario del río Samborombón Grande. Los muestreos se realizaron a 6 km de sus nacientes. Las aguas del arroyo El Portugués se caracterizan por tener un color marrón y ser poco transparentes (por la gran cantidad de ácidos húmicos en dilución), siendo una zona que presenta un fuerte impacto de la actividad ganadera. La velocidad de la corriente depende de la época del año, siendo baja en la época invernal y nula en la estival, presentando pozones. La composición del fondo es predominantemente limosa.
La vegetación sumergida se caracteriza por el predomino de Myriophyllum aquaticum acompañada de Bacopa monnieri. La vegetación flotante dominante en El Portugués está representada por la falsa verdolaga, Ludwigia pepoloide; la amapola de agua, Hydrocleys nymphoides, el helechito de agua, Azolla filiculoide y diversas especies de lentejas de agua pertenecientes a los géneros Lemna y Spirodella. Entre las plantas palustres predomina el junco, Schoenoplectus ca-lifornicus, y sagitaria, Sagitaria montevidensis. Las márgenes bajas, pantanosas, están cubiertas por céspedes de Bacopa monnieri. La vegetación terrestre en las márgenes de las zonas de mues-treo es el pastizal de gramíneas con ausencia de árboles y arbustos.
Se utilizó una red de arrastre de malla fina de 5 mm de distancia entre nudos para la captura de los ejemplares estudiados. Los peces fueron fijados in situ con una solución de formol al 8% y luego conservados en alcohol al 75% para su posterior estudio en el laboratorio. Los ejemplares analizados se depositaron en la colección del MACN-Ict.
El contenido estomacal fue analizado bajo lupa binocular siguiendo las recomendaciones de Hyslop (1980). Para cuantificar los principales componentes de la dieta fue utilizado el índice de importancia relativa (IRI) propuesto por Pinkas et al. (1971), donde se relaciona el porcentaje del volumen (%V), porcentaje numérico (%P) y su porcentaje de frecuencia (%F) a través de la expresión:
IRI = (% N + % V) . % F
El volumen (V) de cada ítem alimentario se determinó a través de una cámara milimetrada de 2 cm2 de superficie por 1 mm de altura. Se determinó el ancho del nicho trófico a través del coeficiente de diversidad de Shannon-Weaver (H'). La amplitud del nicho es una medida del rango o diversidad de los recursos usados por una especie en su condición local (Crowder, 1990).
Para determinar las variaciones ontogénicas de la dieta, los ejemplares estudiados se dividieron en tres grupos: menores o iguales de 42 mm de longitud estándar (Lst), entre 43 y 50 mm de Lst e iguales o mayores de 51 mm de Lst, teniendo en cuenta que las hembras de esta especie, en este ambiente, maduran entre los 42-43 mm de Lst y que a los 50-51 mm de Lst alcanza dicha población el 100% de madurez (Ferriz et al., 2007). Para analizar la estrategia alimentaria de cada uno de los grupos de tallas considerados se gra-ficó de acuerdo a lo propuesto por Amundsen et al. (1996). Este análisis gráfico consiste en representar, para cada componente de la dieta, su frecuencia de ocurrencia (Fi) frente a su abundancia específica (Pi). La importancia de cada presa, la estrategia alimentaria y la contribución intra e interfenotípica a la amplitud del nicho trófico, la importancia de las presas y la estrategia trófica en términos de especialización y generalización a nivel individual y poblacional, pueden ser interpretadas a lo largo de las diagonales generadas en el gráfico.
Se construyó una matriz de similitud con la cual se elaboró un dendrograma con el método de agrupamiento UPGMA. Se utilizó el coeficiente de Morisita modificado por Horn (1966) para describir la superposición estacional de la dieta de P. doriai mediante el empleo del porcentaje del IRI (% IRI) de cada ítem alimentario. Para detectar las diferencias mensuales de la dieta, en los tres grupos de tallas, se utilizó el método no para-métrico de diferencias significativas (ANüSIM) mediante el empleo del índice de similaridad de Bray-Curtis. La importancia de cada presa fue evaluada a través del método de evaluación del porcentaje de similitud (SIMPER), procedimiento que determina las categorías de presas responsables del agrupamiento del cluster. Los análisis multivariados se realizaron con el paquete estadístico PAST (versión 1.99, Hammer et al., 2001).
RESULTADOS
Se analizaron 264 ejemplares de P. doriai comprendidos entre los 29 y los 63 mm de longitud estándar (Lst media = 46,33 mm, DE = 5,54). Sólo un 4 % de los individuos estudiados presentó sus estómagos sin alimento.
El alimento dominante de P. doriai a lo largo de los meses estudiados fue de origen autóctono, excepto en el mes de diciembre en el que dominaron los insectos alóctonos (Tabla 1 y Fig. 2). En mayo se registró el mayor valor de nicho trófico (H' = 2,34) seguido del mes de enero, siendo los meses de agosto y noviembre los que presentaron valores más bajos (H' = 1,77 y 1,74 respectivamente).
Tabla 1. Composición mensual (% IRI) de la dieta de Pseudocorynopoma doriai en el arroyo El Portugués. H': ancho del nicho trófico, A: adultos, L: larvas, P: pupas, N: ninfas, DE: desviación estándar.


Fig. 2. Composición volumétrica (% V) mensual de los distintos grupos tróficos encontrados en los estómagos de Pseudocorynopoma doriai en el arroyo El Portugués.
Los Coleoptera acuáticos (Dytiscidae) fueron el grupo dominante en la dieta en los meses de julio y marzo, manteniendo una presencia secundaria en el resto de los meses. En el mes de septiembre dominaron las larvas de Dytiscidae. Amphipoda y Copepoda fueron el alimento dominante en el mes de mayo (2004). Los Heteroptera acuáticos (Sigara sp.) fueron el grupo dominante en las capturas de noviembre y secundario en los meses de agosto, diciembre y abril. Las ninfas de Plecoptera registraron alta incidencia en las ingestas del mes de agosto y noviembre estando casi ausente en el resto de los meses considerados. En cuanto a las ninfas de Zigoptera presentaron su máxima incidencia en julio. Con respecto a las ingestas de larvas de Diptera sólo en el mes de septiembre presentaron una importancia secundaria en la ingesta.
Los insectos alóctonos dominaron sólo en el mes de diciembre (% IRI = 51,71) siendo el alimento secundario en el resto de los meses, a excepción de mayo donde no se registraron ingestas de este grupo trófico. Junto con los Aranae de origen terrestre los insectos alóctonos en los meses de septiembre, enero y abril equipararon y superaron (respectivamente) a las ingestas de origen acuático.
De acuerdo al análisis realizado por el método de de agrupamiento UPGMA se observan seis grupos de ordenamiento para los meses estudiados (Fig. 3). ANüsiM muestra una separación significativa entre estos grupos (R2 = 0,9624, p = 0,0013). En el grupo I, que reúne los meses de diciembre, abril, enero y marzo, se reconoce, a través del siMPER, a los Thysanoptera, Heteroptera y Coleoptera como al grupo de presas preferido. El grupo ii, que reúne a los meses de julio y febrero, muestra a los Coleoptera, Copepoda y ninfas de Zigoptera como las presas preferidas. El grupo iii (mayo) presenta una dieta caracterizada por la ingesta de Amphipoda, Copepoda, y Aranae. En el grupo iV (agosto) dominan las ninfas de Plecoptera; en el grupo V (noviembre) dominan los Heteroptera, mientras que en el grupo Vi (septiembre) predominan las larvas de Dytiscidae, las larvas de Culicidae y los adultos de Diptera.
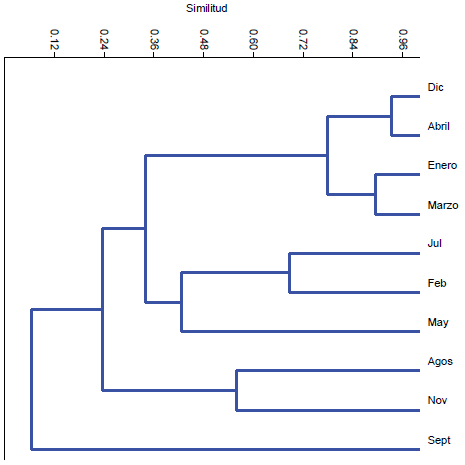
Fig. 3. Dendrograma de similitud de la dieta mensual de Pseudocorynopoma doriai en el arroyo El Portugués. Coeficiente correlación: 0,8976.
No se observó, según el ANüsIM (R2 = 1,333, p =1), diferencias significativas en la dieta durante el desarrollo de esta especie (Fig. 4). Se observa un aumento del consumo de fauna autóctona con el incremento de la talla. La ingesta de presas alóctonas fue mayor en los individuos juveniles (%V = 33,1), siendo los Formicidae el grupo que mayor aporta a estas ingestas. El consumo de Aranae y Amphipoda fue aumentando con la talla.
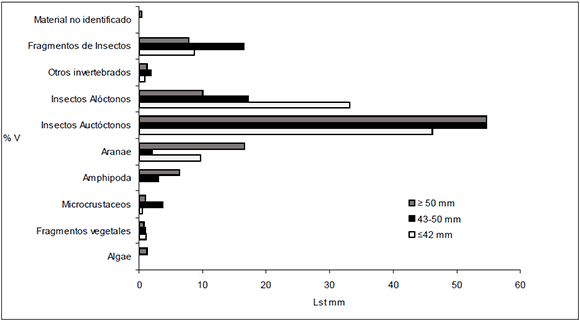
Fig. 4. Composición volumétrica (% V) de la dieta por clases de largo estándar para los grupos tróficos encontrados en los estómagos de Pseudocorynopoma doriai en el arroyo El Portugués.
La diversidad fue más baja en los individuos menores de 42 mm de Lst (H' = 2,38), mientras que para lo ejemplares comprendidos entre 43-50 mm de Lst, el H' fue de 2,83. Para los ejemplares mayores de 51 mm de Lst el H' fue de 2,77.
DISCUSIÓN Y CONCLUSIONES
Los carácidos que habitan los arroyos de la Pampasia son, en su mayoría, omnívoros e insectívoros (Ringuelet, 1975; Escalante, 1987; Menni, 2004, López Cazorla et al., 2003), que consumen primariamente algas, microcrustáceos, insectos autóctonos e insectos alóctonos. Los datos obtenidos en el presente estudio evidencian una predominancia de insectos de origen autóctonos en la dieta de P. doriai de este arroyo de la llanura pampeana, a sola excepción del mes de diciembre donde los insectos alóctonos son los dominantes. Esto significa que esencialmente se explotan los mismos recursos, variando la proporción de los mismos, probablemente, en función de su abundancia en cada uno de estos meses estudiados.
En general, el marcado régimen de lluvias en la región Neotropical es un factor que altera, en otras cosas, la dinámica de la estructura trófica de los arroyos y ríos (Lowe-McConnell, 1987), lo cual se manifiesta en los marcados cambios estacionales de la dieta de los peces. En cambio, en los arroyos de la Pampasia poseen una estacionalidad menos marcada comparada con el ciclo de inundación periódica de los ríos tropicales (Almirón et al., 2000). La relativa constancia sugiere una disponibilidad regular de los recursos alimentarios a lo largo del año (Rocha et al., 2009).
Las márgenes ricas en macrófitos de esta localidad son el lugar preferencial de alimentación de P. doriai. Asociados a las macrófitas, existe una gran disponibilidad de insectos y otros invertebrados acuáticos que sirven de alimento a la variedad de peces que allí viven (Rossi & Parma de Croux, 1993).
A diferencia de los cambios ontogénicos de la dieta que se han observado en la mayoría de los peces omnívoros tropicales y de aguas templadas (Kramer & Bryant, 1995), P. doriai no presenta diferencias significativas en la dieta de los tres grupos de tallas analizadas (Fig. 4). Sin embargo, se observa un aumento en el consumo de fauna autóctona con el aumento de la talla, siendo los grupos más consumidos por los adultos: Coleoptera, Aranae y Amphipoda. Además, la diversidad de la dieta aumenta con el aumento de la talla.
En la Fig. 5 se observa que los tres grupos de tallas analizados presentaron una dieta carnívora del tipo ge-neralista, con una amplitud de nicho trófico caracterizado por una alta competencia intrafenotípica. Lo que significa que los individuos de esta población participan o contribuyen cuantitativa y cualitativamente de forma similar al nicho trófico, no registrándose especializa-ciones del tipo individual, es decir comen de todo un poco (de todos los elementos que componen el nicho trófico del conjunto de la población).

Fig. 5. Representación de las estrategias alimentarias según el método gráfico de Amundsen et al. (1996) para los tres grupos de tallas analizados de Pseudocorynopoma doriai en el arroyo El Portugués. Fi: frecuencia de ocurrencia, Pi: abundancia específica de cada tipo de presa.
Otros estudios sobre la dieta de varios glandulo-caudinos muestran resultados diferentes en cuanto al origen de los alimentos dominantes. Graciolli et al. (2003) en un arroyo del sur de Brasil encontraron que la dieta de P. doriai y Diapoma speculiferum Cope, 1894 está constituido principalmente por insectos de origen alóctono. Dufech et al. (2003) estudiando especies del género Mimagoniates observaron que estos capturan sus presas sobre la superficie del agua y que el 70 a 90% está constituido por insectos terrestres. Kolm & Arnqvist (2011) encontraron, en ríos de Trinidad, que Corynopoma rüsei Gill 1858 consume preferentemente Formicidae en ambientes con un bosque marginal bien desarrollado, mientras que en ambientes de corriente lenta y escasa vegetación marginal la dieta estuvo constituida por Collembola, Acari y Ephemeroptera.
Nelson (1964) afirmó que la dieta de diferentes glandulocaudinos, al igual que otros carácidos, está constituida por materiales de superficie. Mientras que Weitzman et al. (1985) no acepta esta hipótesis, afirmando que muchos Tetragonopterinae se alimentan en superficie tanto como los glandulocaudinos con los cuales dividen el ambiente. Para el sur de Brasil, Dufech et al. (2003) y Graciolli et al. (2003) testearon la hipótesis de Nelson corroborando sus resultados. Asimismo, estos trabajos demuestran la importancia de la vegetación arbórea y arbustiva en torno a arroyos y ríos como proveedora de alimento para ciertas especies de peces. Los datos obtenidos en este trabajo apoyan la hipótesis de Nelson, pues el material consumido fue capturado en la superficie del agua o bien en los primeros centímetros de profundidad, especialmente los Coleoptera y Heteroptera adultos.
La mayoría de los peces tienen la suficiente plasticidad para cambiar la dieta cuando un alimento se torna disponible; muchas especies presentan la habilidad para tomar ventaja de esta oportunidad. Ante la falta del aporte de insectos alóctonos provenientes de las costas arboladas, P. doriai consume dominantemente insectos acuáticos que se encuentran entre la vegetación sumergida. En este ambiente, P. doriai es capaz de utilizar los recursos tróficos presentes en la superficie del agua y a media agua en ambientes cercanos a los parches de vegetación sumergida, tal como ocurre con buena parte de los carácidos neotropicales (Escalante, 1987; Dufech et al., 2003; Graciolli et al., 2003).
La abundancia de insectos en la dieta (tanto autóctonos como alóctonos) y las características anatómicas de P. doriai, como el cuerpo fusiforme, grandes ojos dorsolaterales y la boca orientada hacia arriba, indican que la táctica de esta especie es la alimentación en la superficie del agua. Dadas las características de la vegetación de la llanura pampeana, especialmente la falta de árboles en las margenes de los arroyos, se impone en esta especie un cambio en su estrategia alimentaria, no consumiendo insectos alóctonos en la superficie sino que busca su alimento en la columna de agua unos centímetros por debajo de la superficie, capturando básicamente insectos de origen acuático.
BIBLIOGRAFÍA
1. Almirón, A.E., S.E. Gómez & N.I. Toresani. 1992. Peces de agua dulce de la provincia de Buenos Aires. 1-29 p. En: H.L. López & E.P Toni (coord.), Situación ambiental de la provincia de Buenos Aires. A. Recursos y rasgos naturales en la evaluación ambiental, CIC, La Plata, Argentina, 2(12): 1-29. [ Links ]
2. Almirón, A.E., M.L. García, R.C. Menni, L.C. Protogino & L.C. Solari. 2000. Fish ecology of a seasonal lowland stream in temperate South America. Marine & Freshwater Research. 51:265-274. [ Links ]
3. Amundsen, PA.; H.M. Gabler & F.J. Staldvik. 1996. A new approach to graphical analysis of feeding strategy from stomach contents data-modification of the Costello (1990) method. Journal of Fish Biology, 48:607-614. [ Links ]
4. Azevedo, M.A. 2004. Análise comparada de caracteres reprodutivos em tres linhagens de characidae Ferriz et al.: Alimentación de Pseudocorynopoma doriai (Teleostei: Ostariophysi) com inseminando. Tesis Doctoral Universidade Federal do Rio Grande do Sul, Porto Alegre, Brasil. 238pp. [ Links ]
5. Crowder, L.B. 1990. Community Ecology. En: C.B. Schedeck & PB. Moyle (Eds.), Methods for Fish Biology. American Fisheries Society, Maryland. 684pp. [ Links ]
6. Dufech, A.P; M.A. Azevedo & C.B. Fialo. 2003. Comparative dietary análisis of two populations of Mimagoniates rheocharis (Characidae: Glandulocaudinae) from two streams of Southern Brazil. Neotropical Ichthyology, 1(1):67-74. [ Links ]
7. Escalante, A.H 1987. Alimentación de Bryconamericus iheringi y Jenynsia lineata lineata (Osteichthyes) en Sierra de la Ventana (Argentina). Anales de Museo de Historia Natural de Valparaíso, 18:101-108. [ Links ]
8. Fernández, E.M.; R.A. Ferriz; C.A. Bentos & G.R. López. 2008. Ichthyofauna of two streams in the high basin of the Samborombón River, Buenos Aires province, Argentina. Revista de Museo Argentino de Ciencias Naturales, n.s., 10(1):147-154. [ Links ]
9. Ferriz, R.A., E.M. Fernández, C.A. Bentos & G.R. López. 2007. Reproductive biology of Pseudocorynopoma doriai (Pisces: Characidae) in the High Basin of the Samborombón River, province of Buenos Aires, Argentina. Journal of Applied Ichthyology, 23(3): 226-23. [ Links ]
10. Ferriz, R.A., G.R. López, E.M. Fernández & C.A. Bentos. 2010. Aspectos poblacionales de Pseudocorynopoma doriai en dos arroyos de la alta cuenca del Río Samborombón, provincia de Buenos Aires, Argentina. Bioikos, 24(2):73-81. [ Links ]
11. Gómez, S.E., H. Cassará & S. Bordone. 1993/94. Producción y comercialización de los peces ornamentales en la república Argentina. Revista de Ictiología, 2/3(1/2):13-20. [ Links ]
12. Graciolli, G, M.A. Azevedo & F.A.G. Melo. 2003. Comparative Study of the Diet of Glandulocaudinae and Tetragonopterinae (Ostariophysi: Characidae) in a Small Stream in Southern Brazil. Studies of Neotropical Fauna and Environment, 38(2): 95-103 [ Links ]
13. Hammer, O., D.A.T. Harper & P.D. Ryan. 2001. PAST: Paleontological Statistics Software Package for Education and Data Analysis. Palaeontologia Electronica, 4(1): 9. [ Links ]
14. Horn, W.S. 1966. Measurement of "overlap" in comparative ecological studies. American Naturalist, 100:420-424. [ Links ]
15. Hyslop, E.R. 1980. Stomach contents analysis-a review of methods and their application. Journal of Fish Biology, 17:411-429. [ Links ]
16. Kolm, N. & G. Arnqvist. 2011. Environmental correlates of diet in the swordtail characin (Corynopoma rüsei, Gill). Environmental Biology of Fishes, 92(2):155-166. [ Links ]
17. Kramer, D.L. & M.J. Bryant. 1995. Intestine length in the fishes of a tropical stream: 2. Relationships to diet. The long and short of a convoluted issue. Environmental Biology of Fishes, 42:129-141. [ Links ]
18. López, H.L., C. Baigún, J. Iwaszkiw, R. Delfino & O. Padin. 2001. La cuenca del Salado: uso y posibilidades de sus recursos pesqueros. Editorial de la Universidad de La Plata, La Plata. 76 p. [ Links ]
19. López cazorla, A.; W. Duran & L. Tejera. 2003. Alimentación de la ictiofauna del Río Sauce Grande, Provincia de Buenos Aires, Argentina. Biología Acuática, 20:73-79. [ Links ]
20. Lowe-Mcconnell, R.H. 1987. Ecological studies in tropical fish communities. cambridge Univ. Press, cambridge. 382 p. [ Links ]
21. Menni, R.C. 2004. Peces y ambientes en la Argentina continental. Monografías de Museo Argentino de ciencias Naturales, 5:1-316. [ Links ]
22. Menni, R.C. & A.E Almirón. 1994. Reproductive sea-sonality in fishes manmade ponds in temperate South America. Neotrópica 40(103-104):75-85. [ Links ]
23. Nelson, K. 1964. Behaviour and morphology in the glandulocaudine fishes (Ostariophysi, characidae). University of California Publications in Zoology, 75:59-152. [ Links ]
24. Pinkas, L.; M.S. Oliphant & I.L.K. Iverson. 1971. Food habits of albacore, bluefin, tuna and bonito in california. California Fish and Game, Fisheries Bulletin, 152:1-105. [ Links ]
25. Pouilly, M.; S. Barrera & C. Rosales. 2006. changes and taxonomic and trophic structure of fishes assemblages along an environmental gradient in the Upper Beni watershed (Bolivia). Journal of Fish Biology, 68(1):137-156. [ Links ]
26. Ringuelet, R.A. 1975. Zoogeografía y ecología de los peces de aguas continentales de la Argentina y consideraciones sobre las áreas ictiológicas de América del Sur. Ecosur, 2(3): 1-122. [ Links ]
27. Ringuelet, R.A., R.H. Aramburu & A.A. de Aramburu. 1967. Los peces argentinos de agua dulce. comisión científica de la Provincia de Buenos Aires. La Plata, Argentina. 602 pp. [ Links ]
28. Rocha, F.c.; L. casatti & D.c. Pereira. 2009. Structure and feeding of a stream fish assemblage in Southeastern Brazil: evidence of low seasonal influences. Acta Limnologica Brasilensia, 21(1):123-134. [ Links ]
29. Rossi, L.M. & M.J. Parma de croux. 1993. Influencia de la vegetación acuática en la distribución de peces del río Paraná, Argentina. Ambiente Subtropical, 2:65-75. [ Links ]
30. Weitzman, S.H. 2003. Subfamily Glandulocaudinae (characins, tetras). En: R.E. Reis, S.O. Kullander & c.J. Ferraris, Jr. (Eds), Chek list of the freshwater fishes of South and Central America. Edipucrs. Porto Alegre, Brazil, p. 222-230. [ Links ]
31. Weitzman, S.H., S.V Fink & N.A. Menezes. 1985. A critique of the Monophyly of the Glandulocaudinae. En: S.H. Weitzman & S.V. Fink (Eds.), Xenurobryconin Phylogeny and Putative Pheromone Pumps in Glandulocaudine Fishes (Teleostei: Characidae). Smithsonian contribution of Zoology, 421. [ Links ]
32. Zayas, M.A. & E. cordiviola. 2007. The conservation state of characidae fish (Pisces: characidae) in an area of the Plata Basin, Argentina. Gayana, 71(2):178-186. [ Links ]
Recibido: 27-VIII-2012
Aceptado: 27-XI-2012














