Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista del Museo Argentino de Ciencias Naturales
On-line version ISSN 1853-0400
Rev. Mus. Argent. Cienc. Nat. vol.16 no.1 Ciudad Autónoma de Buenos Aires June 2014
ZOOLOGÍA
Estimación de la longitud de la pescadilla de red (Cynoscion guatucupa) (Actinopterygii: Sciaenidae) utilizando relaciones morfométricas de huesos del cráneo y de la cintura escapular, otolitos y medidas específicas del cuerpo
Jorge Eduardo Perez Comesaña1,2, Carolina Bechthold3, Karina Arias2, Gustavo Rodolfo Carrizo1 & Cecilia Riestra2,4
1División Ictiología, Museo Argentino de Ciencias Naturales "Bernardino Rivadavia". Av. Ángel Gallardo 470, C1405DJR Ciudad de Buenos Aires, jorgepc@macn.gov.ar
2Estación Hidrobiológica de Puerto Quequén. Boulevard Almirante Brown y Calle 520 s/nº. B7631 Quequén. Provincia de Buenos Aires.
3Departamento de Ciencias Biológicas, Universidad CAECE. Junín 516, C1026ABL Ciudad de Buenos Aires.
4Instituto Nacional de Investigación y Desarrollo Pesquero. Paseo Victoria Ocampo N 1. 7600. Mar del Plata.
Resumen
Se generaron ecuaciones de regresión para estimar el largo total de la pescadilla de red (C. guatucupa) a partir de la longitud de los huesos del cráneo, la cintura pectoral, otolitos y medidas corporales específicas. Tanto los huesos como las dimensiones corporales y los otolitos son buenos predictores de la longitud total de C. guatucupa, siendo evidente su importancia a los fines de incrementar y mejorar la información obtenible a partir del análisis de contenidos estomacales de organismos piscívoros en la región del Atlántico del Sur.
Palabras clave: Huesos diagnósticos; Piscívoros; Predadores tope; Dieta.
Abstract
Predictive regression equations were generated to estimate total length of the stripped weakfish (C. guatucupa) using skull and pectoral girdle bones, specific body and otolith lengths. Regressions using skull and pectoral girdle bones, specific body and otolith lengths were all statistically significant. The bone and external body features´ regressions evidently have the capability to increase the amount of dietary information obtainable from stomach contents analyses of Southwest Atlantic piscivore organisms.
Key words: Diagnostic bones; Piscivores; Top predators; Diet.
INTRODUCCIÓN
La alimentación de los animales marinos ha sido estudiada con el fin de establecer su posición dentro de las tramas tróficas y para comprender mejor las interacciones depredador-presa (Pauly et al., 1998b; Cortés, 1999). Las interacciones entre especies afectan la dinámica de las poblaciones ícticas marinas (Alonzo et al., 2003), mientras que las estructuras de las comunidades están fuertemente influenciadas por los depredadores piscívoros (Lyons & Magnuson, 1987; Tonn et al., 1992; Scharf et al., 1997). Por otra parte, en años recientes, los estudios en ecología trófica han adquirido relevancia debido a su utilización en la construcción de índices para la evaluación de la salud de los ecosistemas (Pauly et al., 1998a, b). El nivel trófico es uno de estos índices, y el mismo ha sido extensivamente utilizado para evaluar el estado de las pesquerías, como así también para determinar la existencia de sobre-explotación y la sustentabilidad de dichas pesquerías en el tiempo (Pauly et al., 1998a, 2001, 2002). Por lo tanto, en trabajos de ecología trófica, es de gran importancia alcanzar la mayor precisión posible en la evaluación de la dieta de cualquier depredador, incluyendo el tamaño y el peso de las presas ingeridas, ya que esta información resulta esencial para definir estrategias de manejo y conservación (Cherel et al., 2000).
Por lo común, en trabajos sobre alimentación, la identificación de las especies presa, como así también la estimación de su longitud y peso, se efectúa a partir de los otolitos. Esta estructura, sin embargo, debido a su alta velocidad de degradación, no siempre se puede encontrar en los contenidos estomacales (North et al., 1984; Jobling & Breiby, 1986). Por este motivo, y de bido a su baja tasa de digestión, los huesos del cráneo y de la cintura escapular se convierten en una alternativa o complemento al uso de los otolitos en estudios sobre dieta (Hansel et al., 1988; Scharf et al., 1997, 1998; Gosztonyi et al., 2007; González Zevallos et al., 2010, Perez Comesaña et al., 2014).
La pescadilla de red Cynoscion guatucupa (Cuvier, 1830), es un pez demersal y de hábitos costeros que se distribuye desde los 22º 35' S en costas del Brasil hasta los 43º S en aguas de Argentina (Cousseau & Perrotta, 1998), constituye una presa importante para depredadores tope como el lobo marino sudamericano (Otaria byronia), el delfín franciscana (Pontoporia blainvillei), el tiburón gatuzo (Mustelus schmitti), el tiburón gatopardo (Notorhynchus cepedianus), el tiburón bacota (Carcharhinus brachyurus), el tiburón cazón (Galeorhinus galeus, el tiburón escalandrún (Carcharias taurus), el tiburón ángel (Squatina guggenheim) y la raya (Atlantoraja castelanaui) (Rodríguez et al., 2002; Lucífora, 2003; Lucífora et al., 2005, 2006; Vögler et al., 2003; Suárez et al., 2005; Perez Comesaña, datos inéditos).
Con el fin disponer de una nueva herramienta para optimizar los estudios cuantitativos de la dieta de piscívoros marinos, en este trabajo se dan a conocer por primera vez ecuaciones de regresión lineal predictivas de la longitud total de C. guatucupa a partir del largo de los huesos craneales, huesos escapulares, otolitos y medidas específicas del cuerpo.
MATERIALES Y MÉTODOS
Se analizaron 228 ejemplares de C. guatucupa, de entre 124 y 618 mm de longitud total (LT), desembarcados por la flota comercial de arrastre de fondo que opera en Puerto Quequén, provincia de Buenos Aires, Argentina (39°40'S, 58°50'O). Las medidas corporales fueron tomadas con una aproximación de un centímetro (± 1 mm) (Fig.1). Se procedió a la disección de la totalidad de los especímenes y su posterior congelado. Los huesos diagnósticos fueron seleccionados de acuerdo a Gosztonyi & Kuba (1996). Los huesos elegidos fueron aquellos encontrados frecuentemente en los contenidos estomacales de los depredadores marinos y que permiten una identificación a nivel específico. La remoción de los huesos se realizó con agua hirviendo por un periodo no mayor a los 2 minutos, dependiendo del tamaño del ejemplar. Una vez separados de los tejidos blandos, se midieron inmediatamente utilizando un calibre con una precisión de 0,05 mm, de acuerdo al esquema presentado en la Fig. 2. Las ecuaciones de regresión lineal a fin de estimar la longitud total a partir de la longitud de la cabeza, longitud predorsal y preanal, longitud de la barra hioidea, del cleitro, del dentario, del maxilar, del premaxilar, del opercular, del preopercular, del vómer, del hiomandibular, del parasfenoides y del otolito, se generaron utilizando el paquete estadístico InfoStat/L (Di Rienzo et al., 2010).
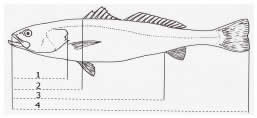
Fig. 1. Esquema de las medidas corporales registradas. 1: longitud de la cabeza; 2: longitud predorsal; 3: longitud preanal; 4: longitud total.
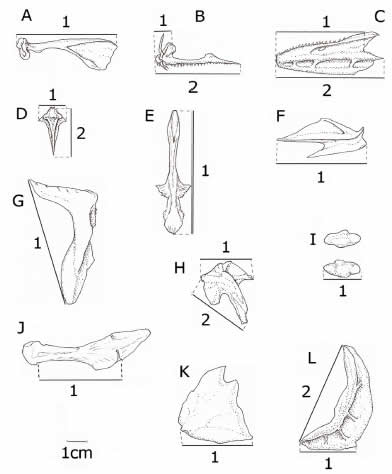
Fig. 2. Esquema de los huesos y otolitos. A: maxilar; B: premaxilar; C: dentario; D: vómer; E: parasfenoides; F: angular; G: cleitro; H: hiomandibular; I: otolitos; J: barra hioidea; K: opercular; L: preopercular. Los números (1) y (2) representan las medidas registradas.
RESULTADOS
Todas las regresiones fueron altamente significativas (p<0,0001). El coeficiente de determinación (r2) relacionado con las medidas corporales tomó valores de entre 0,96 y 0,98, siendo la distancia preanal la que mostró un mejor ajuste (Tabla 1).
Tabla 1. Párametros estimados a partir de los análisis de regresión entre las estructuras medidas vs. la longitud total de Cynoscion guatucupa (y = a + bx). x = variable en mm, y = longitud total en mm, n = tamaño de la muestra, r2 = coeficiente de determinación, SE = error estandard, IC = intervalo de confianza. Los números (1) y (2) representan las medidas ilustradas en la figura 2.

Los valores del coeficiente de determinación para las longitudes de los huesos diagnósticos variaron entre 0,92 y 0,97. El mejor ajuste se obtuvo con el maxilar (r2 = 0,97) que resultó apenas superior al obtenido con el premaxilar (medida 2), el dentario (medida 2), el parasfenoides, el angular, el cleitro, el hiomandibular (las 2 mediciones) y el preopercular (medida 2), todos ellos con un r2 igual a 0,96 (Tabla 1).
La longitud del otolito también mostró un muy buen ajuste (r2 = 0,95) (Tabla 1).
DISCUSIÓN Y CONCLUSIONES
La totalidad de las mediciones, sean de los huesos diagnósticos o de las longitudes corporales y del otolito mostraron una relación significativa con la longitud total. Los cálculos obtenidos a partir de los huesos diagnósticos, especialmente del premaxilar (medida 2), el dentario (medida 2), el parasfenoides, el angular, el cleitro, el hiomandibular (las 2 mediciones) y el preopercular (medida 2), parecen ser predictores confiables del largo de C. guatucupa.
La estimación del tamaño original de las presas a partir de la medición de huesos craneales y escapulares resultaría en una optimización en la calidad de la información obtenida en los trabajos cuantitativos sobre la dieta de especies depredadoras y de su rol en la estructura de las comunidades marinas.
El cálculo de las dimensiones originales de un pez a partir de las mediciones de los huesos diagnósticos no es tan susceptible a error como el tomado de las medidas corporales externas. Se sabe que la morfología externa puede deformarse durante el proceso de digestión lo cual puede conducir a que las mediciones efectuadas sean defectuosas. No obstante, si las presas fueron consumidas en un lapso de tiempo reciente, las medidas morfológicas externas pueden ser estimadoras de una gran consistencia, convirtiéndose en una alternativa apropiada a la de los huesos diagnósticos.
La reconstrucción del tamaño original de las presas a partir de huesos diagnósticos tiene algunas limitaciones. El efecto de los preservantes sobre el tamaño de los huesos debe ser tenido en consideración si los contenidos estomacales son guardados en un estabilizador químico (Hansel et al., 1998; Scharf et al., 1997). No es el caso de las muestras utilizadas en este estudio, dado que las mismas se conservaron congeladas. Otro problema potencial es el uso de agua hirviendo para facilitar la separación de los huesos del tejido blando. Su empleo puede causar la deformación y contracción de los huesos si transcurre el tiempo suficiente entre el hervor y la toma de las mediciones. Para salvar este potencial artefacto de técnica, las medidas deben tomadas inmediatamente después de la remoción de los huesos como se procedió en este trabajo.
Nuestros resultados muestran que los huesos maxilar, premaxilar, dentario, parasfenoides, angular, hiomandibular, preopercular y cleitro, como así también las medidas morfológicas externas son los mejores predictores de la longitud total de C. guatucupa.
Las ecuaciones de regresión calculadas a partir de los huesos craneales y escapulares y las medidas corporales externas presentadas en este trabajo incrementan el potencial cuali-cuantitativo de la información obtenida a partir del análisis de contenidos estomacales de los depredadores piscívoros del Océano Atlántico Sur occidental.
AGRADECIMIENTOS
A Leandro Tamini por su ayuda en las tareas de campo. A Roque Bruno y a Juan de la pescadería "Santa Cecilia". A José Ricci por permitirnos el uso de sus instalaciones. Al Dr. Atila E. Gosztonyi y al revisor anónimo por las sugerencias que permitieron mejorar la calidad del manuscrito.
BIBLIOGRAFÍA
1. Alonzo, S.H., P.V. Switzer & M. Mangel. 2003. An ecosystem based approach to management: using individual behaviour to predict the indirect effects of Antarctic krill fisheries on penguin foraging. J. Appl. Ichthyol. 40: 692-702. [ Links ]
2. Cherel, Y., H. Weimerskirch & C. Trouvé. 2000. Food and feeding ecology of the neritic-slope forager black-browed albatros and its relationships with commercial fisheries in Kerguelen waters. Mar. Ecol. Prog. Ser. 207: 183-199. [ Links ]
3. Cortés, E. 1999. Standardized diet compositions and trophic levels of sharks. ICES J. Mar. Sci. 56: 707-717. [ Links ]
4. Cousseau, M.B. & R.G. Perrotta. 1998. Peces marinos de Argentina. Biología, distribución, pesca. Publicaciones Especiales INIDEP, Mar del Plata, 167 pp. [ Links ]
5. Di Rienzo, J.A., F. Casanoves, M.G. Balzarini, L. González, M. Tablada & C.W. Robledo. 2010. InfoStat versión 2010. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. [ Links ]
6. González Zevallos, D., L. Kuba & A.E. Gosztonyi. 2010. Estimación de la longitud utilizando relaciones morfométricas de huesos del cráneo, cintura escapular, otolitos y medidas específicas del cuerpo en Merluccius hubbsi en aguas patagónicas. Rev. Biol. Mar. 45: 341-345. [ Links ]
7. Gosztonyi, A.E. & L. Kuba. 1996. Atlas de huesos craneales y de la cintura escapular de peces costeros patagónicos. Informe Técnico Nº 4. Fundación Patagonia Natural, Puerto Madryn, Argentina, 29 pp. [ Links ]
8. Gosztonyi, A.E., L. Kuba & L.E. Manzur. 2007. Estimation of body size using morphometric relationships of head bones, pectoral fin bones and bony precaudal distance in Raneya brasiliensis (Kaup, 1856) (Pisces, Ophidiiformes, Ophidiidae) in Patagonian waters. Rev. Biol. Mar. 42: 1-5. [ Links ]
9. Hansel, H.C., S.D. Duke, P.T. Lofy & G.A. Gray. 1988. Use of diagnostic bones to identify and estimate original lengths of ingested prey fishes. Trans. Am. Fish. Soc. 117: 55-62. [ Links ]
10. Jobling, M. & A. Breiby. 1986. The use and abuse of fish otoliths in studies of feeding habits of marine piscivores. Sarsia 71: 265-274. [ Links ]
11. Lucifora, L.O. 2003. Ecología y conservación de los grandes tiburones costeros de Bahía Anegada, Provincia de Buenos Aires Argentina. Tesis doctoral, Universidad de Mar del Plata, Mar del Plata, 405 pp. [ Links ]
12. Lucifora, L.O., V.B. García, R.C. Menni & A.H. Escalante. 2006. Food habits, selectivity, and foraging modes of the school shark Galeorhunus galeus. Mar. Ecol. Prog. Ser. 315: 259-270. [ Links ]
13. Lucifora, L.O., R.C. Menni & A.H. Escalante. 2005. Reproduction, abundance, and feeding habits of the broadnose sevengill shark Notorhynchus cepedianus, from north Patagonia, Argentina. Mar. Ecol. Prog. Ser. 289: 237-244. [ Links ]
14. Lyons, J. & J.J. Magnuson. 1987. Effects of walleys predation on the population dynamics of small littoral-zone fishes in a northern Wisconsin lake. Trans. Am. Fish. Soc. 116: 29-39. [ Links ]
15. North, A.W., M.S. Burchett, C.J. Gilbert & M.G. White. 1984. Identification of fish from the southern ocean by means of otoliths. Br. Antarct. Surv. Bull. 62: 83-94. [ Links ]
16. Pauly, D., V. Christensen, J. Dalsgaard, R. Froese & F. Torres. 1998a. Fishing down marine food webs. Science 279: 860-863. [ Links ]
17. Pauly, D., V. Christensen, S. Guénette, T.J. Pitcher, U.R. Sumaila, C.J. Walters, R. Watson & D. Zeller. 2002. Towards sustainability in world fisheries. Nature 418: 689-684. [ Links ]
18. Pauly, D., M.L. Palomares, R. Froese, P. Sa-a, M. Vakily, D. Preikshot & S. Wallace. 2001. Fishing down Canadian aquatic food webs. Can. J. Fish. Aquat. Sci. 58: 51-62. [ Links ]
19. Pauly, D., A.W. Trites, E. Capuli & V. Christensen. 1998b. Diet composition and trophic levels of marine mammals. ICES J. Mar. Sci. 55: 467-481. [ Links ]
20. Perez Comesaña, J.E., P. Clavin, K. Arias & C. Riestra. 2014. Total length estimation of the Brazilian flathead Percophis brasiliensis, using morphometric relationships of skull, pectoral girdle bones, otoliths and specific body measures, in Argentine waters. J. Appl. Ichthyol. 30: 377-380. [ Links ]
21. Rodríguez, D., L. Rivero & R. Bastida. 2002. Feeding ecology of the franciscana (Pontoporia blainvillei) in marine and estuarine waters of Argentina. LAJAM 1: 77-94. [ Links ]
22. Scharf, F.S., J.A. Buckel, F. Juanes & D.O. Conover. 1997. Estimating piscine prey size from partial remains: testing for shifts in foraging mode by juvenile bluefish. Environ. Biol. Fish. 49: 377-388. [ Links ]
23. Scharf, F.S., R.M. Yetter, A.P. Summers & F. Juanes. 1998. Enhancing diet analyses of piscivorous fishes in the Northwest Atlantic through identification and reconstruction of original prey sizes from ingested remains. Fish. Bull. 96: 575-588. [ Links ]
24. Suárez, A.A., D. Sanfelice, M.H. Cassini & H.L. Cappozzo. 2005. Composition and seasonal variation in the diet of the south american sea lion (Otaria flavescens) from Quequén, Argentina. LAJAM 4: 163-174. [ Links ]
25. Tonn, W.M., C.A. Paszkowski & I.J. Holopainen. 1992. Piscivory and recruitment; mechanisms structuring prey populations in small lakes. Ecology 73: 951-958. [ Links ]
26. Vögler, R., A.C. Milessi & R.A. Quiñones. 2003. Trophic ecology of Squatina guggenheim on the continental shelf off Uruguay and northern Argentina. J. Fish. Biol. 62: 1254-1267. [ Links ]
Recibido: 6-I-2014
Aceptado: 8-V-2014













