Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista del Museo Argentino de Ciencias Naturales
On-line version ISSN 1853-0400
Rev. Mus. Argent. Cienc. Nat. vol.20 no.1 Ciudad Autónoma de Buenos Aires June 2018
MORFOLOGÍA, TAXONOMÍA Y ZOOGEOGRAFÍA DE MAMÍFEROS ARGENTINOS: HOMENAJE A JOSÉ YEPES
Biogeografía ecológica de los ensambles de pequeños mamíferos en los Andes centrales de Argentina
Agustina Novillo & Ricardo A. Ojeda
Grupo de Investigaciones de la Biodiversidad (GIB) – IADIZA – CCT Mendoza. Av. Ruiz Leal s/n. Parque General San Martín (5500), Mendoza, Argentina.
Resumen
Los Andes constituyen una de las cadenas montañosas más extensas del planeta y un verdadero laboratorio para el estudio de la evolución de la biota sudamericana. En homenaje a José Yepes, uno de los pioneros en caracterizar la distribución de mamíferos de Argentina, buscamos en esta contribución sintetizar, desde la biogeografía ecológica, el conocimiento que tenemos sobre los patrones de diversidad de pequeños mamíferos de los Andes Centrales Áridos (ACA) y los factores causales. Caracterizamos, a nivel regional y local, los patrones de riqueza de roedores y endemismos en función de latitud, altitud y área. A escala regional, generamos una base de datos a partir de rangos de distribución de las especies, mientras que a escala local se realizaron muestreos en 4 transectas altitudinales entre los 32ºS y 35ºS. Entre los resultados destacamos, a escala regional: a) un elevado número de endemismos (> 50 %); b) aumento de riqueza con la altura, y c) relación especies endémicas – área. A escala local destacamos: d) la riqueza incrementa con la altura, precipitación media y heterogeneidad topográfica, y e) mayor abundancia en alturas intermedias.
Palabras clave: Roedores; Andes; Gradientes ambientales; Diversidad.
Abstract
Ecological biogeography of small mammal assemblages in the central Andes of Argentina
The Andes constitutes an extensive mountain range and a true laboratory for the study of the evolution of South American biota. In recognition to José Yepes, one of the pioneers in characterizing the distribution of mammals of Argentina we seek in this contribution to synthesize, from ecological biogeography, the knowledge we have about the diversity patterns of small mammals of the Central Arid Andes (ACA). We characterize regional and local patterns of rodent richness and endemism as a function of latitude, altitude and area. At regional scale, we constructed a species database using species range maps, meanwhile at the local scale, we conducted small mammal surveys using standardized techniques along 4 elevational transects between 32ºS and 35ºS. Among the results, we highlight, at regional level: a) a high number of endemisms (> 50%); b) richness increase with elevation, and c) endemic species – area relationship. Among the results at local level we stress: d) richness increases with elevation, mean precipitation and topographic heterogeneity, and e) greater abundance at intermediate elevations. Biogeographic-ecological research allows us to depict patterns of composition and distribution of the central Andean biodiversity, and assess some of its causal factors. However, the long term conservation of the Andes requires not only solid biological / ecological knowledge but also conservation policies that integrate the biological, social and cultural dimensions of the Andean ecosystem. This approach seems the most appropriate alternative in the face of the different impacts induced by man and the climate change in the region.
Key words: Rodents; Andes; Environmental gradient; Species diversity.
INTRODUCCIÓN
Sobre la base de los estudios de Oldfield Thomas y destacando el valor de las colecciones científicas como base para diversos estudios taxonómicos y de faunas regionales, José Yepes es uno de los pioneros, junto a Angel Cabrera, de caracterizar la distribución geográfica de los mamíferos de Argentina (1930, 1937,1938, 1941; véase García, 2018 para una síntesis biográfica de Yepes) y el primero en sintetizar la zoogeografía de mamíferos de la provincia de Mendoza (1936). No obstante el limitado relevamiento regional, escaso número de ejemplares y conocimiento taxonómico de un reducido número de especies, Yepes caracteriza a los mamíferos de Mendoza a modo de “catálogo documentado”, según sus palabras, dentro de 5 divisiones o provincias zoológicas propuestas por Lahille (1898), una de las cuales es la “provincia andina”, o equivalente a la región montañosa de los Andes centrales que tratamos en el presente trabajo.
Los ecosistemas montañosos han desempeñado un papel importante en la evolución y distribución de la biodiversidad (Lomolino, 2001; Körner, 2000). La orogenia de la Cordillera de los Andes tuvo un impacto substancial en el desarrollo y evolución biótica de la Región Neotropical, imponiendo barreras físicas y limitantes altitudinales a la distribución de numerosos taxa y a la migración de distintos linajes (Patterson et al., 2012).
La influencia climática de la orogenia Andina ha determinado cambios en el paisaje, originando un mosaico de nuevos ambientes y ecosistemas áridos (ej. Patagonia y Puna), con una amplia variedad de relieves topográficos, climas y hábitats. Esto contribuyó al desarrollo de una gran diversidad biótica en la cordillera de los Andes y mantenimiento de numerosos endemismos (Hershkovitz, 1969; Patterson & Pascual, 1972; Reig, 1981, 1986; Marquet, 1994). El levantamiento de los Andes, promovió el aislamiento de organismos de tierras bajas a ambos lados y en los sectores más altos de la cordillera (Marshall, 1979; Palma, et al., 2005; Brumfield & Edwards, 2007), y actuó como corredor norte - sur y sur-norte durante el gran intercambio biótico-americano (Gabi -Marshall, 1979).
Los patrones de diversidad a escala global y regional a menudo se asocian con gradientes de latitud y elevación (Simpson, 1964; Terborgh, 1977; Rahbek, 1995, 1997; Rosenzweig, 1995; Brown, 2001; Lomolino, 2001). Así, la disminución de la diversidad a medida que aumenta la latitud es uno de los patrones más generalizados. Este ha sido registrado en numerosos taxa, actuales y extintos, y a diferentes escalas, desde local a global (Willig et al., 2003; Willig & Presley, 2013). La latitud puede ser considerada un substituto de varios factores, entre los que se destaca el área, el clima, la productividad, la heterogeneidad topográfica y la altura (Willig & Bloch 2006; Badgley & Fox 2000; Currie et al., 2004). En el caso de los mamíferos, la forma y fuerza de este patrón varía según el grupo de mamíferos estudiados (Mares & Ojeda, 1982; Ruggiero, 1994, Ruggiero et al., 1998).
Los gradientes altitudinales de diversidad constituyen uno de los patrones biogeográficos mas conocidos y estudiados, remontándose a los trabajos de Darwin (1839, 1859) en los Andes centrales de Chile; Wallace (1876, 1878) en Indonesia; Merriam (1890); Whittaker (1960); Whittaker & Niering (1965) y Brown (1971) para Norte América, entre otros. Actualmente se conocen 5 patrones generales sobre la relación de la diversidad de especies con la elevación: 1) el número de especies disminuye monotónicamente con la elevación; 2) riqueza alta en la porción inferior del gradiente que se mantiene en forma de meseta, seguida por una disminución de la riqueza; 3) riqueza alta en elevaciones bajas con un máximo de diversidad encontrado en alturas intermedias; 4) pico de riqueza de especies en altura intermedia, es decir un pico unimodal de diversidad. 5) la riqueza de especies aumenta con la elevación (Martin, 1958; Wake et al., 1992; Grytnes et al., 2007; Novillo & Ojeda, 2012, Novillo & Ojeda, 2014). Algunas de las posibles explicaciones para estos patrones, establecen que los sitios de mayor diversidad se relacionan con regiones de condiciones ambientales óptimas, o bien pueden registrarse en zonas donde las especies se superponen, o en lugares donde comunidades de vegetación distintas se encuentran en estrecha proximidad (Lomolino, 2001).
Los factores causales de los patrones de diversidad pueden agruparse en 4 categorías: clima, espacio, historia evolutiva y procesos ecológicos (Pianka, 1966; Gaston, 2000; McCain, 2007). Las hipótesis climáticas se basan en la variación de variables abióticas como temperatura, precipitación y humedad, entre otras. Las hipótesis espaciales incluyen la relación especie-área clásica (SAR). Esta expone un aumento de riqueza a medida que aumenta el área (Rosenzweig, 1995). Y puede explicarse mediante dos mecanismos: 1) la probabilidad de extinción es menor en áreas mayores (MacArthur & Wilson, 1967), y 2) áreas mayores contienen mayor diversidad de ambientes, favoreciendo la coexistencia de un mayor número de especies (Simberloff, 1976). La historia evolutiva, se refleja en la variación de las tasas de especiación, extinción y edad de los clados. Y las hipótesis ecológicas incluyen, los efectos ecotonales, la competencia, la heterogeneidad y la complejidad del hábitat, entre otros. También es necesario remarcar que los patrones de diversidad y sus factores causales varían en función del tamaño de rango de distribución de las especies. En general, especies con rangos geográficos pequeños tienden a mostrar un patrón de riqueza diferente al de las especies con distribuciones más extendidas (Jetz et al., 2004).
Los estudios sobre gradientes de diversidad a lo largo de los Andes se han centrado principalmente en ambientes tropicales y húmedos (Patterson et al., 1998; Brehm & Fiedler, 2003; Kattan & Franco, 2004; Herzog et al., 2005, Ferro & Barquez, 2009; Ferro, 2013, etc), destacando la relación especie - energía (en un sentido amplio, teniendo en cuenta temperatura y productividad- Wright, 1983), y el equilibrio hídrico como principales determinantes de los gradientes de diversidad (Bini et al., 2004). Estudios similares sobre la porción árida de los Andes son relativamente escasos y la mayoría se refieren al desierto de altura de la Puna (Pearson & Pearson-Ralph, 1978; Marquet, 1994).
En este trabajo caracterizamos, por un lado, los patrones de diversidad de especies y endemismos de roedores en función de latitud, altitud y área en los Andes áridos centrales, tanto a nivel regional, entre los 8° y 42° S (Young et al., 2007; Sempere et al., 2008) como a nivel local (Provincia de Mendoza). Por otro lado, analizamos los factores topográficos, climáticos y espaciales involucrados en el modelado de estos patrones.
METODOLOGÍA
Para el análisis de los patrones de distribución de las especies de roedores andinos, a escala regional, se utilizaron 2 aproximaciones: 1) se analizaron los patrones de distribución para todas las especies presentes en la región de estudio propuesta (ensamble total); 2) se utilizaron solo las especies endémicas. Para la escala local se consideró el pool de especies registradas en muestreos de campo.
Escala regional
Área de estudio: El área de estudio propuesta como escala regional, se encuentra en el segmento central de los Andes (desde los 8°S hasta los 42° S) (Fig. 1A) y se denomina Andes Centrales Áridos (ACA). Presenta una extensión altitudinal desde los 800 hasta los 6000 msnm. Para generar una base de datos de ocurrencia de pequeños mamíferos pertenecientes a los ACA, se utilizaron las áreas de distribución confeccionadas en la base de datos Natureserver (Patterson et al., 2007), las cuales fueron ajustadas mediante bibliografía actualizada. Se utilizó literatura científica general y particular de la región de estudio (Pearson, 1982; Redford & Eisenberg, 1992; Marquet et al., 1998; Díaz & Barquez, 2002; Wilson & Reeder, 2005). Los rangos de distribución se utilizaron para confeccionar una matriz de presencia y ausencia por bandas latitudinales y altitudinales. El rango latitudinal se dividió en bandas de 2 grados y el altitudinal en bandas de 200 m (Hurlbert & Jetz, 2007). Se cuantificó el número de especies presentes en cada banda para examinar la relación entre el número de especies y la latitud-altitud. Se documentaron patrones de riqueza de especies a lo largo del gradiente usando modelos lineales generalizados. Cada modelo lineal generalizado se comparó utilizando el criterio de información de Akaike (AIC).

Fig. 1. A) Mapa de la ubicación geográfica de los Andes Centrales Áridos. B) Ubicación de la zona de estudio en los Andes centrales de Argentina, Provincia de Mendoza. Se registra el gradiente en elevación y las 4 transectas altitudinales. TU: transectaUspallata; TT: transectaTunuyán; TD: Transecta Laguna del Diamante; VH: transecta Valle Hermoso.
El área por banda altitudinal se calculó a partir de un modelo de elevación (Jarvis et al., 2008). Se realizó un proceso de reclasificado de este DEM en bandas de 200 m de altura y para cada banda se calculó el área mediante la herramienta “zonal statistics” de ArcGis 9.1. Para calcular el efecto del área a lo largo de los ACA, se realizaron regresiones lineales log-log entre la riqueza y el tamaño del área (latitudinal y altitudinal). Calculamos los valores de riqueza corregidos por el tamaño del área utilizando el método curvilíneo (c = S / Az, siendo c = estimación de la diversidad de área corregida, S = riqueza de especies, A = tamaño del área y z = factor constante. Se utilizó un valor z específico de taxón para pequeños mamíferos no voladores (z = 0,22) calculado por McCain (2007).
Escala local
El estudio se realizó en los Andes centrales de Argentina, ubicados entre los 30° S y 36° S en la provincia de Mendoza (Fig. 1B). El área localizada en las ecoregiones de los Altos Andes y Monte, se caracteriza por una vegetación que varía desde matorrales, en las estribaciones andinas (1300 m sobre el nivel del mar), hasta arbustos enanos, gramíneas y hierbas, en elevaciones más altas (3300 m sobre el nivel del mar) (Martínez Carretero & Méndez, 1992; Mendez et al., 2006).
Se establecieron 4 transectas de muestreo, ubicadas entre los 30° y 36° de latitud sur (TU, TT, TD, VH; Fig. 1b). Cada transecta presenta un rango altitudinal desde los 1300 a 3300 msnm. En cada una de ellas se seleccionaron 5 sitios de muestreo a distintas alturas (1300, 1800, 2300, 2800, 3300 msnm). En cada sitio se colocaron 150 trampas tipo Sherman de captura viva, abarcando la mayor cantidad de ambientes posibles. Cada sesión de trampeo consistió en 3 noches por sitio. Las trampas fueron cebadas con pasta de maní y avena arrollada. El estudio se desarrolló durante dos años consecutivos, relevando todas las transectas en dos oportunidades. El esfuerzo de muestreo total fue de 18000 noches trampa.
Para la caracterización de la estructura de los ensambles (riqueza, abundancia y equitatividad) utilizamos curvas de rango abundancia (Whittaker, 1972). En estas curvas las especies se grafican en secuencias/rangos desde las más
abundantes a las menos abundantes a lo largo del eje X. A su vez sobre este eje se puede observar el número de especies presentes en el ensamble, cuanto más extenso, mayor riqueza presenta el ensamble. Estas curvas, también nos dan información sobre que modelo de abundancia describe mejor nuestros datos. Las curvas muy empinadas representan ensambles con alta dominancia (distribuciones geométricas o series logarítmicas), mientras que curvas con menor pendiente (distribución “log normal” o en “vara quebrada”) dan cuenta de una mayor equitatividad (Magurran, 2004).
Para cuantificar la variación de riqueza de pequeños mamíferos a lo largo del gradiente altitudinal se utilizo el número de especies por banda altitudinal. La relación entre la riqueza y la elevación se evaluó utilizando modelos lineales generalizados y mediante análisis polinómico. El modelo de mejor ajuste se seleccionó utilizando el criterio de información de Akaike (AIC) y, para los modelos que presentaron diferencias AICmenores de 2, se consideró el criterio R2.
El efecto del clima y la topografía sobre la diversidad de pequeños mamíferos se evaluó utilizando modelos lineares generalizados mediante selección por diferencias de AICy criterio R2 (Crawley, 1993), utilizando el software SAM (“Spatial Analysis in Macroecology”, Rangel et al., 2010).
Para separar los efectos conjuntos e independientes de clima, topografía y espacio, se llevo a cabo un análisis de partición de la varianza. Este análisis se llevó a cabo mediante el uso de regresiones parciales (Legendre & Legendre, 1998, Lobo et al., 2002, Hortal et al., 2008). Utilizamos la ecuación polinomial de tercer grado (análisis de superficies de tendencias – Legendre & Legendre, 1998) como un proxy para los descriptores espaciales. Estos análisis se realizaron en el software R, versión 2.15.2 (RDevelopment Core Team 2012).
RESULTADOS
Escala regional
A lo largo de los ACA se registra un total de sesenta y siete especies de pequeños mamíferos no voladores, pertenecientes a 7 familias y 26 géneros (Apéndice 1). Treinta y tres (49%) son endémicas del área de estudio propuesta.
La riqueza de especies a lo largo del gradiente latitudinal mostró un patrón bimodal (Fig. 2A), un pico de riqueza se registró a 18° S con 34 especies y un segundo pico de 25 especies ocurrió a los 36° S. Se encontró el mismo patrón bimodal para especies endémicas, mostrando menos especies en altas latitudes. El patrón altitudinal de riqueza mostró un pico entre los 3000 y 3500 msnm. Las especies totales presentaron una forma de joroba no simétrica, con una riqueza de especies decreciente en altas elevaciones. Por otra parte, las especies endémicas presentaron una forma simétrica con una disminución en la riqueza de especies hacia ambos extremos del gradiente (Fig. 2B).

Fig. 2. A) patrón latitudinal de variación de la riqueza de especies. B) patrón altitudinal de variación de la riqueza de especies. C) Distribución de la riqueza y el área a lo largo del gradiente latitudinal.D) Distribución de la riqueza y el área a lo largo del gradiente altitudinal. E) Relación Log–log entre riqueza de especies y área por banda latitudinal. F) Relación Log–log entre riqueza de especies y área por banda altitudinal. G) Relación entre la riqueza corregida por área (c) y la latitud. H) Relación entre la riqueza corregida por área (c) y la altitud. Círculos negros: todas las especies. Cuadrados blancos: especies endémicas. Triángulos negros: área.
El tamaño del área varía a lo largo de ambos gradientes. A los 30° S, se detectó una fuerte disminución en el tamaño de área, que coincidió con una disminución en la riqueza de especies para ambos conjuntos de datos (especies totales y endémicas, Fig. 2C). El tamaño de área para las bandas latitudinales representó el 25% de la variación de la riqueza para las especies totales (R2 = 0,25; p = 0,04) y el 70% para las especies endémicas (R2 = 0,70; p <0,001) (Fig. 2E).
Cuando se utilizo la estimación de riqueza corregida por el área (c = SAz) la relación con la latitud fue positiva para las especies totales (R2 = 0,35; p = 0,014) y ninguna tendencia significativa para las especies endémicas (R2 = 0,06; p = 0,3) (Fig. 2G).
A lo largo del gradiente altitudinal el tamaño del área presentó sus valores máximos en alturas intermedias (3000-4500 m) (Fig. 2D). La relación entre la riqueza y el área representó el 90% de la variación del gradiente altitudinal para el conjunto de especies totales (R2 = 0,91; p <0,001) y el 20% para el conjunto endémico (R2 = 0,20; p = 0,01) (Fig. 2F). Cuando la riqueza de especies se ajustó por tamaño de área, no hubo relación significativa a lo largo del gradiente altitudinal para el grupo de especies total (R2 = 0,06; p = 0,18). Mientras que para las especies endémicas la relación fue positiva y significativa, representando el 57% de la variación de riqueza con altitud (R2 = 0,57; p <0,001) (Fig. 2H). Los polinomios de tercer orden fueron considerados los mejores modelos para explicar los gradientes latitudinales y de elevación (Tabla 1).
Tabla 1. Relación entre la riqueza corregida por área (c) y la latitud y altitud.

Escala local
A escala local cuantificamos 9 géneros y 14 especies de roedores sigmodontinos (Abrothrix olivacea, Abrothrix andina, Akodon spegazzinii, Akodon dolores, Phyllotis xanthopygus, Calomys musculinus, Chelemys macronyx, Euneomys chinchilloides, Euneomys mordax, Graomys griseoflavus, Loxodontomys micropus, Eligmodontia moreni, Eligmodontia morgani y Phyllotis sp). Se capturó un total de 1833 individuos con un éxito de captura total del 10%; el mayor éxito de captura (16% a 29%) se registró en alturas intermedias (entre 1800 y 2300 msnm).
Cada transecta altitudinal presentó diferentes patrones comunitarios, en cuanto a la composición de especies, riqueza y equitatividad de los ensambles. A lo largo de la transecta Las Leñas - Valle Hermoso (VH) (35° S) se registraron 10 especies de pequeños mamíferos (Fig. 3A). Las bandas altitudinales inferiores (1300 – 1800 msnm) mostraron menos especies que las más altas (2300 - 2800 - 3300 msnm). Por otro lado, las bandas más bajas presentaron mayor equitatividad que las más altas. La dominancia de las especies también varió con la altitud; E. morgani se registró como especie dominante a 1300 (msnm), mientras que A. olivacea dominó entre 1800 y 2300 (msnm); C. macronyx lo es a 2800 (msnm) y E. chinchilloides a 3300 (msnm).
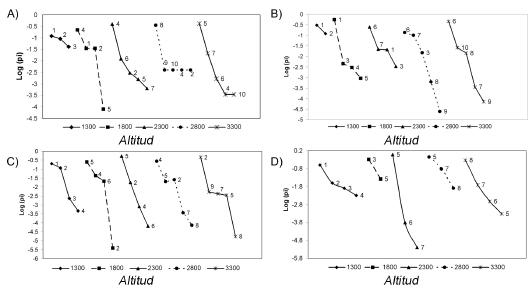
Fig. 3. Curvas rango abundancia para cada transecta altitudinal. A) Transecta Las Leñas-Valle Hermoso (VH); B) Transecta Laguna del Diamante (TD); C) TransectaTunuyán (TT); D) TransectaUspallata (TU). 1) E. morgani, 2) P. xanthopygus, 3) Phyllotissp, 4) A.olivacea, 5) E. chinchilloides, 6) L. micropus, 7) A. andina, 8) C. macronyx, 9) Akodon spegazzinii, 10) E. mordax, 11) G. griseoflavus; 12) E. moreni; 13) C. musculinus; 14) A. dolores. Log (pi)= species relative abundace.
A lo largo de la transecta de Laguna del Diamante (TD) se registraron 10 especies que pertenecen a 7 géneros (Fig. 3B). La mayor riqueza correspondió con los sitios más elevados 2800 - 3300 (msnm). La dominancia de las especies también varió con la altitud; E. morgani fue dominante en sitios entre 1300 - 1800 (msnm), mientras que A. olivacea fue dominante en los sitios entre 2300 - 3300 (msnm).
La transecta de Tunuyán (TT) exhibió 9 especies de 7 géneros. La mayor riqueza y equitatividad de especies se registró entre los 2800 y 3300 msnm (Fig. 3C). En esta transecta, las especies dominantes difirieron para cada banda altitudinal (E. moreni a 1300 msnm, P. xanthopygus a 1800 y 2300 msnm, A. spegazzinii a 2800 msnm y A. andina a 3300 msnm).
En la transecta Uspallata (TU) se registraron 8 especies y 7 géneros. Los sitios intermedios registraron valores de riqueza más bajos, mientras que los 1300 (msnm) y los 3300 (msnm) registraron mayor riqueza y equitatividad (Fig. 3D). Los sitios más bajos fueron dominados por C. musculinus 1300 (msnm) y E. moreni 1800 (msnm). P. xanthophygus fue la especie dominante en las bandas intermedias 2300 y 2800 (msnm); y la banda altitudinal más alta 3300 (msnm) presentó a E. chinchilloides como especie dominante.
La riqueza de especies de pequeños mamíferos mostró una relación monotónica positiva con la elevación (29,19% de varianza explicada) (Fig. 4A). Mientras que el patrón de abundancia evidenció una relación unimodal, con la mayor abundancia en alturas intermedias (55,95% de varianza explicada) (Fig. 4B).

Fig. 4. A) Relación entre riqueza de especies a escala local y altitud. B) Relación entre la abundancia relativa y la altitud.
Varios predictores explicaron el patrón de elevación observado para la riqueza de especies (Tabla 2). La riqueza de especies se asoció positivamente con la precipitación media anual y la heterogeneidad topográfica, y se asoció negativamente con temperatura mínima, disminuyendo a medida que la temperatura aumentaba (Fig. 5A).

Fig. 5: A) Determinantes climáticos y topográficos de la riqueza de pequeños mamíferos a lo largo del gradiente altitudinal de los ACA (PMA: precipitación media anual; TMMF: temperatura mínima del mes más frio. B) Diagrama de partición de la varianza de la riqueza, en función del conjunto climático, el conjunto topográfico y el conjunto espacial de variables predictoras. T(topografía), C(clima), S (espacio), U(varianza no explicada por el modelo).
Tabla 2. Efectos climáticos y topográficos sobre la riqueza de especies. Selección de modelos basados en diferencias de AICy en criterio R2.

La partición de la varianza muestra que las variables seleccionadas explican un 84% de la variación de la riqueza. El efecto puro de cada subconjunto de predictores (clima y topografía) fue similar y moderado (8,4% y 13%, respectivamente). Mientras que el efecto del espacio representó el 7,4% de la variación de la riqueza. El efecto conjunto del clima y topografía explican un 35% de la variación de la riqueza, mientras que el efecto puro de la topografía explicó un 13%. El efecto combinado del clima y el espacio representó el 12% de la variación de la riqueza total (Fig. 5B).
DISCUSIÓN
Más del 50% de los pequeños mamíferos de los Andes Áridos Centrales de Sudamérica son endémicos. Este alto grado de endemismo apoya observaciones anteriores sobre el rol determinante de la formación de ambientes áridos a grandes alturas producidos por el levantamiento de los Andes, en los procesos cladogénicos de los pequeños mamíferos Sudamericanos (Reig, 1981; Pearson, 1982; Marquet, 1994). La singularidad de la biota andina se atribuye a las elevadas tasas de especiación promovidas por condiciones ambientales particulares: ambientes topográficamente complejos, bandas altitudinales homeotérmicas angostas o pequeñas, y una distribución discontinua o en parches del hábitat (Rahbek & Graves, 2000).
La forma bimodal del patrón latitudinal de riqueza, con sus dos picos a los 18° S y 34 – 35° S, y la marcada disminución de la riqueza a los 30° S, constituyen un área de divergencia biogeográfica. Una posible explicación de la disminución en la riqueza a los 30° S, está dada por la reducción de área Andina desde los 20° S en dirección sur, y la presencia de los picos montañosos más elevados de la cordillera, que pudieron actuar como barreras efectivas para varios taxa (Lanzone, 2009). Esta disminución en el área se ve acompañada por una marcada disminución en la elevación de la cordillera hacia latitudes mayores a los 33° S, favoreciendo de este modo la colonización de especies de procedencia patagónica.
La fuerte correlación positiva entre la riqueza de especies endémicas y la elevación de los Andes centrales áridos, contradice el patrón general de disminución de riqueza a mayor altura (Stevens, 1992; Rosenzweig, 1995; Gaston & Blackburn, 2000). Este resultado concuerda con lo observado en un estudio a menor escala, en el bioma de la Puna (Marquet, 1994), y refuerza el rol de los Andes en el proceso cladogenético de los roedores Sudamericanos (Reig, 1981; Leite et al., 2014).
A escala local el patrón altitudinal de riqueza es coincidente con el patrón reportado para las especies endémicas a escala regional. Este aumento de riqueza en función de la altitud, es poco frecuente, ya que en la mayoría de los estudios sobre gradientes de diversidad en roedores se menciona al patrón unimodal como generalidad (Heaney, 2001; Rahbek, 2005; McCain, 2005, McCain & Grytnes, 2010). Los escasos trabajos que reportan una mayor riqueza en zonas altas, pertenecen a zonas áridas de los Andes (Pearson & Ralph, 1978; Marquet, 1994; Patterson et al., 1989, 1998; Ruggiero & Kitzberger, 2004). La relación entre altura y riqueza de especies varía según el tipo de ambiente, las características climáticas de los gradientes y la historia evolutiva de la especies que componen los ensambles. De este modo, la riqueza de especies es elevada en zonas de mayor altura en la cordillera árida, mientras que en general se registra un patrón unimodal en las zonas tropicales.
La interacción entre clima y topografía se registra como mejor predictor para el patrón de riqueza de especies de pequeños mamíferos andinos. Se cree que la variación climática asociada con la heterogeneidad topográfica genera aislamiento geográfico local, lo que puede promover la especiación a través de la alopatría (Ruggiero & Hawkins, 2008). La productividad medida como la precipitación media anual, es uno de los factores que explican el patrón de riqueza de roedores andinos. La hipótesis de productividad plantea que la energía (productividad primaria) limita la diversidad mediante la regulación de las cascadas tróficas. La productividad representa la cantidad de recursos disponible para los consumidores, por lo tanto, zonas de mayor productividad, permitirán la coexistencia de un mayor número de especies (MacArthur, 1972; Terborgh, 1977, Wright 1983, Turner et al., 1987). Además, cuando los factores climáticos se ven modulados o relacionados con cambios en la elevación y relieve, estos pueden generar condiciones climáticas locales (microclimas), pueden afectar el área del hábitat disponible (microhabitats) y la conectividad entre estos hábitats (Badgley, 2010), promoviendo una mayor disponibilidad de nichos y de recursos.
La hipótesis de energía ambiente (temperatura), predice que una mayor temperatura permitirá que los organismos inviertan menor cantidad de energía (ej. tiempo y esfuerzo) en termorregulación, favoreciendo de esta manera el procesos de reproducción. Esto permitirá mayores tamaños poblacionales y menor riesgo de extinción, promoviendo una mayor riqueza de especies (Turner et al., 1987). Sin embargo nuestros resultados no se ajustan a esta hipótesis. Estos resultados podrían estar relacionados con la historia térmica de las especies andinas (Nespolo & Rosenmann, 1997) y con la historia evolutiva de los taxa relacionada a climas fríos o templados (Nespolo et al., 1999; Steppan et al., 2007). Además, estudios fisiológicos en algunas especies andinas (ej. P. xanthopygus) muestran que mayores temperaturas podrían ser una limitante en la distribución de la especie, ya que no cuenta con la plasticidad en las repuestas fisiológicas y comportamentales para hacer frente a temperaturas elevadas, disminuyendo de esta manera su fitness (Sassi & Novillo, 2015; Sassi et al., 2015).
A modo de síntesis, podemos destacar que los Andes áridos se caracterizan por un elevado número de especies endémicas, las cuales se ajustan a un patrón altitudinal positivo, con una fuerte relación especies – área. A escala local, se registra un aumento de riqueza a medida que aumenta la altura y una mayor abundancia en alturas intermedias. Los factores causales del patrón de diversidad son principalmente el clima y la topografía, cuyo efecto conjunto explican un 35% de la variabilidad de la riqueza.
La relación inversa entre temperatura y riqueza es un hecho de marcado interés, ya que los escenarios del cambio climático pronostican aumentos de 2–4° Cen la temperatura para la región andina (Labraga & Villalba, 2009), y esto tendría un impacto directo en la biodiversidad de la región.
AGRADECIMIENTOS
Agradecemos a Guillermo Cassini y Pablo Teta, por la invitación a participar de este volumen especial en homenaje al Dr. José Yepes; a A. Ojeda, V. Chillo, P. Cuello, R. Ovejero, Fernanda Cuevas y varios asistentes por su ayuda en el trabajo de campo. También agradecemos a P. Sassi, V. Chillo, M. E. Mosca, R. Carrara por las sugerencias útiles en distintas versiones de este manuscrito. A los revisores I. Ferro y P. Jayat por los comentarios que mejoraron la calidad del mismo. Este estudio fue financiado parcialmente a través de las subvenciones SECYT (PICT AGENCIA11768; 0455) y CONICET (PIP CONICET 5944; 325), Argentina e IDEA WILD founding.
BIBLIOGRAFIA
1. Badgley, C. & D.L. Fox. 2000. Ecological biogeography of North American mammals: species density and ecological structure in relation to environmental gradients. Journal of Biogeography 27: 1437-1467. [ Links ]
2. Badgley, C. 2010. Tectonics, topography, and mammalian diversity. Ecography 33: 220-231. [ Links ]
3. Bini, L.M., J.A.F. Diniz-Filho & B.A. Hawkins. 2004. Macroecological explanations for differences in species richness gradients: a canonical analysis of South American birds. Journal of Biogeography 31: 1819-1827. [ Links ]
4. Brehm, G. & K. Fiedler. 2003. Faunal composition of geometrid moths changes with altitude in an Andean montane rain forest. Journal of Biogeography 30: 431-440. [ Links ]
5. Brown, J.H. 1971. Mammals on mountaintops: nonequilibrium insular biogeography. The American Naturalist 105(945), p.467. [ Links ]
6. Brown, J.H. 2001. Mammals on mountainsides: elevational patterns of diversity. Global Ecology & Biogeography 10: 101-109. [ Links ]
7. Brumfield, R.T. & S.V. Edwards. 2007. Evolution into and out of the Andes: a Bayesian analysis of historical diversification in Thamnophilusantshrikes. Evolution 61: 346-367. [ Links ]
8. Crawley, M.J. 1993. GLIM for ecologists. Blackwell Science Ltd., Oxford, United Kingdom, 392 pp. [ Links ]
9. Currie, D.J., G.G. Mittelbach, H.V. Cornell, R. Field, J.F.Guegan, B.A. Hawkins, D.M. Kaufman, J.T. Kerr, T. Oberdorff, E. O’Brien & J.R.G. Turner. 2004. Predictions and tests of climate-based hypotheses of broad- scale variation in taxonomic richness. Ecology Letters 7: 1121-1134.
10. Darwin, C. 1839. Journal of the researches into the geology and natural history of various countries visited by the H.M.S. Beagle, under the command of Captain Fitzroy, R.N. from 1832 to 1836. Henry Colburn, London. [ Links ]
11. Darwin, C. 1859. On the origin of species by means of natural selection or the preservation of favoured races in the struggle for life. John Murray, London. [ Links ]
12. Diaz, M.M. & R.M. Barquez. 2002. Los mamíferos de Jujuy, Argentina. LOLA, Buenos Aires, 326 pp. [ Links ]
13. Ferro, L.I. & R.M. Barquez. 2009. Species richness of nonvolant small mammals along elevational gradients in Northwestern Argentina. Biotropica 41(6): 759-767. [ Links ]
14. Ferro, L.I. 2013. Rodent endemism, turnover and biogeographical transitions on elevation gradients in the northwestern Argentinian Andes. Mammalian Biology 78(5) 322-331. [ Links ]
15. García, S. 2018. La trayectoria del zoólogo José Yepes: Colecciones, viajes y zoogeografía en las décadas de 1930 y 1940. Revista del Museo Argentino de Ciencias Naturales, Nueva Serie. 20: 71-81. Doi: 10.22179/REVMACN.20.579 [ Links ]
16. Gaston, K.J. & T.M. Blackburn. 2000. Pattern and Process in Macroecology. Blackwell Science, Oxford, 377 pp. [ Links ]
17. Gaston, K.J. 2000. Global patterns in biodiversity. Nature 405: 220-227. [ Links ]
18. Grytnes, J.A. & C.M. McCain. 2007. Elevational patterns in species richness. En S. Levin (ed.), Encyclopedia of Biodiversity, pp. 1-8, Elsevier, Inc. [ Links ]
19. Heaney, L.R. 2001. Small mammal diversity along elevational gradients in the Philippines: an assessment of patterns and hypotheses. Global Ecology and Biogeography 10: 15-39. [ Links ]
20. Hershkovitz, P. 1969. The evolution of mammals on South Continents: VI. The recent mammals of the Neotropical region: a zoogeographic and ecological review. The Quarterly Review of Biology 44: 1-70. [ Links ]
21. Herzog, S.K., M. Kessler & K. Bach. 2005. The elevational gradient in Andean bird species richness at the local scale: a foothill peak and a high-elevation plateau. Ecography 28: 209-222. [ Links ]
22. Hortal, J., J. Rodríguez, M. Nieto-Díaz & J.M. Lobo. 2008. Regional and environmental effects on the species richness of mammal assemblages. Journal of Biogeography 35: 1202-1214. [ Links ]
23. Hurlbert, A.H. & W. Jetz. 2007. Species richness, hotspots, and the scale dependence of range maps in ecology and conservation. Proceedings of the National Academy of Sciences USA 104; 13384-13389. [ Links ]
24. Jarvis, A., H.I. Reuter, A. Nelson & E. Guevara. 2008. Hole-filled SRTM for the globe Version 4, available from the CGIAR-CSI SRTM 90m Database (http://srtm.csi.cgiar.org). [ Links ]
25. Jetz, W., C. Rahbek & R.K. Colwell. 2004. The coincidence of rarity and richness and the potential signature of history in centres of endemism. Ecology Letters 7: 1180-1191. [ Links ]
26. Kattan, G.H. & P. Franco. 2004. Bird diversity along elevational gradients in the Andes of Colombia: area and mass effects. Global Ecology and Biogeography 13: 451-458. [ Links ]
27. Körner, C. 2000. Why are there global gradients in species richness? Mountains might hold the answer. TREE 15(12): 513 [ Links ]
28. Labraga, J.C. & R. Villalba. 2009. Climate in the Monte Desert: past trends, present conditions, and future projections. Journal of Arid Environment 73: 154-163. [ Links ]
29. Lahille, F. 1898. Ensayo sobre la distribución geográfica de los mamíferos en la República Argentina. Primera Reunión del Congreso Científico Latino Americano 1898, 3: 165-206 + 1 mapa. [ Links ]
30. Lanzone, C. 2009. Sistemática y evolución del genero Eligmodontia. Tesis Doctoral. Universidad Nacional de Cordoba. [ Links ]
31. Legendre, P. & L. Legendre. 1998. Numerical ecology. Elsevier, Amsterdam, Netherlands, XX pp. [ Links ]
32. Leite, R.N., S.O. Kolokotronis, F.C. Almeida, F.P. Werneck, D.C. Rogers & M. Weksler. 2014. In the wake of invasion: Tracing the historical biogeography of the South American cricetid radiation (Rodentia, Sigmodontinae). PloS One 9 (6): e100687. [ Links ]
33. Lobo, J.M., Lumaret, J.P & Jay-Robert, P. 2002. Modelling the species richness distribution of French dung beetles (Coleoptera, Scarabaeidae) and delimiting the predictive capacity of different groups of explanatory variables. Global Ecology and Biogeography 11: 265-277. [ Links ]
34. Lomolino, M.V. 2001. Elevational gradients of species-density: historical and prospective views. Global Ecology and Biogeography 10: 3-13. [ Links ]
35. MacArthur, R. H. & E. O. Wilson. 1967. The theory of island biogeography. Monographs on Population Biology, No. 1. Princeton University Press. [ Links ]
36. MacArthur, R.H. 1972. Geographical Ecology: Patterns in the distribution of species. Harper and Row. New York, NY. 269 pp [ Links ]
37. Magurran, A. E. 2004. Measuring Biological Diversity. Blackwell, Oxford. [ Links ]
38. Mares, M.A. & R.A. Ojeda. 1982. Patterns of diversity and adaptations in South American hystricognath rodents. In: Mares, M.A., Genoways, H.H. (Eds.), Mammalian Biology in South America, pp. 393-432. Special Publ. Ser., vol. 6, Pymatuning Laboratory of Ecology, Univ. of Pittsburg, pp. 1-539. [ Links ]
39. Marquet, P.A., Bozinovic, F., Bradshaw, G.A., Cornelius, C.C., González, H., Gutierrez, J.R., Hajek, E.R., Lagos, J.A., López-Cortés, F., Nuñez, L., Rosello, E., Santoro, C., Samaniego, H., Standen, V.G., Torres-Mura, J.C. & Jaksic, F.M. 1998. Los ecosistemas del Desierto de Atacama y area Andina adjacente. Revista Chilena de Historia Natural 71: 593-617. [ Links ]
40. Marquet, P.A. 1994. Small mammals in the Atacama Desert and in the adjacent Andean area: biogeography and community structure. Australian Journal of Zoology 42: 527-542. [ Links ]
41. Marshall, L.G. 1979. A model for paleobiogeography of South American Cricetine rodents. Paleobiology 5: 126-132. [ Links ]
42. Martin, P.S. 1958. A biogeography of reptiles and amphibians in the Gomez Farias region. Tamaulipas, Mexico. Miscellaneous Publications of the Museum of Zoology, University of Michigan 101: 1-102. [ Links ]
43. Martinez Carretero, E. & Mendez, E. 1992. La vegetación de la vertiente oriental de la Cordillera Real, Mendoza—Argentina. Multiquina 1: 99-106. McCain (2007).
44. McCain, C. M. 2005. Elevational gradients in diversity of small mammals. Ecology Letters 86: 366-72. [ Links ]
45. McCain C. 2007. Area and mammalian elevational diversity. Ecology 88: 76-86. [ Links ]
46. McCain, C. M. & J.A. Grytnes 2010. Elevational Gradients in Species Richness. eLS. [ Links ]
47. Mendez, E., Martinez Carretero, E. & I. Peralta. 2006. La vegetacion del Parque Provincial Aconcagua (Altos Andes centrales de Mendoza, Argentina). Boletín de la Sociedad Argentina de Botanica 41: 41-69. [ Links ]
48. Merriam, C.H. 1890. Results of a biological survey of the San Francisco Mountain region and the desert of the Little Colorado, Arizona. North American Fauna 3: 1-136. [ Links ]
49. Nespolo, R.F. & M. Rosenmann. 1997. Historia térmica de roedores chilenos: una aproximación experimental. Revista Chilena de Historia Natural 70: 363-370. [ Links ]
50. Nespolo, R.F., Opazo, J., Rosenmann, M. & F. Bozinovic. 1999. Thermal acclimation, maximum metabolic rate and nonshivering thermogenesis in Phyllotis xanthopygus (Rodentia) inhabiting the Andean range. Journal of Mammalogy 80: 742-748. [ Links ]
51. Novillo, A. & R.A. Ojeda. 2012. Diversity and distribution of small mammals in the South American dry Andes. Austral Ecology 37: 758-766. [ Links ]
52. Novillo, A. & Ojeda, R. 2014: Elevation patterns in rodent diversity in the dry Andes: disentangling the role of environmental factors. Journal of Mammalogy 95: 99-107. [ Links ]
53. Palma R. E., Marquet P. A. & Boric-Bargetto D. 2005. Inter- and intraspecific phylogeography of small mammals in the Atacama Desert and adjacent areas of northern Chile. Journal of Biogeography 32: 1931-1941. [ Links ]
54. Patterson, B.D. & Pascual, R. 1972. The fossil mammal fauna of South America. En A. Keast, F.C. Erk & B. Glass (eds). Evolution, mammals, and southern continents, pp. 247-309. State University of New York Press. [ Links ]
55. Patterson, B.D. & Costa, L.P. 2012. Introduction to the history and geography of Neotropical mammals. En B.D. Patterson & L.P. Costa (eds). Bones, Clones and Biomes. The History and Geography of Recent Neotropical Mammals, pp. 1-50. The University of Chicago Press. [ Links ]
56. Patterson, B.D., Meserve, P.L. & Lang, B.K. 1989. Distribution and abundance of small mammals along an elevation transect in temperate rainforests of Chile. Journal of Mammalogy 70: 67-78. [ Links ]
57. Patterson, B.D., Stotz, D.F., Solari, S., Fitzpatrick, J.W. & Pacheco, V. 1998. Contrasting patterns of elevational zonation for birds and mammals in the Andes of southeastern Peru. Journal of Biogeography 25: 593-607. [ Links ]
58. Patterson, B.D., Ceballos G., Sechrest W. et al. 2007. Digital Distribution Maps of the Mammals of theWestern Hemisphere, Version 3. NatureServe, Arlington. [ Links ]
59. Pearson, O. P. & Pearson-Ralph C. 1978. The diversity and abundance of vertebrates along an altitudinal gradient in Peru. Memorias del Museo de Historia Natural “Javier Prado” (Perú) 18: 1-97.
60. Pearson, O. 1982. Distribución de pequeños mamíferos en el altiplano y los desiertos del Perú. Zoología neotropical. En P. Salinas (ed.) Actas del VIII Congreso Latinoamericano de Zoología, pp. 263-84. Mérida, Venezuela. [ Links ]
61. Pianka, E. R. 1966. Latitudinal gradients in species diversity: a review of concepts. American Naturalist 100: 33-46. [ Links ]
62. R Development Core Team, 2012. R: A language and environment for statistical computing, software. RFoundation for Statistical Computing, Vienna. https://www.R-project.org/ [ Links ]
63. Rahbek C. & Graves G. R. 2000. Detection of macro-ecological patterns in South American hummingbirds is affected by spatial scale. Proceedings of the Royal Society of London. Series B, Biological sciences 267: 2259-2265. [ Links ]
64. Rahbek, C. 1995. The elevational gradient of species richness: a uniform pattern. Ecography 18: 200-5. [ Links ]
65. Rahbek, C. 1997. The relationship among area, elevation, and regional species richness in Neotropical birds. The American Naturalist 149: 875-902. [ Links ]
66. Rahbek, C. 2005. The role of spatial scale and the perception of large-scale species-richness patterns. Ecology Letters 8: 224-239. [ Links ]
67. Rangel, T.F.L., Diniz-Filho, F.J. & Bini. L.M. 2010. SAM: a comprehensive application for Spatial Analysis in Macroecology. Ecography 33: 46-50. [ Links ]
68. Redford, K. H. & Eisenberg J. F. 1992. Mammals of the Neotropics: The Southern Cone. University of Chicago Press, Chicago. [ Links ]
69. Reig, O. A. 1981. Teoría del origen y desarrollo de la fauna de América del Sur. Monografiae Naturae 1, 1-162. Museo Municipal de Ciencias Naturales Lorenzo Scaglia, Mar del Plata, Argentina. [ Links ]
70. Reig, O. A. 1986. Diversity patterns and differentiation of Andean rodents. En F. Viulleumier & M. Monasterio (eds). High Altitude Tropical Biogeography, pp. 405-439. Oxford University Press, New York. [ Links ]
71. Rosenzweig, M. L. 1995. Species Diversity in Space and Time. Cambridge University Press, Cambridge. [ Links ]
72. Ruggiero, A. & Hawkins, B.A. 2008. Why do mountains support so many species of birds? Ecography 31: 306-315. [ Links ]
73. Ruggiero, A. & Kitzberger, T. 2004. Environmental correlates of mammal species richness in South America: effects of spatial structure, taxonomy and geographic range. Ecography 27: 401-416. [ Links ]
74. Ruggiero, A., Lawton, J.H. & Blackburn, T.M. 1998. The geographic ranges of mammalian species in South America: spatial patterns in environmental resistance and anisotropy. Journal of Biogeography 25: 1093-1103. [ Links ]
75. Ruggiero, A. 1994. Latitudinal correlates of the sizes of mammalian geographical ranges in South America. Journal of Biogeography 21(5): 545-559. [ Links ]
76. Sassi, P.L. & A. Novillo. 2015. Acclimating to thermal changes: intraspecific variation by a small mammal from the Andes Mountains. Mammalian Biology 80: 81-86. [ Links ]
77. Sassi, P.L., Taraborelli, P., Albanese, S. and Gutierrez, A. 2015. Effect of Temperature on Activity Patterns in a Small Andean Rodent: Behavioral Plasticity and Intraspecific Variation. Ethology 121: 840-849. doi:10.1111/eth.12398 [ Links ]
78. Sempere T., Folguera A. & M. Gerbault. 2008. New insights into Andean evolution: an introduction to contributions from the 6th ISAG symposium (Barcelona, 2005). Tectono- physics 459: 1-13. [ Links ]
79. Simberloff, D.S. 1976. Experimental zoogeography of islands: effects of island size. Ecology 57: 629-648. [ Links ]
80. Simpson, G.G.1964.Species density of North American Recent mammals. Systematic Zoology 13: 57-73. [ Links ]
81. Steppan, S.J., Ramirez, O., Banbury, J., Huchon, D., Pacheco, V., Walker, L.I. & Spotorno, A.E., 2007. A molecular reappraisal of the systematics of the leaf-eared mice Phyllotis and their relatives. In: Kelt, D.A., Lessa, E.P., Salazar-Bravo, J., Patton, J.L. (eds.), pp. 799-826. The Quintessential Naturalist: Honoring The Life and Legacy Of Oliver Earson. UCPublications in Zoology, University of California Press, California. [ Links ]
82. Stevens, G.C. 1992. The elevational gradient in altitudinal range, an extension of Rapoport’s latitudinal rule to altitude. The American Naturalist 140: 893 - 911.
83. Terborgh J. 1977. Bird species diversity on an Andean elevational gradient. Ecology 58: 1007-1019. [ Links ]
84. Turner, J. R. G., Gatehouse, C. M. & Corey, C. A. 1987. Does solar energy control organic diversity? Butterflies, moths and the British climate. Oikos 48: 195-205. [ Links ]
85. Wake, D.B, Papenfuss, T.J. & Lynch, J.F. 1992. Distribution of salamanders along elevational transects in Mexico and Guatamala. Tulane Studies in Zoology & Botany 1: 303-319. [ Links ]
86. Wallace, A.R. 1876. The geographical distribution of animals, 2 volumes. Macmillan, London. [ Links ]
87. Wallace, A.R. 1878. Tropical nature and other essays. Macmillan, New York. [ Links ]
88. Whittaker, R.H. 1960. Vegetation of the Siskiyou mountains, Oregon and California. Ecological Monographs 30: 279-338. [ Links ]
89. Whittaker, R. H. & Niering, W. A., 1965. Vegetation of the Santa Catalina Mountains, Arizona: A gradient analysis of the south slope. Ecology 46: 429-52. [ Links ]
90. Whittaker, R.H. 1972. Evolution and measurement of species diversity. Taxon 21: 213-251. [ Links ]
91. Wilson, D.E. & Reeder, D.M. 2005. Mammal species of the world: a taxonomic and geographic reference, 3rd edn. Baltimore, MD: John Hopkins University Press. [ Links ]
92. Willig, M. R. & C. P. Bloch. 2006. Latitudinal gradients of species richness: a test of the geographic areas hypothesis at two ecological scales. Oikos 112: 163-173. [ Links ]
93. Willig, M. R., & Presley, S. J. 2013. Latitudinal Gradients of Biodiversity Theory and Empirical Patterns. En: D. A. Della Sala, & M. I. Goldstein (eds), p. 13-19. The encyclopedia of the Antropocene, vol 3, Elsevier, Oxford. [ Links ]
94. Willig, M.R., Kaufmann, D.M. & Stevens, R.D. 2003. Latitudinal gradients of biodiversity: pattern, process, scale and synthesis. Annual review of ecology and systematics 34: 273-309. [ Links ]
95. Wright D. H. 1983. Species-energy theory: an extension of species-area theory. Oikos 41: 496-506. [ Links ]
96. Yepes, J. 1930. Los roedores octodontinos con distribución en la zona cordillerana de Chile y Argentina. Revista Chilena de Historia Natural, 34: 321-331. [ Links ]
97. Yepes, J. 1937. Los mamíferos de Mendoza y sus relaciones con las faunas limítrofes. Novena Reunión. Soc. Arg. Patol. Reg. 31: 669-725. [ Links ]
98. Yepes J. 1938. La fisiografía regional y la distribución geográfica de algunos de nuestros mamíferos. Revista del Centro de Estudiantes del Doctorado Ciencias Naturales II 4: 29-52. [ Links ]
99. Yepes, J. 1941. Tipos de distribución en la Zoogeografía argentina. Revista Argentina Zoogeografía 1(1): 39-58. [ Links ]
100. Young, K.R., León, B., Jorgensen, P. M. & C. Ulloa Ulloa. 2007. Tropical and subtropical landscapes of the Andes Mountains. En T. T. Veblen, K. R. Young & A. R. Orme (eds), The Physical Geography of South America pp. 200-16. Oxford University Press, Oxford [ Links ]
Recibido: 17-X-2017
Aceptado: 23-V-2018














