Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista del Museo Argentino de Ciencias Naturales
On-line version ISSN 1853-0400
Rev. Mus. Argent. Cienc. Nat. vol.21 no.1 Ciudad Autónoma de Buenos Aires June 2019
ECOLOGÍA
Resistencia biótica vs resistencia abiótica: el caso de las arañas urbanas en Chile
Andrés Taucare-Ríos1,2 & Antonio D. Brescovit3
1 Facultad de Ciencias, Universidad Arturo Prat, Casilla 121, Iquique, Chile. E-mail: antaucar@unap.cl
2 Centro de Investigación en Medio Ambiente (CENIMA), Universidad Arturo Prat.
3 Laboratório Especial de Coleções Zoológicas, Instituto Butantan, São Paulo, Brazil. E-mail: antonio.brescovit@butantan.gov.br
Doi: 10.22179/REVMACN.21.622
Resumen
Las invasiones biológicas son una de las mayores amenazas para la biodiversidad. Muchas hipótesis se han generado para explicar porque algunas especies pueden naturalizarse en áreas invadidas. Una de las mejores conocidas es la hipótesis de resistencia biótica, la cual describe la capacidad de las comunidades para repeler a los invasores; sin embargo, ha sido pobremente estudiado en ambientes urbanos. En este estudio, no se encontró un efecto de la comunidad nativa sobre la riqueza de especies exóticas, pero si existe un efecto negativo relacionado con el clima. En conclusión, se puede señalar que es la resistencia abiótica la que está condicionando la naturalización de las especies exóticas en ambientes urbanos, mientras que las interacciones biológicas no son importantes, rechazándose la hipótesis de resistencia biótica.
Palabras clave: Invasiones biológicas; Resistencia biótica; Clima; Arañas sinantrópicas; Ambientes urbanos.
Abstract
Biotic vs abiotic resistance: the case of urban spiders in Chile
Biological invasions are a major threat that affects negatively to biodiversity. Several hypotheses have been generated to explain why some species can naturalize in invaded areas. The hypothesis of biotic resistance is one of the best known, wich describe the ability of native communities to repel invaders; however it has been poorly studied in urban environments. Urban habitats are currently the most common ecosystem on the planet but have been poor studied. In this study, we do not found effect of communities on exotic species, but a negative and significant effect of climate was found. In conclusion, we can point out that is the abiotic resistance that is conditioning the naturalization of exotic species in urban environments, while the role of the biotic competition to repel the invasion is not important, rejecting the hypothesis of biotic resistance.
Key words: Biological invasion; Biotic resistance; Climate; Synanthropic spiders; Urban environments.
INTRODUCCIÓN
Las invasiones biológicas pueden definirse como la translocación y/o movimiento intencional o accidental de especies fuera de su área biogeográfica natural hacia otras regiones del mundo, donde la introducción ya sea directa o indirecta está mediada por la actividad humana (Jacksic & Castro, 2014; Nentwig, 2007, 2015). Las especies exóticas pueden afectar la diversidad nativa de muchas maneras. Algunos de los mecanismos más relevantes son la depredación, la modificación del hábitat y la competencia inter-especifica (Jacksic, 1998; Mack et al., 2000; Pauchard et al., 2011; Jacksic & Castro, 2014). Dentro de la ecología de invasiones biológicas muchas hipótesis han sido propuestas para explicar el éxito o fracaso en el establecimiento de las especies exóticas (Kolar & Lodge, 2001; Jacksic & Castro, 2014). Por un lado, algunas hipótesis abordan el efecto de las variables abióticas sobre las invasiones (Macdougall et al., 2006; Alexander et al., 2011), mientras que otras involucran el efecto de las interacciones biológicas (Jeschke et al., 2012). Las hipótesis que han sido más estudiadas durante las últimas décadas son: 1) liberación de enemigos naturales, en donde la ausencia de potenciales competidores y depredadores promueve el éxito de la invasión (Keane & Crawley, 2002); 2) susceptibilidad de las islas, en la cual las islas son más proclives a ser invadidas debido a su baja diversidad en relación al continente (Elton, 1958; Jeschke et al., 2012); 3) naturalización de Darwin, que sugiere que especies exóticas lejanamente emparentadas con las especies residentes adquieren mayores ventajas al momento de establecerse en comparación a especies estrechamente relacionadas (Daehler, 2001); 4) y por último, la resistencia biótica (Elton, 1958), que plantea que durante el proceso de invasión las especies exóticas pueden reducir su éxito al establecerse en comunidades con alta riqueza específica (Tilman, 1999; Levine et al., 2004; Jeschke et al., 2012). El motivo es que en comunidades con mayor número de especies, prácticamente no existen nichos disponibles que puedan ser ocupados por los invasores, incrementando la competencia inter-especifica entre especies nativas y exóticas (Elton, 1958; Levine et al., 2004; Jeschke et al., 2012). Tradicionalmente esta última hipótesis ha recibido poca atención en ecosistemas urbanos, siendo evaluada con mayor énfasis en ecosistemas naturales (Robinson et al., 1995; Levine & D’ Antonio, 1999; Levine et al., 2004; Maron & Marler, 2007; Helford, 2012). En general, cuando ha sido estudiada a pequeña escala, la biodiversidad del lugar puede reducir el éxito de las especies introducidas, sin embargo, a una macro escala los efectos que se aprecian pueden ser totalmente distintos (Kennedy et al., 2002; Jeschke et al., 2012). En consecuencia, algunos estudios han mostrado relaciones negativas entre el número de especies exóticas y la diversidad nativa (Maron & Marler, 2007), en otros casos no se ha visto efecto alguno (Dukes, 2001) o inclusive pueden encontrarse relaciones positivas (Robinson et al., 1995, Dunstan & Johnson, 2004).
La mayoría de los estudios en invasiones se han focalizado principalmente en plantas, vertebrados y solo algunos casos en artrópodos, los cuales han sido poco estudiados a nivel mundial, principalmente en el caso de las arañas (Kobelt & Nentwig, 2008; Langor & Sweeney, 2009; Nentwig, 2015). Las arañas son consideradas formidables depredadores y tienen un efecto importante sobre muchas comunidades (Hann, 1990) y a su vez pueden encontrarse en altas densidades tanto en ambientes naturales como en lugares urbanizados (Hann, 1990; Dura-Barron et al., 2009; Desales-Lara et al., 2013). Los estudios ecológicos en ecosistemas urbanos son algo relativamente nuevo dentro de la ecología (Guarisco, 1999; Schochat et al., 2004; Helford, 2012; Taucare-Ríos et al., 2013) y su importancia ha sido desestimada con los años, pese a que la urbanización ha causado profundas modificaciones en los hábitats naturales alrededor del mundo (Schochat et al., 2004; Dura-Barron et al., 2009; Taucare-Ríos et al., 2013). Al mismo tiempo, la perturbación generada por los ambientes urbanos genera una gran variedad de nuevos micro habitas disponibles, que podrían constituir nuevos nichos utilizables para las arañas sinantrópicas (Brescovit, 2002; Japyassú, 2002; Duran-Barrón et al., 2009; Taucare-Ríos et al., 2013). En literatura se menciona que existen ecosistemas mejores que otros para resistir las invasiones biológicas, donde las áreas urbanas son conocidas por su baja riqueza de especies, siendo especialmente susceptibles a ser invadidas por especies exóticas (Kennedy et al., 2002; Levine et al., 2004; Shochat et al., 2010; Helford, 2012). Por otra parte, también hay que considerar otros factores que pueden afectar el éxito de las especies introducidas, como es el caso del clima. La temperatura y las precipitaciones pueden ser considerados como un filtro ambiental relevante, ya que ambientes estresantes pueden afectar la llegada y establecimiento de las especies exóticas, lo que es conocido como “resistencia abiótica” a la invasión (D’Antonio et al., 2001; Catford et al., 2009; Alexander et al., 2011). Esto sería especialmente relevante en arañas, que son organismos ectotermos y la temperatura ambiental es determinante para su sobrevivencia y reproducción (Alfaro et al., 2013).
En ese contexto, la invasión de las especies exóticas puede depender tanto de factores abióticos del área invadida: por ejemplo, el clima (resistencia abiótica), como de la resistencia de la comunidad residente (resistencia biótica) o de una combinación de ambas, que dificulta el establecimiento de este tipo de especies (Levine et al., 2004; Alexander et al., 2011).
En Sudamérica, el estudio de arañas sinantrópicas o urbanas ha sido poco desarrollado (Brescovit, 2002; Japyassú, 2002; Taucare-Ríos et al., 2013). En el caso de Chile, la última revisión de arañas urbanas señala que existe una baja diversidad de especies sinantrópicas, donde la mayoría de ellas son especies exóticas (Taucare-Ríos et al., 2013). Chile a su vez se caracteriza por poseer un gradiente térmico ambiental considerable de norte a sur con distintos tipos de climas: desértico, semidesértico, mediterráneo y templado (diCastri & Hajek, 1976), los cuales podrían tener un efecto importante en el éxito de invasión de estas especies, ya que el éxito de invasión podría variar en gradientes ambientales (Alexander et al., 2011).
Se postula como hipótesis que debido a la baja diversidad de arañas nativas en áreas urbanas, deberíamos encontrar relaciones negativas entre el número de especies nativas y exóticas que habitan este tipo de ambientes en Chile (hipótesis de resistencia biótica). Paralelamente, se evalúa el efecto del clima sobre la riqueza de arañas exóticas, considerando la temperatura como una variable importante en este tipo de organismos (hipótesis de resistencia abiótica). En este escenario, nuestra predicción es que la riqueza de especies exóticas disminuirá a medida que aumenta la latitud hacia climas más fríos.
MATERIALES Y METODOS
Para cada región administrativa en Chile se contabilizaron unicamente las especies de arañas nativas y exóticas presentes en ambientes urbanos (i.e. sinantrópicas), de las cuales se posee un inventario bastante completo en este país (Taucare-Ríos et al., 2013; Taucare-Ríos et al., 2016; World Spider Catalog, 2019).
A partir de la información recopilada se realizó un Modelo Lineal Generalizado (MLG) con distribución normal mediante el programa STATISTICA 6.0 (Stat Soft, 1999) para analizar de forma simultánea el efecto del clima (variable categórica) y del número de especies nativas o comunidad residente (variable continua) sobre la riqueza específica de arañas exóticas (variable de respuesta). Los climas considerados para Chile se basaron en la clasificación propuesta por diCastri & Hajek (1976). Además se realizaron regresiones lineales y correlaciones entre distintas variables climáticas y la riqueza de especies exóticas. Las variables de temperatura media anual y precipitaciones de cada región fueron obtenidas de https://es.climate-data.org/. Los supuestos de normalidad y homocedasticidad fueron evaluados por medio del test de Kolmogorov-Smirnov y Levene, respectivamente.
RESULTADOS
La mayor diversidad de arañas nativas presentes en ambientes urbanos se concentra prácticamente en las regiones del centro del país, caracterizadas por un clima mediterráneo, mientras que hacia los extremos, el número de especies presentes decae. En cuanto a las arañas exóticas, el patrón es distinto, disminuyendo paulatinamente la riqueza de especies a medida que aumenta la latitud. La mayor cantidad de especies exóticas se concentra en el norte del país, en las tres primeras regiones, mientras que la riqueza es mucho menor en las regiones del centro y sur de Chile (Fig. 1). Las especies dominantes en ambientes desérticos provienen fundamentalmente de ambientes cálidos de África, Asia y zonas sub-tropicales, mientras que las que se encuentran en climas mediterráneos y templados provienen generalmente de Eurasia y varias están actualmente consideradas como especies cosmopolitas (Tabla 1).
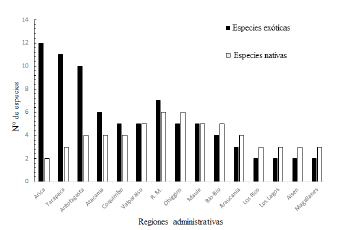
Fig. 1. Número de especies nativas y exóticas por cada región administrativa de Chile. Las regiones se encuentran ordenadas de norte a sur en sentido izquierda a derecha.
Tabla 1. Composición actualizada de arañas urbanas presentes en Chile y su posible origen biogeográfico (Taucare-Ríos et al., 2013; World Spider Catalog 2019).


Los resultados no mostraron un efecto significativo de las comunidades nativas sobre la riqueza de especies exóticas (MLG, F1, 13 = 0.85, p = 0.38), pero si se encontraron efectos vinculados al clima (MLG, F3, 10 = 5.14, p = 0.03), mientras que no se observó interacción entre ambas variables (MLG, F3, 10= 1.68, p = 0.25). En este contexto, encontramos que las comunidades más susceptibles de ser invadidas corresponden a los de clima desértico apoyando la hipótesis de resistencia abiótica. Por otro lado, en climas semidesérticos y mediterráneos la diferencia entre exóticas y nativas es menor, mientras que en climas templados fríos la riqueza de exóticas decae abruptamente (Fig. 2). No se encontraron correlaciones significativas entre especies nativas y exóticas por región administrativa (R2=0.12, F1, 13= 0.13, p= 0.72), pero si se halló un efecto negativo y significativo de la latitud sobre la riqueza (Fig. 3), donde la latitud explica alrededor del 83% de la variación en la riqueza especifica de arañas exóticas (R2= 0.83, F1, 13 = 60.27, p < 0.05). La temperatura anual media y la riqueza específica de especies exóticas están positivamente correlacionadas (r = 0.88, p < 0.05), mientras que las precipitaciones medias anuales están correlacionadas negativamente (r = -0.747, p = 0.001). El efecto de la temperatura (R2 = 0.78, F1, 13 = 45.84, p < 0.05) (Fig. 4A) y precipitaciones (R2 = 0.55, F1, 13 = 16.45, p = 0.001) (Fig. 4B) sobre el número total de especies exóticas es consistente con el gradiente térmico latitudinal presente en Chile, lo que apoya la idea del clima como uno de los factores que podrían afectar la riqueza de especies exóticas.

Fig. 2. Riqueza especifica de arañas en ambientes urbanos para distintos climas presentes en Chile.

Fig. 3. Relación entre la riqueza de especies exóticas y la latitud en ecosistemas urbanos de Chile.

Fig. 4. A-B. Relación entre la riqueza de especies exóticas y variables climáticas. A. Temperatura anual media. B. Precipitación anual media.
DISCUSION
La diversidad de arañas exóticas sinantrópicas en Chile parece estar influida en gran medida por el componente climático y no por la respuesta de las comunidades residentes a la invasión. En este sentido, las interacciones biológicas no serían relevantes para el establecimiento de estas especies, pero sí lo serían factores abióticos como la temperatura y precipitaciones, los cuales afectan significativamente la riqueza específica de estas arañas en ambientes urbanos. Con respecto a este último punto, varios investigadores han resaltado el importante papel del clima como limitante para la entrada de especies exóticas en nuevas áreas geográficas, donde la riqueza específica de estas especies disminuye a medida que aumenta la severidad térmica en gradientes ambientales (Alper et al., 2000; D’Antonio et al., 2001; Becker et al., 2005; Alexander et al., 2011).
La ausencia de correlación entre la comunidad de especies nativas y exóticas nos permite rechazar la hipótesis de resistencia biótica en ambientes urbanos. Sin embargo, la ausencia de correlación, no implica necesariamente ausencia total de competencia a una micro escala (Dukes, 2001; Kennedy et al., 2002). De esta forma, es probable que a macro escala no parezcan relevantes las interacciones biológicas, pero si pueden serlo a pequeña escala en términos de selección de micro hábitats o competencia por sitios con alta disponibilidad de presas al interior de los ecosistemas urbanos (Taucare-Ríos et al., 2013).
Los resultados muestran la disminución de las especies nativas en ambientes urbanos hacia climas extremos y una concentración de la riqueza en zonas de climas mediterráneos, lo que también se ha encontrado en otros organismos nativos (Simonetti, 1995). Esto es particularmente interesante, ya que da cuenta de que en condiciones extremas de temperatura (i.e. altas temperaturas en el desierto y muy bajas en climas templados) las arañas nativas asociadas a las viviendas humanas reducen su riqueza de especies (Taucare-Ríos et al., 2013) comportándose de forma similar al resto de la fauna nativa presente en el país; mientras que en el caso de las arañas exóticas encontramos un patrón diferente. A bajas latitudes en regiones de clima desértico con altas temperaturas y bajas precipitaciones medias anuales encontramos una mayor riqueza específica de arañas exóticas que en regiones de clima mediterráneo y templado oceánico. En este caso, vale la pena resaltar la presencia de poblaciones estables de especies subtropicales y pantropicales en climas desérticos y semidesérticos del país como el caso de Latrodectus geometricus Koch, 1841, Smeringopus pallidus (Blackwall, 1858), Hasarius adansoni (Audouin, 1826), Scytodes univitatta Simon, 1882, Kukulcania santosi Magalhães & Ramírez, 2019 entre otros (Tabla 1), que tendrían dificultades al avanzar hacia zonas más frías, ya que no se encuentran adaptadas a esas condiciones térmicas. Mientras que por otro lado especies como Dysdera crocata C. L. Koch, 1838, Tegenaria domestica (Clerck, 1757) y Tegenaria pagana C. L. Koch, 1841 provenientes de la región Euro asiática se concentran mayoritariamente en climas mediterráneos y templados, donde han logrado generar poblaciones estables en el tiempo (Taucare-Ríos et al. 2013). Las especies cosmopolitas Pholcus phalangioides (Fuesslin, 1775), Parasteatoda tepidariorum (C. L. Koch, 1841) y Steatoda grossa (C. L. Koch, 1838) se encuentran presente en todos los tipos de climas en Chile (Faúndez, 2009; Taucare-Ríos et al. 2013; Faúndez & Téllez, 2016). En relación a esto Alexander et al. (2011) señalan que los patrones de riqueza de especies exóticas a lo largo de gradientes ambientales son el resultado de la filtración secuencial de las especies con nichos más amplios en gradientes térmicos. Por consiguiente, en ambientes estresantes únicamente dominarían aquellas especies con mayores rangos de tolerancia como es el caso de las especies cosmopolitas nombradas anteriormente.
Es sabido que la temperatura a distintas latitudes puede afectar diferencialmente los ensambles de especies y la vulnerabilidad del área nativa a la invasión (Maestre et al., 2009; Alexander et al., 2011). La baja riqueza de especies exóticas en ambientes más fríos puede ser explicada también por el aumento de la severidad térmica, donde aquellas especies que carecen de las adaptaciones fisiológicas necesarias, se verían claramente perjudicadas en relación a las especies nativas (Becker et al., 2005). A su vez si en ambientes estresantes la diversidad de especies nativas decrece, esto puede facilitar la llegada de nuevas especies exóticas flexibilizando con ello las interacciones competitivas (Alexander et al., 2011; Lembredchts et al., 2014); por consiguiente, la resistencia biótica a las invasiones podría ser clima-dependiente en donde la comunidad residente repelería las invasiones en ambientes térmicos favorables, mientras que en ambientes con un alto estrés térmico los invasores tendrían una mayor ventaja (i.e. relajación o intensificación de la competencia mediado por el estrés térmico); sin embargo, en este estudio no encontramos interacción entre el tipo de clima y el número de especies nativas, que pudiesen respaldar esta hipótesis.
Nuestros resultados sugieren que la resistencia abiótica determinaría el establecimiento de arañas exóticas en ambientes urbanos y no la resistencia biótica del área invadida, rechazándose esta última hipótesis. Las arañas son organismos ectotermos y por tanto todos los aspectos de su vida están vinculados con la temperatura ambiental, afectando su actividad predatoria y reproducción (Reichert & Tracy, 1975; Cobb, 1994). El clima tendría un efecto significativo sobre la riqueza de especies exóticas en Chile, disminuyendo paulatinamente la riqueza hacia climas más fríos. En este sentido, únicamente las arañas más tolerantes y de mayor distribución serían capaces de soportar las adversidades climáticas que les impone el ambiente en este país, como por ejemplo algunas especies cosmopolitas con reconocida capacidad de dispersión. Finalmente, puede señalarse que este trabajo ha evaluado por primera vez la hipótesis de resistencia biótica y abiótica en arañas sinantrópicas, generando un precedente para futuros estudios relacionados con la ecología de invasiones biológicas en este tipo de ecosistemas.
Agradecimientos
Se agradece al proyecto VRIIP0109-18 (ATR) y CNPq, grant 301776/2004-0 (ADB). Agradecemos los comentarios y sugerencias de Miguel Simó, Cristian Grismado y de un revisor anónimo sobre la primera versión de este manuscrito.
Referencias
1. Alfaro, C., C. Veloso, H. Torres-Contreras, R. Solis & M. Canals. 2013. Thermal niche overlap of the brown recluse spider Loxosceles laeta (Araneae; Sicariidae) and its possible predator, the spitting spider Scytodes globula (Scytodidae). Journal of Thermal Biology 38:502–507.
2. Alexander, J. M., Kueffer, C., Daehler, C., Edwards, P. J., Pauchard, A., Seipel, T., Arévalo, J. Cavieres, L., Dietz, H. & G. Jakobs. 2011. Assembly of nonnative floras along elevational gradients explained by directional ecological filtering. Proceedings of the National Academy of Sciences of the United States of America, 108, 656-661. [ Links ]
3. Alpert, P., Bone, E. & Holzapfel, C. 2000. Invasiveness, invasibility and the role of environmental stress in the spread of non-native plants. Perspectives in Plant Ecology, Evolution and Systematics, 3, 52-66. [ Links ]
4. Becker, T., Dietz, H., Billeter, R., Buschmann, H. & P.J. Edwards. 2005. Altitudinal distribution of alien plant species in the Swiss Alps. Perspectives in Plant Ecology, Evolution and Systematics, 7, 173-183. [ Links ]
5. Brescovit, A. D. 2002. Aranhas, espécies sinantrópicas, accidente e controle. Saúde Ambiental, 49, 24-27. [ Links ]
6. Catford, J. A., Jansson, R. & C. Nilsson. 2009. Reducing redundancy in invasion ecology by integrating hypotheses into a single theoretical framework. Diversity and Distributions, 15, 22-40. [ Links ]
7. Cobb, V. A. 1994. Effects of temperature on escape behaviour in the cribellate spider, Oecobius annulipes (Araneae, Oecobiidae). The Southwestern Naturalist, 39, 391-394. [ Links ]
8. Daehler, C.C. 2001. Darwin’s naturalization hypothesis revisited. American Naturalist, 158, 324-330.
9. D’Antonio, C. J. Levine & M. Thomsen. 2001. Ecosystem resistance to invasion and the role of propagule supply: a California perspective. Journal of Mediterranean Ecolology, 2, 233-245.
10. Desales-Lara, M. A., O.F. Francke & P. Sánchez-Nava. 2013. Diversidad de arañas (Arachnida: Araneae) en hábitats antropogénicos. Revista Mexicana de Biodiversidad, 84, 291-305. [ Links ]
11. diCastri, F. & E. Hajek. 1976. Bioclimatología de Chile. Santiago, Chile: Pontificia Universidad Católica de Chile. [ Links ]
12. Dukes, J. S. 2001. Biodiversity and invasibility in grassland microcosms. Oecologia, 126, 563-568. [ Links ]
13. Dunstan, P. K. & C.R. Johnson. 2004. Invasion rates increase with species richness in a marine epibenthic community by two mechanisms. Oecologia, 138, 285-292. [ Links ]
14. Durán-Barrón, C.G., O.F. Francke & T.M. Pérez-Ortiz. 2009. Diversidad de arañas (Arachnida: Araneae) asociadas a viviendas de la ciudad de México (Área metropolitana). Revista Mexicana de Biodiversidad, 80, 55-69. [ Links ]
15. Elton, C. S. 1958. The Ecology of Invasions by Animals and Plants. Methuen, London. [ Links ]
16. Faúndez, E. I. 2009. Arañas (Arachnida: Araneae) peligrosas de la Región de Magallanes. Anales del Instituto de la Patagonia, 37(1), 127-131. [ Links ]
17. Faúndez, E. I. & Téllez, F. 2016. New records for Parasteatoda tepidariorum (C.L. Koch, 1841) (Araneae: Theridiidae) in southern Chile. Anales del Instituto de la Patagonia, 43(3), 85-87. [ Links ]
18. Guarisco, H. 1999. House spiders of Kansas. Journal of Arachnology, 27, 217-221. [ Links ]
19. Hann, S. W. 1990. Evidence for the displacement of an endemic New Zealand spider, Latrodectus katipo Powell by the South African species Steatoda capensis Hann (Araneae: Theridiidae). New Zealand Journal of Zoology, 17, 295–308.
20. Helford, S. 2012. Biotic resistance of ants in urban and natural environments. Eukaryon, 8, 80–84.
21. Jaksic, F.M. 1998. Vertebrate invaders and their ecological impacts in Chile. Biodiversity and Conservation, 7, 1427-1445. [ Links ]
22. Jaksic, F.M. & S.A. Castro. 2014. Invasiones biológicas en Chile: Causas globales e impactos locales. Santiago, Chile. Ediciones Universidad Católica de Chile. 526 p. [ Links ]
23. Japyassú, F. H. 2002. Biodiversidade araneológica: A urbanização afeta a riqueza de espécies? Saúde Ambiental, 49, 24-25. [ Links ]
24. Jeschke, J.M., Gómez Aparicio, L., Haider, S., Heger, T., Lortie, C.J., Pyšek, P. & Strayer, D.L. 2012. Support for major hypotheses in invasion biology is uneven and declining. NeoBiota, 14, 1–20.
25. Keane, R.M. & Crawley, M.J. 2002. Exotic plant invasions and the enemy release hypothesis. Trends in Ecology & Evolution, 17, 164–170.
26. Kennedy, T. A., Naeem, S., Howe, K. M., Knops, J. M. H., Tilman, D. & P. Reich, P. 2002. Biodiversity as a barrier to ecological invasion. Nature, 417, 636–638.
27. Kobelt, M. & W. Nentwig. 2008. Alien spider introductions to Europe supported by global trade. Diversity and Distribution, 14, 273-280. [ Links ]
28. Kolar, C. S. & D. M. Lodge. 2001. Progress in invasions biology: Predicting invaders. Trends in Ecology and Evolution, 16, 199-204. [ Links ]
29. Langor, D. W. & J. Sweeney. 2009. Ecological impact of nonnative invertebrates and fungi on terrestrial ecosystems. Springer, Heidelberg. [ Links ]
30. Lembrechts, J. J., Milbau, A. & I. Nijs. 2014. Alien roadside species more easily invade alpine than lowland plant communities in a subarctic mountain ecosystem. PLoS One 9(2):e89664. [ Links ]
31. Levine, J. M. & C.M. D’Antonio. 1999. Elton revisited: a review of evidence linking diversity and invasibility. Oikos, 87, 15-26.
32. Levine, J. M., Adler, P. B. & S.G. Yelenik. 2004. A meta-analysis of biotic resistance to exotic plant invasions. Ecology Letters, 7, 975-989. [ Links ]
33. Lodge, D. M. 1993. Biological invasions: lessons for ecology. Trends in Ecology and Evolution, 8, 133-137. [ Links ]
34. MacDougall, A., Boucher, J., Turkington, R. & G. Bradfield. 2006. Patterns of plant invasion along an environmental stress gradient. Journal of Vegetation Science, 17, 47-56. [ Links ]
35. Mack, R.N., D., Simberloff, W.M., Lonsdale, H., Evans, M., Clout & F. Bazzaz. 2000. Biotic invasions: causes, epidemiology, global consequences and control. Issues in Ecology 5: 1-25. [ Links ]
36. Maestre, F. T., Callaway, R. M, Valladares F. & C.J. Lortie. 2009. Refining the stress-gradient hypothesis for competition and facilitation in plant communities. Journal of Ecology, 97, 199-205. [ Links ]
37. Maron, J. L. & M. Marler. 2007. Native plant diversity resists Diversity and Invader Impact S33 invasion at both low and high resource levels. Ecology 88:2651-2661. [ Links ]
38. Nentwig, W. 2007. Biological invasions, p. 193. Ecological studies. Springer, Berlin, Germany. [ Links ]
39. Nentwig, W. 2015. Introduction, establishment rate, pathways and impact of spiders alien to Europe. Biological Invasions, 17, 2757-2778. [ Links ]
40. Pauchard, A, Quiroz, C., García, R., Anderson, C.H. & Kalin, M. 2011. Invasiones biológicas en América Latina y el Caribe: tendencias en investigación para la conservación, en Conservación Bilógica: Perspectivas desde América Latina. Simonetti J, Dirzo R. Editorial Universitaria, Santiago Chile. pág. 79- 94. [ Links ]
41. Ricciardi, A., M.F. Hoopes, M. P. Marchetti & J. L. Lockwood. 2013. Progress toward understanding the ecological impacts of nonnative species. Ecological Monographs, 83, 263-282. [ Links ]
42. Riechert, S. E. & R. Tracy. 1975. Thermal balance and prey availability: bases for a model relating web-site characteristics to spider reproductive success. Ecology, 56, 265-284. [ Links ]
43. Robinson, G. R., J.F. Quinn & M.L. Stanton. 1995. Invasibility of experimental habitat islands in a California Winter annual grassland. Ecology, 76, 786-794. [ Links ]
44. Shochat, E., Stefanov, W. L., Whitehouse, M. E. A. & S.H. Faeth. 2004. Urbanization and spider diversity: influences of human modification of habitat structure and productivity. Ecological Applications, 14, 268-280. [ Links ]
45. Shochat, E., Lerman, S. B., Anderies, A. M. Warren, P. S., Faeth, S. H. & C.H. Nilon. 2010. Invasion, competition, and biodiversity loss in urban ecosystems. BioScience, 60, 199-208. [ Links ]
46. Simonetti, J. A., Arroyo, M. T. K., Spotorno, A. E. & E. Lozada. 1995. Diversidad Biológica de Chile. CONICYT. Santiago. [ Links ]
47. StatSoft, I.n.c., 1999. STATISTICA for Windows (Computer program manual). Tulsa, Oklahoma. [ Links ]
48. Taucare-Ríos, A., A. Brescovit & M. Canals 2013. Synanthropic spiders (Arachnida: Araneae) from Chile. Revista Ibérica de Aracnología, 23, 49-56. [ Links ]
49. Taucare-Ríos, A., D. Mardones & A. Zúñiga-Reinoso. 2016. Steatoda nobilis (Araneae: Theridiidae) in South America: a new alien species for Chile. The Canadian Entomologist, 148, 479-481. [ Links ]
50. Tilman, D. 1999. The ecological consequences of changes in biodiversity: A search for general principles. Ecology 80: 1455–1474.
51. World Spider Catalog, 2019. World Spider Catalog. Version 20.0. Natural History Museum Bern, online at http://wsc.nmbe.ch, accessed on {3/02/19}. [ Links ]
Recibido: 29-XII-2018
Aceptado: 6-VI-2019














