INTRODUCCIÓN
Los murciélagos (Orden Chiroptera) se ca racterizan por su gran diversidad taxonómica y ecológica, la cual se traduce en numerosos servi cios ecosistémicos tales como el control de plagas agrícolas, dispersión de semillas, polinización, entre otros (Kunz et al., 2011; Ghanem & Voigt, 2012). Actualmente, se reconocen aproximada mente 1400 especies de murciélagos (Simmons & Cirranello, 2019) de las cuales alrededor del 70% se alimentan de insectos y otros artrópodos (Fenton & Simmons, 2014).
Conocer los parámetros tróficos de los orga nismos resulta indispensable tanto para ampliar el conocimiento ecológico de las especies como también para comprender sus interacciones biológicas dentro de la comunidad a la que per tenecen (Begon et al., 2006). La mayoría de los estudios tradicionales acerca de la dieta de mur ciélagos insectívoros se han basado en la identi ficación y clasificación morfológica de los restos de presas hallados en las heces y en el contenido estomacal (Anthony & Kunz, 1977; Whitaker et al., 1994; Hamilton & Barclay, 1998; Bernard, 2002; Aguirre et al., 2003; Weterings et al., 2015). Si bien es posible encontrar algunas diferencias entre el grado de digestión de las presas según la técnica que se emplee (Belwood & Fenton, 1976; Rabinowitz & Tuttle, 1982; Kunz & Whitaker, 1983), en líneas generales ambos métodos permi ten su identificación taxonómica con una preci sión al nivel de orden o familia (Trujillo, 2014).
Tadarida brasiliensis (Molossidae) es una de las especies de quirópteros artropodófagos con una amplia distribución por todo el conti nente americano, extendiéndose desde el sur de Estados Unidos hasta el sur de Chile y Argentina, atravesando México y Centroamérica (Barquez et al., 2015). En Argentina, se distribuye a lo lar go y ancho de todo el país, excepto en las pro vincias de Chaco, Corrientes y Tierra del Fuego, Antártida e Islas del Atlántico Sur (Barquez & Díaz, 2020). Se trata de una especie migratoria de hábitos gregarios que forma grandes colonias tanto en refugios naturales como en construccio nes artificiales (Hutson et al., 2001; Barquez et al., 2015).
La mayor parte del conocimiento sobre la dieta de T. brasiliensis proviene de estudios de sarrollados en el hemisferio Norte (Kunz et al., 1995; Long, 1996; Whitaker et al., 1996; Lee & McCracken, 2002; Kunz, 2004; Hernández Cienfuegos, 2005; Lee & McCracken, 2005; McWilliams, 2005; Hernández Vila, 2018). En dicha región, esta especie es considerada como una de las más importantes en el control de plagas agrícolas dado que se ha registrado que consume grandes cantidades de insectos perju diciales para los cultivos (Whitaker et al., 1996; Lee & McCracken, 2002; McCracken et al., 2012; Krauel et al., 2018). En Sudamérica, el número de investigaciones realizadas decrece notable mente (Silva & Fleck, 1976; Fabián et al., 1990; Vázquez Mota, 2011). En Argentina, solo existen dos trabajos que reportan la dieta de esta especie, ambos realizados durante la última década en el noroeste del país, en la ecorregión de las Yungas (ver Bracamonte, 2013; Gamboa Alurralde & Díaz, 2018).
Teniendo en cuenta el rol de Tadarida bra siliensis en el control natural de plagas agríco las y, considerando que la cantidad y el tipo de presa consumida pueden fluctuar en función de la distribución temporal y espacial del recurso (Kunz, 1988; Whitaker, 1988), resulta de fun damental importancia ampliar el conocimiento sobre la dieta de esta especie en otras áreas de su distribución. Específicamente, es imperativo generar información sobre la ecología trófica de los murciélagos insectívoros en ecosistemas agrícolas, ya que los procesos ecológicos que ocu rren en este tipo de ambientes pueden diferir de aquellos que suceden en ambientes menos dis turbados (Tscharntke et al., 2012; Kahnonitch et al., 2018). La ecorregión Pampa, el ecosiste ma de praderas más importante de Argentina (Matteucci, 2012), representa una buena oportu nidad para abordar este tipo de investigaciones dado que gran parte de los pastizales naturales son reemplazados por pasturas para el ganado y tierras de cultivo (Baldi & Paruelo, 2008; Aizen et al., 2009; Isacch et al., 2016). Asimismo, la es casa información ecológica sobre las especies de murciélagos insectívoros que habitan los agro ecosistemas es probablemente el principal fac tor que limita la integración de estos mamíferos controladores de plagas y la producción agrícola (Kunz et al., 2011).
En el presente trabajo se analizó la compo sición de la dieta de Tadarida brasiliensis en un ambiente serrano del sudeste bonaerense. Como objetivo particular se planteó determinar el efecto del sexo sobre la dieta de los individuos analizados. Según Kunz y colaboradores (1995), durante el período de gestación y lactancia, la demanda energética de las hembras aumenta drásticamente precisando consumir una mayor cantidad de presas por noche. Algunos autores reportaron diferencias en la amplitud dietaria de hembras lactantes en comparación con machos y hembras no reproductivas (Kunz et al., 1995; Lee & McCracken, 2002), mientras que en estudios realizados por fuera de dicho período no han evi denciado tal diferenciación (Gamboa Alurralde & Díaz, 2018; Hernández Vila, 2018). Debido a que el presente estudio fue realizado hacia fines del período reproductivo de T. brasiliensis (primave ra-verano), se estima que las hembras habrían finalizado el período de lactancia y, por lo tanto, se encontrarían enfrentando compromisos ener géticos similares a los machos. De esta forma, no se esperan encontrar variaciones significativas en las presas consumidas por ambos sexos.
MATERIALES Y MÉTODOS
Área de estudio
El estudio fue realizado en la “Estancia y Reserva Natural Paititi” (37°54´S - 57°49´O), ubicada en el partido de General Pueyrredón, en el sudeste de la provincia de Buenos Aires (Fig. 1). Dicha reserva forma parte de la ecorregión Pampa y se enmarca dentro del sistema serrano de Tandilia, un afloramiento rocoso de aproxi madamente 350 km de longitud que atraviesa el centro de la provincia de Buenos Aires en direc ción noroeste-sudeste y que se caracteriza por al bergar una gran diversidad biológica (Kristensen et al., 2014). La Estancia y Reserva Natural Paititi comprende 434 hectáreas, de las cuales la mitad son utilizadas para la producción agrícola y ganadera mediante la aplicación de prácticas sustentables. La mitad restante corresponde a una reserva natural y está conformada por dos sierras (Sierra Grande y Sierra Chica, ver Fig. 1) y un relicto de pastizal que, por su buen grado de conservación, es considerada un Área Valiosa de Pastizal (Bilenca & Miñarro, 2004).

Fig. 1 Estancia y Reserva Natural Paititi, ubicada al sudeste de la provincia de Buenos Aires, Argentina. Se de tallan las sierras que componen la reserva natural: Sierra Grande (SG) y Sierra Chica (SC). La letra R señala el refugio artificial donde se realizaron las capturas de T. brasiliensis, mientras que S1 y S2 señalan los sitios donde se realizó el muestreo de insectos.
Obtención de datos
En el mes de marzo de 2019, mediante la uti lización de copos de red, se capturaron y colecta ron 22 individuos de T. brasiliensis a la salida de un refugio localizado en una construcción artifi cial en la estancia antes mencionada (Fig. 1). Las capturas fueron realizadas durante el atardecer, al momento de la emergencia de los individuos (19:45 hs., hora local), los cuales posteriormente fueron sacrificados.
En el laboratorio se procedió a registrar el sexo, la clase etaria y la condición reproductiva de los individuos capturados. Los ejemplares fue ron clasificados en adultos o juveniles según el método de Brunet-Rossinni y Wilkinson (2009), el cual consiste en observar, por medio de la transiluminación del ala, el grado de fusión de la articulación metacarpo-falange del cuarto dedo. Como medida estandarizada, en el presen te trabajo se realizó dicha observación sobre el ala derecha. Los individuos con epífisis falangeal no fusionadas fueron clasificados como juveniles, mientras que aquellos cuya epífisis falangeal se encontraba fusionada fueron considerados adul tos. Respecto a la condición reproductiva se uti lizó la metodología sugerida por Racey (1974). En el caso de los machos, se observó la posición relativa de los testículos, clasificando como se xualmente inactivos a aquellos que presentaron testículos abdominales o subabdominales y como sexualmente activos a aquellos con testículos escrotales. En las hembras, se observó la condi ción de las mamas, lo que permite distinguir en tre aquellas que han tenido crías previamente y aquellas que no. Los pezones de las hembras nulí paras dan lugar a vello corporal, mientras que los de aquellas que ya han tenido crías se muestran queratinizados con pelo emergente (evidencia de succión previa) (Racey, 1974). Además de estos parámetros, se registraron la masa corporal y las medidas morfométricas de los individuos colec tados (datos no presentados). Para ello se utili zaron una balanza (precisión 0,01 g) y un calibre (precisión 1 mm) digitales y una regla (precisión 1 mm) para el caso de la envergadura alar.
Posteriormente, durante la necropsia de los individuos se procedió a la extracción del estóma go y del intestino, los cuales fueron pesados (ba lanza digital, precisión 0,01 g) y luego conserva dos en alcohol acético al 80% hasta su posterior procesamiento. Si bien el análisis del contenido intestinal es poco utilizado, su incorporación permitió complementar el análisis del contenido estomacal.
Análisis de la composición dietaria
El contenido estomacal (CE) e intestinal (CI) fue analizado utilizando una lupa estereos cópica. Para el reconocimiento de los restos de insectos presa se utilizó la guía de Shiel y cola boradores (1997), así como también material de referencia perteneciente a la colección entomoló gica del Museo Municipal de Ciencias Naturales “Lorenzo Scaglia” de la ciudad de Mar del Plata. La identificación taxonómica de dichas presas se realizó al nivel de orden o familia, en función de la integridad de los fragmentos y/o de la presen cia de caracteres diagnósticos. Aquellos fragmen tos con evidente degradación fueron catalogados como indeterminados debido a la dificultad del reconocimiento diagnóstico de los mismos.
La composición dietaria fue expresada siguiendo el método propuesto por Whitaker (1988). Se estimó la frecuencia de ocurrencia (%FO) para cada ítem presa, expresada como el porcentaje del total de muestras en las que un ítem alimenticio particular fue registrado. Dicho parámetro provee una medida estandarizada sobre qué tan común es cada ítem presa en la die ta, expresando la cantidad de individuos que han consumido determinada presa, pero sin tener en cuenta la contribución de los demás recursos tróficos (McAney et al., 1991). A su vez, se cal culó la frecuencia relativa (%FR) para cada ítem consumido, la cual corresponde al cociente entre el número de ocurrencias de cada ítem presa y el total de ocurrencias de todos los ítems (Lee & McCracken, 2002; Rodales, 2015). Este porcenta je indica la proporción del consumo de una presa en relación a las demás, permitiendo así conocer la contribución relativa de las distintas presas en la dieta de T. brasiliensis (Whitaker, 1988; Rodales, 2015).
Se calculó la amplitud de nicho trófico (B= 1 / Σ(pi2)) y su versión estandarizada (Ba= B-1/ n-1) a partir del índice de Levins (Krebs, 1999; Gamboa Alurralde & Díaz, 2018), donde ‘pi’ es la proporción relativa del ítem presa ‘i’ respecto al total de ítems y ‘n’ es el número total de ítems alimenticios registrados. El valor de B depende de la cantidad de recursos tróficos utilizados, por lo que su rango varía entre 1 y ‘n’. Por ello, se uti liza la medida estandarizada Ba cuyo rango varía entre 0 y 1. Los valores cercanos a 0 indican que todos los individuos de la especie se especializan en un único recurso trófico, mientras que valores cercanos a 1 significan que los individuos utilizan todos los recursos posibles sin discriminar entre ellos (Krebs, 1999).
Muestreo de insectos en zonas adyacentes
Con el objetivo de registrar las presas dis ponibles en el ambiente, en simultaneidad con la captura de murciélagos (marzo del 2019) se realizó un muestreo de insectos en la Reserva Natural Paititi, tomando como eje central el lu gar de procedencia de los individuos capturados (Fig. 1). Debido a que se desconoce cuál es el área de forrajeo que utiliza T. brasiliensis en dicha zona, dicho relevamiento fue realizado en dos si tios diferentes. El primer sitio (S1) correspondió a un bosque de árboles exóticos dominado por las especies Pinus sp. ( Pinaceae) y Eucalyptus sp. ( Myrtaceae), ubicado a una distancia apro ximada de 200 m del refugio donde fueron cap turados los murciélagos. El segundo sitio (S2), alejado aproximadamente 2 km del refugio, es tuvo conformado principalmente por la especie vegetal Acacia melanoxylon (Fabaceae) y algunos ejemplares de Salix sp. (Salicaceae), Platanus sp. (Platanaceae) y Celtis tala (Cannabaceae). En el S1 se colocaron dos trampas de luz con focos de luz mixta (250W) separadas entre sí por 100 m, mientras que en el S2 se colocó una sola trampa de iguales características. Las mismas se colo caron después del atardecer, coincidiendo con el horario de emergencia de los murciélagos (19:45 hs., hora local), y se mantuvieron activas entre 2 a 4 horas hasta que no se registró la llegada de nuevas especies (Beccacece et al., 2012). Se co lectaron hasta cinco ejemplares por morfoespecie en cada sitio, los cuales fueron preservados en al cohol acético al 80% hasta su posterior análisis. Para la identificación taxonómica de los mismos, se recurrió a las colecciones entomológicas de re ferencia pertenecientes al Museo Municipal de Ciencias Naturales “Lorenzo Scaglia”. Aquellos especímenes que no pudieron ser determinados a nivel específico fueron agrupados en morfoespe cies considerando pertenecientes al mismo grupo todos aquellos ejemplares que compartían ciertos caracteres diagnósticos determinados (Oliver & Beattie, 1993).
Análisis de los datos
Las similitudes y diferencias en las compo siciones dietarias entre sexos fueron basadas en datos de presencia/ausencia obtenidos del tracto digestivo (estómago e intestino combinados) y fueron analizadas mediante técnicas univaria das y multivariadas. Para evaluar posibles dife rencias en la frecuencia de ocurrencia de cada ítem presa entre sexos se utilizó la prueba exac ta de Fisher (Finney, 1948) mediante una tabla de contingencia de 2x2. Dicho análisis fue rea lizado mediante el software R, Versión 3.6.1. (R Development Core Team, 2019) utilizando una significancia estadística de α= 0,05.
En cuanto al análisis multivariado, se aplicó el análisis de escalonamiento multidimensio nal no métrico (Nonmetric Multidimensional Scaling, NMDS), con el objetivo de visualizar las diferencias en la composición de la dieta en tre sexos a partir de un ordenamiento espacial de los datos en dimensiones reducidas. Debido a la naturaleza de los datos del presente traba jo (presencia/ausencia), se utilizó como medida de distancia el índice de Sørensen (Clarke et al., 2006). La bondad de ajuste del ordenamiento es pacial está representada por el valor del “estrés”, donde valores menores a 0,2 brindan una imagen bidimensional potencialmente útil e implican un ordenamiento aceptable (Kruskal, 1964). Para evaluar estadísticamente las diferencias entre se xos, se realizó un análisis de similitud de una vía (ANOSIM; Clarke, 1993). Para dicho análisis se consideró significativo un R Global ≥ 0,25. Para este fin se utilizó el software PRIMER v6.1.
A partir del catálogo de insectos registrados en el área de estudio, se realizó un análisis cuali tativo para determinar en qué medida dichos ar trópodos estuvieron presentes en la dieta de los individuos analizados.
RESULTADOS
Se capturaron un total de 11 machos y 11 hembras de T. brasiliensis. Todos los individuos fueron determinados como adultos, debido al ele vado grado de fusión de la epífisis falangeal. La totalidad de los machos presentaron testículos abdominales y todas las hembras presentaron mamas queratinizadas con pelo emergente.
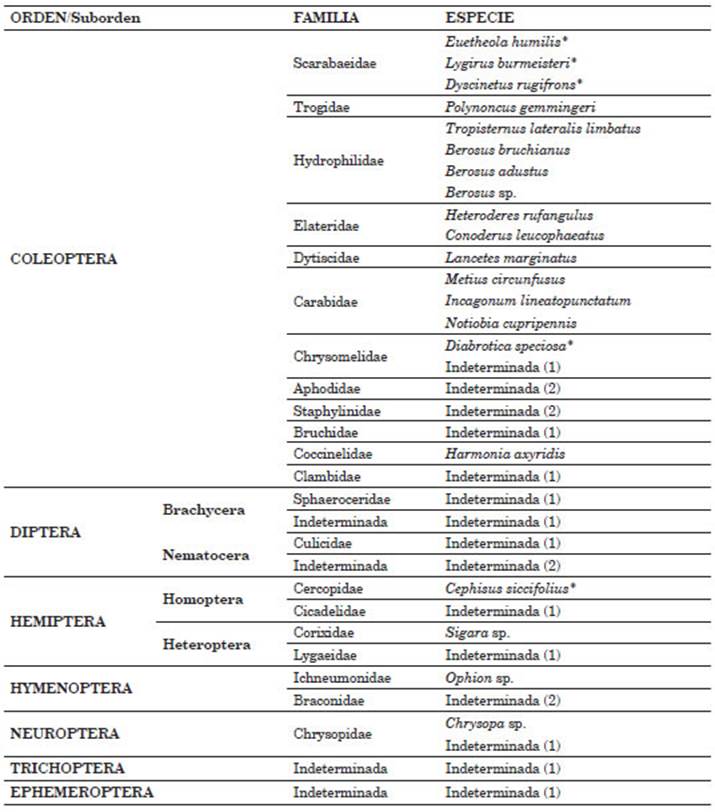
A partir del análisis del tracto digestivo de los individuos capturados, se identificaron fragmen tos de insectos pertenecientes a siete órdenes, dos subórdenes y cinco familias (Tabla 1). Las presas que presentaron mayor frecuencia de ocurren cia fueron Diptera y Lepidoptera (95% y 91%, respectivamente). El orden de los hemípteros se registró con una frecuencia del 45% y estuvo representado tanto por el suborden Heteroptera como por el suborden Homoptera (Tabla 1). Los coleópteros se registraron con una frecuencia del 36% y se identificaron restos pertenecientes a las familias Carabidae y Staphylinidae. Los órdenes menos comunes incluyeron Neuroptera (18%), Trichoptera (9%) e Hymenoptera (4,5%). A su vez, T. brasiliensis mostró una gran amplitud de nicho trófico (B= 4,33, Ba = 0,55).

Tabla 1 Frecuencia de ocurrencia (%FO) y fre cuencia relativa (%FR) de presas en tracto di gestivo de T. brasiliensis en la Reserva Natural Paititi, durante marzo de 2019. Se reporta el índice de Levins (B) y su versión estandarizada (Ba).
En términos de frecuencia relativa, los díp teros y lepidópteros comprendieron el 63% de la dieta de T. brasiliensis, cada uno contribuyendo de forma similar (Tabla 1). Al adicionar los he mípteros y coleópteros a los órdenes anteriores, dicha representación alcanzó el 90%. Los neuróp teros, trichópteros e hymenópteros, en conjunto, representaron el 10% restante.
Además de los insectos presa, se registró la presencia de ácaros del orden Mesostigmata, los cuales fueron identificados como Chiroptonyssus sp. (Macronyssidae). Estos ácaros fueron regis trados en ocho individuos, con una prevalencia similar entre sexos (cinco hembras y tres ma chos). Sin embargo, al tratarse de ectoparásitos, fueron considerados como ingesta accidental y no se incluyeron dentro de las estimaciones de la composición de la dieta.
Respecto a la variación de la composición de la dieta entre sexos, todos los órdenes, con excep ción de Hymenoptera y Trichoptera, estuvieron presentes tanto en hembras como en machos, en frecuencias de ocurrencia similares (Fig. 2A). El orden Hymenoptera se halló solo en hembras, mientras que el orden Trichoptera se encon tró solo en machos. Sin embargo, ambos órde nes fueron registrados con una baja frecuencia de ocurrencia dentro de cada sexo (< 20% cada uno). Tanto en machos como en hembras, alrede dor del 60% de la composición de la dieta estuvo compuesta principalmente por dípteros y lepi dópteros, representados en frecuencias similares (aproximadamente 30% cada orden; Fig. 2B). Al adicionar los hemípteros y coleópteros, se obtuvo una representación del 90% de la composición de la dieta.
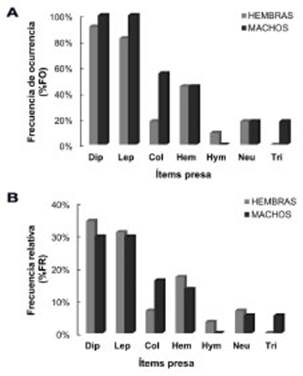
Fig. 2 Frecuencia de ocurrencia (A) y frecuencia rela tiva (B) de las presas en tracto digestivo de hembras y machos de Tadarida brasiliensis. Abreviaciones: Dip, Diptera; Lep, Lepidoptera; Col, Coleoptera; Hem, He miptera; Hym, Hymenoptera; Neu, Neuroptera; y Tri, Trichoptera.
No hubo diferencias significativas entre se xos para los órdenes de insectos registrados en el tracto digestivo (Prueba exacta de Fisher, valor P> 0,05 en todos los casos). Consistentemente, el análisis multivariado mostró un buen ajuste de los datos (estrés 0,04), indicando que los se xos de T. brasiliensis no mostraron variaciones en su composición dietaria (Fig. 3). El análisis de similitudes mostró que no hubo una variación en los tipos de presas consumidas entre machos y hembras (ANOSIM, R Global= 0,021).
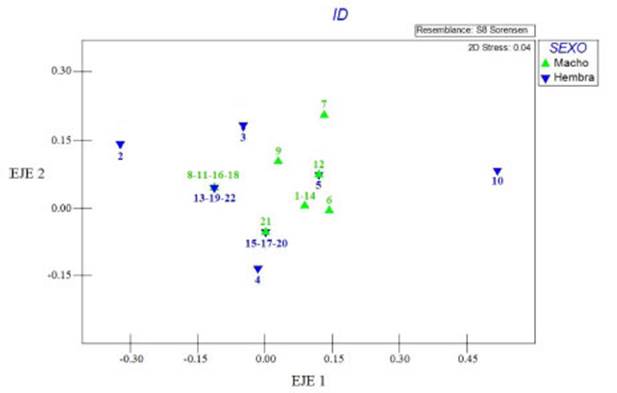
Fig. 3 Ordenamiento Multidimensional No Paramétrico (NMDS) utilizando datos de presencia/ausencia de las presas en tracto digestivo de T. brasiliensis en función del sexo.
En cuanto a las presas disponibles en el ambiente, el listado completo de los órdenes, familias y especies registrados en cada sitio se detalla en el Apéndice. Combinando ambos sitios, se registraron un total de ocho órdenes, 27 familias, 20 especies y 49 morfoespecies, de las cuales aproximadamente el 23% pudieron deter minarse hasta el nivel de género. A excepción de Ephemeroptera, los órdenes restantes estuvie ron presentes en la dieta de T. brasiliensis. En cuanto al nivel de familia, cuatro fueron halladas tanto en la dieta como en el ambiente: Culicidae (Diptera), Corixidae (Hemiptera), Carabidae (Coleoptera) y Staphylinidae (Coleoptera). La fa milia Delphacide (Hemiptera) fue registrada solo en el tracto digestivo de T. brasiliensis, no así en el ambiente.
DISCUSIÓN
En el presente trabajo se capturaron 11 ma chos adultos, determinados como sexualmente inactivos por presentar testículos abdominales. Dicho resultado es consistente con el hecho que los individuos fueron capturados fuera del perío do de apareamiento, el cual tiene lugar durante la primavera (Marques & Fabian, 1994). Por otro lado, se capturaron 11 hembras adultas con ma mas queratinizadas y pelo emergente, lo que es taría reflejando evidencias de succión previa con sistentemente con la finalización del período de lactancia (Racey, 1974). A pesar de la congruen cia de los resultados obtenidos, Miotti (2013) ad vierte que en muchos casos la determinación de la condición reproductiva a partir de caracteres externos suele ser sesgada. Factores como el es trés producido por la captura o las variaciones de temperatura ambiental, pueden producir un desplazamiento de los testículos en los machos, lo que conlleva a una interpretación errónea so bre la condición reproductiva. En consecuencia, se plantea la necesidad de complementar nues tros estudios con análisis histológicos del tracto reproductivo de los individuos para lograr una mayor comprensión de la biología reproductiva de T. brasiliensis.
De acuerdo a la literatura disponible, los re sultados del presente trabajo representan el ter cer estudio sobre la composición de la dieta de T. brasiliensis en Argentina (ver Bracamonte, 2013; Gamboa Alurralde & Díaz, 2018) y el primero realizado en la provincia de Buenos Aires. De acuerdo a los datos obtenidos, la composición de la dieta de T. brasiliensis estuvo conformada por siete órdenes de insectos (Diptera, Lepidoptera, Coleoptera, Hemiptera, Hymenoptera, Neuroptera y Trichoptera), los cuales fueron previamente reportados por Gamboa Alurralde y Díaz (2018) en el norte de Argentina y por nume rosos estudios realizados a lo largo de todo el con tinente americano (Whitaker et al., 1996; Lee & McCracken, 2005; Hernández Vila, 2018). Dicha diversidad de presas se vio reflejada en los índi ces de amplitud de nicho trófico (B= 4,33, Ba= 0,55), los cuales son consistentes con los reporta dos por otros autores en otras áreas a lo largo de la distribución de la especie en estudio (B= 4,17, Ba= 0,40 - Gamboa Alurralde & Díaz, 2018; B= 4,40-4,90 - Lee & McCraken, 2005).
De la diversidad de presas registradas en el presente trabajo, Diptera y Lepidoptera resul taron las presas más comunes ocurriendo en frecuencias mayores al 90% y representando el 60% de la composición de la dieta de la espe cie. Estudios previos coinciden con la alta con tribución de los lepidópteros en la dieta de T. brasiliensis (Whitaker et al., 1996; Hernández Cienfuegos, 2005; Lee & McCracken, 2005; McWilliams, 2005; Bracamonte, 2013; Gamboa Alurralde & Díaz, 2018), mientras que los datos previos sobre la frecuencia de dípteros son va riables. En Argentina, dentro de la Ecorregión de las Yungas, si bien Gamboa Alurralde y Díaz (2018) y Bracamonte (2013) reportaron que los dípteros son presas relativamente comunes en términos de frecuencia de ocurrencia, reportan una baja contribución de estos insectos a la die ta de T. brasiliensis. Por otro lado, diversos au tores sitúan a los coleópteros como presas muy frecuentes con alta contribución en la dieta, hallándose en frecuencias similares a las de los lepidópteros (Lee & McCracken, 2002, 2005; Hernández Cienfuegos, 2005; Gamboa Alurralde & Díaz, 2018; Hernández Vila, 2018). En el pre sente trabajo, dichos insectos representaron el cuarto orden en importancia relativa luego de los dípteros, lepidópteros y hemípteros. De igual manera, los himenópteros fueron raramente re gistrados en este estudio, mientras que en otros trabajos resultaron ser presas relativamente fre cuentes (Kunz et al., 1995; Gamboa Alurralde & Díaz, 2018). Las bajas frecuencias de ocurrencia y contribuciones relativas halladas para los ór denes Neuroptera y Trichoptera son consisten tes con otros trabajos preexistentes (Whitaker et al., 1996; Lee & McCracken, 2002; Hernández Cienfuegos, 2005; McWilliams, 2005; Gamboa Alurralde & Díaz, 2018).
Además de los insectos reportados en este trabajo, la presencia de ácaros Chiroptonyssus sp. fue considerada como ingesta accidental pro ducto del acicalamiento, ya que en el pelo de los murciélagos capturados se obtuvieron ácaros pertenecientes al mismo género y con iguales ca racterísticas a los hallados en el tracto digestivo. Los ácaros del género Chiroptonyssus han sido registrados en numerosas especies de murciéla gos (Ritzi et al., 2001), siendo Chiroptonyssus ro bustipes el ectoparásito más común y con mayor prevalencia en Tadarida brasiliensis (Durden et al., 1992; Spears et al., 1999; Muñoz et al., 2003, 2011; Pesenti et al., 2014).
Dado que la cantidad y el tipo de presa consu mida dependen de la distribución espacial y tem poral del recurso (Kunz, 1988; Whitaker, 1988), cabe esperar ciertas fluctuaciones en la contri bución de cada orden entre distintos trabajos realizados a lo largo de todo el continente ameri cano. Diversos trabajos señalan que los insectos son sensibles a los cambios ambientales locales, lo cual puede traducirse en una variación de la oferta alimenticia para los murciélagos según el tipo de ambiente que habiten (French, 1999; Hughes et al., 2000; Crist et al., 2006). En la zona de estudio del presente trabajo se realizan prác ticas agrícola-ganaderas, donde factores como el tipo de cultivo y las prácticas de manejo influyen sobre la estructura de las comunidades de artró podos edáficos (e.g., insectos holometábolos que pasan parte de su ciclo vital en el suelo como los coleópteros) (Altieri, 1999; Manetti, 2015). Estos factores podrían explicar las diferencias en la composición dietaria de T. brasiliensis con res pecto a trabajos preexistentes.
Respecto a la variación entre sexos, las fre cuencias de ocurrencia aquí reportadas para los distintos insectos presa no variaron significa tivamente entre machos y hembras de T. brasi liensis, confirmándose la hipótesis propuesta en este trabajo. A lo largo del período reproductivo de la especie, dado que las hembras preñadas y lactantes se enfrentan a mayores requerimientos energéticos que los machos u otras hembras no reproductivas, se han registrado variaciones en la composición de la dieta en función de la con dición reproductiva (Kunz et al., 1995; Whitaker et al., 1996; Lee & McCracken, 2002). Sin em bargo, los individuos analizados en el presente trabajo fueron determinados como sexualmente inactivos, en consistencia con la finalización de la etapa reproductiva. Nuestros resultados se encuentran en línea con lo reportado por otros trabajos realizados fuera de la estación reproduc tiva (Lee & McCracken, 2002; Gamboa Alurralde & Díaz, 2018).
Todos los órdenes de insectos registrados durante las capturas nocturnas realizadas en la Reserva Natural Paititi estuvieron represen tados en la dieta de T. brasiliensis, a excepción de Ephemeroptera. Sin embargo, estos últimos insectos son presas poco comunes para la espe cie, reportadas en escasos trabajos y con una baja contribución relativa (Lee & McCracken, 2002, 2005; Hernández Cienfuegos, 2005). Respecto al bajo número de familias halladas en la dieta en relación a aquellas registradas en el ambien te (4 vs. 27), dicha representación posiblemente se deba a un sesgo de la metodología utilizada para el análisis de dieta. Al basarse sobre el re conocimiento de las presas a partir fragmentos digeridos, la erosión de caracteres dificulta una precisión taxonómica mayor al nivel de orden (Kunz & Whitaker, 1983).
Algunas de las especies registradas son con sideradas de importancia agrícola por tratarse de insectos perjudiciales para los cultivos (ver Apéndice). La mayor parte de ellas pertenecen al orden Lepidoptera, principalmente a las familias Noctuidae y Erebidae. Si bien estas no pudieron ser determinadas en la dieta de T. brasiliensis del presente trabajo, un estudio reciente realizado en el sur de Texas (Estados Unidos) evidencia, a través del uso de técnicas moleculares, la inges ta de lepidópteros de los géneros Agrotis spp. y Mocis spp. (Noctuidae) (Krauel et al., 2018).
En el caso de los dípteros, otro de los princi pales grupos de insectos presa de T. brasiliensis, se hallaron morfoespecies pertenecientes a los subórdenes Nematocera y Brachycera. Debido a la dificultad de su identificación a partir de caracteres externos, no se logró determinar las especies que componen estos subórdenes. Sin embargo, un trabajo previo realizado a partir de datos moleculares ha permitido identificar para la ciudad de Mar del Plata (aproximadamente 27 km del área de estudio) un total de 14 especies de culícidos (Nematocera: Culicidae), de las cuales nueve han sido reportadas como potenciales vec tores de patógenos (Díaz-Nieto et al., 2013).
Dada la importancia económica y/o sanita ria de estos insectos y siendo que en el presente estudio han representado la mayor parte de la dieta de T. brasiliensis, resulta necesaria la fu tura identificación de las especies consumidas. Esto permitirá evaluar críticamente su rol como controlador de plagas y de vectores de enferme dades en la región, tal como ha sido evidenciado previamente para otras áreas de su distribución (Cleveland et al., 2006; Krauel et al., 2018).
CONCLUSIONES
El presente estudio representa el primer trabajo sobre la composición de la dieta de T. brasiliensis dentro de la ecorregión Pampa en Argentina. Dicha región está siendo gradual mente transformada en un mosaico de agroeco sistemas, de modo tal que el rol de los murcié lagos insectívoros como T. brasiliensis se torna fundamental en procesos ecológicos tales como el control de plagas agrícolas. En línea con la lite ratura disponible en torno a la especie, nuestros resultados coinciden en que T. brasiliensis es una especie generalista que se alimenta de una amplia gama de insectos. Asimismo, durante el período no reproductivo no se hallaron diferen cias en la composición dietaria entre machos y hembras. Puntualmente, se registraron siete ór denes de insectos consumidos por T. brasiliensis, de los cuales Lepidoptera, Diptera, Coleoptera y Hemiptera fueron los más frecuentes y represen taron 90% del total de la dieta. Si bien los restos hallados en el tracto digestivo no pudieron de terminarse a nivel específico, parte de las presas disponibles en el ambiente fueron identificadas como plagas para los cultivos o posibles vectores de enfermedades. Por ello resulta fundamental abordar en futuros estudios el análisis molecu lar de las especies de insectos consumidas para comprender con mayor precisión el rol ecológico de T. brasiliensis.
Conocer las principales fuentes de alimentos de los murciélagos de hábitos insectívoros per mite diseñar estrategias de manejo sustentables sobre los cultivos, orientándose a la disminución del uso de pesticidas y en consecuencia hacia una menor degradación ambiental. Por lo tanto, el presente estudio no solo contribuye a ampliar el conocimiento general de la especie en particular, sino que a su vez proporciona información rele vante para el manejo de las áreas agrícolas y para la conservación de estos mamíferos.












 uBio
uBio